Производные изоксазола, способы их получения, гербицидная композиция, способ борьбы с сорнякамиПатент на изобретение №: 2126394 Автор: Нейл Гич (GB), Дэвид Вильям Хаукинс (GB), Кристофер Дж.Пиарсон (GB), Филип Хенри Г.Смит (GB), Николас Вайт (GB) Патентообладатель: Рон-Пуленк Эгрикалчер Лимитед (GB) Дата публикации: 20 Февраля, 1999 Адрес для переписки: 103735 Москва, ул.Ильинка 5/2 Союзпатент Изображения   Производные изоксазола формулы I, где Ar - фенил, замещенный 1-3 группами R2, и где два заместителя на смежных положениях фенильного кольца вместе с двумя атомами, к которым они присоединены, образуют 5-6-членное гетероциклическое кольцо, содержащее 1 или 2 гетероатома, выбранных из О, S, N, которое может быть замещено одной или более группами R21, R-Н; R1 -С3-6циклоалкильная группа; R2 -атом галогена, С1-6алкил, возможно замещенный галогеном, группы SR5, -SOR5, -SO2R5, -OR5, -(CR9R10)t-S(O)pR5; R21 представляют R2 или = O, R5 - С1-6алкил; R9 и R10-H; p = 0, 1 или 2; t = I. Соединения формулы I можно использовать в качестве гербицидов. 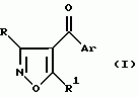 5 с.п. и 10 з.п.ф-лы, 2 табл.
, , 5 с.п. и 10 з.п.ф-лы, 2 табл.
, , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУИзобретение относится к новым производным изоксазола, композициям, содержащим их, способам из получения и использованию в качестве гербицидов. Изобретение предлагает изоксазолы формулы I: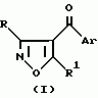 где Ar представляет фенил возможно замещенный одной-тремя группами R2, которые могут быть одинаковыми или разными и в которых два заместителя в смежных положения фенильного кольца вместе с двумя атомами, к которым они присоединены, образуют 5 - 7 - членное кольцо, которое может замещаться одной или несколькими группами R21 и которые могут быть одинаковыми или разными; R представляет атом водорода или группу -CO2R3; R1 представляет алкильную группу с прямой или разветвленной цепью, содержащую от одного до шести атомов углерода, которые могут замещаться одним или несколькими атомами галогена, или циклоалкильную группу, содержащую от трех до шести атомов углерода с возможностью замещения одной или несколькими группами, выбранными из R4, -CO2R4, -SR4, галогена и -OR4; R2 представляет атом галогена, алкильную группу с прямой или разветвленной цепью, содержащую от одного до шести атомов углерода, которая замещается группой ОR4; группу, выбранную из R4, -CO2R4,-COR4, -SR5, -SОR5, SO2R5, -OSO2R5, -ОR5, -O/CH2/m -ОR4, -NR6R7, -N/R8/SO2R5, -/CR9R10/tS - /O/pR5, нитро, циано и NR11R12; R21 - как ранее определено для R2 или представляет =О, =S, циклический кетал или циклический тиокетал; R3 и R4, которые могут быть одинаковыми или разными, каждый представляет группу алкила, алкенила или алкинила с прямой или разветвленной цепью, содержащей до шести атомов углерода, которые могут замещаться одним или несколькими атомами галогена; R5 представляет группу R4, или фенил, возможно замещенный от одной до пяти группами, которые могут быть одинаковыми или разными и выбираться из галогена, R4, -CO2R4,-COR4, -ОR4, нитро, циано и -O/CH2/m -ОR4; R6 и R7, которые могут быть одинаковыми или разными, каждый представляют атом водорода или алкильную группу с прямой или разветвленной цепью, содержащей от одного до шести атомов углерода, которая может замещаться одним или несколькими атомами галогена; Представляет целое число от одного до трех; R8 представляет атом водорода; группу алкила, алкенила или алкинила с прямой или разветвленной цепью, содержащей до шести атомов углерода с возможностью замещения одним или несколькими атомами галогена; циклоалкильную группу, содержащую от трех до шести атомов углерода; или фенил, возможно замещенный от одной до пяти группами R2, которые могут быть одинаковыми или разными; R9 и R10, которые могут быть одинаковыми или разными, каждый представляет: атом водорода; алкильную группу с прямой или разветвленной цепью, содержащую до 6 атомов углерода, которая может замещаться одним или несколькими атомами галогена; или фенил, возможно замещенный одной-пяти группами, которые могут быть одинаковыми или разными, выбранными из галогена, R4, -CO2R4,-COR4, -ОR4, нитро, циано и -O/CH2/m -ОР4; R11 представляет -COR4 и -CO2R4; R12 представляет: атом водорода; алкильную группу с прямой или разветвленной цепью, содержащую до шести атомов углерода с возможностью замещения одним или несколькими атомами галогена; или циклоалкильную группу, содержащую от трех до шести атомов углерода; р =0, 1 или 2; t представляет целое число от одного до трех, причем если t больше единицы, группы CR9R10 могут быть одинаковыми или разными; и их сельскохозяйственно приемлемые соли, которые обладают ценными гербицидными свойствами. В некоторых случаях заместители R, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 и R21 оказывают влияние на оптическую и/или стереоизометрию. Все такие формы охвачены настоящим изобретением. 5 - 7 - членное кольцо, образующее часть группы А, является карбоциклическим или гетероциклическим, содержащим один или несколько гетероатомов, предпочтительно выбранных из кислорода, серы и азота /лучше от одного до четырех/, следует понимать, что атом серы при его наличии может быть в форме группы -SO- или -SO2 и может быть ароматическим, насыщенным или частично насыщенным. Если R21 представляет циклический кеталь или тиокеталь кольцо содержит 5 или 6 элементов. Примеры группы А включают следующие возможно замещенные кольцевые системы и соответствующие дигидросоединения /где применимо/: бензо-1,2,3-тиадиазол, бензо[b] тиофен, бензо[b]фуран, бензо[c]тиофен, бензо[c] фуран, бензтиазол, 1,2-бензизотиазол, 2,1-бензизотиазол, 1,2-бензтиазин, 2,1-бензтиазин, 1,3-бензотиазин, 1,4-бензотиазин, бензимидазол, индазол, тиохроман, хроман, 2Н-хромин, 2Н-тиохромин, 4Н-тихромин, 4Н-хромин, изотиохроман, изохроман, изотиохромин, изохромин, бензофуразан, 1,3-бензодитиол, 1,3-бензодиоксол, 1,3-бензоксатиол, 1,4-бензодитиин, 1,4-бензоксатиин, 1,3-бензоксатиан, 3,1-бензоксатиан, 1,3-бензодитиан, бензоксазол и 1,3-безоксазол-2-он, индол, изоиндол, 1,4-бензодиоксин, 1,3-бензодиоксин. Под термином "сельскохозяйственно приемлемые соли" подразумеваются соли, катионы которых известны и приемлемы в области техники для образования солей для сельскохозяйственного или садоводческого применения. Лучше, если соли водорастворимы. Подходящие кислотно-аддитивные соли, образованные соединениями формулы I, включают соли с неорганическими кислотами, например гидрохлориды, сульфаты, фосфаты и нитраты, и соли с органическими кислотами, например уксусной кислотой. Предпочтительны соединения формулы I, в которой Ar представляет возможно замещенный 1,3-безодиоксол, бензо[b]тиофен, безоксазол или бензо-1,2,3-тиадиазол. Другим предпочтительным классом соединений формулы I являются те, в которых: /а/ R2 расположен у С-2 фенильного кольца, если конденсирования имеет место на С-3 и С-4 этого кольца, и /в/ R2 расположен у С-4 фенильного кольца, если конденсирование имеет место на С-2 и С-3 этого кольца. Предпочтительно R2 представляет атом галогена или группу, выбранную из -SR5, -SОR5, SO2R5, R4, -ОR5. Предпочтительно R21 представляет атом галогена /например, фтор/, С1-4алкил /например бутил/или -ОR5 /например, метокси/. Предпочтительно R1 представляет алкильную группу с прямой или разветвленной цепью, содержащую до четырех атомов углерода; или циклопропиловую группу, возможно замещенную группой R4. Предпочтительны также соединения формулы /I/, в которых R представляет водород. Другим предпочтительным классом соединений формулы /I/ являются те, в которых: Ar представляет фенил, возможно замещенный группой R2 и в котором два заместителя в смежных положениях фенильного кольца вместе с двумя атомами, к которым они присоединены, образуют 5- или 6-членное кольцо, выбранное из диоксолана, тиофена, тиофен S, S-диоксида, тиадиазола, оксазола, пиррола и доксана, кольцо, которое может замещаться одной или двумя группами R21, которые могут быть одинаковыми или разными; R представляет атом водорода; R1 представляет циклопропиловую группу; R2 представляет атом галогена или группу, выбранную из -SR5, -SОR5, SO2R5, -CH2S/O/pR5, R4 и ОR5; R21 представляет атом галогена /например, фтор/, С1-4алкил, -О2R5 или -ОR5; R4 представляет метил; R5 представляет метил или этил; и р=0,1 или 2 /предпочтительно 2/. Наиболее важные соединения включают следующие: 1. 5-циклопропил-4-/2,2-дифторо-7-метилсульфенил-1,3-бензодиоксол-4-оил/изоксазол; 2. 5-циклопропил-4-/2,2-дифторо-1,3-бензодиоксол-4-оил/-изоксазол; 3. 5-циклопропил-4-/3,4-диметоскибензо[b]тиен-5-оил/-изоксазол; 4. 5-циклопропил-4-/бензо-1,2,3-тиадиазол-5-иол/изоксазол: 5. 5-циклопропил-4-/2,2-дифторо-7-метилсульфонил-1,3-бензодиоксол-4-оил/изоксазол; 6. 5-циклопропил-4-/2,2-дифторо-4-метилсульфонил-1,3-бензодиоксол-5-оил/изоксазол; 7. 4-/2-т-бутил-4-хлоробензолсазол-7-оил/-5-циклопропилизоксазол; 8. 4-/4-хлоро-3-метоксибензо[b]тиен-5-оил/-5-циклопропилизоксазол; 9. 5-циклопропил-4-/2,2-дифторо-4-метилсульфинил-1,3-бензодиоксол-5-оил/изоксазол; 10. 5-циклопропил-4-/2,2-дифторо-4-метилсульфенил-1,3-бензодиоксол-5-оил/изоксазол; 11. 5-циклопропил-4-[1-/метилсульфонил/индол-4-карбонил]изоксазол; 12. 5-циклопропил-4-/4-метил-1,3-бензодиоксол-5-оил/изоксазол; 13. 5-циклопропил-4-[4-/метасульфонилметил/-1,3-бензодиоксол-5-оил] изоксазол; 14. 5-циклопропил-4-[2,2-дифторо-4-/метасульфонилметил/-1,3-бензодиоксол-5-оил/изоксазол; 15. 5-циклопропил-4-4-/метилсульфенил/-1,3-бензодиоксол-5-оил/изоксазол; 16. 5-циклопропил-4-[3-этокси-4-/метилсульфенил-/бензотиен-5-оил]озоксазол; 17. 5-циклопропил-4-/4-хлоро-3-этокси-2-этилбензо[b]тиен-5-оил/изоксазол; 18. 5-циклопропил-4-/4-хлоро-3-этоксибензо[b]тиен-5-оил/изоксазол; 19. 5-циклопропил-4-[5-/метилсульфонил/-1,4-бензодиоксан-6-карбонил] изоксазол; 20. 5-циклопропил-4-[4-/метилсульфонил/-1,3-бензодиоксол-5-оил] изоксазол; 21. 5-циклопропил-4-[5-/метилсульфонил/-1,4-бензодиоксан-6-карбонил] изоксазол; 22. 5-циклопропил-4-[4-/метилсульфинил/-1,3-бензодиоксол-5-оил] изоксазол; 23. 5-циклопропил-4-/4-хлоро-3-метоксибензо[b] тиен-5-оил/изоксазол-1,1-диоксид; 24. 5-циклопропил-4-/3,4-диметоксибензо[b]тиен-5-оил/изоксазол-1,1-диоксид; 25. 5-циклопропил-4-4-хлоро-3-метокси-2-метилбензо[b]тиен-5-оил/изоксазол-1,1-диоксид; 26. 5-циклопропил-4-[5-/метилсульфенил/-1,4-бензодиоксан-6-карбонил] изоксазол; и 27. 5-циклопропил-4-/4-хлоро-3-метокси-2-метилбензо[b]тиен-5-оил/изоксазол. Номера от 1 до 27 присвоены этим соединениям для ссылки и последующего указания. Соединения формулы 1 можно получить применением или адаптацией известных методов /т.е. методов, использующихся до сих пор и описанных в литературе/, например, как описано ниже. Надо понимать, что в описании следующих процессов последовательность может иметь разный порядок и что для получения искомых соединений могут потребоваться подходящие защитные группы. В соответствии с одним из признаков настоящего изобретения соединения формулы I, в которых R представляет водород, можно получить реакцией соединения формулы /II/: где Ar представляет фенил возможно замещенный одной-тремя группами R2, которые могут быть одинаковыми или разными и в которых два заместителя в смежных положения фенильного кольца вместе с двумя атомами, к которым они присоединены, образуют 5 - 7 - членное кольцо, которое может замещаться одной или несколькими группами R21 и которые могут быть одинаковыми или разными; R представляет атом водорода или группу -CO2R3; R1 представляет алкильную группу с прямой или разветвленной цепью, содержащую от одного до шести атомов углерода, которые могут замещаться одним или несколькими атомами галогена, или циклоалкильную группу, содержащую от трех до шести атомов углерода с возможностью замещения одной или несколькими группами, выбранными из R4, -CO2R4, -SR4, галогена и -OR4; R2 представляет атом галогена, алкильную группу с прямой или разветвленной цепью, содержащую от одного до шести атомов углерода, которая замещается группой ОR4; группу, выбранную из R4, -CO2R4,-COR4, -SR5, -SОR5, SO2R5, -OSO2R5, -ОR5, -O/CH2/m -ОR4, -NR6R7, -N/R8/SO2R5, -/CR9R10/tS - /O/pR5, нитро, циано и NR11R12; R21 - как ранее определено для R2 или представляет =О, =S, циклический кетал или циклический тиокетал; R3 и R4, которые могут быть одинаковыми или разными, каждый представляет группу алкила, алкенила или алкинила с прямой или разветвленной цепью, содержащей до шести атомов углерода, которые могут замещаться одним или несколькими атомами галогена; R5 представляет группу R4, или фенил, возможно замещенный от одной до пяти группами, которые могут быть одинаковыми или разными и выбираться из галогена, R4, -CO2R4,-COR4, -ОR4, нитро, циано и -O/CH2/m -ОR4; R6 и R7, которые могут быть одинаковыми или разными, каждый представляют атом водорода или алкильную группу с прямой или разветвленной цепью, содержащей от одного до шести атомов углерода, которая может замещаться одним или несколькими атомами галогена; Представляет целое число от одного до трех; R8 представляет атом водорода; группу алкила, алкенила или алкинила с прямой или разветвленной цепью, содержащей до шести атомов углерода с возможностью замещения одним или несколькими атомами галогена; циклоалкильную группу, содержащую от трех до шести атомов углерода; или фенил, возможно замещенный от одной до пяти группами R2, которые могут быть одинаковыми или разными; R9 и R10, которые могут быть одинаковыми или разными, каждый представляет: атом водорода; алкильную группу с прямой или разветвленной цепью, содержащую до 6 атомов углерода, которая может замещаться одним или несколькими атомами галогена; или фенил, возможно замещенный одной-пяти группами, которые могут быть одинаковыми или разными, выбранными из галогена, R4, -CO2R4,-COR4, -ОR4, нитро, циано и -O/CH2/m -ОР4; R11 представляет -COR4 и -CO2R4; R12 представляет: атом водорода; алкильную группу с прямой или разветвленной цепью, содержащую до шести атомов углерода с возможностью замещения одним или несколькими атомами галогена; или циклоалкильную группу, содержащую от трех до шести атомов углерода; р =0, 1 или 2; t представляет целое число от одного до трех, причем если t больше единицы, группы CR9R10 могут быть одинаковыми или разными; и их сельскохозяйственно приемлемые соли, которые обладают ценными гербицидными свойствами. В некоторых случаях заместители R, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 и R21 оказывают влияние на оптическую и/или стереоизометрию. Все такие формы охвачены настоящим изобретением. 5 - 7 - членное кольцо, образующее часть группы А, является карбоциклическим или гетероциклическим, содержащим один или несколько гетероатомов, предпочтительно выбранных из кислорода, серы и азота /лучше от одного до четырех/, следует понимать, что атом серы при его наличии может быть в форме группы -SO- или -SO2 и может быть ароматическим, насыщенным или частично насыщенным. Если R21 представляет циклический кеталь или тиокеталь кольцо содержит 5 или 6 элементов. Примеры группы А включают следующие возможно замещенные кольцевые системы и соответствующие дигидросоединения /где применимо/: бензо-1,2,3-тиадиазол, бензо[b] тиофен, бензо[b]фуран, бензо[c]тиофен, бензо[c] фуран, бензтиазол, 1,2-бензизотиазол, 2,1-бензизотиазол, 1,2-бензтиазин, 2,1-бензтиазин, 1,3-бензотиазин, 1,4-бензотиазин, бензимидазол, индазол, тиохроман, хроман, 2Н-хромин, 2Н-тиохромин, 4Н-тихромин, 4Н-хромин, изотиохроман, изохроман, изотиохромин, изохромин, бензофуразан, 1,3-бензодитиол, 1,3-бензодиоксол, 1,3-бензоксатиол, 1,4-бензодитиин, 1,4-бензоксатиин, 1,3-бензоксатиан, 3,1-бензоксатиан, 1,3-бензодитиан, бензоксазол и 1,3-безоксазол-2-он, индол, изоиндол, 1,4-бензодиоксин, 1,3-бензодиоксин. Под термином "сельскохозяйственно приемлемые соли" подразумеваются соли, катионы которых известны и приемлемы в области техники для образования солей для сельскохозяйственного или садоводческого применения. Лучше, если соли водорастворимы. Подходящие кислотно-аддитивные соли, образованные соединениями формулы I, включают соли с неорганическими кислотами, например гидрохлориды, сульфаты, фосфаты и нитраты, и соли с органическими кислотами, например уксусной кислотой. Предпочтительны соединения формулы I, в которой Ar представляет возможно замещенный 1,3-безодиоксол, бензо[b]тиофен, безоксазол или бензо-1,2,3-тиадиазол. Другим предпочтительным классом соединений формулы I являются те, в которых: /а/ R2 расположен у С-2 фенильного кольца, если конденсирования имеет место на С-3 и С-4 этого кольца, и /в/ R2 расположен у С-4 фенильного кольца, если конденсирование имеет место на С-2 и С-3 этого кольца. Предпочтительно R2 представляет атом галогена или группу, выбранную из -SR5, -SОR5, SO2R5, R4, -ОR5. Предпочтительно R21 представляет атом галогена /например, фтор/, С1-4алкил /например бутил/или -ОR5 /например, метокси/. Предпочтительно R1 представляет алкильную группу с прямой или разветвленной цепью, содержащую до четырех атомов углерода; или циклопропиловую группу, возможно замещенную группой R4. Предпочтительны также соединения формулы /I/, в которых R представляет водород. Другим предпочтительным классом соединений формулы /I/ являются те, в которых: Ar представляет фенил, возможно замещенный группой R2 и в котором два заместителя в смежных положениях фенильного кольца вместе с двумя атомами, к которым они присоединены, образуют 5- или 6-членное кольцо, выбранное из диоксолана, тиофена, тиофен S, S-диоксида, тиадиазола, оксазола, пиррола и доксана, кольцо, которое может замещаться одной или двумя группами R21, которые могут быть одинаковыми или разными; R представляет атом водорода; R1 представляет циклопропиловую группу; R2 представляет атом галогена или группу, выбранную из -SR5, -SОR5, SO2R5, -CH2S/O/pR5, R4 и ОR5; R21 представляет атом галогена /например, фтор/, С1-4алкил, -О2R5 или -ОR5; R4 представляет метил; R5 представляет метил или этил; и р=0,1 или 2 /предпочтительно 2/. Наиболее важные соединения включают следующие: 1. 5-циклопропил-4-/2,2-дифторо-7-метилсульфенил-1,3-бензодиоксол-4-оил/изоксазол; 2. 5-циклопропил-4-/2,2-дифторо-1,3-бензодиоксол-4-оил/-изоксазол; 3. 5-циклопропил-4-/3,4-диметоскибензо[b]тиен-5-оил/-изоксазол; 4. 5-циклопропил-4-/бензо-1,2,3-тиадиазол-5-иол/изоксазол: 5. 5-циклопропил-4-/2,2-дифторо-7-метилсульфонил-1,3-бензодиоксол-4-оил/изоксазол; 6. 5-циклопропил-4-/2,2-дифторо-4-метилсульфонил-1,3-бензодиоксол-5-оил/изоксазол; 7. 4-/2-т-бутил-4-хлоробензолсазол-7-оил/-5-циклопропилизоксазол; 8. 4-/4-хлоро-3-метоксибензо[b]тиен-5-оил/-5-циклопропилизоксазол; 9. 5-циклопропил-4-/2,2-дифторо-4-метилсульфинил-1,3-бензодиоксол-5-оил/изоксазол; 10. 5-циклопропил-4-/2,2-дифторо-4-метилсульфенил-1,3-бензодиоксол-5-оил/изоксазол; 11. 5-циклопропил-4-[1-/метилсульфонил/индол-4-карбонил]изоксазол; 12. 5-циклопропил-4-/4-метил-1,3-бензодиоксол-5-оил/изоксазол; 13. 5-циклопропил-4-[4-/метасульфонилметил/-1,3-бензодиоксол-5-оил] изоксазол; 14. 5-циклопропил-4-[2,2-дифторо-4-/метасульфонилметил/-1,3-бензодиоксол-5-оил/изоксазол; 15. 5-циклопропил-4-4-/метилсульфенил/-1,3-бензодиоксол-5-оил/изоксазол; 16. 5-циклопропил-4-[3-этокси-4-/метилсульфенил-/бензотиен-5-оил]озоксазол; 17. 5-циклопропил-4-/4-хлоро-3-этокси-2-этилбензо[b]тиен-5-оил/изоксазол; 18. 5-циклопропил-4-/4-хлоро-3-этоксибензо[b]тиен-5-оил/изоксазол; 19. 5-циклопропил-4-[5-/метилсульфонил/-1,4-бензодиоксан-6-карбонил] изоксазол; 20. 5-циклопропил-4-[4-/метилсульфонил/-1,3-бензодиоксол-5-оил] изоксазол; 21. 5-циклопропил-4-[5-/метилсульфонил/-1,4-бензодиоксан-6-карбонил] изоксазол; 22. 5-циклопропил-4-[4-/метилсульфинил/-1,3-бензодиоксол-5-оил] изоксазол; 23. 5-циклопропил-4-/4-хлоро-3-метоксибензо[b] тиен-5-оил/изоксазол-1,1-диоксид; 24. 5-циклопропил-4-/3,4-диметоксибензо[b]тиен-5-оил/изоксазол-1,1-диоксид; 25. 5-циклопропил-4-4-хлоро-3-метокси-2-метилбензо[b]тиен-5-оил/изоксазол-1,1-диоксид; 26. 5-циклопропил-4-[5-/метилсульфенил/-1,4-бензодиоксан-6-карбонил] изоксазол; и 27. 5-циклопропил-4-/4-хлоро-3-метокси-2-метилбензо[b]тиен-5-оил/изоксазол. Номера от 1 до 27 присвоены этим соединениям для ссылки и последующего указания. Соединения формулы 1 можно получить применением или адаптацией известных методов /т.е. методов, использующихся до сих пор и описанных в литературе/, например, как описано ниже. Надо понимать, что в описании следующих процессов последовательность может иметь разный порядок и что для получения искомых соединений могут потребоваться подходящие защитные группы. В соответствии с одним из признаков настоящего изобретения соединения формулы I, в которых R представляет водород, можно получить реакцией соединения формулы /II/: 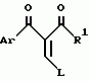 где Ar и R1 - как определены выше и L - уходящая группа, с солью или гдроксиламином. Обычно предпочитается гидрохлорид гидроксиламина. L обычно алкокси, например, этокси, или N, N-диалкиламино, например N, N-диметиламино. Реакция как правило, проводится в растворителе, таком, как этанол или ацетонитрил, можно в присутствии акцептора основного типа или кислотного типа, такого, как триэтиламин или ацетат натрия. По другому признаку настоящего изобретения соединения формулы I, в которых R представляет водород, можно получить реакцией соединения формулы /III/: где Ar и R1 - как определены выше и L - уходящая группа, с солью или гдроксиламином. Обычно предпочитается гидрохлорид гидроксиламина. L обычно алкокси, например, этокси, или N, N-диалкиламино, например N, N-диметиламино. Реакция как правило, проводится в растворителе, таком, как этанол или ацетонитрил, можно в присутствии акцептора основного типа или кислотного типа, такого, как триэтиламин или ацетат натрия. По другому признаку настоящего изобретения соединения формулы I, в которых R представляет водород, можно получить реакцией соединения формулы /III/: 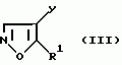 где R1 - как описано выше и V представляет группу карбокси или ее реактивное производное /такое, как хлорид карбоновой кислоты или эстер карбоновой кислоты/, или группу циано с металл-органическим реагентом формулы /IV/: Ar - M, /IV/ где Ar - как определено выше и М представляет щелочной металл, металл, соединенный с одним или несколькими лигандами или группу Гриньяра. Лучше, если М - литий или группа Григнара, содержащая магний. Реакция обычно проводится в инертном растворителе, таком, как диэтиловый эфир или тетрагидрофуран при температуре от -78oC до температуры рефлюкса смеси. В соответствии с другим признаком изобретения соединения формулы I, где R представляет группу -CO2R3, можно получать реакцией соединения формулы /V/: ArCOCH=C/P/R1 /V/ где Ar и R1 - как определены выше и Р - уходящая группа, с соединением формулы R3O2CC/X/= NOH, где R3 - как определено выше и Х - атом галогена. Обычно Х - хлор или бром и Р представляет собой N, N-диалкиламино. Реакция обычно проводится в инертном растворителе, таком, как толуол или дихлорметан, либо в присутствии основания, такого, как триэтиламин, либо катализатора, такого, как молекулярное сито 4 ангстрем, или иона фторида. По другому признаку настоящего изобретения соединения формулы I, в которых R представляет группу -CO2R3, можно получать реакцией соединения формулы /VI/: ArCOC=R1 /VI/ где Ar и R1 - как определены выше, с соединением формулы R3O2CC/X/=NOH, где R3 и Х - как определено выше. Реакция обычно проводится в инертном растворителе, таком, как толуол или дихлорметан возможно в присутствии основания такого, как триэтиламин или катализатора такого, как молекулярное сито 4 ангстрем или ион фторида. Реакция может проводиться при температуре между комнатной температурой и температурой флегмации смеси. В соответствии с еще одним признаком настоящего изобретения соединения формулы I, где R представляет -CO2R3, можно получать реакцией соли соединения формулы /VII/: ArCOCH2-COR1, где Ar и R1 - как определены выше, с соединением формулы R3O2CC/X/=NOH, где R3 и Х - как определено выше. Предпочтительные соли включают соли натрия или магния. Реакцию можно проводить в инертном растворителе, таком, как дихлорметан или ацетонитрил при температурой флегмации смеси. По другому признаку изобретения соединения формулы I, в которых R представляет водород, можно получить реакцией соединения формулы /VIII/: где R1 - как описано выше и V представляет группу карбокси или ее реактивное производное /такое, как хлорид карбоновой кислоты или эстер карбоновой кислоты/, или группу циано с металл-органическим реагентом формулы /IV/: Ar - M, /IV/ где Ar - как определено выше и М представляет щелочной металл, металл, соединенный с одним или несколькими лигандами или группу Гриньяра. Лучше, если М - литий или группа Григнара, содержащая магний. Реакция обычно проводится в инертном растворителе, таком, как диэтиловый эфир или тетрагидрофуран при температуре от -78oC до температуры рефлюкса смеси. В соответствии с другим признаком изобретения соединения формулы I, где R представляет группу -CO2R3, можно получать реакцией соединения формулы /V/: ArCOCH=C/P/R1 /V/ где Ar и R1 - как определены выше и Р - уходящая группа, с соединением формулы R3O2CC/X/= NOH, где R3 - как определено выше и Х - атом галогена. Обычно Х - хлор или бром и Р представляет собой N, N-диалкиламино. Реакция обычно проводится в инертном растворителе, таком, как толуол или дихлорметан, либо в присутствии основания, такого, как триэтиламин, либо катализатора, такого, как молекулярное сито 4 ангстрем, или иона фторида. По другому признаку настоящего изобретения соединения формулы I, в которых R представляет группу -CO2R3, можно получать реакцией соединения формулы /VI/: ArCOC=R1 /VI/ где Ar и R1 - как определены выше, с соединением формулы R3O2CC/X/=NOH, где R3 и Х - как определено выше. Реакция обычно проводится в инертном растворителе, таком, как толуол или дихлорметан возможно в присутствии основания такого, как триэтиламин или катализатора такого, как молекулярное сито 4 ангстрем или ион фторида. Реакция может проводиться при температуре между комнатной температурой и температурой флегмации смеси. В соответствии с еще одним признаком настоящего изобретения соединения формулы I, где R представляет -CO2R3, можно получать реакцией соли соединения формулы /VII/: ArCOCH2-COR1, где Ar и R1 - как определены выше, с соединением формулы R3O2CC/X/=NOH, где R3 и Х - как определено выше. Предпочтительные соли включают соли натрия или магния. Реакцию можно проводить в инертном растворителе, таком, как дихлорметан или ацетонитрил при температурой флегмации смеси. По другому признаку изобретения соединения формулы I, в которых R представляет водород, можно получить реакцией соединения формулы /VIII/: 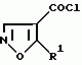 R1 - как определено выше, с соединение формулы Ar-H, в которой Ar - как определено выше. Реакция обычно проводится в присутствии катализатора-кислоты Льюса, такого, как трихлорид алюминия в инертном растворителе при температуре от 0oC до температуры флегмации смеси. Промежуточные соединения в получении соединений формулы I можно получить применением известных методов или их адаптацией, например, как описано ниже. Соединения формулы /II/, в которой L представляет О-алкил или N, N-диметиламино, можно получить реакцией соответствующего соединения формулы /VII/ либо с триалкил ортоформиатом, таким как триэтил ортоформиат, либо с диалкилацетатом диметилформамида, таким как диметил N, N - диметилформамид ацеталь. Реакция с триэтил ортоформиатом обычно проводится в присутствии уксусного ангидрида при температуре дефлегмации смеси и реакция с N, N - диметилформамид диалкил ацеталом может быть проведена в присутствии инертного растворителя при температуре от комнатной до температуры рефлюкса смеси. Соединения формулы /V/ можно получить реакцией соединения формулы /IХ/: R1/Р/С=СН2, где R1 и Р - как определены выше, с кислотным хлоридом формулы /Х/: ArCOCL, /X/ где Ar - как определено выше. Реакция обычно проводится в присутствии органического основания, такого, как триэтиламин в инертном растворителе, таком как толуол или дихлорметан при температуре между -20oC и комнатной температурой. Соединения формулы /VI/ можно получить замещением метлла водорода соответствующего ацетилена формулы /ХI/: R1-С=СН, где R1 - как определено выше, с последующей реакцией полученной таким образом соли металла с кислотным хлоридом формулы /Х/. Замещение металлом водорода обычно проводится с использованием н-бутил лития в инертном растворителе, таком как эфир или тетрагидрофуран при температуре от -78oC до 0oC. Последующая реакция с кислотным растворителем проводится в том же растворителе при температуре между -78oC и комнатной температуре. Соединения формулы /VII/ можно получить реакцией эфира формулы /XII/: Ar-CO2Z, /XII/ где Ar - как определено выше и Z - алкильная группа, с кетоном формулы R1C/O/CH3, в которой R1 - как определено выше, в присутствии основания. Обычно используемым основанием является гидрид натрия и реакция проводится в инертном растворителе при температуре от 0oC до флегмации. Соединения формулы /VII/ можно получить реакцией соединения формулы /XIII/: Ar-COCH3, /XIII/ где Ar - как определено выше, с эстером формулы R1CO2Z, в которой R1 и Z - как определены выше, в присутствии основания. Предпочтительно Z представляет собой метиловую, этиловую или т-бутиловую группу. В качестве основания используется как правило, гидрид натрия и реакция проводится в инертном растворителе при температуре от 0oC до рефлюкса. Соединения формулы /VII/ можно также получить реакцией кислотного хлорида формулы /X/ с солью металла соединения формулы /XIV/: R1COCH2CO2TBU, /XIV/ где R1 - как определено выше, чтобы получить соединение формулы /XV/: Ar COCH/COR1/CO2TBU, /XV/ где Ar и R1 - как определены выше, которое декарбоксилируется, чтобы дать соединение формулы /VII/. Обычно реакция для получения соединения формулы /XIV/ проводится в растворителе таком, как низший спирт, предпочтительно метанол, в присутствии металла, предпочтительно, магния. Декарбоксилирование проводится дефлегмацией соединения формулы /XV/ в присутствии катализатора, такого, как пара-толуолсульфокислота, в инертном растворителе, например, толуоле. Соединения формулы /XIII/ известны или их можно получить применением или адаптацией известных способов. Например, соединения формулы /XIII/, в которых Ar представляет собой возможно замещенный 1,2,3,-бензтиадиазол, можно получить диазотированием и последующей циклизацией амина формулы /XVI/: R1 - как определено выше, с соединение формулы Ar-H, в которой Ar - как определено выше. Реакция обычно проводится в присутствии катализатора-кислоты Льюса, такого, как трихлорид алюминия в инертном растворителе при температуре от 0oC до температуры флегмации смеси. Промежуточные соединения в получении соединений формулы I можно получить применением известных методов или их адаптацией, например, как описано ниже. Соединения формулы /II/, в которой L представляет О-алкил или N, N-диметиламино, можно получить реакцией соответствующего соединения формулы /VII/ либо с триалкил ортоформиатом, таким как триэтил ортоформиат, либо с диалкилацетатом диметилформамида, таким как диметил N, N - диметилформамид ацеталь. Реакция с триэтил ортоформиатом обычно проводится в присутствии уксусного ангидрида при температуре дефлегмации смеси и реакция с N, N - диметилформамид диалкил ацеталом может быть проведена в присутствии инертного растворителя при температуре от комнатной до температуры рефлюкса смеси. Соединения формулы /V/ можно получить реакцией соединения формулы /IХ/: R1/Р/С=СН2, где R1 и Р - как определены выше, с кислотным хлоридом формулы /Х/: ArCOCL, /X/ где Ar - как определено выше. Реакция обычно проводится в присутствии органического основания, такого, как триэтиламин в инертном растворителе, таком как толуол или дихлорметан при температуре между -20oC и комнатной температурой. Соединения формулы /VI/ можно получить замещением метлла водорода соответствующего ацетилена формулы /ХI/: R1-С=СН, где R1 - как определено выше, с последующей реакцией полученной таким образом соли металла с кислотным хлоридом формулы /Х/. Замещение металлом водорода обычно проводится с использованием н-бутил лития в инертном растворителе, таком как эфир или тетрагидрофуран при температуре от -78oC до 0oC. Последующая реакция с кислотным растворителем проводится в том же растворителе при температуре между -78oC и комнатной температуре. Соединения формулы /VII/ можно получить реакцией эфира формулы /XII/: Ar-CO2Z, /XII/ где Ar - как определено выше и Z - алкильная группа, с кетоном формулы R1C/O/CH3, в которой R1 - как определено выше, в присутствии основания. Обычно используемым основанием является гидрид натрия и реакция проводится в инертном растворителе при температуре от 0oC до флегмации. Соединения формулы /VII/ можно получить реакцией соединения формулы /XIII/: Ar-COCH3, /XIII/ где Ar - как определено выше, с эстером формулы R1CO2Z, в которой R1 и Z - как определены выше, в присутствии основания. Предпочтительно Z представляет собой метиловую, этиловую или т-бутиловую группу. В качестве основания используется как правило, гидрид натрия и реакция проводится в инертном растворителе при температуре от 0oC до рефлюкса. Соединения формулы /VII/ можно также получить реакцией кислотного хлорида формулы /X/ с солью металла соединения формулы /XIV/: R1COCH2CO2TBU, /XIV/ где R1 - как определено выше, чтобы получить соединение формулы /XV/: Ar COCH/COR1/CO2TBU, /XV/ где Ar и R1 - как определены выше, которое декарбоксилируется, чтобы дать соединение формулы /VII/. Обычно реакция для получения соединения формулы /XIV/ проводится в растворителе таком, как низший спирт, предпочтительно метанол, в присутствии металла, предпочтительно, магния. Декарбоксилирование проводится дефлегмацией соединения формулы /XV/ в присутствии катализатора, такого, как пара-толуолсульфокислота, в инертном растворителе, например, толуоле. Соединения формулы /XIII/ известны или их можно получить применением или адаптацией известных способов. Например, соединения формулы /XIII/, в которых Ar представляет собой возможно замещенный 1,2,3,-бензтиадиазол, можно получить диазотированием и последующей циклизацией амина формулы /XVI/: 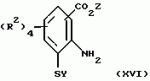 в которой R2 и Z - как определены выше; U - 0 или целое число от 1 до 3; V представляет водород или группу, которая может быть расщеплена во время циклизации. Лучше, если V - водород или бензил. Реакция предпочтительно поводится с использованием водного раствора нитрита в присутствии сильной кислоты, предпочтительно бромистоводородной при температуре от 0oC до 20oC. Промежуточные соединения формул /III/, /IV/, /VIII/, /IX/, /X/, /XI/, /XII/, и /XVI/ известны или могут быть получены применением или адаптацией известных способов. Специалистам понятно, что такие соединения формулы I можно получить взаимным преобразованием других соединений формулы I и такие продукты составляют другие признаки изобретения. Примеры таких взаимных преобразований описаны ниже. По другому признаку настоящего изобретения соединения, в которых R2 и/или R21- -SOR5, -/CR910/т- SOR5 или -/CR910/т- SO2R5, можно получить окислением атома серы соответствующего соединения, в котором R2 и/или R21 - -SR2, -SOR5, -/CR910/т- SR5 или -/CR910/т- SO2R5. По еще одному признаку настоящего изобретения соединения формулы I, в которых Ar включает атом серы в 5 - 7 - членном кольце в форме группы -SO- или -SO2-, можно получить окислением соответствующего соединения формулы /I/, в котором кольцо содержит неокисленный атом серы. В обоих из указанных случаев окисление атома серы обычно проводится с использованием, например, 3-хлорпероксибензойной кислоты в инертном растворителе, таком, как дихлорметан при температуре от -40oC до комнатной температуры. В соответствии с другим признаком настоящего изобретения соединения, в которых R2 и/или R21 представляет -/CR910/т- S/O/pR5, где R5 и р - как определены выше, можно получить реакцией соответствующего соединения, в котором R2 и/или R21 замещается -/CR910/т-L1, в котором L1 - галоген /предпочтительно бром/, с соединением формулы HS/O/pR5, в которой R5 и р - как определены выше. Реакция обычно проводится в растворителе, таком, как тетрагидрофуран или этанол, возможно в присутствии основания такого, как гидрид натрия или алкоксид натрия /напр. этоксид натрия/, и при температуре от 0oC до температуре флегмы растворителя. Соединения, в которых R2 и/или R21 представляет -/CR910/т-L1, в котором т - 1 можно получить реакцией соответствующего соединения, в котором R2 и/или R21 замещается -/CR910/т-Н с галогенирующим агентом, таким как N - галосукцинимид /напр. N -бромосукцинимид/. Если галогенирующим агентом является N - галосукцинимид, реакция обычно проводится в инертном растворителе таком, как тетрахлорметан или дихлорметан с облучением ультрафиолетовым или вольфрамовым светом при температуре от комнатной до температуры флегмы растворителя. Соединения формулы /I/ можно преобразовывать в сельскохозяйственно приемлемые соли известными способами или применением и адаптицией известных способов. Следующие примеры иллюстрируют получение соединений формулы I, а ссылочные примеры иллюстрируют получение промежуточных соединений изобретения. В настоящем описании т.к. означает температура кипения; т.пл. означает температуру плавления. ЯМР указывает характеристики протонного ядерного магнитного спектра. Пример 1 Раствор 4-/3-циклопропил-2-диметиламинометилен-1,3-диоксопропил/-2,2-дифторо-7-метилсульфенил-1,3-бензодиоксола /6.24г/ и гидроксиламин гидрохлорида /1.36г/ перемешивали всю ночь в этаноле. После охлаждения до -15oC осажденное твердое вещество отфильтровывали и промывали холодным этанолом. Фильтрат выпаривали и хроматографировали на силикагеле с элюированием с элюированием этилацетатом/циклогексаном для получения 5-циклопропил-4-/2,2-дифторо-7-метилсульфенил-1,3-бензодиоксол-4-оил/изоксазола/ соединение 1, 0.86 г, т.пл. 97 - 98oC. Таким же образом были получены следующем соединения: 5-циклопропил-4-/2,2-дифторо-1,3-бензодиоксол-4-оил/изоксазол/соединение 2/ в виде смолы, ЯМР /ODCL3/ в которой R2 и Z - как определены выше; U - 0 или целое число от 1 до 3; V представляет водород или группу, которая может быть расщеплена во время циклизации. Лучше, если V - водород или бензил. Реакция предпочтительно поводится с использованием водного раствора нитрита в присутствии сильной кислоты, предпочтительно бромистоводородной при температуре от 0oC до 20oC. Промежуточные соединения формул /III/, /IV/, /VIII/, /IX/, /X/, /XI/, /XII/, и /XVI/ известны или могут быть получены применением или адаптацией известных способов. Специалистам понятно, что такие соединения формулы I можно получить взаимным преобразованием других соединений формулы I и такие продукты составляют другие признаки изобретения. Примеры таких взаимных преобразований описаны ниже. По другому признаку настоящего изобретения соединения, в которых R2 и/или R21- -SOR5, -/CR910/т- SOR5 или -/CR910/т- SO2R5, можно получить окислением атома серы соответствующего соединения, в котором R2 и/или R21 - -SR2, -SOR5, -/CR910/т- SR5 или -/CR910/т- SO2R5. По еще одному признаку настоящего изобретения соединения формулы I, в которых Ar включает атом серы в 5 - 7 - членном кольце в форме группы -SO- или -SO2-, можно получить окислением соответствующего соединения формулы /I/, в котором кольцо содержит неокисленный атом серы. В обоих из указанных случаев окисление атома серы обычно проводится с использованием, например, 3-хлорпероксибензойной кислоты в инертном растворителе, таком, как дихлорметан при температуре от -40oC до комнатной температуры. В соответствии с другим признаком настоящего изобретения соединения, в которых R2 и/или R21 представляет -/CR910/т- S/O/pR5, где R5 и р - как определены выше, можно получить реакцией соответствующего соединения, в котором R2 и/или R21 замещается -/CR910/т-L1, в котором L1 - галоген /предпочтительно бром/, с соединением формулы HS/O/pR5, в которой R5 и р - как определены выше. Реакция обычно проводится в растворителе, таком, как тетрагидрофуран или этанол, возможно в присутствии основания такого, как гидрид натрия или алкоксид натрия /напр. этоксид натрия/, и при температуре от 0oC до температуре флегмы растворителя. Соединения, в которых R2 и/или R21 представляет -/CR910/т-L1, в котором т - 1 можно получить реакцией соответствующего соединения, в котором R2 и/или R21 замещается -/CR910/т-Н с галогенирующим агентом, таким как N - галосукцинимид /напр. N -бромосукцинимид/. Если галогенирующим агентом является N - галосукцинимид, реакция обычно проводится в инертном растворителе таком, как тетрахлорметан или дихлорметан с облучением ультрафиолетовым или вольфрамовым светом при температуре от комнатной до температуры флегмы растворителя. Соединения формулы /I/ можно преобразовывать в сельскохозяйственно приемлемые соли известными способами или применением и адаптицией известных способов. Следующие примеры иллюстрируют получение соединений формулы I, а ссылочные примеры иллюстрируют получение промежуточных соединений изобретения. В настоящем описании т.к. означает температура кипения; т.пл. означает температуру плавления. ЯМР указывает характеристики протонного ядерного магнитного спектра. Пример 1 Раствор 4-/3-циклопропил-2-диметиламинометилен-1,3-диоксопропил/-2,2-дифторо-7-метилсульфенил-1,3-бензодиоксола /6.24г/ и гидроксиламин гидрохлорида /1.36г/ перемешивали всю ночь в этаноле. После охлаждения до -15oC осажденное твердое вещество отфильтровывали и промывали холодным этанолом. Фильтрат выпаривали и хроматографировали на силикагеле с элюированием с элюированием этилацетатом/циклогексаном для получения 5-циклопропил-4-/2,2-дифторо-7-метилсульфенил-1,3-бензодиоксол-4-оил/изоксазола/ соединение 1, 0.86 г, т.пл. 97 - 98oC. Таким же образом были получены следующем соединения: 5-циклопропил-4-/2,2-дифторо-1,3-бензодиоксол-4-оил/изоксазол/соединение 2/ в виде смолы, ЯМР /ODCL3/ 1.3 /2Н, м/, 1.4 /2Н, м/, 2.8 /1Н, м/, 7.25 /2Н, м/, 7.45 /1Н, м/, 8.35 /1Н, с/. 5-циклопропил-4-[1-/метилсульфонил/индол-4-карбонил]изоксазол /соединение 11/ в виде твердого вещества зеленого цвета, т.пл. 142 - 144oC. 5-циклопропил-4-/4-метил-1,3-бензодиоксол-5-оил/изоксазол/соединенеие 12/ в виде белого твердого вещества, т.пл. 124 - 126oC. 5-циклопропил-4-[4-/метилсульфонилметил/-1,3-бензодиоксол-5-оил] изоксазол/соединение 13/ в виде твердого вещества белого цвета, т.пл.206 - 208oC. 5-циклопропил-4-[2,2-дифторо-4-/метилсульфонилметил/-1,3-бензодиоксол-5-оил]изоксазол/соединение 14/ в виде твердого вещества желтого цвета, т.пл. 180 - 181oC. 5-циклопропил-4-[4-/метилcульфенил/-1,3-бензодиоксол-5-оил/изоксазол/соединение 15/ в виде желтой смолы, ЯМР /CDCL3/ 1.3 /2Н, м/, 1.4 /2Н, м/, 2.8 /1Н, м/, 7.25 /2Н, м/, 7.45 /1Н, м/, 8.35 /1Н, с/. 5-циклопропил-4-[1-/метилсульфонил/индол-4-карбонил]изоксазол /соединение 11/ в виде твердого вещества зеленого цвета, т.пл. 142 - 144oC. 5-циклопропил-4-/4-метил-1,3-бензодиоксол-5-оил/изоксазол/соединенеие 12/ в виде белого твердого вещества, т.пл. 124 - 126oC. 5-циклопропил-4-[4-/метилсульфонилметил/-1,3-бензодиоксол-5-оил] изоксазол/соединение 13/ в виде твердого вещества белого цвета, т.пл.206 - 208oC. 5-циклопропил-4-[2,2-дифторо-4-/метилсульфонилметил/-1,3-бензодиоксол-5-оил]изоксазол/соединение 14/ в виде твердого вещества желтого цвета, т.пл. 180 - 181oC. 5-циклопропил-4-[4-/метилcульфенил/-1,3-бензодиоксол-5-оил/изоксазол/соединение 15/ в виде желтой смолы, ЯМР /CDCL3/ 1.2 /2Н, м/, 1.3 /2Н, м/, 2.4 /3Н, с/, 2.7 /1Н, м/, 6.1 /2Н, с/, 6,8 /1Н, д/, 7.0 /1Н, д/, 8.2 /1Н, с/. 5-циклопропил-4-[5-/метилcульфенил/-1,4-бензодиоксан-6-карбонил] изоксазол/соединение 26/ в виде твердого вещества кремового цвета, т.пл.135 - 136oC. Пример 2 Раствор, содержащий 5-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/-3,4-диметоксибензо[b] тиофен /0.56г/ и гидрохлорид гидроксиламина /0.137 г/ перемешивали 15 минут в этаноле. Добавляли ацетат натрия /безводнй, 0.161 г/ и смесь перемешивали 4 часа до выпаривания этанола и добавления воды. Смесь экстрагировали этилацетатом, высушивали /безводный сульфат магния/ и выпаривали в вакууме. Остаток очищали колонной хроматографией на силикагеле, элюировали эфиром /циклогексаном, для получения 5-циклопропил-4-/3,4-диметоксибензо[b] тиен-5-оил/изоксазола/соединение 3, 0.24г/ в виде масла, ЯМР 1.2 /2Н, м/, 1.3 /2Н, м/, 2.4 /3Н, с/, 2.7 /1Н, м/, 6.1 /2Н, с/, 6,8 /1Н, д/, 7.0 /1Н, д/, 8.2 /1Н, с/. 5-циклопропил-4-[5-/метилcульфенил/-1,4-бензодиоксан-6-карбонил] изоксазол/соединение 26/ в виде твердого вещества кремового цвета, т.пл.135 - 136oC. Пример 2 Раствор, содержащий 5-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/-3,4-диметоксибензо[b] тиофен /0.56г/ и гидрохлорид гидроксиламина /0.137 г/ перемешивали 15 минут в этаноле. Добавляли ацетат натрия /безводнй, 0.161 г/ и смесь перемешивали 4 часа до выпаривания этанола и добавления воды. Смесь экстрагировали этилацетатом, высушивали /безводный сульфат магния/ и выпаривали в вакууме. Остаток очищали колонной хроматографией на силикагеле, элюировали эфиром /циклогексаном, для получения 5-циклопропил-4-/3,4-диметоксибензо[b] тиен-5-оил/изоксазола/соединение 3, 0.24г/ в виде масла, ЯМР 1.20 /2H, м/, 1.35 /2H, м/, 2.80 /1H, м/, 3.84 /3H, c/, 4.00 /3H, c/, 6.39 /1H, c/, 7,40 /1H, д/, 7,59 /1H, д/, 8.29 /1H, c/, Аналогичным образом были получены следующие соединения: 5-циклопропил-4-/бензо-1,2,3-тиадиазол-5-оил/изоксазол/соединение 4/ в виде бледно-желтого масла, ЯМР/CDCL3/ 1.20 /2H, м/, 1.35 /2H, м/, 2.80 /1H, м/, 3.84 /3H, c/, 4.00 /3H, c/, 6.39 /1H, c/, 7,40 /1H, д/, 7,59 /1H, д/, 8.29 /1H, c/, Аналогичным образом были получены следующие соединения: 5-циклопропил-4-/бензо-1,2,3-тиадиазол-5-оил/изоксазол/соединение 4/ в виде бледно-желтого масла, ЯМР/CDCL3/ 1.23 /2H, м/, 3.4 /2H, м/, 27.0 /1H, м/, 8.07 /1H, д/, 8.17 /1H, д/, 8.40 /1H, с/, 8.96 /1H, д/. 5-циклопропил-4-[3-этокси-4-/метилсульфенил/бензо[b]тиен-5-оил/изоксазола/соединение 16/ в виде оранжевой смолы, ЯМР/CDCL3/ 1.23 /2H, м/, 3.4 /2H, м/, 27.0 /1H, м/, 8.07 /1H, д/, 8.17 /1H, д/, 8.40 /1H, с/, 8.96 /1H, д/. 5-циклопропил-4-[3-этокси-4-/метилсульфенил/бензо[b]тиен-5-оил/изоксазола/соединение 16/ в виде оранжевой смолы, ЯМР/CDCL3/ 1.1 /2H, м/, 1.3 /2H, м/, 1.5 /2H, м/, 2.4 /3H, c/, 2.5 /1H, м/, 4.1 /2H, кв/, 6.4 /1H, c/, 7.2 /1H, д/, 7.7 /1H, д/, 8.1 /1H, c/. 5-циклопропил-4-/4-хлоро-3-этокси-2-этилбензо[b]тиен-5-оил/изоксазол/соединение 17/, полученное в виде оранжевой смолы, ЯМР/CDCL3/ 1.1 /2H, м/, 1.3 /2H, м/, 1.5 /2H, м/, 2.4 /3H, c/, 2.5 /1H, м/, 4.1 /2H, кв/, 6.4 /1H, c/, 7.2 /1H, д/, 7.7 /1H, д/, 8.1 /1H, c/. 5-циклопропил-4-/4-хлоро-3-этокси-2-этилбензо[b]тиен-5-оил/изоксазол/соединение 17/, полученное в виде оранжевой смолы, ЯМР/CDCL3/ 1.1 /2H, м/, 1.3 /5H, м/, 1.4 /3H, м/, 2,6 /1H, м/, 2.9 /2H, кв/, 3.9 /2H, кв/, 7.1 /1H, д/, 7.6 /1H, д/, 8.1 /1H, c/. 5-циклопропил-4-/4-хлоро-3-этоксибензо-[b]тиен-5-оил/изоксазола/соединение 18/, полученное в виде коричневого цвета, ЯМР/CDCL3/ 1.1 /2H, м/, 1.3 /5H, м/, 1.4 /3H, м/, 2,6 /1H, м/, 2.9 /2H, кв/, 3.9 /2H, кв/, 7.1 /1H, д/, 7.6 /1H, д/, 8.1 /1H, c/. 5-циклопропил-4-/4-хлоро-3-этоксибензо-[b]тиен-5-оил/изоксазола/соединение 18/, полученное в виде коричневого цвета, ЯМР/CDCL3/ 1.2 /2H, м/, 1.5 /3H, м/, 2.7 /1H, м/, 4.2 /2H, кв/, 6.5 /1H, c/, 7.3 /1H, д/, 8.2 /1H, c/. 5-циклопропил-4-/4-хлоро-3-метокси-2-метилбензо[b]тиен-5-оил/изоксазол/соединение 27/ в виде смолы желтого цвета, ЯМР/CDCL3/ 1.2 /2H, м/, 1.5 /3H, м/, 2.7 /1H, м/, 4.2 /2H, кв/, 6.5 /1H, c/, 7.3 /1H, д/, 8.2 /1H, c/. 5-циклопропил-4-/4-хлоро-3-метокси-2-метилбензо[b]тиен-5-оил/изоксазол/соединение 27/ в виде смолы желтого цвета, ЯМР/CDCL3/ 1.2 /2H, м/, 1.4 /2H, м/, 2.5 /3H, c/, 2.6 /1H, м/, 3.9 /3H, c/, 7.3 /1H, д/, 7.7 /1H, д/, 8.2 /1H, c/. Пример 3 Раствор 5-циклопропил-4-[2,2-дифторо-7-метилсульфенил-1,3-бензодиоксол-4-оил/изоксазола /0.64 г/ в дихлорметане обрабатывали м-хлорпербензойной кислотой /55%, 1.5 г/. После 2 часов смесь охлаждали до 1oC и добавляли IM раствора метабисульфата натрия. Отфильтрованный раствор отделяли и органическую фазу промывали раствором ацетата натрия, рассолом, высушивали над безводным сульфатом натрия и выпаривали чтобы получить 5-циклопропил-4-[2,2-дифторо-7-метилсульфенил-1,3-бензодиоксол-4-оил/изоксазол/соедиение 5, 0.35 г/ в виде твердого вещества белого цвета, т.пл. 164 - 165oC. Аналогичным образом были получены следующие соединения: 5-циклопропил-[5-/метилсульфонил/-1,4-бензодиоксан-6-карбонил] изоксазол/соединение 19/ в виде твердого вещества кремового цвета, т.пл. 174 - 175oC. 5-циклопропил-4-[4-/метилсульфонил/-1,3-бензодиоксол-5-оил] изоксазол/соединение 20/ в виде вещества персикового цвета, т.пл. 178 - 180oC. Пример 4 Раствор-2-т-бутил-4-хлоро-7-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/-бензоксазола /3.3 г/, гидрохлорида гидроксиламина /0.74 г/ и безводного ацетата натрия /0.73 г/ в этаноле перемешивался 2 часа. Добавлялась вода и смесь экстрагировалась эфиром. Экстракт промывался водой, высушивался /сульфат магния/ и выпаривался. Очистка хроматографией на силикагеле с элюированием гексаном/этилацетатом дала 4-/2-т-хлоробензоксазол-7-оил/-5-циклопропилизоксазол/соединение 7, 0.15 г/ в виде вещества кремового цвета, т.пл. 166 -168oC. Аналогичным образом были получены следующие соединения: 4-/4-хлоро-3-метоксибензо[b]тиен-5-оил/-5-циклопропилизоксазол/соединение 8/, в виде желтой смолы, ЯМР/CDCL3/ 1.2 /2H, м/, 1.4 /2H, м/, 2.5 /3H, c/, 2.6 /1H, м/, 3.9 /3H, c/, 7.3 /1H, д/, 7.7 /1H, д/, 8.2 /1H, c/. Пример 3 Раствор 5-циклопропил-4-[2,2-дифторо-7-метилсульфенил-1,3-бензодиоксол-4-оил/изоксазола /0.64 г/ в дихлорметане обрабатывали м-хлорпербензойной кислотой /55%, 1.5 г/. После 2 часов смесь охлаждали до 1oC и добавляли IM раствора метабисульфата натрия. Отфильтрованный раствор отделяли и органическую фазу промывали раствором ацетата натрия, рассолом, высушивали над безводным сульфатом натрия и выпаривали чтобы получить 5-циклопропил-4-[2,2-дифторо-7-метилсульфенил-1,3-бензодиоксол-4-оил/изоксазол/соедиение 5, 0.35 г/ в виде твердого вещества белого цвета, т.пл. 164 - 165oC. Аналогичным образом были получены следующие соединения: 5-циклопропил-[5-/метилсульфонил/-1,4-бензодиоксан-6-карбонил] изоксазол/соединение 19/ в виде твердого вещества кремового цвета, т.пл. 174 - 175oC. 5-циклопропил-4-[4-/метилсульфонил/-1,3-бензодиоксол-5-оил] изоксазол/соединение 20/ в виде вещества персикового цвета, т.пл. 178 - 180oC. Пример 4 Раствор-2-т-бутил-4-хлоро-7-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/-бензоксазола /3.3 г/, гидрохлорида гидроксиламина /0.74 г/ и безводного ацетата натрия /0.73 г/ в этаноле перемешивался 2 часа. Добавлялась вода и смесь экстрагировалась эфиром. Экстракт промывался водой, высушивался /сульфат магния/ и выпаривался. Очистка хроматографией на силикагеле с элюированием гексаном/этилацетатом дала 4-/2-т-хлоробензоксазол-7-оил/-5-циклопропилизоксазол/соединение 7, 0.15 г/ в виде вещества кремового цвета, т.пл. 166 -168oC. Аналогичным образом были получены следующие соединения: 4-/4-хлоро-3-метоксибензо[b]тиен-5-оил/-5-циклопропилизоксазол/соединение 8/, в виде желтой смолы, ЯМР/CDCL3/ 1.23 /2H, м/, 1.34 /2H, м/, 267 /1H, м/, 4.0 /3H, с/, 6.5 /1H, с/, 7.3 /1H, д/, 7.73 /1H, д/, 8.17 /1H, с/; 5-циклопропил-4-/2,2-дифторо-4-метилсульфенил-1,3-безодиоксол-5-оил/изоксазол/соединение 10/ в виде оранжевой смолы, ЯМР/CDCL3/ 1.23 /2H, м/, 1.34 /2H, м/, 267 /1H, м/, 4.0 /3H, с/, 6.5 /1H, с/, 7.3 /1H, д/, 7.73 /1H, д/, 8.17 /1H, с/; 5-циклопропил-4-/2,2-дифторо-4-метилсульфенил-1,3-безодиоксол-5-оил/изоксазол/соединение 10/ в виде оранжевой смолы, ЯМР/CDCL3/ 1.25 /2H, м/, 1.35 /2H, м/, 2.6 /3H, с/, 2.75 /1H, м/, 7.05 /1H, д/, 7.23 /1H, д/, 8.25 /1H, с/. Пример 5 Раствор 5-циклопропил-4-/2,2-дифторо-4-метилсульфинил-1,3-бензодиоксол-5-оил/изоксазол /1.0 г/ в дихлорметане перемешивался с М=хлоропербензойной кислотой /55%, 1.33 г/ 5 часов, затем промывался по очереди раствором метабисульфата натрия, насыщенным раствором бикарбоната натрия и водой. Раствор высушивался /сульфат магния/, выпаривался до сухости и остаток рекристаллизовался из толуола/циклогексана, чтобы получить 5-циклопропил-4-/2,2-дифторо-4-метилсульфонил-1,3-бензодиоксол-5-оил/изоксазол/соединение 6, 0.94 г/ в виде бесцветного твердого вещества, т.пл. 162 - 163oC. Аналогичным образом были получены следующие соединения: 5-циклопропил-4-/2,2-дифторо-4-метилсульфонил-1,3-бензодиоксол-5-оил/изоксазол/соединение 9/ в виде твердого вещества, бесцветного, т.пл. 162 - 164oC. 5-циклопропил-4-[5-/метилсульфинил/-1,4-бензодиоксан-6-карбонил] изоксазол /соединение 21/ в виде твердого вещества кремового цвета, т.пл. 135 - 136oC. 5-циклопропил-4-[4-/метилсульфинил/-1,3-бензодиоксол-5-оил] изоксазол /соединение 22/ в виде твердого вещества кремового цвета, т.пл. 171 - 173oC. Пример 6 Раствор-5-циклопропил-4-/4-хлоро-3-метоксибензо[b] тиен-5-оил/изоксазола/0.28 г/ в дихлорметане обрабатывался м/хлорбензойной кислотой /55%, 0.72 г/. После 18 часов смесь охлаждалась до -20oC, фильтровалась и промывалась 0.5 М бисульфата натрия и водой, высушивалась над безводным сульфатом магния и выпаривалась. Очистка хроматографией на силикагеле эюированием циклогексаном/эфиром дала 5-циклопропил-4-/4-хлоро-3-метоксибензо[b] тиен-5-оил/изоксазол-1,1-диоксид /соединение 23, 0.19 г/ в виде белого твердого вещества, т.пл. 215 - 217oC. По аналогии были получены следующие соединения: 5-циклопропил-4-/3,4-диметоксибензо[b] тиен-5-оил/изоксазол-1,1-диоксид /соединение 24/ в виде твердого вещества белого цвета, т.пл.73 - 77oC. 5-циклопропил-4-/4-хлоро-3-метокси-2-метилбензо[b]тиен-5-оил/изоксазол-1,1-диоксид /соединение 25/ в виде твердого белого вещества, т.пл. 143 - 144oC. Ссылочный пример 1 Раствор 4-/3-циклопропил-1,3-диоксопроп-1-ил/-2,2-дифторо-1,3-бензодиоксола /12.0 г/ в сухом толуоле обрабатывался N, N - диметилформамид диметил ацеталом и смесь перемешивалась всю ночь. После выпаривания в вакууме и повторного выпаривания после добавления толуола остаток рекристаллизовался из циклогексан-этанола, чтобы получить 4-/3-циклопропил-2-диметиламинометилен-1,3-диоксопропил/-2,2-дифторо-1,3-бензодиоксол /6.5 г/ в виде бледно-желтого твердого вещества, т.пл. 118 - 119oC. Аналогичным образом были получены следующие соединения: 4-/3-циклопропил-2-диметиламинометилен-1,3-диоксопропил/-2,2-дифторо-7-метилсульфенил-1,3-бензодиоксол в виде оранжевой смолы. 4-/3-циклопропил/-2-диметиламинометилен-1,3-диоксопропил/-1-метилсульфонилиндол в виде коричневого стекла. 5-/3-циклопропил-2-диметиламинометилен-1,3-диоксопропил/-4-метил-1,3-бензодиоксол в виде коричневой смолы. 5-/3-циклопропил-2-диметиламинометилен-1,3-диоксопропил/-4-/метилсульфонилметил/-1,3-бензодиоксол в виде коричневой смолы. 5-/3-циклопропил-2-диметиламинометилен-1,3-диоксопропил/-2,2-дифторо-4-/метилсульфонилметил/-1,3-бензодиоксол в виде оранжевого стекла, ЯМР /CDCL3/ 1.25 /2H, м/, 1.35 /2H, м/, 2.6 /3H, с/, 2.75 /1H, м/, 7.05 /1H, д/, 7.23 /1H, д/, 8.25 /1H, с/. Пример 5 Раствор 5-циклопропил-4-/2,2-дифторо-4-метилсульфинил-1,3-бензодиоксол-5-оил/изоксазол /1.0 г/ в дихлорметане перемешивался с М=хлоропербензойной кислотой /55%, 1.33 г/ 5 часов, затем промывался по очереди раствором метабисульфата натрия, насыщенным раствором бикарбоната натрия и водой. Раствор высушивался /сульфат магния/, выпаривался до сухости и остаток рекристаллизовался из толуола/циклогексана, чтобы получить 5-циклопропил-4-/2,2-дифторо-4-метилсульфонил-1,3-бензодиоксол-5-оил/изоксазол/соединение 6, 0.94 г/ в виде бесцветного твердого вещества, т.пл. 162 - 163oC. Аналогичным образом были получены следующие соединения: 5-циклопропил-4-/2,2-дифторо-4-метилсульфонил-1,3-бензодиоксол-5-оил/изоксазол/соединение 9/ в виде твердого вещества, бесцветного, т.пл. 162 - 164oC. 5-циклопропил-4-[5-/метилсульфинил/-1,4-бензодиоксан-6-карбонил] изоксазол /соединение 21/ в виде твердого вещества кремового цвета, т.пл. 135 - 136oC. 5-циклопропил-4-[4-/метилсульфинил/-1,3-бензодиоксол-5-оил] изоксазол /соединение 22/ в виде твердого вещества кремового цвета, т.пл. 171 - 173oC. Пример 6 Раствор-5-циклопропил-4-/4-хлоро-3-метоксибензо[b] тиен-5-оил/изоксазола/0.28 г/ в дихлорметане обрабатывался м/хлорбензойной кислотой /55%, 0.72 г/. После 18 часов смесь охлаждалась до -20oC, фильтровалась и промывалась 0.5 М бисульфата натрия и водой, высушивалась над безводным сульфатом магния и выпаривалась. Очистка хроматографией на силикагеле эюированием циклогексаном/эфиром дала 5-циклопропил-4-/4-хлоро-3-метоксибензо[b] тиен-5-оил/изоксазол-1,1-диоксид /соединение 23, 0.19 г/ в виде белого твердого вещества, т.пл. 215 - 217oC. По аналогии были получены следующие соединения: 5-циклопропил-4-/3,4-диметоксибензо[b] тиен-5-оил/изоксазол-1,1-диоксид /соединение 24/ в виде твердого вещества белого цвета, т.пл.73 - 77oC. 5-циклопропил-4-/4-хлоро-3-метокси-2-метилбензо[b]тиен-5-оил/изоксазол-1,1-диоксид /соединение 25/ в виде твердого белого вещества, т.пл. 143 - 144oC. Ссылочный пример 1 Раствор 4-/3-циклопропил-1,3-диоксопроп-1-ил/-2,2-дифторо-1,3-бензодиоксола /12.0 г/ в сухом толуоле обрабатывался N, N - диметилформамид диметил ацеталом и смесь перемешивалась всю ночь. После выпаривания в вакууме и повторного выпаривания после добавления толуола остаток рекристаллизовался из циклогексан-этанола, чтобы получить 4-/3-циклопропил-2-диметиламинометилен-1,3-диоксопропил/-2,2-дифторо-1,3-бензодиоксол /6.5 г/ в виде бледно-желтого твердого вещества, т.пл. 118 - 119oC. Аналогичным образом были получены следующие соединения: 4-/3-циклопропил-2-диметиламинометилен-1,3-диоксопропил/-2,2-дифторо-7-метилсульфенил-1,3-бензодиоксол в виде оранжевой смолы. 4-/3-циклопропил/-2-диметиламинометилен-1,3-диоксопропил/-1-метилсульфонилиндол в виде коричневого стекла. 5-/3-циклопропил-2-диметиламинометилен-1,3-диоксопропил/-4-метил-1,3-бензодиоксол в виде коричневой смолы. 5-/3-циклопропил-2-диметиламинометилен-1,3-диоксопропил/-4-/метилсульфонилметил/-1,3-бензодиоксол в виде коричневой смолы. 5-/3-циклопропил-2-диметиламинометилен-1,3-диоксопропил/-2,2-дифторо-4-/метилсульфонилметил/-1,3-бензодиоксол в виде оранжевого стекла, ЯМР /CDCL3/ 0.7 /2H, м/, 1.0 /2H, м/, 2.1 /1H, м/, 2.7/3H, м/, 3.0 /3H, м/, 3.2 /3H, м/, 5.0 /2H, с/, 7.1 /1H, д/, 7.4 /1H, д/, 7,6 /1H, с/. 5-/3-циклопропил-2-диметиламинометилен-1,3-диоксопропил/-4-/метилсульфонил/-1,3-бензодиоксол в виде оранжевого масла. 6-/3-циклопропил-2-диметиламинометилен-1,3-диоксопропил/-1.4-бензодиоксан в виде оранжевой смолы. Ссылочный пример 2 Раствор 4-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-2,2-дифторо-7-метилсульфенил-1,3-бензодиоксола /10.3 г/ и паратолуолсульфокислота /0.5 г/ нагревались с обратным холодильником с толуолом 3 часа. После охлаждения растворитель выпаривался в вакууме и добавлялся этилацетат. Раствор промывался водой, высушивался над безводным сульфатом магния и выпаривался. Остаток очищался колонной хроматографией, эдюированием этилацетатом/циклогексаном, чтобы получить 4-/3-цвиклопропил-1,3-диоксопроп-1-ил/-2,2-дифторо-7-метилсульфенил-1,3-бензодиоксол /6.61 г/ т. пл. 117.5 - 118.5oC. Аналогичным образом были получены следующие соединения 4-/3-циклопропил-1,3-диоксопроп-1-ил/-2,2-дифторо-1,3-бензодиоксол, т.пл. 46 - 47oC. 2-т-бутил-4-хлоро-7-/3-циклопропил-1,3-диоксопроп-1-ил/бензоксазол в виде желтого масла, ЯМР /CDCL3/ 0.7 /2H, м/, 1.0 /2H, м/, 2.1 /1H, м/, 2.7/3H, м/, 3.0 /3H, м/, 3.2 /3H, м/, 5.0 /2H, с/, 7.1 /1H, д/, 7.4 /1H, д/, 7,6 /1H, с/. 5-/3-циклопропил-2-диметиламинометилен-1,3-диоксопропил/-4-/метилсульфонил/-1,3-бензодиоксол в виде оранжевого масла. 6-/3-циклопропил-2-диметиламинометилен-1,3-диоксопропил/-1.4-бензодиоксан в виде оранжевой смолы. Ссылочный пример 2 Раствор 4-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-2,2-дифторо-7-метилсульфенил-1,3-бензодиоксола /10.3 г/ и паратолуолсульфокислота /0.5 г/ нагревались с обратным холодильником с толуолом 3 часа. После охлаждения растворитель выпаривался в вакууме и добавлялся этилацетат. Раствор промывался водой, высушивался над безводным сульфатом магния и выпаривался. Остаток очищался колонной хроматографией, эдюированием этилацетатом/циклогексаном, чтобы получить 4-/3-цвиклопропил-1,3-диоксопроп-1-ил/-2,2-дифторо-7-метилсульфенил-1,3-бензодиоксол /6.61 г/ т. пл. 117.5 - 118.5oC. Аналогичным образом были получены следующие соединения 4-/3-циклопропил-1,3-диоксопроп-1-ил/-2,2-дифторо-1,3-бензодиоксол, т.пл. 46 - 47oC. 2-т-бутил-4-хлоро-7-/3-циклопропил-1,3-диоксопроп-1-ил/бензоксазол в виде желтого масла, ЯМР /CDCL3/ 1.1 /2H, м/, 1.25 /2H, м/, 1.55 /9H, с/, 1.85 /1H, м/, 6.7 /1H, с/, 7.4 /1H, д/, 7.95 /1H, д/, 16.3 /1H, шир.с/. 7-/3-циклопропил-1,3-диоксопропил/-4-фторо-1,3-бензоксазол-2-он в виде оранжевого стекла, ЯМР /CDCL3/ 1.1 /2H, м/, 1.25 /2H, м/, 1.55 /9H, с/, 1.85 /1H, м/, 6.7 /1H, с/, 7.4 /1H, д/, 7.95 /1H, д/, 16.3 /1H, шир.с/. 7-/3-циклопропил-1,3-диоксопропил/-4-фторо-1,3-бензоксазол-2-он в виде оранжевого стекла, ЯМР /CDCL3/ 0.95 /2H, м/, 1.05 /2H, м/, 1.75 /1H, м/, 6.5 /1H, с/, 6.8 /1H, т/, 7.5 /1H, дд/, 12.0 /1H, шир.с/, 16.2 /1H, шир.с/. 5-/3-циклопропл-1,3-диоксопроп-1-ил/-2,2-дифторо-4-метилсульфенил-1,3-бензодиоксол, ЯМР /CDCL3/ 0.95 /2H, м/, 1.05 /2H, м/, 1.75 /1H, м/, 6.5 /1H, с/, 6.8 /1H, т/, 7.5 /1H, дд/, 12.0 /1H, шир.с/, 16.2 /1H, шир.с/. 5-/3-циклопропл-1,3-диоксопроп-1-ил/-2,2-дифторо-4-метилсульфенил-1,3-бензодиоксол, ЯМР /CDCL3/ 1.05 /2H, м/, 1.25 /2H, м/, 1.75 /1H, м/, 2.05 /3H, с/, 6.0 /1H, с/, 7.0 /1H, д/, 7.45 /1H, д/, 16.3 /1H, шир.с/. 4-хлоро-5-/3-циклопропил-1,3-диоксопроп-1-ил/-3-метоксибензо[b] тиофен в виде масла красного цвета, ЯМР /CDCL3/ 1.05 /2H, м/, 1.25 /2H, м/, 1.75 /1H, м/, 2.05 /3H, с/, 6.0 /1H, с/, 7.0 /1H, д/, 7.45 /1H, д/, 16.3 /1H, шир.с/. 4-хлоро-5-/3-циклопропил-1,3-диоксопроп-1-ил/-3-метоксибензо[b] тиофен в виде масла красного цвета, ЯМР /CDCL3/ 1.0 /2H, м/, 1.24 /2H, м/, 1.76 /1H, м/, 3.96 /3H, с/, 6.14 /1H, с/, 6.46 /1H, с/,7.46 /1H, д/, 7.66 /1H, д/, 15.9 /1H, шир.с/. 2-т-бутил-4-метилсульфенил-7-/3-циклопропил-1,3-диоксопроп-1-ил/бензоксазол в виде желтого твердого вещества, ЯМР /CDCL3/ 1.0 /2H, м/, 1.24 /2H, м/, 1.76 /1H, м/, 3.96 /3H, с/, 6.14 /1H, с/, 6.46 /1H, с/,7.46 /1H, д/, 7.66 /1H, д/, 15.9 /1H, шир.с/. 2-т-бутил-4-метилсульфенил-7-/3-циклопропил-1,3-диоксопроп-1-ил/бензоксазол в виде желтого твердого вещества, ЯМР /CDCL3/ 1.05 /2H, м/, 1.25 /2H, м/, 1.57 /H, с/, 1.88 /1H, м/, 2.67 /3H, с/, 6.70 /1H, с/, 7.16 /2H, д/, 7.92 /1H, д/. 4-хлоро-5-/3-циклопропил-1,3-диоксопро-1-ил/-3-метокси-2-метилбензо[b] тиофен в виде масла красного цвета, ЯМР /CDCL3/ 1.05 /2H, м/, 1.25 /2H, м/, 1.57 /H, с/, 1.88 /1H, м/, 2.67 /3H, с/, 6.70 /1H, с/, 7.16 /2H, д/, 7.92 /1H, д/. 4-хлоро-5-/3-циклопропил-1,3-диоксопро-1-ил/-3-метокси-2-метилбензо[b] тиофен в виде масла красного цвета, ЯМР /CDCL3/ 1.1 /2H, м/, 1.3 /2H, м/, 1.8 /1H, м/, 2.5 /3H, с/, 3.9 /3H, с/, 6.1 /1H, с/, 7.4 /1H, д/, 7.6 /1H, д/, 16.0 /1H, шир.с/. 4-хлоро-5-/3-циклопропил-1,3-доксопроп-1-ил/-3этоксибензо[b] тиофен в виде оранжевой смолы, ЯМР /CDCL3/ 1.1 /2H, м/, 1.3 /2H, м/, 1.8 /1H, м/, 2.5 /3H, с/, 3.9 /3H, с/, 6.1 /1H, с/, 7.4 /1H, д/, 7.6 /1H, д/, 16.0 /1H, шир.с/. 4-хлоро-5-/3-циклопропил-1,3-доксопроп-1-ил/-3этоксибензо[b] тиофен в виде оранжевой смолы, ЯМР /CDCL3/ 1.0 /2H, м/, 1.2 /2H, м/, 1.5 /3H, т/, 1.7 /1H, м/, 4.1 /2H, кв/, 6.1 /1H, с/, 6.4 /1H, с/, 7.4 /1H, д/, 7.6 /1H, д/, 16.0 /1H, ш.с./; и 4-хлоро-5-/3-циклопропил-1,3-диоксопроп-1-ил/-3-этокси-2-этилбензо[b] тиофен в виде оранжевой смолы, ЯМР /CDCL3/ 1.0 /2H, м/, 1.2 /2H, м/, 1.5 /3H, т/, 1.7 /1H, м/, 4.1 /2H, кв/, 6.1 /1H, с/, 6.4 /1H, с/, 7.4 /1H, д/, 7.6 /1H, д/, 16.0 /1H, ш.с./; и 4-хлоро-5-/3-циклопропил-1,3-диоксопроп-1-ил/-3-этокси-2-этилбензо[b] тиофен в виде оранжевой смолы, ЯМР /CDCL3/ 1.0 /2H, м/, 1.2 /2H, м/, 1.3 /3H, т/, 1.4 /3H, т/, 1.7 /1H, м/, 2.9 /2H, кв/, 4.0 /2H, кв/, 6.1 /1H, с/, 7.3 /1H, д/, 7.6 /1H, д/, 15.9 /1H, ш.с./, причем каждое из этих соединений отдельно очищалось от реакции со смесью соединений, полученных в ссылочном примере 3. 5-/3-циклопропил-1,3-диоксопроп-1-ил/3-этокси-4-/метилсульфенил/бензо[b] тиофен в виде желтой смолы, ЯМР /CDCL3/ 1.0 /2H, м/, 1.2 /2H, м/, 1.3 /3H, т/, 1.4 /3H, т/, 1.7 /1H, м/, 2.9 /2H, кв/, 4.0 /2H, кв/, 6.1 /1H, с/, 7.3 /1H, д/, 7.6 /1H, д/, 15.9 /1H, ш.с./, причем каждое из этих соединений отдельно очищалось от реакции со смесью соединений, полученных в ссылочном примере 3. 5-/3-циклопропил-1,3-диоксопроп-1-ил/3-этокси-4-/метилсульфенил/бензо[b] тиофен в виде желтой смолы, ЯМР /CDCL3/ 1.0 /2H, м/, 1.2 /2H, м/, 1.6 /3H, т/, 1.7 /1H, м/, 2.5 /3H, т/, 4.2 /2H, кв/, 6.0 /1H, с/, 6.5 /1H, с/, 7.4 /1H, д/, 7.7 /1H, д/, 16.0 /1H, ш.с./, 4-/3-циклопропил-1,3-диоксопроп-1-ил/-1-/метилсульфенил/индол в виде твердого вещества коричневого цвета, ЯМР /CDCL3/ 1.0 /2H, м/, 1.2 /2H, м/, 1.6 /3H, т/, 1.7 /1H, м/, 2.5 /3H, т/, 4.2 /2H, кв/, 6.0 /1H, с/, 6.5 /1H, с/, 7.4 /1H, д/, 7.7 /1H, д/, 16.0 /1H, ш.с./, 4-/3-циклопропил-1,3-диоксопроп-1-ил/-1-/метилсульфенил/индол в виде твердого вещества коричневого цвета, ЯМР /CDCL3/ 1.0/2H, м/, 1.3 /2H, м/, 1.8 /1H, м/, 3.1 /3H, с/, 6.3 /1H, с/, 7.2 - 7.6 /3H, м/, 7.7 /1H, д/, 8.1 /1H, д/. 5-/3-циклопропил-1,3-диоксопропил/-4-метил-1,3-бензодиоксол в виде оранжевой смолы, ЯМР /CDCL3/ 1.0/2H, м/, 1.3 /2H, м/, 1.8 /1H, м/, 3.1 /3H, с/, 6.3 /1H, с/, 7.2 - 7.6 /3H, м/, 7.7 /1H, д/, 8.1 /1H, д/. 5-/3-циклопропил-1,3-диоксопропил/-4-метил-1,3-бензодиоксол в виде оранжевой смолы, ЯМР /CDCL3/ 0.9 /2H, м/, 1.1 /2H, м/, 1.7 /1H, м/, 2.3 /3H, с/, 5.9 /1H, с/, 6.0 /2H, с/, 6.6 /1H, д/, 7.1 /1H, д/. 5-/3-циклопропил-1,3-диоксопропил/-4-/метилсульфонилметил/-1,3-бензодиоксол в виде коричневой смолы, ЯМР /CDCL3/ 1.0 /2H, м/, 1.2 /2H, м/, 1.7 /1H, м/, 2.9 /3H, с/, 4.9 /2H, с/, 6.10 /1H, с/, 6.12 /2H, с/, 6.9 /1H, с/, 7.3 /1H, д/. 5-/3-циклопропил-1,3-диоксопропил/-2,2-дифторо-4-/метилсульфонилметил/-1,3-бензодиоксол в виде оранжевой смолы, ЯМР /CDCL3/ 1.0 /2H, м/, 1.3 /2H, м/, 1.7 /1H, м/, 2.9 /3H, с/, 4.9 /2H, с/, 6.1 /1H, с/, 7.2 /1H, д/, 7.5 /1H, д/. 5-/3-циклопропил-1,3-диоксопропил/-4-/метилсульфонил/-1,3-бензодиоксол в виде оранжевого масла, ЯМР /CDCL3/ 1.0 /2H, м/, 1.2 /2H, м/, 1.7 /1H, м/, 2.5 /3H, с/, 6.0 /1H, с/, 6.1 /2H, с/, 6.7 /1H, д/, 7.1 /1H, д/. 6-/3-циклопропил-1,3-диоксопропил/-5-/метилсульфонил/-1,4-бензодиоксан в виде оранжевого масла, ЯМР /CDCL3/ 0.9 /2H, м/, 1.1 /2H, м/, 1.7 /1H, м/, 2.3 /3H, с/, 5.9 /1H, с/, 6.0 /2H, с/, 6.6 /1H, д/, 7.1 /1H, д/. 5-/3-циклопропил-1,3-диоксопропил/-4-/метилсульфонилметил/-1,3-бензодиоксол в виде коричневой смолы, ЯМР /CDCL3/ 1.0 /2H, м/, 1.2 /2H, м/, 1.7 /1H, м/, 2.9 /3H, с/, 4.9 /2H, с/, 6.10 /1H, с/, 6.12 /2H, с/, 6.9 /1H, с/, 7.3 /1H, д/. 5-/3-циклопропил-1,3-диоксопропил/-2,2-дифторо-4-/метилсульфонилметил/-1,3-бензодиоксол в виде оранжевой смолы, ЯМР /CDCL3/ 1.0 /2H, м/, 1.3 /2H, м/, 1.7 /1H, м/, 2.9 /3H, с/, 4.9 /2H, с/, 6.1 /1H, с/, 7.2 /1H, д/, 7.5 /1H, д/. 5-/3-циклопропил-1,3-диоксопропил/-4-/метилсульфонил/-1,3-бензодиоксол в виде оранжевого масла, ЯМР /CDCL3/ 1.0 /2H, м/, 1.2 /2H, м/, 1.7 /1H, м/, 2.5 /3H, с/, 6.0 /1H, с/, 6.1 /2H, с/, 6.7 /1H, д/, 7.1 /1H, д/. 6-/3-циклопропил-1,3-диоксопропил/-5-/метилсульфонил/-1,4-бензодиоксан в виде оранжевого масла, ЯМР /CDCL3/ 1.0 /2H, м/, 1.2 /2H, м/, 1.7 /1H, м/, 2.4 /3H, с/, 4.3 /4H, м/, 6.0 /1H, с/, 6.9 /1H, д/, 7.1 /1H, д/. Ссылочный пример 3 Раствор т-бутил-3-циклопропил-3-оксопропаноата /5.52 г/ в метаноле обрабатывался стружкой магния /0.72 г/ и реакция инициировалась добавлением тетрахлорметана /2 мл/. После перемешивания при окружающей температуре в течение 40 минут растворитель выпаривался и повторно выпаривался после добавления толуола. Полученное твердое вещество суспендировалось ацетонитриле и добавлялся раствор 2,2-дифторо-7-метилсульфенил-1,3-бензодиоксол-4-оил хлорида /7.9 г/ в ацетонитриле. Эта смесь перемешивалась всю ночь и обрабатывалась хлористоводородной кислотой. После перемешивания в течение 1.5 часов экстракция этилацетатом с последующим промыванием рассолом, высушиванием над безводным сульфатом магния и повторным выпариванием дала 4-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-1,3-диоксопроп-1-ил/-2,2-дифторо-7-метилсульфенил-1,3-бензодиоксол /10.3 г/ в виде желтого масла. Аналогичным путем были получены следующие соединения: 4-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-2,2-дифторо-1,3-бензодиоксол. 2-т-бутил-4-хлоро-7-/3-циклопроил/2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/бензоксазол. 7-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-4-фторо-1,3-бензоксазол-2-он. 5-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-2,2-дифторо-4-метилсульфенил-1,3-бензодиоксол. 4-хлоро-5-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-3-метоксибензо[b]тиофен. 2-т-бутил-4-метилсульфенил-7-3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/бензоксазол. 4-хлоро-5-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-3-метокси-2-метилбензо[b]тиофен. Смесь 4-хлоро-5-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-3-этоксибензо[b] тиофен и 4-хлоро-5-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-3-этокси-2-этилбензо[b]тиофен /получена из продукта ссылочного примера 17/. 5-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-3-этокси-4-/метилсульфенил/бензо[b]тиофен. 4-/3-циклопропил-1-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-1-/метилсульфонил/индол. 5-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-4-метил-1,3-бензодиоксол. 5-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-4-/метилсульфонилметил/-1,3-бензодиоксол. 5-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-2,2-дифторо-4-/метилсульфонилметил/-1,3-бензодиоксол. 5-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-4-/метилсульфенил/-1,3-бензодиоксол. 6-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-5-/метилсульфенил/-1,4-бензодиоксан. Ссылочный пример 4 2,2-дифторо-1,3-бензодиоксил-4-карбоновая кислот /15.0 г/ растворялась в 1,2-дихлорэтане и добавлялись N, N -диметилформамид и тионил хлорид /10.6 г/. Смесь нагревалась с обратным холодильником 1 час и растворитель выпаривался в вакууме. Остаток растворялся в толуоле и повторно выпаривался, чтобы получить 2,2-дифторо-1,3-бензодиоксил-4-оил хлорид /17.35 г/. Аналогично был получен 2,2-дифторо-7-метилсульфенил-1,3-бунзодиоксол-4-оил-хлорид. Ссылочный пример 5 Раствор н-бутиллития/88 мл 2.5 М раствора в гексане/ разбавлялся сухим гексаном в инертной атмосфере, охлаждался до 5oC и по каплям добавлялся N, N, N, N - тетраметилэтилендиамин /33 мл/ в сухом гексане. При -35oC добавлялся сухой тетрагидрофуран, смесь охлаждалась до -70oC, и в течение 1.5 часов с поддержанием температуры ниже -62oC добавлялась 2,2-дифторо-1,3-бензодиоксил-4-карбоновая кислота. После 20 часов при -75oC в течение 30 минут добавлялся диметилдисульфид /25 мл/ и смесь перемешивалась при этой температуре всю ночь и затем при комнатной температуре 24 часа. Смесь выливалась в ледяную воду, промывалась эфиром и окислялась до рН 1 концентрированной хлористоводородной кислотой. Затем экстранад безводным сульфатом магния. Выпаривание растврителя дало 2,2-дифторо-7-метилсульфенил-1,3-бунзодиоксол-4-карбоновую кислоту /17.75 г/ЯМР /D6DMCO/; 7,65 /1H, д/, 7,25 /1Н, д/, 2,6 /3Н, c/, 2,2 - дифторо-1,3 бензодиоксол-4-карбоновая кислота описана в Европейской патентной публикации N 0333658. Ссылочный пример 6 Смесь 5-/3-циклопропил-1-ил/-3,4-диметоксибензо[b] тиофена /0.5 г/ и триэтил ортоформата /0.73 г/ нагревалась с обратным холодильником с уксусным ангидридом /10мл/ 3 часа. После охлаждения и добавления толуола раствор выпаривался до сухости, чтобы получить 5-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/-3,4-диметоксибензо[b]тиофен в виде красного масла. Аналогичным образом были получены следующие соединения: 5-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/бензо-1,2,3-тиадиазол. 2-т-бутил-4-хлоро-7-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/бензоксазол в виде оранжевого масла. 5-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/-2,2-дифторо-4-метилсульфенил-1,3-бензодиоксол. 4-хлоро-5-/3-циклопропил-2-этоксиметилен-2,3-диоксопроп-1-ил/-3-метоксибензо[b]тиофен. 2-т-бутил-4-метилсульфенил-7-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/бензоксазол. 4-хлоро-5-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/-3-метокси-2-метилбензо[b]тиофен. 4-хлоро-5-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/-3-этокси-2-этилбензо[b]тиофен. 5-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/-3-этокси-4-метилсульфенилбензо[b]тиофен. 4-хлоро-5-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/-3-этоксибензо[b]тиофен. Ссылочный пример 7 Раствор метил 4-хлоро-3-метоксибензо[b]тиофен-5-карбоксилата /3.95 г/ в сухом тетрагидрофуране был добавлен к гидриду натрия /60%, 1.355 г/ и перемешивался в инертной атмосфере с согреванием до 50 - 60oC. В течение 3 часов при 50 -60oC добавлялся циклопропил метил кетон /2.59 г/ с перемешиванием. После охлаждения осторожно добавлялся изопропанол /5 мл/ с последующим добавлением воды /5 мл/. Смесь выливалась на 2N хлористоводородной кислоты и экстрагировалась эфиром. Эфирные экстракты высушивались над безводным сульфатом магния и выпаривались в вакууме. Остаток очищался колонной хроматографией на сикагеле с элюированием эфиром/циклогексаном, чтобы получить 5-/3-циклопропил-1,3-диоксопроп-1-ил/-3,4-диметоксибензо тиофен в виде твердого вещества желтого цвета /1.47 г/, т.пл. 77.5 - 80oC. Аналогичным образом был получен 5-/3-циклопропил-1,3-диоксопроп-1-ил/бензо-1,2,3-тиадиазол в виде светло-оранжевого вещества, т.пл. 141.5 - 144.5oC. Ссылочный пример 8 Смесь 4-хлоро-3-гидробензо[b]тиофен-5-карбоновой кислоты /23.4 г/ карбоната цезия /70.07 г/, метил йодида /50 мл/ и тетера-н-бутиламмоний йодида /1.89 г/ нагревалась в ацетоне с обратным холодильником всю ночь. Растворитель выпаривался и остаток растворялся в этилацетате. Раствор промывался насыщенным раствором карбоната натрия, водой, высушивался над безводным сульфатом магния и выпаривался в вакууме. Остаток очищался колонной хроматографией с элюированием этилацетатом/ петролейным эфиром, т.к. 60 - 80oС, чтобы получить метил-4-хлоро-3-метоксибензо[b]тиофен-5-карбоксилата /8.35 г/ в виде бледно-желтого твердого вещества, т.пл. 67 - 70oC и метил 4-хлоро-3-метокси-2-метилбензо[b] тиофен-5-карбоксилат /3.4 г/, ЯМР /CDCL3/ 1.0 /2H, м/, 1.2 /2H, м/, 1.7 /1H, м/, 2.4 /3H, с/, 4.3 /4H, м/, 6.0 /1H, с/, 6.9 /1H, д/, 7.1 /1H, д/. Ссылочный пример 3 Раствор т-бутил-3-циклопропил-3-оксопропаноата /5.52 г/ в метаноле обрабатывался стружкой магния /0.72 г/ и реакция инициировалась добавлением тетрахлорметана /2 мл/. После перемешивания при окружающей температуре в течение 40 минут растворитель выпаривался и повторно выпаривался после добавления толуола. Полученное твердое вещество суспендировалось ацетонитриле и добавлялся раствор 2,2-дифторо-7-метилсульфенил-1,3-бензодиоксол-4-оил хлорида /7.9 г/ в ацетонитриле. Эта смесь перемешивалась всю ночь и обрабатывалась хлористоводородной кислотой. После перемешивания в течение 1.5 часов экстракция этилацетатом с последующим промыванием рассолом, высушиванием над безводным сульфатом магния и повторным выпариванием дала 4-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-1,3-диоксопроп-1-ил/-2,2-дифторо-7-метилсульфенил-1,3-бензодиоксол /10.3 г/ в виде желтого масла. Аналогичным путем были получены следующие соединения: 4-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-2,2-дифторо-1,3-бензодиоксол. 2-т-бутил-4-хлоро-7-/3-циклопроил/2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/бензоксазол. 7-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-4-фторо-1,3-бензоксазол-2-он. 5-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-2,2-дифторо-4-метилсульфенил-1,3-бензодиоксол. 4-хлоро-5-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-3-метоксибензо[b]тиофен. 2-т-бутил-4-метилсульфенил-7-3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/бензоксазол. 4-хлоро-5-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-3-метокси-2-метилбензо[b]тиофен. Смесь 4-хлоро-5-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-3-этоксибензо[b] тиофен и 4-хлоро-5-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-3-этокси-2-этилбензо[b]тиофен /получена из продукта ссылочного примера 17/. 5-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-3-этокси-4-/метилсульфенил/бензо[b]тиофен. 4-/3-циклопропил-1-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-1-/метилсульфонил/индол. 5-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-4-метил-1,3-бензодиоксол. 5-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-4-/метилсульфонилметил/-1,3-бензодиоксол. 5-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-2,2-дифторо-4-/метилсульфонилметил/-1,3-бензодиоксол. 5-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-4-/метилсульфенил/-1,3-бензодиоксол. 6-/3-циклопропил-2-т-бутилоксикарбонил-1,3-диоксопроп-1-ил/-5-/метилсульфенил/-1,4-бензодиоксан. Ссылочный пример 4 2,2-дифторо-1,3-бензодиоксил-4-карбоновая кислот /15.0 г/ растворялась в 1,2-дихлорэтане и добавлялись N, N -диметилформамид и тионил хлорид /10.6 г/. Смесь нагревалась с обратным холодильником 1 час и растворитель выпаривался в вакууме. Остаток растворялся в толуоле и повторно выпаривался, чтобы получить 2,2-дифторо-1,3-бензодиоксил-4-оил хлорид /17.35 г/. Аналогично был получен 2,2-дифторо-7-метилсульфенил-1,3-бунзодиоксол-4-оил-хлорид. Ссылочный пример 5 Раствор н-бутиллития/88 мл 2.5 М раствора в гексане/ разбавлялся сухим гексаном в инертной атмосфере, охлаждался до 5oC и по каплям добавлялся N, N, N, N - тетраметилэтилендиамин /33 мл/ в сухом гексане. При -35oC добавлялся сухой тетрагидрофуран, смесь охлаждалась до -70oC, и в течение 1.5 часов с поддержанием температуры ниже -62oC добавлялась 2,2-дифторо-1,3-бензодиоксил-4-карбоновая кислота. После 20 часов при -75oC в течение 30 минут добавлялся диметилдисульфид /25 мл/ и смесь перемешивалась при этой температуре всю ночь и затем при комнатной температуре 24 часа. Смесь выливалась в ледяную воду, промывалась эфиром и окислялась до рН 1 концентрированной хлористоводородной кислотой. Затем экстранад безводным сульфатом магния. Выпаривание растврителя дало 2,2-дифторо-7-метилсульфенил-1,3-бунзодиоксол-4-карбоновую кислоту /17.75 г/ЯМР /D6DMCO/; 7,65 /1H, д/, 7,25 /1Н, д/, 2,6 /3Н, c/, 2,2 - дифторо-1,3 бензодиоксол-4-карбоновая кислота описана в Европейской патентной публикации N 0333658. Ссылочный пример 6 Смесь 5-/3-циклопропил-1-ил/-3,4-диметоксибензо[b] тиофена /0.5 г/ и триэтил ортоформата /0.73 г/ нагревалась с обратным холодильником с уксусным ангидридом /10мл/ 3 часа. После охлаждения и добавления толуола раствор выпаривался до сухости, чтобы получить 5-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/-3,4-диметоксибензо[b]тиофен в виде красного масла. Аналогичным образом были получены следующие соединения: 5-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/бензо-1,2,3-тиадиазол. 2-т-бутил-4-хлоро-7-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/бензоксазол в виде оранжевого масла. 5-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/-2,2-дифторо-4-метилсульфенил-1,3-бензодиоксол. 4-хлоро-5-/3-циклопропил-2-этоксиметилен-2,3-диоксопроп-1-ил/-3-метоксибензо[b]тиофен. 2-т-бутил-4-метилсульфенил-7-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/бензоксазол. 4-хлоро-5-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/-3-метокси-2-метилбензо[b]тиофен. 4-хлоро-5-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/-3-этокси-2-этилбензо[b]тиофен. 5-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/-3-этокси-4-метилсульфенилбензо[b]тиофен. 4-хлоро-5-/3-циклопропил-2-этоксиметилен-1,3-диоксопроп-1-ил/-3-этоксибензо[b]тиофен. Ссылочный пример 7 Раствор метил 4-хлоро-3-метоксибензо[b]тиофен-5-карбоксилата /3.95 г/ в сухом тетрагидрофуране был добавлен к гидриду натрия /60%, 1.355 г/ и перемешивался в инертной атмосфере с согреванием до 50 - 60oC. В течение 3 часов при 50 -60oC добавлялся циклопропил метил кетон /2.59 г/ с перемешиванием. После охлаждения осторожно добавлялся изопропанол /5 мл/ с последующим добавлением воды /5 мл/. Смесь выливалась на 2N хлористоводородной кислоты и экстрагировалась эфиром. Эфирные экстракты высушивались над безводным сульфатом магния и выпаривались в вакууме. Остаток очищался колонной хроматографией на сикагеле с элюированием эфиром/циклогексаном, чтобы получить 5-/3-циклопропил-1,3-диоксопроп-1-ил/-3,4-диметоксибензо тиофен в виде твердого вещества желтого цвета /1.47 г/, т.пл. 77.5 - 80oC. Аналогичным образом был получен 5-/3-циклопропил-1,3-диоксопроп-1-ил/бензо-1,2,3-тиадиазол в виде светло-оранжевого вещества, т.пл. 141.5 - 144.5oC. Ссылочный пример 8 Смесь 4-хлоро-3-гидробензо[b]тиофен-5-карбоновой кислоты /23.4 г/ карбоната цезия /70.07 г/, метил йодида /50 мл/ и тетера-н-бутиламмоний йодида /1.89 г/ нагревалась в ацетоне с обратным холодильником всю ночь. Растворитель выпаривался и остаток растворялся в этилацетате. Раствор промывался насыщенным раствором карбоната натрия, водой, высушивался над безводным сульфатом магния и выпаривался в вакууме. Остаток очищался колонной хроматографией с элюированием этилацетатом/ петролейным эфиром, т.к. 60 - 80oС, чтобы получить метил-4-хлоро-3-метоксибензо[b]тиофен-5-карбоксилата /8.35 г/ в виде бледно-желтого твердого вещества, т.пл. 67 - 70oC и метил 4-хлоро-3-метокси-2-метилбензо[b] тиофен-5-карбоксилат /3.4 г/, ЯМР /CDCL3/ 2.5 /3H, с/, 3.9 /2H, с/, 4.0 /3H, с/, 7.6 /2H, с/. Ссылочный пример 9 Смесь диметил-4-хлоро-3-гидроксибензо[b]тиофен-2,5-дикарбоксилата /12.62 г/ и 2N гидроксида натрия нагревалась с обратным холодильником 2 часа. Смесь нейтрализовалась 2N хлористоводородной кислоты при 100oC. Раствор окислялся концентрированной хлористоводородной кислотой и перемешивался в условиях флегмации еще 30 минут. Вещество пурпурного цвета фильтровалось и высушивалось /7.72 г/ в эксикаторе и это, как показал анализ, была 4-хлоро-3-гидробензо[b] тиофен-5-карбоновая кислота, ЯМР /DMCOD6/ 2.5 /3H, с/, 3.9 /2H, с/, 4.0 /3H, с/, 7.6 /2H, с/. Ссылочный пример 9 Смесь диметил-4-хлоро-3-гидроксибензо[b]тиофен-2,5-дикарбоксилата /12.62 г/ и 2N гидроксида натрия нагревалась с обратным холодильником 2 часа. Смесь нейтрализовалась 2N хлористоводородной кислоты при 100oC. Раствор окислялся концентрированной хлористоводородной кислотой и перемешивался в условиях флегмации еще 30 минут. Вещество пурпурного цвета фильтровалось и высушивалось /7.72 г/ в эксикаторе и это, как показал анализ, была 4-хлоро-3-гидробензо[b] тиофен-5-карбоновая кислота, ЯМР /DMCOD6/ 6.67 /1H, с/, 7.54 /1H, д/, 7.87 /1H, д/, 10.3 /1H, с/, 13.34 /1H, с/ и 4.07 /2H, с/, 7.63 /1H, д/, 7.93 /1H, д/, 13.34 /1H, д/, /40% в форме кето/. Ссылочный пример 10 Дметил-2,4-дихлороизофталоат /11.95 г/ и метил тиогликолят /7.23 г/ растворялись в N, N - диметилформамиде, и добавлялся моногидрат гидроксида лития /3.81 г/. Смесь перемешивалась при окружающей температуре 2 часа, разбавлялась водой и доводилась до рН 1 хлористоводородной кислотой. Твердое вещество фильтровалось, промывалось кипящим циклогексаном и высушивалось азеотропным удалением толуола, чтобы получить диметил 4-хлоро-3-гидроксибензо[b] тиофен-2,5-дикарбоксилата /13.44 г/ в виде твердого вещества бежевого цвета, т.пл. 127 -131oC. Ссылочный пример 11 2,4-дихлоро-3-метоксикарбонилбензоилхлорид /34.76 г/ перемешивался и нагревался с обратным холодильником с метанолом 15 часов. После охлаждения растворитель выпаривался и остаток рекристаллизовался из циклогексана, чтобы получить диметил 2,4-дихлороизофталоат /16.04 г/ в виде твердого бежевого цвета, ЯМР /DMCOD6/ 6.67 /1H, с/, 7.54 /1H, д/, 7.87 /1H, д/, 10.3 /1H, с/, 13.34 /1H, с/ и 4.07 /2H, с/, 7.63 /1H, д/, 7.93 /1H, д/, 13.34 /1H, д/, /40% в форме кето/. Ссылочный пример 10 Дметил-2,4-дихлороизофталоат /11.95 г/ и метил тиогликолят /7.23 г/ растворялись в N, N - диметилформамиде, и добавлялся моногидрат гидроксида лития /3.81 г/. Смесь перемешивалась при окружающей температуре 2 часа, разбавлялась водой и доводилась до рН 1 хлористоводородной кислотой. Твердое вещество фильтровалось, промывалось кипящим циклогексаном и высушивалось азеотропным удалением толуола, чтобы получить диметил 4-хлоро-3-гидроксибензо[b] тиофен-2,5-дикарбоксилата /13.44 г/ в виде твердого вещества бежевого цвета, т.пл. 127 -131oC. Ссылочный пример 11 2,4-дихлоро-3-метоксикарбонилбензоилхлорид /34.76 г/ перемешивался и нагревался с обратным холодильником с метанолом 15 часов. После охлаждения растворитель выпаривался и остаток рекристаллизовался из циклогексана, чтобы получить диметил 2,4-дихлороизофталоат /16.04 г/ в виде твердого бежевого цвета, ЯМР /DMCOD6/ 3.87 /3H, с/, 3.94 /3H, с/, 7.74 /1H, д/, 7.94 /1H, д/. Ссылочный пример 12 2,4-дихлоро-3-метоксикарбонилбензойная кислота /32.37 г/ и тионил хлорид /100 мл/ нагреватель с обратным холодильником с перемешиванием 3 часа. Смесь охлаждалась и выпаривалась в вакууме, затем повторно выпаривалась поcле добавления толуола, чтобы получить 2,4-дихлоро-3-метоксикарбонилбензоилхлорид /34.76 г/ в виде темно-коричневого масла. Оно использовалось на следующей стадии без очистки. Ссылочный пример 13 К перемешанному раствору диизопропиламина /22 мл/ в сухом тетерагидрофуране /160 мл/, охлажденному до 0oC в инертной атмосфере был по каплям добавлен н-бутил литий /2.5 М, 67 мл/. Раствор перемешивался 30 минут при 0oC, затем добавлялся к раствору метил 2,6-дихлорбензоата /26.62 г/ в сухом тетрагидрофуране /160 мл/, охлажденному до -78oC в инертной атмосфере. После 1.5 часов при этой температуре смесь выливалась на избыток кардиса и оставлялась на всю ночь. Растворитель выпаривался в вакууме и остаток окислялся 3N хлористоводородной кислоты. Затем это экстрагировалось этилацетатом, высушивалось над безводным сульфатом магния и выпаривалось в вакууме, чтобы получить 2,4-дихлоро-3-метоксикарбонилбензоилхлоридную кислоту /32.37 г/ в виде твердого вещества, ЯМР /DMCOD6/ 3.87 /3H, с/, 3.94 /3H, с/, 7.74 /1H, д/, 7.94 /1H, д/. Ссылочный пример 12 2,4-дихлоро-3-метоксикарбонилбензойная кислота /32.37 г/ и тионил хлорид /100 мл/ нагреватель с обратным холодильником с перемешиванием 3 часа. Смесь охлаждалась и выпаривалась в вакууме, затем повторно выпаривалась поcле добавления толуола, чтобы получить 2,4-дихлоро-3-метоксикарбонилбензоилхлорид /34.76 г/ в виде темно-коричневого масла. Оно использовалось на следующей стадии без очистки. Ссылочный пример 13 К перемешанному раствору диизопропиламина /22 мл/ в сухом тетерагидрофуране /160 мл/, охлажденному до 0oC в инертной атмосфере был по каплям добавлен н-бутил литий /2.5 М, 67 мл/. Раствор перемешивался 30 минут при 0oC, затем добавлялся к раствору метил 2,6-дихлорбензоата /26.62 г/ в сухом тетрагидрофуране /160 мл/, охлажденному до -78oC в инертной атмосфере. После 1.5 часов при этой температуре смесь выливалась на избыток кардиса и оставлялась на всю ночь. Растворитель выпаривался в вакууме и остаток окислялся 3N хлористоводородной кислоты. Затем это экстрагировалось этилацетатом, высушивалось над безводным сульфатом магния и выпаривалось в вакууме, чтобы получить 2,4-дихлоро-3-метоксикарбонилбензоилхлоридную кислоту /32.37 г/ в виде твердого вещества, ЯМР /DMCOD6/ 3.93 /3H, с/, 7.70 /1H, д/, 7.91 /1H, д/. Ссылочный пример 14 Раствор Этил-3-амино-4-бензилтиобензоата /6.11 г/ в этаноле /20 мл/ добавлялся к энергично перемешанному раствору нитрита натрия /3.23 г/ и 48% бромистоводородной кислоте /21 мл/ в воде /2500 мл/, охлажденной до 0oC. Смесь оставлялась согреваться до комнатной температуре всю ночь и делалась основной твердым карбонатом натрия /12 г/. Красный осадок фильтровался, растворялся в этилацетате, высушивался над безводным сульфатом магния и выпаривался, чтобы получить этил бензо-1,2,3-тиадиазол-5-карбоксилат /2.97 г/ в виде красного кристаллического вещества, т.пл. 74.5 - 77oC. Ссылочный пример 15 Этил-4-бензилтио-3-нетробензоат /10.16 г/ суспендировался в этаноле и перемешивался. Добавлялась концентрированная хлористоводородная кислота /60 мл/ с последующим добавлением порциями железного порошка /12.51 г/. Смесь моленно согревалась до 60 - 70oC и перемешивалась всю ночь. После охлаждения смесь выливалась на лед, нейтрализовалась твердым бикарбонатом натрия и фильтровалась. Твердое вещество непрерывно экстрагировалось этилацетатом и фильтрат экстрагировался этилацетатом. Экстракты высушивались над безводным сульфатом магния и выпаривались, чтобы получить этил-3-амино-4-бензидтиобензоат /6.11 г/ в виде масла, ЯМР /CDCL3/ 3.93 /3H, с/, 7.70 /1H, д/, 7.91 /1H, д/. Ссылочный пример 14 Раствор Этил-3-амино-4-бензилтиобензоата /6.11 г/ в этаноле /20 мл/ добавлялся к энергично перемешанному раствору нитрита натрия /3.23 г/ и 48% бромистоводородной кислоте /21 мл/ в воде /2500 мл/, охлажденной до 0oC. Смесь оставлялась согреваться до комнатной температуре всю ночь и делалась основной твердым карбонатом натрия /12 г/. Красный осадок фильтровался, растворялся в этилацетате, высушивался над безводным сульфатом магния и выпаривался, чтобы получить этил бензо-1,2,3-тиадиазол-5-карбоксилат /2.97 г/ в виде красного кристаллического вещества, т.пл. 74.5 - 77oC. Ссылочный пример 15 Этил-4-бензилтио-3-нетробензоат /10.16 г/ суспендировался в этаноле и перемешивался. Добавлялась концентрированная хлористоводородная кислота /60 мл/ с последующим добавлением порциями железного порошка /12.51 г/. Смесь моленно согревалась до 60 - 70oC и перемешивалась всю ночь. После охлаждения смесь выливалась на лед, нейтрализовалась твердым бикарбонатом натрия и фильтровалась. Твердое вещество непрерывно экстрагировалось этилацетатом и фильтрат экстрагировался этилацетатом. Экстракты высушивались над безводным сульфатом магния и выпаривались, чтобы получить этил-3-амино-4-бензидтиобензоат /6.11 г/ в виде масла, ЯМР /CDCL3/ 1.37 /3H, т/, 3.97 /2H, с/, 4.33 /2H, кв/, 7.1 - 7.4 /8Н/. Ссылочный пример 16 Этил-4-бензилтио-3-нетробензоат /10 г/ и бензил меркаптан /5.41 г/ растворялись в N, N - диметилформамиде и при перемешивании добавлялся моногидрат гидроксида лития /1.83 г/. Смесь перемешивалась всю ночь, затем выливалась в эфир и 2N хлористводородной кислоты. Органическая фаза промывалась водой, высушивалась над безводным сульфатом магния и выпаривалась, чтобы получить этил 4-бензилтио-3-нитробензоат /10.16 г/; в виде масла, ЯМР /CDCL3/ 1.37 /3H, т/, 3.97 /2H, с/, 4.33 /2H, кв/, 7.1 - 7.4 /8Н/. Ссылочный пример 16 Этил-4-бензилтио-3-нетробензоат /10 г/ и бензил меркаптан /5.41 г/ растворялись в N, N - диметилформамиде и при перемешивании добавлялся моногидрат гидроксида лития /1.83 г/. Смесь перемешивалась всю ночь, затем выливалась в эфир и 2N хлористводородной кислоты. Органическая фаза промывалась водой, высушивалась над безводным сульфатом магния и выпаривалась, чтобы получить этил 4-бензилтио-3-нитробензоат /10.16 г/; в виде масла, ЯМР /CDCL3/ 1.41 /3H, т/, 4.24 /2H, с/, и 4.40 /2H, кв/, 7.3 - 7.47 /5H/, 7.53 /1H, д/, 8.14 /1H, дд/, 8.86 /1H, кв/. Ссылочный пример 17 Перемешанная суспензия 4-фторо-1,3-бензоксазол-2-он-7-карбоновой кислоты /1.79 г/ в сухом дихлорметане обрабатывалась оксалил хлоридом /0.97 г/ с последующим добавлением N, N - диметилформамида /3 капли/, чтобы инициировать реакцию. Перемешивание продолжалось в условиях флегмации 1.5 часа и смесь выпаривалась до сухости, чтобы получить 4-фторо-1,3-бензоксазол-2-он-7-хлорид карбоновой кислоты, используемый на следующем этапе без очистки. Аналогичным образом были получены следующие соединения: 2-т-бутил-4-хлоробензоксазол-7-хлорид- карбоновой кислоты в виде оранжевого вещества, используемый непосредственно в следующей стадии. 2,2-дифторо-4-метилсульфенил-1,3-бензодиоксол-5-хлорид- карбоновой кислоты, полученный в виде полутвердого вещества оранжевого цвета. 4-хлоро-3-метоксибензо[b]тиофен-5-хлорид- карбоновой кислоты. 2-т-бутил-4-метилсульфенилбензоксазол-7-хлорид- карбоновой кислоты. 4-хлоро-3-метокси-2-метилбензо[b] тиофен-5-хлорид- карбоновой кислоты в виде твердого вещества желтого цвета. Смесь 4-хлоро-3-этоксибензо[b]тиофен-5-хлорида карбоновой кислоты и 4-хлоро-3-метокси-2-этилбензо[b] тиофен-5-хлорид- карбоновой кислоты/, полученная от продукта ссылочного примера 18. 3-этокси-4-метилсульфенилбензо[b] тиофен-5-хлорид- карбоновой кислоты в виде коричневой жидкости. 1-/метилсульфонил/-4-хлорид карбоновой кислоты в виде твердого вещества желтого цвета. 4-метил-1,3-бензодиоксол-5-хлорид- карбоновой кислоты в виде оранжевого твердого вещества. 4-/метилсульфонилметил/-1,3-бензодиоксол-5-хлорид карбоновой кислоты в виде коричневой смолы. 2,2-дифторо-4-/метилсульфонилметил/-1,3-бензодиоксол-5-хлорид- карбоновой кислоты в виде желтого твердого вещества. 4-/метилсульфенил/-1,3-бензодиоксол-5-хлорид карбоновой кислоты в виде твердого вещества бежевого цвета. 5-/метилсульфенил/-1,4-бензодиоксан-6-хлорид карбоновой кислоты в виде оранжевого масла. 4-фторо-1,3-бензоксазол-2-он-7-карбоновая кислота описана в Synthetie Communicat, 1990, 20, 1423 D.R. Peabill и S.K. Pichardson, Ссылочный пример 18 Смесь метил 4-хлоро-3-метоксибензо[b]тиофен-5-хлорид-карбоксилата /8.35 г/ и гидрата гидроксида лития /1.37 г/ перемешивалась в метаноле /75 мл/ и воде /25 мл/ при комнатной температуре 4 дня. Метанол выпаривался в вакууме и смесь выливалась на избыток холодной разбавленной хлористоводородной кислоты. Твердое вещество фильтровалось, промывалось холодным циклогексаном и высушивалось, чтобы получить 4-хлоро-3-этоксибензо[b] тиофен-5-хлорида карбоновую кислоту /7.28 г/ в виде твердого белого вещества, ЯМР /D 6DМСО/ 1.41 /3H, т/, 4.24 /2H, с/, и 4.40 /2H, кв/, 7.3 - 7.47 /5H/, 7.53 /1H, д/, 8.14 /1H, дд/, 8.86 /1H, кв/. Ссылочный пример 17 Перемешанная суспензия 4-фторо-1,3-бензоксазол-2-он-7-карбоновой кислоты /1.79 г/ в сухом дихлорметане обрабатывалась оксалил хлоридом /0.97 г/ с последующим добавлением N, N - диметилформамида /3 капли/, чтобы инициировать реакцию. Перемешивание продолжалось в условиях флегмации 1.5 часа и смесь выпаривалась до сухости, чтобы получить 4-фторо-1,3-бензоксазол-2-он-7-хлорид карбоновой кислоты, используемый на следующем этапе без очистки. Аналогичным образом были получены следующие соединения: 2-т-бутил-4-хлоробензоксазол-7-хлорид- карбоновой кислоты в виде оранжевого вещества, используемый непосредственно в следующей стадии. 2,2-дифторо-4-метилсульфенил-1,3-бензодиоксол-5-хлорид- карбоновой кислоты, полученный в виде полутвердого вещества оранжевого цвета. 4-хлоро-3-метоксибензо[b]тиофен-5-хлорид- карбоновой кислоты. 2-т-бутил-4-метилсульфенилбензоксазол-7-хлорид- карбоновой кислоты. 4-хлоро-3-метокси-2-метилбензо[b] тиофен-5-хлорид- карбоновой кислоты в виде твердого вещества желтого цвета. Смесь 4-хлоро-3-этоксибензо[b]тиофен-5-хлорида карбоновой кислоты и 4-хлоро-3-метокси-2-этилбензо[b] тиофен-5-хлорид- карбоновой кислоты/, полученная от продукта ссылочного примера 18. 3-этокси-4-метилсульфенилбензо[b] тиофен-5-хлорид- карбоновой кислоты в виде коричневой жидкости. 1-/метилсульфонил/-4-хлорид карбоновой кислоты в виде твердого вещества желтого цвета. 4-метил-1,3-бензодиоксол-5-хлорид- карбоновой кислоты в виде оранжевого твердого вещества. 4-/метилсульфонилметил/-1,3-бензодиоксол-5-хлорид карбоновой кислоты в виде коричневой смолы. 2,2-дифторо-4-/метилсульфонилметил/-1,3-бензодиоксол-5-хлорид- карбоновой кислоты в виде желтого твердого вещества. 4-/метилсульфенил/-1,3-бензодиоксол-5-хлорид карбоновой кислоты в виде твердого вещества бежевого цвета. 5-/метилсульфенил/-1,4-бензодиоксан-6-хлорид карбоновой кислоты в виде оранжевого масла. 4-фторо-1,3-бензоксазол-2-он-7-карбоновая кислота описана в Synthetie Communicat, 1990, 20, 1423 D.R. Peabill и S.K. Pichardson, Ссылочный пример 18 Смесь метил 4-хлоро-3-метоксибензо[b]тиофен-5-хлорид-карбоксилата /8.35 г/ и гидрата гидроксида лития /1.37 г/ перемешивалась в метаноле /75 мл/ и воде /25 мл/ при комнатной температуре 4 дня. Метанол выпаривался в вакууме и смесь выливалась на избыток холодной разбавленной хлористоводородной кислоты. Твердое вещество фильтровалось, промывалось холодным циклогексаном и высушивалось, чтобы получить 4-хлоро-3-этоксибензо[b] тиофен-5-хлорида карбоновую кислоту /7.28 г/ в виде твердого белого вещества, ЯМР /D 6DМСО/ / 3.9 /3Н, с/, 7.0 /1Н, с/, 7.6 /1Н, д/, 7.95 1Н, д/, 13.3 /1Н, шир. с/. Аналогичным образом были получены следующие соединения 4-хлоро-3-метокси-2-метилбензо[b] тиофен-5-карбоновая кислота в виде бледно-желтого твердого вещества, т.пл. 185 - 192oC. Таким же образом было получено следующее соединение: 2-т-бутил-4-метилсульфенилбензоксазол-7-карбоновая кислота, т. пл. 203 - 204oC с использованием гидросида калия вместо гидрата гидроксида лития. Аналогичным образом из продукта ссылочного примера 24, смеси этил-4-хлоро-3-этоксибензо[b] тиофен-5-карбоксилата и этил 4-хлоро-3-этокси-2-этилбензотиофена, с использованием гидроксида лития в этаноле, тетрагидрофурана и воды была получена смесь 4-хлоро-3-этоксибензо[b]тиофен-5-карбоновой кислоты в виде твердого вещества белого цвета. Модифицированным способом была также получена 3-этоки-4-/метилсульфенил/бензо[b] тиофен-5-карбоновая кислота в виде коричневого твердого вещества, ЯМР /CDCL3/ / 3.9 /3Н, с/, 7.0 /1Н, с/, 7.6 /1Н, д/, 7.95 1Н, д/, 13.3 /1Н, шир. с/. Аналогичным образом были получены следующие соединения 4-хлоро-3-метокси-2-метилбензо[b] тиофен-5-карбоновая кислота в виде бледно-желтого твердого вещества, т.пл. 185 - 192oC. Таким же образом было получено следующее соединение: 2-т-бутил-4-метилсульфенилбензоксазол-7-карбоновая кислота, т. пл. 203 - 204oC с использованием гидросида калия вместо гидрата гидроксида лития. Аналогичным образом из продукта ссылочного примера 24, смеси этил-4-хлоро-3-этоксибензо[b] тиофен-5-карбоксилата и этил 4-хлоро-3-этокси-2-этилбензотиофена, с использованием гидроксида лития в этаноле, тетрагидрофурана и воды была получена смесь 4-хлоро-3-этоксибензо[b]тиофен-5-карбоновой кислоты в виде твердого вещества белого цвета. Модифицированным способом была также получена 3-этоки-4-/метилсульфенил/бензо[b] тиофен-5-карбоновая кислота в виде коричневого твердого вещества, ЯМР /CDCL3/ 1.6 /3Н, с/, 2.6 /3Н, с/, 4.2 /2Н,кв/, 6.5 /1Н, с/, 7.8 /2Н, д/, 8,2 /1Н,д/. Аналогичным образом было получено следующее соединение: 1-/метилсульфенил/индол-4-карбоновая кислота в виде твердого вещества белого цвета, т. пл. 220 - 222oC, используя гидроксид калия в промышленных метилированных спиртах вместо гидрата гидроксида лития в метаноле. С модификацией способа было также получено следующее соединение: 4-/метилсульфенил/-1,3-бензодиоксол-5- карбоновая кислота в виде оранжевой смолы, ЯМР /CDCL3/ 1.6 /3Н, с/, 2.6 /3Н, с/, 4.2 /2Н,кв/, 6.5 /1Н, с/, 7.8 /2Н, д/, 8,2 /1Н,д/. Аналогичным образом было получено следующее соединение: 1-/метилсульфенил/индол-4-карбоновая кислота в виде твердого вещества белого цвета, т. пл. 220 - 222oC, используя гидроксид калия в промышленных метилированных спиртах вместо гидрата гидроксида лития в метаноле. С модификацией способа было также получено следующее соединение: 4-/метилсульфенил/-1,3-бензодиоксол-5- карбоновая кислота в виде оранжевой смолы, ЯМР /CDCL3/ 2.7 /3Н, с/, 4.9 /2Н, с/, 6.0 /2Н, с/, 6.7 /1Н, д/, 7.6 /1Н, д/. Ссылочный пример 19 н-Бутиллитий /11.6 мл 2.5 М раствора в гексанах/ добавлялся по каплям к перемешивемому раствору 2,2-дифторо-1,3-бензодиоксол-5-карбоновой кислоты /2.8 г/ в сухом тетерагидрофуране с поддержанием при -78oC в инертной атмосфере. Послу 6 часов при -78oC по каплям добавлялся раствор диметил дисульфида /3.75 мл/ и смесь оставлялась на всю ночь до достижения комнатной температуры. Добавлялся раствор гидроксида натрия /2M/, смесь промывалась эфиром, окислялась /соляная кислота/ и осажденное твердое вещество фильтровалось. Оно промывалось гексаном и высушивалось, чтобы получить 2,2-дифторо-4-метилсульфенил-1,3-бензодиоксол-5-карбоновую кислоту /2.59 г/ в виде твердого вещества кремового цвета. Чистый образец был получен в виде бесцветных кристаллов, т.пл. 190 - 192oC рекристаллизацией из толуол/циклогексана. Таким же образом были получены следующие соединения: 4-/метилсульфенил/-1,3-бензодиоксол-5-карбоновая кислота в виде вещества кремового цвета, т.пл. 196 - 198oC. 5-/метилсульфенил/-1,4-бензодиоксан-6-карбоновая кислота в виде кремового вещества, т.пл. 122 - 124oC. 1.4-бензодиоксан-6-карбоновая кислота, как описано в G.Coudert и др. Tetrahedron Letters, 1978, 1059. Ссылочный пример 20 н-Бутиллитий /101.6 мл 2.5М раствора в гексане/ добавлялся в течение 30 минут к перемешанному раствору 2,5-дихлоро-1-/тиметилацетиламино/бензолу /25.0 г/ в сухом тетрагидрофуране при -40oC и раствор перемешивался при -20oC 1.5 часа и выливался на твердую двуокись углерода в сухом тетрагидрофуране. Смесь достигала комнатной температуры, добавлялся раствор гидроксида натрия 2М и экстрагировалась этилацетатом. Водный раствор окислялся /концентрированная соляная кислота/ и осажденное твердое вещество собиралось и высушивалось, чтобы получить 2-т-бутил-4-хлоробензоксазол-7-карбоновую кислоту /11.7 г/, т.пл. 209 - 210oC. Ссылочный пример 21 К перемешанной смеси 2,5-дихлоранилина /15.0 г/, триэтиламина /сухого 14.1 мл/ и 4-диметиламинопиридина /0.45 г/ в сухом дихлорметане /100 мл/ был добавлен раствор ди-т-бутилдикарбоната /22.2 г/ в сухом дихлорметане. Смесь перемешивалась в азоте 18 часов и гасилась добавлением насыщенного раствора хлорида аммония и экстрагировалась дихлорметаном. Экстракт высушивался /сульфат магния/, выпаривался и очищался хроматографией на силикагеле с элюированием циклогексаном, чтобы получить 2,5-дихлоро-1-/триметилацетиламино/бензол/12.2 г/ в виде кремового вещества, используемого на следующем этапе без дальнейшей очистки. Ссылочный пример 22 Смесь метил-2-т-бутил-4-хлоро-1,3-бензоксазол-7-карбоксилата /5.7 г/ и тиометоксида натрия /1.64 г/ перемешивалась при нагревании с обратным холодильником 48 часов в сухом тетрагидрофуране. Добавлялась вода и смесь экстрагировалась /эфир/, высушивалась /безводный сульфат магния/ и выпаривалась. Очистка хроматографией на силикагеле дала метил 2-т-бутил-4-метилсульфенил-1,3-бензоксазол-7-карбоксилат в виде кремового вещества, ЯМР /CDCL3/ 2.7 /3Н, с/, 4.9 /2Н, с/, 6.0 /2Н, с/, 6.7 /1Н, д/, 7.6 /1Н, д/. Ссылочный пример 19 н-Бутиллитий /11.6 мл 2.5 М раствора в гексанах/ добавлялся по каплям к перемешивемому раствору 2,2-дифторо-1,3-бензодиоксол-5-карбоновой кислоты /2.8 г/ в сухом тетерагидрофуране с поддержанием при -78oC в инертной атмосфере. Послу 6 часов при -78oC по каплям добавлялся раствор диметил дисульфида /3.75 мл/ и смесь оставлялась на всю ночь до достижения комнатной температуры. Добавлялся раствор гидроксида натрия /2M/, смесь промывалась эфиром, окислялась /соляная кислота/ и осажденное твердое вещество фильтровалось. Оно промывалось гексаном и высушивалось, чтобы получить 2,2-дифторо-4-метилсульфенил-1,3-бензодиоксол-5-карбоновую кислоту /2.59 г/ в виде твердого вещества кремового цвета. Чистый образец был получен в виде бесцветных кристаллов, т.пл. 190 - 192oC рекристаллизацией из толуол/циклогексана. Таким же образом были получены следующие соединения: 4-/метилсульфенил/-1,3-бензодиоксол-5-карбоновая кислота в виде вещества кремового цвета, т.пл. 196 - 198oC. 5-/метилсульфенил/-1,4-бензодиоксан-6-карбоновая кислота в виде кремового вещества, т.пл. 122 - 124oC. 1.4-бензодиоксан-6-карбоновая кислота, как описано в G.Coudert и др. Tetrahedron Letters, 1978, 1059. Ссылочный пример 20 н-Бутиллитий /101.6 мл 2.5М раствора в гексане/ добавлялся в течение 30 минут к перемешанному раствору 2,5-дихлоро-1-/тиметилацетиламино/бензолу /25.0 г/ в сухом тетрагидрофуране при -40oC и раствор перемешивался при -20oC 1.5 часа и выливался на твердую двуокись углерода в сухом тетрагидрофуране. Смесь достигала комнатной температуры, добавлялся раствор гидроксида натрия 2М и экстрагировалась этилацетатом. Водный раствор окислялся /концентрированная соляная кислота/ и осажденное твердое вещество собиралось и высушивалось, чтобы получить 2-т-бутил-4-хлоробензоксазол-7-карбоновую кислоту /11.7 г/, т.пл. 209 - 210oC. Ссылочный пример 21 К перемешанной смеси 2,5-дихлоранилина /15.0 г/, триэтиламина /сухого 14.1 мл/ и 4-диметиламинопиридина /0.45 г/ в сухом дихлорметане /100 мл/ был добавлен раствор ди-т-бутилдикарбоната /22.2 г/ в сухом дихлорметане. Смесь перемешивалась в азоте 18 часов и гасилась добавлением насыщенного раствора хлорида аммония и экстрагировалась дихлорметаном. Экстракт высушивался /сульфат магния/, выпаривался и очищался хроматографией на силикагеле с элюированием циклогексаном, чтобы получить 2,5-дихлоро-1-/триметилацетиламино/бензол/12.2 г/ в виде кремового вещества, используемого на следующем этапе без дальнейшей очистки. Ссылочный пример 22 Смесь метил-2-т-бутил-4-хлоро-1,3-бензоксазол-7-карбоксилата /5.7 г/ и тиометоксида натрия /1.64 г/ перемешивалась при нагревании с обратным холодильником 48 часов в сухом тетрагидрофуране. Добавлялась вода и смесь экстрагировалась /эфир/, высушивалась /безводный сульфат магния/ и выпаривалась. Очистка хроматографией на силикагеле дала метил 2-т-бутил-4-метилсульфенил-1,3-бензоксазол-7-карбоксилат в виде кремового вещества, ЯМР /CDCL3/ 1.53 /9Н, с/, 2.64 /3Н, с/, 3.98 /3Н, с/, 7.09 /1Н, д/, 7.85 /1Н, д/. Таким же способом было получено следующее соединение: Этил-3-этокси-4-метилсульфенилбензо[b]тиофен-5-карбоксилат в виде желтой смолы, ЯМР /CDCL3/ 1.53 /9Н, с/, 2.64 /3Н, с/, 3.98 /3Н, с/, 7.09 /1Н, д/, 7.85 /1Н, д/. Таким же способом было получено следующее соединение: Этил-3-этокси-4-метилсульфенилбензо[b]тиофен-5-карбоксилат в виде желтой смолы, ЯМР /CDCL3/ 1.4 /3Н, т/, 1.6 /3Н, т/, 2.5 /3Н, с/, 4.2 /2Н, кв/, 4.4 /2Н, кв/, 6.5 /1Н, с/, 7.4 /1Н, д/, 7.7 /1Н, д/. Аналогичным образом в реакции при комнатной температуре были получены следующие соединения: Метил-4-/метансульфенилметил/-1,3-бензодиоксол-5-карбоксилат в виде желтого масла, ЯМР /CDCL3/ 1.4 /3Н, т/, 1.6 /3Н, т/, 2.5 /3Н, с/, 4.2 /2Н, кв/, 4.4 /2Н, кв/, 6.5 /1Н, с/, 7.4 /1Н, д/, 7.7 /1Н, д/. Аналогичным образом в реакции при комнатной температуре были получены следующие соединения: Метил-4-/метансульфенилметил/-1,3-бензодиоксол-5-карбоксилат в виде желтого масла, ЯМР /CDCL3/ 2.1 /3Н, с/, 3.9 /3Н, с/, 4.1 /2Н, с/, 6.7 /1Н, д/, 7.6 /1Н, д/. Метил-2,2-дифторо-4-/метансульфенилметил/-1,3-бензодиоксол-5-карбоксилат в виде твердого вещества желтого цвета. т.пл. 64 - 66oC. Ссылочный пример 23 Оксалил хлорид по каплям добавлялся /2.6 мл/ к перемещенной суспензии 2-т-бутил-4-хлоро-1,3-бензоксазол-7-карбоновой кислоте /6.2 г/. Добавлялся сухой N, N -диметилформамид /3 капли/ смесь перемешивалась при нагревании с обратным холодильником 2 часа и выпаривалась. Добавлялся дихлорметан и раствор по каплям добавлялся к перемешанному раствору метанола /сухому, 3.0 мл/ и триэтиламина /сухому, 10мл/ в дихлорметане при 0oC. После перемешивания при окружающей температуре 18 часов смесь промывалась водой соляной кислоты /2М/, карбонатом натрия /2М/, затем высушивалась /сульфат магния/ и выпаривалась, чтобы получить метил-2-т-бутил-4-хлоро-1,3-белнзоксазол-7-карбоксилат /5,7 г/ в виде твердого вещества светло-коричневого цвета. т.пл. 130 - 131oC. Аналогичным образом были получены следующие соединения: Метил-4-метил-1,3-бензодиоксол-5-карбоксилат, изолированное как смесь 4 : 1 с метил 1,3-бензодиоксол-5-карбоксилатом/ в виде оранжевой смолы. Метил 2,2-дифторо-4-метил-1,3-бензодиоксол-5-карбоксилат в виде оранжевого вещества, т.пл. 39 - 41oC. Ссылочный пример 24 Смесь 4-хлоро-3-гидроксибензо[b] тиофен-5-карбоновой кислоты /45.2 г/, карбоната цезия /135.4 г/, этил йодида /247 г/ и тетра-н-бутиламмоний йодида /3.65 г/ нагревалась в ацетонитриле с обратным холодильником 18 часов. Растворитель выпаривался и остаток разделялся между ацетатом и водой. Органическая фаза промывалась водой еще три раза, высушивалась над безводным сульфатом магния и выпаривалась в вакууме. Остаток очищался колонной хроматографией с элюированием этилацетатом/ петролейным эфиром, т.к. 60 - 80oC с получением приблизительно 5 : 1 смеси 4-хлоро-3-этокси-2-этилбензо[b]тиофена в виде твердого вещества желтого цвета /23.04 г/. Ссылочный пример 25 Гидрид натрия /1.1 г 80% дисперсии в минеральном масле/, метил 1Н-индол-4-карбоксилат /5.46 г/ и безводный ацетонитрил смешивались в инертной атмосфере при 0oC и перемешивались при комнатной температуре в течение часа. Метансульфонил хлорид /1.8 г/ был добавлен при 0oC и смесь перемешивалась при комнатной температуре 18 часов. Затем доавлялись метанол и вода и смесь экстрагировалась дихлорметаном. Органическая фаза промывалась 2N соляной кислотой, водой, 1Мм карбоната натрия и водой, высушивалась над безводным сульфатом магния и выпаривалась в вакууме. Остаток очищался колонной хроматографией с элюированием этилацетатом/гексаном с получением метил 1-/метилсульфонил/индол-4-карбоксилата /4.7 г/ в виде белого вещества, т.пл. 102 - 104oC. Метил 1Н-индол-4-карбоксилат описан в А.Р. Коzikowsky и др. Journ of Organie Chew 1980, 45, 3350. Ссылочный пример 26 Раствор н-бутиллития /5.1 мл 2.5 М раствора в гексанах/ добавлялся к перемешанной суспензии 1,3-бензодиоксол-5-карбоновой кислоте /1.0 г/ в безводном тетрагидрофуране в инертной атмосфере с поддержанием температуры ниже -60oC. Затем смесь перемешивалась при -78oC 7часов и добавлялся метил йодид /0.50 г/ и смесь перемешивалась при комнатной температуре 18 часов. Затем смесь обрабатывалась водой и 2N гидроксида натрия. Водная фаза промывалась эфиром, окислялась и фильтровалась. Твердое вещество промывалось гексаном и высушивалось, чтобы получить 4-метил-1,3-бензодиоксол-5-карбоновую кислоту в виде вещества кремового цвета /0.91 г/, т.пл. 217 - 219oC. Аналогичным образом было получено и следующее соединение: /из 2,2-дифторо-1,3-бензодиоксол-5-карбоновой кислоты, которое описано в патенте США 4895871/ 2,2-дифторо-4-метил-1,3-бензодиоксол-5-карбоновая кислота в виде твердого вещества бежевого цвета, т.пл. 180 - 182oC. Ссылочный пример 27 Смесь метил 4-метил-1,3-бензодиоксол-5-карбоксилата /9.9 г/, N - бромосукцинида /9.6 г/ в тетрахлорметане облучалась ультрафиолетовой лампой со средним давлением в 500 ватт в течение 6 часов при флегмации. Смесь охлаждалась до 0oC, фильтровалась и фильтрат выпаривался, чтобы получить масло, которое кристаллизовалось из толуола/гексана и рекристаллизовалось из циклогексана, чтобы дать метил 4-бромометил-1,3-бензодиоксол-5-карбоксилат /3.0 г/ в виде бежевого твердого вещества. т.пл. 95 - 98 oC. Аналогичным образом было получено следующее соединение: Метил 4-бромометил-2,2-дифторо-1,3-бензодиоксол-5-карбоксилат в виде твердого вещества желтого цвета, т.пл. 56 - 58oC. Ссылочный пример 28 Смесь метил 4-/метансульфенилметил/-1,3-бензодиоксол-5-карбоксилата /1.6 г/, м-хлоропербензойной кислоты /55%, 4.6 г/ и дихлорметана перемешивалась 24 часа и затем промывалась 10% раствором метабисульфита натрия, насыщалась бикарбонатом натрия и водой, высушивалась над безводным сульфатом магния и выпаривалась для получения метил 4-/метилсульфонилметил/-1,3-бензодиоксол-5-карбоксилата в виде желтой смолы /1.5 г/, ЯМР /CDCL3/ 2.1 /3Н, с/, 3.9 /3Н, с/, 4.1 /2Н, с/, 6.7 /1Н, д/, 7.6 /1Н, д/. Метил-2,2-дифторо-4-/метансульфенилметил/-1,3-бензодиоксол-5-карбоксилат в виде твердого вещества желтого цвета. т.пл. 64 - 66oC. Ссылочный пример 23 Оксалил хлорид по каплям добавлялся /2.6 мл/ к перемещенной суспензии 2-т-бутил-4-хлоро-1,3-бензоксазол-7-карбоновой кислоте /6.2 г/. Добавлялся сухой N, N -диметилформамид /3 капли/ смесь перемешивалась при нагревании с обратным холодильником 2 часа и выпаривалась. Добавлялся дихлорметан и раствор по каплям добавлялся к перемешанному раствору метанола /сухому, 3.0 мл/ и триэтиламина /сухому, 10мл/ в дихлорметане при 0oC. После перемешивания при окружающей температуре 18 часов смесь промывалась водой соляной кислоты /2М/, карбонатом натрия /2М/, затем высушивалась /сульфат магния/ и выпаривалась, чтобы получить метил-2-т-бутил-4-хлоро-1,3-белнзоксазол-7-карбоксилат /5,7 г/ в виде твердого вещества светло-коричневого цвета. т.пл. 130 - 131oC. Аналогичным образом были получены следующие соединения: Метил-4-метил-1,3-бензодиоксол-5-карбоксилат, изолированное как смесь 4 : 1 с метил 1,3-бензодиоксол-5-карбоксилатом/ в виде оранжевой смолы. Метил 2,2-дифторо-4-метил-1,3-бензодиоксол-5-карбоксилат в виде оранжевого вещества, т.пл. 39 - 41oC. Ссылочный пример 24 Смесь 4-хлоро-3-гидроксибензо[b] тиофен-5-карбоновой кислоты /45.2 г/, карбоната цезия /135.4 г/, этил йодида /247 г/ и тетра-н-бутиламмоний йодида /3.65 г/ нагревалась в ацетонитриле с обратным холодильником 18 часов. Растворитель выпаривался и остаток разделялся между ацетатом и водой. Органическая фаза промывалась водой еще три раза, высушивалась над безводным сульфатом магния и выпаривалась в вакууме. Остаток очищался колонной хроматографией с элюированием этилацетатом/ петролейным эфиром, т.к. 60 - 80oC с получением приблизительно 5 : 1 смеси 4-хлоро-3-этокси-2-этилбензо[b]тиофена в виде твердого вещества желтого цвета /23.04 г/. Ссылочный пример 25 Гидрид натрия /1.1 г 80% дисперсии в минеральном масле/, метил 1Н-индол-4-карбоксилат /5.46 г/ и безводный ацетонитрил смешивались в инертной атмосфере при 0oC и перемешивались при комнатной температуре в течение часа. Метансульфонил хлорид /1.8 г/ был добавлен при 0oC и смесь перемешивалась при комнатной температуре 18 часов. Затем доавлялись метанол и вода и смесь экстрагировалась дихлорметаном. Органическая фаза промывалась 2N соляной кислотой, водой, 1Мм карбоната натрия и водой, высушивалась над безводным сульфатом магния и выпаривалась в вакууме. Остаток очищался колонной хроматографией с элюированием этилацетатом/гексаном с получением метил 1-/метилсульфонил/индол-4-карбоксилата /4.7 г/ в виде белого вещества, т.пл. 102 - 104oC. Метил 1Н-индол-4-карбоксилат описан в А.Р. Коzikowsky и др. Journ of Organie Chew 1980, 45, 3350. Ссылочный пример 26 Раствор н-бутиллития /5.1 мл 2.5 М раствора в гексанах/ добавлялся к перемешанной суспензии 1,3-бензодиоксол-5-карбоновой кислоте /1.0 г/ в безводном тетрагидрофуране в инертной атмосфере с поддержанием температуры ниже -60oC. Затем смесь перемешивалась при -78oC 7часов и добавлялся метил йодид /0.50 г/ и смесь перемешивалась при комнатной температуре 18 часов. Затем смесь обрабатывалась водой и 2N гидроксида натрия. Водная фаза промывалась эфиром, окислялась и фильтровалась. Твердое вещество промывалось гексаном и высушивалось, чтобы получить 4-метил-1,3-бензодиоксол-5-карбоновую кислоту в виде вещества кремового цвета /0.91 г/, т.пл. 217 - 219oC. Аналогичным образом было получено и следующее соединение: /из 2,2-дифторо-1,3-бензодиоксол-5-карбоновой кислоты, которое описано в патенте США 4895871/ 2,2-дифторо-4-метил-1,3-бензодиоксол-5-карбоновая кислота в виде твердого вещества бежевого цвета, т.пл. 180 - 182oC. Ссылочный пример 27 Смесь метил 4-метил-1,3-бензодиоксол-5-карбоксилата /9.9 г/, N - бромосукцинида /9.6 г/ в тетрахлорметане облучалась ультрафиолетовой лампой со средним давлением в 500 ватт в течение 6 часов при флегмации. Смесь охлаждалась до 0oC, фильтровалась и фильтрат выпаривался, чтобы получить масло, которое кристаллизовалось из толуола/гексана и рекристаллизовалось из циклогексана, чтобы дать метил 4-бромометил-1,3-бензодиоксол-5-карбоксилат /3.0 г/ в виде бежевого твердого вещества. т.пл. 95 - 98 oC. Аналогичным образом было получено следующее соединение: Метил 4-бромометил-2,2-дифторо-1,3-бензодиоксол-5-карбоксилат в виде твердого вещества желтого цвета, т.пл. 56 - 58oC. Ссылочный пример 28 Смесь метил 4-/метансульфенилметил/-1,3-бензодиоксол-5-карбоксилата /1.6 г/, м-хлоропербензойной кислоты /55%, 4.6 г/ и дихлорметана перемешивалась 24 часа и затем промывалась 10% раствором метабисульфита натрия, насыщалась бикарбонатом натрия и водой, высушивалась над безводным сульфатом магния и выпаривалась для получения метил 4-/метилсульфонилметил/-1,3-бензодиоксол-5-карбоксилата в виде желтой смолы /1.5 г/, ЯМР /CDCL3/ 2.8 /3Н, с/, 3.8 /3Н, с/, 4.9 /2Н, с/, 6.1 /2Н, с/, 6.8 /1Н, д/, 7.6 /1Н, д/. Ссылочный пример 29 Смесь метил 2,2-дифторо-4-/метансульфенилметил/-1,3-бензо- и циклопропил метил кетона /2.5 г/ в безводном тетрагидрофуране медленно добавлялась к флегмирующей суспензии гидрида натрия /0.98 г 80% дисперсии в минеральном масле/ в тетрагидрофуране в инертной атмосфере. После двух часов при температуре флегмации реакционная смесь охлаждалась и добавлялся метанол /15 мл/. Затем смесь добавлялась к насыщенному бикарбонату натрия и неорганическая фаза промывалась дихлорметаном и окислялась до рН 1 концентрированной соляной кислотой. Полученный осадок высушивался в вакууме для получения 2,2-дифторо-4-/метилсульфонилметил/-1,3-бензодиоксол-5-карбоновой кислоты /3.3 г/ в виде желтого вещества, т.пл. 107 - 109oC. Ссылочный пример 30 35% перекись водорода /3.1 мл/ медленно добавлялась к перемешанному раствору 2,2-дифторо-4-/метилсульфонилметил/-1,3-бензодиоксол-5-карбоновой кислоты /3.3 г/ в ледяной уксусной кислоте при 0oC. Затем смесь перемешивалась при 50oC 18 часов, охлаждалась и разбавлялась водой, с собиранием осадка фильтрацией. Высушивание в вакууме дало 2,2-дифторо-4-/метилсульфонилметил/-1,3-бензодиоксол-5-карбоновую кислоту /2.2 г/ в виде кремового вещества, т.пл. 185 - 186oC. В соответствии с одним из признаков настоящего изобретения предлагается способ борьбы с ростом сорняков /т.е. нежелательной растительности/ в очаге, который включает применение к очагу гербицидно эффективного количества по меньшей мере одного производного изоксазола формулы 1 или его сельскохозяйственно приемлемой соли. Для этой цели производные изоксазола обычно используются в форме гербицидных композиций /т.е. вместе с совместимыми разбавителями или носителями и/или поверхностно-активными /ПАВ/ для использования в гербицидных композициях/, например, как описано ниже. Соединения формулы 1 демонстрируют гербицидную активность против двудольный /т. е. широколистных/ и однодольных /например, травы/ сорняков применением до- и после появления всходов. Под термином "до появления всходов" подразумевается применение в почву, в которой семена или ростки сорняков находятся о появления над поверхность почвы. Под термином "после появления всходов" подразумевается применение к отрытым частям сорняков, которые появились над поверхностью почвы. Например, соединения формулы I можно использовать для борьбы с ростом: широколистных сорняков, например, Abutilon theophrasti, Amaraufhus refroflexus, Bidens pilosa, Chenopodium album, Galium aparine, Jpomoca, напр. Jpomoca purpurea, Sesbama exaltafa, Sinapis arvensis, Solanum nigrum n Xanthium Sfrumarium и травянистых сорняков, например. Alopecurus myosuroides, Avena fatua, Digitaria sanguinalis, Echinjchloa crus-galli, Eleusine indica и Setaria. spp, например, Setariafaberii или Setaria viridis и осок, например, Cyperus esculenfus. Количество прменяемых соединений формулы I будет зависеть от характера сорняков, используемых композиций, времени применения, климатических и почвенных условий и/при использовании в борье с ростом сорняков на полях/ от вида культур. При применении на полях доизоровка применения должна быть достаточной, чтобы контролировать рост сорняков без нанесения постоянного ущерба культуре. В общем, учитывая эти факторы, хорошие результаты дает дозировка между 0.01 кг и 5 кг активного материала на гектар. Однако следует понимать, что можно использовать более высокие или низкие концентрации в зависимости от конкретного случая. Соединения формулы I можно использовать для борьбы селективной например, борьбы с ростом тех видов, которые упоминались ранее, применением до или после всхожести прямым или непрямым путем; например, прямым или непрямым орошением очага заражения, который является площадью используемой или предполвагаемой для использования для выращивания культур, например, зрновых, пшеницы, овса, ячменя, кукурузы и риса, соевых бобов, полевых и карликовых бобов, гороха, люцерны, хлопка, льна, лука, моркови, капусты, рапса, подсолнечники, сахарной свеклы и постоянных или засеянных пастбищ до или после засевания культуры до или после появления урожая. Для селективного контроля сорняков в очаге заражения сорняками в полях для выращивания культур, например, тех, которые упомянуты выше, обычно приемлемы дозировки применения между 0.01 кг и 4.0 кг, предпочтительно между 0.01 кг и 2.0 кг активного материала на гектар. Соединения формулы I можно также использовать для борьбы с сорняками до или после появления всходов в рощах и других местах роста деревьев, например, лесах, парках и плантациях, например сахарных плантациях, пальмовых и каучуковых плантациях. Для этой цели и можно применять прямым или непрямым путем к сорняка или почве, в которой они находятся до или после засадки деревьев или плантаций с дозировкой между 0.25 кг и 5.0 кг, и предпочтительно между 0.5 кг и 4.0 кг активного материала на гектар. Соединения формулы I можно использовать для борьбы с сорняками, указанными выше в очагах, не являющихся полями для выращивания культур, но там, где необходим контроль за ростом сорняков. Примерами таких очагов являются аэродромы, промышленные зоны, железные дороги, обочины дорог, склоны рек, ирригационных и других водных сооружений, кустарники, пустые или некультивированные земли, в частности, где желателен контроль над сорняками, чтобы снизить риск пожаров. Для таких целей, когда необходим полный гербицидный эффект, активные соединения используются с дозировкой выше, чем для полей с культурами. Точная дозировка будет зависеть от характера растительности и желаемого эффекта. Для этой цели применение до- или после появления всходов прямым или непрямым способом, а лучше до появления всходов требует дозировки между 1.0 кг и 20.0 кг, лучше 5.0 и 10.0 кг активного материала не гектар. При использовании для борьбы с ростом сорняков до появления всхожести соединения формулы I можно вводить в почву. При использовании соединений формулы I в борьбе с ростом сорняков после появления всхожести, т.е. применением к открытым частям сорняков, соединения формулы I обычно входят в контакт с почвой и затем могут контролировать сорняки, появляющиеся позднее. Если требуется более длительный контроль, применение соединений формулы I можно повторить при желании. В соответствии с другим признаком изобретения предлагаются композиции для гербицидного использования, включающие одно или несколько производных изоксазола формулы I или их сельскохозяйственно-приемлемую соль, вместе с-, а лучше диспергированных однородно в одном или нескольких совместимых сельскохозяйственно приемлемых разбавителях ил носителях и/или ПАВ /т.е. разбавителях или носителях и/или носителях и/или ПАВ типа, обычно используемого в данной области для гербицидных композиций, и которые совместимы с соединениями формулы I/. Термин "однородно диспергированный" включает композиции, в которых соединения формулы I растворены в других компонентах. Термин "гербицидные композиции" используется в широком смысле, и включает не только композиции, которые готовы для использования в качестве гербицидов, а также концентратов, которые должны разбавляться перед использованием. Предпочтительно, композиции содержат от 0.05 до 90% по весу одного или нескольких соединений формулы I. Гербицидные композиции могут содержать как разбавитель или носитель, так и ПАВ /например, смачивающий, диспергирующий или эмульгирующий/. Поверхностно-активные агенты, которые могут присутствовать в гербицидных композициях настоящего изобретения могут быть ионного или неионного типа, например, сульфорицинолеаты, производные четвертичного аммония, продукты, основанные на конденсатах этиленоксида с алкиловыми или полиариловыми фенолами, например, нонил- или октил-фенолы, или эфира карбоновой кислоты ангидросорбитолов, которые делаются растворимыми этерификацией свободных гидроксильных групп конденсацией этиленоксида, солей щелочных и щелочноземельных металлов производных сульфокислоты с высокой молекулярной массой, таких как лигносульфонаты натрия и кальция и алкилбензолсульфонаты натрия и кальция. Гербицидные композиции по изобретению могут включать до 10 вес% например, от 0.05 до 10 вес% ПАВ, но при желании допустимы и более высокие пропорции ПАВ, например, до 15 вес% в жидких эмульсионных суспензионных концентратах и до 25 вес% в жидких водных растворимых концентратах. Примерами подходящих твердых разбавителей или носителей являются силикат алюминия, тальк, кальцинированная магнезия, кизелькур, трикальцийфосфат, измельченная пробка, адсорбентная газовая сажа и глины, такие, как каолин и бентонит, Твердые композиции /которые могут принимать форму дустов, гранул или смачиваемых порошков/ готовятся размолом соединений формулы I с твердыми разбавителями или насыщением твердых разбавителей или носителей растворами соединений формулы I в летучих растворителях и, при желании измельчением продуктов до порошков. Гранулированные формы можно готовить абсорбированием соединением формулы I /растворенных в подходящих растворителях, которые при желании могут быть летучими/ на твердые разбавители или носители в гранулированной форме, и при желании выпариванием растворителей или гранулированием композиций в порошке, полученном, как описано выше. Твердые гербицидные соединения, в частности, смачиваемые порошки и гранулы, могут содержать смачивающие или диспергирующие агенты /например, типов, описанных выше/, которые в твердом состоянии могут служить разбавителями или носителями. Жидкие композиции по изобретению могут принимать форму водных органических или водно-органических растворов, суспензий и эмульсий которые могут включать ПАВ. Подходящие жидкие разбавители для включения в жидкие композиции включают воду, гликоли, тетрагидрофурфуриловый спирт, ацетофенон, циклогексанон, изофорон, толуол, ксилен, минеральные, животные и растительные масла и легкие ароматические и нафтеновые фракции нефти /и смеси этих разбавителей/. ПАВ, которые могут присутствовать в жидкой композиции, могут быть ионными или неионными /например, типов, описанных выше/ и жидком состоянии могут служить разбавителями или носителями. Порошки, диспергируемые гранулы и жидкие композиции в форме концентратов могут разбавляться водой или другими подходящими разбавителями, например, минеральными или растительным маслами, особенно в случае жидких концентратов, в которых разбавитель или носитель является маслом, чтобы получить композиции готовые для использования. При желании жидкие композиции соединения формулы I можно использовать в форме само-эмульгирующихся концентратов, содержащих активные вещества, растворенные в эмульгирующих агентах или растворителях, содержащих эмульгирующие агенты, совместимые с активными веществами, простое добавление воды к таким концентратам делает композиции готовыми для использования. Жидкие концентраты, в которых разбавитель или носитель является маслом, могут использоваться без дальнейшего разбавления с применением техники электростатического распыления. Гербицидные композиции по изобретению могут также содержать традиционные адъюванты, такие как клеи, защитные коллоиды, загустители, смачивающие агенты, стабилизаторы, пассиваторы, антиспекающие агенты, красители и ингибиторы коррозии. Эти адъюванты могут также служить носителями или разбавителями. Если не указаны иначе, процентные показатели даются по весу. Предпочтительными гербицидными композициями по изобретению являются: водные суспензионные концентраты, которые включают от 10 до 70% одного или нескольких соединений формулы I, от 2 до 10% ПАВ, от 0.1 до 5% сгустителя и от 15 до 87.9% воды; Смачиваемые порошки, которые включают от 10 до 90% одного или несколько соединений формулы I, от 2 до 10% ПАВ и от 8 до 88% твердого разбавителя или носителя; водорастворимые или вододиспергирумые порошки, которые содержат от 10 до 90% одного или нескольких соединений формулы I, от 2 до 40% карбоната натрия и от 0 до 88% твердого разбавителя: жидкие водорастворимые концентраты, которые содержат от 5 до 50%, например, 10 - 30%, одного или нескольких соединений формулы I, от 5 до 25% ПАВ и от 25 до 90%, например, 45 - 85%, водо-смешиваемого растворителя, например, диметилформамида, или смесь водо-смешиваемого от растворителя и воды; жидкие эмульсионные суспензионные концентраты, которые содержат от 10 до 70% одного или нескольких соединений формулы I, 5 до 15% ПАВ, от 0.1 до 5% сгустителя и от 10 до 84.9% органического растворителя; гранулы, которые содержат от 1 до 90%, например, 2 - 10% одного или нескольких соединений формулы I, от 0.5 до 7%, например, 0.5 - 2 ПАВ, и от 3 до 98.5%, например 88 - 97.5%, гранулярного носителя и эмульсионные концентраты, которые содержат 0.05 - 90%, и предпочтительно от 1 до 10% ПАВ и от 9.99 до 99.94%, лучше от 39 до 98.99% органического растворителя. Гербицидные композиции по настоящему изобретению могут также содержать соединения формулы I вместе в - , а лучше быть диспергированными в одном или нескольких других пестицидно активных соединениях и, при желании - одном или нескольких пестицидно приемлемых разбавителях или носителях, ПАВ и традиционных адъювантах, как описано выше. Примеры других пестицидно активных соединений, которые могут быть включены или использоваться вместе с гербицидными композициями настоящего изобретения, включают гербициды, например, чтобы увеличить диапазон контролируемых сорняков, - алахлор [2-хлоро-2.6"-диэтил-N-/метокси-метил/-ацетанилид] , атразин[2-хлоро-4-этиламино-6-изопропиламино-1,3,5-триазин] , бромоксинил[3,5-дибромо-4-гидроксибензонитрил], хлортолурон[N"-/3-хлоро-4-метилфенил/-N, N] -диметилмочевина, цианазин[2-хлоро-4-/1-циано-1-метилэтиламино/-6-этиламино-1,3,5-триазин], 2,5-D[2,4-дихлорофенокси-уксусная кислота] , дикамба[3,6-дихлоро-2-метоксибензойная кислота] , дифензокат[1,2-диметил-3,5-дифенилпиразолиевые соли], флампропметил[метил N-2-/N-бензоил-3-хлоро-4-фторанилино/-пропионат] , флюометурон [N"-/3-трифторометилфенил/-N, N -диметилмочевина], изопротурон [N"-/4-изопропилфенил/-N, N - диметилмочевина] , инсектициды, например синтетические пиретроиды, например, перметрин и циперметрин и фунгициды, например, карбаматы, например, метил N-/1-т-бутил-карбамоил-бензимидазол-2-ил/карбамат, и триазолы, например, 1-/4-хлоро-фенокси/-3,3-диметил-1-/1,2,4-триазол-1-ил/-бутан-2-он. Пестицидно активные соединения и другие биологически активные материалы, которые могут быть включены или использоваться вместе с гербицидными соединениями настоящего изобретения, например, теми, которые упомянуты выше, при желании могут применяться в форме традиционных производных, например, солей и эфиров щелочных металлов и аминов. Следующие примеры иллюстрируют гербицидные композиции в соответствии с настоящим изобретением: Пример С1 Растворимый концентрат готовится из: Активного ингредиента /соединение 1/ - 20% вес/об. Раствора гидроксида калия - 10% вес/об. Тетрагидрофурфурилового спирта /ТГФС/ - 10% вес/об. Воды - до 100 объемов перемешиванием ТГФС, активного ингредиента /соединение 1/ и 90% объема воды и медленным добавлением раствора гидроксида калия до получения стабильного рН 7 - 8 и затем доведением до объема водой. Аналогичные растворимые концентраты можно приготовить как описано выше, заменой изоксазола /соединение 1/ другими соединениями формулы I. Пример С2 Смачиваемый порошок готовится из: Активного ингредиента /соединение 1/ - 50% вес/вес Натрий додецилбензол сульфоната - 3% вес/вес Лигносульфоната натрия - 5% вес/вес Натрий формальдегид алкилнафталина сульфоната - 2% вес/вес Измельченного диоксида кремния - 3% вес/вес Фарфоровой глины - 37 % вес/вес смешиванием указанных ингредиентов вместе порошки можно приготовить как описано выше заменой изоксазола /соединение 1/ другими соединениями формулы I. Пример С3 Водорастворимый порошок готовится из: Активного ингредиента /соединение 1/ - 50% вес/вес Додецилбензолсульфоната натрия - 1 % вес/вес Измельченного диоксида кремния - 2% вес/вес Бикарбоната натрия - 47% вес/вес смешиванием указанных и градиентов и измельчением указанной смеси в молотковой мельнице. Аналогичные водорастворимые порошки можно получить как описано выше заменой изоксазола /соединение 1/ другими соединениями формулы I. Соединения формулы I, представленные здесь, использовались как гербициды в соответствии со следующими процедурами. Способ использования гербицидных соединений а/ Общие сведения Соответствующие количества соединений, используемых для обработки растений, растворялись в ацетоне для получения растворов, эквивалентных дозировкам применения до 4000 г тестуемого соединения на гектар /г/га/. Эти растворы применялись из стандартного лабораторного опрыскивателя с эквивалентом 290 литров распыления жидкости на гектар. в/ Контроль сорняков: до всходов Смена высевались в 70 мм квадратные, глубиной в 75 мм пластиковые горшочки в нестерильную землю. Количество семян на горшок было следующим: (см. табл.1) Соединения изобретения применялись к поверхности почвы, содержащей семена, как описано в /а/. Один горшочек каждой культуры и каждого сорняка был подвергнут каждой обработке, были также контрольные растения без обработки и обработанные только одним ацетоном. После обработки горшочки помещались на капиллярную подстилку в застекленную теплицу и поливались сверху. Визуальная оценка повреждения культур проводилась через 20 - 24 дня после распыления. Результаты выражались в процентном сокращении роста или повреждения культуры или сорняка в сравнении с контрольными горшочками. с/ Контроль сорняков: после всходов Сорняки и культуры высевались непосредственно в компост Джона Инна в горшочки глубиной 75 мм и размеров 70х70 мм, за исключением Amaranthus, который был перенесен на стадии ростка в горшочек за неделю до распыления. Растения выращивались в теплице. Число растений на горшок было следующим: (см. табл.2) Соединения, используемые для обработки растений поменялись к растениям, как описано в /а/. Каждой обработке подвергался один горшочек каждой культуры и вида сорняка, были контрольные растения без обработки и растения, на которые распылялся только ацетон. После обработки горшочки помещались на капиллярную подстилку в теплицу и поливались сверху раз в 24 часа и затем контролируемым поливом под землей. Визуальная оценка повреждений культур и сорняков проводилась 20 - 24 дня спустя после распыления. Результаты выражались в процентном выражении как снижение роста или повреждение культур или сорняков в сравнении с растениями в контрольных горшочках. При применении до или после всхожести при дозировке 4 кг/га или меньше, соединения 1 - 27 обеспечивали контроль по меньшей мере 90% одного или нескольких видов сорняков и демонстрировали селективность по меньшей мере в одном из видов культур. 2.8 /3Н, с/, 3.8 /3Н, с/, 4.9 /2Н, с/, 6.1 /2Н, с/, 6.8 /1Н, д/, 7.6 /1Н, д/. Ссылочный пример 29 Смесь метил 2,2-дифторо-4-/метансульфенилметил/-1,3-бензо- и циклопропил метил кетона /2.5 г/ в безводном тетрагидрофуране медленно добавлялась к флегмирующей суспензии гидрида натрия /0.98 г 80% дисперсии в минеральном масле/ в тетрагидрофуране в инертной атмосфере. После двух часов при температуре флегмации реакционная смесь охлаждалась и добавлялся метанол /15 мл/. Затем смесь добавлялась к насыщенному бикарбонату натрия и неорганическая фаза промывалась дихлорметаном и окислялась до рН 1 концентрированной соляной кислотой. Полученный осадок высушивался в вакууме для получения 2,2-дифторо-4-/метилсульфонилметил/-1,3-бензодиоксол-5-карбоновой кислоты /3.3 г/ в виде желтого вещества, т.пл. 107 - 109oC. Ссылочный пример 30 35% перекись водорода /3.1 мл/ медленно добавлялась к перемешанному раствору 2,2-дифторо-4-/метилсульфонилметил/-1,3-бензодиоксол-5-карбоновой кислоты /3.3 г/ в ледяной уксусной кислоте при 0oC. Затем смесь перемешивалась при 50oC 18 часов, охлаждалась и разбавлялась водой, с собиранием осадка фильтрацией. Высушивание в вакууме дало 2,2-дифторо-4-/метилсульфонилметил/-1,3-бензодиоксол-5-карбоновую кислоту /2.2 г/ в виде кремового вещества, т.пл. 185 - 186oC. В соответствии с одним из признаков настоящего изобретения предлагается способ борьбы с ростом сорняков /т.е. нежелательной растительности/ в очаге, который включает применение к очагу гербицидно эффективного количества по меньшей мере одного производного изоксазола формулы 1 или его сельскохозяйственно приемлемой соли. Для этой цели производные изоксазола обычно используются в форме гербицидных композиций /т.е. вместе с совместимыми разбавителями или носителями и/или поверхностно-активными /ПАВ/ для использования в гербицидных композициях/, например, как описано ниже. Соединения формулы 1 демонстрируют гербицидную активность против двудольный /т. е. широколистных/ и однодольных /например, травы/ сорняков применением до- и после появления всходов. Под термином "до появления всходов" подразумевается применение в почву, в которой семена или ростки сорняков находятся о появления над поверхность почвы. Под термином "после появления всходов" подразумевается применение к отрытым частям сорняков, которые появились над поверхностью почвы. Например, соединения формулы I можно использовать для борьбы с ростом: широколистных сорняков, например, Abutilon theophrasti, Amaraufhus refroflexus, Bidens pilosa, Chenopodium album, Galium aparine, Jpomoca, напр. Jpomoca purpurea, Sesbama exaltafa, Sinapis arvensis, Solanum nigrum n Xanthium Sfrumarium и травянистых сорняков, например. Alopecurus myosuroides, Avena fatua, Digitaria sanguinalis, Echinjchloa crus-galli, Eleusine indica и Setaria. spp, например, Setariafaberii или Setaria viridis и осок, например, Cyperus esculenfus. Количество прменяемых соединений формулы I будет зависеть от характера сорняков, используемых композиций, времени применения, климатических и почвенных условий и/при использовании в борье с ростом сорняков на полях/ от вида культур. При применении на полях доизоровка применения должна быть достаточной, чтобы контролировать рост сорняков без нанесения постоянного ущерба культуре. В общем, учитывая эти факторы, хорошие результаты дает дозировка между 0.01 кг и 5 кг активного материала на гектар. Однако следует понимать, что можно использовать более высокие или низкие концентрации в зависимости от конкретного случая. Соединения формулы I можно использовать для борьбы селективной например, борьбы с ростом тех видов, которые упоминались ранее, применением до или после всхожести прямым или непрямым путем; например, прямым или непрямым орошением очага заражения, который является площадью используемой или предполвагаемой для использования для выращивания культур, например, зрновых, пшеницы, овса, ячменя, кукурузы и риса, соевых бобов, полевых и карликовых бобов, гороха, люцерны, хлопка, льна, лука, моркови, капусты, рапса, подсолнечники, сахарной свеклы и постоянных или засеянных пастбищ до или после засевания культуры до или после появления урожая. Для селективного контроля сорняков в очаге заражения сорняками в полях для выращивания культур, например, тех, которые упомянуты выше, обычно приемлемы дозировки применения между 0.01 кг и 4.0 кг, предпочтительно между 0.01 кг и 2.0 кг активного материала на гектар. Соединения формулы I можно также использовать для борьбы с сорняками до или после появления всходов в рощах и других местах роста деревьев, например, лесах, парках и плантациях, например сахарных плантациях, пальмовых и каучуковых плантациях. Для этой цели и можно применять прямым или непрямым путем к сорняка или почве, в которой они находятся до или после засадки деревьев или плантаций с дозировкой между 0.25 кг и 5.0 кг, и предпочтительно между 0.5 кг и 4.0 кг активного материала на гектар. Соединения формулы I можно использовать для борьбы с сорняками, указанными выше в очагах, не являющихся полями для выращивания культур, но там, где необходим контроль за ростом сорняков. Примерами таких очагов являются аэродромы, промышленные зоны, железные дороги, обочины дорог, склоны рек, ирригационных и других водных сооружений, кустарники, пустые или некультивированные земли, в частности, где желателен контроль над сорняками, чтобы снизить риск пожаров. Для таких целей, когда необходим полный гербицидный эффект, активные соединения используются с дозировкой выше, чем для полей с культурами. Точная дозировка будет зависеть от характера растительности и желаемого эффекта. Для этой цели применение до- или после появления всходов прямым или непрямым способом, а лучше до появления всходов требует дозировки между 1.0 кг и 20.0 кг, лучше 5.0 и 10.0 кг активного материала не гектар. При использовании для борьбы с ростом сорняков до появления всхожести соединения формулы I можно вводить в почву. При использовании соединений формулы I в борьбе с ростом сорняков после появления всхожести, т.е. применением к открытым частям сорняков, соединения формулы I обычно входят в контакт с почвой и затем могут контролировать сорняки, появляющиеся позднее. Если требуется более длительный контроль, применение соединений формулы I можно повторить при желании. В соответствии с другим признаком изобретения предлагаются композиции для гербицидного использования, включающие одно или несколько производных изоксазола формулы I или их сельскохозяйственно-приемлемую соль, вместе с-, а лучше диспергированных однородно в одном или нескольких совместимых сельскохозяйственно приемлемых разбавителях ил носителях и/или ПАВ /т.е. разбавителях или носителях и/или носителях и/или ПАВ типа, обычно используемого в данной области для гербицидных композиций, и которые совместимы с соединениями формулы I/. Термин "однородно диспергированный" включает композиции, в которых соединения формулы I растворены в других компонентах. Термин "гербицидные композиции" используется в широком смысле, и включает не только композиции, которые готовы для использования в качестве гербицидов, а также концентратов, которые должны разбавляться перед использованием. Предпочтительно, композиции содержат от 0.05 до 90% по весу одного или нескольких соединений формулы I. Гербицидные композиции могут содержать как разбавитель или носитель, так и ПАВ /например, смачивающий, диспергирующий или эмульгирующий/. Поверхностно-активные агенты, которые могут присутствовать в гербицидных композициях настоящего изобретения могут быть ионного или неионного типа, например, сульфорицинолеаты, производные четвертичного аммония, продукты, основанные на конденсатах этиленоксида с алкиловыми или полиариловыми фенолами, например, нонил- или октил-фенолы, или эфира карбоновой кислоты ангидросорбитолов, которые делаются растворимыми этерификацией свободных гидроксильных групп конденсацией этиленоксида, солей щелочных и щелочноземельных металлов производных сульфокислоты с высокой молекулярной массой, таких как лигносульфонаты натрия и кальция и алкилбензолсульфонаты натрия и кальция. Гербицидные композиции по изобретению могут включать до 10 вес% например, от 0.05 до 10 вес% ПАВ, но при желании допустимы и более высокие пропорции ПАВ, например, до 15 вес% в жидких эмульсионных суспензионных концентратах и до 25 вес% в жидких водных растворимых концентратах. Примерами подходящих твердых разбавителей или носителей являются силикат алюминия, тальк, кальцинированная магнезия, кизелькур, трикальцийфосфат, измельченная пробка, адсорбентная газовая сажа и глины, такие, как каолин и бентонит, Твердые композиции /которые могут принимать форму дустов, гранул или смачиваемых порошков/ готовятся размолом соединений формулы I с твердыми разбавителями или насыщением твердых разбавителей или носителей растворами соединений формулы I в летучих растворителях и, при желании измельчением продуктов до порошков. Гранулированные формы можно готовить абсорбированием соединением формулы I /растворенных в подходящих растворителях, которые при желании могут быть летучими/ на твердые разбавители или носители в гранулированной форме, и при желании выпариванием растворителей или гранулированием композиций в порошке, полученном, как описано выше. Твердые гербицидные соединения, в частности, смачиваемые порошки и гранулы, могут содержать смачивающие или диспергирующие агенты /например, типов, описанных выше/, которые в твердом состоянии могут служить разбавителями или носителями. Жидкие композиции по изобретению могут принимать форму водных органических или водно-органических растворов, суспензий и эмульсий которые могут включать ПАВ. Подходящие жидкие разбавители для включения в жидкие композиции включают воду, гликоли, тетрагидрофурфуриловый спирт, ацетофенон, циклогексанон, изофорон, толуол, ксилен, минеральные, животные и растительные масла и легкие ароматические и нафтеновые фракции нефти /и смеси этих разбавителей/. ПАВ, которые могут присутствовать в жидкой композиции, могут быть ионными или неионными /например, типов, описанных выше/ и жидком состоянии могут служить разбавителями или носителями. Порошки, диспергируемые гранулы и жидкие композиции в форме концентратов могут разбавляться водой или другими подходящими разбавителями, например, минеральными или растительным маслами, особенно в случае жидких концентратов, в которых разбавитель или носитель является маслом, чтобы получить композиции готовые для использования. При желании жидкие композиции соединения формулы I можно использовать в форме само-эмульгирующихся концентратов, содержащих активные вещества, растворенные в эмульгирующих агентах или растворителях, содержащих эмульгирующие агенты, совместимые с активными веществами, простое добавление воды к таким концентратам делает композиции готовыми для использования. Жидкие концентраты, в которых разбавитель или носитель является маслом, могут использоваться без дальнейшего разбавления с применением техники электростатического распыления. Гербицидные композиции по изобретению могут также содержать традиционные адъюванты, такие как клеи, защитные коллоиды, загустители, смачивающие агенты, стабилизаторы, пассиваторы, антиспекающие агенты, красители и ингибиторы коррозии. Эти адъюванты могут также служить носителями или разбавителями. Если не указаны иначе, процентные показатели даются по весу. Предпочтительными гербицидными композициями по изобретению являются: водные суспензионные концентраты, которые включают от 10 до 70% одного или нескольких соединений формулы I, от 2 до 10% ПАВ, от 0.1 до 5% сгустителя и от 15 до 87.9% воды; Смачиваемые порошки, которые включают от 10 до 90% одного или несколько соединений формулы I, от 2 до 10% ПАВ и от 8 до 88% твердого разбавителя или носителя; водорастворимые или вододиспергирумые порошки, которые содержат от 10 до 90% одного или нескольких соединений формулы I, от 2 до 40% карбоната натрия и от 0 до 88% твердого разбавителя: жидкие водорастворимые концентраты, которые содержат от 5 до 50%, например, 10 - 30%, одного или нескольких соединений формулы I, от 5 до 25% ПАВ и от 25 до 90%, например, 45 - 85%, водо-смешиваемого растворителя, например, диметилформамида, или смесь водо-смешиваемого от растворителя и воды; жидкие эмульсионные суспензионные концентраты, которые содержат от 10 до 70% одного или нескольких соединений формулы I, 5 до 15% ПАВ, от 0.1 до 5% сгустителя и от 10 до 84.9% органического растворителя; гранулы, которые содержат от 1 до 90%, например, 2 - 10% одного или нескольких соединений формулы I, от 0.5 до 7%, например, 0.5 - 2 ПАВ, и от 3 до 98.5%, например 88 - 97.5%, гранулярного носителя и эмульсионные концентраты, которые содержат 0.05 - 90%, и предпочтительно от 1 до 10% ПАВ и от 9.99 до 99.94%, лучше от 39 до 98.99% органического растворителя. Гербицидные композиции по настоящему изобретению могут также содержать соединения формулы I вместе в - , а лучше быть диспергированными в одном или нескольких других пестицидно активных соединениях и, при желании - одном или нескольких пестицидно приемлемых разбавителях или носителях, ПАВ и традиционных адъювантах, как описано выше. Примеры других пестицидно активных соединений, которые могут быть включены или использоваться вместе с гербицидными композициями настоящего изобретения, включают гербициды, например, чтобы увеличить диапазон контролируемых сорняков, - алахлор [2-хлоро-2.6"-диэтил-N-/метокси-метил/-ацетанилид] , атразин[2-хлоро-4-этиламино-6-изопропиламино-1,3,5-триазин] , бромоксинил[3,5-дибромо-4-гидроксибензонитрил], хлортолурон[N"-/3-хлоро-4-метилфенил/-N, N] -диметилмочевина, цианазин[2-хлоро-4-/1-циано-1-метилэтиламино/-6-этиламино-1,3,5-триазин], 2,5-D[2,4-дихлорофенокси-уксусная кислота] , дикамба[3,6-дихлоро-2-метоксибензойная кислота] , дифензокат[1,2-диметил-3,5-дифенилпиразолиевые соли], флампропметил[метил N-2-/N-бензоил-3-хлоро-4-фторанилино/-пропионат] , флюометурон [N"-/3-трифторометилфенил/-N, N -диметилмочевина], изопротурон [N"-/4-изопропилфенил/-N, N - диметилмочевина] , инсектициды, например синтетические пиретроиды, например, перметрин и циперметрин и фунгициды, например, карбаматы, например, метил N-/1-т-бутил-карбамоил-бензимидазол-2-ил/карбамат, и триазолы, например, 1-/4-хлоро-фенокси/-3,3-диметил-1-/1,2,4-триазол-1-ил/-бутан-2-он. Пестицидно активные соединения и другие биологически активные материалы, которые могут быть включены или использоваться вместе с гербицидными соединениями настоящего изобретения, например, теми, которые упомянуты выше, при желании могут применяться в форме традиционных производных, например, солей и эфиров щелочных металлов и аминов. Следующие примеры иллюстрируют гербицидные композиции в соответствии с настоящим изобретением: Пример С1 Растворимый концентрат готовится из: Активного ингредиента /соединение 1/ - 20% вес/об. Раствора гидроксида калия - 10% вес/об. Тетрагидрофурфурилового спирта /ТГФС/ - 10% вес/об. Воды - до 100 объемов перемешиванием ТГФС, активного ингредиента /соединение 1/ и 90% объема воды и медленным добавлением раствора гидроксида калия до получения стабильного рН 7 - 8 и затем доведением до объема водой. Аналогичные растворимые концентраты можно приготовить как описано выше, заменой изоксазола /соединение 1/ другими соединениями формулы I. Пример С2 Смачиваемый порошок готовится из: Активного ингредиента /соединение 1/ - 50% вес/вес Натрий додецилбензол сульфоната - 3% вес/вес Лигносульфоната натрия - 5% вес/вес Натрий формальдегид алкилнафталина сульфоната - 2% вес/вес Измельченного диоксида кремния - 3% вес/вес Фарфоровой глины - 37 % вес/вес смешиванием указанных ингредиентов вместе порошки можно приготовить как описано выше заменой изоксазола /соединение 1/ другими соединениями формулы I. Пример С3 Водорастворимый порошок готовится из: Активного ингредиента /соединение 1/ - 50% вес/вес Додецилбензолсульфоната натрия - 1 % вес/вес Измельченного диоксида кремния - 2% вес/вес Бикарбоната натрия - 47% вес/вес смешиванием указанных и градиентов и измельчением указанной смеси в молотковой мельнице. Аналогичные водорастворимые порошки можно получить как описано выше заменой изоксазола /соединение 1/ другими соединениями формулы I. Соединения формулы I, представленные здесь, использовались как гербициды в соответствии со следующими процедурами. Способ использования гербицидных соединений а/ Общие сведения Соответствующие количества соединений, используемых для обработки растений, растворялись в ацетоне для получения растворов, эквивалентных дозировкам применения до 4000 г тестуемого соединения на гектар /г/га/. Эти растворы применялись из стандартного лабораторного опрыскивателя с эквивалентом 290 литров распыления жидкости на гектар. в/ Контроль сорняков: до всходов Смена высевались в 70 мм квадратные, глубиной в 75 мм пластиковые горшочки в нестерильную землю. Количество семян на горшок было следующим: (см. табл.1) Соединения изобретения применялись к поверхности почвы, содержащей семена, как описано в /а/. Один горшочек каждой культуры и каждого сорняка был подвергнут каждой обработке, были также контрольные растения без обработки и обработанные только одним ацетоном. После обработки горшочки помещались на капиллярную подстилку в застекленную теплицу и поливались сверху. Визуальная оценка повреждения культур проводилась через 20 - 24 дня после распыления. Результаты выражались в процентном сокращении роста или повреждения культуры или сорняка в сравнении с контрольными горшочками. с/ Контроль сорняков: после всходов Сорняки и культуры высевались непосредственно в компост Джона Инна в горшочки глубиной 75 мм и размеров 70х70 мм, за исключением Amaranthus, который был перенесен на стадии ростка в горшочек за неделю до распыления. Растения выращивались в теплице. Число растений на горшок было следующим: (см. табл.2) Соединения, используемые для обработки растений поменялись к растениям, как описано в /а/. Каждой обработке подвергался один горшочек каждой культуры и вида сорняка, были контрольные растения без обработки и растения, на которые распылялся только ацетон. После обработки горшочки помещались на капиллярную подстилку в теплицу и поливались сверху раз в 24 часа и затем контролируемым поливом под землей. Визуальная оценка повреждений культур и сорняков проводилась 20 - 24 дня спустя после распыления. Результаты выражались в процентном выражении как снижение роста или повреждение культур или сорняков в сравнении с растениями в контрольных горшочках. При применении до или после всхожести при дозировке 4 кг/га или меньше, соединения 1 - 27 обеспечивали контроль по меньшей мере 90% одного или нескольких видов сорняков и демонстрировали селективность по меньшей мере в одном из видов культур.
ФОРМУЛА ИЗОБРЕТЕНИЯ1. Производное изоксазола формулы I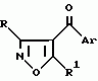 где Ar представляет фенил, замещенный одной-тремя группами R2, и где два заместителя на смежных положениях фенильного кольца вместе с двумя атомами, к которым они присоединены, образуют 5-6-членное гетероциклическое кольцо, содержащее один или два гетероатома, выбранных из O, S, N, которое может быть замещено одной или более группами R21, R представляет атом водорода; R1 представляет циклоалкильную группу, содержащую от трех до шести атомов углерода; R2 могут быть одинаковыми или разными, представляют атом галогена, алкильную группу с прямой или разветвленной цепью, содержащую от одного до шести атомов углерода, которая может быть необязательно замещена одним или более галогенами, группу, выбранную из -SR5, -SOR5, -SO2R5, -OR5, -(CR9R10)t -S(O)pR5; R21 могут быть одинаковыми или разными, представляют R2 или = 0; R5 представляет алкил с прямой или разветвленной цепью, содержащий до шести атомов углерода; R9 и R10 каждый представляет атом водорода; p - 0, 1 или 2; t = 1, или его сельскохозяйственно приемлемые соли. 2. Соединение по п. 1, в котором Ar представляет возможно замещенный 1,3-бензодиоксол, бензо[в]тиофен, бензоксазол или бензо- 1,2,3 -тиадиазол. 3. Соединение по п.1 или 2, отличающееся тем, что: (a) R2 расположен в C-2 положении фенильного кольца, когда конденсирование имеет место по C-3 и C-4 этого кольца, или (b) R2 расположено в C-4 положении фенильного кольца, если конденсирование имеет место на C-2 и C-3 этого кольца. 4. Соединение по п.1, 2 или 3, в котором R2 - атом галогена или группа, выбранная из -SR5, -SOR5, -OR5, -SO2R5, где R5 - как определено в п.1. 5. Соединение по любому из пп.1-4, отличающееся тем, что R21 является атомом галогена C1-4 алкилом или -OR5 и R5 - как определено в п.1. 6. Соединение по п.5, отличающееся тем, что R21 представляет фтор, т-бутил или метокси. 7. Соединение по любому из пп.1-6, в котором R1 представляет циклопропильную группу. 8. Соединение по любому из пп.1-7, где R1 представляет циклопропильную группу и R2 представляет галоген. 9. Соединение по п.1, где Ar представляет фенил, необязательно замещенный группой R2 и где два заместителя на смежных позициях фенильного кольца вместе с двумя атомами, к которому они присоединены, образуют 5- или 6-членное кольцо, выбранное из диоксолана, тиофена, тиофен -S, S -диоксида, тиадиазола, оксазола, пиррола и диоксана, и кольцо необязательно замещено одной или двумя группами R21, которые могут быть одинаковыми или разными; R1 представляет циклопропильную группу; R2 представляет атом галогена или группу, выбранную из -SR5, -SOR5, -SO2R5, -CH2S(O)pR5, -OR5; R21 представляет атом галогена, C1-4 алкил, SO2R5 или -OR5, R5 представляет метил или этил; p = 0, 1 или 2. 10. Соединение по п.1, которое представляет собой: 5-циклопропил-4-/2,2-дифторо-7-метилсульфенил-1,3-бензодиоксол-4-оил/ изоксазол; 5-циклопропил-4-/2,2-дифторо-1,3-бензодиоксол-4-оил/ изоксазол; 5-циклопропил-4-/3,4-диметоксибензо/b/ тиен-5-оил/ изоксазол; 5-циклопропил-4-/бензо-1,2,3-тиадиазол-5-оил/изоксазол; 5-циклопропил-4-/2,2-дифторо-7-метилсульфонил-1,3-бензодиоксол-4-оил/изоксазол; 5-циклопропил-4-/2,2-дифторо-4-метилсульфонил/-1,3-бензодиоксол-5-оил/изоксазол; 4-/2-т-бутил-4-хлорбензоксазол-7-оил/-5-циклопропилизоксазол; 4-/4-хлоро-3-метоксибензо/b/тиен-5-оил/-циклопропилизоксазол; 5-циклопропил-4-/2,2-дифторо-4-метилсульфинил-1,3-бензодиоксол-5-оил/изоксазол; 5-циклопропил-4-/2,2-дифторо-4-метилсульфенил-1,3-бензодиоксол-5-оил/изоксазол; 5-циклопропил-4-/1-/метилсульфонил/индол-4-карбоил/изоксазол; 5-циклопропил-4-/4-метил-1,3-бензодиоксол-5-оил/изоксазол; 5-циклопропил-4-/4-/метансульфонилметил-1,3-бензодиоксол-5-оил/ изоксазол; 5-циклопропил-4-/2,2-дифторо-4-/метансульфонилметил/-1,3-бензодиоксол-5-оил/изоксазол; 5-циклопропил-4-/4-/метилсульфенил/-1,3-бензодиоксол-5-оил/изоксазол; 5-циклопропил-4-/3-этокси-4-/метилсульфенил/бензо[b] тиен-5-оил/ изоксазол; 5-циклопропил -4-/4-хлоро-3-этокси-2-этилбензо/b/тиен-5-оил/изоксазол; 5-циклопропил -4-/4-хлоро-3-этоксибензо/b/тиен-5-оил/-изоксазол; 5-циклопропил-4-/2,3-дигидро-5-/метилсульфонил/-1,3-бензодиоксол-5-оил/изоксазол; 5-циклопропил-4-/4-/метилсульфонил/-1,3-бензодиоксол-5-оил/изоксазол; 5-циклопропил-4-/5-/метилсульфинил/-1,4-бензодиоксан-6-карбонил/изоксазол; 5-циклопропил-4-/4-/метилсульфинил/-1,3-бензодиоксол-5-оил/изоксазол; 5-циклопропил-4-/4-хлоро-3-метоксибензо[b] тиен-5-оил/изоксазол-1,1-диоксид; 5-циклопропил-4-/3,4-диметоксибензо[b]тиен-5-оил/изоксазол-1,1-диоксид; 5-циклопропил-4-/4-хлоро-3-метокси-2-метилбензо[b]тиен-5-оил/изоксазол-1,1-диоксид; 5-циклопропил-4-/5-/метилсульфенил/-1,4-бензодиоксан-6-карбонил/изоксазол; или 5-циклопропил-4-/4-хлоро-3-метокси-2-метилбензо[b]тиен-5-оил/изоксазол. 11. Гербицидная композиция, включающая активный ингредиент - производное изоксазола и сельскохозяйственно приемлемый разбавитель или носитель и/или поверхностно-активный агент, отличающаяся тем, что в качестве производного изоксазола она содержит соединение формулы (I), как определено в любом из пп. 1 - 10, или его сельскохозяйственно приемлемую соль в гербицидно-эффективном количестве. 12. Композиция по п. 11, отличающаяся тем, что она представляет собой смачиваемый порошок, водорастворимый порошок, жидкий растворимый концентрат, 13. Способ борьбы с ростом сорняков в очаге, включающий применение производного изоксазола, отличающийся тем, что в качестве производного изоксазола используют соединение формулы (I), как определено в любом из пп.1 - 10, или его сельскохозяйственно приемлемую соль в гербицидно эффективном количестве. 14. Способ получения производного изоксазола формулы (I), как определено в п.1, включающий взаимодействие соединения формулы (II): где Ar представляет фенил, замещенный одной-тремя группами R2, и где два заместителя на смежных положениях фенильного кольца вместе с двумя атомами, к которым они присоединены, образуют 5-6-членное гетероциклическое кольцо, содержащее один или два гетероатома, выбранных из O, S, N, которое может быть замещено одной или более группами R21, R представляет атом водорода; R1 представляет циклоалкильную группу, содержащую от трех до шести атомов углерода; R2 могут быть одинаковыми или разными, представляют атом галогена, алкильную группу с прямой или разветвленной цепью, содержащую от одного до шести атомов углерода, которая может быть необязательно замещена одним или более галогенами, группу, выбранную из -SR5, -SOR5, -SO2R5, -OR5, -(CR9R10)t -S(O)pR5; R21 могут быть одинаковыми или разными, представляют R2 или = 0; R5 представляет алкил с прямой или разветвленной цепью, содержащий до шести атомов углерода; R9 и R10 каждый представляет атом водорода; p - 0, 1 или 2; t = 1, или его сельскохозяйственно приемлемые соли. 2. Соединение по п. 1, в котором Ar представляет возможно замещенный 1,3-бензодиоксол, бензо[в]тиофен, бензоксазол или бензо- 1,2,3 -тиадиазол. 3. Соединение по п.1 или 2, отличающееся тем, что: (a) R2 расположен в C-2 положении фенильного кольца, когда конденсирование имеет место по C-3 и C-4 этого кольца, или (b) R2 расположено в C-4 положении фенильного кольца, если конденсирование имеет место на C-2 и C-3 этого кольца. 4. Соединение по п.1, 2 или 3, в котором R2 - атом галогена или группа, выбранная из -SR5, -SOR5, -OR5, -SO2R5, где R5 - как определено в п.1. 5. Соединение по любому из пп.1-4, отличающееся тем, что R21 является атомом галогена C1-4 алкилом или -OR5 и R5 - как определено в п.1. 6. Соединение по п.5, отличающееся тем, что R21 представляет фтор, т-бутил или метокси. 7. Соединение по любому из пп.1-6, в котором R1 представляет циклопропильную группу. 8. Соединение по любому из пп.1-7, где R1 представляет циклопропильную группу и R2 представляет галоген. 9. Соединение по п.1, где Ar представляет фенил, необязательно замещенный группой R2 и где два заместителя на смежных позициях фенильного кольца вместе с двумя атомами, к которому они присоединены, образуют 5- или 6-членное кольцо, выбранное из диоксолана, тиофена, тиофен -S, S -диоксида, тиадиазола, оксазола, пиррола и диоксана, и кольцо необязательно замещено одной или двумя группами R21, которые могут быть одинаковыми или разными; R1 представляет циклопропильную группу; R2 представляет атом галогена или группу, выбранную из -SR5, -SOR5, -SO2R5, -CH2S(O)pR5, -OR5; R21 представляет атом галогена, C1-4 алкил, SO2R5 или -OR5, R5 представляет метил или этил; p = 0, 1 или 2. 10. Соединение по п.1, которое представляет собой: 5-циклопропил-4-/2,2-дифторо-7-метилсульфенил-1,3-бензодиоксол-4-оил/ изоксазол; 5-циклопропил-4-/2,2-дифторо-1,3-бензодиоксол-4-оил/ изоксазол; 5-циклопропил-4-/3,4-диметоксибензо/b/ тиен-5-оил/ изоксазол; 5-циклопропил-4-/бензо-1,2,3-тиадиазол-5-оил/изоксазол; 5-циклопропил-4-/2,2-дифторо-7-метилсульфонил-1,3-бензодиоксол-4-оил/изоксазол; 5-циклопропил-4-/2,2-дифторо-4-метилсульфонил/-1,3-бензодиоксол-5-оил/изоксазол; 4-/2-т-бутил-4-хлорбензоксазол-7-оил/-5-циклопропилизоксазол; 4-/4-хлоро-3-метоксибензо/b/тиен-5-оил/-циклопропилизоксазол; 5-циклопропил-4-/2,2-дифторо-4-метилсульфинил-1,3-бензодиоксол-5-оил/изоксазол; 5-циклопропил-4-/2,2-дифторо-4-метилсульфенил-1,3-бензодиоксол-5-оил/изоксазол; 5-циклопропил-4-/1-/метилсульфонил/индол-4-карбоил/изоксазол; 5-циклопропил-4-/4-метил-1,3-бензодиоксол-5-оил/изоксазол; 5-циклопропил-4-/4-/метансульфонилметил-1,3-бензодиоксол-5-оил/ изоксазол; 5-циклопропил-4-/2,2-дифторо-4-/метансульфонилметил/-1,3-бензодиоксол-5-оил/изоксазол; 5-циклопропил-4-/4-/метилсульфенил/-1,3-бензодиоксол-5-оил/изоксазол; 5-циклопропил-4-/3-этокси-4-/метилсульфенил/бензо[b] тиен-5-оил/ изоксазол; 5-циклопропил -4-/4-хлоро-3-этокси-2-этилбензо/b/тиен-5-оил/изоксазол; 5-циклопропил -4-/4-хлоро-3-этоксибензо/b/тиен-5-оил/-изоксазол; 5-циклопропил-4-/2,3-дигидро-5-/метилсульфонил/-1,3-бензодиоксол-5-оил/изоксазол; 5-циклопропил-4-/4-/метилсульфонил/-1,3-бензодиоксол-5-оил/изоксазол; 5-циклопропил-4-/5-/метилсульфинил/-1,4-бензодиоксан-6-карбонил/изоксазол; 5-циклопропил-4-/4-/метилсульфинил/-1,3-бензодиоксол-5-оил/изоксазол; 5-циклопропил-4-/4-хлоро-3-метоксибензо[b] тиен-5-оил/изоксазол-1,1-диоксид; 5-циклопропил-4-/3,4-диметоксибензо[b]тиен-5-оил/изоксазол-1,1-диоксид; 5-циклопропил-4-/4-хлоро-3-метокси-2-метилбензо[b]тиен-5-оил/изоксазол-1,1-диоксид; 5-циклопропил-4-/5-/метилсульфенил/-1,4-бензодиоксан-6-карбонил/изоксазол; или 5-циклопропил-4-/4-хлоро-3-метокси-2-метилбензо[b]тиен-5-оил/изоксазол. 11. Гербицидная композиция, включающая активный ингредиент - производное изоксазола и сельскохозяйственно приемлемый разбавитель или носитель и/или поверхностно-активный агент, отличающаяся тем, что в качестве производного изоксазола она содержит соединение формулы (I), как определено в любом из пп. 1 - 10, или его сельскохозяйственно приемлемую соль в гербицидно-эффективном количестве. 12. Композиция по п. 11, отличающаяся тем, что она представляет собой смачиваемый порошок, водорастворимый порошок, жидкий растворимый концентрат, 13. Способ борьбы с ростом сорняков в очаге, включающий применение производного изоксазола, отличающийся тем, что в качестве производного изоксазола используют соединение формулы (I), как определено в любом из пп.1 - 10, или его сельскохозяйственно приемлемую соль в гербицидно эффективном количестве. 14. Способ получения производного изоксазола формулы (I), как определено в п.1, включающий взаимодействие соединения формулы (II): 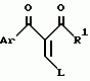 где Ar и R1, как определены в п.1, и L - уходящая группа, с солью гидроксиламина. 15. Способ получения производного изоксазола формулы (I), как определено в п. 1, которое содержит окисленный атом серы SO или SO2, включающий окисление соответствующего соединения формулы (I), в котором содержится неокисленный атом серы. где Ar и R1, как определены в п.1, и L - уходящая группа, с солью гидроксиламина. 15. Способ получения производного изоксазола формулы (I), как определено в п. 1, которое содержит окисленный атом серы SO или SO2, включающий окисление соответствующего соединения формулы (I), в котором содержится неокисленный атом серы.Популярные патенты: 2054429 Способ получения антисептика для защиты древесины ... побочные продукты синтеза 4,4-диметилдиоксана-1,3 и процесс проводят при 140 - 160oС и 4 - 6 ати в присутствии 0,05 - 0,10 мас.% щавелевой, муравьиной или фосфорной кислоты при непрерывной отгонке выделяющихся реакционной воды и ... 2154939 Способ выращивания кроликов и устройство для его осуществления ... по п.1, отличающееся тем, что под полом клетки размещена наклонно сетка, сверху которой под углом и с зазором к ней установлен поддон, а под сеткой смонтирован второй поддон, размещенный ниже плоскости первого поддона. 7. Устройство по п.1, отличающееся тем, что клетка для самца установлена или на тележке, или на транспортере для раздачи корма и имеет несколько отделений для самцов. 8. Устройство по п.1, отличающееся тем, что открывающаяся стенка крайнего отделения секции для крольчат смонтирована с возможностью открытия вниз, или вверх, или в сторону. 9. Устройство по п.1, отличающееся тем, что маточное отделение, гнездо и секция для крольчат имеют технологические дверцы, при этом ... 2233582 Устройство для охлаждения молока ... соприкасающихся блоков и теплообменных поверхностей приводит к увеличению трудоемкости их изготовления.При этом наличие резиновых вакуумных уплотнений между теплообменными пластинами молочного и водяного контуров вызывает необходимость использования в качестве хладоносителя только чистой питьевой воды [СанПиН 2.3.4.551-96 “Производство молока и молочных продуктов”], так как не исключена вероятность ее просачивания в молочный контур теплообменника. Это, в свою очередь, ограничивает возможность использования таких устройств в сочетании с водой низкого качества.По совокупности существенных признаков данное устройство наиболее близко к заявляемому и может быть принято в качестве ... 2168887 Машина для добычи корней ... комочков 1-1,5 см) укладываются вновь на дно и в емкость канавы. Фигурные дугообразные кронштейны 28 лопастей поддерживают корнесодержащий пласт с боков. Встречающиеся корни и корневища ими ориентируются при сбрасывании на среднюю часть обработанной полосы. Закругленная поверхность корпуса каждого клыка 26, предпочтительно круглой формы полых элементов 24, плавные сопряжения монтажных штифтов 27 и 29 и соответствующая геометрия дугообразных кронштейнов 28 исключают механическое травмирование поверхности корней и корневищ девясила высокого. Этому способствует также экспериментально подтвержденные режимы работы ротора 6 при правильном соотношении поступательной скорости машины и ... 2404898 Устройство на воздушной подушке для разбрасывателей органоминеральных удобрений ... раздвижным дышлом и выполненные в виде платформ с вентиляторами и камерами для образования воздушной подушки, согласно изобретению, на боковых приставках установлен складной портал с пантографом для обеспечения параллельности боковых приставок и их размещения параллельно разбрасывателю. Кроме того, сцепление бортовых приставок с разбрасывателем выполнено через обода его колес и дышло.Сравнения заявляемого устройства с прототипом показывает, что новым является то, что на боковых приставках установлен складной портал с пантографом для обеспечения параллельности бортовых приставок и их размещения параллельно разбрасывателю, наличие бортовых приставок и складного портала, ... |
Еще из этого раздела: 2218755 Способ длительного клонирования пайзы (echinochloa frumentacea link) 2195801 Картофелекопатель швыряльного типа 2473211 Приспособление для автоматической дойки молочного скота 2405306 Способ определения содержания крахмала по содержанию глюкозы с учетом индивидуального коэффициента пересчета в растительном материале 2414114 Зерноуборочный комбайн 2076603 Способ повышения урожайности сельскохозяйственных культур 2067798 Агромостовой комплекс 2121263 Способ лесоводственной оценки технологического комплекса машин 2489835 Гнездовой высевающий аппарат для посева проросших семян овощных культур 2449809 Дезинфицирующее средство |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||