Способ получения трансгенных животныхПатент на изобретение №: 2108714 Автор: Соболев А.С., Розенкранц А.А., Иванова М.М., Смирнова О.А., Никитин В.А., Эрнст Л.К., Народицкий Б.С. Патентообладатель: Товарищество с ограниченной ответственностью "Био Прогресс" Дата публикации: 20 Апреля, 1998 Адрес для переписки: подача заявки28.10.1996 публикация патента20.04.1998 Изображения  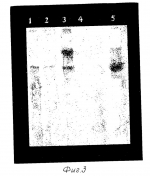  Использование: биотехнология, генетическая инженерия животных, экспериментальная и молекулярная биология, экспериментальная медицина, ветеринария и племенное животноводство. Сущность изобретения: способ получения трансгенных животных, состоящий в том, что доставляемый в клетки ранних эмбрионов животных генетический материал включают в конструкцию, имеющую компонент для проникновения конструкции внутрь клетки, компонент для транспорта конструкции внутри клетки и компонент для проникновения конструкции в клеточное ядро, добавляют к эмбрионам животных на ранней стадии развития и инкубируют с ранними эмбрионами животных. 9 з.п. ф-лы, 3 ил., 2 табл. , , , , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУИзобретение направлено на решение задачи получения трансгенных животных, относится к области биотехнологии, генетической инженерии животных, экспериментальной и молекулярной биологии, может быть использовано в экспериментальной медицине, ветеринарии и племенном животноводстве. Для получения трансгенных животных в настоящее время широко применяется способ, включающий в себя введение генетического материала в извлеченные из организма зиготы при помощи микроинъекции [1]. К недостаткам этого способа относятся его большая трудоемкость, необходимость извлечения зигот из животного и применение сложных микроинъекционных процедур на дорогостоящем оборудовании. Неоднократно предпринимались попытки разработать способ получения трансгенных животных без участия микроинъекции [2-5]. Так, например, известен способ получения трансгенных животных при помощи добавления ДНК к клеткам ранних эмбрионов животных в составе липосом, которые переносят генетический материал внутрь клеток ранних эмбрионов животных, и инкубации с ними [2]. Этот способ не включает в себя обычно применяемую для получения трансгенных животных микроинъекцию и имеет следующие общие с заявляемым способом получения трансгенных животных черты: включение генетического материала в искусственную конструкцию (липосому), переносящую генетический материал, добавление этой конструкции к эмбрионам и инкубацию с этой конструкцией. Инкубация с конструкцией, переносящей генетический материал в клетки эмбрионов, осуществляется in vitro. Такой способ не предполагает каких-либо специальных средств для узнавания клеток эмбрионов и для транспорта генетического материала в клеточное ядро; после слияния липосомы с клеточной мембраной доставляемый генетический материал оказывается в цитоплазме и проникает в клеточное ядро случайным образом. Другой способ немикроинъекционного получения трансгенных животных предполагает использование рекомбинантных вирусов для переноса генетического материала в клетки ранних эмбрионов животных [3]. В этом случае генетический материал включается в рекомбинантный вирусный геном и в его составе в структуру вируса, переносящего генетический материал - приготовленную для переноса генетического материала конструкцию. Узнавание клеток ранних эмбрионов животных и транспорт в эти клетки происходит за счет вирусных детерминант. Инкубация с конструкцией, переносящей генетический материал в клетки эмбрионов, также осуществляется in vitro. Этот способ получения трансгенных животных является наиболее близким аналогом заявляемого способа, имеющим следующие общие с ним существенные признаки: включение генетического материала в конструкцию (вирус), переносящую генетический материал, добавление этой структуры к эмбрионам и инкубацию с этой структурой [3]. К недостаткам этого способа получения трансгенных животных относятся ограниченный размером вирусного генома размер переносимого генетического материала, ограниченная вирусными детерминантами возможность узнавания клеток-мишеней и относительная сложность конструирования рекомбинантных вирусов. Технический результат, достигаемый изобретением, состоит в устранении указанных недостатков, т. е. расширении возможностей способа (в увеличении диапазона размеров вводимого генетического материала), в повышении экономичности способа, в возможности вводить различный генетический материал на основе применения одних и тех же компонентов. Предлагаемый способ получения трансгенных животных позволяет получать трансгенных животных при помощи последовательного включения генетического материала в состав искусственной конструкции, переносящей генетический материал в клетки ранних эмбрионов животных, добавления этой конструкции к ранним эмбрионам и инкубации конструкции, содержащей генетический материал, с ранними эмбрионами млекопитающих. В предлагаемом способе используется искусственная конструкция, в состав которой входят: компонент для проникновения в клетки ранних эмбрионов животных, компонент для внутриклеточного транспорта и компонент для проникновения конструкции в клеточное ядро. В качестве компонента для проникновения в клетки ранних эмбрионов животных в предлагаемом способе используется интернализуемый (эндоцитируемый) лиганд. Однако к настоящему времени только для немногих эндоцитируемых лигандов показано их наличие на поверхности клеток ранних эмбрионов и существование рецептор-опосредуемого эндоцитоза (интернализации) в клетках ранних эмбрионов животных. Правильный выбор интернализуемого лиганда для проникновения в клетки ранних эмбрионов является, поэтому, необходимым условием получения трансгенных животных данным способом. Таким лигандом, рецепторы к которому присутствуют на клетках эмбрионов, начиная со стадии зиготы, является инсулин [6, 7]. Показано, что ДНК-переносящие конструкции с использованием инсулина могут быть успешно применены для трансформации как клеток в культуре [8] , так и соматических клеток in vivo [9], однако до настоящего момента не имеется сведений о применении инсулина, и других лигандов как компонентов для обеспечения проникновения в клетки ранних эмбрионов животных. Наличие инсулиновых рецепторов на клетках эмбрионов, начиная с самых ранних стадий развития, делает возможным применение инсулина в качестве компонента для переноса генов не только в соматические клетки взрослого организма, но и для переноса генов в клетки ранних эмбрионов. Применение для получения трансгенных животных других подобных конструкций, приготовляемых на основе, например, асиалоорозомукоида и трансферрина, как компонентов для проникновения в клетки, [10-14] не представляется оправданным, поскольку рецепторы к этим интернализуемым лигандам присутствуют в соматических клетках (в наибольшем числе в клетках печени) и нет данных об их наличии в клетках ранних эмбрионов. Комплекс вышеизложенных фактов обусловил применение в предлагаемом способе получения трансгенных животных инсулина в качестве компонента для проникновения внутрь эмбриональной клетки. В качестве компонента для транспорта конструкции, переносящей генетический материал внутри клеток, мы использовали аденовирус, который способен обеспечить транспорт содержимого из эндосом. Наличие в составе конструкции компонентов, которые способны вызывать выход содержимого из кислых эндоцитозных компартментов, способно значительно облегчить процесс транспорта генетического материала по направлению к месту его доставки - ядру [15]. В качестве компонентов, способных вызывать выход содержимого из кислых эндоцитозных компартментов, могут быть использованы различные вирусы [16-18], либо же амфипатические полипептиды [18]. Ранее было показано, что аденовирусы являются наиболее эффективными компонентами для транспорта конструкции через эндосомальную мембрану при трансфекции in vitro и на соматических клетках [18]. На основании известных к настоящему моменту сведений было не очевидно, однако, что аденовирусы можно применять для транспорта конструкции, переносящей генетический материал, в клетках ранних эмбрионов при получении трансгенных животных. Для достижения наибольшей эффективности способа необходимо также использовать и средства для проникновения генетического материала в ядро клетки, поскольку при применяемой в данном способе схеме генетический материал в составе конструкции после того, как его протранспортируют внутрь клетки и, затем, внутри клетки через эндосомальную мембрану, оказывается в цитоплазме. В качестве компонента для проникновения в ядро в данном способе был использован инсулин, для которого показано проникновение в ядра различных клеток [19, 20]. Компоненты конструкции, переносящей генетический материал, объединены между собой и с генетическим материалом за счет ковалентных и нековалентных взаимодействий. Например, компонент для проникновения конструкции внутрь клетки ковалентно присоединяется к поликатиону, который нековалентно связывается с генетическим материалом; компонент для транспорта конструкции внутри клетки ковалентно соединяется с биотином, биотин нековалентно присоединяется со стрептавидином, ковалентно присоединенным к поликатиону, который нековалентно взаимодействует с генетическим материалом. В существующих к настоящему времени способах создания трансгенных животных (как с помощью микроинъекции, так и в способах без применения микроинъекции) предполагается стадия извлечения ранних эмбрионов из организма животного-донора. В заявляемом способе появляется возможность обойтись без этой процедуры. Предлагаемый способ получения трансгенных животных может быть осуществлен как при инкубации ранних эмбрионов с требуемым генетическим материалом в составе переносящей его конструкции in vitro, так и без извлечения эмбрионов из организма животного при добавлении конструкции непосредственно в половые пути, и инкубации с конструкцией, переносящей генетический материал, непосредственно в живом организме. Поскольку эндоцитируемые инсулиновые рецепторы присутствуют начиная с самой ранней стадии эмбрионального развития, способ дает возможность получения трансгенных животных при добавлении генетического материала к ранним эмбрионам на разных стадиях развития. На фиг. 1 представлена электрофореграмма ПЦР анализа ДНК из эмбрионов кролика после трансформации in vitro на стадии 2-х клеток: 1 - буфер; 2 - 7 - ДНК из тканей эмбрионов через 51 час после трансформации конструкцией при концентрации 5 нМ, 8 - среда отмывки эмбрионов, 9 - 14 - ДНК из тканей эмбрионов через 51 час после трансформации конструкцией при концентрации 0,5 нМ, 16-17 ДНК плазмиды pGL2. На фиг. 2 представлена электрофореграмма образцов тканей мыши после ПЦР-анализа: 1, 3,5 - ДНК из тканей эмбрионов 19 дня развития, подвергшихся трансформации in vivo; 2, 4, 6 - ДНК из плаценты эмбрионов 1,3,5, соответственно; 7 - контрольный эмбрион, не подвергавшийся трансформации; 8 - ДНК pGL2; 9 - раствор для выделения ДНК. Стрелкой указана полоса амплифицированного фрагмента. На фиг. 3 представлена гибридизация зонда с ДНК, выделенной из тканей мышей: 1 - плазмида pGL2, 1 нг; 2 - плазмида pGL2, 0,1 нг; 3,4 - ДНК из эмбрионов 15 дня развития; 5 - ДНК, выделенная из ткани матки. Пример 1. Включение генетического материала в состав конструкции, переносящей генетический материал. В качестве генетического материала для получения трансгенных животных были использованы плазмиды pGL2-Control Vector, (pGL2, "Promega") pVK28VP7d и pVK28VP7r. Плазмиды были включены в состав конструкций, переносящих генетический материал, общей схемы: инсулин-полилизин-плазмида- полилизин-стрептавидин-биотин-аденовирус. В качестве аденовируса были использованы аденовирус человека 5 (штаммы dl-312 и AD5-neo), утиный аденовирус EDS-76 и аденовирус кур CELO. Для включения инсулина в состав конструкции, переносящей генетический материал, бычий инсулин (Sigma) был ковалентно присоединен к полилизину с молекулярной массой 80 или 90 кД (Sigma) [8,21,22] при помощи N-оксисукцинимидного эфира 3-(2-пиридилдитио)пропионовой кислоты (SPDP, Sigma). Включение аденовирусов в состав конструкций было осуществлено посредством их биотинилирования при помощи N-оксисукцинимидного эфира биотинамидокапроата (N-OC-AK-биотин, Sigma) и присоединения к стрептавидину (Sigma или Molecular Probes), ковалентно присоединенного к полилизину с молекулярной массой 80 или 90 кД. Инсулин-полилизин, синтез и очистка. Бычий инсулин (Sigma) был иодирован 125I при помощи иодогена (Pierce) [23], полилизин метили [14C]-динитрофторбензолом или [35S]-метящим реагентом (Amersham). Синтез и очистку коньюгата инсулин-полилизин проводили как описано [8]. Вкратце: цитраконированный бычий [125I] -инсулин был ковалентно присоединен к [14C]-полилизину при помощи бифункционального сшивающего реагента SPDP по схеме Юнга с авторами [24]. Полученный коньюгат был очищен гель-фильтрацией на колонке с сефакрилом S-300 (Pharmacia), после чего цитраконильные группы были удалены. Молярное содержание инсулина и полилизина в коньюгате, определенное по соотношению радиоактивных иода и серы, составляло от 4 до 10 остатков инсулина на 1 полилизин в различных партиях синтезированного препарата. Стрептавидин-полилизин, синтез и очистка. Стрептавидин был присоединен к полилизину при помощи SPDP аналогично синтезу инсулин-полилилизина и очищен на сефакриле S-300 (Pharmacia). Молярное соотношение полилизина к стрептавидину было от 1-2 в зависимости от партии. Биотинилирование и очистка аденовирусов: биотинилирование аденовирусов человека и птиц (EDS-76 и CELO) проводили при помощи N-OC-AK-биотина в CsCl (1,35 г/мл); очистку биотинилированных вирусов проводили диализом против 0,15 M NaCl, 25 mM HEPES, pH 7,5. Получение конструкции, переносящей генетический материал: конструкцию получали последовательными добавлениями стрептавидин-полилизина, плазмиды и инсулин-полилизина к биотинилированному аденовирусу и инкубациями в течение 30 мин при 25oC. Пример 2. Перенос генетического материала в клетки ранних эмбрионов in vitro. Для проверки возможности переноса генетического материала в клетки ранних эмбрионов при помощи конструкции, переносящей генетический материал, были использованы предимплантационные эмбрионы мышей (линия Balb/c), кроликов (породы Шиншилла) и овец (Романовская порода) разных стадий развития. Конструкцию, приготовленную в 0,15 M NaCl, смешивали с средой M2 в соотношении 1:3. Эмбрионы инкубировали в этой среде (300 мкл) под слоем минерального масла в течение 3 ч при 37oC, после чего отмывали в среде M2 и культивировали в среде M16 при 37oC при 5% CO2, отмывали средой M2 (10 -12 отмывок в каплях объемом 300 - 500 мкл) и проводили анализ. Анализ наличия в эмбрионах перенесенного генетического материала: Получение материала для полимеразной цепной реакции (ПЦР) из эмбрионов предимплантационных стадий проводили, разрушая эмбрионы замораживанием - оттаиванием в гипотонической среде в общем объеме 12 мкл с последующей обработкой протеиназой K (Serva). Полимеразную цепную реакцию проводили в общем объеме 25 мкл в инкубационном буфере, содержащем 67 mM Tris-HCl pH 8,8; 15 nM (NH4)2SO4, 2mM MgCl2, 170 мкг/мл BSA, 200 мкМ dATP, dCTP, dTTP, dGTP, 1,25 единицы Taq-полимеразы, по 1 мкМ каждого из олигонуклеотидных праймеров. Анализ наличия в эмбрионах перенесенного генетического материала проводили методом ПЦР с использованием праймеров GL (Promega) при ведении в эмбрионы плазмиды pG12 и специально синтезированных олигонуклеотидов следующего состава: direct - 5"-CTGGAGAGGAATTGGACATATCCG, reverse - 5" - CCATCAACAACATCAACTATCGCC в качестве праймеров для выявления в реакции ПЦР нуклеотидной последовательности поверхностного антигена ротавируса свиней VP7 (pVK28VP7). Электрофорез аликвот полученных образцов проводили в 2%-ном агарозном геле. Для проверки специфичности фрагмента, синтезированного в полимеразной цепной реакции, ДНК из агарозного геля переносили на нейлоновый фильтр (HYBOND N+) и гибридизировали с [32P]-меченным зондом, в качестве контроля были использованы среды после отмывки эмбрионов, а также эмбрионы, которые были инкубированы в среде M2 с добавкой 0,15 M NaCl (3:1). Фотография типичного электрофореза представлена на фиг.1. Эксперименты, проведенные на различных видах животных, показали, что конструкции, переносящие генетический материал, описанные в примере 1, способны переносить генетический материал в клетки эмбрионов различных предимплантационных стадий in vitro. Полученные данные позволяют утверждать, что перенос генетического материала в эмбрионы успешно проходит на различных стадиях развития. Результаты переноса генетического материала при помощи конструкции, переносящей генетический материал, суммированы в табл. 1. Пример 3. Получение трансгенных животных при переносе генетического материала в ранние эмбрионы in vivo. Для возможности получения трансгенных животных при помощи добавления генетического материала in vivo в составе конструкции, доставляющей генетический материал, были проведены опыты на мышах линий Balb/c и SHK. Введение конструкции с чужеродным геном проводили на беременных самках мышей в интервале 78-108 ч после оплодотворения, когда эмбрионы находятся на стадиях морулы или бластоцисты. Конструкцию, переносящую генетический материал, приготовленную, как описано в примере 1, вводили интравагинально при помощи зонда длиной около 0,5 см в среде M2, в объеме 50 - 100 мкл. Выделение ДНК из тканей эмбрионов проводили по Маниатису [25], гомогенизируя ткани в 50 мМ трис-HCl, pH 8, 100 mM NaCl, 100 mM ЭДТА, 1% додецил сульфат Na, протеиназа K, 50 мкг/мл, с последующей экстракцией фенол-хлороформом. Анализ наличия в тканях перенесенного генетического материала проводили при помощи метода ПЦР и блот-гибридизации, как это описано в примере 2. Фотография типичного электрофореза представлена на фиг.2. Проведенные эксперименты показали возможность получения трансгенных животных непосредственно при введении конструкции, переносящей генетический материал, в организм животных и инкубации эмбрионов с конструкцией непосредственно в полости организма (табл.2). Включение перенесенного генетического материала в геном подтверждается блот-гибридизацией зонда с выделенной из тканей ДНК, обработанной рестриктазами HindIII и Eco RI (фиг.3). Таблица 2. In vivo введение генетического материала в клетки эмбрионов ранних стадий развития при помощи конструкции, переносящей генетический материал. Источники информации. 1. Mammalian development. A practical approach. Ed. M. Monk, IRL Press, Oxford - Washington, 1987. 2. Rottmann OJ; Stratowa C; Hornstein M; Hughes J Tissue specific expression of hepatitis B surface antigen in mice following liposome--mediated gene transfer into blastocysts. Zentralbl. Veterinarmed [A], v. 32, 676-82, 1985. 3. van der Putten H; Botteri FM; Miller AD; Rosenfeld MG; Fan H; Evans RM; Verma IM. Efficient insertion of genes into the mouse germ line via retroviral vectors. Proc. Natl. Acad. Sci. USA, v. 82, 6148-52, 1985. 4. Kim T; Leibfried-Rutledge ML; First NL. Gene transfer in bovine blastocysts using replication-defective retroviral vectors packaged with Gibbon ape leukemia virus envelopes. Mol. Reprod. Dev., v. 35, 105-13, 1993. 5. Boris-Lawrie K. A., Temin H.M. Recent advances in retrovirus vector technology. Current Opinion in Genetics and Development, v. 3, 102-109, 1993. 6. Heyner S, Rao LV, Jarett L, Smith R.M. Preimplantation mouse embryos internalize maternal insulin via receptor-mediated endocytosis: pattern of uptake and functional correlatins. Dev Biol., v. 134, 48-58, 1989. 7. Harvey MB, Kaye PL. Visualization of insulin receptors on mouse preembryos. Reprod Fertil Dev., v.3, 9-15, 1991. 8. Rosenkranz A.A., Yachmenev S.V., Jans D.A., Serebryakova N.V., Murav"ev V.I., Peters R., and Sobolev A.S. Receptor-mediated endocytosis and nuclear transport of a transfecting DNA construct. Exp. Cell Res., v. 199, 323-329, 1992. 9. Способ генетической трансформации молочной железы животного и устройство для введения генетического материала в молочный проток молочной железы животного. Соболев А.С., Розенкранц А.А. Никитин В.А. Патент RU 2025487, кл. C 12 N, A 61 D, 1994. 10. Wu G.Y., Wu C.H. Evidence for gene delivery to Hep G2 hepatoma cells in vitro Biochemistry, v.27, 887-892, 1987. 11. Wu G.Y. Wilson J.W., Wu C.H. Targeting genes delivery and persisten expression of a foreign gene driven by mammalian regulatory elements in vivo. J. Biol Chem. v. 264, 16985-16987, 1989. 12. Wagner E. , Zenke M., Cotten M., Beug H., Birnstiel M.L. Transferrin-polycation conjugates as carriers for DNA uptake into cells. Proc. Natl. Acad. Sci. USA, v. 87, 3410-3414, 1990. 13. Neue protein-polykation-konjugate. Birnstiel M.L., Cotten M., Wagner E., EP 0388785, 1990. 14. Gao L. , Wagner E. , Cotten M., Agarwal S., Harris C., Romer M., Miller L. , Hu P.C., and Curiel D. Direct in vivo gene transfer to airway epithelium employing adenovirus-polylysine-DNA complexes. Hum. Gene. Ther., v. 4, 17-24, 1993. 15. Guy J., Drabeck D., Antoniou M. Delivery of DNA into mammalian cells by receptor-mediated endocytosis and gene therapy. Mol. Biotechnology, v. 3, 237-248, 1995. 16. Curiel D.T., Agarwal S., Wagner E., Cotten M. Adenovirus anhancement of transferrin-polylysine-mediated gene devivery. Pros. Natl. Acad. Sci. USA, v. 88, 8850-8854, 1991. 17. Zauner W. , Blaas D., Kuechler E., Wagner E. Rhinovirus -mediated endosomal release of transfection complexes. J. Virology, v. 69, 1085-1092, 1995. 18. Wagner E., Cotten M., Zatloukal K., Plank C., Birnstiel M.L., Oberhauser B., Schmidt W.G.M. Zusammensetzung fuer das einbringen von nucleinsaure-komplexen in hohere eucariotishe zellen. EP 0 545 016 Al, 1993. 19. Smith R.M., Jarret L. Partial characterization of mechanism of insulin accumulation in H35 hepatoma cell nuclei. Diabetes, v. 39, p. 683-689, 1990. 20. Burwen S.J., Jones A.L. The association of polypeptide hormones and growth factors with the nuclei of target cells. Trends Biochem. Sci., v. 12, p. 159-162, 1987. 22. Розенкранц А.А., Ячменев С.В., Соболев А.С. Использование искусственных конструкций для селективного переноса генетического материала в клетки человека путем рецептор-опосредуемого эндоцитоза. Докл. акад. наук СССР, т. 312, 493-494, 1990. 23. Markwell M. A. K. A new solid state reagent to iodinate proteins. Anal. Biochem., v. 125, p. 427-432, 1982. 24. Jung G., Kohnlein W., Luders G. Biological activity of the antitumor protein neocarcinostatin coupled to a monoclonal antibody by N-succinimidyl-3-(2-pyridyldithio)-propionate. Biochem. Biophys. Res. Commun., v. 101, p. 599-606 (1981). 25. Маниатис Т. , Фрич Э., Сэмбрук Дж. Молекулярное клонирование.-М.; Мир, 1990.ФОРМУЛА ИЗОБРЕТЕНИЯ1. Способ получения трансгенных животных, включающий введение генетического материала в состав конструкции, переносящей генетический материал, добавление этой конструкции к ранним эмбрионам животных и инкубацию конструкции с ранними эмбрионами животных, отличающийся тем, что доставляемый в клетки ранних эмбрионов животных генетический материал включают в искусственную конструкцию, имеющую компонент для проникновения конструкции внутрь клетки, компонент для транспорта конструкции внутри клетки и компонент для проникновения конструкции в клеточное ядро. 2. Способ по п.1, отличающийся тем, что компоненты конструкции, переносящей генетический материал, объединены при помощи ковалентных и нековалентных взаимодействий. 3. Способ по п.1, отличающийся тем, что в качестве компонента для проникновения констукции внутрь клетки используют интернализуемый лиганд. 4. Способ по п.3, отличающийся тем, что в качестве интернализуемого лиганда используют инсулин. 5. Способ по п.1, отличающийся тем, что в качестве компонента для транспорта внутри клеток используют компонент, обеспечивающий транспорт из эндосом. 6. Способ по п.5, отличающийся тем, что в качестве компонента, обеспечивающего транспорт из эндосом, используют вирус. 7. Способ по п. 6, отличающийся тем, что в качестве вируса используют аденовирус. 8. Способ по п.1, отличающийся тем, что в качестве компонента для проникновения конструкции в клеточное ядро используют инсулин. 9. Способ по п.1, отличающийся тем, что добавление конструкции производится in vivo путем введения ее в половые пути. 10. Способ по п.1, отличающийся тем, что добавление конструкции производится in vitro.Популярные патенты: 2157603 Способ послепосевного прикатывания озимых культур и каток для его осуществления ... катка заключается в том, что наружная поверхность каждого выступа выполнена полуцилиндрической, проходящей вдоль всей длины цилиндра и соосной его наружной поверхности, при этом выступы размещены с одинаковым угловым шагом на окружности цилиндра. Радиус полуцилиндра каждого выступа составляет не менее 1/3 радиуса цилиндра. Совокупность вышеперечисленных признаков представляет такую геометрическую форму рабочей поверхности катка, которая, при его вращательно-поступательном движении по полю, как бы создает ее непрерывную "зеркальную" развертку, где выступ катка соответствует низине в создаваемом волновом рельефе поля, а расположенная между выступами цилиндрическая часть ... 2474105 Плодосъемник шолина ... черешка кисти, имеющего жесткую волокнистую структуру, не может осуществляться.Эксплуатация опытного образца плодосъемника показала, что его надежная работоспособность может быть обеспечена при значениях угла отклонения плоскости лезвия бритвы от оси бункера в противоположную сторону от захвата при угле =(15-20)°.Таким образом, видно, что приведенные выше сведения подтверждают возможность осуществления заявляемого устройства, достижения указанного технического результата и решения поставленной задачи - упрощения конструкции плодосъемника и расширения арсенала технических средств для дистанционного и непосредственного съема плодов с кустов и деревьев, преимущественно ... 2154940 Способ получения, содержания и хранения живого корма для биологических объектов птиц и рыб ... в процессе роста, помещают грену шелкопрядов. Для выращивания гусениц используют кормушки с жидким - 67, вязким безагаровым - 24 и порошкообразным - 7 кормом. Отродившиеся гусеницы, повинуясь инстинкту положительного гелиотаксиса, поднимаются в течение 5-6 дней, после чего переходят на крышку B1, где линяют на 2 возраст в течение 1-2 суток. После последующего питания в течение 4-5 дней гусеницы поднимаются на крышку B2, где линяют на 3 возраст в течение 1-2 суток, после чего после питания в течение 6-8 суток переходят на крышку B3, где линяют на 4 возраст в течение 1- 2 суток. После последующего питания в течение 6-8 дней, гусеницы поднимаются на крышку B4, где линяют на 5 ... 2485762 Ракета для активного воздействия на облака ... заряда обеспечивает воспламенение последней до входа ракеты в обрабатываемое облако, что заметно снижает продуктивность его обработки по назначению, снижая эффективность образования осадков. Отмеченные недостатки устранены в ракете для активного воздействия на облака по патенту RU 2340861, A01G 15/00; F42B 12/36, 2008 г., которая по технической сущности и числу совпадающих признаков выбрана в качестве наиболее близкого аналога предложенной ракете.Известная ракета для активного воздействия на облака содержит головную часть с установленной в ней шашкой активного дыма, снабженной средством инициирования системы самоликвидации, коллектор и обтекатель с выходными отверстиями, ... 2238970 Штамм mycelia sterilia лх-1-продуцент комплекса биологически активных веществ, обладающих рострегуляторными свойствами ... регуляторов роста растений, состоящее из микромицета Acremonium panaxeorum UHMU F-160, дрожжей Candida muscorum UHMU Y-411, Rhodotorula glutinis UHMU Y-42 и бактерий Azomonas macrocytogenes UHMU B-28 и Xantobacter sp UHMU B-29 /пат. РФ 2100932/.Недостатком указанного сообщества является сложность и трудоемкость его культивирования.Известны препараты, стимулирующие развитие и рост растений, полученные из чистых культур грибов-эндофитов, выделенных из корней пшеницы, овса, картофеля, пырея, мать-и-мачихи. Каждый препарат состоит из растворенных в 70% этиловом спирте продуктов метаболизма соответствующего ему эндофита. Обработка одним из указанных препаратов семян пшеницы, огурцов или ... |
Еще из этого раздела: 2437262 Культиватор-плоскорез 2278503 Способ управления формированием качества виноградного вина 2473211 Приспособление для автоматической дойки молочного скота 2172085 Способ управления групповым вождением машин 2124820 Устройство для изменения объемного заряда в атмосфере 2389173 Способ выращивания земляники садовой 2261597 Способ борьбы с нематодами - возбудителями болезней сельскохозяйственных растений 2229213 Способ регулирования роста зерновых культур 2145478 Гранулированное либо пеллетированное средство для защиты растений, способ его получения и способ борьбы с грибами 2059368 Способ борьбы с насекомыми-листогрызущими вредителями растений |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||