Производные амидов пиразолгликолевой кислоты, гербицидная композиция, способ борьбы с сорнякамиПатент на изобретение №: 2090560 Автор: Моримото Катсуси[JP], Охнари Масатоси[JP], Навамаки Цутоми[JP], Ватанабе Сигеоми[JP], Исикава Кимихиро[JP] Патентообладатель: Ниссан Кемикал Индастриз ЛТД (JP) Дата публикации: 20 Сентября, 1997 Адрес для переписки: подача заявки12.11.1992 публикация патента20.09.1997 Изображения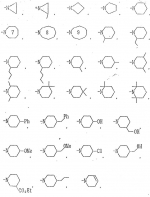 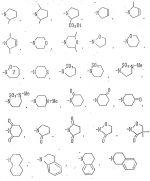 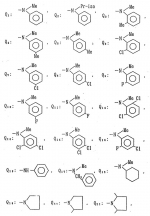 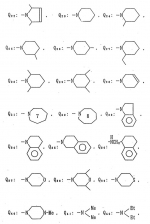 Амиды пиразолгликолевой кислоты с приведенной формулой (I), в которой каждая из групп от R1 до R5 представляет собой атом водорода или заместитель самого разного вида, и гербициды, содержащие их. Соединения обладают высокой гербицидной активностью против рисовых сорняков, особенно против вида Echinochloa crus-galli, не воздействуя при этом на сами рисовые растения. 2 з.п. ф-лы, 6 табл. , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУИзобретение касается новых производных амидов пиразолгликолевой кислоты и гербицидов, содержащих их в качестве активных ингредиентов. В настоящее время множество гербицидов нашло практическое использование, например на рисовых полях, гербициды повсеместно используют как индивидуально, так и в сочетании друг с другом. Гербициды могут быть применены к различным видам сорняков рисовых полей. Известно множество гербицидов, эффективно действующих против однолетних широколиственных сорняков, и в течение последних нескольких лет наблюдается рост числа гербицидов, эффективно действующих против многолетних сорняков. Однако, поскольку вид Echinochloa crus-galli, который является одним из серьезных рисовых сорняков и который в большинстве случаев произрастает на больших площадях рисовых полей, принадлежит к тому же семейству Cramineae, что и сам рис, являются почти неизвестными гербицидами, которые бы эффективно действовали только против вида Echinochloa crus-galli, особенно против тех растений, которые вырастают высокими, не нанося вообще вреда самим рисовым растениям. Рассматривая прежний уровень техники, касающийся соединений, которые являются аналогичными соединениями, отвечающими настоящему изобретению, в отношении их химического строения, следует сказать, что соединения с гликолиевокислотной амидной составляющей, присоединенной в положении 2 бензотиазольного кольца, раскрыты в патенте JP-A 54-154762, соединения с такой же составляющей, присоединенной к пятичленному ароматическому моноциклическому кольцу, содержащему атом кислорода или атом серы наряду с одним-тремя атомами азота, раскрыты в патенте JP-A 55-147267, соединения с такой же составляющей, присоединенной в положении 5 к тетразольному кольцу, раскрыты в патенте JP-A 56-86175 и соединения с такой же составляющей, присоединенной в положении 5 изоксазольного кольца, раскрыты в патенте JP-A 63-152367. Однако соединения с гликолиевокислотной амидной составляющей, присоединенной к пиразольному кольцу, такие как соединения, отвечающие настоящему изобретению, до настоящего времени вообще не были известными и являются новыми соединениями. Авторами на протяжении многих лет неустанно велись исследования, направленные на совершенствование гербицидов в направлении создания гербицидов, избирательно действующих только против вредных сорняков без повреждения важных культурных растений, причем в ходе проведения исследований было изучено множество соединений в отношении их гербицидной активности, что делали с целью создания гербицидных соединений, которые обладают повышенной гербицидной активностью и более широкой избирательностью. В результате проведения этих исследований было установлено, что производные амидов пиразолгликолевой кислоты с приведенной ниже формулой (I) обладают высокой гербицидной активностью, направленной против вида Echinochloa crus-galli и других рисовых сорняков, оставаясь совершенно безопасными для растений самого риса, и что производные являются эффективными даже при использовании их в небольшом количестве.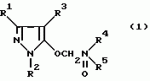 в которой R1 представляет собой атом водорода, (C1-6) алкильную группу, (C3-6) циклоалкильную группу; (C2-4) алкенильную группу, (C2-4) алкинильную группу, (C3-6) циклоалкилзамещенную (C1-2)алкильную группу, (C1-4) галоалкильную группу, ди(C1-4)алкильную группу, (C1-4)алкокси (C1-4)алкильную группу, (C1-4)алкилтио(C1-4)алкильную группу, (C1-4)алкилсульфинил-(C1-4)алкильную группу, (C1-4)алкилсульфонил(C1-4)алкильную группу, фенилзамещенную (C1-4)алкильную группу, фенильную группу (не обязательно замещенную одним или несколькими заместителями, выбранными из (C1-4)алкильной группы, (C1-4)галоалкильной группы, (C1-4)алкоксигруппы, цианогруппы, нитрогруппы и атома галогена), (C1-4)алкоксигруппу, (C1-4)галоалкоксигруппу, бензилоксигруппу, (C1-4)алкилтиогруппу, бензилтиогруппу, (C1-4) -алкилсульфинильную группу, (C1-4)алкилсульфонильную группу, ди(С1-4)алкилсульфамоильную группу, цианогруппу, атом галогена, ди(С1-4)алкиламиногруппу или нитрогруппу; R2 представляет собой атом водорода, (C1-6)алкильную группу, (C3-6)циклоалкильную группу, (C2-4)алкенильную группу, (C2-4)алкинильную группу, (C3-6)циклоалкилзамещенную (C1-2)алкильную группу, (C1-4)галоалкильную группу, (C1-4)алкилкарбонил (C1-4)алкильную группу, (C1-4)алкоксикарбонильную (C1-4)алкильную группу, ди(C1-4)алкиламино(C1-4) алкильную группу, (C1-4)алкокси(C1-4)алкильную группу, (C1-4)алкокси (C1-4)алкокси (C1-4)алкильную группу, (C1-4)алкилтио (C1-4)алкильную группу, (C1-4)алкилсульфинил(C1-4)алкильную группу, (C1-4)алкилсульфонил(C1-4)алкильную группу, фенилзамещенную (C1-4)алкильную группу, фенильную группу (не обязательно замещенную одним или несколькими заместителями, выбранными из (C1-4)алкильной группы, (C1-4)галоалкильной группы, (C1-4)алкоксигруппы, цианогруппы, нитрогруппы и атома галогена), нафтильную группу, пиридильную группу (не обязательно замещенную одним или несколькими заместителями, выбранными из (C1-4)алкильной группы, (C1-4)галоалкильной группы, (C1-4)алкоксигруппы, цианогруппы, нитрогруппы и атома галогена), (C1-4)алкилкарбонильную группу, (C1-4)алкиламинокарбонильную группу, ди(C1-4) алкиламинокарбонильную группу, (C1-4)алкоксикарбонильную группу, (C1-4)алкилсульфонильную группу или ди(C1-4)алкилсульфамоильную группу; R3 представляет собой атом водорода, (C1-6)алкильную группу, (C3-6)циклоалкильную группу, (C2-4)алкенильную группу, (C2-4)алкинильную группу, фенильную группу (не обязательно замещенную одним или несколькими заместителями, выбранными из (C1-4)алкильной группы, (C1-4)галоалкильной группы, (C1-4)алкоксигруппы, цианогруппы, нитрогруппы и атома галогена), цианогруппу, атом галогена или нитрогруппу; R4 и R5 независимо представляют собой атом водорода, (C1-6)алкильную группу, (C3-6)циклоалкильную группу, (C2-4)алкенильную группу, (C2-4)алкинильную группу, (C3-6)циклоалкилзамещенную (C1-2)алкильную группу, (C1-4)алкокси (C1-4)алкильную группу, (C1-4)алкоксикарбонильную, фенилзамещенную (C1-4)алкильную группу (у которой фенильная составляющая может не обязательно бытьзамещенной одним или несколькими заместителями, выбранными из (C1-4)алкильной группы, (C1-4)галоалкильной группы, (C1-4)алкоксигруппы, цианогруппы, нитрогруппы и атома галогена), фенильную группу (не обязательно замещенную одним или несколькими заместителями, выбранными из (C1-4)алкильной группы, (C1-4)галоалкильной группы, (C1-4)алкоксигруппы, цианогруппы, нитрогруппы и атома галогена), пиридилзамещенную группу (C1-4)алкильную группу (в которой пиридильная составляющая может не обязательно быть замещенной одним или несколькими заместителями, выбранными из (C1-4)алкильной группы, (C1-4)галоалкильной группы, (C1-4)алкоксигруппы, цианогруппы, нитрогруппы и атома галогена), пиридильную группу (не обязательно замещенную одним или несколькими заместителями, выбранными из (C1-4)алкильной группы, (C1-4)галоалкильной группы, (C1-4)алкоксигруппы, цианогруппы, нитрогруппы и атома галогена), нафтильную группу, нафтилзамещенную (C1-4)алкильную группу, (C1-4)алкоксигруппу (с условием, что обе группы R4 и R5 не должны представлять собой алкоксигруппы), циано(C1-4)алкильную группу, (C1-4)алкилкарбонильную группу, (C1-4)алкоксикарбонильную группу, (C1-4) алкоксикарбонил (C1-4)алкильную группу или (C1-4) алкилсульфонилкарбонильную группу; R4 и R5 могут образовывать вместе с атомами азота, к которому они присоединяются, кольцо с числом членов от 3 до 9; кольцо может содержать один или несколько атомов кислорода, атомов серы, атомов азота, карбонильных групп, сульфонильных групп или ненасыщенных связей, кольцо может быть замещенным (C1-4) алкильной группой, (C1-4)алкоксигруппой, гидроксильной группой, атомом галогена, (C1-4)галоалкильной группой, (C1-4)алкоксикарбонильной группой, фенильной группой или бензильной группой, кольцо может быть соединено поперечной связью с (C1-4)алкиленовой группой и кольцо может быть конденсировано с бензольным кольцом. Примеры заместителей R1, R2, R3, R4 и R5 в соединениях, отвечающих настоящему изобретению, упоминаются ниже, определения сокращенных выражений, использованных в примерах, следующие: Me: methyl group метильная группа, Et: ethyl group этильная группа, Pr-n: normal propyl group н-пропильная группа, Pr-iso: isopropyl group изопропильная группа, Bu-n: normal butyl group н-бутильная группа, Bu-iso: isobutyl group -изобутильная группа, Nu-sec: secondary butyl group втор-бутильная группа, Bu-tertiary butyl group трет-бутильная группа, Pen-n: normal pentyl group н-пентильная группа, Hex-n: normal hexyl group н-гексильная группа, Pr-cyc: cyclopropyl group циклопропильная группа, Bu-cyc: cyclobutyl group циклобутильная группа, Pen-cycl: cylopentyl group циклопентильная группа, Hex-cyc: cyclohexyl group циклогексильная группа, Ph: phenyl group фенильная группа, Py: pyridyl group пиридильная группа, Naph: naphthyl group нафтильная группа. Примерами заместителя R1 в соединениях, отвечающих настоящему изобретению, являются: H, Me, Bt, Pr-n, Pr-iso, Bu-n, Bu-iso, Bu-sec, Bu-tert, Pen-n, Hex-iso, Pr-cyc, Bu-cyc, Pen-cyc, Hex-cyc, CH2CH= CH2, CH2CH=CHMe, CH2CH2CH=CH2, в которой R1 представляет собой атом водорода, (C1-6) алкильную группу, (C3-6) циклоалкильную группу; (C2-4) алкенильную группу, (C2-4) алкинильную группу, (C3-6) циклоалкилзамещенную (C1-2)алкильную группу, (C1-4) галоалкильную группу, ди(C1-4)алкильную группу, (C1-4)алкокси (C1-4)алкильную группу, (C1-4)алкилтио(C1-4)алкильную группу, (C1-4)алкилсульфинил-(C1-4)алкильную группу, (C1-4)алкилсульфонил(C1-4)алкильную группу, фенилзамещенную (C1-4)алкильную группу, фенильную группу (не обязательно замещенную одним или несколькими заместителями, выбранными из (C1-4)алкильной группы, (C1-4)галоалкильной группы, (C1-4)алкоксигруппы, цианогруппы, нитрогруппы и атома галогена), (C1-4)алкоксигруппу, (C1-4)галоалкоксигруппу, бензилоксигруппу, (C1-4)алкилтиогруппу, бензилтиогруппу, (C1-4) -алкилсульфинильную группу, (C1-4)алкилсульфонильную группу, ди(С1-4)алкилсульфамоильную группу, цианогруппу, атом галогена, ди(С1-4)алкиламиногруппу или нитрогруппу; R2 представляет собой атом водорода, (C1-6)алкильную группу, (C3-6)циклоалкильную группу, (C2-4)алкенильную группу, (C2-4)алкинильную группу, (C3-6)циклоалкилзамещенную (C1-2)алкильную группу, (C1-4)галоалкильную группу, (C1-4)алкилкарбонил (C1-4)алкильную группу, (C1-4)алкоксикарбонильную (C1-4)алкильную группу, ди(C1-4)алкиламино(C1-4) алкильную группу, (C1-4)алкокси(C1-4)алкильную группу, (C1-4)алкокси (C1-4)алкокси (C1-4)алкильную группу, (C1-4)алкилтио (C1-4)алкильную группу, (C1-4)алкилсульфинил(C1-4)алкильную группу, (C1-4)алкилсульфонил(C1-4)алкильную группу, фенилзамещенную (C1-4)алкильную группу, фенильную группу (не обязательно замещенную одним или несколькими заместителями, выбранными из (C1-4)алкильной группы, (C1-4)галоалкильной группы, (C1-4)алкоксигруппы, цианогруппы, нитрогруппы и атома галогена), нафтильную группу, пиридильную группу (не обязательно замещенную одним или несколькими заместителями, выбранными из (C1-4)алкильной группы, (C1-4)галоалкильной группы, (C1-4)алкоксигруппы, цианогруппы, нитрогруппы и атома галогена), (C1-4)алкилкарбонильную группу, (C1-4)алкиламинокарбонильную группу, ди(C1-4) алкиламинокарбонильную группу, (C1-4)алкоксикарбонильную группу, (C1-4)алкилсульфонильную группу или ди(C1-4)алкилсульфамоильную группу; R3 представляет собой атом водорода, (C1-6)алкильную группу, (C3-6)циклоалкильную группу, (C2-4)алкенильную группу, (C2-4)алкинильную группу, фенильную группу (не обязательно замещенную одним или несколькими заместителями, выбранными из (C1-4)алкильной группы, (C1-4)галоалкильной группы, (C1-4)алкоксигруппы, цианогруппы, нитрогруппы и атома галогена), цианогруппу, атом галогена или нитрогруппу; R4 и R5 независимо представляют собой атом водорода, (C1-6)алкильную группу, (C3-6)циклоалкильную группу, (C2-4)алкенильную группу, (C2-4)алкинильную группу, (C3-6)циклоалкилзамещенную (C1-2)алкильную группу, (C1-4)алкокси (C1-4)алкильную группу, (C1-4)алкоксикарбонильную, фенилзамещенную (C1-4)алкильную группу (у которой фенильная составляющая может не обязательно бытьзамещенной одним или несколькими заместителями, выбранными из (C1-4)алкильной группы, (C1-4)галоалкильной группы, (C1-4)алкоксигруппы, цианогруппы, нитрогруппы и атома галогена), фенильную группу (не обязательно замещенную одним или несколькими заместителями, выбранными из (C1-4)алкильной группы, (C1-4)галоалкильной группы, (C1-4)алкоксигруппы, цианогруппы, нитрогруппы и атома галогена), пиридилзамещенную группу (C1-4)алкильную группу (в которой пиридильная составляющая может не обязательно быть замещенной одним или несколькими заместителями, выбранными из (C1-4)алкильной группы, (C1-4)галоалкильной группы, (C1-4)алкоксигруппы, цианогруппы, нитрогруппы и атома галогена), пиридильную группу (не обязательно замещенную одним или несколькими заместителями, выбранными из (C1-4)алкильной группы, (C1-4)галоалкильной группы, (C1-4)алкоксигруппы, цианогруппы, нитрогруппы и атома галогена), нафтильную группу, нафтилзамещенную (C1-4)алкильную группу, (C1-4)алкоксигруппу (с условием, что обе группы R4 и R5 не должны представлять собой алкоксигруппы), циано(C1-4)алкильную группу, (C1-4)алкилкарбонильную группу, (C1-4)алкоксикарбонильную группу, (C1-4) алкоксикарбонил (C1-4)алкильную группу или (C1-4) алкилсульфонилкарбонильную группу; R4 и R5 могут образовывать вместе с атомами азота, к которому они присоединяются, кольцо с числом членов от 3 до 9; кольцо может содержать один или несколько атомов кислорода, атомов серы, атомов азота, карбонильных групп, сульфонильных групп или ненасыщенных связей, кольцо может быть замещенным (C1-4) алкильной группой, (C1-4)алкоксигруппой, гидроксильной группой, атомом галогена, (C1-4)галоалкильной группой, (C1-4)алкоксикарбонильной группой, фенильной группой или бензильной группой, кольцо может быть соединено поперечной связью с (C1-4)алкиленовой группой и кольцо может быть конденсировано с бензольным кольцом. Примеры заместителей R1, R2, R3, R4 и R5 в соединениях, отвечающих настоящему изобретению, упоминаются ниже, определения сокращенных выражений, использованных в примерах, следующие: Me: methyl group метильная группа, Et: ethyl group этильная группа, Pr-n: normal propyl group н-пропильная группа, Pr-iso: isopropyl group изопропильная группа, Bu-n: normal butyl group н-бутильная группа, Bu-iso: isobutyl group -изобутильная группа, Nu-sec: secondary butyl group втор-бутильная группа, Bu-tertiary butyl group трет-бутильная группа, Pen-n: normal pentyl group н-пентильная группа, Hex-n: normal hexyl group н-гексильная группа, Pr-cyc: cyclopropyl group циклопропильная группа, Bu-cyc: cyclobutyl group циклобутильная группа, Pen-cycl: cylopentyl group циклопентильная группа, Hex-cyc: cyclohexyl group циклогексильная группа, Ph: phenyl group фенильная группа, Py: pyridyl group пиридильная группа, Naph: naphthyl group нафтильная группа. Примерами заместителя R1 в соединениях, отвечающих настоящему изобретению, являются: H, Me, Bt, Pr-n, Pr-iso, Bu-n, Bu-iso, Bu-sec, Bu-tert, Pen-n, Hex-iso, Pr-cyc, Bu-cyc, Pen-cyc, Hex-cyc, CH2CH= CH2, CH2CH=CHMe, CH2CH2CH=CH2, 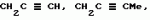 CH2Pr-cyc, CH2Bu-cyc, CH2Pen-cyc, CH2Hex-cyc, CH2CH2Pr-cyc, CH2F, CH2Cl, CH2Br, CH2I, CHF2, CHCl2, CHBr2, CF3, CCl3, CBr3, CClF2, CF3CH2, CF3CF2, CF3CF2CF2, ClCH2CH2CH2, ClCH2CH2CH2CH2, CH2NMe2, CH2NBt2, CH2N(Pr-n)2, CH2N(Pr-iso)2, CH2N(Bu-n)2, CH2CH2CH2CH2NMe2, CH2OMe, CH2OBt, CH2OPr-n, CH2OBu-n, CH2OBu-iso, CH2OBu-sec, CH2OBu-tert, CH2CH2OMe, CH2CH2OBt, CH2CH2OPr-n, CH2CH2CH2OMe, CH2CH2CH2OBt, CH2CH2CH2CH2OMe, CH2SMe, CH2SBt, CH2SPr-n, CH2SBu-n, CH2CH2CH2CH2SMe, CH2S(O)Me, CH2S(O)Bt, CH2S(O)Pr-n, CH2S(O)Bu-n, CH2CH2CH2CH2S(O)Me, CH2SO2Me, CH2SO2Bt, CH2SO2Pr-n, CH2SO2Bu-n, CH2CH2CH2CH2SO2Me, CH2Ph, CHMePh, CMe2Ph, Ph, 2-Cl-Ph, 3-Cl-Ph, 4-Cl-Ph, 2,4-Cl2Ph, 2-F-Ph, 3-F-Ph, 4-F-Ph, 2-F-4-Cl-Ph, 2-Br-Ph, 3-Br-Ph, 4-Br-Ph, 2-Me-Ph, 3-Me-Ph, 4-Me-Ph, 2,4-Me2-Ph, 2,6-Me2-Ph, 2-MeO-Ph, 3-Meo-Ph, 4-MeO-Ph, 2-CF3-Ph, 3-CF3-Ph, 4-CF3-Ph, 3,5-Cl2-Ph, 2,6-Cl2-Ph, 2,3-Cl2-Ph, 2,4,6-Cl3-Ph, 2,3,5-Cl3-Ph, 2,3,4-Cl3-Ph, 2-NO2-Ph, 2-CN-Ph, OMe, OBt, OPr-b, OPr-iso, OBu-n, OBu-iso, Obu-tert, OCH2F, OCBrF2, OCHF2, OCF3, OCH2CH2Cl, OCH2CH2CH2CHCl, OCH2Ph, SMe, SBt, SPr-n, SPr-iso, SBu-n, SBu-iso, SBu-tert, SCH2Ph, S(O)Me, S(O)Bt, S(O)Pr-n, S(O)Pr-iso, S(O)Bu-n, SO2Me, SO2Bt, SO2Pr-n, SO2Pr-iso, SO2Bu-n, SO2NMe2, SO2NBt2, SO2N(Pr-n)2, SO2N(Bu-n)2, CN, F, Cl, Br, I, NMe2, NBt2, N(Pr-n)2, N(Pr-iso)2, N(Bu-n)2, No2 Примерами заместителя R2 в соединениях, отвечающих настоящему изобретению, являются: H, Me, Bt, Pr-n, Pr-iso, Bu-n, Bu-iso, Bu-sec, Bu-tert, Pen-n, Hex-n, Pr-cyc, Bu-cyc, Pen-cyc, Hex-cyc, CH2CH= CH2, CH2CH=CHMe, CH2CH2CH=CH2, CH2Pr-cyc, CH2Bu-cyc, CH2Pen-cyc, CH2Hex-cyc, CH2CH2Pr-cyc, CH2F, CH2Cl, CH2Br, CH2I, CHF2, CHCl2, CHBr2, CF3, CCl3, CBr3, CClF2, CF3CH2, CF3CF2, CF3CF2CF2, ClCH2CH2CH2, ClCH2CH2CH2CH2, CH2NMe2, CH2NBt2, CH2N(Pr-n)2, CH2N(Pr-iso)2, CH2N(Bu-n)2, CH2CH2CH2CH2NMe2, CH2OMe, CH2OBt, CH2OPr-n, CH2OBu-n, CH2OBu-iso, CH2OBu-sec, CH2OBu-tert, CH2CH2OMe, CH2CH2OBt, CH2CH2OPr-n, CH2CH2CH2OMe, CH2CH2CH2OBt, CH2CH2CH2CH2OMe, CH2SMe, CH2SBt, CH2SPr-n, CH2SBu-n, CH2CH2CH2CH2SMe, CH2S(O)Me, CH2S(O)Bt, CH2S(O)Pr-n, CH2S(O)Bu-n, CH2CH2CH2CH2S(O)Me, CH2SO2Me, CH2SO2Bt, CH2SO2Pr-n, CH2SO2Bu-n, CH2CH2CH2CH2SO2Me, CH2Ph, CHMePh, CMe2Ph, Ph, 2-Cl-Ph, 3-Cl-Ph, 4-Cl-Ph, 2,4-Cl2Ph, 2-F-Ph, 3-F-Ph, 4-F-Ph, 2-F-4-Cl-Ph, 2-Br-Ph, 3-Br-Ph, 4-Br-Ph, 2-Me-Ph, 3-Me-Ph, 4-Me-Ph, 2,4-Me2-Ph, 2,6-Me2-Ph, 2-MeO-Ph, 3-Meo-Ph, 4-MeO-Ph, 2-CF3-Ph, 3-CF3-Ph, 4-CF3-Ph, 3,5-Cl2-Ph, 2,6-Cl2-Ph, 2,3-Cl2-Ph, 2,4,6-Cl3-Ph, 2,3,5-Cl3-Ph, 2,3,4-Cl3-Ph, 2-NO2-Ph, 2-CN-Ph, OMe, OBt, OPr-b, OPr-iso, OBu-n, OBu-iso, Obu-tert, OCH2F, OCBrF2, OCHF2, OCF3, OCH2CH2Cl, OCH2CH2CH2CHCl, OCH2Ph, SMe, SBt, SPr-n, SPr-iso, SBu-n, SBu-iso, SBu-tert, SCH2Ph, S(O)Me, S(O)Bt, S(O)Pr-n, S(O)Pr-iso, S(O)Bu-n, SO2Me, SO2Bt, SO2Pr-n, SO2Pr-iso, SO2Bu-n, SO2NMe2, SO2NBt2, SO2N(Pr-n)2, SO2N(Bu-n)2, CN, F, Cl, Br, I, NMe2, NBt2, N(Pr-n)2, N(Pr-iso)2, N(Bu-n)2, No2 Примерами заместителя R2 в соединениях, отвечающих настоящему изобретению, являются: H, Me, Bt, Pr-n, Pr-iso, Bu-n, Bu-iso, Bu-sec, Bu-tert, Pen-n, Hex-n, Pr-cyc, Bu-cyc, Pen-cyc, Hex-cyc, CH2CH= CH2, CH2CH=CHMe, CH2CH2CH=CH2, 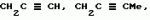 CH2Pr-cyc, CH2Bu-cyc, CH2Pen-cyc, CH2Hex-cyc, CH2CH2Pr-cyc, CH2F, CH2Cl, CH2Br, CH2I, CHF2, CHCl2, CHBr2, CF3, CCl3, CBr3, CClF2, CF3CH2, CF3CF2, CF3CF2CF2, ClCH2CH2CH2, ClCH2CH2CH2CH2, CH2COMe, CH2COBt, CH2COPr-n, CH2COPr-iso, CH2COBu-n, CHMeCOMe, CHMeCOBt, CHMeCOPr-n, CH2CH2CH2COMe, CH2CO2Me, CH2CO2Bt, CH2CO2Pr-n, CH2CO2Pr-iso, CH2CO2Bu-n, CHMeCO2Me, CHMeCO2Bt, CHMeCO2Pr-n, CH2CH2CH2CO2Me, CH2NMe2, CH2NBt2, CH2N(Pr-n)2, CH2N(Pr-iso)2, CH2N(Bu-n)2, CH2CH2CH2CH2NMe2, CH2OMe, CH2OBt, CH2OPr-n, CH2OBu-n, CH2OBu-iso, CH2OBu-sec, CH2OBu-tert, CH2CH2OMe, CH2CH2OBt, CH2CH2OPr-n, CH2CH2CH2OMe, CH2CH2CH2OBt, CH2CH2CH2CH2OMe, CH2OCH2CH2OMe, CH2OCH2CH2OBt, CH2SMe, CH2SBt, CH2SPr-n, CH2SBu-n, CH2CH2CH2CH2SMe, CH2S(O)Me, CH2S(O)Bt, CH2S(O)Pr-n, CH2S(O)Bu-n, CH2CH2CH2CH2S(O)Me, CH2SO2Me, CH2SO2Bt, CH2SO2Pr-n, CH2SO2Bu-n, CH2CH2CH2CH2SO2Me, CH2Ph, CHMePh, CMe2Ph, Ph, 2-Cl-Ph, 3-Cl-Ph, 4-Cl-Ph, 2,4-Cl2-Ph, 2-F-Ph, 3-F-Ph, 4-F-Ph, 2-F-4-Cl-Ph, 2-Br-Ph, 3-Br-Ph, 4-Br-Ph, 2-Me-Ph, 3-Me-Ph, 4-Me-Ph, 2,4-Me2-Ph, 2,6-Me2-Ph, 2-MeO-Ph, 3-MeO-Ph, 4-MeO-Ph, 2-CF3-Ph, 3-CF3-Ph, 4-CF3-Ph, 3,5-Cl2-Ph, 2,6-Cl2-Ph, 2,3-Cl2-Ph, 2,4,6-Cl3-Ph, 2,3,5-Cl3-Ph, 2,3,4-Cl3-Ph, 2-Cl-4-CF3-Ph, 2,6-Cl2-4-CF3-Ph, 2-NO2-Ph, 2-CN-Ph, 3-CN-Ph, 4-CN-Ph, 1-NaPh, 2-NaPh, COMe, COBt, COPr-n, COPr-iso, COBu-b, CONHMe, CONHBt, CONHPr-n, CONHPr-iso, CONHBu-n, CONMe2, CONBt2, CON(Pr-n)2, CON(Pr-iso)2, CON(Bu-n)2, CO2Me, CO2Bt, CO2Pr-n, CO2Pr-iso, CO2Bu-n, SO2Me, SO2Bt, SO2Pr-n, SO2Pr-iso, SO2Bu-nSO2NMe2, SO2NBt2, SO2N(Pr-n)2, SO2N(Bu-n)2, 2,5-Cl2-Ph, 3,4-Cl2-Ph, 2,4-(NO2)2-Ph, 3-NO2-Ph, 4-NO2-Ph, 2-Py, 3-Py, 4-Py, 3-Cl-2-Py, 4-Cl-2-Py, 5-Cl-2-Py, 6-Cl-2-Py, 3-F-2-Py, 4-F-2-Py, 5-F-2-Py, 6-F-2-Py, 3-Br-2-Py, 4-Br-2-Py, 5-Br-2-Py, 6-Br-2-Py, 3-CF3-2-Py, 4-CF3-2-Py, 5-CF3-2-Py, 6-CF3-2-Py, 3-Cl-5-CF3-2-Py, 3-Me-2-Py, 4-Me-2-Py, 5-Me-2-Py, 6-Me-2-Py, 3-NO2-2-Py, 4-NO2-2-Py, 5-NO2-2-Py, 6-NO2-2-Py, 3-Py, 4-Py, Примерами заместителя R3 в соединениях, отвечающих настоящему изобретению, являются: CN, F, Br, I, NO2, H, Me, Bt, Pr-n, Pr-iso, Bu-n, Bu-iso, Bu-sec, Bu-tert, Pen-n, Hex-n, Hex-iso, Pr-cyc, Bu-cyc, Pen-cyc, Hex-cyc, CH2CH=CH2, CH2CH= CHMe, CH2CH2CH=CH2, CH2Pr-cyc, CH2Bu-cyc, CH2Pen-cyc, CH2Hex-cyc, CH2CH2Pr-cyc, CH2F, CH2Cl, CH2Br, CH2I, CHF2, CHCl2, CHBr2, CF3, CCl3, CBr3, CClF2, CF3CH2, CF3CF2, CF3CF2CF2, ClCH2CH2CH2, ClCH2CH2CH2CH2, CH2COMe, CH2COBt, CH2COPr-n, CH2COPr-iso, CH2COBu-n, CHMeCOMe, CHMeCOBt, CHMeCOPr-n, CH2CH2CH2COMe, CH2CO2Me, CH2CO2Bt, CH2CO2Pr-n, CH2CO2Pr-iso, CH2CO2Bu-n, CHMeCO2Me, CHMeCO2Bt, CHMeCO2Pr-n, CH2CH2CH2CO2Me, CH2NMe2, CH2NBt2, CH2N(Pr-n)2, CH2N(Pr-iso)2, CH2N(Bu-n)2, CH2CH2CH2CH2NMe2, CH2OMe, CH2OBt, CH2OPr-n, CH2OBu-n, CH2OBu-iso, CH2OBu-sec, CH2OBu-tert, CH2CH2OMe, CH2CH2OBt, CH2CH2OPr-n, CH2CH2CH2OMe, CH2CH2CH2OBt, CH2CH2CH2CH2OMe, CH2OCH2CH2OMe, CH2OCH2CH2OBt, CH2SMe, CH2SBt, CH2SPr-n, CH2SBu-n, CH2CH2CH2CH2SMe, CH2S(O)Me, CH2S(O)Bt, CH2S(O)Pr-n, CH2S(O)Bu-n, CH2CH2CH2CH2S(O)Me, CH2SO2Me, CH2SO2Bt, CH2SO2Pr-n, CH2SO2Bu-n, CH2CH2CH2CH2SO2Me, CH2Ph, CHMePh, CMe2Ph, Ph, 2-Cl-Ph, 3-Cl-Ph, 4-Cl-Ph, 2,4-Cl2-Ph, 2-F-Ph, 3-F-Ph, 4-F-Ph, 2-F-4-Cl-Ph, 2-Br-Ph, 3-Br-Ph, 4-Br-Ph, 2-Me-Ph, 3-Me-Ph, 4-Me-Ph, 2,4-Me2-Ph, 2,6-Me2-Ph, 2-MeO-Ph, 3-MeO-Ph, 4-MeO-Ph, 2-CF3-Ph, 3-CF3-Ph, 4-CF3-Ph, 3,5-Cl2-Ph, 2,6-Cl2-Ph, 2,3-Cl2-Ph, 2,4,6-Cl3-Ph, 2,3,5-Cl3-Ph, 2,3,4-Cl3-Ph, 2-Cl-4-CF3-Ph, 2,6-Cl2-4-CF3-Ph, 2-NO2-Ph, 2-CN-Ph, 3-CN-Ph, 4-CN-Ph, 1-NaPh, 2-NaPh, COMe, COBt, COPr-n, COPr-iso, COBu-b, CONHMe, CONHBt, CONHPr-n, CONHPr-iso, CONHBu-n, CONMe2, CONBt2, CON(Pr-n)2, CON(Pr-iso)2, CON(Bu-n)2, CO2Me, CO2Bt, CO2Pr-n, CO2Pr-iso, CO2Bu-n, SO2Me, SO2Bt, SO2Pr-n, SO2Pr-iso, SO2Bu-nSO2NMe2, SO2NBt2, SO2N(Pr-n)2, SO2N(Bu-n)2, 2,5-Cl2-Ph, 3,4-Cl2-Ph, 2,4-(NO2)2-Ph, 3-NO2-Ph, 4-NO2-Ph, 2-Py, 3-Py, 4-Py, 3-Cl-2-Py, 4-Cl-2-Py, 5-Cl-2-Py, 6-Cl-2-Py, 3-F-2-Py, 4-F-2-Py, 5-F-2-Py, 6-F-2-Py, 3-Br-2-Py, 4-Br-2-Py, 5-Br-2-Py, 6-Br-2-Py, 3-CF3-2-Py, 4-CF3-2-Py, 5-CF3-2-Py, 6-CF3-2-Py, 3-Cl-5-CF3-2-Py, 3-Me-2-Py, 4-Me-2-Py, 5-Me-2-Py, 6-Me-2-Py, 3-NO2-2-Py, 4-NO2-2-Py, 5-NO2-2-Py, 6-NO2-2-Py, 3-Py, 4-Py, Примерами заместителя R3 в соединениях, отвечающих настоящему изобретению, являются: CN, F, Br, I, NO2, H, Me, Bt, Pr-n, Pr-iso, Bu-n, Bu-iso, Bu-sec, Bu-tert, Pen-n, Hex-n, Hex-iso, Pr-cyc, Bu-cyc, Pen-cyc, Hex-cyc, CH2CH=CH2, CH2CH= CHMe, CH2CH2CH=CH2, 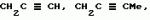 Ph, 2-Cl-Ph, 3-Cl-Ph, 4-Cl-Ph, 2,4-Cl2-Ph, 2-F-Ph, 3-F-Ph, 4-F-Ph, 2-F-4-Cl-Ph, 2-Br-Ph, 3-Br-Ph, 4-Br-Ph, 2-Me-Ph, 3-Me-Ph, 4-Me-Ph, 2,4-Me2-Ph, 2,6-Me2-Ph, 2-MeO-Ph, 3-MeO-Ph, 4-MeO-Ph, 2-CF3-Ph, 3-CF3-Ph, 4-CF3-Ph, 3,5-Cl2-Ph, 2,6-Cl2-Ph, 2,3-Cl2-Ph, 2,4,6-Cl3-Ph, 2,3,4-Cl3-Ph, 2-NO2-Ph, 2-CN-Ph Примерами заместителей R4 и R5 в соединениях, отвечающих настоящему изобретению, являются: H, Me, Bt, Pr-n, Pr-iso, Bu-n, Bu-iso, Bu-sec, Bu-tert, CHBeCHMe2, Pen-n, Hex-n, Hex-iso, Pr-cyc, Bu-cyc, Pen-cyc, Hex-cyc, CH2Pr-cyc, CH2Bu-cyc, CH2Pen-cyc, CH2Hex-cyc, CH2CH2Pr-cyc, CH2CH=CH2, CH2CH=CHMe, CH2CH2CH= CH2, Ph, 2-Cl-Ph, 3-Cl-Ph, 4-Cl-Ph, 2,4-Cl2-Ph, 2-F-Ph, 3-F-Ph, 4-F-Ph, 2-F-4-Cl-Ph, 2-Br-Ph, 3-Br-Ph, 4-Br-Ph, 2-Me-Ph, 3-Me-Ph, 4-Me-Ph, 2,4-Me2-Ph, 2,6-Me2-Ph, 2-MeO-Ph, 3-MeO-Ph, 4-MeO-Ph, 2-CF3-Ph, 3-CF3-Ph, 4-CF3-Ph, 3,5-Cl2-Ph, 2,6-Cl2-Ph, 2,3-Cl2-Ph, 2,4,6-Cl3-Ph, 2,3,4-Cl3-Ph, 2-NO2-Ph, 2-CN-Ph Примерами заместителей R4 и R5 в соединениях, отвечающих настоящему изобретению, являются: H, Me, Bt, Pr-n, Pr-iso, Bu-n, Bu-iso, Bu-sec, Bu-tert, CHBeCHMe2, Pen-n, Hex-n, Hex-iso, Pr-cyc, Bu-cyc, Pen-cyc, Hex-cyc, CH2Pr-cyc, CH2Bu-cyc, CH2Pen-cyc, CH2Hex-cyc, CH2CH2Pr-cyc, CH2CH=CH2, CH2CH=CHMe, CH2CH2CH= CH2, 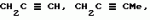 CH2OMe, CH2OBt, CH2OPr-n, CH2OBu-n, CH2OBu-iso, CH2OBu-sec, CH2OBu-tert, CH2CH2OMe, CH2CH2OBt, CH2CH2OPr-n, CH2CH2CH2OMe, CH2CH2CH2OBt, CH2CH2CH2CH2OMe, Ph, 2-Cl-Ph, 3-Cl-Ph, 4-Cl-Ph, 2,4-Cl2-Ph, 3,5-Cl2-Ph, 2,6-Cl2-Ph, 2,3-Cl2-Ph, 2,5-Cl2-Ph, 2-F-Ph, 3-F-Ph, 4-F-Ph, 2-F-4-Cl-Ph, 2-Br-Ph, 3-Br-Ph, 4-Br-Ph, 2-Me-Ph, 3-Me-Ph, 4-Me-Ph, 2,4-Me2-Ph, 3,5-Me2-Ph, 2,6-Me2-Ph, 2,3-Me2-Ph, 2,5-Me2-Ph, 2-MeO-Ph, 3-MeO-Ph, 4-MeO-Ph, 2-CF3-Ph, 3-CF3-Ph, 4-CF3-Ph, 2,4,6-Cl3-Ph, 2,3,5-Cl3-Ph, 2,3,4-Cl3-Ph, 2-NO2-Ph, 2-CN-Ph, CH2Ph, OMe, OBt, OPr-n, OPr-iso, OBu-n, OBu-iso, OBu-tert, SO2Me, SO2Bt, SO2Pr-n, SO2Pr-iso, SO2Bu-n, COMe, COBt, COPr-n, COPr-iso, COBu-n, CO2Me, CO2Bt, CO2Pr-n, CO2Pr-iso, CO2Bu-n, CH2CO2Me, CH2CO2Bt, CH2CO2Pr-n, CH2CO2Bu-n, CHMeCO2Me, CHMeCO2Bt, CH2CH2CO2Me, CH2CH2CH2CO2Me, CH2CH2CH2CH2CO2Me, CH(Pr-iso)CO2Me, CH(Bu-sec)CO2Me, CH(Bu-iso)CO2Me, CH(CH2Ph)CO2Me, CH2CH2CN, 1-Naph, 2-Naph, CH2-1-Naph, CH2-2-Naph, CH2Ph, CHMePh, CMe2Ph, CH2-2-Cl-Ph, CH2-3-Cl-Ph, CH2-4-Cl-Ph, 2-Py, 6-MeO-2-Py, 6-Cl-2-Py, 6-F-2-Py, 5-CF3-2-Py, 3-Cl-5-CF3-2-Py, 3-Py, 4-Py, CH2-5-Cl-2-Py, CH2-6-Cl-3-Py. Примеры насыщенных 5-членных-7-членных колец, которые должны образовываться заместителями R4 и R5 с участием атома азота, к которому они присоединяются в соединениях, отвечающих настоящему изобретению: Соединения, отвечающие настоящему изобретению, могут быть легко получены по какой-либо из следующих реакционных схем 1 4. Реакционная схема 1: CH2OMe, CH2OBt, CH2OPr-n, CH2OBu-n, CH2OBu-iso, CH2OBu-sec, CH2OBu-tert, CH2CH2OMe, CH2CH2OBt, CH2CH2OPr-n, CH2CH2CH2OMe, CH2CH2CH2OBt, CH2CH2CH2CH2OMe, Ph, 2-Cl-Ph, 3-Cl-Ph, 4-Cl-Ph, 2,4-Cl2-Ph, 3,5-Cl2-Ph, 2,6-Cl2-Ph, 2,3-Cl2-Ph, 2,5-Cl2-Ph, 2-F-Ph, 3-F-Ph, 4-F-Ph, 2-F-4-Cl-Ph, 2-Br-Ph, 3-Br-Ph, 4-Br-Ph, 2-Me-Ph, 3-Me-Ph, 4-Me-Ph, 2,4-Me2-Ph, 3,5-Me2-Ph, 2,6-Me2-Ph, 2,3-Me2-Ph, 2,5-Me2-Ph, 2-MeO-Ph, 3-MeO-Ph, 4-MeO-Ph, 2-CF3-Ph, 3-CF3-Ph, 4-CF3-Ph, 2,4,6-Cl3-Ph, 2,3,5-Cl3-Ph, 2,3,4-Cl3-Ph, 2-NO2-Ph, 2-CN-Ph, CH2Ph, OMe, OBt, OPr-n, OPr-iso, OBu-n, OBu-iso, OBu-tert, SO2Me, SO2Bt, SO2Pr-n, SO2Pr-iso, SO2Bu-n, COMe, COBt, COPr-n, COPr-iso, COBu-n, CO2Me, CO2Bt, CO2Pr-n, CO2Pr-iso, CO2Bu-n, CH2CO2Me, CH2CO2Bt, CH2CO2Pr-n, CH2CO2Bu-n, CHMeCO2Me, CHMeCO2Bt, CH2CH2CO2Me, CH2CH2CH2CO2Me, CH2CH2CH2CH2CO2Me, CH(Pr-iso)CO2Me, CH(Bu-sec)CO2Me, CH(Bu-iso)CO2Me, CH(CH2Ph)CO2Me, CH2CH2CN, 1-Naph, 2-Naph, CH2-1-Naph, CH2-2-Naph, CH2Ph, CHMePh, CMe2Ph, CH2-2-Cl-Ph, CH2-3-Cl-Ph, CH2-4-Cl-Ph, 2-Py, 6-MeO-2-Py, 6-Cl-2-Py, 6-F-2-Py, 5-CF3-2-Py, 3-Cl-5-CF3-2-Py, 3-Py, 4-Py, CH2-5-Cl-2-Py, CH2-6-Cl-3-Py. Примеры насыщенных 5-членных-7-членных колец, которые должны образовываться заместителями R4 и R5 с участием атома азота, к которому они присоединяются в соединениях, отвечающих настоящему изобретению: Соединения, отвечающие настоящему изобретению, могут быть легко получены по какой-либо из следующих реакционных схем 1 4. Реакционная схема 1: 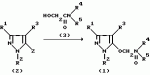 в которой R1, R2, R3, R4 и R5 являются такими же, что и указанные выше, Z представляет собой атом галогена. Говоря точнее, 5-галогенопиразол (2) взаимодействует с амидом гликолевой кислоты (3) в присутствии основания, в результате чего получается соединение (1), отвечающее настоящему изобретению. В качестве основания могут быть использованы неорганические основания, такие как гидроксид натрия, гидроксид калия, карбонат калия, гидрид натрия и т. д. или органические основания, такие как пиридин, триэтиламин, дибутилмочевина и т.д. Эта реакция может протекать даже при отсутствии растворителя; однако она может быть при желании проведена и в присутствии растворителя. Растворитель, пригодный для использования в реакции, не является специфическим; важно лишь, чтобы он был инертным в отношении реакции. В качестве приемлемых растворителей можно, например, назвать алифатические или ароматические углеводороды, такие как гексан, циклогексан, бензол, толуол и т.д. простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран и т.д. кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон и т.д. нитрилы, такие как ацетонитрил, пропионитрил и т.д. амиды кислот, такие как диметилформамид, диметилацетамид и т.д. сульфоны, такие как диметилсульфоксид, сульфоран и т.д. органические основания, такие как пиридин и т.д. Температура взаимодействия может быть без ограничений выбрана в области от -50 до 150oC; однако желательно, чтобы температура находилась в пределах 0 60oC. Реакционная схема 2: в которой R1, R2, R3, R4 и R5 являются такими же, что и указанные выше, Z представляет собой атом галогена. Говоря точнее, 5-галогенопиразол (2) взаимодействует с амидом гликолевой кислоты (3) в присутствии основания, в результате чего получается соединение (1), отвечающее настоящему изобретению. В качестве основания могут быть использованы неорганические основания, такие как гидроксид натрия, гидроксид калия, карбонат калия, гидрид натрия и т. д. или органические основания, такие как пиридин, триэтиламин, дибутилмочевина и т.д. Эта реакция может протекать даже при отсутствии растворителя; однако она может быть при желании проведена и в присутствии растворителя. Растворитель, пригодный для использования в реакции, не является специфическим; важно лишь, чтобы он был инертным в отношении реакции. В качестве приемлемых растворителей можно, например, назвать алифатические или ароматические углеводороды, такие как гексан, циклогексан, бензол, толуол и т.д. простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран и т.д. кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон и т.д. нитрилы, такие как ацетонитрил, пропионитрил и т.д. амиды кислот, такие как диметилформамид, диметилацетамид и т.д. сульфоны, такие как диметилсульфоксид, сульфоран и т.д. органические основания, такие как пиридин и т.д. Температура взаимодействия может быть без ограничений выбрана в области от -50 до 150oC; однако желательно, чтобы температура находилась в пределах 0 60oC. Реакционная схема 2: 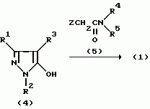 , в которой R1, R2, R3, R4 и R5 являются такими же, что и ранее. Говоря точнее, 5-гидроксипиразол (4) взаимодействует с галогенацетамидом (5) в присутствии основания, в результате чего получается соединение (I), отвечающее настоящему изобретению. В качестве основания и растворителя следует использовать те же вещества, что и упоминавшиеся в случае реакционной схемы 1. Температура взаимодействия может быть без ограничений в области от -50 до 150oC; однако желательно, чтобы температура находилась в пределах от 0 до 100oC. Реакционная схема 3: , в которой R1, R2, R3, R4 и R5 являются такими же, что и ранее. Говоря точнее, 5-гидроксипиразол (4) взаимодействует с галогенацетамидом (5) в присутствии основания, в результате чего получается соединение (I), отвечающее настоящему изобретению. В качестве основания и растворителя следует использовать те же вещества, что и упоминавшиеся в случае реакционной схемы 1. Температура взаимодействия может быть без ограничений в области от -50 до 150oC; однако желательно, чтобы температура находилась в пределах от 0 до 100oC. Реакционная схема 3: 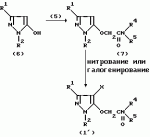 в которой R1, R2, R3, R4 и R5 являются такими же, что и ранее, группа X представляет собой нитрогруппу или атом галогена. Говоря точнее, 5-гидроксипиразол (6) взаимодействует с галогенацетамидом (5) в присутствии основания, в результате чего образуется амид пиразолгликолевой кислоты (7). Основание, растворитель и температура взаимодействия являются такими же, что и упоминавшиеся в случае реакционной схемы 1. Амид (7) затем обрабатывают нитрующим веществом, таким как кислота в виде смеси или ей подобным веществом, или электрофильным галогенирующим веществом, таким как хлор, бром, хлористый сульфил, N-хлорсукцинимид, N-бромсукцинимид и т.д. в результате чего получают соединение (1"), отвечающее настоящему изобретению. Реакционная схема 4: в которой R1, R2, R3, R4 и R5 являются такими же, что и ранее, группа X представляет собой нитрогруппу или атом галогена. Говоря точнее, 5-гидроксипиразол (6) взаимодействует с галогенацетамидом (5) в присутствии основания, в результате чего образуется амид пиразолгликолевой кислоты (7). Основание, растворитель и температура взаимодействия являются такими же, что и упоминавшиеся в случае реакционной схемы 1. Амид (7) затем обрабатывают нитрующим веществом, таким как кислота в виде смеси или ей подобным веществом, или электрофильным галогенирующим веществом, таким как хлор, бром, хлористый сульфил, N-хлорсукцинимид, N-бромсукцинимид и т.д. в результате чего получают соединение (1"), отвечающее настоящему изобретению. Реакционная схема 4: 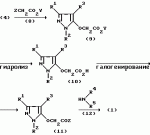 в которой R1, R2, R3, R4 и R5 и Z являются такими же, что и ранее и группа Y представляет собой (C1-6)алкильную группу или фенильную группу. Говоря точнее, 5-гидроксипиразол (4) взаимодействует с галогенацетатом (8) в присутствии основания, в результате чего получается пиразолгликолят (7). Основание, растворитель и температура взаимодействия являются такими же, что и упоминавшиеся в случае реакционной схемы 1. Сложный эфир (9) затем подвергают гидролизу и галогенированию, в результате чего получают хлорангидрид (11), который, взаимодействуя с амином (12), дает соединение (I), отвечающее настоящему изобретению. Касаясь исходных веществ, которые должны быть использованы в упомянутых выше реакциях, следует сказать, что 5-хлор-4-нитропиразолы (2, где Z представляет собой хлор) могут быть получены по американскому патенту N 3282954 (1966) и т. д. 5-бром-4-нитропиразолы (2, где Z представляет собой бром) могут быть получены по способу, описанному в Журнале органической химии (Journal of Organic Chemistry, Vol. 51, page 4656 (1986) и т.д. и 5-гидрокси-4-нитропиразолы (4) могут быть получены по способу, описанному в литературе (Chemiche Berichte, Vol. 74, page 1420 (1941) и т.д. Примеры получения соединений, отвечающих настоящему изобретению, приводятся ниже; они, однако, не направлены на ограничение рамок настоящего изобретения. Пример 1. 1. Получение 3,5-дихлор-1-метилпиразола в которой R1, R2, R3, R4 и R5 и Z являются такими же, что и ранее и группа Y представляет собой (C1-6)алкильную группу или фенильную группу. Говоря точнее, 5-гидроксипиразол (4) взаимодействует с галогенацетатом (8) в присутствии основания, в результате чего получается пиразолгликолят (7). Основание, растворитель и температура взаимодействия являются такими же, что и упоминавшиеся в случае реакционной схемы 1. Сложный эфир (9) затем подвергают гидролизу и галогенированию, в результате чего получают хлорангидрид (11), который, взаимодействуя с амином (12), дает соединение (I), отвечающее настоящему изобретению. Касаясь исходных веществ, которые должны быть использованы в упомянутых выше реакциях, следует сказать, что 5-хлор-4-нитропиразолы (2, где Z представляет собой хлор) могут быть получены по американскому патенту N 3282954 (1966) и т. д. 5-бром-4-нитропиразолы (2, где Z представляет собой бром) могут быть получены по способу, описанному в Журнале органической химии (Journal of Organic Chemistry, Vol. 51, page 4656 (1986) и т.д. и 5-гидрокси-4-нитропиразолы (4) могут быть получены по способу, описанному в литературе (Chemiche Berichte, Vol. 74, page 1420 (1941) и т.д. Примеры получения соединений, отвечающих настоящему изобретению, приводятся ниже; они, однако, не направлены на ограничение рамок настоящего изобретения. Пример 1. 1. Получение 3,5-дихлор-1-метилпиразола 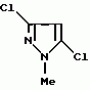 3,5-Дихлор-1-метилпиразол-4-карбоновую кислоту, взятую в количестве 113 г (0,58 моль), грели при 300oC и подвергали разгонке, в результате чего получали 51 г сырого маслянистого вещества, которое растворяли в 200 мл хлороформа и промывали водой. После удаления растворителя разгонкой получали 44 г требуемого продукта. Температура кипения этого продукта находилась в области от 172 до 173oC. 2. Получение 3,5-дихлор-1-метил-4-нитропиразола 3,5-Дихлор-1-метилпиразол-4-карбоновую кислоту, взятую в количестве 113 г (0,58 моль), грели при 300oC и подвергали разгонке, в результате чего получали 51 г сырого маслянистого вещества, которое растворяли в 200 мл хлороформа и промывали водой. После удаления растворителя разгонкой получали 44 г требуемого продукта. Температура кипения этого продукта находилась в области от 172 до 173oC. 2. Получение 3,5-дихлор-1-метил-4-нитропиразола 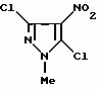 Раствор 8,5 г (56 моль) 3,5-дихлор-1-метилпиразола в уксусном ангидриде (15 мл) по каплям добавляли к смеси кислот, состоящей из 20 мл концентрированной серной кислоты и 6 г дымящей азотной кислоты, что делали при 20oC или более низкой температуре. После перемешивания в течение 48 ч при комнатной температуре смесь выливали в 300 мл воды со льдом, после чего фильтрованием отделяли осевшие кристаллы, промывали их водой и сушили, в результате чего получали 5,68 г требуемого продукта. Этот продукт обладал температурой плавления, находящейся в области от 34 до 88oC. 3. Получение N-метил-N-фенил-2-(3-хлор-1-метил-4-нитропиразол-5-илокси)ацетамида Раствор 8,5 г (56 моль) 3,5-дихлор-1-метилпиразола в уксусном ангидриде (15 мл) по каплям добавляли к смеси кислот, состоящей из 20 мл концентрированной серной кислоты и 6 г дымящей азотной кислоты, что делали при 20oC или более низкой температуре. После перемешивания в течение 48 ч при комнатной температуре смесь выливали в 300 мл воды со льдом, после чего фильтрованием отделяли осевшие кристаллы, промывали их водой и сушили, в результате чего получали 5,68 г требуемого продукта. Этот продукт обладал температурой плавления, находящейся в области от 34 до 88oC. 3. Получение N-метил-N-фенил-2-(3-хлор-1-метил-4-нитропиразол-5-илокси)ацетамида 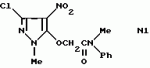 3,5-Дихлор-1-метил-4-нитропиразол, взятый в количестве 0,63 г (3,2 ммоль), и 0,53 г (3,2 ммоль) N-метил-N-фенил-гликолевокислого амида растворили в 5 мл диметилформамида, и к ним добавляли 0,18 г (3,2 ммоль) порошкообразного гидроксида калия. Затем эту смесь перемешивали в течение 0,5 ч при комнатной температуре, и к ней добавляли 20 мл воды. Эту смесь дважды экстрагировали бензолом, беря каждый раз по 20 мл, результирующий экстракт промывали водой и сушили над безводным сульфатом натрия. Затем растворитель удаляли дистилляцией. К результирующему остатку добавляли небольшое количество диизопропилового простого эфира, и осевшие кристаллы отделяли фильтрованием и сушили, в результате чего получали 0,7 г требуемого продукта. Его температура плавления находилась в области от 104 до 105oC. Пример 2. 1. Получение 3-трифторметил-1-метил-5-гидрокси-4-нитропиразола. 3,5-Дихлор-1-метил-4-нитропиразол, взятый в количестве 0,63 г (3,2 ммоль), и 0,53 г (3,2 ммоль) N-метил-N-фенил-гликолевокислого амида растворили в 5 мл диметилформамида, и к ним добавляли 0,18 г (3,2 ммоль) порошкообразного гидроксида калия. Затем эту смесь перемешивали в течение 0,5 ч при комнатной температуре, и к ней добавляли 20 мл воды. Эту смесь дважды экстрагировали бензолом, беря каждый раз по 20 мл, результирующий экстракт промывали водой и сушили над безводным сульфатом натрия. Затем растворитель удаляли дистилляцией. К результирующему остатку добавляли небольшое количество диизопропилового простого эфира, и осевшие кристаллы отделяли фильтрованием и сушили, в результате чего получали 0,7 г требуемого продукта. Его температура плавления находилась в области от 104 до 105oC. Пример 2. 1. Получение 3-трифторметил-1-метил-5-гидрокси-4-нитропиразола. 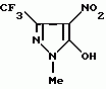 3-Трифторметил-1-метил-5-гидроксипиразол, взятый в количестве 10 г (60 ммоль), растворяли в 30 мл концентрированной серной кислоты, и в смесь по каплям добавляли 7 мл 60%-ной азотной кислоты, что делали при 10oC или более низкой температуре. После перемешивания в течение 2 ч при комнатной температуре смесь выливали в 300 мл воды со льдом, после чего фильтрованием отделяли осевшие кристаллы, промывали водой и сушили. Полученные таким способом кристаллы промывали смесью диизопропилового простого эфира и диэтилового простого эфира и сушили, в результате чего получали 5,5 г требуемого чистого продукта. Его температура плавления находилась в области от 93 до 94oC. 2. Получение N-метил-N-фенил-2-(3-трифторметил-1-метил-4-нитропиразол-5-илокси)ацетамида 3-Трифторметил-1-метил-5-гидроксипиразол, взятый в количестве 10 г (60 ммоль), растворяли в 30 мл концентрированной серной кислоты, и в смесь по каплям добавляли 7 мл 60%-ной азотной кислоты, что делали при 10oC или более низкой температуре. После перемешивания в течение 2 ч при комнатной температуре смесь выливали в 300 мл воды со льдом, после чего фильтрованием отделяли осевшие кристаллы, промывали водой и сушили. Полученные таким способом кристаллы промывали смесью диизопропилового простого эфира и диэтилового простого эфира и сушили, в результате чего получали 5,5 г требуемого чистого продукта. Его температура плавления находилась в области от 93 до 94oC. 2. Получение N-метил-N-фенил-2-(3-трифторметил-1-метил-4-нитропиразол-5-илокси)ацетамида 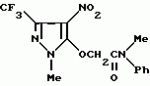 3-Трифторметил-1-метил-5-гидрокси-4-нитропиразол, взятый в количестве 1,0 г (4,7 ммоль), и 0,95 г (5,2 ммоль) N-метил-N-фенилхлорацетамида растворяли в 10 мл диметилформамида; в смесь добавляли 0,29 г (5,2 ммоль) порошкообразного гидроксида калия, и ее перемешивали в течение 5 ч при 80oC. После охлаждения смеси к ней добавляли 30 мл воды. Затем дважды проводили экстракцию бензолом, беря каждый раз по 30 мл. Результирующий экстракт промывали водой и обезвоживали над безводным сульфатом натрия. Растворитель удаляли дистилляцией, и получали маслянистый остаток. Остаток очищали препаративной высокопроизводительной жидкостной хроматографией, в результате чего получали 0,04 г требуемого вещества. Продукт представлял собой маслянистое вещество. Пример 3. Получение 2-[4-хлор-1-(2,5-дихлорфенил)-3-трифторметил-пиразол-5-илокси)ацетопиперидида 3-Трифторметил-1-метил-5-гидрокси-4-нитропиразол, взятый в количестве 1,0 г (4,7 ммоль), и 0,95 г (5,2 ммоль) N-метил-N-фенилхлорацетамида растворяли в 10 мл диметилформамида; в смесь добавляли 0,29 г (5,2 ммоль) порошкообразного гидроксида калия, и ее перемешивали в течение 5 ч при 80oC. После охлаждения смеси к ней добавляли 30 мл воды. Затем дважды проводили экстракцию бензолом, беря каждый раз по 30 мл. Результирующий экстракт промывали водой и обезвоживали над безводным сульфатом натрия. Растворитель удаляли дистилляцией, и получали маслянистый остаток. Остаток очищали препаративной высокопроизводительной жидкостной хроматографией, в результате чего получали 0,04 г требуемого вещества. Продукт представлял собой маслянистое вещество. Пример 3. Получение 2-[4-хлор-1-(2,5-дихлорфенил)-3-трифторметил-пиразол-5-илокси)ацетопиперидида 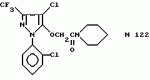 4-Хлор-1-(2,5-дихлорфенил)-3-трифторметил-5-гидроксипиразол, взятый в количестве 0,8 г (2,4 ммоль), и 0,56 г (2,2 ммоль) хлорацетпиперидида растворяли в 4 мл диметилформамида; в смесь добавляли 0,5 г (3,6 ммоль) карбоната калия, и ее перемешивали в течение 4 ч при 80oC. После охлаждения к смеси добавляли 50 мл воды. Затем дважды проводили экстракцию диэтиловым простым эфиром, беря каждый раз по 50 мл. Результирующий экстракт промывали водой и затем ненасыщенным солевым раствором, после этого обезвоживали над безводным сульфатом магния. Растворитель затем удаляли дистилляцией. Остаток очищали колонной хроматографией с использованием силикагеля (в качестве элюента применяли хлороформ), в результате чего получали 0,42 г требуемого продукта. Его температура плавления находилась в области от 61 до 62oC. Пример 4. 1. Получение 2-(3-трифторметилпиразол-5-илокси)ацетопиперидида 4-Хлор-1-(2,5-дихлорфенил)-3-трифторметил-5-гидроксипиразол, взятый в количестве 0,8 г (2,4 ммоль), и 0,56 г (2,2 ммоль) хлорацетпиперидида растворяли в 4 мл диметилформамида; в смесь добавляли 0,5 г (3,6 ммоль) карбоната калия, и ее перемешивали в течение 4 ч при 80oC. После охлаждения к смеси добавляли 50 мл воды. Затем дважды проводили экстракцию диэтиловым простым эфиром, беря каждый раз по 50 мл. Результирующий экстракт промывали водой и затем ненасыщенным солевым раствором, после этого обезвоживали над безводным сульфатом магния. Растворитель затем удаляли дистилляцией. Остаток очищали колонной хроматографией с использованием силикагеля (в качестве элюента применяли хлороформ), в результате чего получали 0,42 г требуемого продукта. Его температура плавления находилась в области от 61 до 62oC. Пример 4. 1. Получение 2-(3-трифторметилпиразол-5-илокси)ацетопиперидида 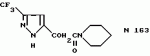 3-Трифторметил-5-гидроксипиразол, взятый в количестве 6,0 г (40 ммоль), и 6,4 г (39 ммоль) хлорацетопиперидида растворяли в 40 мл диметилформамида; в смесь добавляли 8,2 г (59 ммоль) карбоната калия, и ее перемешивали в течение 4 ч при комнатной температуре. После дополнительного перемешивания в течение 2 ч при 50oC смесь охлаждали. К смеси добавляли 200 мл воды, и дважды проводили экстракцию этилацетатом, беря каждый раз по 200 мл. Результирующий экстракт промывали насыщенным солевым раствором и обезвоживали безводным сульфатом магния. Затем растворитель удаляли дистилляцией. К остатку добавляли диэтиловый простой эфир, после чего осевшие кристаллы отделяли фильтрованием и сушили, в результате чего получали 3,6 г требуемого продукта. Его температура плавления находилась в области от 154 до 156oC. 2. Получение 2-(3-трифторметил-1-пропаргилпиразол-5-илокси)ацетопиперидида 3-Трифторметил-5-гидроксипиразол, взятый в количестве 6,0 г (40 ммоль), и 6,4 г (39 ммоль) хлорацетопиперидида растворяли в 40 мл диметилформамида; в смесь добавляли 8,2 г (59 ммоль) карбоната калия, и ее перемешивали в течение 4 ч при комнатной температуре. После дополнительного перемешивания в течение 2 ч при 50oC смесь охлаждали. К смеси добавляли 200 мл воды, и дважды проводили экстракцию этилацетатом, беря каждый раз по 200 мл. Результирующий экстракт промывали насыщенным солевым раствором и обезвоживали безводным сульфатом магния. Затем растворитель удаляли дистилляцией. К остатку добавляли диэтиловый простой эфир, после чего осевшие кристаллы отделяли фильтрованием и сушили, в результате чего получали 3,6 г требуемого продукта. Его температура плавления находилась в области от 154 до 156oC. 2. Получение 2-(3-трифторметил-1-пропаргилпиразол-5-илокси)ацетопиперидида 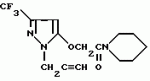 2-(3-Трифторметилпиразол-5-илокси)ацетопиперидид, взятый в количестве 0,8 г (2,9 ммоль), и 0,34 г (2,9 ммоль) бромистого пропаргила растворяли в 4 мл диметилформамида; в смесь добавляли 0,6 г (4,3 ммоль) карбоната калия, и ее перемешивали в течение 18 ч при комнатной температуре. К смеси добавляли 50 мл воды, и дважды проводили экстракцию диэтиловым простым эфиром, беря каждый раз по 50 мл. Результирующий экстракт промывали водой и затем насыщенным солевым раствором и обезвоживали безводным сульфатом магния. Затем растворитель удаляли дистилляцией. Остаток очищали хроматографией на колонке с силикагелем (с использованием хлороформа в качестве элюента), в результате чего получали 0,75 г смеси, состоящей из требуемого продукта и его изомера 2-(5-трифторметил-1-пропаргилпиразол-3-илокси)ацетопиперидида. В следующей стадии смесь использовали непосредственно как таковую. 3. Получение 2-(4-хлор-3-трифторметил-1-пропаргилпиразол-5-илокси)ацетопиперадида 2-(3-Трифторметилпиразол-5-илокси)ацетопиперидид, взятый в количестве 0,8 г (2,9 ммоль), и 0,34 г (2,9 ммоль) бромистого пропаргила растворяли в 4 мл диметилформамида; в смесь добавляли 0,6 г (4,3 ммоль) карбоната калия, и ее перемешивали в течение 18 ч при комнатной температуре. К смеси добавляли 50 мл воды, и дважды проводили экстракцию диэтиловым простым эфиром, беря каждый раз по 50 мл. Результирующий экстракт промывали водой и затем насыщенным солевым раствором и обезвоживали безводным сульфатом магния. Затем растворитель удаляли дистилляцией. Остаток очищали хроматографией на колонке с силикагелем (с использованием хлороформа в качестве элюента), в результате чего получали 0,75 г смеси, состоящей из требуемого продукта и его изомера 2-(5-трифторметил-1-пропаргилпиразол-3-илокси)ацетопиперидида. В следующей стадии смесь использовали непосредственно как таковую. 3. Получение 2-(4-хлор-3-трифторметил-1-пропаргилпиразол-5-илокси)ацетопиперадида 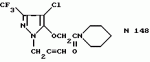 Смесь изомеров в количестве 0,75 г (2,4 ммоль), полученную на стадии (2), растворяли в 4 мл хлороформа, и к ней при 0oC по каплям добавляли хлористый сульфурил в количестве 0,19 г (1,4 ммоль). Затем смесь перемешивали в течение 2 ч при 0oC и к ней добавляли 20 мл воды со льдом. Затем дважды проводили экстракцию хлороформом, беря каждый раз по 20 мл. Результирующий экстракт промывали водным 10%-ным раствором бикарбоната натрия и после него насыщенным солевым раствором и обезвоживали безводным сульфатом магния. Затем растворитель удаляли дистилляцией. Остаток очищали тонкослойной хроматографией на силикагеле (при использовании смеси этилацетата с н-гексаном при соотношением 1:1 в качестве проявителя), в результате чего получали 0,35 г требуемого продукта. Его температура плавления находилась в области от 78 до 79oC. 2-(5-Трифторметил-1-пропаргилпиразол-3-илокси)ацетопиперидид, содержащийся в исходном материале, оставался непрореагировавшим, и его извлекали в виде маслянистого вещества в количестве 0,35 г. Пример 5. 1. Получение этил-2-(4-хлор-3-трифторметил-1-фенилпиразол-5-илокси)ацетата Смесь изомеров в количестве 0,75 г (2,4 ммоль), полученную на стадии (2), растворяли в 4 мл хлороформа, и к ней при 0oC по каплям добавляли хлористый сульфурил в количестве 0,19 г (1,4 ммоль). Затем смесь перемешивали в течение 2 ч при 0oC и к ней добавляли 20 мл воды со льдом. Затем дважды проводили экстракцию хлороформом, беря каждый раз по 20 мл. Результирующий экстракт промывали водным 10%-ным раствором бикарбоната натрия и после него насыщенным солевым раствором и обезвоживали безводным сульфатом магния. Затем растворитель удаляли дистилляцией. Остаток очищали тонкослойной хроматографией на силикагеле (при использовании смеси этилацетата с н-гексаном при соотношением 1:1 в качестве проявителя), в результате чего получали 0,35 г требуемого продукта. Его температура плавления находилась в области от 78 до 79oC. 2-(5-Трифторметил-1-пропаргилпиразол-3-илокси)ацетопиперидид, содержащийся в исходном материале, оставался непрореагировавшим, и его извлекали в виде маслянистого вещества в количестве 0,35 г. Пример 5. 1. Получение этил-2-(4-хлор-3-трифторметил-1-фенилпиразол-5-илокси)ацетата 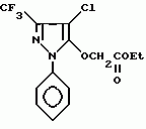 4-Хлор-3-трифторметил-5-гидрокси-1-фенилпиразол, взятый в количестве 28 г (107 ммоль), и 19,5 г (117 ммоль) этилбромацетата растворяли в 150 мл ацетонитрила; к смеси добавляли 28 г (203 ммоль) карбоната калия, и ее грели в сосуде с обратным холодильником в течение одного часа. После охлаждения твердое вещество отфильтровывали, и растворитель удаляли дистилляцией. Хлороформ в количестве 150 мл добавляли к остатку, который промывали водой и обезвоживали безводным сульфатом натрия. Затем растворитель удаляли дистилляцией, и получали 37 г требуемого продукта. Он представлял собой маслянистое вещество. 2. Получение 2-(4-хлор-3-трифторметил-1-фенилпиразол-5-илокси)уксусной кислоты 4-Хлор-3-трифторметил-5-гидрокси-1-фенилпиразол, взятый в количестве 28 г (107 ммоль), и 19,5 г (117 ммоль) этилбромацетата растворяли в 150 мл ацетонитрила; к смеси добавляли 28 г (203 ммоль) карбоната калия, и ее грели в сосуде с обратным холодильником в течение одного часа. После охлаждения твердое вещество отфильтровывали, и растворитель удаляли дистилляцией. Хлороформ в количестве 150 мл добавляли к остатку, который промывали водой и обезвоживали безводным сульфатом натрия. Затем растворитель удаляли дистилляцией, и получали 37 г требуемого продукта. Он представлял собой маслянистое вещество. 2. Получение 2-(4-хлор-3-трифторметил-1-фенилпиразол-5-илокси)уксусной кислоты 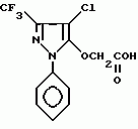 Этил-2-(4-хлор-3-трифторметил-1-фенилпиразол-5-илокси)ацетат, взятый в количестве 37 г (106 ммоль), растворяли в 100 мл этанола, и к смеси добавляли 40 мл водного раствора гидроксида натрия, взятого в количестве 8,5 г (213 ммоль). Затем смесь перемешивали в течение одного часа при комнатной температуре, растворитель удаляли дистилляцией, и остаток растворяли в 300 мл воды. Результирующий водный раствор промывали 100 мл бензола и затем подкисляли (pH 1) концентрированной хлористоводородной кислотой. Раствор трижды экстрагировали хлороформом, беря каждый раз по 100 мл, и результирующий экстракт промывали водой и обезвоживали безводным сульфатом натрия. Затем растворитель удаляли дистилляцией, и получали 33 г требуемого продукта. Его температура плавления находилась в области от 93 до 96oC. 3. Получение 2-(4-хлор-3-трифторметил-1-фенилпиразол-5-илокси)ацетилхлорида. Этил-2-(4-хлор-3-трифторметил-1-фенилпиразол-5-илокси)ацетат, взятый в количестве 37 г (106 ммоль), растворяли в 100 мл этанола, и к смеси добавляли 40 мл водного раствора гидроксида натрия, взятого в количестве 8,5 г (213 ммоль). Затем смесь перемешивали в течение одного часа при комнатной температуре, растворитель удаляли дистилляцией, и остаток растворяли в 300 мл воды. Результирующий водный раствор промывали 100 мл бензола и затем подкисляли (pH 1) концентрированной хлористоводородной кислотой. Раствор трижды экстрагировали хлороформом, беря каждый раз по 100 мл, и результирующий экстракт промывали водой и обезвоживали безводным сульфатом натрия. Затем растворитель удаляли дистилляцией, и получали 33 г требуемого продукта. Его температура плавления находилась в области от 93 до 96oC. 3. Получение 2-(4-хлор-3-трифторметил-1-фенилпиразол-5-илокси)ацетилхлорида. 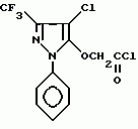 Хлористый тионил в количестве 80 мл добавляли к 23 г (72 ммоль) 2-(4-хлор-3-трифторметил-1-фенилпиразол-5-илокси)-уксусной кислоты и грели в сосуде с обратным холодильником в течение 1,5 ч. Хлористый тионил удаляли дистилляцией при пониженном давлении, и получали 24 г требуемого продукта. Он представлял собой маслянистое вещество. 4. Получение N, N-диаллил-2-(4-хлор-3-трифторметил-1-фенилпиразол-5-илокси)ацетамида Хлористый тионил в количестве 80 мл добавляли к 23 г (72 ммоль) 2-(4-хлор-3-трифторметил-1-фенилпиразол-5-илокси)-уксусной кислоты и грели в сосуде с обратным холодильником в течение 1,5 ч. Хлористый тионил удаляли дистилляцией при пониженном давлении, и получали 24 г требуемого продукта. Он представлял собой маслянистое вещество. 4. Получение N, N-диаллил-2-(4-хлор-3-трифторметил-1-фенилпиразол-5-илокси)ацетамида 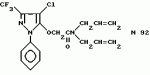 Диаллиламин в количестве 0,8 г (8,2 ммоль) растворяли в 10 мл тетрагидрофурана; к смеси добавляли 1,3 г (3,8 ммоль) хлористого 2-(4-хлор-3-трифторметил-1-фенилпиразол-5-илокси)-ацетила, и смесь перемешивали в течение одного часа при комнатной температуре. Реакционную смесь экстрагировали добавлением 50 мл воды, 100 мл хлороформа и нескольких капель концентрированной хлористоводородной кислоты. Хлороформный слой промывали водой и обезвоживали безводным сульфатом натрия. Затем растворитель удаляли дистилляцией. Остаток очищали хроматографией на колонке с силикагелем (при использовании хлороформа в качестве элюента), в результате чего получали 1,3 г требуемого продукта. Он представлял собой маслянистое вещество. Теми же способами, что и описанные в приведенных выше примерах, получали соединения, указанные в табл. 1, в которой структурные формулы и физические данные полученных соединений приводятся наряду с такими же характеристиками, отвечающими соединениям, полученным в приведенных выше примерах. Смысл символов, использованных в табл. 1, расшифрован ниже. Примеры соединений, отвечающих настоящему изобретению, приведены в табл. 2, 3 и 4 наряду с соединениями, полученными в приведенных выше примерах, что, однако, сделано не с целью ограничения рамок настоящего изобретения. Определения сокращений, использованных в таблицах, даны ниже. Me: methyl group метильная группа, Et: ethyl group этильная группа, Pr-n: normal propyl group н-пропильная группа, Pr-iso: isopropyl group изопропильная группа, Bu-n: normal butyl group н-бутильная группа, Bu-iso: isobutyl group -изобутильная группа, Nu-sec: secondary butyl group втор-бутильная группа, Bu-tertiary butyl group трет-бутильная группа, Pen-n: normal pentyl group н-пентильная группа, Hex-n: normal hexyl group н-гексильная группа, Pr-cyc: cyclopropyl group циклопропильная группа, Bu-cyc: cyclobutyl group циклобутильная группа, Pen-cycl: cylopentyl group циклопентильная группа, Hex-cyc: cyclohexyl group циклогексильная группа, Ph: phenyl group фенильная группа, Доза, с которой соединения, отвечающие настоящему изобретению, должны вводиться в сельскохозяйственные угодья и т.д. меняется в зависимости от места, где они должны быть применены, времени их применения, способа их применения, характера сорняков, которые должны быть уничтожены ими, и характера культурных растений, которые должны быть защищены от вредных сорняков, и т. д. В общем случае приемлемо вносить от 0,001 до 50 кг/га (гектар), предпочтительно от 0,01 до 10 кг/га в расчете на количество активного ингредиента. При желании соединения, отвечающие настоящему изобретению, могут быть объединены с другими гербицидами, различными инсектицидами, фунгицидами; стимуляторами роста растений, синергическими веществами и т.д. что делается в момент составления рецептур или применений. В частности, их желательно объединять с другими гербицидами, в результате чего может оказаться пониженной доза их использования, что может сопровождаться понижением стоимости гербицидных продуктов, содержащих их, и, кроме того, расширением их гербицидного спектра в силу существования синергического эффекта от воздействия добавленных химических веществ, в результате чего комбинированные продукты могут оказаться обладающими повышенным гербицидным эффектом. С целью получения таких комбинированных продуктов многие известные гербициды могут быть соединены с соединениями, отвечающими настоящему изобретению. В качестве гербицидов, которые могут быть соединены с соединениями, отвечающими настоящему изобретению, могут быть, например, упомянуты соединения, описанные в справочнике Farm Chemical Handbook (1990). В качестве химических веществ, которые желательно соединять с соединениями, отвечающими настоящему изобретению, могут быть, например, упомянуты пиразолсульфуронэтил (общее название), бензсульфуронметил (общее название), циносульфурон (общее название) и имазосульфурон (общее название). Дополнительно к ним следующие химические вещества могут быть также соединены с соединениями, отвечающими настоящему изобретению: претилахлор (общее название), экспрокарб (общее название), пиразолат (общее название), пиразоксифен (общее название), бензофенап (общее название), димрон (общее название), бромобутид (общее название), напроанилид (общее название), кломепроп (общее название), CNP (общее название), хлометоксинил (общее название), бифенокс (общее название), оксадиазон (общее название), мефенацет (общее название), бутахлор (общее название), бутенахлор (общее название), дитиопир (общее название), бенфуресат (общее название), пирибутикарб (общее название), бентиокарб (общее название), димепиперат (общее название), молинат (общее название), бутамифос (общее название), хинклорак (общее название), цинметилин (общее название), симетрин (общее название), SAP (бенсулид общее название), диметаметрин (общее название), МСРА, МСРВ, 2", 3"-дихлор-4-этоксиметоксибензанилид (HW-52 в качестве экспериментального названия), 1-(2-хлорбензил)-3-( Диаллиламин в количестве 0,8 г (8,2 ммоль) растворяли в 10 мл тетрагидрофурана; к смеси добавляли 1,3 г (3,8 ммоль) хлористого 2-(4-хлор-3-трифторметил-1-фенилпиразол-5-илокси)-ацетила, и смесь перемешивали в течение одного часа при комнатной температуре. Реакционную смесь экстрагировали добавлением 50 мл воды, 100 мл хлороформа и нескольких капель концентрированной хлористоводородной кислоты. Хлороформный слой промывали водой и обезвоживали безводным сульфатом натрия. Затем растворитель удаляли дистилляцией. Остаток очищали хроматографией на колонке с силикагелем (при использовании хлороформа в качестве элюента), в результате чего получали 1,3 г требуемого продукта. Он представлял собой маслянистое вещество. Теми же способами, что и описанные в приведенных выше примерах, получали соединения, указанные в табл. 1, в которой структурные формулы и физические данные полученных соединений приводятся наряду с такими же характеристиками, отвечающими соединениям, полученным в приведенных выше примерах. Смысл символов, использованных в табл. 1, расшифрован ниже. Примеры соединений, отвечающих настоящему изобретению, приведены в табл. 2, 3 и 4 наряду с соединениями, полученными в приведенных выше примерах, что, однако, сделано не с целью ограничения рамок настоящего изобретения. Определения сокращений, использованных в таблицах, даны ниже. Me: methyl group метильная группа, Et: ethyl group этильная группа, Pr-n: normal propyl group н-пропильная группа, Pr-iso: isopropyl group изопропильная группа, Bu-n: normal butyl group н-бутильная группа, Bu-iso: isobutyl group -изобутильная группа, Nu-sec: secondary butyl group втор-бутильная группа, Bu-tertiary butyl group трет-бутильная группа, Pen-n: normal pentyl group н-пентильная группа, Hex-n: normal hexyl group н-гексильная группа, Pr-cyc: cyclopropyl group циклопропильная группа, Bu-cyc: cyclobutyl group циклобутильная группа, Pen-cycl: cylopentyl group циклопентильная группа, Hex-cyc: cyclohexyl group циклогексильная группа, Ph: phenyl group фенильная группа, Доза, с которой соединения, отвечающие настоящему изобретению, должны вводиться в сельскохозяйственные угодья и т.д. меняется в зависимости от места, где они должны быть применены, времени их применения, способа их применения, характера сорняков, которые должны быть уничтожены ими, и характера культурных растений, которые должны быть защищены от вредных сорняков, и т. д. В общем случае приемлемо вносить от 0,001 до 50 кг/га (гектар), предпочтительно от 0,01 до 10 кг/га в расчете на количество активного ингредиента. При желании соединения, отвечающие настоящему изобретению, могут быть объединены с другими гербицидами, различными инсектицидами, фунгицидами; стимуляторами роста растений, синергическими веществами и т.д. что делается в момент составления рецептур или применений. В частности, их желательно объединять с другими гербицидами, в результате чего может оказаться пониженной доза их использования, что может сопровождаться понижением стоимости гербицидных продуктов, содержащих их, и, кроме того, расширением их гербицидного спектра в силу существования синергического эффекта от воздействия добавленных химических веществ, в результате чего комбинированные продукты могут оказаться обладающими повышенным гербицидным эффектом. С целью получения таких комбинированных продуктов многие известные гербициды могут быть соединены с соединениями, отвечающими настоящему изобретению. В качестве гербицидов, которые могут быть соединены с соединениями, отвечающими настоящему изобретению, могут быть, например, упомянуты соединения, описанные в справочнике Farm Chemical Handbook (1990). В качестве химических веществ, которые желательно соединять с соединениями, отвечающими настоящему изобретению, могут быть, например, упомянуты пиразолсульфуронэтил (общее название), бензсульфуронметил (общее название), циносульфурон (общее название) и имазосульфурон (общее название). Дополнительно к ним следующие химические вещества могут быть также соединены с соединениями, отвечающими настоящему изобретению: претилахлор (общее название), экспрокарб (общее название), пиразолат (общее название), пиразоксифен (общее название), бензофенап (общее название), димрон (общее название), бромобутид (общее название), напроанилид (общее название), кломепроп (общее название), CNP (общее название), хлометоксинил (общее название), бифенокс (общее название), оксадиазон (общее название), мефенацет (общее название), бутахлор (общее название), бутенахлор (общее название), дитиопир (общее название), бенфуресат (общее название), пирибутикарб (общее название), бентиокарб (общее название), димепиперат (общее название), молинат (общее название), бутамифос (общее название), хинклорак (общее название), цинметилин (общее название), симетрин (общее название), SAP (бенсулид общее название), диметаметрин (общее название), МСРА, МСРВ, 2", 3"-дихлор-4-этоксиметоксибензанилид (HW-52 в качестве экспериментального названия), 1-(2-хлорбензил)-3-(  , , -диметилбензил)мочевина (JC-940 в качестве экспериментального названия), N-[2"-(3"-метокси)тиенил-метил]-N-хлорацетил-2,6-диметиланилид (NSK-850 в качестве экспериментального названия) и т.д. При использовании соединений, отвечающих настоящему изобретению, в качестве гербицида они в общем случае могут быть смешаны с приемлемыми носителями, например твердыми носителями, такими как глина, тальк, бентонит, диатомовая земля, белая сажа и т.д. или жидкими носителями, такими как вода, спирты (например, изопропанол, бутанол, бензиловый спирт, фурфуриловый спирт и т.д.), ароматические углеводороды (например, толуол, ксилол и т.д.), простые эфиры (например, анизол и т.д.), кетоны (например, циклогексанон, изофорон и т. д.), сложные эфиры (например, бутилацетат и т.д.), амиды кислот (например, N-метилпирролидон и т. д. ) или галогенированные углеводороды (например, хлорбензол и т.д.). При желании они могут быть приготовлены в виде различных составов практического назначения, включая жидкий состав, концентрат эмульсии, смачивающийся порошок, сухой текучий порошок, текучую жидкость, дуст, гранулы и т.д. куда при желании могут быть добавлены поверхностно-активное вещество, эмульгатор, диспергирующее вещество, промотор проницания, промотор клейкости, антифриз, противослеживатель, стабилизатор и т. д. При использовании соединений, отвечающих настоящему изобретению, для создания гербицидных гранул, предназначенных для применения на рисовых полях, могут быть, например, использованы каолинит, монтмориллонит, диатомовая земля, бентонит, тальк, глина, карбонат кальция, сульфат кальция, сульфат аммония и т.д. в качестве твердых носителей и алкилбензолсульфонаты, полиоксиэтиленовые алкиларильные простые эфиры, лигнин-сульфонаты, алкилсульфосукцинаты, полиоксиэтиленовые сложные эфиры жирных кислот, нафталинсульфонаты, полиоксиэтиленалкиларильные сульфаты простых эфиров, алкиламиновые соли, триполифосфаты и т.д. в качестве поверхностно-активных веществ. Содержание этих поверхностно-активных веществ в гербицидных гранулах специально не оговаривается; однако в общем случае желательно, чтобы их содержалось от 0,05 до 20 мас. ч. на 100 мас. ч. гранул. При желании гранулы могут содержать ингибитор разложения, такой как эпоксидированное соевое масло и т.д. Ниже приведены примеры рецептур гербицидных продуктов, содержащих соединения, отвечающие настоящему изобретению, которые, однако, не носят ограничительный характер. Смачивающийся порошок, мас. ч: Соединение этого изобретения от 5 до 80 Твердый носитель от 10 до 85 Поверхностно-активное вещество от 1 до 10 Другие вещества от 1 до 5 В качестве других веществ может, например, быть упоминавшийся противослеживатель и т.д. Концентрат эмульсии, мас. ч: Соединение этого изобретения от 1 до 30 Жидкий носитель от 30 до 95 Поверхностно-активное вещество от 5 до 15 Текучая жидкость мас. ч: Соединение этого изобретения от 5 до 70 Жидкий носитель от 15 до 65 Поверхностно-активное вещество от 5 до 12 Другие вещества от 5 до 30 В качестве других веществ могут, например, быть антифриз, промотор клейкости и т.д. Гранулированный смачивающийся порошок (сухой текучий порошок), мас. ч: Соединение этого изобретения от 20 до 90 Твердый носитель от 10 до 60 Поверхностно-активное вещество от 1 до 20 Гранулы, мас. ч: Соединение этого изобретения от 0,1 до 10 Твердый носитель от 90 до 99,9 Другие вещества от 1 до 5 Рецептурный пример 1: смачиваемый порошок, мас. ч: Соединение N 1 этого изобретения 20 Циклит A (коалиновая глина, торговое название фирмы "Циклит Ко".) 76 Сорпол 5039 (смесь неионного поверхностно-активного вещества и анионного поверхностно-активного вещества, торговое название фирмы "Тохо кемикал Ко".) 2 Карплекс (противослеживатель) (белая сажа, торговое название фирмы "Сийоноги фармацевтикал Ко."). 2 Указанные выше компоненты гомогенно смешивали и измельчали в порошок, в результате чего получали смачиваемый порошок. Рецептурный пример 2: смачивающийся порошок,мас. ч. Соединение N 1 этого изобретения 40 Циклит A 54 Сорпол 5039 2 ч Карплекс (противослеживатель) 4 ч Указанные выше компоненты гомогенно смешивали и измельчали в порошок, в результате чего получали смачиваемый порошок. Рецептурный пример 3: эмульгируемый концентрат. мас. ч: Соединение N 1 этого изобретения 5 Ксилол 75 Диметилформамид 15 Сорпол 2680 5 Указанные выше компоненты гомогенно смешивали, в результате чего получали эмульсию. Рецептурный пример 4: текучая жидкость, мас. ч: Соединение N 1 этого изобретения 25 Агризол S-710 (неионное поверхностно-активное вещество, торговое название фирмы "Каох Ко.") 10 Рунокс 1000С (анионное поверхностно-активного вещество, торговое название фирмы "Тохо Кемикал Ко.") 0,53 Водный 1%-ный родопол (промотор, торговое название фирмы "Роне-Пулени Ко.") 20 Вода 44,5 Указанные выше компоненты гомогенно перемешивали, в результате чего получали текучую жидкость. Рецептурный пример 5: текучая жидкость, мас. ч: Соединение N 1 этого изобретения 40 Агризол S-710 10 Рунокс 1000С 0,5 Водный 1%-ный раствор родопола 20 Вода 29,5 Указанные выше компоненты гомогенно перемешивали, в результате чего получали текучую жидкость. Рецептурный пример 6: гранулированный смачивающийся порошок (сухой текучий порошок), мас. ч: Соединение N 1 этого изобретения 75 Изобам N 1 (анионное поверхностно-активное вещество, торговое название фирмы "Курагаи изопрен кемикал Ко.") 10 Ванилекс N (анионное поверхностно-активное вещество, торговое название фирмы "Санио Кокусаку палп Ко.") 5 Карплекс N 80 10 ч. Указанные выше компоненты гомогенно перемешивали и превращали в токодисперсный порошок, в результате чего получали текучий порошок. Рецептурный пример 7: гранулы, мас. ч: Соединение N 1 этого изобретения 1 Бентонит 55 Тальк 44 Указанные выше компоненты смешивали и превращали в порошок, туда добавляли небольшое количество воды, перемешивали, дополнительно смешивали и месили. Используя гранулятор, смесь гранулировали и сушили, в результате чего получали гранулы. Рецептурный пример 8: гранулы, мас. ч: Соединение N 1 этого изобретения 1,0 Соединение (А) 0,07 DBSN 3 Эпоксидированное соевое масло 1 Бентонит 30 Тальк 64,93 Указанные выше компоненты смешивали и превращали в порошок, туда добавляли небольшое количество воды и месили. Используя экструзионный гранулятор, смесь гранулировали и сушили, в результате чего получали гранулы. Соединения (А) представляют собой пиразосульфуронэтил (общее название), DBSN представляет собой додецилбензол-сульфонат натрия. В тех случаях, когда действительно использовали упомянутые выше смачивающиеся порошки, эмульсию, текучую жидкость и гранулированный смачивающийся порошок, их разбавляли водой в соотношении от 1/50 до 1/1000; разбавленный препарат применяли с нормой расхода в пределах от 0,001 до 50 кг/га, предпочтительно от 0,01 до 10 кг/га по активному ингредиенту. Гербициды, содержащие соединения, отвечающие настоящему изобретению, могут быть применены на рисовых полях как для обработки почвы, так и для обработки листвы. В качестве примеров рисовых сорняков можно назвать сорняки семейства Alismataceae, такие как Alisma canaliculatum, Sagittaria trifolia, Sagittaria pugmaca и т.д. сорняки семейства, Cyperaceae, такие как Cyperus difformis, Cyperus serotinus, Scirpus juncoides, Sleocharis kuroguwai и т.д. сорняки семейства Scrothulariaceae, такие как Lindemia pyxidaria и т.д. сорняки семейства Potenderiaceae, такие как Monochoria vaginalis и т.д. сорняки семейства Potamogetonaceae, такие как Potamogeton distinctus и т.д. сорняки семейства Lythraceae, такие как Rotala indica и т.д. и сорняки семейства Gramineae, такие как Echinochloa crus-galli и т.д. Соединения, отвечающие настоящему изобретению, являются также полезными в качестве гербицидов для обработки почвы, обработки почвенных материалов и обработки листвы. Кроме того, они могут быть также применены для управления ростом различных сорняков на несельскохозяйственных полях, таких как спортивные площадки, свободные земли, полосы отчуждения у железных дорог и т.д. в дополнение к использованию на сельскохозяйственных и садовых землях, таких как рисовые поля, суходольные поля, фруктовые сады и т.д. Следующие примеры иллюстрируют полезность соединений, заявленных в настоящем изобретении в качестве гербицидов. Пример 1. Испытание соединений на их гербицидное действие при обработке почвы рисового поля. Аллювиальную почву помещали в сосуды Вагнера площадью 1/5000 а, туда добавляли воду, чтобы почва стала вязкой, создавая условия, отвечающие тем, которые имеют место на рисовых полях, причем глубина водного слоя составляла 4 см. В сосуды высевали смесь семян видов Echinochloa crus-galli, Monochoria vaginalis, Rotola indica и Scirpus juncoides и туда высаживали рисовые растения в возрасте 2,5 листа. Сосуды помещали в теплицу с температурой от 25 до 30oC, чтобы растения могли там расти. На первый день после высева на поверхность воды, находящейся в сосудах, в предварительно установленной дозе наносили соединения, отвечающие настоящему изобретению, которые находились в виде гербицидных рецептур, отвечающих рецептурным примерам, описанным выше. Через три недели после нанесения оценивали гербицидное воздействие тестируемых соединений на рисовые растения и на сорняки. Воздействие оценивали по 5-значной шкале, по которой "0" означает, что соединение не оказывает воздействия на растения, тогда как "5" свидетельствует об их полной увядаемости. Результаты тестирования приведены в табл. 5. Пример 2. Испытание соединений на их гербицидное действие при обработке листвы на рисовом поле. Аллювиальную почву помещали в сосуды Вагнера площадью 1/5000 а, и туда добавляли воду, чтобы почва стала вязкой. Создавали условия, отвечающие тем, которые имеют место на рисовых полях, причем глубина воды составляла 4 см. В сосуды в смеси высевали семена видов Echinochloa crus-galli, Monochoria vaginalis, Rotola indica и Scirpus juncoides и туда высаживали рисовые растения в фазе развития 2,5 листа. Сосуды помещали в теплицу с температурой от 25 до 30oC, чтобы растения могли там расти. Когда сорняки Echinochloa crus-galli, Monochoria vaginalis, Rotola indica и Scirpus juncoides достигали фазы развития 1-2 листа, а рисовые растения 4 листа, на растения, находящиеся в сосудах, с предварительно установленной дозой наносили соединения, отвечающие настоящему изобретению, которые находились в виде гербицидных рецептур, составленных согласно рецептурным примерам, описанным выше. Через три недели после нанесения оценивали гербицидное воздействие тестируемых соединений на рисовые растения и на сорняки. Воздействие оценивали так же, как в случае проверочного примера 1. Результаты тестирования приведены в табл. 6. В следующих таблицах A означает вид Echinochloa crus-galli, B вид Scirpus juncoides, C вид Monochoria vaginalis, D Rotola indica и a - растения риса. -диметилбензил)мочевина (JC-940 в качестве экспериментального названия), N-[2"-(3"-метокси)тиенил-метил]-N-хлорацетил-2,6-диметиланилид (NSK-850 в качестве экспериментального названия) и т.д. При использовании соединений, отвечающих настоящему изобретению, в качестве гербицида они в общем случае могут быть смешаны с приемлемыми носителями, например твердыми носителями, такими как глина, тальк, бентонит, диатомовая земля, белая сажа и т.д. или жидкими носителями, такими как вода, спирты (например, изопропанол, бутанол, бензиловый спирт, фурфуриловый спирт и т.д.), ароматические углеводороды (например, толуол, ксилол и т.д.), простые эфиры (например, анизол и т.д.), кетоны (например, циклогексанон, изофорон и т. д.), сложные эфиры (например, бутилацетат и т.д.), амиды кислот (например, N-метилпирролидон и т. д. ) или галогенированные углеводороды (например, хлорбензол и т.д.). При желании они могут быть приготовлены в виде различных составов практического назначения, включая жидкий состав, концентрат эмульсии, смачивающийся порошок, сухой текучий порошок, текучую жидкость, дуст, гранулы и т.д. куда при желании могут быть добавлены поверхностно-активное вещество, эмульгатор, диспергирующее вещество, промотор проницания, промотор клейкости, антифриз, противослеживатель, стабилизатор и т. д. При использовании соединений, отвечающих настоящему изобретению, для создания гербицидных гранул, предназначенных для применения на рисовых полях, могут быть, например, использованы каолинит, монтмориллонит, диатомовая земля, бентонит, тальк, глина, карбонат кальция, сульфат кальция, сульфат аммония и т.д. в качестве твердых носителей и алкилбензолсульфонаты, полиоксиэтиленовые алкиларильные простые эфиры, лигнин-сульфонаты, алкилсульфосукцинаты, полиоксиэтиленовые сложные эфиры жирных кислот, нафталинсульфонаты, полиоксиэтиленалкиларильные сульфаты простых эфиров, алкиламиновые соли, триполифосфаты и т.д. в качестве поверхностно-активных веществ. Содержание этих поверхностно-активных веществ в гербицидных гранулах специально не оговаривается; однако в общем случае желательно, чтобы их содержалось от 0,05 до 20 мас. ч. на 100 мас. ч. гранул. При желании гранулы могут содержать ингибитор разложения, такой как эпоксидированное соевое масло и т.д. Ниже приведены примеры рецептур гербицидных продуктов, содержащих соединения, отвечающие настоящему изобретению, которые, однако, не носят ограничительный характер. Смачивающийся порошок, мас. ч: Соединение этого изобретения от 5 до 80 Твердый носитель от 10 до 85 Поверхностно-активное вещество от 1 до 10 Другие вещества от 1 до 5 В качестве других веществ может, например, быть упоминавшийся противослеживатель и т.д. Концентрат эмульсии, мас. ч: Соединение этого изобретения от 1 до 30 Жидкий носитель от 30 до 95 Поверхностно-активное вещество от 5 до 15 Текучая жидкость мас. ч: Соединение этого изобретения от 5 до 70 Жидкий носитель от 15 до 65 Поверхностно-активное вещество от 5 до 12 Другие вещества от 5 до 30 В качестве других веществ могут, например, быть антифриз, промотор клейкости и т.д. Гранулированный смачивающийся порошок (сухой текучий порошок), мас. ч: Соединение этого изобретения от 20 до 90 Твердый носитель от 10 до 60 Поверхностно-активное вещество от 1 до 20 Гранулы, мас. ч: Соединение этого изобретения от 0,1 до 10 Твердый носитель от 90 до 99,9 Другие вещества от 1 до 5 Рецептурный пример 1: смачиваемый порошок, мас. ч: Соединение N 1 этого изобретения 20 Циклит A (коалиновая глина, торговое название фирмы "Циклит Ко".) 76 Сорпол 5039 (смесь неионного поверхностно-активного вещества и анионного поверхностно-активного вещества, торговое название фирмы "Тохо кемикал Ко".) 2 Карплекс (противослеживатель) (белая сажа, торговое название фирмы "Сийоноги фармацевтикал Ко."). 2 Указанные выше компоненты гомогенно смешивали и измельчали в порошок, в результате чего получали смачиваемый порошок. Рецептурный пример 2: смачивающийся порошок,мас. ч. Соединение N 1 этого изобретения 40 Циклит A 54 Сорпол 5039 2 ч Карплекс (противослеживатель) 4 ч Указанные выше компоненты гомогенно смешивали и измельчали в порошок, в результате чего получали смачиваемый порошок. Рецептурный пример 3: эмульгируемый концентрат. мас. ч: Соединение N 1 этого изобретения 5 Ксилол 75 Диметилформамид 15 Сорпол 2680 5 Указанные выше компоненты гомогенно смешивали, в результате чего получали эмульсию. Рецептурный пример 4: текучая жидкость, мас. ч: Соединение N 1 этого изобретения 25 Агризол S-710 (неионное поверхностно-активное вещество, торговое название фирмы "Каох Ко.") 10 Рунокс 1000С (анионное поверхностно-активного вещество, торговое название фирмы "Тохо Кемикал Ко.") 0,53 Водный 1%-ный родопол (промотор, торговое название фирмы "Роне-Пулени Ко.") 20 Вода 44,5 Указанные выше компоненты гомогенно перемешивали, в результате чего получали текучую жидкость. Рецептурный пример 5: текучая жидкость, мас. ч: Соединение N 1 этого изобретения 40 Агризол S-710 10 Рунокс 1000С 0,5 Водный 1%-ный раствор родопола 20 Вода 29,5 Указанные выше компоненты гомогенно перемешивали, в результате чего получали текучую жидкость. Рецептурный пример 6: гранулированный смачивающийся порошок (сухой текучий порошок), мас. ч: Соединение N 1 этого изобретения 75 Изобам N 1 (анионное поверхностно-активное вещество, торговое название фирмы "Курагаи изопрен кемикал Ко.") 10 Ванилекс N (анионное поверхностно-активное вещество, торговое название фирмы "Санио Кокусаку палп Ко.") 5 Карплекс N 80 10 ч. Указанные выше компоненты гомогенно перемешивали и превращали в токодисперсный порошок, в результате чего получали текучий порошок. Рецептурный пример 7: гранулы, мас. ч: Соединение N 1 этого изобретения 1 Бентонит 55 Тальк 44 Указанные выше компоненты смешивали и превращали в порошок, туда добавляли небольшое количество воды, перемешивали, дополнительно смешивали и месили. Используя гранулятор, смесь гранулировали и сушили, в результате чего получали гранулы. Рецептурный пример 8: гранулы, мас. ч: Соединение N 1 этого изобретения 1,0 Соединение (А) 0,07 DBSN 3 Эпоксидированное соевое масло 1 Бентонит 30 Тальк 64,93 Указанные выше компоненты смешивали и превращали в порошок, туда добавляли небольшое количество воды и месили. Используя экструзионный гранулятор, смесь гранулировали и сушили, в результате чего получали гранулы. Соединения (А) представляют собой пиразосульфуронэтил (общее название), DBSN представляет собой додецилбензол-сульфонат натрия. В тех случаях, когда действительно использовали упомянутые выше смачивающиеся порошки, эмульсию, текучую жидкость и гранулированный смачивающийся порошок, их разбавляли водой в соотношении от 1/50 до 1/1000; разбавленный препарат применяли с нормой расхода в пределах от 0,001 до 50 кг/га, предпочтительно от 0,01 до 10 кг/га по активному ингредиенту. Гербициды, содержащие соединения, отвечающие настоящему изобретению, могут быть применены на рисовых полях как для обработки почвы, так и для обработки листвы. В качестве примеров рисовых сорняков можно назвать сорняки семейства Alismataceae, такие как Alisma canaliculatum, Sagittaria trifolia, Sagittaria pugmaca и т.д. сорняки семейства, Cyperaceae, такие как Cyperus difformis, Cyperus serotinus, Scirpus juncoides, Sleocharis kuroguwai и т.д. сорняки семейства Scrothulariaceae, такие как Lindemia pyxidaria и т.д. сорняки семейства Potenderiaceae, такие как Monochoria vaginalis и т.д. сорняки семейства Potamogetonaceae, такие как Potamogeton distinctus и т.д. сорняки семейства Lythraceae, такие как Rotala indica и т.д. и сорняки семейства Gramineae, такие как Echinochloa crus-galli и т.д. Соединения, отвечающие настоящему изобретению, являются также полезными в качестве гербицидов для обработки почвы, обработки почвенных материалов и обработки листвы. Кроме того, они могут быть также применены для управления ростом различных сорняков на несельскохозяйственных полях, таких как спортивные площадки, свободные земли, полосы отчуждения у железных дорог и т.д. в дополнение к использованию на сельскохозяйственных и садовых землях, таких как рисовые поля, суходольные поля, фруктовые сады и т.д. Следующие примеры иллюстрируют полезность соединений, заявленных в настоящем изобретении в качестве гербицидов. Пример 1. Испытание соединений на их гербицидное действие при обработке почвы рисового поля. Аллювиальную почву помещали в сосуды Вагнера площадью 1/5000 а, туда добавляли воду, чтобы почва стала вязкой, создавая условия, отвечающие тем, которые имеют место на рисовых полях, причем глубина водного слоя составляла 4 см. В сосуды высевали смесь семян видов Echinochloa crus-galli, Monochoria vaginalis, Rotola indica и Scirpus juncoides и туда высаживали рисовые растения в возрасте 2,5 листа. Сосуды помещали в теплицу с температурой от 25 до 30oC, чтобы растения могли там расти. На первый день после высева на поверхность воды, находящейся в сосудах, в предварительно установленной дозе наносили соединения, отвечающие настоящему изобретению, которые находились в виде гербицидных рецептур, отвечающих рецептурным примерам, описанным выше. Через три недели после нанесения оценивали гербицидное воздействие тестируемых соединений на рисовые растения и на сорняки. Воздействие оценивали по 5-значной шкале, по которой "0" означает, что соединение не оказывает воздействия на растения, тогда как "5" свидетельствует об их полной увядаемости. Результаты тестирования приведены в табл. 5. Пример 2. Испытание соединений на их гербицидное действие при обработке листвы на рисовом поле. Аллювиальную почву помещали в сосуды Вагнера площадью 1/5000 а, и туда добавляли воду, чтобы почва стала вязкой. Создавали условия, отвечающие тем, которые имеют место на рисовых полях, причем глубина воды составляла 4 см. В сосуды в смеси высевали семена видов Echinochloa crus-galli, Monochoria vaginalis, Rotola indica и Scirpus juncoides и туда высаживали рисовые растения в фазе развития 2,5 листа. Сосуды помещали в теплицу с температурой от 25 до 30oC, чтобы растения могли там расти. Когда сорняки Echinochloa crus-galli, Monochoria vaginalis, Rotola indica и Scirpus juncoides достигали фазы развития 1-2 листа, а рисовые растения 4 листа, на растения, находящиеся в сосудах, с предварительно установленной дозой наносили соединения, отвечающие настоящему изобретению, которые находились в виде гербицидных рецептур, составленных согласно рецептурным примерам, описанным выше. Через три недели после нанесения оценивали гербицидное воздействие тестируемых соединений на рисовые растения и на сорняки. Воздействие оценивали так же, как в случае проверочного примера 1. Результаты тестирования приведены в табл. 6. В следующих таблицах A означает вид Echinochloa crus-galli, B вид Scirpus juncoides, C вид Monochoria vaginalis, D Rotola indica и a - растения риса.
ФОРМУЛА ИЗОБРЕТЕНИЯ1. Производные амидов пиразолгликолевой кислоты формулы I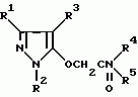 где R 1 атом водорода, С1 С6- алкил, С3 - С6-циклоалкил, С1 С4- галоалкил, фенил (не обязательно замещенный одним атомом галогена), атом галогена, циано- или нитрогруппа; R2 атом водорода, С1 С6-алкил, С3 - С6-циклоалкил, С2 С4-алкенил, С2 - С4-алкинил, фенилзамещенная С1 С4-алкильная группа, фенил (не обязательно замещенный одним или несколькими заместителями, выбранными из С1 С4-алкила, С1 С4-алкоксила, нитрогруппы и атома галогена), пиридил (не обязательно замещенный одним или несколькими заместителями, выбранными из С1 С4-алкила, C1 C4-галоалкила, С1 С4-галоалкила и атома галогена); R3 атом водорода, цианогруппа, атом галогена или нитрогруппа; R4 и R 5 независимо, атом водорода, С1 - С6-алкил, С3 С6-циклоалкил, С2 С4-алкенил, С2 С4-алкинил, С1 - С4-алкокси-С1 -С4-алкил, фенилзамещенный С1 - С4-алкил (у которого фенил составляющая не обязательно является замещенной одним или несколькими заместителями, выбранными из С1 - С4 -алкила и атома галогена), пиридил, замещенная С1 С4 -алкильная группа, у которой пиридильная составляющая не обязательно является замещенной одним атомом галогена, С1 С4 -алкоксигруппа (с условием, что обе группы R4 и R5 не являются алкоксигруппами); R4 и R5 вместе с атомом азота, к которому они присоединены, могут образовывать кольцо с числом членов от 3 до 9 и это кольцо может содержать один или несколько атомов кислорода, атомов серы, атомов азота или ненасыщенных связей, кольцо может быть замещенным С1 - С4-алкилом, атомом галогена, или С1 С4-алкоксикарбонильной группой и кольцо может быть конденсировано с бензольным кольцом. 2. Гербицидная композиция, содержащая производное пиразола и целевые добавки, отличающаяся тем, что в качестве производного пиразола используют соединение формулы I по п. 1 в эффективном количестве. 3. Способ регулирования или торможения роста сорняков обработкой производным пиразола, отличающийся тем, что в качестве производного пиразола используют соединение формулы I по п. 1 в эффективном количестве. Приоритет по признакам: 12.11.91 при R1 Н, С1 С6-алкил, C1 - C4-галоалкил, атом галогена; R2 С1 С6-алкил; R3 атом галогена, циано- или нитрогруппа; R4, R5 независимо С1 С6-алкил, фенилзамещенный С1 - С4 -алкил (у которого фенил составляющая не обязательно является замещенной одним или несколькими заместителями, выбранными из С1 - С4-алкила и атома галогена); R4 и R5 вместе с атомом азота, к которому они присоединены, могут образовывать кольцо с числом членов от 3 до 9. 17.03.92 при R1 (С3 С6)-циклоалкил, фенил, 12.06.92 при R1 фенил, замещенный атомом галогена; R2 - фенил, необязательно замещенный одним заместителем, выбранным из С1 - С4 -алкила, нитрогруппы или атома галогена; R4 и R5 - независимо (С3 С6)-циклоалкил. 19.10.92 при R2 Н, С2 С4-алкенил, фенил, необязательно замещенный двумя заместителями, выбранными из С1 - С4- алкила, нитрогруппы или атом галогена, пиридил; R3 Н; R4 и R5 независимо (С2 С4)-алкинил, пиридилзамещенная (С1 С4)-алкильная группа, у которой пиридильная составляющая не обязательно является замещенной одним атомом галогена, С1 С4- алкоксигруппу (с условием, что обе группы R4 и R5 не являются алкоксигруппами); 11.05.94 при R1 циано; R2 (С3 С 6)-циклоалкил; R4 и R5 вместе с атомом азота, к которому они присоединены, могут образовывать кольцо с числом членов от 3 до 9 и это кольцо может содержать один или несколько атомов кислорода, атомов серы, атомов азота или ненасыщенных связей, кольцо может быть замещенным С1 С4-алкилом, атомом галогена или С1 - С4-алкоксикарбонильной группой и кольцо может быть сконденсировано с бензольным кольцом. где R 1 атом водорода, С1 С6- алкил, С3 - С6-циклоалкил, С1 С4- галоалкил, фенил (не обязательно замещенный одним атомом галогена), атом галогена, циано- или нитрогруппа; R2 атом водорода, С1 С6-алкил, С3 - С6-циклоалкил, С2 С4-алкенил, С2 - С4-алкинил, фенилзамещенная С1 С4-алкильная группа, фенил (не обязательно замещенный одним или несколькими заместителями, выбранными из С1 С4-алкила, С1 С4-алкоксила, нитрогруппы и атома галогена), пиридил (не обязательно замещенный одним или несколькими заместителями, выбранными из С1 С4-алкила, C1 C4-галоалкила, С1 С4-галоалкила и атома галогена); R3 атом водорода, цианогруппа, атом галогена или нитрогруппа; R4 и R 5 независимо, атом водорода, С1 - С6-алкил, С3 С6-циклоалкил, С2 С4-алкенил, С2 С4-алкинил, С1 - С4-алкокси-С1 -С4-алкил, фенилзамещенный С1 - С4-алкил (у которого фенил составляющая не обязательно является замещенной одним или несколькими заместителями, выбранными из С1 - С4 -алкила и атома галогена), пиридил, замещенная С1 С4 -алкильная группа, у которой пиридильная составляющая не обязательно является замещенной одним атомом галогена, С1 С4 -алкоксигруппа (с условием, что обе группы R4 и R5 не являются алкоксигруппами); R4 и R5 вместе с атомом азота, к которому они присоединены, могут образовывать кольцо с числом членов от 3 до 9 и это кольцо может содержать один или несколько атомов кислорода, атомов серы, атомов азота или ненасыщенных связей, кольцо может быть замещенным С1 - С4-алкилом, атомом галогена, или С1 С4-алкоксикарбонильной группой и кольцо может быть конденсировано с бензольным кольцом. 2. Гербицидная композиция, содержащая производное пиразола и целевые добавки, отличающаяся тем, что в качестве производного пиразола используют соединение формулы I по п. 1 в эффективном количестве. 3. Способ регулирования или торможения роста сорняков обработкой производным пиразола, отличающийся тем, что в качестве производного пиразола используют соединение формулы I по п. 1 в эффективном количестве. Приоритет по признакам: 12.11.91 при R1 Н, С1 С6-алкил, C1 - C4-галоалкил, атом галогена; R2 С1 С6-алкил; R3 атом галогена, циано- или нитрогруппа; R4, R5 независимо С1 С6-алкил, фенилзамещенный С1 - С4 -алкил (у которого фенил составляющая не обязательно является замещенной одним или несколькими заместителями, выбранными из С1 - С4-алкила и атома галогена); R4 и R5 вместе с атомом азота, к которому они присоединены, могут образовывать кольцо с числом членов от 3 до 9. 17.03.92 при R1 (С3 С6)-циклоалкил, фенил, 12.06.92 при R1 фенил, замещенный атомом галогена; R2 - фенил, необязательно замещенный одним заместителем, выбранным из С1 - С4 -алкила, нитрогруппы или атома галогена; R4 и R5 - независимо (С3 С6)-циклоалкил. 19.10.92 при R2 Н, С2 С4-алкенил, фенил, необязательно замещенный двумя заместителями, выбранными из С1 - С4- алкила, нитрогруппы или атом галогена, пиридил; R3 Н; R4 и R5 независимо (С2 С4)-алкинил, пиридилзамещенная (С1 С4)-алкильная группа, у которой пиридильная составляющая не обязательно является замещенной одним атомом галогена, С1 С4- алкоксигруппу (с условием, что обе группы R4 и R5 не являются алкоксигруппами); 11.05.94 при R1 циано; R2 (С3 С 6)-циклоалкил; R4 и R5 вместе с атомом азота, к которому они присоединены, могут образовывать кольцо с числом членов от 3 до 9 и это кольцо может содержать один или несколько атомов кислорода, атомов серы, атомов азота или ненасыщенных связей, кольцо может быть замещенным С1 С4-алкилом, атомом галогена или С1 - С4-алкоксикарбонильной группой и кольцо может быть сконденсировано с бензольным кольцом.Популярные патенты: 2482660 Способ выращивания рапса ярового на семена ... д.в., весной проводят допосевное и послепосевное прикатывание, посев проводят инкрустированными семенами в ранние сроки по мерзлоталой почве с нормой высева до 2,0 млн штук всхожих семян на га, а уборку ярового рапса осуществляют прямым ... 2201069 Травяное покрытие на основе гибкого полотна ... Изобретение относится к области сельского хозяйства, а более конкретно к покрытиям для посадки и выращивания растений, и может быть использовано для декоративного пейзажного садоводства и огородничества, дизайна в области составления цветочных и травяных композиций поверхностей, в т.ч. для устройства высококачественных газонов и травяных покрытий различного назначения, а также облагораживания территорий, укрепления откосов земляных сооружений (дорог, каналов, насыпей), рекультивации техногенно-нарушенных земель. Известно покрытие для укрепления насыпи дорог, содержащее выполненные из волокон восстановленной шерсти верхний и нижний укрепляющие слои и средний слой с семенами, ... 2470922 Сокристаллы ... образец выдерживали при 50°C в течение 2 часов и затем остужали и упаривали, после чего фильтровали на воронке Бюхнера. 8. Сокристаллы ципродинил-4-гидрокси-4-бифенилкарбоновая кислотаФиг.16: Картины дифракции рентгеновских лучей на порошках ципродинила форма (A) (a), ципродинила форма B (b), сокристаллов ципродинил-4-гидрокси-4-бифенилкарбоновая кислота форма B (c) и 4-гидрокси-4-бифенилкарбоновой кислоты (d).Таблица 9: значения углов 2 для избранных пиков картины дифракции рентгеновских лучей на порошке сокристаллов ципродинил-4-гидрокси-4-бифенилкарбоновая кислота. Фиг.17: кривые DSC ципродинила, форма B (a), сокристаллов ... 2040152 Способ выращивания корнеплодных культур в контролируемых условиях и установка для его осуществления ... сторон. Кольцо 10 изготавливают из стальной низкоуглеродистой полосы 20, которую приваривают к кронштейну 11 (фиг.3). Крючки 21 в простейшем случае также приваривают к полосе 20. На фиг. 1 для простоты показаны только по два установленных кронштейна 11 на четырех стойках. На крючки 21 мешочки 9 надевают с помощью упрочненной полосы 22 (например, путем частичной металлизации мешочка в его верхней части в местах отверстий), на которой концентрируют соответствующее числу крючков 21 число отверстий 23. Основная часть 24 мешочка изготавливается, например, из стеклоткани. Установка работает следующим образом. На смонтированной, отлаженной и сданной в эксплуатацию установке работает ... 2251837 Рабочий орган кустореза ... магистраль с нижней частью емкости с арборицидной смесью, кроме того, для предотвращения вытекания смеси из кожуха установлена воздушная магистраль, соединяющая кожух с верхней частью емкости. MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 03.06.2005 Извещение опубликовано: 27.01.2007 БИ: ... |
Еще из этого раздела: 2426302 Всепогодная теплица 2264065 Способ возделывания сельскохозяйственных культур на корм 2209542 Контейнер 2494593 Способ повышения селена в чесноке горной зоны 2245017 Способ подготовки картофеля перед закладкой на хранение 2473735 Электрический рыбозаградитель направляющего действия (варианты) 2157603 Способ послепосевного прикатывания озимых культур и каток для его осуществления 2181542 Способ хранения эритроцитов в условиях охлаждения при отсутствии кислорода (варианты) 2141196 Способ получения растений с комплексной устойчивостью к фитостеринзависимым вредителям 2269892 Способ выращивания цыплят-бройлеров |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||