Способ клонального микроразмножения смородины и антиоксидант для клонального микроразмножения смородиныПатент на изобретение №: 2080060 Автор: Атрощенко Г.П. Патентообладатель: Санкт-Петербургский государственный аграрный университет Дата публикации: 27 Мая, 1997 Адрес для переписки: подача заявки01.03.1994 публикация патента27.05.1997 Изображения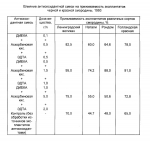 Использование: сельское хозяйство и биотехнология. Сущность изобретения: клональное микроразмножение смородины на питательную среду, при этом исходные побеги обрабатывают раствором антиоксиданта и после получения почек и микропобегов их также обрабатывают антиоксидантом перед разделением. Культивирование разделенных почек и микропобегов осуществляют до получения растений-регенерантов. Антиоксидант для клонального микроразмножения смородины содержит диэтилдитиокарбамат натрия и дополнительно аскорбиновую кислоту и этилендиаминтетраацетат натрия в указанных количествах. 2 с.п. ф-лы, 1 табл. ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУИзобретение относится к сельскому хозяйству и может быть использовано в биотехнологии сельскохозяйственных растений, в частности при наклонном микроразмножении черной и красной смородины. Известно, что основной сложностью технологии на первом этапе клонального микроразмножения для раза растений является возможность ингибирования ростовых процессов эксплантата токсическими веществами, выделяемыми им в питательную среду. В результате травмы, полученной эксплантатом при изолировании, активизируются фермент окисляющие фенолы растений. При этом продукты окисления фенолов не только вызывают потемнение ткани и культурной среды, но могут подавлять деление и рост клеток эксплантата. Для снижения окислительной активности ферментов используют химические вещества-антиоксиданты. Одним из способов снижения фенольного окислителя является включение в питательную среду антиоксидантов (Муромцев Г.С. Бутенко Р. Г. Тихоненко Т.И. Прокофьев М.И. Основы сельскохозяйственной биотехнологии. М. ВО Агропромиздат, 1990, с. 221 222). Недостатком данного способа является то, что окисление фенолов происходит уже на стадии изолирования эксплантатов смородины до посадки на питательную среду, что вызывает снижение приживаемости эксплантатов. Наиболее близким к предлагаемому способу относится способ клонального микроразмножения смородины (Калинин Ф.Л. и др. Технология микроклонального размножения растений. Киев: Найкова думка, 1992, с. 187 190). Недостатком известного способа является снижение приживаемости меристем на этапе введения в культуру in vitro, а также для дополнительных почек и микропробегов при разделении конгломератов для дальнейшего их субкультивирования. Проведенные исследования по обработке эксплантатов смородины перед вычленением меристематических верхушек стерильным раствором аскорбиновой и лимонной кислотой не дали ощутимого эффекта. Кроме того, в литературных источниках отсутствуют какие-либо данные о эффективности антиоксидантного действия этих веществ при обработке эксплантатов черной и красной смородины. Известно использование некоторых веществ в качестве антиоксидантов в биотехнологических процессах. Так, для эксплантатов ряда растений фенольное окисление предотвращают обработкой их аскорбиновой или лимонной кислотой (Биотехнология сельскохозяйственных растений. М. ВО Агропромиздат, 1987, с. 118). Использование одного из указанных антиоксидантов при клональном микроразмножении смородины приводит к отсутствию эффекта в связи с тем, что каждый антиоксидант действует на определенный фермент, блокируя его, и не реагирует на другие ферменты, которые окисляют фенолы растений. Известно использование ряда антиоксидантов добавлением их в питательную среду, где культивируются растения. Так, для роста побегов голосеменных в питательную среду добавляют активированный уголь в концентрации 2% Вероятно он адсорбирует ингибиторы роста, выделяемыми тканями растений (Constantin M. J. Henke R.R. Mansur M.A. Effect of activated Ckarcoal on Callas growth and shoot organogenesis in tobacco in vitro, 13, 1977, 293). Существенный недостаток активированный уголь связывает также гормоны и другие вещества, необходимые для роста эксплантата. Наиболее широко в последнее время используют в питательных средах для предотвращения фенольного окисления ряд антиоксидантов:аскорбиновую кислоту 1 мг/л, глютатион 4 5 мг/л, дитиотриэтол 1 3 мг/л, диэтилдитиокарбамат 2 5 мг/л, поливинилпорролидон 5000 10000 мг/л (Муромцев Г.С. Бутенко Р. Г. Тихоненко Т.И. Прокофьеф М.И. Основы сельскохозйственной биотехнологии. М. ВО Агропромиздат, 1990, с. 221 222). Включение этих веществ в питательную среду Мурасиге-Скугу, которую используют при клональном микроразмножении смородины, не дает надлежащего антиоксидантного эффекта. Во-первых, окисление фенолов смородины проходит еще на стадии изолирования эксплантата до посадки на питательную среду. Во-вторых, каждый из указанных антиоксидантов блокирует определенные ферменты и не действует на другие ферменты, которые окисляют фенолы растений. Наиболее близким к изобретению является ДИЕКА (диэтилдитиокарбамат натрия). Это вещество чаще других используют для связывания фенольных компонентов при очистке вирусов плодовых культур. В связи с тем, что некоторые фенольные соединения у плодовых окисляются посредством фермента полифенолоксидазы, использование ДИЕКА (диэтилдитиокарбамата натрия) в концентрации 2 3% позволяет в подобном случае добиваться определенного эффекта. Карбаматные вещества этого препарата блокируют ион меди и тем самым всю деятельность полифенолоксидазы, что приводит к существенному снижению фенольного окисления (Вердеревская Т. Д. Маринеску В.Г. Вирусные и микоплазменные заболевания плодовых культур и винограда. Кишинев: Штиинца, 1985, с. 9). Использование этого вещества в качестве антиоксиданта при клональном микроразмножении смородины на дает существенного эффекта в связи с действием его только на один фермент-полифеноксидазу. Кроме того, применение ДИЕКА в концентрации 2 3% рекомендованного для связывания фенольных компонентов при изолировании вирусов в соке плодовых культур, непригодно для клонального микроразмножения смородины. Включение этого вещества в концентрации 2 3% в питательную среду Мурасиге-Скугу оказалось губительной для эксплантатов смородины. Задача изобретения увеличение выхода эксплантатов черной и красной смородины при клональном микроразмножении. Поставленная задача решается способом клонального микроразмножения смородины, включающим вычленение эксплантата от исходных побегов, высадку из на питательную среду, культивирование до получения почек и микропобегов, разделение их в дальнейшее культивирование до полечения растений-регенератов, причем обрабатывают исходные побеги раствором антиоксиданта и в последствии обрабатывают полученные при культивировании почек и побегов перед их разделением раствором антиоксиданта. Антиоксидант для клонального микроразмножения смородины, содержащее ДИЕКА (диэтилдитиокарбамат натрия), аскорбиновую кислоту, ДЭТА (этилендиаминтетраацетат натрия) при следующих соотношениях ингридиентов, г/л: ДИЕКА (диэтилдитиокарбамат натрия) 0,4 0,5 Аскорбиновая кислота 1 2 ЭДТА (этилендиаминтетраацетат натрия) 0,8 1,0 Новые существенные признаки следующие: обработку источников эксплантатов смородины антиоксидантной смесью (ДИЕКА, аскорбиновая кислота, ЭДТА) проводят перед вычненением меристематических верхушек на первом этапе клонального микроразмножения; разделение дополнительных почек и микропобегов в конгломератах проводят в стерильном растворе антиоксидантной смеси (ДИЕТА, аскорбиновая кислота, ЭДТА) перед посадкой их на новые питательные среды на втором этапе клонального микроразмножения; вещество для фенольного окисления эксплантатов черной и красной смородины при клональном микроразмножении содержит смесь: ДИЕКА (диэтилдитиокарбамат натрия) + аскорбиновая кислоты + ЭДТА) (этилендиаминтетраацетат натрия); весовое соотношение антиоксидантной смеси: ДИЕКА (диэтилдитиокарбамат натрия) 0,4 0,5 г/л + аскорбиновая кислоты 1 2 г/л, + ЭДТА (этилендиаминтетраацетат натрия) 0,8 1 г/л. Перечисленные новые существенные признаков в совокупности с известными обеспечивают получение технического результата во всех случаях, на которые распространяется объем испрашиваемой правой охраны. За счет того, что каждый из трех антиоксидантов (ДИЕКА, аскорбиновая кислота, ЭДТА) блокирует определенные ферменты, комбинация этих веществ расширяет и улучшает действие и возможности их применения. ДИЕКА блокирует полифенолоксидазу, аскорбиновая кислота-аскорбиноксидазу. ЭДТА защищает фенолы от необратимого ингибирования хинонами (продуктами окисления фенолов). Антиоксидантная смесь вы указанной концентрации, г/л: ДИЕКА (диэтилдитиокарбамат натрия) 0,4 0,5, аскорбиновая кислота 1 2, ЭДТА (этилендиаминтетраацетат натрия) 0,4 0,5, аскорбиновая кислота 1 2, ЭДТА (этилендиаминтетраацетат натрия) 0,8 1 является безопасной для эксплантатов смородины при их обработке. При повышении концентрации антиоксидантной смеси наблюдается угнетение эксплантатов смородины, а при уменьшении концентрации не снижается фенольное окисление. Обработку источников эксплантатов смородины проводят стерильным раствором антиоксидантной смеси (ДИЕКА, аскорбиновая кислота, ЭДТА) в течение 5 10 мин перед вычленением меристематических верхушек на первом этапе клонального микроразмножения. Насыщение источников эксплантата указанной антиоксидантной смесью позволяет снизить ферментативную окислительную деятельность. Разделение дополнительных почек и микропобегов в конгломератьах проводят в стерильном растворе антиоксидантной смеси (ДИЕКА, аскорбиновая кислота, ЭДТА) перед посадкой их на новые питательные среды на втором этапе клонального микроразмножения. Это предотвращает фенольное окисление при травмировании почек и микропобегов. Способ и вещество для снижения фенольного окисления эксплантатов черной и красной смородины в процессе технологии реализуется следующим образом. В качестве источника эксплантатов черной и красной смородины при культивировании в стерильных условиях используют вегетативные органы растений (почку, апикальный конец стебля). Почки смородины берут в феврале-апреле с искусственно пробужденных растений или в фазу активного роста (май-июнь). Почки, после того как их срезали с исходного растения, промывают водой. Перед этим их очищают от верхних листьев и помещают под проточную воду на 1 1,5 ч, после чего споласкивают дистиллированной водой. Затем материал стерилизуют от сапрофитной микрофлоры, используя при этом 0,1% -ный раствор диацида в экспозиции 10 мин. После чего материал промывают стерильной дистиллированной водой и переносят в чашки Петри. Предварительно в чашки Петри наносят по несколько капель стерильного раствора антиоксидантной смеси следующего состава, г/л: ДИЕКА (диэтилдитиокарбамат натрия 0,4 0,5, аскорбиновая кислота 1 2, ЭДТА (этилендиаминтетраацетат натрия) 0,8 1. Материал находится в каплях с антиоксидантной смесью 5 10 мин по мере постепенного их изъятия для вычленения меристематических верхушек. После этого вычлененные меристематические верхушки сажают на питательную среду Мурасиге-Скугу. Через 2 3 нед после введения в культуру меристематические верхушки начинают развиваться. Первыми начинают рост примордиальные листья. Через 4 5 нед эксплантаты переносят на свежую питательную среду. Сформировавшиеся конгломераты почек и побегов требуют периодического разделения на субъединицы и рекультивирования. При этом процесс разделения конгломератов проводят в каплях со стерильным раствором антиоксидантной смесью того же состава. Это значительно увеличивает прижимаемость вновь пересаженных на новую питательную среду почек и микропобегов. Результаты опытов, проведенные на кафедре плодоводства Санкт-Петербургского Государственного Аграрного Университета, представлены в таблице.ФОРМУЛА ИЗОБРЕТЕНИЯ1. Способ клонального микроразмножения смородины, включающий вычленение экспланта из исходных побегов, высадку их на питательную среду, культивирование до получения почек и микропобегов, разделение их и дальнейшее культивирование по получению растений-регенерантов, отличающийся тем, что исходные побеги обрабатывают раствором антиоксиданта и в последующем обрабатывают раствором антиоксиданта полученные почки и микропобеги перед их разделением. 2. Антиоксидант для клонального микроразмножения смородины, содержащий диэтилдитикарбамат натрия, отличающийся тем, что он дополнительно содержит аскорбиновую кислоту и этилендиаминтетраацетат натрия при следующем соотношении ингредиентов, г/л: Диэтилдитиокарбамат натрия 0,4 0,5 Аскорбиновая кислота 1,0 2,0 Этилендиаминтетраацетат натрия 0,8 1,0рПопулярные патенты: 2421965 Способ возделывания зерновых колосовых культур ... Фитолавин 300, для протравливания семян и обработки посевов. Фитолавин 300 представляет собой активное вещество фитобактериомицина. Его используют для предпосевного опудривания семян пшеницы и ячменя с целью профилактики корневой гнили, а также против бактериозов сои (Список пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации. Приложение к журналу «Защита и карантин растений 6, 2005 г.»).Известен способ возделывания озимой пшеницы, включающий однократную обработку семян рабочим раствором Фитолавина 300 путем опрыскивания при постоянном перемешивании, заделку семян в почву, однократную обработку посевов в фазу весеннего кущения растений ... 2261592 Ферма двухконсольного дождевального агрегата ... агрегата, включающей центральную панель с шарнирно закрепленными на ней двумя консолями, каждая из которых выполнена в виде пространственной фермы, имеющей разновеликие по сечению трубопроводы, гибкие пояса, боковые и центральную стойки, раскосы и дождевальные насадки на водопроводящем поясе, согласно изобретению трубопроводам центральной панели и водопроводящего пояса придана в поперечно-вертикальной плоскости дождевального агрегата форма кривой цепной линии, описываемая уравнением вида: где а - расстояние от поверхности орошаемого поля до трубопровода в средней части центральной панели;е - основание натурального логарифма (число Непера);е=2,71828;х и у - абсциссы и ординаты ... 2195801 Картофелекопатель швыряльного типа ... Боковые части указанного кожуха снабжены крышками, прилегающими к боковинам 5. Канал имеет в поперечном сечении П-образную форму и выполнен с уменьшающимся живым сечением по ширине в направлении потока клубненосной массы. На выходе он имеет прямоугольную форму для образования валка. Нижняя часть канала закрыта граблинами 11 с образованием просвета в горизонтальной плоскости для укладки валка клубней на поверхность поля. Угол наклона плоскости крышки 22 канала превышает угол наклона боковин 6 этого канала. При этом угол наклона среза боковин 6 к горизонтальной плоскости ориентировочно равен углу установки лемехов 13. Экран 8 присоединен посредством шарниров 7 к верхней кромке канала ... 2059362 Установка для выращивания мидий ... управления установкой; на фиг. 3 храповой механизм лебедки. Установка для выращивания мидий состоит из плота 1. Плот снабжен растяжками 2, которые соединены с бетонным блоком 3. Растяжки 2 пропущены через ролики 4 и снабжены противовесами 5. Плот 1 снабжен надувными камерами понтонами 6. Плот 1 при помощи троса 7 соединен с буем 8. На верхней части корпуса буя 8 установлены солнечные батареи 9, датчики 10 силы и направления ветра. Внутри буя 8 установлен компрессор 11. Компрессор 11 соединен с надувными камерами 6 при помощи гибких шлангов 12. На плоту установлены лебедки 18. На барабанах 14 лебедок 13 закреплены канаты 15, на которых выращивают мидий. Канаты 15 соединены с ... 2440721 Способ определения вредоносности насекомых комплекса "гнус" для крупного рогатого скота ... давать доход, снижать себестоимость продукции и повышать рентабельность производства.Источники информации 1. Трухан М.Н., Пахолкина Н.В. Кровососущие двукрылые насекомые Белоруссии. - Минск: Наука и техника, 1984. - С.7-8. 2. Андреев К.П. Ветеринарная энтомология и дезинсекция. - М.: Колос, 1966. - С.120-122; 146-149. Формула изобретения Способ определения вредоносности насекомых комплекса «гнус» для крупного рогатого скота, включающий оценку влияния этих насекомых на продуктивность животных, отличающийся тем, что, с целью получения более точных объективных данных, сравнительную количественную вредоносность особей каждого из семейств кровососущих двукрылых ... |
Еще из этого раздела: 2423033 Способ укрепления склонов посевом семян древесных растений 2090040 Машина для возделывания корнеклубневых культур 2438305 Способ выращивания цыплят-бройлеров 2307495 Пневматический высевающий аппарат 2185045 Способ посева, устройство для его осуществления и семявысевающий аппарат конструкции ибрагимова 2217912 Способ проведения контрольного лова молоди пелагических рыб, в частности лососевых, и обкидной невод 2076583 Способ выращивания растений в теплице и устройство для его осуществления 2261583 Выгрузное устройство бункера зерноуборочного комбайна 2102853 Питательное устройство для растений 2414113 Способ и комплекс для обработки зерна, семян или плодоовощной продукции озоном |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||