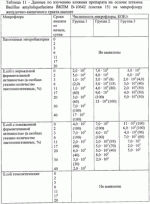
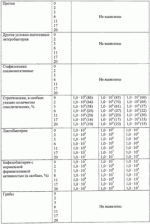
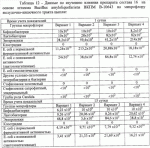
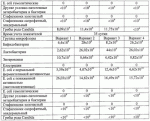
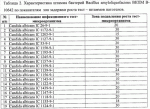
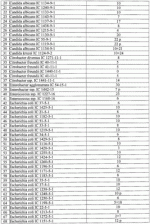
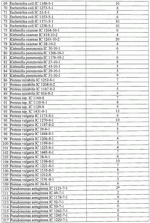
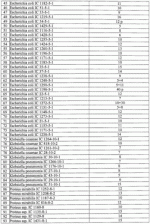
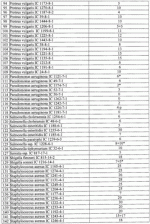
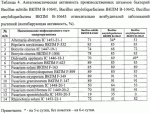
Штаммы бактерий bacillus subtilis и bacillus amyloliquefaciens, обеспечивающие восстановление микробиоценозов почвы и желудочно-кишечного тракта животных, обладающие бактерицидной, фунгицидной и вирулицидной активностью, и препарат на основе этих штаммовПатент на изобретение №: 2482174 Автор: Леляк Анастасия Александровна (RU), Леляк Александр Иванович (RU) Патентообладатель: Леляк Александр Иванович (RU) Дата публикации: 20 Августа, 2012 Начало действия патента: 10 Февраля, 2011 Адрес для переписки: 630559, Новосибирская обл., Новосибирский р-н, р.п. Кольцово, а/я 247, А.И. Леляку Изображения    Изобретения относятся к биотехнологии, ветеринарной медицине и защите растений. Штамм бактерий Bacillus subtilis IC-1435-1-1 депонирован в ВКПМ под регистрационным номером В-10641. Штамм бактерий Bacillus amyloliquefaciens IC-1436-1-23 депонирован в ВКПМ под регистрационным номером В-10642. Штамм бактерий Bacillus amyloliquefaciens IC-1437-1-23 депонирован в ВКПМ под регистрационным номером В-10643. Штаммы получены путем селекции и обеспечивают восстановление микробиоценозов почвы и желудочно-кишечного тракта животных, обладают бактерицидной, фунгицидной и вирулицидной активностью. Препарат на основе штаммов содержит наполнитель или воду с биомассой бактерий в споровой форме Bacillus subtilis ВКПМ В-10641, или Bacillus amyloliquefaciens номером ВКПМ В-10642, или Bacillus amyloliquefaciens ВКПМ В-10643, или их смесью в соотношении 1:1:1 с титром каждого штамма бактерий не менее 1-10 4 КОЕ/г или 1·104 КОЕ/мл. Препарат обладает бактерицидной и фунгицидной активностью. 4 н. и 3 з.п. ф-лы, 9 ил., 12 табл., 10 пр. Изобретение относится к штаммам микроорганизмов, стимулирующим восстановление микробиоценоза почвы и желудочно-кишечного тракта (ЖКТ) животных и человека, обладающим антибактериальной, фунгицидной и вирулицидной активностью, продуцирующим интерферон получения препаратов против бактериальных, грибных и вирусных инфекций животных и растений; использования в качестве микробиологических удобрений, предназначенных для восстановления почвенной микробиоты; изготовления лечебно-профилактических препаратов для животных и человека, способных восстанавливать и поддерживать микробиоценоз желудочно-кишечного тракта; корректировать и поддерживать в норме иммунный статус. Среди бактериальных фунгицидов, имеющих государственную регистрацию и внесенных в Государственный каталог пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации, в настоящее время нет фунгицида, обладающего столь широким спектром действия как в настоящем изобретении. Препарат Интеграл (жидкость на основе штамма 24Д Bacillus subtilis) зарегистрирован в качестве средства, предназначенного для применения против болезней зерновых культур (пшеница, ячмень яровой), овощных культур (картофеля, томатов и огурцов) и для борьбы с антракнозом черной смородины. Препарат Фитоспорин-М (порошок на основе штамма 24Д Bacillus subtilis) зарегистрирован для применения против болезней зерновых культур (пшеница, ячмень), бобовых (горох), овощных культур (картофель, капуста, томаты, огурцы), (патент РФ Препарат Бактофит (смачивающийся порошок на основе штамма ИПМ 215 Bacillus subtilis) предназначен для защиты от болезней овощных культур, выращиваемых в открытом и защищенном грунте, цветочных культур, а также черной смородины от мучнистой росы. Среди микробиологических удобрений аналогом заявляемого препарата является Бактофосфин, основу которого составляют почвенные микроорганизмы Bacillus mucilaginosus, предназначенные для обогащения почвы усвояемыми растениями формами фосфора, а также восстановления плодородия почв, повышения всхожести и урожайности на многих видах сельскохозяйственных культур в открытом и защищенном грунте. Авторами данного удобрения не приводятся конкретные данные по влиянию на показательные для плодородных почв группы микроорганизмов, а также влияния на урожайность культур. Микробиологическое удобрение Байкал ЭМ-1 содержит консорциум представителей различных групп микроорганизмов, в том числе грибов, которые, при внесении в почву развиваясь как симбиотическое сообщество, призваны увеличить численность почвенной микрофлоры и, соответственно, плодородие и урожайность. Однако вышеприведенные препараты обладают узким спектром действия. В отличие от вышеперечисленных заявляемый бактериальный препарат на основе заявляемого штамма Bacillus subtilis ВКПМ В 10641 зарекомендовал себя в лабораторных и полевых экспериментах как эффективное средство для борьбы с такими высоковредоносными болезнями малины и черной смородины, как пурпуровая пятнистость, фузариоз, альтернариоз, серая гниль, и не имеет аналогов на территории Российской Федерации. Известен ряд штаммов бактерий рода Bacillus, являющихся антагонистами различных возбудителей болезней сельскохозяйственных культур. Штамм Bacillus subtilis В-116 оказывает антагонистическое действие на грибы Pythium и Rhysoctonia. Штамм бактерий Bacillus subtilis ВНИИСХМ N128 используется для получения препарата против грибковых болезней хлопчатника (Авторское свидетельство СССР Однако эти штаммы оказывают ограниченное действие, направленное на отдельных возбудителей грибковых болезней различных сельскохозяйственных культур. Известен штамм бактерий Bacillus subtilis ВНИИСХМ N131, используемый для получения препарата против возбудителей гнилей яблок и винограда при их хранении (Авторское свидетельство СССР Однако вышеприведенные штаммы не были исследованы на антагонистическую активность и на способность восстанавливать микробиоценоз почвы и ЖКТ животных до эволюционно нормального, а также не обладают противовирусной активностью и не являются продуцентами интерферона. Известен штамм бактерий Bacillus subtilis ВКПМ В-7036 для получения препарата против грибковых болезней растений (Патент РФ Наиболее близким аналогом (прототипом) является штамм бактерий Bacillus subtilis IC-16, полученный путем трансформации штамма В. subtilis ВКПМ В-7048 (IC-9) рекомбинантной плазмидой ДНК рВМВ 105, содержащий ген альфа-2 интерферона (патент РФ Наиболее близким аналогом (прототипом) препаративной формы является препарат Фитоп, полученный на основе вышеуказанного штамма Bacillus subtilis ВКПМ В-7036 при следующем соотношении компонентов, мас.% (Патент РФ Однако штамм-прототип и препарат на его основе обладает недостаточно широким спектром антагонистической активности, а также не исследовался на способность восстановления микробиоценоза ЖКТ животных и почвы до эволюционно нормального. Техническим результатом заявляемых технических решений является обеспечение восстановления до эволюционно нормального микробиоценоза почвы, ЖКТ животных и расширение спектра антибактериальной, фунгицидной и вирулицидной активности с использованием препарата, полученного на основе заявляемых штаммов. Указанный технический результат достигается путем получения методом направленной селекции штаммов бактерий: - Bacillus subtilis IC-1435-1-1, обеспечивающий восстановление микробиоценоза почвы и желудочно-кишечного тракта животных, обладающий бактерицидной, фунгицидной и вирулицидной активностью и депонированный во Всероссийской Коллекции Промышленных Микроорганизмов ФГУП ГосНИИГенетика под регистрационным номером ВКПМ В-10641 (справка о депонировании прилагается); - Bacillus amyloliquefaciens IC-1436-1-23, обеспечивающий восстановление микробиоценоза почвы и желудочно-кишечного тракта животных, обладающий бактерицидной и фунгицидной активностью и депонированный во Всероссийской Коллекции Промышленных Микроорганизмов ФГУП ГосНИИГенетика под регистрационным номером ВКПМ В-10642 (справка о депонировании прилагается); - Bacillus amyloliquefaciens IC-1437-1-23, обеспечивающий восстановление микробиоценоза почвы и желудочно-кишечного тракта животных, обладающий бактерицидной и фунгицидной активностью и депонированный во Всероссийской Коллекции Промышленных Микроорганизмов ФГУП ГосНИИГенетика под регистрационным номером ВКПМ В-10643 (справка о депонировании прилагается). Указанный технический результат достигается также тем, что препарат характеризуется содержанием наполнителя или воды с биомассой бактерий в споровой форме Bacillus subtilis IC-1435-1-1 (ВКПМ В-10641), или Bacillus amyloliquefaciens IC-1436-1-23 (ВКПМ В-10642), или Bacillus amyloliquefaciens IC-1437-1-23 (ВКПМ В-10643), или их смеси в соотношении 1:1:1 с титром каждого штамма бактерий не менее 1·104 КОЕ/г или 1·10 4 КОЕ/мл. В качестве порошкообразного сорбента препарат содержит порошок отрубей, или цеолит, или полисахарид, или моносахарид, или дисахарид, или смесь полисахарида с моносахаридом или дисахаридом в соотношении от 1:100 до 1:10. В качестве полисахарида препарат содержит крахмал, в качестве моносахарида - глюкозу, в качестве дисахарида - сахарозу. Иммобилизация спор бактерий на сорбенте обеспечивает им дополнительную механическую защиту, предотвращает агрегирование спор и обеспечивает более равномерное их распределение в массе наполнителя. При применении препарата крахмал (полисахарид) способствует ускорению прорастания спор бактерий, что повышает эффективность его действия. Порошкообразный сорбент на основе сахарозы (сахара) или глюкозы является не только сорбентом - наполнителем, но и оказывает на препарат стабилизирующий и консервирующий эффект, создает более мягкие условия для хранения спор бактерий. Характеристика заявляемых штаммов. Штаммы бактерий Bacillus amyloliquefaciens подвергались селекции на подавление бактериального и грибного роста. Штамм Bacillus subtilis ВКПМ В-10641 получен путем селекции рекомбинантного штамма бактерий Bacillus subtilis IC-16. Указанный штамм подвергался селекции на подавление бактериального и грибного роста, а также по признаку количества продуцируемого интерферона Штамм Bacillus amyloliquefaciens IC-1436-1-23 получен путем селекции штамма бактерий Bacillus subtilis IC-9. Указанный штамм подвергался селекции на подавление бактериального и грибного роста. Исходный штамм-прототип Bacillus subtilis IC-9 депонирован во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) ГНИИ Генетика под номером ВКПМ В-7048. В связи с изменением методов идентификации микроорганизмов в Российской Федерации и других странах была выполнена работа по повторному определению видовой принадлежности заявляемого отселектированного штамма IC-1436-1-23 во всероссийской коллекции промышленных микроорганизмов (ВКПМ) методом детекции по 16s pPHK, который был идентифицирован как Bacillus amyloliquefaciens с присвоением заявляемому штамму в коллекции ГНИИ Генетика номера ВКПМ В-10642. Штамм Bacillus amyloliquefaciens IC-1437-1-23 получен путем селекции штамма бактерий Bacillus licheniformis IC-1. Указанный штамм подвергался селекции на подавление бактериального и грибного роста. Исходный штамм-прототип Bacillus licheniformis IC-1 депонирован во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) ГНИИ Генетика под номером ВКПМ В-7038. В связи с изменением методов идентификации микроорганизмов в Российской Федерации и других странах была выполнена работа по повторному определению видовой принадлежности заявляемого отселектированного штамма IC-1437-1-23 во всероссийской коллекции промышленных микроорганизмов (ВКПМ) методом детекции по 16s pPHK, который был идентифицирован как Bacillus amyloliquefaciens с присвоением заявляемому штамму в коллекции ГНИИ Генетика номера ВКПМ В-10643. Культурально-морфологические и биохимические свойства штаммов бактерий Bacillus subtilis ВКПМ В-10641, Bacillus amyloliquefaciens ВКПМ В-10642, Bacillus amyloliquefaciens ВКПМ В-10643. Штаммы относятся к грамположительным факультативно аэробным палочковидным бактериям. При росте на мясопептонном агаре штамм бактерий Bacillus subtilis ВКПМ В-10641 образует шероховатые колонии белого цвета, врастающие в поверхность питательной среды. Клетки палочковидные, эндоспоры овальные, расположены центрально или парацентрально, не раздувают клетку при спорообразовании. Длина клетки - (2-3) мкм, ширина - (0,7-0,8) мкм. Капсулу не образуют. По Граму окрашиваются положительно. Штаммы бактерий Bacillus amyloliquefaciens ВКПМ В-10642 и Bacillus amyloliquefaciens ВКПМ В-10643 образуют шероховатые колонии кремового цвета. Клетки палочковидные, эндоспоры овальные, расположены центрально или парацентрально, не раздувают клетку при спорообразовании. Длина клетки - 2,0-3,8 мкм, ширина - 0,5-1,0 мкм. Капсулу не образуют. Штаммы являются олигофильными, размножаются при 25-45°С, оптимальный рост наблюдается при температуре 33-37°С. Через 48 часов роста при 37°С на мясопептонном агаре культура имеет непрозрачные колонии однородной мучнистой консистенции, с ровным краем. рН среды: минимальная 5,7; максимальная 8,0; оптимальная 7,0-7,2. Штаммы размножаются при 37°С на мясопептонном агаре и мясопептонном бульоне. Биохимические свойства штаммов. Не растут в анаэробных условиях, не образуют ацетилметилкарбинол из глюкозы в реакции Фогес - Проскауэра, ферментируют с образованием кислоты глюкозу, маннозу, фруктозу, рибозу, ликсозу, целлобиозу, трегалозу, мальтозу, туранозу. Гидролизуют крахмал, мочевину и эскулин. Обладают лецитиназной, каталазной активностью. Толерантны к концентрациям хлорида натрия в питательной среде в диапазоне 1-9%. Штаммы не являются зоопатогенными и фитопатогенными. Штаммы продуцируют биологически активные метаболиты, в том числе антибиотики и ферменты широкого спектра действия, подавляющие рост патогенной и условно-патогенной бактериальной и грибной микрофлоры, штамм бактерий Bacillus subtilis ВКПМ В-10641 продуцирует интерферон Для длительного хранения штаммов бактерий споровую массу лиофильно высушивают. Для массового размножения бактерий используют мясопептонный бульон. Культивирование проводят при температуре 37°С. Определение количества единиц активности интерферона Пяти беспородным белым мышам массой 18-20 г с помощью автоматической пипетки вводили перорально 0,1 см3 водной суспензии клеток штамма в концентрации 50 мг/см3 в течение 5 сут. Через 5 сут от начала введения штамма у 5 мышей отбирали для исследования образцы (отдельно от каждого животного). Животных подвергали эвтаназии методом цервикальной дислокации. Асептически вскрывали брюшную полость и извлекали по 0,5 см дистального и проксимального отделов кишечника. Извлеченные фрагменты кишечника помещали в предварительно взвешенную стерильную микропробирку с налитой в нее 0,5 см3 среды Игла MEM. Микропробирку с фрагментами кишечника взвешивали. Все пробы до анализа хранили при температуре минус 80°С. Образцы кишечника гомогенизировали в микропробирках с помощью тефлонового гомогенизатора. Осветляли центрифугированием при 10000 об/мин в течение 15 мин. Супернатант дополнительно осветляли и стерилизовали фильтрацией. В лунки планшета добавляли по 0,05 см3 раствора нейтрального красного (1,1 г/см3) в среде Игла MEM. Инкубировали в течение 90 мин. Содержимое лунок удаляли и лунки промывали трехкратно физиологическим раствором. Планшеты подсушивали в ламинарном потоке воздуха. В каждую лунку добавляли 0,1 см 3 этанола (подкисленного соляной кислотой до рН 4,0). Инкубировали в течение 30 мин и измеряли оптическую плотность при длине волны 490 нм. Определение специфической активности интерферона в биологических субстратах экспериментальных животных определяли с использованием 2-3-суточного монослоя культур клеток L-929 и Л-68, чувствительных к интерферону Для определения активности (титра) индикаторного вируса готовили десятикратные разведения культуры вируса, полученной из коллекции культур, в поддерживающей среде. Далее в культуральные планшеты вносили по 100 мм3 приготовленных разведении, используя на каждое разведение не менее четырех лунок. Инокулированные и контрольные культуры клеток инкубировали в течение 24 час при температуре 36,0±1,0°С в атмосфере с 5,0±0,5% CO2. За титр вируса принимали величину, обратную разведению препарата, при которой клеточная культура в 50% лунок оказалась полностью пораженной цитопатическим действием вируса. Активность (титр) вируса определяли методом Спирмена - Кербера по формуле:
где Dmax - десятичный логарифм разведения, выше которого произошла 100% гибель клеток (+); d - десятичный логарифм шага разведении (1,0); n - число лунок на каждую дозу (4); p - число лунок, давших гибель (+) в Dmax и последующих разведениях. Для определения активности интерферона в фильтрате гомогенатов фрагментов проксимального, дистального отделов кишечника экспериментальных животных и его содержимого готовили их двукратные разведения и двукратные разведения контрольного образца интерферона в поддерживающей среде (на 4 разведения ниже и выше предполагаемого титра). Из лунок культуральных планшетов удаляли ростовую среду и вносили по 100 мкл приготовленных разведении экспериментальных и контрольных образцов, используя на каждое разведение не менее 4 лунок с культурой клеток. Для контроля дозы индикаторного вируса оставляли 16 лунок с культурой клеток, а для контроля состояния монослоя клеток - 4 лунки. В эти 20 лунок вносили по 100 мкл поддерживающей среды, используемой для приготовления разведении анализируемых образцов. Инокулированные и контрольные культуры клеток инкубировали в течение 24 часов при температуре 36,0±1,0°С в атмосфере с 5,0±0,5% СО2. Затем в каждую лунку с опытными образцами и контролем интерферона вносили рассчитанную заранее дозу индикаторного вируса - вируса энцефаломиокардита мышей, соответствующую 100 ТЦД 50, в объеме по 0,1 см3 на каждую лунку. Учет и анализ результатов измерений проводили на вертикальном многоканальном спектрофотометре-флюориметре FL-600 с помощью программного обеспечения КС-4 Bio-Tek Ink., USA. Концентрация человеческого альфа-2 интерферона, полученная методом подавления ЦПД, была не менее 30 МЕ/г исследуемого образца, что на порядок выше, чем в исходном штамме-прототипе В.subtilis ВКПМ В-7092. Пример 1. Исследование непатогенности штаммов бактерий Bacillus subtilis ВКПМ В-10641, Bacillus amyloliquefaciens ВКПМ В-10642, Bacillus amyloliquefaciens ВКПМ В-10643. Исследование проведено в лаборатории биотехнологического контроля НПФ «Исследовательский центр». Патогенность каждого микроорганизма оценивали по выживаемости инфицированных животных, их внешнему виду и поведению, высеваемости бактерий из крови и органов в различные сроки после заражения, а также макроскопической картине внутренних органов при вскрытии животных в конце срока наблюдения. В работе использованы лабораторные животные двух видов: нелинейные белые мыши массой 18-20 г в количестве 40 особей обоего пола и крысы породы Вистар массой 180-200 г в количестве 40 особей обоего пола. Из животных формировали опытную и контрольную группу по 20 особей в каждой. Для выявления проникновения бактерий в органы экспериментальных животных животным из опытных групп на протяжении 60 суток перорально вводили суточную культуральную жидкость бактерий, полученную путем культивирования исследуемого штамма на мясопептонном бульоне. Животных из опытных и контрольных групп забивали по следующей схеме: - день 5 - по 4 особи из каждой группы (контрольной и опытной); - день 15 - по 4 особи из каждой группы (контрольной и опытной); - день 30 - по 4 особи из каждой группы (контрольной и опытной); - день 45 - по 4 особи из каждой группы (контрольной и опытной); - день 60 - по 4 особи из каждой группы (контрольной и опытной). После проведения вскрытия посев органов (сердце, легкое, печень, селезенка) и крови производили на мясопептонный и кровяной агары в чашки Петри методом отпечатков. Посевы инкубировали в термостате при температуре 37±1°С в течение 24 часов. Результат учитывали по наличию/отсутствию колоний на поверхности питательной среды в чашке Петри. В результате проведенных исследований установлено нижеследующее. В течение опыта не зарегистрировано гибели животных. Не отмечено каких-либо изменений в их внешнем виде и поведении. При макроскопической оценке внутренних органов во все периоды проведения вскрытий патологических изменений не обнаружено. Микробиологический анализ показал, что внутренние органы и кровь были стерильными в опытном и контрольном вариантах во все периоды проведения исследований. На основании отсутствия гибели животных и каких-либо изменений в их внешнем виде и общем поведении, на протяжении 60-дневного наблюдения, отрицательных результатов микробиологического анализа сердца, легких, печени, селезенки и крови сделан вывод, что штаммы бактерий Bacillus subtilis ВКПМ В-10641, Bacillus amyloliquefaciens ВКПМ В-10642, Bacillus amyloliquefaciens ВКПМ В-10643 являются непатогенными. Пример 2. Исследование антагонистической активности штаммов бактерий Bacillus subtilis ВКПМ В-10641, Bacillus amyloliquefaciens ВКПМ В-10642, Bacillus amyloliquefaciens ВКПМ В-10643. Полученные путем селекции штаммы бактерий Bacillus subtilis ВКПМ В-10641, Bacillus amyloliquefaciens ВКПМ В-10642, Bacillus amyloliquefaciens ВКПМ В-10643 характеризуются высокой антагонистической активностью в отношении патогенных и условно патогенных микроорганизмов. Антагонистическую активность в отношении тест-культур проверяли методом отсроченного антагонизма. В качестве тест-штаммов использовали Staphylococcus aureus, Candida albicans, Klebsiella pneumonia, Shigella flexneri, Shigella sonnet, Yersinia pseudotuberculosis, Serratia marcescens, Escherichia coli, Enterococcus spp. Используемые тест-штаммы удовлетворяли следующим требованиям: находились в S-форме, имели типичные морфологические и ферментативные свойства. Исследование антагонистической активности заявляемых штаммов бактерий Bacillus subtilis и Bacillus amyloliquefaciens производили на мясопептонном агаре. Рецептура мясопептонного агара на 1 дм3: - пептон мясной ферментативный - 10,0 г; - дрожжевой экстракт - 5,0 г; - хлорид натрия - 5,0 г; - агар микробиологический - 15,0 г. - дистиллированная вода - до общего объема 1 дм3. После смешивания компонентов среду разогревали до полного растворения агара и фильтровали через ватно-марлевый фильтр в колбы вместимостью 500 см3 по 300 см3. Колбы со средой закрывали ватно-марлевыми пробками, оборачивали горловину пергаментом и стерилизовали в автоклаве при давлении 0,15 МПа в течение 40 мин. После остывания до температуры 45±1°С среду разливали по стерильным чашкам Петри. Для контроля стерильности чашки с подсушенной средой помещали в термостат при температуре 37±1°С на 24±2 часа. Нестерильные чашки отбраковывали. Культуры патогенных микроорганизмов, указанные выше, выращивали на чашках Петри в течение 18±2 часов на мясопептонном агаре. В стерильные пробирки приливали по 1 мл физиологического раствора и готовили суспензии тест-штаммов с концентрацией микробных клеток (5,0±1,0)×108 КОЕ/см3. Для проведения испытания от каждой серии препарата отбирали 3 пробы по 1 г. Далее 0,5 г препарата разводили в 0,5 см3. Полученную взвесь высевали штрихом с помощью микробиологической петли по диаметру чашки Петри с мясопептонным агаром. Посевы инкубировали в термостате при температуре 37±1°С в течение 48±2 часов. Затем к выросшей в виде штриха культуре подсевали с помощью микробиологической петли суспензии патогенов методом перпендикулярных штрихов. Учет результатов проводили через 8 часов инкубирования при 37±1°С по величине зон угнетения роста тест-штаммов. Контролем роста культур патогенов служил их параллельный высев на чашки Петри с той же плотной средой (мясопептонным агаром) без исследуемой ассоциации антагонистов. Полученные в опыте данные представлены в таблицах 1, 2 и 3. Таким образом, исследуемые штаммы бактерий проявляют антагонистическую активность в отношении широкого спектра патогенных и условно патогенных микроорганизмов. Пример 3. Методика культивирования бактерий Bacillus subtilis и Bacillus amyloliquefaciens для получения микробной биомассы. Для получения биомассы спор бактерий штаммы Bacillus subtilis ВКПМ В-10641, Bacillus amyloliquefaciens ВКПМ В-10642, Bacillus amyloliquefaciens ВКПМ В-10643 культивировали на жидкой питательной среде следующего состава: - пептон мясной ферментативный - 10,0 г; - дрожжевой экстракт - 5,0 г; - хлорид натрия - 5,0 г; - дистиллированная вода - до общего объема 1 дм3. рН 7,2±0,2. На 1 дм3 ферментационной питательной среды использовали 10 см3 посевного материала с титром 108 КОЕ/см3 . Процесс выращивания биомассы осуществляли в ферментере в течение 48±2 часов. При указанном способе культивирования может быть получен титр спор (5-10)×1010 КОЕ/см 3. Пример 4. Получение готовой формы препарата на основе бактерий штаммов Bacillus subtilis и Bacillus amyloliquefaciens. Вначале готовят смесь собранной и проверенной по показателям качества сырой биомассы с наполнителем. В качестве наполнителя может быть использована вода (для обработки растений методом распыления) с титром спор не менее 1·104 КОЕ/мл или порошкообразный сорбент, например цеолит. В качестве сорбента используют также порошок из отрубей или сахарную пудру и крахмал в соотношении биомасса, пудра и крахмал 1:5:5, тщательно перемешивают. В процессе перемешивания происходит иммобилизация спор бактерий на частицы крахмала. Далее в полученную смесь вводят сахарную или глюкозную пудру из расчета 1 часть смеси на 10 частей пудры. В результате получают концентрат препарата с титром спор не менее 1×1010 КОЕ/г. Далее его смешивают с сахарной или глюкозной пудрой и крахмалом в такой пропорции, чтобы получить готовый препарат с титром спор не менее 1·10 4-106 КОЕ/г. Остаточная влажность препарата составляет не более 5%. Пример 5. Составы препаратов 5.1. Состав 1. Водный раствор биомассы спор бактерий Bacillus amyloliquefaciens ВКПМ В-10642 с титром спор не менее 1·104 КОЕ/мл. Данный раствор хранят в темном месте не более 1-2 суток. 5.2. Состав 2. Смесь биомассы спор бактерий Bacillus amyloliquefaciens ВКПМ В-10642 с цеолитом с титром спор не менее 1·106 КОЕ/г. 5.3. Состав 3. Смесь биомассы спор бактерий Bacillus subtilis ВКПМ В-10641 не менее 1·106 КОЕ/г со смесью крахмала и пудры на основе сахарозы в соотношении 1:100. 5.4. Состав 4. Смесь биомассы спор бактерий Bacillus subtilis ВКПМ В-10641 с порошком из отрубей с титром спор не менее 1·106 КОЕ/г. 5.5. Состав 5. Смесь биомассы спор бактерий Bacillus amyloliquefaciens ВКПМ В-10643 с титром спор не менее 1·106 КОЕ/г со смесью крахмала и пудры на основе сахарозы в соотношении 1:50. 5.6. Состав 6. Смесь биомассы спор бактерий Bacillus amyloliquefaciens ВКПМ В-10643 с титром спор не менее 1·10 6 КОЕ/г со смесью крахмала и пудры на основе сахарозы в соотношении 1:10. 5.7. Состав 7. Биомасса спор бактерий Bacillus amyloliquefaciens ВКПМ В-10643, Bacillus amyloliquefaciens ВКПМ В-10642, Bacillus subtilis ВКПМ В-10641 в соотношении 1:1:1 с титром спор каждого вида бактерий не менее 1·104 КОЕ/г со смесью крахмала и пудры на основе глюкозы в соотношении 1:20. 5.8. Состав 8. Смесь биомассы спор бактерий Bacillus subtilis ВКПМ В-10641 с крахмалом с титром не менее 1·106 КОЕ/г. 5.9. Состав 9. Смесь биомассы спор бактерий Bacillus subtilis ВКПМ В-10641 с сахарозой с титром не менее 1·106 КОЕ/г. 5.10. Состав 10. Смесь биомассы спор бактерий Bacillus subtilis ВКПМ В-10641 с глюкозой с титром не менее 1·106 КОЕ/г. 5.11. Состав 11. Водный раствор биомассы спор бактерий Bacillus amyloliquefaciens ВКПМ В-10643 с титром спор не менее 1·104 КОЕ/мл. Данный раствор хранят в темном месте не более 1-2 суток. 5.12. Состав 12. Водный раствор биомассы спор бактерий Bacillus subtilis ВКПМ В-10641 с титром спор не менее 1·104 КОЕ/мл. Данный раствор хранят в темном месте не более 1-2 суток. 5.13. Состав 13. Водный раствор биомасс спор бактерий Bacillus amyloliquefaciens ВКПМ В-10643, Bacillus amyloliquefaciens ВКПМ В-10642, Bacillus subtilis ВКПМ В-10641 в соотношении 1:1:1 с титром спор каждого вида бактерий не менее 1·104 КОЕ/г. Данный раствор хранят в темном месте не более 1-2 суток. 5.14. Состав 14. Водный раствор биомассы спор бактерий Bacillus subtilis ВКПМ В-10641 с титром спор не менее 1·10 6 КОЕ/мл. 5.15. Состав 15. Водный раствор биомассы спор бактерий Bacillus amyloliquefaciens ВКПМ В-10642 с титром спор не менее 1·106 КОЕ/г. 5.16. Состав 16. Водный раствор биомассы спор бактерий Bacillus amyloliquefaciens ВКПМ В-10643 с титром спор не менее 1·10 6 КОЕ/г. Пример 6. Данные по хранению сухой формы препарата на основе штаммов Bacillus subtilis ВКПМ В-10641, Bacillus amyloliquefaciens ВКПМ В-10642, Bacillus amyloliquefaciens ВКПМ В-10643. Для установления срока годности и условий хранения препарата проведены соответствующие исследования. В течение 96 месяцев хранения сухой формы препарата при температуре 30±0,5°С титр и антагонистическая активность препарата не изменились, что подтверждает высокую термостабильность препаратов в споровой форме, обеспечивающую значительное упрощение технологии их применения в медицине, ветеринарии и растениеводстве. Пример 7. Данные по ингибирующей активности штаммов бактерий Bacillus subtilis ВКПМ В-10641, Bacillus amyloliquefaciens ВКПМ В-10642, Bacillus amyloliquefaciens ВКПМ В-10643 в отношении фитопатогенов. Для испытания штаммов Bacillus subtilis и Bacillus amyloliquefaciens в отношении способности ингибировать фитопатогенов использовали метод агаровых блоков. Суспензию препарата с титром 1×108 КОЕ/см 3 вносили в мясопептонный агар, остуженный до температуры 36±1°С. Для выращивания фитопатогенов использовали картофельно-глюкозный агар. Инокулированную штаммами (каждым в отдельности) среду разливали в чашки Петри и на застывшую поверхность, в центр помещали блок диаметром 10 мм, вырезанный из колонии фитопатогена. Учет результатов проводили с периодичностью в 3 дня. Активность штамма учитывали по изменению диаметра колонии гриба в сравнении с контролем (среда без внесения штаммов). На основании полученных данных определяли ингибирующую активность, которую рассчитывали по формуле: ИА=[(Дк-До)/Дк]×100, где Дк - диаметр колонии в контрольном варианте; До - диаметр колонии в опытном варианте. В таблице 4 приведены значения показателей ингибирующей активности в отношении грибных фитопатогенов испытуемых штаммов бактерий, полученные в эксперименте. Таким образом, заявляемые штаммы бактерий Bacillus subtilis и Bacillus amyloliquefaciens проявляет антагонистическую активность по отношению к обозначенным в таблице 4 грибным фитопатогенам. Пример 8. Данные полевых испытаний по изучению влияния препаратов на основе штаммов Bacillus subtilis ВКПМ В-10641, Bacillus amyloliquefaciens ВКПМ В-10642, Bacillus amyloliquefaciens ВКПМ В-10643 на пораженность малины пурпуровой пятнистостью и на поражение смородины септориозом. Для испытания штаммов Bacillus subtilis ВКПМ В-10641, Bacillus amyloliquefaciens ВКПМ В-10642 в отношении болезней малины и смородины в открытом грунте использовали промышленные посадки малины сорта Зоренька Алтая и смородины сорта Софья. В качестве химического эталона использовали Топаз в концентрации 0,1%. Обработку проводили суспензией препаратов с титром 106 спор/мл. Обработку посадок проводили в июле и июне согласно схеме опыта: - штаммы Bacillus subtilis ВКПМ В-10641 и Bacillus amyloliquefaciens ВКПМВ-10642; - Топаз 0,1%; - контроль. Повторность опыта четырехкратная, площадь делянки 10 м2, расход рабочей жидкости - 4 дм3 на вариант. Схемы на малине и смородине аналогичны. Поражение листьев смородины септориозом учитывали по следующей шкале: - 0 - баллов - здоровые листья; - 1 балл - слабое развитие заболевания (занято пятнами от 0 до 10% поверхности листовой пластинки); - 2 балла - средние развитие заболевания (занято пятнами от 11 до 25% поверхности листовой пластинки); - 3 балла - сильное развитие заболевания (занято пятнами от 26 до 50% поверхности листовой пластинки); - 4 балла - очень сильное развитие заболевания (занято пятнами более 50% поверхности листовой пластинки). Степень повреждения побегов малины оценивали по специальной 4-бальной шкале для пурпуровой пятнистости малины: - 0 баллов - здоровый стебель; - 1 балл - поверхность пораженного участка гладкая, возможны утолщения коры, участок расположен по одну сторону стебля; - 2 балла - поверхность пораженного участка гладкая, возможны трещины коры, участок расположен по обе стороны стебля; - 3 балла - поверхность пораженного участка деформирована, участок расположен по обе стороны стебля; - 4 балла - поверхность пораженного участка деформирована, участок окольцовывает стебель. Развитие болезни определяли по следующей формуле:
где R - индекс развития болезни, %; а - количество растений соответствующего балла, шт; b - балл шкалы; N - общее количество растений, шт; К - высший балл используемой шкалы. Распространенность рассчитывали по формуле:
где R - индекс распространенности болезни, %; а - количество растений в контроле, шт; b - количество растений в опыте, шт. Биологическую эффективность биопрепаратов определяли по формуле:
где а - показатель средней пораженности в контроле, %; b - показатель средней пораженности на обработанном участке, %. Результаты полевых опытов представлены в таблицах 5 и 6. Таким образом, обработка насаждений малины препаратами на основе штаммов Bacillus subtilis ВКПМ В-10641 и Bacillus amyloliquefaciens ВКПМ В-10642 в полевом опыте снижала: развитие болезни почти в 3 раза; распространенность - больше, чем в 2 раза. Таблица 5. Влияние заявляемых препаратов на основе штаммов бактерий Bacillus subtilis ВКПМ В-10641 и Bacillus amyloliquefaciens ВКПМ В-10642 на поражение малины пурпуровой пятнистостью (СХА «Сады Сибири», 2009 год). ВариантРаспространенность, %Развитие, % Биологическая эффективность, %Контроль 75,0 25,0- Bacillus amyloliquefaciens ВКПМ В-1064227,3 11,4 54,4Bacillus subtilis ВКПМ В-10641 38,69,7 61,2Топаз 0,1%38,6 10,856,8 НСР05 2,0 2,0  Биологическая эффективность составила 54,4-61,2% в зависимости от срока проведения учета. Прибавка урожайности составила 0,3 т/га. Обработка насаждений смородины штаммами бактерий Bacillus subtilis ВКПМ В-10641 и Bacillus amyloliquefaciens ВКПМ В-10642 в полевом опыте снижала развитие болезни в 2,2 раза. Биологическая эффективность составила 41,8-59,7% в зависимости от срока проведения учета. Таблица 6. Влияние заявляемых препаратов на основе штаммов бактерий Bacillus subtilis ВКПМ В-10641 и Bacillus amyloliquefaciens ВКПМ В-10642 на поражение смородины септориозом (СХА «Сады Сибири», 2009 год) Вариант Биологическая эффективность, %* Сроки учетов 27 июня4 июля 11 июля Bacillus amyloliquefaciens ВКПМ В-1064256,5 48,4 46,8Bacillus subtilis ВКПМ В-10641 59,743,5 41,9Топаз 0,1%64,5 56,556,5 Пример 9. Исследования заявляемого препарата в виде микробиологического удобрения Было изучено влияние экспериментальных биологических препаратов на основе спорообразующих бактерий Bacillus subtilis и Bacillus amyloliquefaciens на качественные показатели урожая мягкой яровой пшеницы Баганская - 95 в условиях Западной Сибири. Исследования проводили в 2007-2009 годах на территории ФГУ «Госсортсеть» (Новосибирский район, с.Верх - Тула). Тип почвы: чернозем выщелоченный среднемощный, среднегумусный, механический состав - тяжелосуглинистый. Для посева на экспериментальном участке использовали семена первой репродукции сорта яровой мягкой пшеницы Баганская - 95. Повторность опыта четырехкратная, площадь одной делянки составила 42 м2. Была изучена эффективность применения экспериментальных биологических препаратов на основе спорообразующих бактерий рода Bacillus (Bacillus subtilis, Bacillus amyloliquefaciens) в следующих вариантах: 1 - контроль 1, не предпосевная обработка семян не проводилась; 2 - контроль 2, предпосевная обработка семян проводилась химическим протравителем (Виал-ТТ); 3 - предпосевная обработка семян выполнена препаратом (состав 13) на основе смеси штаммов бактерий Bacillus subtilis ВКПМ В-10641, Bacillus amyloliquefaciens ВКПМ В-10642, Bacillus amyloliquefaciens ВКПМ В-10643 (далее по тексту в примере 9 - Фитоп 8.67) и препаратов (составы 1, 11 и 12) на основе монокультур штаммов (расход смеси и монокультур - 10 мл/т); 4 - проводилась внекорневая подкормка вегетирующих растений в фазу кущения; 5 - выполнена предпосевная обработка семян смесью штаммов и внекорневая подкормка вегетирующих растений в фазу кущения. В вегетационный период для всех вариантов опыта была проведена однократная гербицидная обработка посевов баковой смесью Магнум, в.д.г. (5 г/га), Диален-супер, в.р. (0,4 л/га). Топик, к.э. (0,5 л/га). По итогам трехлетних экспериментов выявлено положительное влияние Фитопа 8.67 при его использовании для обработки семян и подкормки вегетирующих растений в фазу кущения на урожайность и качественные характеристики яровой пшеницы. Полученные данные представлены в таблицах 7, 8 и 9. Таблица 7. Масса тысячи зерен, г. Мягкая яровая пшеница Баганская - 95. Вариант опыта2007 2008 2009 В среднем за годы опыта гг гг к контролю 1% Контроль 1 (без обработок)34,2 30,8 33,832,9 0,0100,0 Контроль 2 (обработка семян химическим протравителем Витал-ТТ) 35,531,1 34,833,8 0,9102,7 Обработка семян Фитопом 8.6735,6 3135,6 34,11,2 103,5Обработка семян Азофитом20,8 20,5 22,221,2 4,1123,8 Обработка семян Криаллом 20,7 2021,2 20,63,5 120,7Обработка семян Фитопом 8.67 и Криаллом 35,731,6 36,234,5 1,6104,9 Подкормка Фитопом 8.6734,7 31,537,6 34,61,7 105,2Подкормка Азофитом20,8 23,7 21,221,9 4,8128,1 Подкормка Криаллом 20,7 2323,6 22,45,3 131,2Подкормка Фитопом 8.67 и Криаллом 31,931 31,231,4 -1,595,3 Обработка семян Фитопом 8.67 и подкормка Фитопом 8.67 34,630,5 35,733,6 0,7102,1 Обработка семян Азофитом и подкормка Азофитом 20,822 16,719,8 2,7116,0 Обработка семян Криаллом и подкормка Криаллом 20,721,3 16,219,4 2,3113,5 Обработка семян Фитопом 8.67 совместно с Криаллом и подкормка Фитопом 8.67 совместно с Криаллом33,9 29,6 30,831,4 -1,595,5В таблице 7 приведены данные по влиянию Фитопа 8.67 на массу 1000 зерен пшеницы. Наибольшее достоверное увеличение массы тысячи зерен отмечено в варианте подкормки вегетирующих растений Криаллом (на 5,3 г по сравнению с контролем 1 и на 4,4 г по сравнению с контролем 2). Также отмечено достоверное (НСР) по сравнению с контролем 1 и контролем 2 увеличение массы тысячи зерен в вариантах опыта с обработкой семян на 1,2 г и 0,3 г и обработкой семян с последующей подкормкой в период кущения Фитопом 8.67 на 1,7 г и 0,8 г. Хорошо показал себя вариант, в котором Фитоп 8.67 и препарат Криалл использовали совместно для обработки семян перед посевом. Однако внекорневая подкормка посевов в период кущения смесью этих препаратов отрицательно повлияла на массу тысячи зерен, которая снизилась по сравнению с обоими контрольными вариантами. Масса тысячи зерен в контроле 2 превышала аналогичное значение в контроле 1 на 0,9 г. Остальные варианты опыта показали более низкое значение массы тысячи зерен по сравнению с контролем 2, но более высокое по сравнению с контролем 1. В таблице 8 представлены данные по влиянию Фитопа 8.67 на содержание клейковины в зернах пшеницы. Достоверное увеличение содержания клейковины в зерне отмечено при совокупном использовании предпосевной обработки семян и внекорневой подкормки растений в период кущения Фитопом 8.67 - на 1,6% относительно контроля 1 и 0,2% относительно контроля 2. В зерне, полученном после сбора урожая в контроле 2, содержание клейковины превышало его аналогичное значение в контроле 1 на 1,4%. Использование препаратов Криалл и Азофит для обработки семян и внекорневой подкормки негативно отразилось на содержании клейковины, процентное содержание которой в указанных вариантах опыта было ниже, чем в контроле 1 и контроле 2. Увеличение содержания клейковины отмечено в вариантах опыта с совместным использованием для обработки семян и подкормки в период кущения Фитопа 8.67 и препарата Криалл. В остальных вариантах опыта отмечено повышенное по сравнению с контролем 1 содержание клейковины, однако ее повышение не превосходит значение HCP05 и не может быть признано значимым. Таблица 8. Содержание клейковины, %. Мягкая яровая пшеница Баганская - 95 Вариант опыта2007 2008 2009 В среднем за годы опыта %% %% к контролю 1% Контроль 1 (без обработок)30 29,8 21,827,2 0,0100,0 Контроль 2 (обработка семян химическим протравителем Витал-ТТ) 3331,2 21,728,6 1,4105,3 Обработка семян Фитопом 8.6732 30,520 27,50,3 101,1Обработка семян Азофитом32 25 20,725,9 -1,395,2 Обработка семян Криаллом 32 27,720,7 26,8-0,4 98,5Обработка семян Фитопом 8.67 совместно с Криаллом 2927,6 1925,2 -2,092,6 Подкормка Фитопом 8.6732 28,922,5 27,80,6 102,2Подкормка Азофитом32 30 19,327,1 -0,199,6 Подкормка Криаллом 31 30,719,7 27,1-0,1 99,8Подкормка Фитопом 8.67 совместно с Криаллом 3328,2 20,727,3 0,1100,4 Обработка семян Фитопом 8.67 и подкормка Фитопом 8.67 3528,4 2328,8 1,6105,9 Обработка семян Азофитом и подкормка Азофитом 3332,4 2028,5 1,3104,7 Обработка семян Криаллом и подкормка Криаллом 3330,4 2128,1 0,9103,4 Обработка семян Фитопом 8.67 совместно с Криаллом и подкормка Фитопом 8.67 совместно с Криаллом32 33,6 22,429,3 2,1107,8В таблице 9 представлены данные по влиянию Фитопа 8.67 на урожайность пшеницы. Урожайность была достоверно выше в вариантах опыта: с обработкой семян Фитопом 8.67 на 4,3 ц/га и 1,1 ц/га; обработкой семян Фитопом 8.67 с последующей внекорневой подкормкой Фитопом 8.67 в период кущения на 5,1 ц/га и 1,9 ц/га; обработкой семян Фитопом 8.67 с препаратом Криалл - на 6,8 ц/га и 3,6 ц/га по сравнению с контролем 1 и контролем 2 соответственно. В варианте опыта с контролем 2 урожайность мягкой яровой пшеницы превысила ее значение в контроле 1 на 3,2 ц/га. В следующих вариантах опыта урожайность превышала аналогичный показатель в контроле 1, но была ниже значения, полученного в варианте опыта с протравливанием семян химическим протравителем Виал-ТТ совместно с обработкой семян Фитопом 8.67 и последующей подкормкой в период кущения Фитопом 8.67 на 1,9 ц/га. Более высокая, чем в контроле 2 урожайность отмечена в вариантах опыта с предпосевной обработкой семян препаратами Криалл и Азофит и последующей подкормкой этими же препаратами. Таблица 9. Урожайность, ц/га. Мягкая яровая пшеница Баганская - 95. Вариант опыта2007 2008 2009 В среднем за годы опыта ц/гац/га ц/гац/га к контролю 1% Контроль 1 (без обработок)17,5 17,6 16,117,1 0,0100,0 Контроль 2 (обработка семян химическим протравителем Витал-ТТ) 2017,9 23,120,3 3,2118,9 Обработка семян Фитопом 8.6721,3 21,521,4 21,44,3 125,1Обработка семян Азофитом20,8 20,5 22,221,2 4,1123,8 Обработка семян Криаллом 20,7 2021,2 20,63,5 120,7Обработка семян Фитопом 8.67 совместно с Криаллом 21,323,9 26,623,9 6,8140,0 Подкормка Фитопом 8.6721,3 22,223 22,25,1 129,6Подкормка Азофитом20,8 23,7 21,221,9 4,8128,1 Подкормка Криаллом 20,7 2323,6 22,45,3 131,2Подкормка Фитопом совместно с Криаллом 21,321,2 2020,8 3,7121,8 Обработка семян Фитопом 8.67 и подкормка Фитопом 8.67 21,320,9 14,719,0 1,9110,9 Обработка семян Азофитом и подкормка Азофитом 20,822 16,719,8 2,7116,0 Обработка семян Криаллом и подкормка Криаллом 20,721,3 16,219,4 2,3113,5 Обработка семян Фитопом 8.67 совместно с Криаллом и подкормка Фитопом 8.67 совместно с Криаллом21,3 20,1 12,718,0 0,9105,5В таблице 10 представлены данные по влиянию препарата (состав 13) Фитоп 8.67 и препаратов на основе штаммов бактерий Bacillus subtilis ВКПМ В-10641 (состав 12), Bacillus amyloliquefaciens ВКПМ В-10642 (состав 1), Bacillus amyloliquefaciens ВКПМ В-10643 (состав 11) на различные группы почвенных микроорганизмов. Обработка семян препаратом (состав 13) Фитоп 8.67 на основе смеси штаммов, а также препаратами на основе монокультур штаммов Bacillus subtilis (состав 12) и Bacillus amyloliquefaciens (препараты составов 1 и 11) позволяет достоверно повысить общее микробное и грибное число, а также количество нитрификаторов и аммонификаторов в почве, а также способствует увеличению количества зимогенной микрофлоры. Аналогичные данные получены при применении Фитопа 8.67 для внекорневой подкормки растений пшеницы в период вегетации и совместном действии при обработке семян и подкормке. Таблица 10. Численный состав микрофлоры почвы (фрактал, в среднем за 3 года испытаний). Вариант опытаОМЧ ОГЧ НитрификаторыАммонификаторы Автохтонная микрофлора Зимогенная микрофлора, суммарно 12 34 56 7Контроль 1 (без обработок) 0,41 0,21,7 5,17,4 Контроль 2 (обработка семян химическим протравителем Витал-ТТ) 1,00,1 0,11,8 0,43,1 Обработка семян Фитопом 8.675,3 4,21,5 2,70,8 35,1Обработка семян Азофитом0,2 0,3 0,40,9 1,42,9 Обработка семян Криаллом 12,5 3,12,8 23,01,9 8,2Обработка семян Фитопом 8.67 совместно с Криаллом 5,56,7 1,31,3 1,217,6 Подкормка Фитопом 8.675,0 1,82,4 10,01.8 85,5Подкормка Азофитом14,5 2,8 7,31,2 3,0143,1 Подкормка Криаллом 2,0 2,01,0 0,10,1 0,2Подкормка Фитопом совместно с Криаллом 2,11,0 4,617,0 1,015,3 Обработка семян Фитопом 8.67 и подкормка Фитопом 8.67 3,91,5 3,53,0 0,34,8 Обработка семян Азофитом и подкормка Азофитом 7,51,8 4,73,2 0,10,8 Обработка семян Криаллом и подкормка Криаллом 4,11,7 6,05,0 2,034,1 Обработка семян Фитопом 8.67 совместно с Криаллом и подкормка Фитопом 8.67 совместно с Криаллом3,3 1,7 4,27,0 0,11,5 Обработка семян штаммом бактерий Bacillus subtilis ВКПМВ-10641 (состав 12) 4,311 1,52,3 5,945,9 Обработка семян штаммом бактерий Bacillus amyloliquefaciens ВКПМ В-10642 (состав 1) 1,2 2,20,6 2,14,0 90,3Обработка семян штаммом бактерий Bacillus amyloliquefaciens ВКПМ В-10643 (состав 11)2,0 1,1 1,41,0 4,7116,6Пример 10. Данные по восстановлению микрофлоры желудочно-кишечного тракта животных на смоделированном в лабораторных условиях сальмонеллезе. Данные представлены на фиг.1-9. Фиг.1 - график количественного учета динамики выделения Salmonella typhimurium штамм 5715 из фекалий крыс. Фиг.2 - график изменения титра IgG в сыворотке крови крыс в контрольной группе. Фиг.3 - график изменения титра IgG в сыворотке крови крыс в 1 группе, по дням. Фиг.4 - график изменения титра IgG в сыворотке крови крыс во 2 группе, по дням. Фиг.5 - график изменения титра IgG в сыворотке крови крыс, по группам. Фиг.6 - график количественного учета динамики выделения Salmonella typhimurium штамм 5715 из фекалий крыс. Фиг.7 - график изменения титра IgG в сыворотке крови крыс в 3 группе, по дням. Фиг.8 - график изменения титра IgG в сыворотке крови крыс в 4 группе, по дням. Фиг.9 - график изменения титра IgG в сыворотке крови крыс, по группам. В качестве тест-объекта для инфицирования в лабораторных условиях использовали здоровых крыс породы Вистар обоего пола массой 280±10 г из питомника НПФ «Исследовательский центр». Животных содержали при температуре 25±1°С и 12-часовом освещении. В качестве корма использовали гранулы для кормления лабораторных мышей и крыс. В качестве лечебно-профилактического средства применяли суспензию клеток штамма Bacillus subtilis ВКПМ В-10641 (водный раствор, состав 14) в количестве не менее 1×106 КОЕ/мл (далее по тексту - препарат Ветом 1.23). Для инфицирования животных использовали суспензию клеток в физиологическом растворе агаровой культуры Salmonella typhimurium штамм 5715 (задепонированной за номером 100067 в Государственной коллекции патогенных микроорганизмов государственного института стандартизации и контроля медицинских биологических препаратов им. Л.А.Тарасовича Роспотребнадзора РФ) с концентрацией 5×107 КОЕ/мл. Инфицирование осуществляли парентерально (внутрибрюшинно), инфицирующая доза - 1 мл. Динамику выделения сальмонелл определяли двумя методами - посевом суспензии фекалий крыс на дифференциальные питательные среды с последующим серотипированием выделенной культуры и твердофазным «сэндвич»-методом (с использованием текст-системы «IgG общий - ИФА - БЕСТ»). На первой стадии определения динамики выделения сальмонелл твердофазным «сэндвич»-методом калибровочные образцы с известной концентрацией IgG и анализируемые образцы инкубировали в лунках стрипированного планшета с иммобилизированными моноклональными антителами (МКАТ) к IgG; на второй стадии, связавшийся в лунках IgG обрабатывали конъюгатом МКАТ к легким (лямбда и каппа) цепям иммуноглобулинов крысы с пероксидазой. После отмывания избытка конъюгата образовавшиеся иммунные комплексы «иммобилизированные МКАТ - IgG - конъюгат» выявляли ферментативной реакцией пероксидазы с перекисью водорода в присутствии хромогена (ОФД). После постановки пероксидазной реакции стоп-реагентом результаты учитывали фотометрически. Концентрацию IgG в образцах определяли по калибровочному графику. Были сформированы следующие группы: контрольная; 1 опытная (лечебная), в которой Ветом 1.23 в дозе 75 мл/кг задавали перорально в течение 10 дней после инфицирования; 2 опытная (лечебная), в которой Ветом 1.23 задавали перорально в дозе 100 мл/кг в течение 10 дней после инфицирования; 3 опытная (профилактическая), в которой Ветом 1.23 задавали перорально в дозе 75 мл/кг за 10 дней до инфицирования; 4 опытная (профилактическая), в Ветом 1.23 задавали перорально в дозе 100 мл/кг за 10 дней до инфицирования. Повторность в опыте применялась четырехкратная. Установлено, что в лабораторных условиях при искусственно смоделированном на крысах сальмонеллезе Ветом 1.23 обладает как лечебной, так и профилактической эффективностью. В результате трехкратного определения содержания микробных клеток сальмонелл в фекалиях крыс установлено (фиг.1), что в двух опытных группах за период эксперимента количество КОЕ/г сальмонелл снижалось. Снижение титра сальмонелл относительно контроля на порядок зарегистрировано на 1 день после начала лечения (фиг.1) при даче препарата в дозе 100 мл/кг живой массы и на 10 день после начала лечения при даче препарата в дозе 75 мл/кг, что свидетельствует о терапевтической эффективности Ветома 1.23 при лечении сальмонеллеза. Из данных диаграммы (фиг.2) видно, что наибольший титр IgG в разведении 1:128000 в контрольной группе наблюдался на 10 день эксперимента. Ввиду значительного варьирования показателей в остальных разведениях ввиду высокой концентрации сыворотки крови в дальнейшем было принято решение о целесообразности учета только данных разведении 1:128000. В 1 и 2 опытных группах (фиг.3, 4) уровень IgG в сыворотке значительно увеличился к последнему дню эксперимента. Для сравнения величин изменения титров IgG в сыворотке крови животных 1, 2 опытных и контрольной групп была составлена общая диаграмма (фиг.5, разведение 1:128000). Отмечено, что в первой группе за период проведения эксперимента показатель оптической плотности IgG повысился на 0,212, во второй - на 0,199, в контрольной группе - на 0,041. Разница между данными, полученными от опытных групп и контрольной, статистически достоверна на уровне НСР05. Учитывая изменения количества микробных единиц сальмонелл в кале зараженных животных и сопоставляя их с данными определения титра IgG, можно сделать вывод, что использование Ветома 1.23 в терапии сальмонеллеза оказывает терапевтический эффект и обеспечивает переболевание животных сальмонеллезом в более легкой (абортивной) форме. Наиболее высокий титр IgG наблюдался у животных, получающих Ветом 1.23 в дозе 75 мл/кг. При определении профилактической эффективности Ветома 1.23 в дозировках препарата 75 (3 группа) и 100 (4 группа) мл/кг массы тела животного анализ изменения количества микробных единиц сальмонелл в кале зараженных животных проводили по группам дважды: через 4 дня после инфицирования (4-й день эксперимента) и через 10 дней после инфицирования (24-й день эксперимента). Определение изменения титра IgG в сыворотке крови крыс мы проводили трижды: до начала применения препарата (1-й день эксперимента); через 4 дня после инфицирования (4-й день эксперимента) и через 10 дней после инфицирования (14-й день эксперимента). В результате установлено (фиг.6), что животные 3 группы в начале заболели сальмонеллезом, однако, к концу эксперимента они перестали выделять сальмонеллу с калом, что может свидетельствовать об их клиническом выздоровлении. В 4 группе в фекалиях крыс сальмонелл не обнаружено за весь период эксперимента, что свидетельствует о хорошей иммунной защите к инфицирующему агенту. В отличие от контрольной группы, где количество КОЕ/г сальмонелл в фекалиях крыс не снизилось за все время проведения эксперимента. Следовательно, Ветом 1.23 является эффективным средством для профилактики сальмонеллеза при использовании его в дозе 100 мл/кг. При изучении динамики изменения титра IgG в сыворотке крови установлено (фиг.7), что в 3 группе (доза препарата 75 мл/кг) титр IgG в разведении 1:128000 на 4 день заражения был незначительно выше, чем в 1 день эксперимента (что может объяснить заболевание животных в первые дни заражения), затем, к 24 дню эксперимента, их титр значительно увеличился, и, возможно, поэтому в этот период мы не обнаружили микробные единицы сальмонелл в кале. В 4 опытной группе (доза препарата 100 мл/кг) титр IgG спустя 4 дня после заражения был сравнительно выше, чем в 1 день (фиг.8), до начала применения штамма, а к 24 дню эксперимента титр значительно увеличился. Для сравнения величин изменения титров IgG в сыворотке крови животных 3, 4 опытных и контрольной групп была составлена общая диаграмма (фиг.9, разведение 1:128000). Из графика видно, что в 3 группе за период проведения эксперимента показатель оптической плотности IgG повысился на 0,114, в 4 группе - на 0,135, в контроле - снизился на 0,002. Таким образом, по результатам изучения профилактической эффективности Ветома 1.23, можно сделать вывод, что наиболее эффективной профилактической дозой является 100 мл/кг живой массы тела. Таким образом, Ветом 1.23 является эффективным препаратом для профилактики сальмонеллеза, применение которого в дозе 100 мл/кг живой массы с титром не менее 1×106 КОЕ/мл не только позволяет избежать инфицирования (животные остаются клинически здоровыми), но и создает значительную напряженность специфического иммунитета, позволяя поддерживать высокий уровень иммуноглобулина IgG в сыворотке крови. Для препаратов на основе штаммов Bacillus amyloliquefaciens ВКПМ В-10642 (состав 15) и Bacillus amyloliquefaciens ВКПМ В-10643 (состав 16) было определено влияние на микрофлору желудочно-кишечного тракта цыплят-бройлеров кросса ISA F-15 (табл.11, 12). Так, ежедневное применение препарата состава 15 на основе штамма Bacillus amyloliquefaciens ВКПМ В-10642 в 3-й опытной группе в течение всего периода выращивания цыплят (35 суток) в наибольшей степени способствовало вытеснению условно-патогенных бактерий. Применение препарата состава 16 на основе штамма Bacillus amyloliquefaciens ВКПМ В-10642 в течение 5 дней с 5-дневным перерывом во 2-й опытной группе приводило к снижению численности условно-патогенных бактерий и незначительному сокращению численности симбиотических лакто- и бифидобактерий. В наибольшей степени влияние на видовой состав микрофлоры кишечного тракта цыплят изучаемый биопрепарат оказал в 1-й опытной группе при скармливании его в течение 10 дней. В этом случае наблюдали резкое сокращение численности условно-патогенных бактерий в период скармливания штамма и резкое увеличение количества симбиотических лакто- и бифидобактерий через 10 дней после отмены препарата. При этом количество лакто- и бифидобактерий, а также штаммов кишечной палочки с нормальной ферментативной активностью увеличилось в 100-1000 раз по сравнению с исходным уровнем. Данные, представленные в таблице 11, показывают, что применение препарата на основе штамма Bacillus amyloliquefaciens ВКПМ В-10642 (состав 15) не оказывает отрицательного воздействия на видовой состав микрофлоры желудочно-кишечного тракта цыплят. Более того, его введение в организм животных способствует повышению как абсолютного, так и относительного количества симбиотических микроорганизмов с нормальной ферментативной активностью. По результатам изучения влияния препарата состава 16 на основе штамма Bacillus amyloliquefaciens ВКПМ В-10643 (таблица 12) на микрофлору желудочно-кишечного тракта цыплят-бройлеров кросса ISA F-15 отмечено увеличение количества бифидобактерий, лактобактерий и кишечной палочки с нормальной ферментативной активностью в опытных вариантах 1-3 (применение штамма в виде культуральной жидкости с титром 1×109 КОЕ/мл ежедневно (первые 5 дней совместно с антибиотиками); ежедневно с антибиотиками; через день (первые 5 дней совместно с антибиотиками) в дозе 3 мкл/кг. Показания к применению (рекомендательные). Препараты на основе штаммов Bacillus subtilis ВКПМ В-10641, Bacillus amyloliquefaciens ВКПМ В-10642, Bacillus amyloliquefaciens ВКПМ В-10643 рекомендуется использовать в птицеводстве и животноводстве, растениеводстве для: - профилактики и лечения дисбактериозов сельскохозяйственных и диких птиц, в том числе кур, уток, гусей, индеек, цесарок и других; повышения естественной резистентности организма птиц; устранения иммунодефицитных состояний, вызванных инфекционными (вирусы, бактерии, простейшие, внутриклеточные) и неинфекционными (некачественные корма, скученное содержание, стресс вследствие несоблюдения температурных режимов содержания) факторами; увеличения сохранности поголовья; увеличения яйценоскости; получения дополнительных привесов бройлеров; снижения конверсии кормов; уменьшения времени выращивания птицы; - профилактики и лечения у всех видов продуктивных сельскохозяйственных животных: дисбактериозов; инфекционных заболеваний вирусной, бактериальной и протозойной этиологии; профилактики вирусных заболеваний и иммунодефицитных состояний; повышения сохранности молодняка в ранние периоды развития; повышения продуктивности; получения дополнительных привесов молодняка мясного животноводства; улучшения качества и сортности молока и мяса; продления фертильности маточного поголовья; - обработки посевного материала - семян, клубней, луковиц и пр. перед посевом; обработки корневой системы при пересадке растений; обработки вегетирующей массы сельскохозяйственных растений и растений городских ландшафтов; полива сельскохозяйственных растений и растений городских ландшафтов (цветы, кустарники, газонная трава и пр.); обработки почвы в теплицах, полях, садах и прочих насаждениях; обработки овощей, фруктов, зерна после сбора урожая; обработки сена перед закладкой на зимнее хранение. Формула изобретения1. Штамм бактерий Bacillus subtilis IC-1435-1-1, обеспечивающий восстановление микробиоценоза почвы и желудочно-кишечного тракта животных, обладающий бактерицидной, фунгицидной и вирулицидной активностью и депонированный во Всероссийской Коллекции Промышленных Микроорганизмов ФГУП ГосНИИГенетика под регистрационным номером ВКПМ В-10641. 2. Штамм бактерий Bacillus amyloliquefaciens IC-1436-1-23, обеспечивающий восстановление микробиоценоза почвы и желудочно-кишечного тракта животных, обладающий бактерицидной и фунгицидной активностью и депонированный во Всероссийской Коллекции Промышленных Микроорганизмов ФГУП ГосНИИГенетика под регистрационным номером ВКПМ В-10642. 3. Штамм бактерий Bacillus amyloliquefaciens IC-1437-1-23, обеспечивающий восстановление микробиоценоза почвы и желудочно-кишечного тракта животных, обладающий бактерицидной и фунгицидной активностью и депонированный во Всероссийской Коллекции Промышленных Микроорганизмов ФГУП ГосНИИГенетика под регистрационным номером ВКПМ В-10643. 4. Препарат, обладающий бактерицидной и фунгицидной активностью, характеризующийся содержанием наполнителя или воды с биомассой бактерий в споровой форме Bacillus subtilis ВКПМ В-10641, или Bacillus amyloliquefaciens номером ВКПМ В-10642, или Bacillus amyloliquefaciens ВКПМ В-10643, или их смесь в соотношении 1:1:1 с титром каждого штамма бактерий не менее 1·10 4 КОЕ/г или 1·104 КОЕ/мл. 5. Препарат по п.4, отличающийся тем, что в качестве наполнителя он содержит порошкообразный сорбент. 6. Препарат по п.5, отличающийся тем, что в качестве порошкообразного сорбента он содержит порошок из отрубей, или цеолит, или полисахарид, или моносахарид, или дисахарид, или смесь полисахарида с моносахаридом, или смесь полисахарида с дисахаридом в соотношении от 1:100 до 1:10. 7. Препарат по п.6, отличающийся тем, что в качестве полисахарида он содержит крахмал, в качестве моносахарида - глюкозу, в качестве дисахарида - сахарозу. Популярные патенты: 2234219 Композиция для отпугивания паразитов ... или нескольких положениях;Rb обозначает водород, C1-С20алкил, гетероциклил или арил, где каждый из циклических радикалов является незамещенным или имеет один или несколько заместителей, выбранных из ряда, включающего С1-С3алкил, С1-С3галоалкил, С1-С3галоалкокси, С2-С6алкенил, галоген, циано, гидроксил, С1-С3алкокси, амино, (С1-С3алкил)2N или нитро;наносят местно вместе с добавкой, улучшающей распространение соединения по поверхности, на кожу, шерсть или оперение теплокровного животного.2. Способ по п.1, согласно которому применяют соединение формулы (I) или одну из его кислотно-аддитивных солей, где R обозначает водород или С1-С6алкил;R1 обозначает водород, С1-С6алкил, -C(O)-R3 ... 2048744 Устройство для регулирования температуры воздуха в теплице ... температуры в парнике до минимально допустимой, соответствующей температуре прямого мартенситного превращения, которая на 10-15оС ниже температуры обратного мартенситного превращения, в термочувствительном элементе происходят структурные превращения и модуль упругости понижается в 3-4 раза. При этом крутящий момент от действия груза, оставаясь постоянным, преодолевает момент трения в шарнирах рамы и деформирует термочувствительный элемент в исходное положение, одновременно раскрывая раму (авт. св. N 1672957, кл. А 01 G 9/24, опубл. N 32, 1991 г.). К недостаткам устройства относится то, что привод поворота рамы выполнен в виде пластины из материала, обладающего эффектом памяти формы ... 2060659 Установка для переработки органического субстрата в биогумус ... там устанавливают контейнеры 3 на расстоянии 5 см друг от друга и 5 см ряд от ряда. После засова питательной среды в шахты дождевыми червями, последние расползаются по поверхности шахты и перемещаются в слой питательной среды, где они живут, развиваются и размножаются. По мере высыхания питательной среды ее увлажняют водой при помощи гибкого переносного шланга (не показан). При помощи электрических нагревательных элементов 57 и терморегулятора 58 в помещении 4 автоматически поддерживается оптимальная температура. Как только питательная среда полностью перерабатывается дождевыми червями в биогумус, при помощи тельфера 13 и мостового крана 8 контейнер 3 перемещают из помещения 4 в ... 2007901 Устройство для хранения овощей и фруктов ... подключен к второму выходу блока питания и входу первого диода и через девятый резистор - к первому контакту реле, второй контакт которого соединен с управляющим входом тиристора непосредственно, выход тиристора подключен к второму входу блока нагревателей, выход компаратора подключен к входу седьмого резистора, третий и четвертый входы - к первому выходу блока питания, пятый вход - к выходу первого резистора, датчик температуры выполнен в виде терморезистора и подключен параллельно второму конденсатору. На фиг. 1 изображено устройство; на фиг. 2 - электрическая схема устройства; на фиг. 3 - электрическая схема блока питания. В устройстве для хранения овощей и фруктов камера 1 ... 2496298 Узел крепления пальцев подборщика ... пружин пальца, параллельного основанию скобы, так, что один стержень П-образного проволочного фиксатора упирается в переднюю внутреннюю часть витков пружин пальца, считая по ходу полотна, а второе отверстие просверлено на линии диаметра, внутри витков пружин, перпендикулярного к основанию скобы, так, что второй стержень фиксатора прижимает витки обеих пружин к основанию скобы, первый стержень П-образного фиксатора не позволяет монтажной петле пальца выйти из ниши основания скобы, а второй не позволяет пальцу провернуться вокруг оси витков его пружин. Преимуществами данного подборщика является отсутствие полимерной вставки и большая надежность крепления пальцев за счет наличия ... |
Еще из этого раздела: 2112337 Рабочий орган культиватора 2048055 Устройство для отрезания и погрузки сенажа и силоса 2154938 Способ охлаждения молока на животноводческих фермах и устройство для его осуществления 2257713 Способ производства пестицида (варианты) 2141196 Способ получения растений с комплексной устойчивостью к фитостеринзависимым вредителям 2462016 Устройство для протравливания семян 2106081 Животноводческая ферма с применением помещений круглой формы и способ содержания в ней, например, крупного рогатого скота 2488437 Способ получения микрокапсул пестицидов методом осаждения нерастворителем 2420058 Способ выращивания зеленных культур в интенсивной светокультуре 2411718 Устройство для внутрипочвенного импульсного дискретного полива растений |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
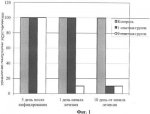
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
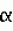 -2 лейкоцитарный человеческий, и к препаративной форме на их основе и может быть использовано в биотехнологии, ветеринарной медицине, медицине и защите растений для:
-2 лейкоцитарный человеческий, и к препаративной форме на их основе и может быть использовано в биотехнологии, ветеринарной медицине, медицине и защите растений для: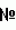 2129375, МПК A01N 63/00, C12N 1/20, опубликован 27.04.1999).
2129375, МПК A01N 63/00, C12N 1/20, опубликован 27.04.1999).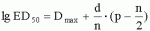 ,
,






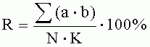 ,
,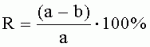 ,
,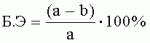 ,
,