Продуцент ингибитора вируса некротической пятнистости бальзаминаПатент на изобретение №: 2481392 Автор: Смирнова Ирина Павловна (RU), Шнейдер Юрий Андреевич (RU) Патентообладатель: Государственное образовательное учреждение высшего профессионального образования "Российский университет дружбы народов" (РУДН) (RU) Дата публикации: 20 Июня, 2012 Начало действия патента: 9 Декабря, 2010 Адрес для переписки: 117198, Москва, ГСП, ул. Миклухо-Маклая, 6, РУДН, отдел интеллектуальной собственности Изобретение относится к области биохимии и касается применения шатамма Trichoderma harzianum Rifai в качестве продуцента ингибитора тосповируса некротической пятнистости бальзамина (Impatiens necrotic spot tospovirus. Штамм гриба Trichoderma harzianum Rifai, депонированный во Всероссийской коллекции промышленных микроорганизмов под Изобретение относится к биохимии и может найти применение в агробиотехнологии, микробиологии и растениеводстве. В последние годы в Российскую Федерацию из европейских стран ежегодно импортируются сотни тысяч цветочно-декоративных растений, которые могут являться хозяевами тосповируса некротической пятнистости бальзамина (Impatiens necrotic spot tospovirus). В связи с тем что этот вирус имеет чрезвычайно широкий круг растений-хозяев на большинстве декоративных и овощных культур, создается опасность заражения потенциальных растений-хозяев данным вирусом. Вирус некротической пятнистости бальзамина приносит значительные убытки производству декоративных культур во многих Европейских странах. Impatiens necrotic spot tospovirus причинял большой вред различным видам декоративных и овощных культур, выращиваемых в теплицах на территории Мексики, США и на юге Канады и странах Европы. Потери урожая доходили до 100% (4, 5). Из уровня техники известен ингибитор вируса герпеса простого 1-го типа (1) и ингибитор вируса иммунодефицита человека (2), в качестве ингибитора которых использовался метаболит штамма Trichoderma harzianum Rifai - гомогенный фермент L-лизин- Также из уровня техники известна возможность использования гена, ингибирующего вирус пятнистости бальзамина путем его введения в растение семейства Бальзаминовых с получением трансгенных растений, устойчивых к такому вирусу (US 6528703 B1, 04.03.2003) - прототип. Однако такая методика является трудоемкой и требует больших финансовых и временных затрат. Техническим результатом изобретения является снижение потерь декоративных и овощных культур, вызванных вирусом Impatiens necrotic spot tospovirus. Технический результат достигается тем, что штамм Trichoderma harzianum Rifai является продуцентом ингибитора тосповируса некротической пятнистости бальзамина. Штамм депонирован во Всероссийской коллекции промышленных микроорганизмов под Морфолого-биохимическая характеристика штамма Штамм Trichoderma harzianum Rifai на среде сусло-агар образует колонии быстрорастущие. Мицелий гриба бесцветный, септированный, распростертый. На 4-е - 5-е сутки роста появляются дерновинки с конидиеносцами, подушковидные, сначала белые, со временем желто- или темно-зеленого цвета. Фиалиды бутыльчатые /9-12µ/, расположены мутовками по 3 и более. На каждой фиалиде образуются конидии, склеенные в головку. Конидии гриба округлые, гладкие, мелкие /3-5µ/, в проходящем свете бледно-зеленые, а в массе - темные. На агаризованной среде Чапека колонии штамма-продуцента быстрорастущие, но слабо спороносящие. Штамм хорошо растет на среде Чапека, однако лучший рост наблюдается на среде сусло-агар. Агар и желатину не разжижает, молоко не пептонизирует. Аэробный гриб. Температурный оптимум +28 - +29°С. На картофельно-декстрозном агаре наблюдается снижение интенсивности роста, образование воздушного мицелия и спороношения. Оптимальные условия роста гриба при рН 4-6, однако может расти и при рН от 1,5 до 9. Trichoderma harziatum Rifai в одинаковой степени усваивает как аммонийные, так и азотнокислые соли. Лучшим источником азота из органических соединений является пептон. Хорошо растет на средах с аспарагином и с глутаминовой кислотой. Лучшими источниками углерода являются ксилоза, глюкоза, сахароза, лактоза, галактоза, маннит, крахмал. На средах с этими сахарами наблюдается интенсивный рост. Слабо усваиваются спирты метиловый, этиловый, дульцит. Хорошо усваивает в качестве источника углерода пшеничные отруби. Инокулят гриба, выросший на среде с пшеничными отрубями, дает положительный результат при использовании его при ферментации на средах разного состава. Штамм Trichoderma harzianum Rifai обладает L-лизин- Для построения калибровочной кривой молярность свежеприготовленного раствора H2O2 определяли перманганатометрией. Субстратами служили L и DL-формы аминокислот («Reanal», Венгрия). Применяли 0,05 М фосфатный буфер. В качестве катализатора пероксидазной реакции использовали пероксидазу фирмы «Reanal», а в качестве донора протонов - O-дианизидингидрохлорид («Merck», ФРГ). За единицу активности принимали количество фермента, катализирующего образование 1 мкмоль Н2О2 за 1 мин при температуре +37°С. Удельную активность фермента выражали числом единиц активности на 1 мг белка или 1 мл культуральной жидкости. Белок определяли по методу Лоури. В качестве стандарта использовали 0.05%-ный раствор кристаллического бычьего альбумина («Reanal», Венгрия). Для оценки чистоты препарата использовали электрофорез в 10% ПААГ в присутствии додецилсульфата натрия, а также капиллярный электрофорез на установке Капель 105 производства фирмы Люмекс (Санкт-Петербург). Условия культивирования штамма Trichoderma harzianum Rifai Ферментация штамма производилась на оборудовании Опытной технологической установки ИБФМ РАН им. Г.К.Скрябина (г.Пущино). Использовали ферментер типа БИОР-01 производства ОКБ ТБМ, г.Кириши, объемом 100 л с коэффициентом заполнения 0,6. Ферментер оснащен магнитной мешалкой, фильтрами тонкой очистки воздуха, датчиками температуры и рН. Питательную среду готовили непосредственно в аппарате. Для этого в аппарат заливали 60 л водопроводной воды, вносили 1% пшеничных отрубей, стимулятор - 0,1%, 1,3% сульфата аммония, значение рН 5.8-6,0 устанавливали 10%-ным раствором HCl. Пшеничные отруби и стимулятор предварительно замачивали в 10 л воды в течение 4-х ч, стерилизовали в автоклаве 1 ч при температуре +125°C. Затем подготовленный ферментер засевали посевным материалом из колб. Посевная доза не менее 5%. Культивирование проводили при температуре +26°С, расход воздуха на протяжении всей ферментации 30 л в минуту, скорость вращения мешалки 200 оборотов в минуту. Величину рН в процессе роста корректировали до 6,5. Продолжительность выращивания составила 94-98 ч, конечные значения рН от 5,3 до 7.5. По окончании ферментации культуральную жидкость направляли на участок предварительной очистки, где мицелий гриба отделяли фильтрованием под вакуумом на нутч-фильтре. Вес полученной биомассы составил 3,5 кг. Полученный нативный раствор подвергали дополнительному сепарированию на сепараторе типа ОСБ при 9000 об/мин в течение часа при температуре +2 - +4°С. Затем нативный раствор в объеме 55 л, полученный после отделения биомассы, концентрировали до 1,5 л (концентрат). Рибонуклеиновую кислоту (РНК) тосповируса некротической пятнистости бальзамина выделяли из декоративного горшечного растения Стрептокарпус (лат. Streptocarpus) семейства Геснериевые. Производили замораживание при температуре -20°C растительных образцов (листья декоративной культуры Стрептокарпус). Затем образцы растирали в фарфоровой ступке до гомогенного состояния с добавлением лизирующего буфера из набора «Проба НК» фирмы ООО «Агродиагностика». Из предварительно приготовленных образцов выделяли РНК с использованием наборов «Проба НК» фирмы ООО «Агродиагностика» по протоколу из набора. Для постановки обратной транскрипции (ОТ) в пробирки была добавлена следующая смесь для ОТ: ОТ-буфер AMV фирмы «Promega» (250 mM Трис-HCl, 250 mM KCl, 50 mM MgCl2, 2,5 mM spermidine, 50 mM DTT) - 5 µ1, смесь дНТФ фирмы ЗАО «Диалат ЛТД» (дА, дТ, дГ, дЦ - по 200 µМ каждого) - 2,5 µl, РНазин - 40ед. (1 µ1), ревертаза AMV фирмы «Promega» (10 U/µl) - 3 µl, вода до общего объема 20 µl РНК образца - 5 µl. Реакция обратной транскрипции (процесс образования двуцепочечной ДНК на матрице одноцепочечной РНК) происходила при температуре +42°С в течение 1 ч, при температуре +95°С - 5 мин. На этапе обратной транскрипции к выделенной и очищенной РНК вируса некротической пятнистости бальзамина был добавлен концентрат культуральной жидкости в разных разведениях (от 5 до 0,025 Ед/мл). Далее для реакции амплификации готовили следующую смесь: 10х MagMIX - 2025 фирмы ЗАО «Диалат-ЛТД» - 2,5 µl на образец, праймеры INSV прямые (S1) и обратные (S2) - по 2 µl (10 Пример 1 После проведения обратной транскрипции к образцам выделенной кДНК был добавлен фермент в концентрациях 2,5 Ед/мл и 5 Ед/мл. Также был взят контрольный образец кДНК, в который не был добавлен фермент. На электрофореграмме наличие темной полосы в контрольном образце свидетельствовало о сохранении вируса, отсутствие полосы означало его разрушение. При концентрации 2,5 Ед/мл и более кДНК вируса разрушается, при этом не наблюдается образования темной полосы. Пример 2 После проведения обратной транскрипции к образцам выделенной кДНК был добавлен фермент в разных концентрациях (1, 0,1, 0,05, 0,025 Ед/мл). Также был взят контрольный образец кДНК без добавления фермента. На электрофореграмме наличие темной полосы в контрольном образце свидетельствовало о сохранении вируса, отсутствие полосы означало его разрушение. При концентрации более 1 Ед/мл кДНК вируса разрушалось, при этом не наблюдалось образования темной полосы. При большем разведении фермента вирусная кДНК сохраняется и наблюдается темная полоса. Литература 1. Ингибитор вируса герпеса простого 1-го типа. Патент РФ 2. Ингибитор вируса иммунодефицита человека. Патент РФ 3. Смирнова И.П., Алексеев С.Б. Биосинтез противоопухолевого фермента L-лизин- 4. ОЕРР/ЕРРО (2004). Diagnostic protocol for regulated pests. PM 7/34(1). Tomato spotted wilt tospovirus, Impatiens necrotic spot tospovirus and Watermellon silver mottle tospovirus. Bulletin ОЕРР/ЕРРО Bulletin 34, 271-279. 5. Windham A.S., Hale F., Yanes J. Impatiens necrotic spot virus: a serious pathogen of floral crops (1998). Agricultural Extension Service University of Tennessee. SP370A. 6. Mumford R.A., Barker I., Wood K.R. (1996b) An improved method for the detection of Tospoviruses using the polymerase chain reaction. Journal of Virological Methods 57, 109-115. Формула изобретенияПрименение штамма Trichoderma harzianum Rifai, депонированного в ВКПМ под Популярные патенты: 2161391 Комбинированная почвообрабатывающая посевная машина ... может быть использовано в сельскохозяйственной технике и относится к машинам для выполнения одновременно обработки почвы и посева за один проход агрегата. Комбинированная почвообрабатывающая посевная машина содержит две части: рыхлящую навесную и посевную прицепную. На раме первой последовательно расположены батареи, лапы-сошники, барабан-выравниватель с прутками, дисками и зубьями и спиральный каток. На второй части имеются дисковые сошники, семенной ящик с высевающими аппаратами и приводом от прикатывающего барабана, за которым расположен шлейф. Изобретение позволяет за счет оборудования машины лапами-сошниками, расположенными между дисковыми батареями и барабаном-выравнивателем со ... 2108695 Орудие для образования гребней в почве ... расположенное боковым граням сквозное щелевое отверстие, а режущие кромки лемеха расположены П-образно оси симметрии орудия. Криволинейный участок делителя-рызлителя по оси симметрии орудия плавно переходит на прямолинейный участок стойки 1 с помощью их сопряжения общим радиусом. 2 ил. Изобретение относится к сельскохозяйственному машиностроению, в частности к почвообрабатывающим орудиям для образования почвенных гребней (грядок), используемых для посева пропашных культур. Известно орудие для образования гребней корпус-окучник, содержащее криволинейную стойку с прикрепленным двухсторонним отвалом, центральная (линия симметрии) рабочая кромка которого выполнена также ... 2438305 Способ выращивания цыплят-бройлеров ... 14 гол./м2, для самок - 16 гол./м2, с фронтом кормления для самцов 4,0-4,4 см/гол., и фронтом поения - 1,4-1,5 см/гол., а для самок, соответственно, 3,6-4,0 см/гол. и 1,3-1,4 см/гол.Результаты выращивания цыплят-бройлеров представлены в таблице. Результаты выращивания цыплят-бройлеров Показатель Опыт Контроль (прототип) петушкикурочки петушки курочкиПоголовье, гол.100 100131 133Возраст убоя, недель6 6 1010 Средняя живая масса, г 2787 23203000 2500Среднесуточный прирост, г65,3 54,2 43,334,4 Сохранность, % 98 9897,1 98,5Затраты корма на 1 кг прироста, кг 1,911,99 2,702,80 Убойный выход, % 72,69 73,2071,9 71,0Выход мяса 1-го сорта, %: 100100 97,792,9 ... 2241344 Способ производства зеленого корма ... сдвиги в организме животных проявляются в излечивании гельминтозов, улучшении структуры пищеварения животных и птицы; имеет место увеличение живого веса до 15%, сохранности - на 1-3%, удои КРС повышаются до 11-12%.Как показали исследования, нанесение электроаэрозоля, содержащего антигельминтные препараты, на смесь семян и цеолита позволяет повысить урожайность зеленой массы и ее качество, улучшить режим выращивания за счет более равномерного внесения влаги (за счет электрических сил при нанесении электроаэрозоля). При этом антигельминтики связываются кормом и имеется возможность их дозированного введения внутрь организма животного вместе с кормом. Положительные эффекты, ... 2115304 Доильный аппарат ... отсутствует, а в основной период доения (фиг.3), стенка соскового чулка раскрывается полностью. Источники информации 1. Авторское свидетельство СССР N 176787, кл. A 01 J 5/04, 1966. 2. Авторское свидетельство СССР N 971176, кл. A 01 J 5/02, A 01 J 7/00, 1982.5 ФОРМУЛА ИЗОБРЕТЕНИЯ Доильный аппарат, содержащий молокосборник, коллектор, двухкамерные доильные стаканы, основной и дополнительный пульсаторы, каждый из которых имеет камеры переменного и постоянного вакуума, при этом камера переменного вакуума основного пульсатора соединена с камерой постоянного вакуума дополнительного пульсатора, переменная камера которого соединена с воздухораспределительной камерой коллектора, ... |
Еще из этого раздела: 2067832 Способ борьбы с грибковыми инфекциями растений 2019938 Рабочий орган почвообрабатывающей машины 2142696 Способ выращивания цветочных и декоративных растений в тепличных и домашних условиях 2406295 Способ экологического мониторинга лесов 2454066 Светодиодный фитооблучатель 2053664 Медогонка 2146444 Способ выявления и отбора стрессоустойчивых животных 2137365 Способ отпугивания биологических существ 2269243 Капсулированный посадочный материал с регулируемыми свойствами и способ его получения 2275804 Способ повышения продуктивности птицы |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
 F-180, является продуцентом гомогенного фермента L-лизина-
F-180, является продуцентом гомогенного фермента L-лизина-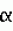 -оксидазы, который проявляет выраженную противовирусную активность в отношении Impatiens necrotic spot tospovirus. Представленное изобретение может быть направлено на снижение потерь декоративных и овощных культур, вызванных вирусом Impatiens necrotic spot tospovirus. 2 пр.
-оксидазы, который проявляет выраженную противовирусную активность в отношении Impatiens necrotic spot tospovirus. Представленное изобретение может быть направлено на снижение потерь декоративных и овощных культур, вызванных вирусом Impatiens necrotic spot tospovirus. 2 пр. mol/µl) на образец, кДНК - 5 µl, вода до 25 µ1, минеральное масло. В результате выделена комплементарная-дезоксирибонуклеиновая кислота (кДНК). Для получения продуктов реакции (ампликонов) проводили нагревание смеси по следующей схеме: один цикл при температуре +94°С в течение 15 минут, 30 циклов при температуре +94°С в течение 1 минуты, при температуре +48С в течение 1 минуты и при температуре +72°С в течение 1 минуты; один цикл при температуре +72°С в течение 10 минут. Хранение осуществляли при температуре +4°С. Полученные ампликоны (многократно увеличенное число копий изучаемого участка кДНК) вносили в 1,5% агарозный гель, после чего получали электрофореграммы и оценивали полученные результаты (6).
mol/µl) на образец, кДНК - 5 µl, вода до 25 µ1, минеральное масло. В результате выделена комплементарная-дезоксирибонуклеиновая кислота (кДНК). Для получения продуктов реакции (ампликонов) проводили нагревание смеси по следующей схеме: один цикл при температуре +94°С в течение 15 минут, 30 циклов при температуре +94°С в течение 1 минуты, при температуре +48С в течение 1 минуты и при температуре +72°С в течение 1 минуты; один цикл при температуре +72°С в течение 10 минут. Хранение осуществляли при температуре +4°С. Полученные ампликоны (многократно увеличенное число копий изучаемого участка кДНК) вносили в 1,5% агарозный гель, после чего получали электрофореграммы и оценивали полученные результаты (6).