Способ микроклонального размножения ириса сибирского (i.sibirica l.)Патент на изобретение №: 2479992 Автор: Тихомирова Людмила Ивановна (RU), Смирнов Сергей Владимирович (RU), Куцев Максим Геннадьевич (RU) Патентообладатель: Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования "Алтайский государственный университет" (RU) Дата публикации: 27 Апреля, 2013 Начало действия патента: 25 Октября, 2011 Адрес для переписки: 656049, г.Барнаул, пр-кт Ленина, 61, Алтайский государственный университет, отдел инновационного развития и охраны интеллектуальной собственности Изобретение представляет собой способ микроклонального размножения I.sibirica L. in vitro. Растения, идентичные исходным экземплярам, получают методом прямой регенерации, минуя каллусную культуру, а в качестве эксплантов используют фрагменты трубки околоцветника и цветоножки. Экспланты культивируют на питательной среде Мурасиге-Скуга, в которую вносят фитогормоны 3 мкМ НУК в сочетании с 8 мкМ БАП и добавляют 0,6% агара. Затем побеги переносят на питательную среду, дополненную 5-7,5 мкМ БАП, 0,1 мкМ НУК и 0,1 мкМ ИМК, размножают по схеме, чередуя среды с высоким (5-7,5 мкМ) и низким (1 мкМ) содержанием БАП. Затем побеги укореняют на питательной среде Мурасиге-Скуга, содержащей 1 мкМ НУК. Изобретение позволяет ускорить получение регенерантов данного вида ириса прямым методом, минуя каллусную культуру, и повысить их выход путем увеличения коэффициента размножения для получения растений, идентичных исходным экземплярам. 1 табл. Изобретение относится к цветоводству и биотехнологии, может быть использовано для массового размножения ценных декоративных сортов и гибридов ириса сибирского, освобождения их от системных патогенов, а также в селекционной практике для создания новых улучшенных сортов. Известен способ получения растений-регенерантов I.Sibirica, согласно которому эксплантами являются верхушечные и боковые почки, изолированные с корневищ многолетних генеративных растений во время вегетации (июнь-июль) и после ее окончания (сентябрь-октябрь). Корневища выкапывали из земли, очищали от частиц почвы и отмерших тканей, делили на участки, содержащие почки, промывали в мыльном растворе и проводили стерилизацию растительного материала. Стерильность и жизнеспособность эксплантов при введении в культуру in vitro составила 49-68%. Экспланты культивировали на безгормональной среде, после формирования первых листьев пересаживали на питательные среды мультипликации побегов. В результате из одного экспланта формировалось одно растение-регенерант (Ишмуратова М.М. Особенности культивирования in vitro растений различных экологических групп на примере видов рода Iris L. Растительные ресурсы. - 1999. - 35, Недостатком данного способа (аналога) является сложность проведения стерилизации растительного материала. I.sibirica является геофитом, поэтому получение стерильного и жизнеспособного материала при введении в культуру in vitro почек вегетативного побега представляет большую трудность. Даже при условии успешной поверхностной стерилизации внутренняя инфекция проявляет себя на протяжении всех этапов микроклонального размножения этой культуры. При данном способе повреждается или уничтожается растение-донор. Наиболее близким (прототипом) является способ получения растений-регенерантов I.sibirica на основе индукции развития почек в каллусной культуре из изолированных фрагментов трубки околоцветника. После стерилизации бутонов из них извлекали части околоцветника, которые делили на фрагменты размером 0,5×0,5 см и помещали на поверхность питательной среды Мурасиге-Скуга, дополненной 10, 20 и 30 мкМ 2,4-Д (2,4-дихлорфеноксиуксусная кислота) в сочетании с 5 мкМ БАП (6-бензиламинопурин). Культивирование осуществляли в условиях темноты. В первые дни культивирования наблюдали увеличения размеров эксплантов за счет растяжения клеток, а в дальнейшем сформировался зеленый плотный каллус. При пересадке каллуса на среду с уменьшенным содержанием 2,4-Д (0,2 мкМ) и культивировании его в условиях фотопериода происходила регенерация флоральных почек у I.sibirica. Индуцировать регенерацию вегетативных почек на данной среде не удалось. В связи с этим каллусную ткань с флоральными почками пересаживали на среду с повышенной концентрацией БАП - 20 мкМ. В конце пассажа на этой среде происходила регенерация вегетативных почек. Продолжительность пассажа на одной среде составляла 25-30 суток (Вечернина Н.А., Таварткиладзе O.К., Клементьева Л.А., Долганова З.В. Особенности регенерации и размножения растений рода Iris (Iridaceae) in vitro // Раст. Ресурсы, 2004. - Т.40, вып.4. - С.56-60). Недостатками данного способа (прототипа) является длительный период получения вегетативных почек (90 суток). Получение каллусной ткани с последующей индукцией органогенеза или соматического эмбриогенеза непригодно для использования при микроразмножении сортов растений, так как при дедифференциации клеток может происходить полиплоидизация и анеуплоидизация числа хромосом, которое способствует получению неоднородного потомства. Задачей заявляемого изобретения является создание способа микроклонального размножения I.sibirica за счет ускорения получения регенерантов данного вида ириса прямым методом, минуя каллусную культуру, и повышение их выхода путем увеличения коэффициента размножения для получения растений, идентичных исходным экземплярам. Сущность изобретения заключается в том, что способ микроклонального размножения Ириса Сибирского (I.sibirica L.) in vitro позволяет применять метод прямой регенерации, минуя стадию каллусообразования, а в качестве эксплантов используют фрагменты трубки околоцветника и цветоножки. Причем экспланты культивируют на питательной среде, которая обеспечивает высокий процент выхода генетически стабильных регенерантов в более короткие сроки. После обеззараживания бутонов трубку околоцветника и цветоножку делят на фрагменты 3×3 мм, которые затем высаживают на питательную среду Мурасиге-Скуга (MS), содержащую 3 мкМ НУК ( Способ осуществляют в два этапа. 1 этап. Цветки берут в фазе бутонизации (VII этап органогенеза), когда они плотно закрыты листочками обертки, и в условиях ламинарбокса проводят стерилизацию. Части трубки околоцветника и цветоножки делят на фрагменты размером не более 3×3 мм и помещают на питательные среды. Питательные среды готовят по прописи Мурасиге и Скуга (MS), содержащие 30 г/л сахарозы. В них вводят фитогормоны в разных концентрациях: 3 мкМ НУК в сочетании с 8 мкМ БАП, рН среды доводят до 5,8-5,9 и добавляют 0,6% агара. Среды разливают в пластиковые контейнеры (по 30 мл) или в культуральные флаконы (по 10 мл). Автоклавируют приготовленные питательные среды в течение 20 мин при 120°С. Экспланты культивируют в условиях фотопериода 16/8 часов свет/темнота при 24-26°С. Через 30 суток в ткани эксплантов развиваются вегетативные побеги достаточной величины для пересадки на среды размножения. В результате прямого органогенеза получают полноценные вегетативные побеги I.sibirica в количестве 10-15 штук на один эксплант. 2 этап. На этапе собственно микроклонального размножения I.sibirica L субкультивирование побегов проводят на питательной среде, содержащей 5-7,5 мкМ БАП, 0,1 ДмкМ НУК и 0,1 мкМ ИМК, по схеме чередуя среды с высоким и низким (1 мкМ БАП) содержанием цитокинина, (используются питательные среды: Мурасиге-Скуга или Гамборга и Эвелега (B5), дополненные 5-7,5 мкМ БАП, 0,1 мкМ НУК и 0,1 мкМ ИМК). Данные питательные среды позволяют получать морфологически не измененные побеги с хорошей способностью к укоренению (табл.1). Укоренение проводят на питательной среде Мурасиге-Скута, дополненной 1 мкМ НУК. Способность к укоренению на данной среде составляет 100%. После укоренения растения переносят в контейнеры с почвой и выращивают обычным способом до получения стандартной рассады с закрытой корневой системой. Необходимым условием клонального микроразмножения является стабильное воспроизводство исходного генотипа. Однако соблюдение этого условия вызывает ряд трудностей, т.к. биологически активные компоненты питательных сред способны вызвать генетические изменения в клетках, что приводит к генетической вариабельности полученных регенерантов. Для подтверждения идентичности регенерантов материнским растениям I.sibirica сорт Стерх, полученных в результате прямой регенерации побегов из тканей трубки околоцветника, проводят анализ с помощью ПЦР. Методом RAPD-анализа полногеномной ДНК не выявлено никаких отличий между материнскими экземплярами I.sibirica сорт Стерх и полученными от них растениями-регенерантами. В результате использования микроклонального размножения I.sibirica от одного экспланта за 4 месяца культивирования получают около 100 штук растений-регенерантов, морфологически генетически идентичных материнским. Таблица 1 Влияние концентрации БАП и способа культивирования на число и высоту побегов у I.sibirica сорт Стерх БАП, мкМ Без ауксинов С ауксинами (0.1 мкМ НУК+ОДмкМ ИМК) Без чередования Чередование сред с 1 мкМ БАП Без чередования Чередование сред с 1 мкМ БАП ч.п.в.р., мм ч.п. в.р., ммч.п. в.р., мм ч.п.в.р., мм 2,5 2,5±0,540,5±7,7 1,8±0,1 55,3±3,62,2±0,3 35,7±3,1 2,4±0,442,7±2,3 5,0 1,7±0,141,4±9,3 2,0±0,1 56,0±4,61,9±0,3 34,7±3,8 1,9±0,252,3±3,0 7,5 1,9±0,342,7±3,0 2,0±0,3 52,0±6,31,5±0,2 55,0±4,2 1,8±0,252,1±3,1 10,0 1,5±0,265,3±4,6 1,5±0,2 53,4±3,61,5±0,3 53,6±5,9 2,0±0,557,1±5,5 1,0 контр 1,3±0,158,4±5,8      Примечание: Примечание:  1) ч.п. - число побегов; 1) ч.п. - число побегов;  2) в.р. - высота растения. 2) в.р. - высота растения.
Формула изобретенияСпособ микроклонального размножения ириса Сибирского (I.sibirica L.) in vitro, включающий, культивирование эксплантов на питательной среде, размножение и укоренение регенерантов, отличающийся тем, что применяют метод прямой регенерации, минуя каллусную культуру, а в качестве эксплантов используют фрагменты трубки околоцветника и цветоножки, причем экспланты культивируют в течение 30 суток на питательной среде Мурасиге-Скуга (MS), в которую вносят фитогормоны 3 мкМ НУК в сочетании с 8 мкМ БАП и добавляют 0,6% агара, затем полученные побеги переносят на питательную среду, дополненную 5-7,5 мкМ БАП, 0,1 мкМ НУК и 0,1 мкМ ИМК, размножают по схеме, чередуя среды с высоким (5-7,5 мкМ) и низким (1 мкМ) содержанием БАП, укореняют на питательной среде Мурасиге-Скуга, содержащей 1 мкМ НУК. Популярные патенты: 2479996 Экологический комплекс для аквакультуры и рекультивации морских вод ... параметров водной среды, электронных датчиков 33 массы, а управляющими выходами соединен с помпой 5, аэратором 6, а также с электрокранами 25 разводящих труб 29 и культиватора 2 для микроводорослей. Соединение приемных устройств 34 датчиков 32, 33 со входами блока 31 программного управления (БПУ), а также выходов БПУ 31 с электрокранами 25 разводящих труб может осуществляться как при помощи электрокабеля 35, так и с помощью радиофицированного приемно-передающего устройства 36.Сборка комплекса осуществляется следующим образом. Сначала устанавливают систему 1 носителей моллюсков. Сборка системы 1 носителей моллюсков на месте может осуществляться с борта маломерного судна. Для этого на ... 2200947 Способ количественной оценки лесопригодности почвогрунтов ... им за вегетационный период при условии сохранения жизнеспособности (Вп min), т.е. Лп=3 п.в. min/Вп min. Лс определяют по отношению запасов почвенной влаги, формирующихся под сомкнутым пологом лесонасаждения в наиболее засушливый (3 п.в. min) и наиболее влажный (3 п.в. mах) годы на одинаковом принятом уровне вероятности выпадения минимальной и максимальной годовых сумм осадков, т.е. Лс=3 п.в. min/3 п.в. mах, а Л - по среднепропорциональной величине двух показателей, т.е. Лесопригодность почвогрунтов увеличивается прямо пропорционально увеличению значений Л. К лесопригодным под сплошное облесение определенной породы (группы пород), на которых сформировавшиеся лесонасаждения ... 2238970 Штамм mycelia sterilia лх-1-продуцент комплекса биологически активных веществ, обладающих рострегуляторными свойствами ... осаждают этанолом, ацетоном, термоустойчив до 150В°С, характеризуется биологической стабильностью, устойчив к воздействию микроорганизмов.Изобретение характеризуется следующими примерами.Пример 1.Штамм Mycelia sterilia ЛХ-1 растет на богатой органической среде (жидком сусле) в условиях аэрации при 20-30В°С, в течение 48 ч продуцирует 25 г вторметоболитов, проявляющих биостимулирующую активность. Культивирование штамма осуществляют на жидкой питательной среде Гельцер, продолжительность культивирования 20-30 дней при температуре 26В±1В°C. Состав среды: жидкая питательная среда Гельцер, г/л, рН 6,0-6,4:Глюкоза 8,0КН2РO4 0,6К2НРO4 1,8MgSO4 0,2K2SO4 0,1MnSO4 СледыFeSO4 ... 2125366 Доильный аппарат ... и молочную цистерны вымени и их эвакуацию в доильное ведро 19 доильный аппарат работает следующим образом. После запуска в работу компрессора 2 в ресивере 3 образуется избыточное давление воздуха. После открытия крана 4 давление по воздушному шлангу 5 передается в емкость 6, в которой по технологической необходимости находится содосолевой раствор или растворы лечебных препаратов, фиксируемые по количеству шкалой 7. Величина давления воздуха в емкости 6 регулируется и поддерживается по его величине при помощи реле давления 8. Кран 9 закрыт. Емкость 6 шлангом содосолевых и других растворов 10 соединена с трехходовым краном 11. Доильное ведро 19 молочным шлангом 15 также соединено с ... 2138949 Комбинированный препарат для борьбы с таежными и лесными клещами, способ борьбы и аттрактант ... камере, по своему физиологическому состоянию являются неактивными (см. цитированную выше работу). При оценке аттрактивности учитывали результаты только тех опытов, в которых доля неактивных клещей не превышала 20%. Чтобы исключить влияние случайных факторов, опыт повторяли, переместив испытуемый образец из опытной камеры в контрольную. Показателем аттрактивности служила средняя величина из двух опытов. Образцы для испытания готовили следующим образом. Листочки фильтровальной бумаги размером 4 мм2 пропитывали 20 мкл 10% метанольного раствора вещества или смеси веществ и затем высушивали для удаления растворителя. Чтобы не пачкать испытуемым веществом камеры ольфактометра, листочки ... |
Еще из этого раздела: 2415570 Искусственное роение и борьба с естественным роением пчелиных семей 2080774 Способ изготовления брикетов для выращивания растений и устройство для его осуществления 2140738 Производные n-арилгидразина, способ их получения, способ подавления насекомых и композиция для подавления насекомых 2427121 Почвообрабатывающий агрегат 2471341 Стойло, устройство в стойле и способ монтажа указанного устройства 2411718 Устройство для внутрипочвенного импульсного дискретного полива растений 2164741 Устройство для заготовки древесины 2201910 Устройство для ферментационной обработки жидкого навоза 2384048 Способ испытания травяного покрова на пойме малой реки 2121258 Устройство для вентилирования зерна или другого сыпучего материала (варианты) |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
 4. Москва. 1999. - С.67-74).
4. Москва. 1999. - С.67-74).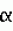 -нафтилуксусную кислоту) в сочетании с 8 мкМ БАП, через 30 суток образовавшиеся вегетативные побеги из всех предложенных типов эксплантов пересаживают на питательную среду, дополненную 5-7,5 мкМ БАП, 0,1 мкМ НУК и 0,1 мкМ ИМК (3-индолилмасляную кислоту) при чередовании высоких (5-7,5 мкМ) и низких (1 мкМ) концентраций БАП, укореняют побеги на среде Мурасиге-Скуга, дополненной 1 мкМ НУК.
-нафтилуксусную кислоту) в сочетании с 8 мкМ БАП, через 30 суток образовавшиеся вегетативные побеги из всех предложенных типов эксплантов пересаживают на питательную среду, дополненную 5-7,5 мкМ БАП, 0,1 мкМ НУК и 0,1 мкМ ИМК (3-индолилмасляную кислоту) при чередовании высоких (5-7,5 мкМ) и низких (1 мкМ) концентраций БАП, укореняют побеги на среде Мурасиге-Скуга, дополненной 1 мкМ НУК.