Способ определения стрессового состояния кур мясного направления продуктивностиПатент на изобретение №: 2473215 Автор: Мифтахутдинов Алевтин Викторович (RU) Патентообладатель: Федеральное государственное образовательное учреждение высшего профессионального образования "Уральская государственная академия ветеринарной медицины" (RU) Дата публикации: 27 Января, 2013 Начало действия патента: 18 Мая, 2011 Адрес для переписки: 457100, Челябинская обл., г. Троицк, ул. Гагарина, 13, ФГОУ ВПО "УГАВМ" Изобретение относится к птицеводству. Способ предполагает отбор биологического материала и определение концентрации кортикостерона иммуноферментным методом. При этом отбирают пробы помета через 1-3 часа после последнего воздействия фактора, предположительно вызывающего стресс. Экстракцию кортикостерона проводят 89-91%-ным этиловым спиртом из высушенных и измельченных проб помета. Измельчают 200 мг высушенной при температуре 20-50°С без доступа света пробы помета и заливают 5-6 мл 89-91%-ного этилового спирта. Смесь перемешивают и центрифугируют при 2500 об/мин в течение 9-11 минут. Затем сливают надосадочную жидкость и к осадку добавляют еще 2-3 мл 89-91%-ного этилового спирта. Смесь перемешивают и центрифугируют при 2500 об/мин в течение 9-11 минут. После чего объединяют надосадочные жидкости после первого и второго центрифугирования, полученный экстракт выпаривают досуха и растворяют в 2 мл 89-91%-ного этилового спирта. Концентрация кортикостерона в пробе более 50 нмоль/л указывает на активацию гипоталамо-гипофизарно-надпочечниковой системы организма и служит индикатором стрессового состояния кур мясного направления продуктивности. 3 табл. Изобретение относится к животноводству, в частности к птицеводству, а именно к определению у родительского поголовья кур мясного направления продуктивности состояния стресса. Стрессы в птицеводстве обуславливают высокие экономические потери и являются формой адаптационной реакции кур на внешние раздражители. В настоящее время для повышения сохранности птицы особое внимание уделяется профилактике стрессов. Однако в условиях промышленного содержания диагностика стрессового состояния кур не всегда объективна, часто осложняется патологиями и приводит к ошибкам в назначении лечебно-профилактических мероприятий. К тому же диагностика стрессового состояния необходима для решения вопроса о целесообразности применения антистрессорной терапии, а также при определения степени воздействия технологических факторов на состояние кур. Высокая продуктивность кур не всегда является объективным показателем стресса, так как компенсаторные механизмы организма позволяют некоторое время поддерживать продуктивность и здоровье на определенном уровне, но по мере истощения резервов адаптационных систем наблюдается снижение реактивности и резистентности и в результате происходит резкое падение продуктивности, развитие болезней и массовая гибель кур. Известен способ определения стресса у яичных кур по интенсивности оперения в области шеи и клоачного кольца, по степени потери пера судят о стрессовом состоянии птицы в период пика продуктивности. Потеря пера связана с расклевом и каннибализмом, а также увеличением кортикостерона в крови [1]. Недостатками данного способа являются: во-первых, в основе метода лежит визуальная оценка, не подкрепленная строгими методологическими характеристиками оперения кур в различных физиологических состояниях, к тому же у разных пород, линий и промышленных кроссов могут наблюдаться различия в оперении; во-вторых, на характер расклева большое влияние оказывают генетически обусловленные особенности поведения кур, принятые технологии, что в конечном итоге сказывается на состоянии оперения; в третьих, способ был разработан на курах яичного направления продуктивности и не прошел апробацию на курах мясного направления продуктивности. Известен способ диагностики стресса путем определения миграционной активности лейкоцитов (МАЛ) периферической крови, основан на капиллярном способе в модификации Ю.И.Забудского с соавт. [2]. Метод включает пипетирование, термостатирование, центрифугирование крови с последующим измерением столба форменных элементов, инкубированием и повторным определением столба форменных элементов. Недостатком данного способа является то, что взятие крови является дополнительным стрессом для кур, влияющим на результаты исследования. В исследованиях, посвященных изучению стресса и стрессовой чувствительности кур, широко используется один из косвенных физиологических тестов - кинетика величины соотношения гетерофилов и лимфоцитов (Г/Л) периферической крови. Установлено, что при развитии состояния стресса этот показатель увеличивается за счет абортивного выброса незрелых клеток гетерофилов из костного мозга в кровяное русло и миграции лимфоцитов из последнего в ткани. Изменения величины соотношения Г/Л коррелируют со сдвигом концентрации кортикостерона в крови птиц и пропорциональны степени действия стресс-факторов различной природы [3, 4]. Недостатком данного метода является то, что при воздействии сверхпороговых раздражителей Г/Л не всегда изменяется адекватно физиологическому состоянию птицы и поэтому не может приниматься как точный показатель стрессового воздействия у птицы [5], к тому же подсчет форменных элементов в мазках крови птиц является трудоемким процессом и требует высокой квалификации специалиста, выполняющего подсчет клеток крови. В качестве прототипа выбран биохимический способ определения содержания в крови стрессовых гормонов [6], наиболее информативным гормоном для определения степени стрессирования кур является кортикостерон [7]. Недостатками данного метода являются: во-первых, взятие крови у кур приводит к дополнительному стрессу, концентрация кортикостерона при этом может повышаться, что может привести к искажению результатов исследования; во-вторых, концентрация кортикостерона в крови зависит от силы и продолжительности внешнего воздействия на организм кур, пик концентрации в крови наблюдается через 30 минут после воздействия, однако взятие крови осуществляется в определенное время, не совпадающее с периодом стрессирования, к тому же воздействие может быть не однократным, поэтому показатели концентрации кортикостерона в период взятия крови не всегда могут отражать состояние организма. в-третьих, в отечественной и зарубежной литературе отсутствуют четкие нормативные данные концентрации кортикостерона в разных физиологических состояниях, в результате анализ может быть не объективным. Технической задачей нового способа является использование для определения стрессового состояния кур мясного направления продуктивности безинвазивного метода, позволяющего вести контроль на основании специфических маркеров стрессовой реакции. Целью изобретения является совершенствование способа оценки стрессового состояния кур мясного направления продуктивности, позволяющего на основании результатов иммуноферментного анализа концентрации кортикостерона в выделяемом помете судить об активации стрессреализующих систем организма. Сущность изобретения заключается в том, что для определения стрессового состояния кур отбирают пробы помета, проводят экстракцию кортикостерона нижеописанным способом, в полученном экстракте определяют концентрацию кортикостерона иммуноферментным методом, по количеству кортикостерона в пробе судят о развитии состояния стресса. Важным условием является то, что отбирают пробы помета через 1-3 часа после последнего воздействия фактора, предположительно вызывающего стресс, или для плановой диагностики стада в дневное время не ранее чем через 1 час после включения освещения. Экстракцию кортикостерона проводят 89-91%-ным этиловым спиртом из высушенных и измельченных проб помета по следующей схеме: 200 мг высушенной при температуре 20-50°С без доступа света пробы помета измельчают на лабораторной мельнице и заливают 5-6 мл 89-91%-ного этилового спирта; смесь перемешивают и центрифугируют при 2500 об/мин в течение 9-11 минут; сливают надосадочную жидкость и к осадку добавляют еще 2-3 мл 89-91%-ного этилового спирта; смесь перемешивают и центрифугируют при 2500 об/мин в течение 9-11 минут, объединяют надосадочные жидкости после первого и второго центрифугирования, полученный экстракт выпаривают досуха и растворяют в 2 мл 89-91%-ного этанола, что является обязательным условием точности проведения анализа, так как строго соответствует чувствительности иммуноферментного метода определения кортикостерона. Концентрация кортикостерона в пробе более 50 нмоль/л указывает на активацию гипоталамо-гипофизарно-надпочечниковой системы организма и служит индикатором стрессового состояния кур мясного направления продуктивности. Анализ известных технических решений (аналогов) по определению стрессового состояния кур (птицы) позволяет сделать вывод об отсутствии в них признаков, сходных с существенными отличительными признаками в заявляемом способе, что соответствует условию патентоспособности «новизна». Анализ известных технических решений в птицеводстве, используемых для определения стрессов, позволяет сделать вывод о соответствии заявляемого способа условию патентоспособности «изобретательский уровень», так как для специалиста он явным образом не следует из уровня техники и науки. Апробация заявленного способа в условиях птицефабрики показала, что он соответствует условию патентоспособности «промышленная применимость». Изобретение предназначено для птицеводческих предприятий, племенных репродукторов и селекционно-генетических центров, занимающихся разведением родительских форм кур мясного направления продуктивности. Пример выполнения. Для разработки способа были проведены исследования помета кур мясного направления продуктивности кросса ISA F1, возрастом 48 недель, находящихся в разных физиологических состояниях - в состоянии относительного покоя и в состоянии острого стресса. Исследования были проведены на территории родительской площадки Аргаяшской птицефабрики ЗАО «Уралбройлер». Для объективной оценки показателей очень важным является выбор способа моделирования стрессового состояния кур. Введение в организм кур стрессовых гормонов - адренокортикотропного гормона (АКТГ) или кортикостерона согласно исследованиям ряда зарубежных исследователей [8] не всегда является правильным при исследовании гормонального статуса кур и метаболизма стрессовых гормонов. Это связано с тем, что введение синтетических гормонов в организм сопровождается с одной стороны их повышенной экстракцией, с другой стороны приводит к запуску малоизученных адаптационных механизмов, ведущих к рассогласованию гипоталамо-гипофизарно-надпочечниковой системы организма. По нашим исследованиям внутрикожное введение 70%-ного раствора скипидара в дозе 0,1 мл в область бородки вызывает состояние стресса у кур. Для подтверждения этого были исследованы показатели соотношения количества гетерофилов к лимфоцитам в периферической крови и уровни стрессовых гормонов, адреналина и кортикостерона, в плазме крови. Взятие крови для исследований осуществляли через 30 минут после проведения внутрикожного введения раствора скипидара. Результаты представлены в таблице 1. Таблица 1 Индикаторы стресса кур, М±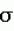 ПоказательВ состоянии покоя (контроль) Через 30 мин. после введения скипидара Г/Л0,24±0,08 0,4±0,11 Адреналин в плазме крови, нг/мл10,57±3,16 106,68±71,99 Кортикостерон в плазме крови, нмоль/л 33,74±6,67 106,59±50,79 ПоказательВ состоянии покоя (контроль) Через 30 мин. после введения скипидара Г/Л0,24±0,08 0,4±0,11 Адреналин в плазме крови, нг/мл10,57±3,16 106,68±71,99 Кортикостерон в плазме крови, нмоль/л 33,74±6,67 106,59±50,79Показатель Г/Л через 30 минут после внутрикожного введения раствора скипидара был увеличен на 55%, концентрация адреналина и кортикостерона была увеличена в 10 раз и 3,2 раза соответственно по сравнению с контрольными показателями. Анализируя полученные данные можно констатировать, что внутрикожное введение скипидара вызывает резкое повышение в крови стрессовых гормонов и приводит к значительному увеличению соотношения Г/Л, что указывает на развитие острого стрессового состояния кур. Следовательно, внутрикожное введение в бородку 70%-ного раствора скипидара в дозе 0,1 мл можно использовать для моделирования острых стрессов в птицеводстве. Для оценки влияния времени сбора помета на показатели кортикостерона пробы помета отбирали сразу после выделения из клоаки, через 1 час после выделения и через 3 часа после выделения. Исследование кортикостерона в помете проводили методом твердофазного конкурентного иммуноферментного анализа, используя наборы DRG Corticosterone ELISA EIA-4164. Используемый метод имеет высокую специфичность к кортикостерону на уровне 100%, перекрестную активность к прогестерону на уровне 7,4%, диоксикортикостерону на уровне 3,4%, 1,6% к 11-дегидрокортикостерону и менее 0,3% к другим стероидам. ИФА метод определения кортикостерона имеет высокую чувствительность и широкий диапазон определения кортикостерона от 0 до 240 нмоль/л. Кортикостерон, как и другие стероиды, устойчив во внешней среде и хорошо растворим в органических растворителях. Для проведения исследований кур разделили на 2 группы по 300 голов в каждой. Куры первой группы были интактны, у кур второй группы вызывали стресс с помощью внутрикожного введения в бородку 70%-ного раствора скипидара. Отбор проб помета осуществляли через 1 час, 3 часа, 8 часов и 24 часа после воздействия, что соответствует 9 часам, 12 часам, 17 часам и 9 часам дня. Взятие проб осуществляли с пола, пробы с насестов не отбирали, вследствие значительных колебаний уровня кортикостерона перед снесением яйца. Для учета влияния циркадного ритма отбор проводили в опытной и контрольной группах. Экстракцию кортикостерона проводили 90%-ным этиловым спиртом из высушенных и измельченных проб помета по следующей схеме: 200 мг высушенной при температуре не более 50-60°С без доступа света пробы помета измельчают на лабораторной мельнице и заливают 5 мл 90%-ного этилового спирта; смесь перемешивают и центрифугируют при 2500 об/мин в течение 10 минут; сливают надосадочную жидкость и к осадку добавляют еще 2,5 мл 90%-ного этилового спирта; смесь перемешивают и центрифугируют при 2500 об/мин в течение 10 минут, объединяют надосадочные жидкости после первого и второго центрифугирования, полученный экстракт выпаривают досуха и растворяют в 2 мл 90%-ного этанола. Пробы высушивали сразу же после отбора. Образцы взятые через 1 и 3 часа дополнительно подвергали экспозиции в условиях птичника в течение 3 часов для определения степени потерь кортикостерона после выделения помета. От каждой группы брали по 4 пробы. Исследования проводили в двух повторностях для каждой пробы, в качестве результата использовали среднее значение. В результате иммуноферментного анализа отобранных образцов получены следующие результаты (таблица 2): Таблица 2 Концентрация кортикостерона в помете кур, М± 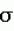 Время отбора проб Группы Контрольная Опытная В течение 1 часа после выделения Через 3 часа после выделения В 9 часов43,15±0,71*** 53,30±2,55*** 50,98±0,91*** В 12 часов 40,80±1,02*** 56,47±4,48*** 55,65±2,64*** В 17 часов 39,50±0,55 39,60±1,32 - В 9 часов через сутки 42,72±0,39 42,53±0,69 - Разность между опытом и контролем достоверна* - при Р<0,05; ** - Р<0,01; ***- Р<0,001 Время отбора проб Группы Контрольная Опытная В течение 1 часа после выделения Через 3 часа после выделения В 9 часов43,15±0,71*** 53,30±2,55*** 50,98±0,91*** В 12 часов 40,80±1,02*** 56,47±4,48*** 55,65±2,64*** В 17 часов 39,50±0,55 39,60±1,32 - В 9 часов через сутки 42,72±0,39 42,53±0,69 - Разность между опытом и контролем достоверна* - при Р<0,05; ** - Р<0,01; ***- Р<0,001 Данные, представленные в таблице 2, наглядно демонстрируют, что под действием раздражителя происходит большее выделение кортикостерона с пометом. В течение 1 часа после проведения скипидарной пробы количество кортикостерона в помете было повышено на 19,0%, через 3 часа после воздействия стрессового фактора на 27,7%, через 8 часов выделение кортикостерона соответствовало нормативным показателям. Сопоставляя полученные данные с показателями концентрации кортикостерона в плазме крови необходимо отметить, что в крови под действием стресс-фактора происходит значительно большее повышение концентрации кортикостерона, чем в помете, при этом выделяется во внешнюю среду значительно меньшее количество гормона. Это явление связано с метаболизмом кортикостерона в организме кур. По данным многочисленных исследователей [9] под действием ферментов желудочно-кишечного тракта происходит превращение кортикостерона в 11-дегидрокортикостерон, 20-дегидрокортикостерон и 11-дегидро-20-дегидрокортикостерон и выделение его в виде некоторых других метаболитов [10]. Поэтому диагностическое значение имеет выделение кортикостерона с мочевой кислотой, выделяемой в клоаку, а затем с пометом во внешнюю среду. Количество выделяемой мочевой кислоты будет зависеть от потребления питательных веществ и воды, показателей микроклимата и массы тела. Учитывая то, что в условиях промышленного содержания птица имеет очень высокое генетическое сродство, высокую однородность по живой массе, одинаковые параметры микроклимата, рацион питания, то выделение мочевой кислоты на единицу помета будет на одном уровне. Через 3 часа после выделения концентрация кортикостерона в помете достоверно не снижается (таблица 2), поэтому пробы помета для диагностики стрессового состояния кур можно собирать в течение этого периода после выделения из клоаки. Согласно нашим наблюдениям сбор проб помета для исследований в период более 3 часов после его выделения невозможен вследствие высокой активности кур и смешивания помета с подстилкой. Отбор проб помета для исследований необходимо начинать не ранее чем через 1 час после воздействия фактора, предположительно вызывающего стресс, или для плановой диагностики стада в дневное время не ранее, чем через 1 час после включения освещения. Это связано с циркадным ритмом концентрации кортикостерона в крови. Второй пример выполнения. Для оценки эффективности метода на птицах, находящихся "на пике" продуктивности, были использованы куры возрастом 23 недели. Для проведения исследований кур разделили на 2 группы по 100 голов в каждой. Куры первой группы были интактны, у кур второй группы вызывали стресс с помощью внутрикожного введения в бородку 70%-ного раствора скипидара. Отбор проб помета осуществляли через 1 и 3 часа после воздействия, что соответствует 9 и 12 часам. От каждой группы отбирали по 5 проб. Пробы высушивали сразу же после отбора и исследовали вышеописанным методом. Результаты исследований представлены в таблице 3. Таблица 3 Концентрация кортикостерона в помете кур возрастом 23 недели, М±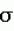 Время отбора проб Группы ОпытнаяКонтрольная В 9 часов 43,66±0,48 53,03±1,72 В 12 часов 40,94±1,21 56,76±1,44 Время отбора проб Группы ОпытнаяКонтрольная В 9 часов 43,66±0,48 53,03±1,72 В 12 часов 40,94±1,21 56,76±1,44 Анализируя результаты, представленные в таблице 3, необходимо отметить, что наблюдаются те же закономерности, что и в предыдущем исследовании. Под действием стрессового фактора происходит увеличение концентрации кортикостерона в помете более 50 нмоль/л. Возраст кур не влияет на концентрацию кортикостерона в помете. Концентрация кортикостерона в помете, более 50 нмоль/л, определяемая предлагаемым способом, указывает на активацию гипоталамо-гипофизарно-надпочечниковой системы организма и служит индикатором стрессового состояния кур мясного направления продуктивности. Предлагаемый способ может быть использован при оценке целесообразности применения схем антистрессовой терапии, для определения оптимальной плотности комплектования птицей производственных площадей, для анализа степени воздействия на организм кур производственных факторов и ветеринарных обработок. Литература 1. Патент РФ на изобретение 2. Забудский Ю.И. Миграционная активность лейкоцитов - маркер стресса птиц. / Ю.И.Забудский, И.Г.Скутарь. // Ветеринария. - 1993. - 3. Забудский Ю.И. Современные методы диагностики состояния стресса у сельскохозяйственных птиц. // Материалы Третьей международная ирано-российской конференции. «Сельское хозяйство и природные ресурсы». М., 2002. - с.134-135. 4. Gross W.B. Evaluation of the heterophil/lymphocyte ratio as a measure of stress in chickens / W.B.Gross, H.S.Siegel // Avian Diseases 27(4). - 1983. - pp.972-979. 5. Edens F.W. Adrenal responses in high and low ACTH response lines of chickens during acute heat stress / F.W.Edens, H.S.Siegel // Gen. Соmp. Endocrinol. - 6. Резников А.П. Методы определения гормонов. - Киев: Наукова Думка, 1980. - С.260. 7. Edens F.W. Modification of corticosterone and glucose responses by sympatholytic agents in young chickens during acute heat exposure / F.W.Edens, H.S.Siegel // Poultry Science. - 1976. - 55:17041. - pp.71-72. 8. Correlation between the stress-induced transient increase in corticotropin-releasing hormone content of the median eminence of the hypothalamus and adrenocorticotropic hormone secretion / K.Murakami, S.Akana, M.F.Dallman, W.F.Ganong // Neuroendocrinology, 1989. - pp.233-241. 9. A non-invasive method for assessing adrenal activity in the chinchilla (Chinchilla lanigera) / M.F.Ponzio, S.L.Monfort, J.M.Busso, V.G.Dabbene, R.D.Ruiz, М.Fiol de Cuneo // J. Exp.Zool. - 10. Vylitova М. Metabolism of Corticosterone in Mammalian and Avian Intestine / М.Vylitova, I.MikSikt, J.Pachat // General and Comparative Endocrinology Формула изобретенияСпособ определения стрессового состояния кур, включающий отбор биологического материала, определение концентрации кортикостерона иммуноферментным методом, отличающийся тем, что отбирают пробы помета через 1-3 ч после последнего воздействия фактора, предположительно вызывающего стресс; экстракцию кортикостерона проводят 89-91%-ным этиловым спиртом из высушенных и измельченных проб помета по следующей схеме: 200 мг высушенной при температуре 20-50°С без доступа света пробы помета измельчают на лабораторной мельнице и заливают 5-6 мл 89-91%-ного этилового спирта; смесь перемешивают и центрифугируют при 2500 об/мин в течение 9-11 мин; сливают надосадочную жидкость и к осадку добавляют еще 2-3 мл 89-91%-ного этилового спирта; смесь перемешивают и центрифугируют при 2500 об/мин в течение 9-11 мин, объединяют надосадочные жидкости после первого и второго центрифугирования, полученный экстракт выпаривают досуха и растворяют в 2 мл 89-91%-ного этилового спирта; концентрация кортикостерона в пробе более 50 нмоль/л служит индикатором стрессового состояния кур мясного направления продуктивности. Популярные патенты: 2025945 Способ выращивания насаждений сосны ... при котором каждый 20 ряд формирует с шириной междурядий 2,0 м и проведением первого лесохозяйственного ухода в возрасте 25-30 лет со сплошной вырубкой каждого 20 ряда и равномерным разреживанием насаждения по всей площади лесорастительного участка. При таком способе исходная густота (главной породы и кустарника) - 8,8 тыс. шт/га способствует раннему смыканию крон в рядах, формированию повышенной устойчивости против снеголома, корневой губке и сосновому подкорному клопу. Введение кустарников повышает рекреационную ценность насаждения. Однако способ не учитывает режима густоты выращивания древостоев после 25-30 лет. А к этому времени, в результате полного смыкания крон, ... 2450505 Порционное устройство для вытирания семян трав ... с ним закрытую терочную емкость, механизмы электропривода, отличающееся тем, что дополнительно снабжено таймером, терочные поверхности стакана выполнены рифлеными, лопасть ротора установлена относительно боковой терочной поверхности без зазора, а относительно дна стакана - с зазором в 2 3 эквивалентных диаметра семени обрабатываемой культуры. MM4A Досрочное прекращение действия патента из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 04.12.2012 Дата публикации: ... 2216903 Устройство для отделения плодов от ветвей ... камеры 3. Плоды с примесями листьев, соплодий и мелких веточек попадают на деку 17 и, пройдя через зазоры между перемычками 18 треугольного сечения, равные 3-5 диаметра плода, падают на транспортер 19 для улавливания плодов. Уменьшение зазора между перемычками 18 не обеспечит прохождение крупных плодов и соплодий через деку 17, а его увеличение приведет к попаданию на транспортер 19 крупных ветвей. Ворох с транспортера 19 поступает на поперечные планки 21 просеивающего транспортера 20. Зазор между поперечными планками 21 транспортера 20 выбирают равным 2-3 диаметра плода. Уменьшение зазора не позволит выделить из вороха крупные плоды и мелкие соплодья, а увеличение приведет к ... 2265314 Устройство системы зашторивания теплиц с регулируемым ходом ... штанги при их взаимном перемещении, а также является опорой свободного конца дополнительной штанги. На дополнительных штангах по обе стороны от поводка закрепляются упоры так, чтобы расстояние между ними обеспечивало свободный ход поводка при движении балки зашторивания предыдущего пролета. Свободный ход настраивается перемещением упоров на дополнительных штангах и величина его должна обеспечивать уменьшение хода зашторивания уменьшенного пролета теплицы. Это обеспечивает создание надежного устройства зашторивания уменьшенного пролета теплицы с регулируемым ходом, не имеющего недостатков известных технических решений. 1 з.п. ф-лы, 4 ил. Изобретение относится к конструкциям ... 2153256 Инсектицидное средство и способ борьбы с вредителями сельскохозяйственных культур ... инсектицидного средства с различными соотношениями компонентов для обработки семян Готовили "базовый" раствор - смесь, состоящую из 9 л 50% к.э. карбофоса и 100 г FeSO4. "Базовый" раствор делили на несколько частей, в каждую из которых добавляли 50% к.э. карбофос с увеличением его количества для каждой последующей порции на 1 л. Активным началом в инсектицидном составе является карбофос, но активность действия средства против проволочников определяется наличием каталитического количества FeSO4. Индивидуально сульфат железа не проявляет инсектицидных свойств. Найдено, что оптимальное количество сульфата железа в 100% смеси составляет от 1 до 0,7%. Уменьшение каталитического количества ... |
Еще из этого раздела: 2197817 Поплавок для рыболовных удочек и снастей 2087614 Способ создания травяного газонного покрытия открытых спортивных площадок и ухода за ним 2083070 Способ предпосевной обработки семян и устройство для его осуществления 2148319 Растительное средство для борьбы с пресноводными моллюсками 2076603 Способ повышения урожайности сельскохозяйственных культур 2050099 Косилка с всасывающим устройством 2239968 Способ предпосевной обработки семян овощных культур 2482660 Способ выращивания рапса ярового на семена 2056755 Способ регулирования роста овощных культур 2216923 Способ выращивания льна-долгунца |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
 2151502. Способ прогноза стресса у яичных кур. Опубл. 27.06.2000.
2151502. Способ прогноза стресса у яичных кур. Опубл. 27.06.2000.