Способ клонального микроразмножения сирени in vitroПатент на изобретение №: 2457669 Автор: Шестибратов Константин Александрович (RU), Салмова Маргарита Анатольевна (RU), Алпатова Анна Александровна (RU), Азарова Анна Борисовна (RU) Патентообладатель: Общество с ограниченной ответственностью Научно-производственное предприятие "МИКРОКЛОН" (RU) Дата публикации: 10 Августа, 2012 Начало действия патента: 13 Ноября, 2010 Адрес для переписки: 142290, Московская обл., г. Пущино, а/я 7, ООО НПП "МИКРОКЛОН", К.А. Шестибратову Изображения  Изобретение относится к области биотехнологии растений. Способ включает культивирование одноузловых сегментов на среде мультипликации, содержащей макро-, микроэлементы, хелат железа, витамины по прописи Murashige & Skoog (MS) или Quorin & Lepoivre, или Woody Plant Medium, или Driver & Kuniyuki, 30-40 г/л сахарозы, 8-9 г/л агар-агара, 0,2-2,0 мг/л 6-бензиламинопурина и/или 0,2-2,0 мг/л зеатина, или 0,5-1,5 мг/л кинетина и антибиотики (пенициллин (50-1000 мг/л) и/или ампициллин (50-1000 мг/л), и/или цефотаксим (50-1000 мг/л), и/или тикарциллин (10-500 мг/л), и/или стрептомицин (5-500 мг/л), и/или тетрациклин (10-1000 мг/л), и/или ванкомицин (1-100 мг/л)). Полученные пробирочные микрорастения повторно черенкуют на апикальную часть и серединные одноузловые сегменты. Одноузловые сегменты повторно выращивают на среде мультипликации, а апикальные высаживают на среду укоренения. Она содержит 1/2 макроэлементов, полные микроэлементы, хелат железа и витамины по прописи MS, 10-30 г/л сахарозы, 8-9 г/л агар-агара, перечисленные выше антибиотики, 0,1 мг/л индолилмасляной кислоты, а также 0,01 мг/л Изобретение относится к области биотехнологии растений, в частности цветоводству, и может быть использовано для оздоровления и микроразмножения растений сирени in vitro. Известен способ микроразмножения сирени, включающий черенкование выращиваемых in vitro растений на одноузловые сегменты, посадку черенков на питательную среду для мультипликации, содержащую микроэлементы, хелат железа и витамины по прописи Мурасиге и Скуга (MS) [2], 1,5 концентрацию макроэлементов MS, 35 г/л сахарозы, 8 г/л Difco бакто-агара и 1 мг/л 2-изопентениладенина (2ip), получение пробирочных микрорастений, повторное их черенкование и высадку полученных регенерантов на среду укоренения с ауксинами (R.L.M.Pierik; H.H.M.Steegmans; A.A.Elias; O.T.J.Stiekema; A.J.van der Velde. Vegetative propagation of Syringa vulgaris L. in vitro. // Acta Hort., 226 (1988) 195-204.). Недостатком данного способа размножения является то, что растения по окончанию этапа размножения получаются утолщенными и укороченными со скрученными листьями вдоль центральной жилки (витрифицированными) (Рисунок 1). Эти микропобеги плохо укореняются (Рисунок 2). Укорененные микрорастения такого качества неспособны адаптироваться к условиям ex vitro. Технический результат изобретения заключается в повышении выхода нормально сформированных корнесобственных микрорастений, улучшении роста и развитии эксплантов при положительном влиянии оптимальных концентраций минеральных и органических компонентов питательной среды, регуляторов роста растений и антибиотиков. Сущность изобретения заключается в том, что одноузловые сегменты выращиваемых in vitro растений помещают на среду для мультипликации, содержащую макро-, микроэлементы, хелат железа и витамины по прописи Мурасиге и Скуга (MS) (Murashige Т. & Skoog F., A revised medium for rapid growth and bioassays with tobacco tissue culture. // Physiol. Plant, 15 (1962) 473-497) или или Кворина-Лепорье (1977) (QL) (Quorin M. & Lepoivre P., Elude de milieux adaptes aux cultures in vitro de Prunus. // Acta Hort., 78 (1977) 437-442) или Вуди Плант Медиум (WPM) (Lloyd G. & McCown В., Commercially feasible micropropagation of mountain laurel, Kalmia latifolia, by shoot tip culture. // Comb. Proc. Int. Plant Prop.Soc, 30 (1980) 421-427) или Драйвер и Куниюки (DKW) (Driver J.A., Kuniyuki A.H., In vitro propagation of Paradox walnut rootstock. // Hort. Science, 19 (4), August (1984).), 30-40 г/л сахарозы, 8-9 г/л агар-агара, 0,2-2,0 мг/л 6-бензиламинопурина (БАП) и/или 0,2-2,0 мг/л зеатина (Z) и/или 0,5-1,5 мг/л кинетина (kin) и антибиотики (пенициллин (50-1000 мг/л) и/или ампициллин (50-1000 мг/л) и/или цефотаксим (50-1000 мг/л) и/или тикарциллин (10-500 мг/л) и/или стрептомицин (5-500 мг/л) и/или тетрациклин (10-1000 мг/л) и/или ванкомицин (1-100 мг/л)). Культивирование проводят на светокультуральных стеллажах при освещении белыми люминесцентными лампами общей интенсивностью 2000-4000 люкс при 16-часовом фотопериоде и температуре 21-25°C. Полученные пробирочные микрорастения повторно черенкуют на апикальную часть и серединные одноузловые сегменты. Одноузловые сегменты повторно выращиваются на среде мультипликации, а апикальные высаживают на среду укоренения. Она содержит ½ макроэлементов, полные микроэлементы, хелат железа и витамины по прописи MS, 10-30 г/л сахарозы, 8-9 г/л агар-агара, перечисленные выше антибиотики, 0,1 мг/л ИМК, а также 0,01 мг/л НУК или 0,1 мг/л ИУК. Добавление сахарозы в питательные среды в концентрациях более 40 г/л снижает интенсивность роста растений и приводит к их витрификации. Добавление в питательные среды регуляторов роста и антибиотиков в предложенных концентрациях наиболее оптимально подходят для роста эксплантов и не оказывают токсического воздействия и эффекта угнетения культуры. Предлагаемый способ клонального микроразмножения сирени реализуется следующим образом: 1. В нестерильных условиях готовится питательная среда. В нее добавляются необходимые количества макро-, микроэлементов, хелата железа, мио-инозита, объем доводится дистиллированной водой, pH 5,6-5,8. После этого растворяется навеска агара. Среда разливается по колбам, укупоривается фольгой и бумагой, завязывается банковской резинкой. Автоклавирование проводится при 1 ати (=1 изб. атм) в течение 25 минут. В остывшую до 55°C среду в ламинар-боксе добавляются стерильные растворы витаминов, регуляторов роста и антибиотиков. Полученный раствор разливается по стерильным культуральным сосудам. Все манипуляции с растительным материалом производится в стерильных условиях ламинар-бокса. На всех этапах культивирования число эксплантов в сосудах составляет 15-25 штук. 2. Размножение растительного материала проводят на средах мультипликации, приготовленных по прописи MS или QL или WPM или DKW, дополненных сахарозой (30-40 г/л), агар-агаром (8-9 г/л), БАП и/или зеатином (0,2-2,0 мг/л) или кинетином (0,5-1,5 мг/л) и антибиотиками (пенициллин (50-1000 мг/л) и/или ампициллин (50-1000 мг/л) и/или цефотаксим (50-1000 мг/л) и/или тикарциллин (10-500 мг/л) и/или стрептомицин (5-500 мг/л) и/или тетрациклин (10-1000 мг/л) и/или ванкомицин (1-100 мг/л)). При этом наиболее оптимальными минеральными композициями являются MS и QL. Для цитокининов наиболее удачны концентрации 0,2-1,0 мг/л как для БАП, так и для зеатина, для кинетина - 0,9-1,1 мг/л, а для антибиотиков - пенициллин (50-100 мг/л) и/или ампициллин (50-100 мг/л) и/или цефотаксим (50-200 мг/л) и/или тикарциллин (10-50 мг/л) и/или стрептомицин (5-50 мг/л) и/или тетрациклин (10-100 мг/л) и/или ванкомицин (1-15 мг/л). 3. Полученные микропобеги черенкуются на апикальную часть и серединные одноузловые сегменты. Серединные сегменты повторно переносятся на среды мультипликации. Апикальные части высаживают на среду укоренения. В качестве среды для укоренения используется редуцированная до ½ по макросолям среда MS, дополненная сахарозой (10-30 г/л), агар-агаром (8-9 г/л), антибиотиками (перечень и концентрации указаны в п.2). Эффективность укоренения оценивается долей укорененных хорошо сформированных микрорастений от числа всех эксплантов, выраженной в процентах. В таблицах 1-3 представлены результаты исследований по влиянию на укореняемость микропобегов условий предшествующего этапа культивирования, а именно: концентрация цитокининов (БАЛ, зеатин и кинетин), минеральный состав питательной среды (MS, QL, WPM и DKW), наличие антибиотиков в среде. В качестве контрольного варианта использовались среда и концентрация цитокинина (2-изопентениладенин), описанные в прототипе. Таблица 1 Процент укорененных хорошо сформированных микрорастений на питательных средах с различным содержанием сахарозы в зависимости от концентраций фитогормонов, применяемых на этапе мультипликации (при использовании среды MS) Среда укоренения Среда мультипликации Прототип Z0,5 мг/л БАП0,2 мг/л Z 0,2 мг/л; БАП0,5 мг/л Z 0,5 мг/л;БАП 0,2 мг/л БАП1,0 мг/л БАП2,0 мг/л Z 1,0 мг/л Z 2,0 мг/л kin 0,5 мг/л kin 1 мг/л kin 1,5 мг/л Примроуз R 10*45 6043 6350 6037 9579 5357 39R20* 51 4340 7230 6342 9577 5063 43R30* 47 4539 5735 6040 9081 4653 30 Богдан Хмельницкий R1054 7540 9050 8061 8474 5481 28R20 51 9535 9395 8557 9779 6292 30R30 62 8035 8970 8263 9483 6376 35 Надежда R1048 6550 6588 7364 9383 6160 58R20 48 7050 6292 7671 8785 6764 61R30 45 7045 7087 7459 7879 6768 66 * - где R - редуцированная по макросолям до ½ среда MS, цифровой индекс после R означает концентрацию сахарозы в среде в граммах на 1 литр (Здесь и далее) Таблица 2 Процент укорененных хорошо сформированных микрорастений на различных питательных средах с различным содержанием сахарозы в зависимости от типа питательной среды Среда укоренения Минеральный состав среды на этапе мультипликации MS QL WPM DKW Цитокинин (концентрация 1 мг/л) ZБАП KinZ БАП KinZ БАП KinZ БАПKin R10 9560 5790 90 6580 75 6989 6765 R20 9563 6397 93 7179 73 7092 7264 R30 9060 5395 95 7075 77 6894 7065 Результаты представлены на примере сорта Примроуз. Таблица 3 Процент укорененных хорошо сформированных микрорастений на питательных средах с различным содержанием сахарозы в зависимости от типа питательной среды и наличия антибиотика, применяемых на этапе мультипликации Среда укоренения Среда мультипликации MS; Z 1,0 мг/лMS; Z 1,0 мг/л; CEF QL; Z 1,0 мг/л; QL; Z 1,0 мг/л; CEF R1075 8080 85R20 70 7568 81R30 80 9584 100 Результаты представлены на примере сорта Президент Греви. Статистически достоверные различия отсутствуют в вариантах питательных сред, где цевотаксим содержится в концентрациях от 50 до 150 мг/л.При добавлении индивидуальных антибиотиков в среду культивирования в следующих концентрациях: ванкомицин 1-15 мг/л и/или цефотаксим 50-150 мг/л и/или тикарциллин 10-50 мг/л и/или пенициллин 50-100 мг/л и/или ампициллин 50-100 мг/л и/или стрептомицин 5-50 мг/л и/или тетрациклин 10-100 мг/л - статистически достоверных различий не выявлено (данные не представлены). Добавление НУК или ИУК в заявленных концентрациях не вызывало статистически достоверных различий процента укоренения (данные не представлены). Использование перечисленных концентраций фитогормонов позволяют увеличить эффективность укоренения микропобегов сирени в культуре in vitro относительно прототипа до 2 раз. Формула изобретения1. Способ клонального микроразмножения сирени in vitro, включающий микрочеренкование пробирочных растений на одноузловые сегменты, высадку их на питательную среду, содержащую макро- и микроэлементы, хелат железа, витамины, сахарозу, агар-агар и цитокинины, получение микропобегов, их черенкование и укоренение на среде, содержащей ауксины, отличающийся тем, что высадку одноузловых сегментов осуществляют на питательную среду Quorin & Lepoivre или Woody Plant Medium, или Driver & Kuniyuki с добавлением 0,2-2,0 мг/л 6-бензиламиноурина, и/или 0,2-2,0 мг/л зеатина, и/или 0,5-1,5 мг/л кинетина, 50-1000 мг/л антибиотика из группы 2. Способ по п.1, отличающийся тем, что в питательную среду в качестве антибиотика группы Популярные патенты: 2108695 Орудие для образования гребней в почве ... образования гребней - окучивающий корпус, содержащий криволинейную стойку с прикрепленными к ней параллельными и симметрично расположенными отвалами (Техническое решение по авт. свид. СССР N 212337, кл. A 01 B 13/02, 1986). Функции рыхления почвы наральником и долотом совпадают по их конструктивной форме. Недостатки этого окучивающего корпуса аналогичны недостаткам вышеуказанного аналога. Кроме того, этот окучивающий корпус имеет также дополнительный недостаток, который выражается в том, что, имея наральник /долото/ типа стрельчатой лапы, испытывает при работе значительно большее сопротивление почвы в сравнении с орудиями, имеющими долото, что приводит также к увеличению ... 2307495 Пневматический высевающий аппарат ... угла между дозирующими элементами внешнего ряда, а центр сопла избыточного давления расположен на окружности, концентричной окружностям расположения центров дозирующих элементов, радиус которой равен полусумме радиусов окружностей расположения центров дозирующих элементов, кроме того, внутренний диаметр сопла избыточного давления равен двойному максимальному диаметру дозирующих элементов, заборное устройство содержит две трубки, а выступы в крышке и прокладке выполнены таким образом, что их длина больше расстояния от внешней кромки высевающего диска до окружности расположения дозирующих элементов внутреннего ряда на величину, равную максимальному диаметру дозирующих ... 2488422 Сеть фильтров ... Фильтровальные материалы с подходящей структурой и/или подходящим размером пор могут быть куплены. Понятно, что используемый фильтровальный материал должен иметь подходящую стабильность к текучей среде, другими словами, он должен быть устойчив с гидролитической точки зрения к чистой воде. Очевидно, что несколько материалов могут быть объединены друг с другом. Сеть из фильтровального материала образована продольными и поперечными элементами 1, 5. Длина, ширина и глубина элементов не имеют конкретных ограничений и должны подходить для конкретного применения или для имеющегося корпуса фильтра. Поперечное сечение также может быть таким, как необходимо, например, круглым, овальным, ... 2487516 Почвообрабатывающая машина ... имеющие гидравлический привод от гидромоторов, отличающаяся тем, что диски рабочих органов приварены к полому барабану с поворотом вокруг него на 45° относительно смежной лопасти, внутри барабана на неподвижной опоре в виде швеллера с узкими полками установлен гидромотор с ведущей шестерней, находящейся в зацеплении с зубчатым колесом с внутренними зубьями, жестко связанным с барабаном, причем в наружном торце барабана выполнен подшипниковый узел с цапфой, приваренной к опоре, внутренний торец закрыт неподвижным диском, по периметру которого установлены шарики или ролики, и соединение внутренних торцов барабанов с рамой машины выполнено шарнирно с возможностью поворота по ... 2059362 Установка для выращивания мидий ... икринок развиваются плавающие личинки. Личинки оседают на субстрат, приобретают раковину и превращаются в миниатюрных моллюсков. Парящие в толще воды личинки и моллюски оседают на канаты 15 и прикрепляются к ним нитями бисера и начинают питаться, профильтровывая массу воды. Мидии добывают пищу сами, не двигаясь с места. Поэтому важно, чтобы плот был установлен на течении. Когда моллюски достигают товарного размера замыкают электрическую цепь, питающую электрический двигатель 18. Электрический двигатель 18 вращает лебедку 13. Лебедка 13 медленно перемещает вверх все канаты 15 одного ряда одновременно вверх и фильтрует их при помощи храпового механизма 19. При ... |
Еще из этого раздела: 2502793 Масло, семена и растения подсолнечника с модифицированным распределением жирных кислот в молекуле триацилглицерина 2453090 Способ минимальной обработки почвы 2088063 Широкозахватный сельскохозяйственный агрегат 2414113 Способ и комплекс для обработки зерна, семян или плодоовощной продукции озоном 2241344 Способ производства зеленого корма 2402211 Способ получения трансгенных кроликов, продуцирующих белки в молочную железу 2450501 Способ повышения плодородия почвы на склонах 2399194 Способ и устройство контроля воздушного режима в корнеобитаемой среде 2391804 Почвообрабатывающий каток 2415560 Способ выращивания корнесобственных саженцев винограда |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
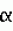 -нафтилуксусной кислоты или 0,1 мг/л индолилуксусной кислоты. Культивирование проводят на светокультуральных стеллажах при освещении белыми люминесцентными лампами общей интенсивностью 2000-4000 люкс с 16-часовым фотопериодом и температурой 21-25°С. Изобретение позволяет повысить выход нормально сформированных корнесобственных микрорастений, улучшить рост и развитие эксплантов. 1 з.п. ф-лы, 3 ил., 3 табл.
-нафтилуксусной кислоты или 0,1 мг/л индолилуксусной кислоты. Культивирование проводят на светокультуральных стеллажах при освещении белыми люминесцентными лампами общей интенсивностью 2000-4000 люкс с 16-часовым фотопериодом и температурой 21-25°С. Изобретение позволяет повысить выход нормально сформированных корнесобственных микрорастений, улучшить рост и развитие эксплантов. 1 з.п. ф-лы, 3 ил., 3 табл.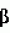 -лактамных антибиотиков, и/или 5-500 мг/л антибиотика из группы аминогликозидов, и/или 10-1000 мг/л антибиотика из группы тетрациклинов, и/или 1-100 мг/л антибиотика из группы циклических гликопептидов, а укоренение осуществляют на среде, содержащей 1/2 концентрации микросолей по прописи Murashige & Skoog с добавлением 50-1000 мг/л антибиотика из группы
-лактамных антибиотиков, и/или 5-500 мг/л антибиотика из группы аминогликозидов, и/или 10-1000 мг/л антибиотика из группы тетрациклинов, и/или 1-100 мг/л антибиотика из группы циклических гликопептидов, а укоренение осуществляют на среде, содержащей 1/2 концентрации микросолей по прописи Murashige & Skoog с добавлением 50-1000 мг/л антибиотика из группы