Средство для консервации донорской роговицыПатент на изобретение №: 2450515 Автор: Тахчиди Христо Периклович (RU), Борзенок Сергей Анатольевич (RU), Малюгин Борис Эдуардович (RU), Ролик Ольга Ивановна (RU), Комах Юрий Алексеевич (RU), Мороз Зинаида Ивановна (RU), Ковшун Евгения Владимировна (RU) Патентообладатель: Федеральное государственное учреждение "Межотраслевой научно-технический комплекс "Микрохирургия глаза" имени академика С.Н. Федорова Федерального агентства по высокотехнологичной медицинской помощи" (RU) Дата публикации: 20 Мая, 2012 Начало действия патента: 1 Декабря, 2010 Адрес для переписки: 127486, Москва, Бескудниковский б-р, 59А, ФГУ "МНТК "Микрохирургия глаза" им. акад. С.Н. Федорова Росмедтехнологии", патентно-лицензионный отдел Изображения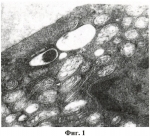 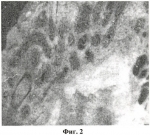  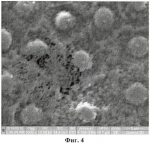 Изобретение относится к медицине, а именно к офтальмологии. Средство содержит среду М-199, среду Хэма F-10, хондроитин-сульфат, декстран-40, гентамицин-сульфат, амфотеррицин В, среду Дюльбекко-Игла, препарат NeyDIL Изобретение относится к медицине, а именно к офтальмологии, и может быть использовано для длительного сохранения, продления жизнеспособности трансплантата роговицы и улучшения его трансплантационных качеств для сквозной кератопластики. Известна среда для консервации роговицы глаза (патент РФ Недостатком этой среды является то, что при низкотемпературной консервации клетки эндотелия роговицы испытывают холодовой стресс с инициацией перекисного окисления и нарушением липо-протеидного слоя клеточных мембран, что приводит к их последующей деструкции и повреждению эндотелиальных клеток трансплантата донорской роговицы на ультраструктурном уровне. Это приводит к потере жизнеспособности донорского материала, к уменьшению плотности эндотелиальных клеток роговицы и соответственно к повышению полиморфизма и полимегетизма клеток и снижению процента гексагональных клеток. Такой донорский материал не пригоден для сквозных кератопластик при наиболее тяжелых бельмах ожоговой этиологии, которые сопровождаются большой потерей эндотелиальных клеток в посттрансплантационном периоде. Задачей изобретения является создание многокомпонентного средства для длительного сохранения донорской роговицы в режиме глубокой гипотермии (при температуре 4 Техническим результатом является улучшение трансплантационных качеств трансплантата роговицы, а именно повышенная биохимическая устойчивость эндотелия к срокам и факторам консервации, сохранение высокой плотности эндотелиальных клеток и быстрая адаптация донорского трансплантата после кератопластики. Технический результат достигается тем, что данное средство для консервации донорской роговицы, в режиме гипотермической консерваии, содержащее среду М-199, среду Хэма F-10, хондроитин-сульфат, декстран-40, гентамицин-сульфат, амфотеррицин В и среду Дюльбекко-Игла, дополнительно содержит препарат NeyDIL Средство имеет следующее соотношение компонентов, мас.%: Среда М-19925,0 Среда Хэма F-10 25,0 Хондроитин-сульфат А 0,5Декстран-40 5,0 Гентамицин-сульфат 0,00014Амфотерицин В0,00015 NeyDIL  37 St.III0,00015 Среда Дюльбекко-Игла остальное 37 St.III0,00015 Среда Дюльбекко-Игла остальное При этом среда М-199 имеет следующий состав, мг/л: Л-аланин 25; Л-аргинина хлорид 70; аспарагиновая кислота 30; Л-цистеина хлорид - 0,0987; Л-цистина двунатриевая соль; Л глютаминовая кислота 66,82; Л-глютамин 100; глютатион 0,05; глицин 50; Л гистидина хлорид одноводный 21,88; Л гидрооксипролин 10; Л-изолейцин 20; Л-лейцин 60; Л лизина хлорид 70; Л-метионин 15; Л-фенилаланин 25; Л-пролин 40; Л-серин 25; Л-треонин 30; Л-триптофан 10; Л-тирозина двунатриевая соль - 49,72; Л-валин 25; Л-аскорбиновая кислота 0,05; биотин 0,01; кальциферол 0,1; Д-кальция пантотенат 0,01; холина хлорид 0,5; фолиевая кислота - 0,01; и-инозитол 0,05; менафтона натрия бисульфат трехводный 0,019; никотиновая кислота 0,025; никотинамид 0,025; пара-амино-бензойная кислота 0,05; пиридоксальхлорид 0,025; пиридоксинхлорид 0,025; рибофлавин 0,01; тиамина хлорид 0,01; Д-Л-токоферола фосфата двунатриевая соль 0,01; витамина А-ацетат 0,1147; кальция хлорид двухводный 185,5; железа нитрат девятиводный 0,01; калия хлорид 400; калия дегидроортофосфат 60; магния сульфат семиводный 200; натрия хлорид 8000; натрия гидроортофосфат 47,5; аденина сульфат 10; 5-АМФ 0,2; АТФ двунатриевая соль 10; холестерол 0,2; 2-дезоксирибоза 0,5; Д-глюкоза 1000; гуанина хлорид - 0,3; гипоксантин 0,3; Д-рибоза 0,5; натрия ацетата 36,71; натриевая соль фенола красного 17; тимин 0,3; твин 80-5; урацил 0,3; ксантин 0,3. Среда Хэма F-10 имеет следующий состав, мг/л: Л-аланин 8,91; Л-аргинина хлорид 210,7; Л-аспарагин 1-водный - 15,01; Л-аспарагиновая кислота 13,31; Л-цистеина хлорид 31,53; Л-глютаминовая кислота 14,71; Л-глютамин 146,2; глицин 7,51; Л-гистидина хлорид одноводный 20,96; Л-изолейцин 2,62; Л-лейцин 13,12; Л-лизин 29,3; Л-метионин 4,48; Л-фенилаланин 4,96; Л-пролин 11,51; Л-серии 10,5; Л-треонин 3,57; Л-триптофан 0,61; Л-тирозина натриевая соль 2,25; Л-валин 3,51; биотин 0,024; Д кальция пантотенат 0,715; хлорид холина 0,698; фолиевая кислота 1,32; и-инозитол 0,541; никотинамид 0,611; пиридоксин-хлорид 0,206; рибофлавин 0,376; тиамина хлорид 1,012; витамин В12 1,36; кальция хлорид двухводный 44,1; сульфат меди пятиводный 0,0025; сульфат железа семиводный 0,8346; хлорид калия - 285; калия дегидрофосфат 83; магния сульфат семиводный 152,7; натрия хлорид 7400; натрия гидроортофосфат 156,2; цинка сульфат семиводный 0,0288; Д-глюкоза 1100; гипоксантин 4,08; липоевая кислота 0,206; натриевая соль фенола красного 12; натрия пируват 110; тимидин 0,727. Среда Дюльбекко-Игла имеет следующий состав, мг/л: Л-аргинин 84; Л-цистина двунатриевая соль 56,78; Л-глютамин 584; глицин 30; Л-гистидина хлорид одноводный 42; Л-изолейцин 104,8; Л-лейцин 104,8; Л-лизина хлорид 146,2; Л-метионин 30; Л-фенилаланин - 66; Л-серии 42; Л-треонин 95,2; Л-триптофан 16; Л-тирозина двунатриевая соль 89,5; Л-валин 93,6; Д кальция пантотенат 4; холина хлорид 4; фолиевая кислота 4; и-инозитол 7; никотинамид 4; пиридоксаль-хлорид 4; рибофлавин 0,4; тиамина хлорид 4; кальция хлорид двухводный 264,9; нитрат железа девятиводный 0,1; калия хлорид 400; магния сульфат семиводный 200; натрия хлорид 6400; натрия бикарбонат 3700; натрия дигидроортофосфат двухводный 141,3; Д-глюкоза 4500; натриевая соль фенола красного 15; натрия пируват 110. NeyDIL Каждая в отдельности взятая среда, как-то: среда М-199 как наиболее сложная по своему составу, среда Хэма F-10 и Среда Дюльбекко-Игла как наиболее универсальные, поддерживает высокую жизнеспособность чувствительных клеток перевиваемых линий. Однако для органных культур, которые в процессе культивирования остаются интактными и не относятся к перевиваемым линиям, требуется экспериментальный подбор соотношений нескольких сред, в зависимости от гистогенетической характеристики органной культуры. В этой связи для эндотелия трупной донорской роговицы, который относится к глиальной ткани, наиболее оптимальным является выбор трех сред - среда М-199, среда Хэма F-10 и Среда Дюльбекко-Игла, в заявленных соотношениях, имитирующих аминокислотный и метаболический состав водянистой влаги передней камеры интактного глаза. Хондроитин-сульфат А относится к цитопротекторам - вискоэлластикам, обладая соответствующим знаком и электронным зарядом, он образует поверхностную защитную пленку на клетках эндотелиального пласта роговицы. Тем самым предотвращаются механическое повреждение и десквамация клеток эндотелия роговицы в процессе гипотермической консервации донорского материала. Декстран с молекулярной массой 40'000 D относится к высокомолекулярным онкотическим компонентам среды и, таким образом, подобранный в оптимальной концентрации создает в среде онкотическое давление, равное 320 млОсм/л, при котором предотвращается процесс набухания клеток и коллоидного вещества стромы донорской роговой оболочки в процессе длительного гипотермического культивирования. Для предотвращения роста патогенной микрофлоры добавлены: гентамицин-сульфат, оказывающий бактерицидное действие в отношении широкого спектра грамотрицательных и грамположительных микроорганизмов, и амфотерицин В, обладающий фунгицидным и фунгистатическим действиями. Пептидный препарат NeyDIL Заявленное средство для консервации донорской роговицы благодаря входящим в его состав компонентам в обозначенных концентрациях обладает патогенетически направленным, восстанавливающим и защитным действиями на эндотелиальные клетки донорских роговиц, обладает способностью нормализации внутриклеточного метаболизма за счет оптимальной фармакокинетики. Средство, будучи достаточно мощным цитопротектором и метаболитным посредником с физиологически активным началом, также обладает антиоксидантными и мембраностабилизирующими свойствами, тормозит процесс Это подтверждает морфометрическое и ультраструктурное исследование 20 донорских роговиц лиц зрелого трудоспособного возраста (28-36 лет). Были сформированы две группы: опытная и контрольная, включающие по 10 донорских роговиц каждая. Опытная группа состояла из 10 роговиц от 10 доноров трупов, данные роговицы хранились в предложенном средстве для консервации роговицы в гипотермических условиях. Контрольная группа включала 10 роговиц от тех же 10 доноров, хранение этих роговиц осуществлялось в среде для консервации роговицы глаза (патент РФ Сроки консервации в опытной и контрольной группе составили 3, 6, 9 суток, в эти же сроки проводился анализ морфометрических и ультраструктурных характеристик эндотелиальных клеток донорских роговиц. При трансмиссионной микроскопии эндотелиальных клеток донорских роговиц наибольшая разница между опытной и контрольной группой была отмечена в образцах на 9 сутки консервации. На Фигуре 1 представлена трансмиссионная электронная микроскопия эндотелиальной клетки роговицы образца из опытной группы на 9 сутки консервирования, увеличение ×40000. Отмечается начинающейся отек митохондриальных мембран и их небольшая сглаженность, в то время как в контроле выявлены грубые ультраструктурные изменения с паринхематозной дегенерацией, то есть осаждением клеточных белков в матриксе цитоплазмы эндотелиальной клетки роговицы, что является проявлением необратимых клеточных процессов. На Фигуре 2 представлена трансмиссионная электронная микроскопия эндотелиальной клетки роговицы образца из контрольной группы на 9 сутки консервирования, увеличение ×40000. При сканирующей электронной микроскопии образцов роговиц контрольной группы на 9 сутки консервации выявлено разрушение межклеточных взаимоотношений и деструкция липидного слоя мембран. Уменьшение электронно-оптической плотности внутри клеток, говорящее о деструкции и потере внутриклеточных органелл (Фигура 3, Фигура 4). Вышеперечисленные изменения не наблюдались при изучении образцов донорских роговиц, входивших в опытную группу, где клетки сохранили гексо- и пентогональность, без разрушения межклеточных взаимоотношений и без выраженной деструкции липидного слоя мембран (Фигура 5). При оценке морфометрических характеристик выявлено, что за 9 суток консервации потеря плотности эндотелиальных клеток донорских роговиц в опытной группе составила 4,1%, в контрольной - 7,2%. Процент потери эндотелиальных клеток отображен на Фигуре 6. Динамика снижения плотности эндотелиальных клеток донорских роговиц в опытной и контрольной группах на 3, 6 и 9 сутки консервации показана на Фигуре 7. Изменение площади эндотелиальных клеток на 3, 6 и 9 сутки консервации отображено на Фигуре 8. Площадь эндотелиальных клеток донорских роговиц к 9 суткам консервации в опытной группе увеличилась на 1,8%, в контрольной группе на 2,9%. Снижение процента гексагональных эндотелиальных клеток донорских роговиц изображено на Фигуре 9. Процент гексагональных эндотелиальных клеток к 9 суткам в опытной группе снизился на 6,86%, а в контрольной группе на 28,31%. При этом удалось добиться значительного экономического эффекта за счет двукратного сокращения объема консервационной среды (использование 5 мл среды на 1 роговицу вместо 10 мл) и заметно повысить трансплантационные качества трупных донорских роговиц на этапе гипотермической консервации. Средство для консервации роговицы получают следующим образом: в условиях ламинарной комнаты в химически чистую и стерильную мерную колбу сливают вместе две среды: 25 мл среды 199 и 25 мл среды Хэма F-10. Далее последовательно вносят 0,00014 г гентамицина сульфата 0,00015 г амфотерицина В и 0,0005 пептидного препарата NeyDIL Средство используют следующим образом. В условиях стерильного бокса выкраивают роговицу с ободком склеры диаметром 16 мм. Изолированный корнео-склеральный лоскут помещают во флакон с предварительно охлажденным до +4°С средством, плотно закрывают и помещают в холодильник для сохранения при температуре 4 Использование предлагаемого средства для сохранения донорской роговицы в Глазном банке ГУ МНТК «Микрохирургия глаза» позволило увеличить объем заготавливаемого трупного материала для сквозных кератопластик за счет сокращения требований к его отбору и улучшения трансплантационных качеств в процессе хранения в данном средстве. Формула изобретенияСредство для сохранения донорской роговицы глаза человека, включающее среду М-199, среду Хэма F-10, хондроитин-сульфат, декстран-40, гентамицин-сульфат, амфотерицин В, среду Дюльбекко-Игла, отличающееся тем, что она дополнительно содержит препарат NeyDIL  37 St.III0,00015 Среда Дюльбекко-Игла Остальное 37 St.III0,00015 Среда Дюльбекко-Игла Остальное
MM4A Досрочное прекращение действия патента из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 02.12.2012 Дата публикации: 27.09.2013 Популярные патенты: 2123784 Сетное каскадное устройство для промысла поверхностных объектов лова ... четыре аккумулирующих объема, образованных стенками ловушки, продольной и поперечной сетными перегородками, и соответственно четыре входных устройства, образованных боковыми стенками ловушки, крылом и усынками, остальные ловушки выполнены прямоугольной или трапецеидальной, или треугольной формы и расположены относительно крыла как по оси симметрии, так и сбоку, при этом крыло выполняет роль стенки ловушки, а распорные элементы ловушек установлены на верхних передних и/или задних кромках ловушки. Распорный элемент устройства может быть выполнен жестким или гибким как в цельном исполнении, так и в сборном виде. Распорный элемент может быть выполнен в виде дискретных плавов ... 2384988 Способ и устройство для управления сельскохозяйственной машиной ... управляющие сигналы для регулирования по меньшей мере одного параметра сельскохозяйственной машины, а этот по меньшей мере один параметр сельскохозяйственной машины вырабатывается в зависимости от конфигурации обработанной территории и/или территории оставшейся площади. Дальнейшая разгрузка оператора сельскохозяйственной машины достигается за счет того, что вычислительно-управляющее устройство автоматически производит регулирование выработанных параметров в сельскохозяйственной машине.Для того чтобы дать оператору возможность воздействия на регулирование выработанных параметров, в дальнейшем примере осуществления предусмотрено, что выработанные параметры могут быть визуально ... 2260932 Способ уборки льна и тресты при неблагоприятных погодных условиях ... тресты, хотя по нормативам он должен быть существенно больше. При таком низком выходе длинного волокна из тресты производство льнопродукци и переработка ее на льнозаводе являются убыточными [7]. С учетом сказанного, в настоящее время особенно актуальным является усовершенствование применяющегося в нашей стране в широких масштабах способа уборки льна и тресты при неблагоприятных погодных условиях, с целью повышения выхода длинного волокна при переработке тресты.В предлагаемом способе уборки льна и тресты при неблагоприятных погодных условиях, включающем операции уборки льна с расстилом лент стеблей на почву и оборачивания лент или их вспушивания в процессе приготовления тресты, ... 2142696 Способ выращивания цветочных и декоративных растений в тепличных и домашних условиях ... удобрение с соотношением основных элементов питания N : Р2О5 : К2О = 1 : 1 : 1 и микроэлементами. 2. Способ по п.1, отличающийся тем, что корнепитатель устанавливают в емкость за 30 - 35 суток до начала периода обильного полива и подкормок на глубину 40 - 60 мм так, чтобы не менее 50% от его длины находилось в почве, после установки производят обильный полив. 3. Способ по п.1, отличающийся тем, что за 8 - 10 суток до начала периода обильного полива и подкормок корнепитатель погружают в воду и выдерживают в ней при 18 - 25oC, после чего его устанавливают в емкость на глубину 40 - 60 мм так, чтобы не менее 50% от его длины находилось в ... 2076583 Способ выращивания растений в теплице и устройство для его осуществления ... вдоль и поперек вегетационных лотков, каждый из которых включает электропривод, вход управления которого подключен к соответствующему выходу блока управления, а выходной вал посредством последовательно соединенных элемента задания траектории перемещения и гибкого передающего элемента связан с соответствующей групповой тягой, причем групповая тяга механизма перемещения источников оптического излучения вдоль вегетационных лотков соединена с ближайшим к ней держателем первой группы каждого указанного источника, а групповая тяга механизма перемещения источников оптического излучения поперек вегетационных лотков связана с держателем второй группы каждого упомянутого источника. 3. ... |
Еще из этого раздела: 2111642 Высевающий аппарат 2450501 Способ повышения плодородия почвы на склонах 2048055 Устройство для отрезания и погрузки сенажа и силоса 2233582 Устройство для охлаждения молока 2462866 Рыболовная катушка 2296457 Устройство для магнитно-импульсной обработки растений 2452157 Рыхлитель-щелерез 2423033 Способ укрепления склонов посевом семян древесных растений 2020793 Способ выращивания растений и стаканчик для его осуществления 2007081 Способ биологической борьбы с вредителями капусты |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
 8°С), длительно сохраняющего жизнеспособность и цитоархитектонику эндотелия (до 9 суток), способного оказывать протективное действие на липопротеидные компоненты мембран, уменьшающего потерю эндотелиальных клеток (менее чем на 5%).
8°С), длительно сохраняющего жизнеспособность и цитоархитектонику эндотелия (до 9 суток), способного оказывать протективное действие на липопротеидные компоненты мембран, уменьшающего потерю эндотелиальных клеток (менее чем на 5%). -окисления липидов эндотелиальных мембран, то есть способствует поддержанию цитоархитектоники клетки.
-окисления липидов эндотелиальных мембран, то есть способствует поддержанию цитоархитектоники клетки.