Консервирование и контролируемая доставка-высвобождение сперматозоидовПатент на изобретение №: 2438309 Автор: КОММИСРУД Элизабет (NO), ХОФМО Пеер Ола (NO), КЛИНКЕНБЕРГ Гейр (NO) Патентообладатель: СПЕРМВИТАЛЬ АС (NO) Дата публикации: 10 Августа, 2010 Начало действия патента: 3 Июля, 2007 Адрес для переписки: 191186, Санкт-Петербург, а/я 230, "АРС-ПАТЕНТ", пат.пов. И.И.Липатовой, рег. 554 Изображения   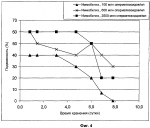 Настоящее изобретение относится к животноводству. Биополимерные частицы для консервирования сперматозоидов содержат сперматозоиды, заключенные в сетку биополимерного геля. Биополимер содержит альгинат, обогащенный гулуроновой кислотой. Для получения частиц смесь альгината и сперматозоидов добавляют в гелеобразующий раствор. Применяют для разведения животных. Изобретение позволяет увеличить срок хранения и жизнеспособность сперматозоидов. 4 н. и 29 з.п. ф-лы, 4 ил., 5 табл. Область изобретения Настоящее изобретение относится к биополимерным частицам для консервирования сперматозоидов. Настоящее изобретение также относится к способу консервирования, хранения и контролируемой доставки/высвобождения сперматозоидов и к применению биополимерных частиц согласно настоящему изобретению в разведении животных. Предшествующий уровень техники Искусственное осеменение (ИО) представляет собой метод, при котором сперматозоиды помещают в матку или в шейку матки животного искусственными способами вероятнее, чем путем естественного спаривания. Его широко применяют в качестве способа скрещивания и при разведении животных для приумножения желательных характеристик, в частности, в случае сельскохозяйственных животных, таких как крупный рогатый скот, свиньи, овцы, домашняя птица и лошади, но также и в случае домашних питомцев, таких как породистые собаки, водных животных или вымирающих видов. Обычно сперматозоиды собирают, разбавляют, а затем консервируют путем, например, криоконсервации. Применение методов криоконсервации предполагает, что сперматозоиды от конкретного вида животного выдерживают такую обработку, не приводящую в результате к слишком большому повреждению качества сперматозоидов, их жизнеспособности и способности к оплодотворению. Затем сперматозоиды транспортируют к месту расположения самок либо в криоконсервированном, либо в свежем виде в зависимости от того, что в данном случае пригодно. Очень важно, чтобы сперматозоиды сохраняли жизнеспособность до момента осеменения и в течение достаточного периода времени внутри самки животного после осеменения до тех пор, пока яйцеклетка(и) не достигнет места оплодотворения. Искусственное осеменение сельскохозяйственных животных применяют с 1940-х годов и в настоящее время широко применяют в сельскохозяйственном производстве, в частности, для разведения молочных пород коров, а также свиней. Обзор по развитию современного ИО и проблем животноводов в отношении применения искусственного осеменения и консервирования сперматозоидов раскрыт в R.H.Foote (2002), American Society of Animal Science (http://www.asas.org/symposia/esupp2/Footehist.pdf) и в книге "Reproduction in farm animals", edited by B.Hafez, E.S.E.Hafez. - 7th ed., Philadelphia, Lippincott Williams & Wilkins, 2000. - XIII, ISBN 0-683-30577-8 (ib.). Искусственное осеменение стало важным экономическим средством для разведения животных в сельскохозяйственном производстве, как в отношении разведения животных с конкретными предпочтительными генетическими характеристиками, так и для животноводства в целом. Однако существуют некоторые ограничения в отношении получения беременностей у самок животных в результате проведения искусственного осеменения. Например, срок хранения и жизнеспособность собранных сперматозоидов, как в процессе хранения после оттаивания в случае криоконсервированных сперматозоидов, так и после осеменения, существенны для успешного результата разведения. Доступность пригодных методик консервирования для конкретного вида животных варьирует. Для крупного рогатого скота широко используют методы криоконсервации. С другой стороны, сперматозоиды от других видов, таких как свиньи, менее толерантны к методам криоконсервации, что приводит в результате к меньшей гибкости в отношении возможностей обработки и хранения спермы. Кроме того, для получения сперматозоидов с пригодной оплодотворяющей способностью желательно, чтобы используемый метод консервирования также обеспечивал сохранение оплодотворяющей способности после осеменения. Сосредоточено множество усилий и исследований способов консервирования, нацеленных на обеспечение способов и средств хранения, которые гарантируют, что сперматозоиды сохраняют оплодотворяющую способность в течение более длительного времени после сбора и до момента осеменения. Если срок хранения в отношении сохранения оплодотворяющей способности после осеменения короток, труднее найти подходящий момент для осеменения в отношении овуляции. В случае свойства короткого срока хранения необходимы хорошие методы консервирования сперматозоидов, которые обеспечивают более длительный срок хранения и, следовательно, более длительную оплодотворяющую способность. Все еще отсутствует доступный способ консервирования, который обеспечивает достаточный срок хранения и жизнеспособность сперматозоидов в течение достаточного периода после осеменения, чтобы соответствовать потребности животноводов в гибкости применения, в частности, когда существует дальнее расстояние между расположением самцов и, следовательно, местом, где проводят сбор спермы, и самок-реципиентов, и требуется время для транспортировки. Кроме того, способ консервирования, обеспечивающий более контролируемую и длительную доступность сперматозоидов, снизил бы необходимость в искусственно стимулируемой овуляции путем гормональной обработки. Это было бы предпочтительно как экономически, в соответствии с нуждами потребителя, так и в отношении здоровья животных. Следовательно, существует необходимость в способах, гарантирующих, что сперматозоиды сохраняют оплодотворяющую способность в течение более длительного времени после осеменения, и сохраняют оплодотворяющую способность в течение более длительного времени, когда они помещены внутрь самки-реципиента. В настоящее время искусственное осеменение (ИО) у крупного рогатого скота в широком масштабе проводят, используя криоконсервированные сперматозоиды. Криоконсервированные сперматозоиды можно хранить в жидком азоте в течение десятилетий до применения. Однако когда сперматозоиды оттаивают, ИО необходимо проводить в пределах нескольких часов. После осеменения криоконсервированные сперматозоиды обладают оплодотворяющим потенциалом в течение примерно 12-24 часов, и ИО необходимо проводить примерно за 12-24 часа до овуляции. Поэтому существует необходимость в методах консервирования для разведения крупного рогатого скота, обеспечивающих сперматозоиды, которые обладают характеристиками достаточного срока хранения и которые предпочтительно сохраняют оплодотворяющую способность в течение нескольких суток. В некоторых странах используют бычьи сперматозоиды, хранимые в жидкости, с целью уменьшения числа клеток спермы на дозу ИО. Сперматозоиды обладают оплодотворяющей способностью в течение примерно 24-36 часов до осеменения. ИО следует проводить в пределах примерно 24 часов после сбора сперматозоидов. Однако бычьи сперматозоиды жидкого консервирования отягощены некоторыми недостатками, такими как укороченный/сниженный срок хранения и сниженный объем распределения. У свиней криоконсервированные сперматозоиды применяют только для специальных целей, таких как экспорт, перевозка на дальние расстояния, а также для контроля заразных заболеваний. ИО у свиней обычно проводят спермой жидкого консервирования. Время хранения спермы (сперматозоидов) жидкого консервирования должно зависеть от того, какой разбавитель используют. Сперматозоиды, разведенные разбавителями кратковременного действия, сохраняют оплодотворяющую способность в течение примерно 2-3 суток, тогда как сперматозоиды, разведенные разбавителями длительного действия, могут сохранять оплодотворяющую способность в течение вплоть до 5-6 суток. После осеменения оплодотворяющая способность сперматозоидов длится в течение примерно 12-24 часов. Большинство свиноматок осеменяют дважды во время обогрева с интервалом примерно 24 часа. При более гибкой системе, обеспечивающей более длительное время хранения до осеменения (например, одну неделю) и/или пролонгированное хранение и высвобождение сперматозоидов после осеменения (например, более чем 24 часа) животноводство имело бы более эффективную продуктивность и распространение, и животноводы имели бы меньшую потребность в точности периодизации осеменения относительно овуляции. В коневодстве животновод, в основном, зависит от наличия свежесобранной спермы в связи с отсутствием приемлемых методов консервирования для конских сперматозоидов. Это представляет большую проблему в коневодстве и в индустрии лошадиных скачек, поскольку предпочтительный жеребец-производитель для конкретной племенной кобылы чаще всего находится в другой стране, что требует длительного времени транспортировки. Кроме того, в связи с отсутствием пригодных методов консервирования для конских сперматозоидов ИО свежих конских сперматозоидов необходимо проводить в пределах 24 часов после сбора сперматозоидов. Коневодство, таким образом, сопровождается нежелательным дефицитом времени, что часто приводит к сниженному качеству спермы или сниженному оплодотворению в связи с некорректным осеменением в отношении овуляции. Следовательно, существует необходимость в способах консервирования, которые гарантируют как более длительный срок хранения в отношении необходимого времени на транспортную доставку, так и более длительный срок хранения после осеменения. Способ консервирования, применимый к конской сперме, имел бы большую экономическую и практическую ценность и, возможно, привел бы к перевороту в коневодстве. Система консервирования сперматозоидов, которая обеспечивает достаточную жизнеспособность как во время хранения, так и до и после осеменения, была бы выгодна для животноводства в целом. Более гибкая система консервирования сделала бы работу по разведению всех видов животных легче и привела бы в результате к повышению успешного оплодотворения. Система, где животновод в меньшей степени зависим от соответствия наиболее предпочтительному моменту времени осеменения в отношении овуляции, обеспечивает большую гибкость. В целях повышения оплодотворяющей способности извергнутых сперматозоидов исследовано несколько способов консервирования, включая криоконсервацию и жидкое консервирование. Опубликовано несколько исследований хранения сперматозоидов внутри капсул. В этих исследованиях использовали способы инкапсуляции, которые приводят в результате к частице, где сперматозоиды расположены внутри жидкой сердцевины, окруженной полупроницаемой мембраной. Nebel et al. (1985), Microencapsulation of bovine spermatozoa. J. Anim. Sci. 1985 60(6):1631-39, описали способ инкапсуляции бычьих сперматозоидов в капсулах, изготовленных из альгината в сочетании с полилизином. Данный способ основан на ранее опубликованном способе от Lim and Sun (1980), Microencapsulated islets as bioartificial endocrine pancreas. Science 1980 210(4472):908-10, которые разрабатывали получение инкапсулированного инсулина на основании инкапсуляции клеток островков Лангерганса. Nebel et al. (1985) сообщили о результатах как хранения при 37°C, так и 335 осеменений, и результаты для инкапсулированных сперматозоидов сравнивали с не инкапсулированными контрольными образцами. В данном исследовании не было сообщено о больших различиях между инкапсулированными и контрольными образцами. В других опубликованных исследованиях также продемонстрировано, что сперматозоиды могут быть инкапсулированы внутри капсул подобными способами, и они могут сохранять свою функциональность in vivo (Munkittrick et al. (1992) Accessory sperm numbers for cattle inseminated with protamine sulfate microcapsules. J. Dairy Sci., 75(3):725-31 (Bovine), Vishwanath et al. (1997) Selected times of insemination with microencapsulated bovine spermatozoa affect pregnancy rates of synchronized heifers. Theriogenology, 48: 369-76 (Bovine), и Maxwell et al. (1996). Survival and fertility of micro-encapsulated ram spermatozoa stored at 5°C. Reprod. Dom. Anim., 31:665-73 (Sheep). Munkittrick et al. (1992), и Vishwanath et al. (1997) сообщили, однако, что инкапсулированные сперматозоиды не являются столь же эффективными, как необработанные сперматозоиды, при осеменении в одно и то же время. Это было объяснено тем, что инкапсулированным сперматозоидам может требоваться некоторое время для высвобождения из капсул, прежде чем может произойти оплодотворение. Conte et al. (1998) в EP 0922451 BI, опубликованном Universita di Pavia и Universita Degli Studi Di Milano, и Torre et al. (2002), Boar semen controlled delivery system: storage and in vitro spermatozoa release. J. Contol. Release, 85:83-89, разработали альтернативный способ инкапсуляции сперматозоидов хряка. При данном способе сперматозоиды добавляют в раствор, содержащий кальций или барий, и эту суспензию переносят по каплям в раствор, содержащий альгинат. Капсула из альгината кальция или бария спонтанно образуется вокруг капли, как только она попадает в раствор альгината. Этот способ заявлен как более мягкий по отношению к клеткам по сравнению со способом, описанным Nebel et al. (1985). Другое преимущество состоит в том, что в данный способ вовлечено очень небольшое разбавление раствора сперматозоидов, которое заявлено как благоприятное для жизнеспособности клеток. Faustini et al. (2004), Boar spermatozoa encapsulated in barium alginate membranes: a microdensitometric evaluation of some enzymatic activities during storage at 18°C, Theriogenology, 61(1):173-184, сообщили о значительно большей фракции сперматозоидов с интактной акросомой и меньшим вытеканием ферментов из сперматозоидов, хранимых в инкапсулированном состоянии, где данный способ сравнили с необработанными сперматозоидами, хранимыми в таких же условиях. В недавней статье Weber et al. (2006), Design of high-throughput-compatible protocols for microencapsulation, cryopreservation and release of bovine spermatozoa. Journ. Biotechnol., 123:155-163, также описана новая система для инкапсуляции бычьих сперматозоидов. Данная система предназначена для производства инкапсулированных сперматозоидов с высокой пропускной способностью с использованием капсул из Ca-альгината или целлюлозы сульфата и полидиаллилдиметиламмония хлорида (pDADMAC). Наконец, Chou et al., US 6596310 BI (2003), раскрыт способ искусственного осеменения путем регулируемого по времени высвобождения спермы из капсул или твердых гранул, где сперму хранят в не капацитированном состоянии за счет использования источника энергии, который не поддерживает капацитацию. Краткое изложение сущности изобретения Настоящее изобретение основано на удивительном открытии, что заключение сперматозоидов внутрь биополимерных матриксов, где этот биополимерный матрикс состоит из альгината, обогащенного гулуроновой кислотой, приводит в результате к сперматозоидам с лучшими характеристиками консервирования в отношении срока хранения, жизнеспособности и оплодотворения. Биополимерные частицы и их сперматозоиды можно, таким образом, применять при искусственном осеменении животных. Одно из не ограничивающих преимуществ настоящей биополимерной системы консервирования сперматозоидов состоит в том, что она обеспечивает преимущества в результате придания сперматозоидам оплодотворяющей способности в течение более длительного периода после осеменения и, таким образом, делает время осеменения относительно овуляции менее критическим. Биополимерные частицы согласно настоящему изобретению можно применять при разведении животных и в животноводческом производстве в сельскохозяйственном производстве. Биополимерные частицы, таким образом, применимы, когда цель состоит в получении животных с особенно желательными характеристиками. Биополимерные частицы также применимы, когда целью является получение животных в целом, например, для продукции крупного рогатого скота мясного направления. Согласно настоящему изобретению биополимерные частицы можно использовать непосредственно и осеменять ими как таковыми животное-реципиент, если биополимерные частицы, такие как частицы альгината, растворяются в физиологических условиях внутри животного-реципиента (то есть внутри матки или шейки матки). Биополимерные частицы согласно настоящему изобретению, таким образом, обеспечивают контролируемое высвобождение сперматозоидов. Сперматозоиды можно также растворять из биополимерной частицы перед осеменением сперматозоидов. Как обсуждено выше, на предшествующем уровне техники, в основном, предложена инкапсуляция сперматозоидов в биополимерных капсулах, где сперматозоиды содержатся в жидкой сердцевине биополимерной капсулы. Только в одной ссылке (Chou et al., US 6596310 BI) упомянута возможность заключения сперматозоидов в твердом полимерном матриксе, хотя не приведено ни одного примера описанных там твердых гранул. Вместо этого авторами настоящего изобретения открыт другой подход к иммобилизации сперматозоидов. Согласно настоящему изобретению сперматозоиды заключены внутри сетки из твердого геля, образованной альгинатными гелями, где используемый альгинат обогащен гулуроновой кислотой. Авторами настоящего изобретения сделано открытие, что иммобилизация внутри сетки из твердого геля обладает несколькими преимуществами по сравнению с инкапсуляцией внутри капсул и гранул, раскрытой на предшествующем уровне техники. Не связываясь с конкретной теорией, предполагают, что путем использования биополимерных частиц и способа согласно настоящему изобретению это заключение приводит в результате к иммобилизации, например к ограничению естественной подвижности сперматозоидов за счет ограничительных связей сетки геля. Физическое ограничение подвижности за счет высоких концентраций клеток и присутствия полимеров высокой вязкости может быть одним из факторов, который влияет на выживаемость и поддержание функциональности сперматозоидов в хвосте придатка яичка (Watson 1993). Сперматозоиды хранятся в течение длительных периодов времени (более чем 1 неделя) в хвосте придатка яичка (Watson 1993). Использование альгината, обогащенного гулуроновой кислотой, дает возможность получения биополимерных частиц, содержащих заключенные в них сперматозоиды, которые полезны на практике в качестве системы консервирования, и которые можно применять при искусственном осеменении, например, в разведении животных. Таким образом, согласно одному аспекту в изобретении предложена биополимерная частица для консервирования сперматозоидов, где сперматозоиды заключены в биополимерной сетке геля, и где биополимерная частица, в которой заключен сперматозоид, содержит альгинат, обогащенный гулуроновой кислотой. Согласно другому аспекту настоящего изобретения биополимер, заключающий сперматозоиды, содержит альгинат кальция. Согласно другому аспекту указанный биополимер содержит альгинат с низкой вязкостью. Согласно еще одному другому аспекту изобретения концентрация альгината в биополимерных частицах по изобретению составляет по меньшей мере 0,1%. Согласно еще одному другому аспекту изобретения концентрация альгината в биополимерных частицах по изобретению составляет между по меньшей мере 0,1% и 6% альгината. Согласно еще одному другому аспекту изобретения концентрация альгината в биополимерных частицах по изобретению составляет по меньшей мере 1%. Кроме того, согласно одному аспекту изобретения концентрация сперматозоидов в биополимерных частицах составляет по меньшей мере 0,1×106 сперматозоидов/мл, как, например, по меньшей мере 100×106 сперматозоидов/мл, как, например, вплоть до по меньшей мере 2,5×109 сперматозоидов/мл. Согласно еще одному другому аспекту частицы согласно настоящему изобретению хранят в растворе, например, где отношение раствор для хранения : биополимерные частицы находится по меньшей мере между 1:1 и 1:100. Согласно еще одному другому аспекту сперматозоиды могут быть заключены совместно с соединениями или агентами, которые полезны в смысле оплодотворяющей способности и/или здоровья животного, как, например, одно или более чем одно из соединений или агентов, выбранных из не ограничивающей группы, состоящей из разбавителей, криопротекторов, антибиотиков, антител, антиоксидантов, белков и гормонов. Согласно другому аспекту изобретения сперматозоиды заключены совместно с одним или более чем одним антиоксидантом, выбранным из группы, состоящей из пирувата, 2,2,6,6-тетраметилпиперидин-1-оксила, 4-гидрокси-2,2,6,6-тетраметилпиперидин-1-оксила, супероксиддисмутазы, каталазы, глутатионпероксидазы, бутилированного гидрокситолуола, бутилированного гидроксианизола (гваякола). Согласно одному аспекту биополимерные частицы покрыты оболочкой. Эта оболочка может быть выбрана из не ограничивающей группы, состоящей из полилизина, хитозана, сульфата целлюлозы, гидроксипропилметилцеллюлозы и полидиаллилдиметиламмония хлорида. Биополимерные частицы согласно настоящему изобретению содержат сперматозоиды, собранные от животного, выбранного из не ограничивающей группы, состоящей из свиней, крупного рогатого скота, лошадей, овец, коз, кроликов, домашней птицы, домашних питомцев, таких как породистые собаки, водных животных и вымирающих видов животных, предпочтительно свиней, крупного рогатого скота, пушных зверей и лошадей. Биополимерные частицы по настоящему изобретению можно, таким образом, применять при получении беременностей у самок животных того же вида с помощью общепринятых способов искусственного оплодотворения, таких как ИО, ЭКО (экстракорпоральное оплодотворение) и ВЦИС (внутрицитоплазматическая инъекция спермы). Согласно одному аспекту изобретения сперматозоиды, используемые для образования указанной частицы, содержатся в семенной жидкости. Возможно, биополимерная частица может быть дополнительно обработана путем дегидратации, криоконсервации или лиофилизации. В изобретении также предложен способ получения частиц согласно изобретению, при котором смесь альгината, обогащенного гулуроновой кислотой, и сперматозоидов добавляют по каплям к гелеобразующему раствору, гелеобразующий раствор содержит согласно одному аспекту изобретения один или более чем один из нижеследующих ионов, выбранных из не ограничивающей группы, состоящей из кальция, натрия, бария и магния, предпочтительно ионов кальция и натрия. Кроме того, биополимерные частицы могут быть возможно образованы непосредственно в семенном контейнере. Согласно одному аспекту способа по изобретению частицы дополнительно обрабатывают путем дегидратации, криоконсервации или лиофилизации. В настоящем изобретении также предложено применение биополимерных частиц согласно настоящему изобретению при разведении животных, таких как свиньи, крупный рогатый скот, лошади, овцы, козы, кролики, домашняя птица, домашние питомцы, такие как породистые собаки, водные животные и вымирающие виды животных. Согласно одному аспекту изобретения биополимерные частицы применяют при разведении свиней, крупного рогатого скота или лошадей. Согласно одному аспекту частицами осеменяют непосредственно. Согласно другому аспекту частицы растворяют перед осеменением. Согласно еще одному другому аспекту частицы по изобретению используют вместе со свободными, иммобилизованными сперматозоидами. Наконец, в настоящем изобретении предложен способ оплодотворения животного, при котором сперматозоиды, консервированные в частицах согласно настоящему изобретению, вводят самке-реципиенту животного. Краткое описание графических материалов На фиг.1 показано хранение in vitro сперматозоидов быка (панель А) и хряка (панель Б) при температурах окружающей среды (бык 20°C, хряк 18°C). Значения подвижности приведены в виде функций времени хранения в сравнительных образцах и в образцах с иммобилизованными сперматозоидами. На фиг.2 показано хранение in vitro сперматозоидов быка (панель А) и хряка (панель Б) при 37°C. Значения подвижности приведены в виде функций времени хранения в сравнительных образцах и в образцах с иммобилизованными сперматозоидами. На фиг.3 показано хранение in vitro сперматозоидов при температурах окружающей среды (18°C). Значения подвижности приведены в виде функций времени хранения в сравнительных образцах и в образцах с иммобилизованными сперматозоидами. В экспериментах по хранению использовано различное количество среды для хранения относительно количества гранул, что указано номером серии. Сперматозоиды иммобилизованы на гранулах диаметром 1 мм при концентрации 1×109 сперматозоидов/мл. Фиг.4 - хранение in vitro сперматозоидов хряка при температуре окружающей среды (18°C). Значения подвижности приведены в виде функций времени хранения в сравнительных образцах и в образцах с иммобилизованными сперматозоидами. В экспериментах по хранению использованы гранулы с различными концентрациями иммобилизованных сперматозоидов, что указано номером серии. Сперматозоиды иммобилизованы на гранулах диаметром 3 мм. Подробное описание изобретения Как описано ранее, основное внимание исследований ранее было сосредоточено в направлении инкапсуляции сперматозоидов в целях облегчения оплодотворения in vitro и искусственного осеменения. Авторы настоящего изобретения предприняли принципиально иной подход к иммобилизации сперматозоидов, где сперматозоиды заключают внутрь сетки геля или биополимера внутри частицы твердого геля, и где сетка биополимера состоит из альгината, обогащенного гулуроновой кислотой. Данный подход принципиально отличен от инкапсуляции сперматозоидов, ранее описанной на предшествующем уровне техники, где сперматозоиды содержатся внутри капсулы с жидкой сердцевиной, где сперматозоиды могут совершать круговые движения, как в их природном окружении. Биополимерные частицы, заключающие сперматозоиды, согласно настоящему изобретению не зависят от использования растворов, что гарантирует, что сперматозоиды поддерживаются в не капацитированном состоянии. Термин "заключать" или "заключающий", как используют здесь, следует понимать как иммобилизацию сперматозоидов, приводящую в результате к тому, что предотвращена естественная возможность движения сперматозоидов. Степень иммобилизации должна варьировать в зависимости от характеристик биополимерной частицы, таких как механическая прочность, и от типа используемого полимера. Однако должно быть понятно, что предотвращена естественная возможность движения сперматозоидов, заключенных в биополимерных частицах согласно настоящему изобретению, которой сперматозоиды в ином случае обладали бы, если бы они хранились в жидкости, такой как жидкая сердцевина капсулы. Термин "биополимерная частица", как используют здесь, означает частицу, которая, когда она содержит сперматозоиды, обеспечивает пониженную возможность движения. Биополимерные частицы согласно настоящему изобретению состоят из вещества, образующего сетку, состоящую из альгинатного геля, обогащенного гулуроновой кислотой. Функция биополимерной частицы в отношении консервирования сперматозоидов не зависит от трехмерной формы биополимерной частицы согласно настоящему изобретению. Таким образом, биополимерные частицы согласно настоящему изобретению могут иметь различные формы, такие как, например, сферическая или цилиндрическая форма. Альгинат представляет собой полимер, который состоит из гулуроновой кислоты (G) и маннуроновой кислоты (M). Альгинат является общей составной частью клеточной стенки у всех видов бурых водорослей (Phaeophyceae), и обычно его экстрагируют щелочным раствором. Отношения маннуроновой кислоты к гулуроновой кислоте (M/G) в альгинате широко варьируют в зависимости от конкретных альгинофитов (бурых водорослей, продуцирующих альгинат) и на протяжении различных сезонов. Альгинат также синтезируется бактериями Pseudomonas и Azotobacter (Svanem et al. (2001), The Journal of Biological Chemistry, Vol 276:34, 31542-31550, Jain et al. (2003), Molecular Microbiology, 47(4), 1123-1133, Scott and Quatrano (1982), Applied and Environmental Microbiology, 44:3, 754-756). Альгинаты широко применяют, например, в пищевой промышленности, как, например, в качестве стабилизаторов и для регуляции вязкости, в фармацевтической и косметической промышленности в качестве, например, разрыхлителя. Для различных целей доступны как альгинаты, обогащенные гулуроновой кислотой, так и маннуроновой кислотой, соответственно (Mancini et al., (1999), Journal of Food Engineering 39, 369-378), и известны различные способы получения альгинатов, обогащенных гулуроновой кислотой (см. WO 8603781, US 4990601, US 5639467). Термин "альгинат, обогащенный гулуроновой кислотой" или "G-обогащенный альгинат", как его используют здесь, означает альгинат, содержащий более высокие количества гулуроновой кислоты, чем маннуроновой кислоты в полимерных цепях, составляющих полисахарид. Примеры понимания термина "G-обогащенный", как обычно он используется специалистами в данной области техники, очевидны из предшествующего уровня техники, изложенного в двух предшествующих параграфах. Альгинатные гели образуются за счет взаимодействий между двухвалентными ионами, такими как Са2+, и блокируют структуру гулуроновой кислоты в полимерной цепи альгината. Таким образом, образование альгинатных гелей можно осуществлять в очень мягких условиях, и оно пригодно для иммобилизации клеток. Альгинатные гели, таким образом, широко применяют для иммобилизации различных типов клеток. Однако иммобилизацию в альгинате чаще всего применяют в качестве исходной точки для последующего образования различных типов капсул с жидкой сердцевиной. При ссылке здесь далее на альгинат, альгинатный гель, альгинатную сетку или биополимерную частицу согласно настоящему изобретению, должно быть понятно, что указанный альгинат, альгинатный гель, альгинатная частица или биополимерная сетка или частица согласно настоящему изобретению является обогащенной гулуроновой кислотой. Не ограничивающими примерами пригодных типов альгината являются FMC LF 10/40, FMC LF 10/60 и FMC LF 20/60, доступные от FMC Biopolymer AS, Драммен, Норвегия, или А2033 от Sigma, Осло, Норвегия. Термин "срок хранения", как его используют здесь, означает время, в течение которого сперматозоиды сохраняют оплодотворяющую способность, как в отношении хранения in vitro до осеменения, так и in vivo после осеменения у животного-реципиента. Конкретный срок хранения сперматозоидов различного происхождения может варьировать. Тем не менее настоящая система консервирования, где сперматозоиды заключены в биополимерные частицы согласно настоящему изобретению, обеспечивает более длительный срок хранения после осеменения по сравнению со сперматозоидами, которыми осеменяют, после общепринятых способов хранения после сбора спермы. В соответствии с одним из примеров изобретения свиные сперматозоиды сохраняют отличную оплодотворяющую способность в течение более чем 12 часов после осеменения, более предпочтительно более чем 24 часов после осеменения. Согласно еще одному другому примеру изобретения бычьи сперматозоиды сохраняют отличную оплодотворяющую способность в течение более чем 12 часов после осеменения, более предпочтительно более чем 24 часов после осеменения. Термин "разведение", как используют здесь, означает любой способ, используемый для достижения беременности у самки животного. Не ограничивающий перечень таких способов включает ЭКО, искусственное осеменение и ВЦИС. Кроме того, разведение охватывает как разведение в отношении получения животных, обладающих особенно желательными характеристиками, так и в отношении коммерческой продукции. Термин "сперматозоиды", как используют здесь, включает сперматозоиды как таковые, а также сперматозоиды, содержащиеся в семенной жидкости, то есть сперму можно использовать непосредственно при образовании биополимеров согласно настоящему изобретению. Однако также сперматозоиды, выделенные из семенной жидкости, возможно, содержащиеся в других пригодных растворах для хранения, можно использовать для образования биополимерных частиц согласно настоящему изобретению. Термин "семенной контейнер", как используют здесь, включает все виды упаковок, пригодных для содержания и хранения сперматозоидов. Предшествующие способы инкапсуляции, раскрытые на предшествующем уровне техники и такие, как обсуждено выше, являются трудоемкими, и методы иммобилизации обычно содержат несколько стадий. Однако препарат биополимерных частиц согласно настоящему изобретению можно готовить в одностадийной методике. Точнее, частицы альгината кальция, содержащие сперматозоиды, легко образуются при минимальной физиологической и химической нагрузке на иммобилизованные клетки. Могут быть получены альгинатные частицы различных размеров и форм и с варьирующими типами альгината, концентрациями альгината и концентрациями иммобилизованных сперматозоидов. С целью заключения сперматозоидов согласно настоящему изобретению использование альгината в качестве биополимерного материала особенно пригодно вследствие того факта, что i) можно образовать гели в мягких условиях, ii) альгинат нетоксичен по отношению как к сперматозоидам, так и к животному-реципиенту, и iii) альгинат растворяется в физиологических условиях и, следовательно, способен высвобождать сперматозоиды внутри матки или шейки матки. Согласно одному аспекту настоящего изобретения альгинатные частицы получают путем добавления раствора, содержащего альгинат и сперматозоиды, по каплям в гелеобразующий раствор, приводящего в результате к образованию альгинатных гранул с заключенными в них сперматозоидами. Получение альгинатных гранул известно специалистам в данной области техники, например, как раскрыто в Smidsrad, O. and Skjak-Brak, G. (1990) Alginate as immobilization matrix for cells. Trends in Biotechnology 8, 71-78, и в US 6497902. Различные гелевые растворы можно применять для образования биополимерных частиц, таких как альгинатные гранулы. Различные растворы, которые пригодны для образования различных биополимерных частиц, находятся в пределах знаний специалистов в данной области техники. Согласно настоящему изобретению двухвалентные ионы (здесь также названы гелеобразующими ионами), такие как кальций и барий, можно использовать для образования альгинатных частиц, например, для достижения гелеобразования альгината. Альгинаты образуют гели в присутствии многих двухвалентных ионов и многовалентных ионов. Применение ионов кальция приводит в результате к быстрому гелеобразованию и относительно прочным частицам. С другой стороны, использование ионов бария приводит в результате даже к более прочным частицам, которые более стабильны в физиологических условиях. Должно быть понятно, что тип и количество гелеобразующего иона, которые следует использовать для образования биополимерных частиц согласно настоящему изобретению, могут варьировать в соответствии, среди прочего, с желаемой прочностью образованного геля, типом и концентрацией используемого альгината, содержанием гулуроновой кислоты и длиной G-блока альгината, типом и источником используемых сперматозоидов, типом дополнительных агентов, которые нужно включать в частицы (таких как антибиотики, разбавители, антиоксиданты и т.д.), и что такие модификации находятся в пределах объема настоящего изобретения. Основываясь на предшествующем уровне техники и на руководстве настоящего описания, специалист в данной области техники должен идентифицировать и определить без лишней нагрузки различные соединения, которые могут быть совместно заключены со сперматозоидами в биополимерных частицах согласно настоящему изобретению. Согласно одному аспекту настоящего изобретения ионы кальция и ионы натрия используют для образования биополимерных частиц. Таким образом, путем варьирования концентрации альгината и степени сшивания можно получить частицы с различными характеристиками высвобождения сперматозоидов и те, которые, например, адаптированы к конкретному виду животных или к конкретным условиям овуляции у различных животных. Кроме того, концентрация альгината влияет на механические характеристики биополимерных частиц и, следовательно, также на характеристики растворения частиц. Концентрация альгината может, таким образом, варьировать в зависимости от характеристик растворения, необходимых в каждом случае в зависимости, например, от животного-реципиента. Специалист в данной области техники, основываясь на общих знаниях и основываясь на приведенном здесь руководстве и без лишней нагрузки, определит различные применимые концентрации G-богатого альгината для использования при получении биополимерных частиц согласно настоящему изобретению. Согласно одному аспекту изобретения концентрация альгината в биополимерных частицах согласно настоящему изобретению находится между по меньшей мере 0,1 и 6%. Концентрация сперматозоидов, заключенных в биополимерных частицах согласно настоящему изобретению, может варьировать в зависимости, например, от типа/источника сперматозоидов, породы, животного-реципиента, методик или системы осеменения, методик или системы оплодотворения, присутствия других агентов, включенных в частицы (антибиотиков, антиоксидантов, разбавителей, белков и т.д.). В принципе, не существует нижнего предела концентрации сперматозоидов, и эта концентрация может варьировать в зависимости, например, от способа оплодотворения, происхождения сперматозоидов, животного-реципиента, характеристик растворения биополимерных частиц и т.д. При руководстве настоящего описания и общих знаниях специалист в данной области техники должен без лишней нагрузки экспериментирования определять пригодную концентрацию сперматозоидов, которую нужно использовать в каждом случае на основании желаемого способа оплодотворения, происхождения сперматозоидов, животного-реципиента и т.д. Следует принять во внимание, что при применении ВЦИС в качестве желаемого способа оплодотворения можно использовать более низкие количества сперматозоидов по сравнению, например, с искусственным осеменением. Согласно одному аспекту изобретения концентрация сперматозоидов, таким образом, составляет по меньшей мере 0,1×10 6 сперматозоидов/мл. Открытия настоящего изобретения показывают, что для некоторых животных выживаемость сперматозоидов в высокой степени повышена при повышении концентрации сперматозоидов. Следовательно, в соответствии с одним примером настоящего изобретения по меньшей мере 2,5 х 109 свиных сперматозоидов/мл заключают в биополимерную частицу (см. фиг.4). Однако 100×106 свиных сперматозоидов/мл также приводят в результате к беременностям у самок животных. Для бычьих сперматозоидов применим такой же диапазон концентрации, как для свиных сперматозоидов. Концентрацию сперматозоидов в биополимерных частицах можно, кроме того, модифицировать путем изменения количества сперматозоидов относительно количества альгината перед гелеобразованием, либо путем концентрирования или разведения раствора сперматозоидов перед смешиванием раствора альгината и раствора, содержащего сперматозоиды. Однако, поскольку модификация количества сперматозоидов, в конечном счете, приводит к модификации концентрации альгината в полученных частицах, концентрация альгината в исходном растворе альгината должна быть отрегулирована, если концентрацию альгината в биополимерных частицах следует сохранить. Вследствие высокой вязкости альгината в растворе на практике может быть затруднительно использование раствора альгината более чем с 4-6% альгината. Таким образом, согласно одному аспекту изобретения биополимерные частицы состоят из альгината с низкой вязкостью. Кроме того, сперматозоиды, заключенные в биополимерных частицах согласно настоящему изобретению, некоторым образом изолированы от окружающей среды и не высвобождаются до тех пор, пока сетка геля альгината кальция на растворится. Кроме того, сетка геля альгината кальция растворяется медленно в физиологических условиях, что вызывает медленно высвобождение сперматозоидов из матрикса иммобилизации. За счет этого эффекта сперматозоиды с оплодотворяющей способностью могут присутствовать в течение более длительных периодов времени. Скорости растворения можно контролировать, используя различные типы покрытий на матриксе иммобилизации. Различные полезные покрытия известны, включая, но не ограничиваясь ими, полилизин, хитозан, сульфат целлюлозы, гидроксипропилметилцеллюлозу или полидиаллилдиметиламмония хлорид. Для дальнейшего улучшения качества сперматозоидов сперматозоиды можно совместно заключать с различными растворами, важными для выживаемости и жизнеспособности сперматозоидов. Согласно одному воплощению изобретения в биополимерную частицу по настоящему изобретению включают разбавитель. Разбавители для сперматозоидов обычно используют для нескольких целей: - для увеличения объема - для стандартизации числа спермы в дозе ИО - для получения буферной емкости - для обеспечения физиологической окружающей среды в отношении осмомолярности - для поддержания питания клеток спермы - для контроля микробиологического заражения (антибиотики), либо в случае криоконсервации - для защиты клеток спермы от повреждений при замораживании и оттаивании. В пределах знаний специалистов в данной области техники находится выбор соответствующего разбавителя, который можно использовать в биополимерных частицах согласно настоящему изобретению, основываясь, например, на типе (происхождении) сперматозоидов, виде, способе консервирования, температуре хранения, способе осеменения, зоосанитарных требованиях и международном законодательстве. Молочные разбавители и Трис являются только немногими не ограничивающими примерами разбавителей среди огромного числа применимых, имеющихся в продаже разбавителей для сперматозоидов. Другими полезными разбавителями являются разбавители, описанные в Aalbers, JG, Rademaker, JHM, Grooten, HJG and Johnson, LA, 1983: Fecundity of boar semen stored in BTS, Kiev, Zorlesco, и Modena extenders under field conditions. J. Anim. Sci. 75 (Suppl. 1), 314-315, и Aalbers, JG, Johnson, LA, Rademaker, JHM and Grooten, HJG, 1984: Use of boar spermatozoa for Al: fertility and morphology of semen diluted in BTS and used for insemination within 24 hrs or 25 to 48 hrs after collection. Proc. 10th Int Congr. Anim. Reprod and Artif. Insemin. Urbana IL, Vol II, No 180, pp 1-3, обычно известный как BTS. BTS имеется в продаже от Minitub i Tyskland (Minitub Abfull und Labortechnik GmbH & Co.KG, Hauptstrasse 41, DE-84184 Тиефенбач, Германия). Еще одним другим полезным разбавителем является разбавитель Tri X-Cell Различные разбавители различаются по составу, pH, буферной емкости, осмомолярности и антибиотикам. Многие опубликованы, тогда как другие являются коммерческой тайной. Простейшие разбавители состоят только из различных растворов сахаров, как, например, лактозы и глюкозы. На основе общих знаний специалистов в данной области техники в области консервирования спермы должно быть понятно, что различные разбавители можно использовать согласно настоящему изобретению. Типы разбавителей, используемых согласно настоящему изобретению, могут варьировать в зависимости от происхождения спермы, типа используемого полимера, способа консервирования, температуры хранения и т.д. В пределах знаний специалистов в данной области техники находится определение и выбор типа и подходящего количества используемого разбавителя без отклонения от объема изобретения, раскрытого в описании и вложенной формуле изобретения. Согласно настоящему изобретению могут быть образованы биополимерные частицы различных размеров в соответствии со способами, известными на предшествующем уровне техники. Какой размер является пригодным, зависит от различных факторов, таких как источник сперматозоидов, тип и размер используемого устройства для оплодотворения, размер и форма используемого семенного контейнера и т.д. Биополимерные частицы согласно настоящему изобретению могут быть образованы диаметром, пригодным для всех методов осеменения предшествующего уровня техники для обеспечения легкости манипуляций, обращения, транспортировки и консервирования. Согласно еще одному другому аспекту изобретения биополимерные частицы образуют внутри контейнера, такого как, например, трубка для осеменения, в результате чего получают частицы, отлично приспособленные к размеру контейнера. Таким образом, в случае образования биополимерных частиц внутри контейнера может не быть необходимости в каком-либо растворе для хранения. Согласно одному аспекту изобретения биополимерные частицы содержат сперматозоиды, собранные от крупного рогатого скота. Согласно еще одному другому аспекту изобретения настоящие биополимерные частицы содержат сперматозоиды, собранные от свиней. Хотя настоящее изобретение проиллюстрировано альгинатными частицами, содержащими сперматозоиды, собранные от крупного рогатого скота и свиней, соответственно, в биополимерные частицы можно также заключать сперматозоиды от других видов животных. Без ограничения в биополимерные частицы можно также заключать сперматозоиды, собранные, например, от лошадей, овец, коз, кроликов, домашней птицы, домашних питомцев, таких как породистые собаки, водных животных и различных вымирающих видов. Кроме того, нигде не встречаются указания на то, что настоящие биополимерные частицы не могут быть полезны при консервировании человеческих сперматозоидов, и, следовательно, полезны при лечении бесплодия. Таким образом, должно быть понятно, что термин "животное", как его используют здесь, также охватывает людей. Кроме того, методы консервирования сперматозоидов также широко требуются в рыбоводческом производстве. Таким образом, сперматозоиды, имеющие происхождение от водных животных, также можно заключать в биополимерные частицы согласно настоящему изобретению, и, следовательно, они также охвачены термином "животное", как используют здесь. Иммобилизацию сперматозоидов в сетке биополимерного геля можно также применять для создания микроокружения, которое благоприятно для хранения сперматозоидов даже внутри половых органов самки. Это можно осуществить с дополнительными растворами для совместного заключения, которые благоприятны по отношению к сперматозоидам, степени оплодотворения, здоровью животного и т.д. Например, не ограничивающими примерами веществ, которые повышают жизнеспособность во время хранения, являются антиоксиданты или белки, гормоны и т.д. Сперматозоиды могут быть также совместно заключены с другими агентами или соединениями, которые благоприятны в свете оплодотворяющей способности или здоровья животного. Такие агенты или соединения могут представлять собой, например, антибиотики, такие как, например, стрептомицин, неомицин, гентамицин, пенициллин, линкомицин, спектиномицин, амоксициллин, тилозин и т.д., которые можно применять для контроля или предупреждения венерических заболеваний, криопротекторы, антитела, гормоны или соединения, повышающие репродуктивную эффективность, например, такие как соединения, известные из US 5972592. Таким образом, согласно еще одному другому аспекту изобретения биополимерные частицы содержат в дополнение к сперматозоидам соединения, которые благоприятны по отношению к оплодотворяющей способности или здоровью животного, такие как, например, антиоксиданты, антибиотики, антитела, гормоны или агенты, повышающие репродуктивную эффективность, либо их комбинации. Согласно одному предпочтительному воплощению настоящего изобретения биополимерные частицы содержат антиоксиданты, например, такие как пируват. Биополимерные частицы согласно настоящему изобретению, возможно, можно хранить в хорошо известных растворах для хранения сперматозоидов, таких как, например, молочные разбавители, ФСБ (фосфатно-солевой буферный раствор), BTS, Tri X-Cell В процессе хранения доля биополимерных частиц относительно раствора для хранения может варьировать в зависимости от типа и концентрации G-богатого альгината, источника сперматозоидов, используемого способа оплодотворения и т.д. В соответствии с примерами настоящего изобретения отношение раствора для хранения к биополимерным частицам составляет по меньшей мере 1:1, как, например, по меньшей мере 1:2, по меньшей мере 1:3, по меньшей мере 1:4, по меньшей мере 1:5, по меньшей мере 1:6, по меньшей мере 1:7, по меньшей мере 1:8, по меньшей мере 1:9 или по меньшей мере 1:10. Согласно настоящему изобретению можно использовать отношение раствора для хранения к биополимерным частицам вплоть до по меньшей мере 1:100. Кроме того, биополимерные частицы согласно настоящему изобретению можно, возможно, хранить как при температуре окружающей среды, например, при 18°C или 20°C при физиологической температуре (37°C), так и в условиях охлаждения, например, при 5°C. Кроме того, биополимерные частицы можно дополнительно обрабатывать путем дегидратации, криоконсервации или лиофилизации. Тогда в случае криоконсервации биополимерные частицы оттаивают перед осеменением. Сперматозоиды, которые обычно представлены в жидкости, можно хранить в течение длительного периода времени при заключении в биополимерную частицу согласно настоящему изобретению. Согласно другому воплощению изобретения биополимерные частицы используют непосредственно для осеменения животного-реципиента. Возможно, биополимерные частицы можно растворять для высвобождения сперматозоидов перед осеменением. Однако биополимерные частицы можно также, согласно еще одному другому воплощению, использовать вместе и в комбинации со свободными сперматозоидами. Хотя данное изобретение описано в связи с его конкретными воплощениями, должно быть понятно, что оно способно к дальнейшим модификациям. Подразумевают, что данная заявка охватывает любые вариации, применения или приспособления изобретения, в целом следуя принципам изобретения и включая такие отклонения от настоящего описания, которые приходят из известной и общепринятой практики в области техники, к которой принадлежит изобретение, и которые можно применить к существенным признакам, раскрытым выше, и в соответствии с объемом вложенной формулы изобретения. Приведенное выше описание различных аспектов настоящего изобретения выявляет общую природу изобретения, и специалист в данной области техники путем применения общих знаний в области искусственного осеменения и технологии разведения (включая содержание цитируемых здесь ссылок) легко модифицирует и/или адаптирует настоящие биополимерные частицы и их получение и использование для различных применений без ненужного экспериментирования, не отклоняясь от общей концепции настоящего изобретения и объема вложенной формулы изобретения. Следовательно, подразумевают, что такие адаптации или модификации находятся в пределах значения ряда эквивалентов раскрытых воплощений, основанных на положениях и руководствах, приведенных здесь. Должно быть понятно, что используемая здесь терминология предназначена для целей описания и не для ограничения. Таким образом, терминологию настоящей заявки специалист в данной области техники должен интерпретировать в свете положений и руководств, представленных здесь, в сочетании со знаниями специалистов в данной области техники. Приведенные ниже не ограничивающие примеры дополнительно иллюстрируют настоящее изобретение. Примеры Пример 1 Иммобилизация сперматозоидов в альгинате МАТЕРИАЛЫ И МЕТОДЫ Материалы Использовали следующие химические вещества: CaCl2.H 2O, K2HPO4, NaH2PO 4, NaCl и цитрат натрия от Riedel de Наën (Зеельце, Германия); моногидрат глюкозы от Norsk Medisinaldepot (Осло, Норвегия); альгинат натрия (PROTANAL LF 10/60), поставляемый FMC Biopolymer A/S (Драммен, Норвегия). Источник сперматозоидов Бычьи сперматозоиды собирали в животноводческом комплексе Geno при Hallsteingard при г.Тронхейм, Норвегия. Сперматозоиды хряка собирали в животноводческом комплексе Norsvin при Хамаре, Норвегия. Бычьи сперматозоиды разводили 1+2 в молочном разбавителе спустя короткое время после эякуляции. Сперматозоиды хряка разводили 1+4 в TRI X-CELL Буферные растворы Использовали приведенные ниже культуральные среды. Модифицированная IVT: 3 г/л глюкозы, 20 г/л цитрата натрия, 2,1 г/л NaHCO 3,1,16 г/л NaCl, 3 г/л ЭДТА, pH 7,35. BTS (с 3 мМ Ca): 37 г/л глюкозы, 0,44 г/л CaCl2, 4,5 г/л цитрата натрия, 1,25 г/л NaHCO3, 1,25 г/л ЭДТА, 0,74 г/л KCl, 1 г/л неомицина, pH 7,2. Гелеобразующий раствор для гранул: 7,3 г/л CaCl2, 5,96 г/л NaCl. Молочный разбавитель: 110 г/л обезжиренного молока Molico, 120 мл/л яичного желтка, 6,25 г/л стрептомицина, 1,5 млн. I.E./л пенициллина. Иммобилизация клеток Клетки сперматозоидов собирали в животноводческих комплексах Geno или Norsvin и разводили, как описано выше. Перед иммобилизацией сперматозоиды концентрировали центрифугированием (800 г, 20 мин, 20°C). Количество надосадочной жидкости, которое нужно удалять в каждой партии, зависит от желаемой концентрации сперматозоидов в готовых гранулах. После удаления избытка надосадочной жидкости клеточный осадок осторожно ресуспендируют путем мягкого перемешивания. Затем клеточную суспензию осторожно смешивают со стерильным 6% (мас./об) раствором альгината натрия. Альгинатный раствор добавляют в объемном отношении 2 части клеточной суспензии на 1 часть альгинатного раствора (Исследовано большое число различных комбинаций концентрации альгината, объемных отношений альгинатного раствора и клеточной суспензии. Типичные значения и методики приведены здесь). Смесь альгината и клеток добавляют по каплям к гелеобразующему раствору для гранул (см. выше). В целях получения гранул с диаметром 3 мм раствор добавляют через наконечники шприца с внутренним диаметром 0,5 мм. В целях получения гранул с меньшими диаметрами (вплоть до менее чем 1 мм в диаметре) используют систему, основанную на использовании воздушного потока в целях ограничения размера капель, которые образуются на иглах. Хлорид натрия используют в гелеобразующем растворе в целях обеспечения однородной концентрации полисахарида на протяжении гранулы (Smidsrad, O. and Skjak-Braek, G. (1990) Alginate as immobilization matrix for cells. Trends in Biotechnology 8, 71-78). В целях ограничения количества Са2+ в гранулах гранулы перемешивают не более чем в течение 8 мин в гелеобразующем растворе для гранул. Всю процедуру иммобилизации проводят при температуре окружающей среды. Хранение иммобилизованных сперматозоидов in vitro при температуре окружающей среды Одной из целей методики иммобилизации является продление периода времени, в течение которого можно хранить сперматозоиды до осеменения. Следовательно, были проведены эксперименты, в которых сперматозоиды хранят in vitro при температуре окружающей среды в буферных растворах. Сравнительные образцы с не иммобилизованными сперматозоидами из того же эякулята включают во все эксперименты. Качество сперматозоидов оценивают путем измерений подвижности в различные моменты времени в течение периода хранения. В каждый момент времени образцы анализируют и регистрируют подвижность иммобилизованных сперматозоидов и подвижность контрольных образцов. Исследован ряд комбинаций растворов для хранения и плотностей клеток в целях оптимизации экспериментальной системы (данные не представлены). Экспериментальные условия, описанные ниже, являются типичными, и их использовали в описанных ниже экспериментах. В экспериментах с бычьими сперматозоидами примерно 2 мл гранул с иммобилизованными сперматозоидами переносили в 13 мл центрифужные пробирки и добавляли раствор молочного разбавителя при объемном отношении 1+2. Контрольные образцы со свободно суспендированными сперматозоидами готовят путем получения суммарного разведения 1+15 в 13 мл центрифужных пробирках (во всех пробирках используют объем примерно 6 мл). В предшествующих экспериментах показано, что данное разведение является почти оптимальным для ограничения подвижности в течение хранения в сравнительных образцах (данные не представлены). В экспериментах со сперматозоидами хряка сперматозоиды хранили при 18°C в BTS (с 3 мМ Ca). В описанных ниже экспериментах контрольные образцы разводили 1+10 во всех экспериментах с получением суммарного объема 20 в 50 мл центрифужных пробирках (Ранее показано, что данное разведение является почти оптимальным для ограничения подвижности в течение хранения). Гранулы, содержащие иммобилизованные сперматозоиды, переносили в 50 мл центрифужные пробирки и добавляли BTS (с 3 мМ CaCl2) в отношении 1+3. Гранулы, содержащие иммобилизованные сперматозоиды, промывали раствором для хранения перед переносом в раствор для хранения. Хранение иммобилизованных сперматозоидов при 37°C С целью оценки выживаемости сперматозоидов при физиологических температурах регистрировали подвижность сперматозоидов в течение хранения сперматозоидов при 37°C. Бычьи сперматозоиды переносили в буферный раствор перед экспериментами по хранению при 37°C. Как описано выше, сравнительные образцы из того же эякулята включали в каждый эксперимент. Тесты проводили в 13 мл центрифужных пробирках с суммарным объемом 8 мл в каждой пробирке. Сравнительные образцы разводили 1+4 в растворе для хранения. Для иммобилизованных сперматозоидов 3 мл гранул, содержащих сперматозоиды, добавляли к 6 мл буферного раствора и хранили в 13 мл центрифужной пробирке. Сперматозоиды хряка обрабатывали подобным способом за исключением того, что использовали нормальный BTS (с 3 мМ Ca). Оценка подвижности Подвижность сперматозоидов оценивали с помощью микроскопической оценки. Образцы (типично 1 мл) отбирали из контейнеров для хранения и переносили в 1,5 мл пробирки Эппендорф. Пробиркам давали подогреться в течение минимум 15 минут в термоблоке при 37°C перед оценкой. Во время измерения 2,5 мкл образца добавляли на подогретое предметное стекло и сразу исследовали, используя световой микроскоп. Число подвижных сперматозоидов в каждом образце было установлено почти до 5% интервала. Если это практически возможно, экспериментатор не знает об идентификации образцов во время оценки. Иммобилизованные сперматозоиды должны быть высвобождены из гранул перед оценкой подвижности. С целью растворения альгинатных гранул 1 часть гранул добавляли к 3 частям раствора IVT в 13 мл центрифужной пробирке. Затем эти пробирки помещали во вращающийся барабан для пробирок и давали перемешиваться в течение примерно 30 мин перед оценкой. Результаты и обсуждение Выживаемость иммобилизованных сперматозоидов Данные экспериментов по хранению сперматозоидов в сравнительных образцах (с не иммобилизованными сперматозоидами) и в образцах с иммобилизованными сперматозоидами представлены на фиг.1 для сперматозоидов как быка, так и хряка. Для сперматозоидов хряка представлены данные по 2 различным размерам гранул. Причина этого состоит в том, что размер гранул должен быть ниже 1 мм с целью применения этих гранул для внутриматочного осеменения при существующем доступном оборудовании. Как видно из данных, представленных на фиг.1, оказывается, что иммобилизованные сперматозоиды обладают несколько более низкой подвижностью, чем сперматозоиды в сравнительных образцах, спустя короткое время после иммобилизации. Это различие в подвижности может быть вызвано как процедурой иммобилизации, так и процедурой растворения, поскольку гранулы, содержащие иммобилизованные сперматозоиды, необходимо растворить перед оценкой подвижности. Однако нет необходимости в растворении гранул перед осеменением, поскольку гранулы в физиологических условиях должны растворяться медленно (данные не представлены). Различие в подвижности между сравнительными образцами и иммобилизованными сперматозоидами уменьшается в течение периода хранения, поскольку оказывается, что подвижность в сравнительных образцах падает быстрее, чем в иммобилизованных образцах, особенно для сперматозоидов хряка. Для иммобилизованных сперматозоидов хряка подвижность примерно 50% была зарегистрирована после 5 суток хранения в гранулах диаметром 3 мм в данном конкретном эксперименте. В это время подвижность 10% была зарегистрирована в сравнительных образцах. Эти результаты показывают, что иммобилизация влияет на клетки или локальное окружение клеток благоприятно для их способности выдерживать хранение in vitro при 18°C. Для бычьих сперматозоидов отсутствует значимое различие в подвижности между сравнительными образцами и иммобилизованными сперматозоидами в последний период представленного эксперимента. Дальнейшая оптимизация условий хранения и методики иммобилизации может, однако, улучшить периоды хранения иммобилизованных бычьих сперматозоидов. Измерения потребления глюкозы и продуцирования лактата иммобилизованных бычьих сперматозоидов и не иммобилизованных сперматозоидов в сравнительных образцах показывают, что сперматозоиды, хранимые внутри сетки геля альгината кальция, обладают сниженной скоростью метаболизма (см. Пример 2). С целью оценки, выдерживают ли иммобилизованные сперматозоиды физиологические условия, то есть условия, где активность сперматозоидов должна быть максимальной, эксперименты по хранению проводили при температуре 37°C. данные экспериментов по хранению in vitro сперматозоидов быка и хряка во время хранения при 37°C показаны на фиг.2. Как видно в экспериментах по хранению in vitro при температурах окружающей среды, существует различие в подвижности между сравнительными образцами и образцами со сперматозоидами, иммобилизованными альгинатом, после приготовления образцов. Однако для сперматозоидов как быка, так и хряка подвижность падает достаточно быстро в сравнительных образцах с не иммобилизованными сперматозоидами во время хранения при 37°C. В образцах с иммобилизованными сперматозоидами подвижность падает значительно медленнее. После 15 часов хранения in vitro при 37°C подвижность сперматозоидов хряка при обоих диаметрах гранул все еще выше 50%. Действительно, подвижность все еще составляет примерно 30% после 60 часов хранения при 37°C в гранулах диаметром 3 мм. Для бычьих сперматозоидов оказывается, что подвижность падает быстрее, чем для сперматозоидов хряка, в данной экспериментальной системе. Однако, как и для сперматозоидов хряка, существует значимое различие между скоростями падения подвижности во время хранения в данном эксперименте для бычьих сперматозоидов. После 24 хранения иммобилизованные бычьи сперматозоиды все еще обладают подвижностью 45%, тогда как в сравнительных образцах подвижность не зарегистрирована. Необходимо помнить, что данные, представленные на фиг.2, получены с использованием искусственной экспериментальной системы, которая не является репрезентативной для ситуации in vivo у самки животного. Данные, представленные на фиг.2, однако, указывают на то, что сперматозоиды как быка, так и хряка выживают и могут сохранять подвижность в течение достаточно длительных периодов при иммобилизации в сетке геля альгината кальция даже при физиологической температуре. Эти данные могут также указывать на то, что иммобилизацию в сетках геля альгината кальция можно применять с целью ограничения подвижности сперматозоидов во время хранения при физиологических температурах. Это может быть особенно важно, поскольку время осеменения является критическим, в целях получения хороших результатов оплодотворения. Время осеменения является критическим, поскольку сперматозоиды обладают ограниченным временем выживания после осеменения. Эти результаты могут, следовательно, указывать на то, что иммобилизацию сперматозоидов в сочетании с контролируемым высвобождением после осеменения можно применять с целью увеличения периода времени от осеменения до оплодотворения. Испытания осеменения Испытания осеменения проводили суммарно у 9 свиноматок в одном стаде. Эти свиноматки были предназначены для выбраковки сразу после отъема предыдущего выводка поросят, но выбраковка была отсрочена вплоть до примерно 4 недель после осеменения. На скотобойне половые органы собирали непосредственно после удаления из полости и исследовали в течение 15 минут. Число желтых тел в яичниках и число эмбрионов (если они были) в рогах матки подсчитывали и записывали. В результате прерывания беременности на этой ранней стадии возможность наблюдения каждого присутствующего эмбриона (даже дегенерированного) относительно высока. В результате наблюдения числа доношенных родившихся поросят существует высокий риск потери высокого процента эмбрионов, поскольку любое оплодотворенное яйцо и эмбрион, погибший до оссификации, рассасывается материнской системой, и в это время никакие остатки не будут видимыми. Столь много, как 30% оплодотворенных яиц свиньи, могут погибнуть и исчезнуть от оплодотворения до оссификации. В испытаниях авторов изобретения хороший показатель вероятности оплодотворения может быть вычислен для каждой свиноматки путем подсчета числа эмбрионов и числа желтых тел при 4 неделях. Периодизация осеменений варьировала от обычной до одних суток раньше обычной, и проводили как однократные, так и двукратные осеменения. Результаты этих испытаний осеменения представлены в таблице 1. Таблица 1: Число осемененных свиноматок, частота беременности и частота оплодотворения (у беременных животных) в испытаниях осеменения Способ свиноматок Беременные (%)Частота оплодотворения (%) Имм. сперма, сутки 11+2 54 (80%) 57%Повторно растворенная имм. сперма, сутки 1+2 42 (50%) 66% свиноматок Беременные (%)Частота оплодотворения (%) Имм. сперма, сутки 11+2 54 (80%) 57%Повторно растворенная имм. сперма, сутки 1+2 42 (50%) 66%Испытания осеменения также проводили с бычьими сперматозоидами. Эти испытания менее просты для количественного определения, поскольку большие опытные стада недоступны. Эти испытания проводили в одном стаде с 20 имеющимися в наличии нетелями. Нетели были синхронизированы по эструсу перед осеменением. Хорошие частоты оплодотворения достигнуты с использованием иммобилизованных бычьих сперматозоидов. В этом исследовании 6 из 12 нетелей, осемененных иммобилизованными сперматозоидами, хранимыми в течение 24 часов, были оплодотворены, что подтверждено контролем на беременность. Сперматозоиды были иммобилизованы в альгинате, их хранили в иммобилизованном состоянии при температуре окружающей среды в течение различных периодов, осеменяли растворенными или нерастворенными. Периодизация осеменений варьировала от обычной до одних суток раньше обычной, и проводили только однократные осеменения. Беременных животных проверяли путем ректального исследования через 5-7 недель после осеменения. Результаты этих испытаний показаны в таблице 2. Таблица 2: Испытания осеменений у крупного рогатого скота: Используемый способ, число осемененных нетелей и частота беременности Испытание осеменений Способ нетелейБеременные (%)1 Сперма, имм., хранение в течение 24 часов при 18°C, растворена сразу перед осеменением 12 6 (50%) 2Сперма, имм., хранение в течение 24 часов при 18°C, осеменение в нерастворенном виде на одни сутки раньше обычного относительно эструса 31 (33,3%) 3 Сперма, имм., хранение в течение 48 часов при 18°С, растворена непосредственно перед осеменением 54 (80%) 1Сутки 1=сутки сбора сперматозоидов нетелейБеременные (%)1 Сперма, имм., хранение в течение 24 часов при 18°C, растворена сразу перед осеменением 12 6 (50%) 2Сперма, имм., хранение в течение 24 часов при 18°C, осеменение в нерастворенном виде на одни сутки раньше обычного относительно эструса 31 (33,3%) 3 Сперма, имм., хранение в течение 48 часов при 18°С, растворена непосредственно перед осеменением 54 (80%) 1Сутки 1=сутки сбора сперматозоидов Эти данные показывают, что сперматозоиды, иммобилизованные в гранулах альгината кальция, не только сохраняют подвижность, но также сохраняют все функциональные свойства, необходимые для оплодотворения. Таким образом, Geno и Norsvin продемонстрировали, что сперматозоиды, иммобилизованные в геле альгината кальция, можно применять для осеменения, и они могут вызывать оплодотворение как крупного рогатого скота, так и свиней. Пример 2. Потребление энергии иммобилизованными сперматозоидами Не ограничиваясь какой-либо конкретной теорией, считают, что иммобилизация сперматозоидов приводит в результате к сниженному потреблению энергии сперматозоидами, и что это полезно в отношении срока их хранения и способности к оплодотворению. Таким образом, для исследования этой теории бычьи сперматозоиды были иммобилизованы в гранулах альгината при концентрации примерно 150×106 сперматозоидов/мл и добавлены к 2-кратному объему гранул молочному буферу для разбавления. Сравнительные образцы со свободно суспендированными сперматозоидами готовили из того же эякулята, и они содержали такую же суммарную концентрацию сперматозоидов на суммарный объем в молочном буфере для разбавления. Образцы готовили в анаэробных условиях путем продувания N2 перед хранением при 20°C. Образцы молочного буфера для разбавления отбирали в течение периода хранения и измеряли продуцирование лактата сперматозоидами в образцах с помощью ВЭЖХ. Результаты представлены в таблице 3: Таблица 3: Продуцирование лактата иммобилизованными и свободно суспендированными сперматозоидами во время хранения при температурах окружающей среды. Значения приведены в наномолях лактата, продуцируемого на 350 млн сперматозоидов Время хранения (сутки) Иммобилизованные сперматозоиды Сравнительные образцы 14,21 16,12 6,00 20,63 6,90 22,1 Пример 3: Иммобилизация спермы от черно-бурой лисицы (vulpes fulva) Смешанную сперму хорошего качества от трех взрослых самцов черно-бурой лисицы (Vulpes fulva) разводили в ЭДТА разбавителе 228×10 6 клеток спермы на мл и перевозили в лабораторию. Через три часа после сбора и разведения аликвоту спермы центрифугировали при 2000 об/мин в течение 10 мин. Осадок смешивали с альгинатом (LF10/60) и образовывали гранулы, как описано в данной патентной заявке. Гранулы хранили в модифицированном Biladyl при 18°C. Остальную сперму хранили в ЭДТА при 18°C в качестве контроля. Гранулы растворяли через 48 часов. Как растворенную сперму, так и контрольную сперму нагревали до 35°C в течение 20 минут, после чего проводили оценку подвижности в виде процента подвижных сперматозоидов с помощью фазово-контрастной микроскопии при увеличении 10× и 25× на обогревающем столике при 38°C. Таблица 4: Подвижность спермы черно-бурой лисицы при хранении в иммобилизованном и не иммобилизованном (контроль) состоянии Подвижность по прибытииПодвижность после хранения в течение 48 ч Контрольная сперма 75%45-50% Иммобилизованная сперма (после растворения) 55-60% Подвижность по прибытииПодвижность после хранения в течение 48 ч Контрольная сперма 75%45-50% Иммобилизованная сперма (после растворения) 55-60%Пример 4: Поросята, рожденные доношенными после однократного внутриматочного осеменения спермой хряка, иммобилизованной в альгинате Смешанную сперму от 3 взрослых хряков обрабатывали согласно настоящему изобретению, и гранулы использовали для внутриматочного осеменения свиноматки, которая впоследствии опоросилась после полного срока беременности. Свиноматка была отлучена от предшествующего помета 12 февраля 2007 и была осеменена спермой, иммобилизованной в альгинатных гранулах, однократно 12 февраля 2007. Свиноматка родила 16 живых поросят 10 июня 2007. В этом помете не было мертворожденных поросят, и все поросята выглядели нормальными при клиническом исследовании. Пример 5: Иммобилизация спермы барана в альгинате Сперму от двух баранов для ИО собирали с помощью искусственной вагины и переносили в лабораторию в течение десяти минут. Сперму разводили 1+3 в разбавителе на основе обезжиренного молока (Curtis PG, Forteath AD, Polge C. Survival of bull sperm frozen in milk diluents containing varying concentrations of glycerol and fructose. Proc IVth Int Congr Anim Reprod 1961; 3:952-956), после чего добавляли альгинат и образовали гранулы, как описано в патентной заявке 0613288.0, пример 1. Гранулы хранили в разбавителе на основе обезжиренного молока либо при 5°C, либо при температуре окружающей среды. Иммобилизованные сперматозоиды высвобождали из гранул перед микроскопической оценкой подвижности в виде процента подвижных сперматозоидов через 24 и 48 часов после иммобилизации. Из практических соображений контроли не включали в данное исследование. Однако параметры жизнеспособности, включая подвижность, должны ухудшаться в процессе хранения жидкой спермы барана при 5°C или 20°C в течение 30 часов (Paulenz H, Soderquist L, Perez-Ре R, Berg KA. Effect of different extenders and storage temperatures on sperm viability of liquid ram semen. Theriogenology 2002:57(2):823-36). Таблица 5. Подвижность иммобилизованной спермы барана, хранимой при различных температурах в течение 24 часов и 48 часов  Температура храненияПодвижность после 24 ч хранения Подвижность после 48 ч хранения Баран 15°C 75-85% 70-80% 20°C70-80% 65-75% Баран 2 5°C 75-85%70-80% 20°C 70-80% 65-75% Температура храненияПодвижность после 24 ч хранения Подвижность после 48 ч хранения Баран 15°C 75-85% 70-80% 20°C70-80% 65-75% Баран 2 5°C 75-85%70-80% 20°C 70-80% 65-75%
Формула изобретения1. Биополимерные частицы для консервирования сперматозоидов, где сперматозоиды заключены в сетку биополимерного геля, и где биополимер, в который заключены сперматозоиды, содержит альгинат, обогащенный гулуроновой кислотой. 2. Частицы по п.1, где биополимер, в который заключены сперматозоиды, включает альгинат кальция. 3. Частицы по п.1, где концентрация альгината составляет по меньшей мере 0,1%. 4. Частицы по п.3, где концентрация альгината составляет между по меньшей мере 0,1% и 6% альгината. 5. Частицы по п.4, где концентрация альгината составляет по меньшей мере 1%. 6. Частицы по п.4, где концентрация альгината составляет по меньшей мере 2%. 7. Частицы по п.4, где концентрация альгината составляет 6%. 8. Частицы по п.1, имеющие концентрацию сперматозоидов по меньшей мере 0,1×10 6 сперматозоидов/мл. 9. Частицы по п.8, имеющие концентрацию сперматозоидов по меньшей мере 100×106 сперматозоидов/мл. 10. Частицы по п.8, имеющие концентрацию сперматозоидов по меньшей мере 2,5×109 сперматозоидов/мл. 11. Частицы по п.1, где частицы хранят в растворе. 12. Частицы по п.11, где отношение раствор для хранения: биополимерные частицы составляет по меньшей мере между 1:1 и 1:100. 13. Частицы по п.1, где сперматозоиды заключены совместно с одним или более чем одним антиоксидантом. 14. Частицы по п.13, где антиоксидант выбран из группы, состоящей из пирувата, 2,2,6,6-тетраметилпиперидин-1-оксила, 4-гидрокси-2,2,6,6-тетраметилпиперидин-1-оксила, супероксиддисмутазы, каталазы, глутатионпероксидазы, бутилированного гидрокситолуола, бутилированного гидроксианизола. 15. Частицы по п.1, где указанная частица покрыта оболочкой. 16. Частицы по п.15, где покрытие выбрано из группы, состоящей из полилизина, хитозана, сульфата целлюлозы, гидроксипропилметилцеллюлозы или полидиаллилдиметиламмония хлорида. 17. Частицы по п.1, где сперматозоиды дополнительно заключены совместно с соединениями или агентами, которые полезны для оплодотворяющей способности и/или здоровья животного. 18. Частицы по п.17, где сперматозоиды заключены совместно с одним или более чем одним из соединений или агентов, выбранных из группы, состоящей из разбавителей, криопротекторов, антибиотиков, антител, антиоксидантов, белков и гормонов. 19. Частицы по п.1, где сперматозоиды имеют происхождение от животного, выбранного из группы, состоящей из свиней, крупного рогатого скота, лошадей, овец, коз, кроликов, домашней птицы, домашних питомцев, таких как породистые собаки, пушных зверей, водных животных и вымирающих видов животных. 20. Частицы по п.19, где сперматозоиды собирают от животного, выбранного из группы, состоящей из свиней, крупного рогатого скота, пушных зверей и лошадей. 21. Частицы по п.1, где сперматозоиды содержатся в семенной жидкости. 22. Частицы по п.1, где частицы дополнительно обрабатывают путем дегидратации, криоконсервации или лиофилизации. 23. Частицы по п.1, где частицы образуют непосредственно в семенном контейнере. 24. Способ получения частиц по п.1, где смесь альгината и сперматозоидов добавляют в гелеобразующий раствор. 25. Способ по п.24, где гелеобразующий раствор содержит один или более чем один из нижеследующих ионов, выбранных из группы, состоящей из кальция, натрия, бария, магния. 26. Способ по п.25, где гелеобразующий раствор содержит ионы кальция и натрия. 27. Способ по любому из пп.24-26, где частицы дополнительно обрабатывают путем дегидратации, криоконсервации или лиофилизации. 28. Применение биополимерных частиц по п.1 в разведении животных. 29. Применение по п.28, где частицы применяют в разведении животных, выбранных из группы, состоящей из свиней, крупного рогатого скота, лошадей, овец, коз, кроликов, домашней птицы, домашних питомцев, таких как породистые собаки, пушных зверей, водных животных и вымирающих видов животных. 30. Применение по п.28, где частицами осеменяют непосредственно. 31. Применение по п.28, где частицы растворяют перед осеменением. 32. Применение по п.28, где частицы используют вместе со свободными сперматозоидами. 33. Способ оплодотворения животного с помощью сперматозоидов, консервированных в частицах по п.1, включающий стадии, на которых (а) получают частицы по п.1, в которых консервированы сперматозоиды, и (б) вводят указанные частицы реципиентной самке животного. Популярные патенты: 2154296 Зерноуборочная машина, преимущественно зерноуборочный комбайн, с мультипроцессорным управляющим устройством ... идентификатора (ID) и информации о рабочих параметрах (MES) в промежуточное запоминающее устройство (FIFO) операторского терминала (MI), в результате чего вскоре информация о рабочих параметрах (MES) оказывается полностью принятой, о чем приемная цепь (ES) извещает сигналом комплектности информации (MESC). Функции, изображенные в виде аппаратных средств, предпочтительно выполняются в значительной мере программными средствами в микропроцессоре, причем комплектные сообщения (IDC, MESC) служат для синхронизации буферного запоминающего устройства и программы. Перенос содержания буфера целесообразно производить, как в известных цепях подключения интерфейсов, каждый раз серийно ... 2296457 Устройство для магнитно-импульсной обработки растений ... аналогов прототипа, как наиболее близкого по совокупности признаков аналога, позволил установить совокупность существенных по отношению к усматриваемому нами техническому результату отличительных признаков в заявленном устройстве, изложенных в формуле изобретения. Следовательно, заявленное изобретение соответствует условию В«новизнаВ».Результаты проведенного дополнительного поиска известных решений показали, что заявленное изобретение не содержит признаков, совпадающих с отличительными от прототипа признаков заявленного устройства.Следовательно, заявленное изобретение не вытекает для специалиста явным образом из известного уровня техники, а является результатом творческого ... 2123784 Сетное каскадное устройство для промысла поверхностных объектов лова ... т.д. Такая распорная балка не снимается с ловушки при ее подсушке, а деформируется при прохождении силовых блоков и формирователей. Гибкая распорная балка прикрепляется к передней и задней кромкам ловушки по концам и за середину к крылу. При подходе оттяжек 12 к силовому вытяжному блоку отстегивают полузамок 31 - 32 (фиг.6) оттяжки 12 (фиг. 8), заводят в крючок с концом троса 43 и заправляют последний на силовой блок 26 и турачку 25. Подтягивая трос, разворачиваем распорную балку и направляем ее в ручей силового блока. Дальнейшая деформация балки при прохождении силовых блоков и формирователей осуществляется за счет удлинения упругого элемента 42 (см. фиг. 7). При укладке на палубе и ... 2025945 Способ выращивания насаждений сосны ... последствий редкого размещения деревьев по площади. Приведенные на рис. 2 размеры стволов являются суммарным результатом фактического прироста, полученного вследствие изменения экологических условий, вызванных различной густотой, а также и механического их увеличения за счет уборки при разреживаниях деревьев с более низкими таксационными показателями. Таксационная характеристика культур приведена в табл. 1. На основе комплексного показателя качества древесных стволов с учетом цели использования древесины проф. О.И.Полубояринова, а также древесных запасов насаждений, их сортиментной структуры, процента текущего прироста различных категорий древесины в чистых сосновых культурах ... 2129787 Инсектицидная композиция ... Ко) для получения раствора. Волокнистая пластина с размерами 22 35 2,8 мм (800 мг), состоящая из пульпы и хлопка, была пропитана указанным раствором с получением настоящей композиции (2). Сравнительный пример 1 К 10 мг бенфлутрина было добавлено 190 мг растворителя IP 2028 для получения раствора. Волокнистая пластина с размерами 22 35 2,8 мм (800 мг), состоящая из пульпы и хлопка, была пропитана указанным раствором с получением сравнительной композиции (1). Сравнительный пример 2 Сравнительная композиция (2) была получена точно таким же способом, что и композиция в примере композиции 1, за исключением того, что вместо 60 мг MGK 264 было использовано 60 мг бис ... |
Еще из этого раздела: 2472951 Машина (варианты) 2024226 Производные s- -тиоакриламидов и композиция для предотвращения или ингибирования роста бактерий 2027341 Бункер для сыпучих материалов 2462864 Устройство составления экономичного кормового рациона и экономичного кормления животных и птиц 2253239 Способ производства средства для обработки растений (варианты) 2400069 Способ защиты материалов от микробного разрушения 2235464 Гербицидно-действующее средство 2490849 Способ переработки безподстилочного помета птиц клеточного содержания и навоза свиней в топливные брикеты 2234219 Композиция для отпугивания паразитов 2451442 Способ обогащения селеном овощей и злаков |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
 , имеющийся в продаже от IMV (Instrument de Medecine Veterinaire, 10, rue Georges Clemenceau, B.P. 81, FR-61302 L'AIGLE Cedex, Франция).
, имеющийся в продаже от IMV (Instrument de Medecine Veterinaire, 10, rue Georges Clemenceau, B.P. 81, FR-61302 L'AIGLE Cedex, Франция).