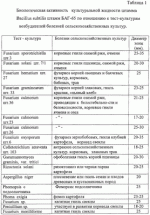
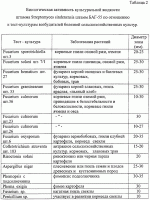
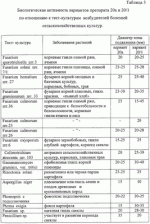
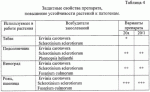
Препарат для защиты растений от возбудителей болезней сельскохозяйственных культур и винограда с ростстимулирующим эффектом, способ получения этого препарата и штаммы для его осуществленияПатент на изобретение №: 2313941 Автор: Буяновский Эдуард Константинович (RU), Санцевич Нинель Ивановна (RU), Кадомцева Валентина Михайловна (RU), Галкина Нэлли Николаевна (RU), Винокурова Тамара Павловна (RU) Патентообладатель: ООО "БИО Агат Групп" (RU) Дата публикации: 10 Апреля, 2007 Начало действия патента: 5 Октября, 2005 Адрес для переписки: 142290, Московская обл., г.Пущино, пр.Науки, 5, ИБФМ РАН, Н.И.Санцевич Изображения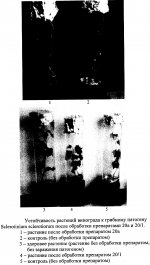 Изобретения относятся к биотехнологии, микробиологической промышленности, а именно к получению средств защиты растений от возбудителей болезней сельскохозяйственных культур и винограда с ростстимулирующим эффектом. Предложенный препарат для защиты растений содержит культуральные жидкости штамма бактерий Bacillus subtilis БАГ-65 и штамма актиномицета Streptomyces sindenensis БАГ-55, а также вспомогательные добавки и наполнители. Штамм бактерий Bacillus subtillis БАГ-65 обладает бактерицидными, фунгицидными и ростстимулирующими свойствами. Штамм актиномицета Streptomyces sindenensis БАГ-55 обладает одновременно фунгицидными и бактерицидными свойствами. Способ получения препарата заключается в том, что выращивают в условиях подпитки раздельно штамм бактерии Bacillus subtilis БАГ-65 и штамм актиномицета Streptomyces sindenesis БАГ-55, смешивают культуральную жидкость штамма бактерий Bacillus subtilis БАГ-65, культуральную жидкость штамма актиномицета Streptomyces sindenensis БАГ-55 в соотношении 10:1-1:1, в полученную смесь вносят вспомогательные добавки и наполнители. Изобретение обеспечивает защиту от наиболее вредоносных возбудителей и обладает ростстимулирующим эффектом. 4 н. и 4 з.п. ф-лы, 10 табл., 1 ил. (56) (продолжение): CLASS="b560m"Л.: Издательство сельскохозяйственной литературы, журналов и плакатов, 1962, с.155-160. Изобретения относятся к биотехнологии, микробиологической промышленности, а именно к получению средств защиты растений от возбудителей болезней сельскохозяйственных культур и винограда, в частности к получению препарата для защиты растений от возбудителей грибковых и бактериальных болезней сельскохозяйственных культур и винограда с ростстимулирующим эффектом. Известны штаммы для получения препаратов против грибковых возбудителей болезней злаковых культур. Так штамм бактерий Bacillus subtilis ВИЗР М-22, используемый для защиты растений от фитопатогенных бактерий, проявляет антагонистическую активность по отношению Clavibacter michiganense subsp. michiganense, Vanthomonas campestris pv. vesicatora, Pseudamonas corrugata, Pseudamonas syringae pv. tomato, Erwinia carotovora subsp. carotovora, Alternaria splani, Verticillum dachliae, Fusarium graminearum, Ascohyta fabae, Colletotrichum lagenarium, Rhizoctonia solani, Bipolaris sorokiniana, Sclerotinia sclerotiorum, Sertoria nodorum. (RU 2084152, кл. А01 N63/00, C12N 1/20, C12N 1/20, C12R1:125, 1997.07.20). Известный штамм бактерий Bacillus subtilis ВКПМ В-6554 - продуцент вещества, обладающего противогрибковой активностью, проявляет антагонические свойства в отношении грибов вида Beaveria bassiana, Gliocladium vide, Verticillium nigrescens, Verficillium dahiae, Fusarium graminearum, Sclerotinia scleotiorum, Phytophtora infestaus. (RU 2094990, кл. A01N 63/00, C12N 1/20, C12N 1/20, C12R1:125. 1997.11.10). Недостатком описанных штаммов является отсутствие препаративной формы препарата и промышленной технологии получения, а также быстрая инактивация в процессе хранения. Разработан и разрешен к производству и применению в сельском хозяйстве препарат бактофит для защиты растений от возбудителей болезней на основе культуры бактерий Bacillus subtilis штамм ИПМ-215 для защиты растений от болезней (RU 2019966, кл. A01N 63/00, 1994.09.30). Известен способ получения препарата фитоспорин (RU 2129004, А61К 35/74, C12N 1/20, C12R1:07, C12R1:125, 1999.04.20) на основе штамма бактерий Bacillus subtilis 26, представляющего собой культуральную жидкость этого штамма. Известен препарат против возбудителей болезней сельскохозяйственных культур и винограда на основе штамма бактерий Bacillus subtilis Ч-13 (ВНИИСХМ Д-606), который представляет собой средство для защиты сельскохозяйственных культур, подсолнечника, винограда от фитопатогенных микроорганизмов, а овощных культур - от фитопатогенных бактерий (RU 2259397 кл. А01С 1/06, C12N 1/20, C12R1:125. 2005.08.27). К недостаткам препаратов на основе одного штамма относится отсутствие эффективности против комплекса грибов родов Fusarium (Fusarium moniliforme, Fusarium sporotrichiella, Fusarium solani, Fusarium hematium) Colletotrichum, Gaeumannomyces, вызывающих корневые гнили злаков, грибных возбудителей, а также заболевания винограда оидиум (возбудитель - Uncinula necator Burril - мучнистая роса), и мильдью (возбудитель - Plasmopara viticola Beri. et Toni - ложная мучнистая роса), Antracnose (антракноз зернобобовых, ягодников, винограда), Actinomyces scabiens (парша на картофеле и свекле), Phoma exigia (фомоз картофеля), Aspergillus niger. Задача изобретения - разработка препарата для защиты растений от возбудителей болезней сельскохозяйственных культур и винограда с ростстимулирующим эффектом. Технический эффект, получаемый от использования этого изобретения, заключается в том, что препарат обладает более широким спектром действия на возбудителей болезней сельскохозяйственных культур и винограда и ростстимулирующим эффектом. Другой задачей является получение культур микроорганизмов - для получения препарата для защиты растений от возбудителей болезней сельскохозяйственных культур и винограда с ростстимулирующим эффектом. Технический эффект этих предлагаемых изобретений состоит в том, что они проявляют одновременно фунгицидные и бактерицидные свойства, что может быть использовано для защиты растений от возбудителей болезней сельскохозяйственных культур и винограда. Первая из указанных задач решается тем, что создан препарат для защиты растений от возбудителей болезней сельскохозяйственных культур и винограда с ростстимулирующим эффектом, включающий культуральную жидкость штаммов микроорганизмов, отличающийся тем, что в качестве культуральной жидкости штаммов микроорганизмов он содержит культуральные жидкости штамма бактерий Bacillus subtilis БАГ-65 и штамма актиномицета Streptomyces sindenensis БАГ-55, а также вспомогательные добавки и наполнители, при следующем соотношении компонентов, мас.%: Культуральная жидкость Bacillus subtilis БАГ-55 20-50Культуральная жидкость Streptomyces sindenensis БАГ-655-20 Вспомогательные добавки и наполнителиОстальноеВ качестве вспомогательных добавок могут быть использованы вещества, содержащие основные питательные вещества - азот, фосфор, калий - минеральные соли и микроэлементы, стимулятор - гидролизат хвойной хлорофилло-каротиновой пасты, протектор - диметилсульфоксид, прилипатель - молочная сыворотка. Указанные вещества могут использоваться в следующих количествах, мас.%: минеральные соли и микроэлементы 0,5-50, гидролизат хвойной хлорофилло-каротиновой пасты 1,0-4,0, диметилсульфоксид 3,0-5,0, молочная сыворотка 3,0-10,0. В качестве наполнителя используют соевую муку и каолин (5,0-8,5, 0-7,0 соответственно). Предлагаемый препарат представляет собой текучую пасту коричневого цвета со слабым хвойным запахом. Он содержит комплекс гептаеновых соединений и комплекс соединений из группы макролидов - названный нами синденином, который представляет собой комплекс макролидов, по физико-химическим свойствам близкий к азаломицинам F. Вторая задача решается тем, что выделены новые штаммы для получения препарата для защиты растений от возбудителей болезней сельскохозяйственных культур и винограда с ростстимулирующим эффектом: штамм бактерии Bacillus subtilis БАГ-65 и штамм актиномицета Streptomyces sindenensis БАГ-55. Штаммы пригодны для использования, в частности, против грибных и бактериальных заболеваний сельскохозяйственных культур. Культуральные жидкости указанных штаммов содержат в качестве действующего начала комплекс метаболитов двух культур, в том числе полиеновые соединения и синденин, который представляет собой комплекс макролидов, по физико-химическим свойствам близкий к азаломицинам F. Указанные метаболиты способны подавлять различные фитопатогенные грибы и бактерии, за счет чего расширяется спектр патогенов, на которые действует препарат. Штамм бактерий Bacillus subtilis БАГ-65, обладающий бактерицидными, фунгицидными и ростстимулирующими свойствами, пригодный для получения препарата для защиты растений от возбудителей болезней сельскохозяйственных культур и винограда с ростстимулирующим эффектом, выделен из почвы и депонирован Всероссийской коллекцией микроорганизмов под номером ВКМ В-2440 D и хранится в коллекции микроорганизмов ООО В«Био-Агат-ГруппВ» под номером БАГ-65. Целевое назначение: перспективен для использования в производстве биопрепарата против фитопатогенных почвенных грибов и бактерий, вызывающих заболевания сельскохозяйственных культур, а также обладающий ростстимулирующими свойствами. Культурально-морфологическая характеристика: Морфологические признаки. При микроскопировании - в поле зрения клетки палочковидные, прямые с закругленными концами, подвижные, расположенные одиночно, парами, реже цепочками; величина клеток в экспоненциальной фазе роста равна 0,7-0,8·2,0-3,0 мкм. Реакция по Граму положительная, клетки при спорообразовании не раздуваются. Перитрихи. Образуют термоустойчивые эндоспоры, не более одной в клетке. Споры крупные, овальной формы, расположены центрально или субтерминально. Строгие аэробы. Не образует глобулы в протоплазме после роста на глюкозном агаре. На мясопептонном агаре культура образует колонии с изрезанным краем, складчатые, сероватого цвета, сухой консистенции. Колонии среднего размера, диаметр которых у пятисуточной культуры достигает 4-5 мм. На мясопептонном бульоне культура образует пленку, осадок на 6-7 сутки, пигмент не синтезирует. На картофельном агаре образует колонии с изрезанным краем, морщинистые, светло-серого цвета, с уплотненным центром вгрызающиеся в агар. На ломтике картофеля - обильный рост, поверхность складчатая, пигмент не образует. Молочный агар. Рост хороший, колонии матового цвета, поверхность складчатая. На среде 5/5, содержащей триптон, аминопептид, экстракт сои, экстракт кормовых дрожжей, колонии с изрезанным краем, складчатые, серого цвета, сухой консистенции. Физиолого-биохимические свойства. Штамм БАГ-65 культуры Bacillus subtilis хорошо усваивает следующие углеводы без образования газа: глюкозу, сахарозу, крахмал, маннит, сорбит; целлобиозу, не усваивает арабинозу, ксилозу, слабо маннозу. Молоко коагулирует и пептонизирует без образования пигмента, не образует лецитиназу на яично-желтковых средах и уреазу на среде с мочевиной, желатину разжижает (гидролиз), крахмал гидролизует, на среде с казеином дает зоны просветления, хитиназу образует, образует АМК (ацетилметилкарбинол). Редукция нитратов положительная. Образование газа из NO3 в анаэробных условиях отрицательное. Активен в отношении эскулина и не разлагает салицин. Образует каталазу, отсутствует аргинингидролаза. Использует пептон, дрожжевой автолизат, экстракт кормовых дрожжей, экстракт сои, кукурузные и пшеничные экстракты, мясные отвары и бульоны, дрожжи пивные и пекарские, овсяную муку, нитратные формы азота. Гетеротроф. Обмен в высшей степени окислительный. В опытах по сбраживанию кислоты не выявляются. Аэроб. При глубинном культивировании растет до образования спор. Культура может расти при температуре от 28 до 37°С. Оптимальная температура роста при глубинном культивировании 28-30°С (+2). Антагонистическая активность. Штамм бактерий Bacillus subtilis БАГ-65 является культурой-антагонистом и синтезирует биологически активные вещества, проявляя биологическую активность к ряду фитопатогенных микроорганизмов: Fusarium sporotrchiella - корневые гнили озимой ржи, ячменя; Fusarium solani - корневые гнили озимой пшеницы, ячменя и ржи; Fusarium hematium - фузариоз корней овощебахчевых культур, кормовых, бобовых, трав (гнили); Fusarium graminearum - фузариоз корней злаковых, гниль красная, В«пьяный хлебВ»; Fusarium culmorum - корневые гнили озимой ржи, приводящие к белостебельности и белоколосости, корневые гнили ячменя и овса; Fusarium oxysporum - фузариоз зернобобовых, гнили клубней картофеля, корнеед свеклы; Colletotrichium atraventa - антракноз сельскохозяйственных культур, кормовых, злаковых трав; Gaeumannomyces graminis var. Tritici - офоболезная гниль корней пшеницы; Penicillium sp. - участвует в развитии корнееда свеклы; Fusarium moniliforme - кагатная гниль свеклы; Botrytis cinerea - кагатная гниль свеклы; Aspergillus niger - плесневение или гниль семян и плодов древесных и кустарниковых пород; Phomopsis - фомопсис у подсолнечника; Actinomyces scabies - обыкновенная парша на картофеле и свекле; Phoma exigia - фомоз картофеля; Verticillium dahliae - вертициллезное увядание хлопчатника, подсолничника; Antracnoze - антракноз зернобобовых, ягодников, винограда; Rizoctonia solani - ризоктониоз или черная парша картофеля; Fusarium sp.- кагатная гниль свеклы; Ervinia carotovora - слизистый бактериоз капусты. Антагонистическую активность изучали на картофельно-глюкозном и сахарозном агаре, на среде Сабуро и среде Чапека. Штамм бактерий Bacillus subtilis БАГ-65 хранят на скошенном картофельном агаре в биологических пробирках под вазелиновом маслом, при +4°С в течение 3-5 месяцев; в лиофилизированном виде в запаянных ампулах с защитной сахарозо-желатиновой средой или в жидком азоте. Штамм Bacillus subtilis БАГ-65 поддерживают на картофельном агаре, который включает: картофельный отвар(300-600 г картофеля) в 1 дм3 агар микробиологический20,0 г дистиллированная водадо 1,0 лДля размножения штамм выращивают на агаризованных средах: картофельный агар, картофельно-глюкозный агар, среда 5/5, L агар. Для глубинного культивирования используют ряд сред: 1) первая питательная среда, содержащая органические компоненты, %: дрожжи кормовые (БВК) 3.0зеленая патока, по объему, 3.0по редуцирующим веществам1.2-1.4 (или меласса) по объему3.0 магний сернокислый0.1 мочевина0.3 вода водопроводная до 100рН среды до стерилизации 6,8-7,02) вторая среда (%): соевая мука0.5 дрожжи (БВК)1.0 кукурузный экстракт0.3 NaCl0.5 вода водопроводнаядо 100Оптимум рН среды для роста культуры - 7.0-7.2, количество оборотов мешалки равно 240-260 об/мин. Время ферментации - 40-48 часов при 28-30°С. Отношение объема среды к объему колбы - 1:10. Отношение к фагам, лизирующим клетки других штаммов того же вида: штамм не продуцирует вирулентный фаг и не чувствителен к фагам, специфичным для культуры бактерий Bacillus subtilis. Особенности штамма: штамм бактерий Bacillus subtilis БАГ-65 отличается от описанных штаммов Bacillus subtilis способностью синтезировать комплекс полиеновых антибиотиков, определяющий его высокую фунгицидную активность. Выделение бактерий из почвенного образца проводили по следующей общеизвестной методике. При микробиологических исследованиях полученные почвенные образцы предварительно прогревали в металлических бюксах при температуре 105°С в течение 2 час для подавления роста немицелиальных бактерий. Брали навески почв по 1 или 10 г и переносили в протертые спиртом фарфоровые чашки. Увлажнив почву небольшим количеством стерильной воды, ее растирали в течение 5-7 минут стерильным пестиком. Растертую почву аккуратно переносили стерильным фарфоровым или металлическим шпателем в пустую стерильную колбочку с ватной пробкой. Количество воды в колбе - 99 (для 1 г почвы) или 90 мл (для 10 г почв), тогда концентрация почвенных суспензий была 1:100 или 1:10. Колбочки встряхивали на качалке 10-15 мин. Из полученных суспензий готовили серию последовательных разведении. Из пробирки (второго или третьего разведении) брали стерильной пипеткой по 0,1 мл суспензии и переносили в чашки Петри на плотные агаровые среды (мясопептонный или картофельный агар) и сеяли известным поверхностным методом (Большой практикум по микробиологии, Изд. МГУ. М., 1957 г., с.44-52). В среду добавляли антибиотик рубомицин (от 20-50 мкг/мл) для подавления роста грибов. Капли растирали стерильным стеклянным шпателем. Для каждого разведения суспензии брали 3-5 чашек Петри со средой. Засеянные чашки помещали в термостат при 29-30°С. Посевы инкубировали в течение 3-5 дней. Для выявления на чашках с питательной средой представителей споровых бактерий, относящихся к различным родам, микроскопировали колонии в оптическом микроскопе, отмечая характер колоний, наличие спор, отличающихся по форме и размерам. Выделяли колонии, относящиеся к определенному морфотипу. Для выделения в чистую культуру и дальнейшего культивирования использовали среду картофельный агар. Отобранные клоны проверяли на антагонистическую активность по отношению к фитопатогенам - возбудителям болезней сельскохозяйственных культур. Использовали метод блочков на твердых средах и жидких средах методом диффузии в агар (Н.С.Егоров, В«Основы учения об антибиотикахВ». М.: Высшая школа, 1986 г., с.117-120). Активность оценивали по величине зон подавления. У клона, проявившего высокую фунгицидную активность, изучали морфологические, культуральные и физиолого-биохимические свойства. По совокупности свойств культура была идентифицирована как Bacillus subtilis (Краткий определитель бактерий Берги, Изд. В«МирВ». М., 1980 г., с.286-288). Полученный штамм бактерий по антагонистическим и антибиотическим свойствам отличается от описанных штаммов Bacillus subtilis способностью синтезировать комплекс макролидных противогрибковых полиеновых антибиотиков, что позволило его выделить в новый штамм Bacillus subtilis БАГ-65. Наряду с антагонистическими свойствами синтез этих веществ определяет его высокую фунгицидную и ростстимулирующую активность по отношению к патогенам - возбудителям болезней сельскохозяйственных культур. Штамм бактерии Bacillus subtilis БАГ-65 пригоден для создания препарата против широкого спектра патогенов, вызывающих заболевания сельскохозяйственных - зерновых, масличных, овощных, технических культур, плодовых и винограда. В Таблице 1 приведены данные по биологической активности культуральной жидкости штамма, подтверждающие его способность подавлять тест-культуры возбудителей болезней сельскохозяйственных культур. Штамм актиномицета Streptomyces sindenensis БАГ-55, обладающий одновременно фунгицидными и бактерицидными свойствами, пригодный для получения препарата для защиты растений от возбудителей болезней сельскохозяйственных культур и винограда с ростстимулирующим эффектом, выделен из почвы Московской области, депонирован Всероссийской коллекцией микроорганизмов под номером ВКМ Ac-2535D и хранится в коллекции микроорганизмов ООО В«Био-Агат-ГруппВ» под номером БАГ-55. Целевое назначение: фунгицид широкого спектра действия, пригодный для использования в производстве биопрепарата против фитопатогенных почвенных грибов и бактерий, вызывающих заболевания сельскохозяйственных культур, обладающий ростстимулирующим эффектом. Культурально-морфологическая характеристика. Морфология. Вегетативные гифы тонкие, в диаметре - 0,5-1,5 мкм, образуют хорошо разветвленный мицелий. Воздушный мицелий беловатый, порошковидный, в зрелом состоянии образует цепочки из 7-10 спор. Цепочки спор прямые, споры гладкие. Грамположительные. Аэробы. Размножаются путем прорастания воздушных спор. При выделении колонии небольшие, обособленные, кожистые; в начале поверхность гладкая, но позже образуется беловатый воздушный мицелий, который может быть зернистым, легко превращающимся в порошок. Рост на диагностических средах. На минеральном агаре 1: воздушный мицелий белый, порошковидный, плохо развит; субстратный мицелий бесцветный до желтоватого; растворимого пигмента нет. На глицерин-нитратном агаре: воздушный мицелий очень скудный, беловатый; субстратный мицелий желтоватый, коричневатый, иногда зеленоватый; растворимого пигмента нет. На овсяном агаре: воздушный мицелий скудный, беловатый; субстратный мицелий желтоватый; растворимого пигмента нет. На органическом агаре 2: воздушный мицелий скудный, беловатый; субстратный мицелий желтоватый, иногда коричневатый; растворимого пигмента нет. Меланоидные пигменты: не образует. Физиолого-биохимические свойства. Гетеротроф. Обмен в высшей степени окислительный. Из углеродных соединений утилизирует глюкозу, ксилозу, арабинозу, сахарозу, салицин, рамнозу, слабо - сорбит, не усваивает рафинозу, инозит. В опытах по сбраживанию кислоты не выявляются. Гидролизует желатину, крахмал. Восстанавливает нитраты до нитритов. Культура идентифицирована как Streptomyces sindenensis. Идентификация вида проведена по Определителю актиномицетов (Гаузе Г.Ф., Преображенская Т.П,, Свешникова М,А., Терехова Л,П,, Максимова Т.С. Определитель актиномицетов. М., Изд-во Наука, 1983, 244 с.). Антагонистическая активность. При первичном определении антагонистических свойств использовали метод блоков (Бабьева И.П., Зенова Г.М. Биология почв. М., Изд-во Московского Университета, 1989, 333 с.). Культура Streptomyces sindenensis штамм БАГ-55 угнетает рост грамположительных бактерий (в том числе актиномицетов), грамотрицательных бактерий. Одновременно штамм актиномицета проявляет антагонистические свойства по отношению к ряду фитопатогенных грибов (представителей рода Fusarium, Coleotrichum, Rizoctonia, Aspergillius). He действует на рост микроскопических грибов и дрожжей (Penicillium chrysogenum, Neosavtovya fisher, Saccaromyces cerevisiae, Candida albicans). Изучение антибиотической активности штамма Streptomyces sindenensis БАГ-55 проводили на жидких средах методом лунок (Егоров Н.С. Выделение микробов - антагонистов и биологические методы учета их антибиотической активности. М., Изд-во Московского Университета, 1957 г.) В качестве тест-объектов использовали следующие патогены - возбудители болезней сельскохозяйственных культур. Fusarium sporotrchiella - корневые гнили озимой ржи, ячменя; Fusarium solani - корневые гнили озимой пшеницы, ячменя и ржи; Fusarium hematium - фузариоз корней овощебахчевых культур, кормовых, бобовых, трав (гнили); Fusarium graminearum - фузариоз корней злаковых, гниль красная, "пьяный хлеб"; Fusarium culmorum - корневые гнили озимой ржи, приводящие к белостебельности и белоколосости, корневые гнили ячменя и овса; Fusarium oxysporum - фузариоз зернобобовых, гнили клубней картофеля, корнеед свеклы; Colletotrichium atraventa - антракноз сельскохозяйственных культур, кормовых, злаковых трав; Gaeum-annomyces graminis var. Tritici - офоболезная гниль корней пшеницы; Penicillium sp. - участвует в развитии корнееда свеклы; Fusarium moniliforme - кагатная гниль свеклы; Botrytis cinerea - Fusarium кагатная гниль свеклы; Aspergillus niger - плесневение или гниль семян и плодов древесных и кустарниковых пород; Phomopsis - фомопсис у подсолнечника; Actinomyces scabies - обыкновенная парша на картофеле и свекле; Phoma exigia - фомоз картофеля; Verticillium dahliae - вертициллезное увядание хлопчатника, подсолничника; Antracnoze - антракноз зернобобовых, ягодников, винограда; Rizoctonia solani - ризоктониоз или черная парша картофеля; Fusarium sp. - кагатная гниль свеклы; Ervinia carotovora - слизистый бактериоз капусты. Данные по антагонистической активности культуры актиномицета Streptomyces sindenensis штамма БАГ-55 по отношению к фитопатогенным грибам приведены в Таблице 2. Выделение актиномицетов из почвы проводили по следующей общеизвестной методике. Для выделения и дифференцированного учета штаммов актиномицетов пользовались традиционным методом поверхностного посева из разведении почвенных суспензий, на среду с пропионатом натрия (Rowbatham T.J., Cross Т. Ecology of Rhodococcus coprochilus and associated actinomycetes in fresh and acricultaral habitats J. Gen. Microbiol. 1977. V.100 P.231-240.) следующего состава, г/л: КН2PO 40,46 Na2HPO4 0,73KNO3 0,10NaCl 0,29MgSO4 0,10СаСО 30,02 Пропионат натрия0,20 Агар-агар20,00 рН7,00После стерилизации (1 атм.) добавляли витамин B1 (4 мг/л) и раствор микроэлементов (1 мл/л) следующего состава, мг/мл: FeSO4·7H 2O200 ZnSO4·7H2O 180MnSO 4·2H2O20В среду добавляли антибиотики: нистатин (50 мкг/мл среды) для подавления роста грибов; налидиксовую кислоту (1,5 мкг/мл) и рубомицин (1 мкг/мл) для подавления роста немицелиальных бактерий. Образцы перед посевом прогревали про 120°С 1 час. Инокулированные чашки Петри инкубировали в термостате при 28°С в течение 14-28 суток. Выросшие колонии изолировали на пробирки со скошенным овсяным агаром или с органическим агаром 2 Гаузе (Г.Ф.Гаузе, Т.П.Преображенская, М.А.Свешникова, Л.П.Терехова, Т.С.Максимова. Определитель актиномицетов. Изд. " Наука". М., 1983 г., с.172) и инкубировали в термостате при 28°С в течение 14 суток. Подсчитывали общее число выросших колоний актиномицетов и проводили дифференцированный учет по морфологическим типам, микроскопируя колонии с чашки в оптическом микроскопе (400). Для выделения штаммов актиномицетов и проверки чистоты культуры использовали среду органический агар (среда Гаузе 2) следующего состава, г/л: Бульон Хотингера30 мл Пептон5,0 NaCl5.0 Глюкоза10,0 Агар-агар20,0 рН7,0-7,2Выросшие культуры оценивали по культуральным свойствам (окраске воздушного и субстратного мицелия и растворимым пигментам). Культуры, идентичные по культуральным свойствам и морфологии, отбраковывали. У отобранных культур изучали спектр действия или антагонистические свойства методом блочков на твердых средах и жидких средах методом диффузии в агар на жидких средах (Н.С.Егоров. "Микробы - антагонисты и биологические методы определения антибиотической активности. Изд. "Высшая школа ". М., 1965 г., с.28-41, 67-79) по отношению к фитопатогенным микроорганизмам, вызывающим заболевания растений. Активность оценивали по величине зон подавления тест-культуры. Необходимо было отобрать штамм, обладающий фунгицидными свойствами. Из проверенных актиномицетов наибольшая активность была отмечена у культуры актиномицета штамм БАГ-65. Идентификация проведена по Определителю актиномицетов Гаузе (Г.Ф.Гаузе, Т.П.Преображенская, М.А.Свешникова, Л.П.Терехова, Т.С.Максимова. Определитель актиномицетов. Изд. " Наука". М., 1983 г., с.175). Данный вид имеет ряд отличий от штаммов, описанных для вида Streptomyces sindenensis, что позволило выделить его в новый штамм Streptomyces sindenensis БАГ-65. Штамм Streptomyces sindenensis БАК-55 в отличие от типового штамма использует из углеродных соединений ксилозу, арабинозу и сахарозу. Штамм актиномицета БАГ-55 отличается от типовой культуры проявлением антагонистических и антибиотических свойств по отношению к ряду фитопатогенных грибов (представителей рода Fusarium, Coleotrichum, Rizoctonia, Aspergillius). He действует на рост проверенных микроскопических грибов и дрожжей (Penicillium chrysogenum, Neosavtovya fisher, Saccaromyces cerevisiae, Candida albicans). В литературе нет ссылок на антибиотические свойства культуры Streptomyces sindenensis no отношению к фитопатогенам - возбудителям болезней сельскохозяйственных культур. Антибиотическая активность штамма по отношению к фитопатогенным грибам, особенно в отношении грибов родов Fusarium и Coleotrichum, связана с синтезом комплекса антибиотиков макролидной природы. Для типового штамма эта группа антибиотиков не отмечена. По морфологическим свойствам колонии штамма БАГ-65 отличаются складчатой поверхностью с уплотненным центром, погруженным в агаризованные плотные среды. По культуральным свойствам, в отличие от описанных штаммов, не утилизирует арабинозу, ксилозу и маннит и в опытах по сбраживанию некоторых углеводов не образует кислоту. Штамм актиномицета Streptomyces sindenensis БАГ-55 хранят на скошенном овсяном агаре в биологических пробирках под вазелиновом маслом при +4°С в течение 1-3 месяцев; споровый материал - в пробирках с простерилизованной почвой, содержащей суспензию мела (СаСО3) или глюкозу. Срок хранения - 3 года. В лиофилизированном виде - в запаянных ампулах с защитной сахарозо-желатиновой средой и в жидком азоте. Для размножения штамма проводят культивирование на агаризованных средах: овсяном агаре, среде Гаузе №1 или глубинное выращивание на среде Гаузе №1 и №2. Оптимум роста 28°С. Для ферментации используют среду, содержащую кукурузную муку, соевую муку, мел и соли азота. Выращивание проводят на качалке при 190-200 об/мин, время ферментации - 4-5 суток при 28°С. Объем среды - 50-100 мл. Особенности штамма. Штамм обладает антибиотическими свойствами по отношению к ряду фитопатогенных микроорганизмов, особенно грибов рода Fusarium. Биологическая активность штамма связана с синтезом комплекса соединений, названного нами синденином, - комплекса макролидов, по физико-химическим свойствам близкого к азаломицинам F. Предлагаемый способ получения препарата для защиты растений от возбудителей болезней сельскохозяйственных культур и винограда с ростстимулирующим эффектом, заключается в том, что выращивают в условиях подпитки раздельно штамм бактерии Bacillus subtilis БАГ-65 и штамм актиномицета Streptomyces sindenensis БАГ-55, смешивают культуральную жидкость штамма бактерий Bacillus subtillus БАГ-65 и культуральную жидкость штамма актиномицета Streptomyces sindenensis БАГ-55 в соотношении 10:1-1:1, в полученную смесь вносят вспомогательные добавки и наполнители, при этом полученная смесь культуральных жидкостей составляет 25-70% от массы препарата, вспомогательные добавки и наполнители - остальное. Штамм бактерии Bacillus subtilis БАГ-65 выращивают при 25-35°С в течение 2-3 суток. В процессе культивирования в условиях подпитки получают уплотненную культуру штамма бактерии Bacillus subtilis БАГ-65 до оптической плотности культуральной жидкости не менее 100 ед. Это значение в 4-5 раз превышает плотность культуры при периодическом культивировании. Для получения уплотненной культуры используют дробное добавление раствора мелассы, которая является источником углеводов и ростовых факторов. Дробная подача мелассы предотвращает катаболитную репрессию важнейших факторов метаболизма, поддерживает концентрацию сахаров в культуральной жидкости. Введенные с мелассой биологически активные вещества способствуют размножению микробных клеток, активизируют биосинтез вторичных метаболитов. Штамм актиномицета Streptomyces sindenensis БАГ-55 выращивают при 25-30°С в течение 4-5 суток. В процессе культивирования условия подпитки обеспечиваются дробным добавлением раствора глюкозы, что позволяет повысить содержание синденина в культуральной жидкости в 2-2,5 раза. Культуральные жидкости получают культивированием штаммов на соответствующих средах в аэробных условиях. Ферментацию указанных штаммов микроорганизмов проводят в ферментере вместимостью 10 л с регулированием перемешивания, температуры, рН, аэрации, добавкой пеногасителя. Питательную среду стерилизуют при температуре 121°С в течение 20 мин. Культуральная жидкость штамма актиномицета Streptomyces sendenensis БАГ-55 содержит метаболиты, секретируемые штаммом, в том числе синденин, неиндефицированные метаболиты, источники углерода, азота, неорганические соли из питательной среды, вегетативные клетки - мицелий, конидии и их комбинации, также обладающие фунгицидным действием. Культуральная жидкость штамма бактерии Bacillus subtilis БАГ-65 содержит действующие вещества - комплекс гептаеновых соединений, неиндефицированные метаболиты, источники углерода, азота, неорганические соли из питательной среды, вегетативные клетки и споры штамма. Биологическая активность препарата была продемонстрирована на вариантах препарата 20а и 20/1. При оптимальном разведении препарата они проявляли хорошие защитные функции на подсолнечнике, винограде и зерновых культурах (рожь, пшеница) против возбудителей Sclerotinium scleotiorum, Fusarium culmorum и Phomopsis helianthi. Препараты показали быстрое начальное действие и долговременную защиту. Фунгицидное действие длится на протяжении более четырех недель, обеспечивая внутреннюю защиту растения на всех стадиях роста и, тем самым, предотвращая заражение. Интересные данные были получены при использовании в качестве защитных факторов отдельных фракций препаратов. Так, например, обработка растений супернатантом автоклавированной культуры Bacillus subtilis приводила к повышенной устойчивости подсолнечника и винограда к действию бактериального патогена Erwinia carotovora. В то время как отдельно взятая биомасса защитного эффекта не оказала. А клетки штамма Streptomyces sindenensis, напротив, проявляли защитный эффект, но по отношению к грибному патогену Sclerotinium scleotiorum. Возможно, что в основе этой защиты лежит и иммунологическое воздействие данных фракций по отношению к растению. Имеются данные, что при атаке патогена защитные механизмы клетки включают системы биосинтеза клеточной стенки растений, а также биосинтеза различных защитных низкомолекулярных соединений и специфических защитных белков. Также клетки растений способны распознавать патогены и индуцировать при их атаке специфический защитный ответ. Обычно взаимодействие между растением и патогеном вызывает у растения быструю реакцию гиперчувствительности, приводящую к локальному некрозу инфицированной ткани растения и гибели патогена. Кроме того, эта реакция сопровождается индукцией в окружающих неинфицированных клетках системной приобретенной устойчивости, в результате чего растение получает иммунитет против повторного заражения фитопатогенами. Такой механизм может объяснить специфическую защиту растений, обработанных клетками штамма Streptomyces sindenensis, к грибному патогену Sclerotinium scleotiorum и повышенную устойчивость растений, обработанных культуральной жидкостью штамма Bacillus subtilis к бактериальному патогену Erwinia carotovora. Вероятно, что большая часть действующих веществ поглощается ассимилирующими частями растений в течение очень короткого времени, распространяется по сосудам, и с этого момента начинается воздействие препарата непосредственно на растение. Возможность осуществления предлагаемых изобретений иллюстрируется следующими примерами, но не исчерпывается ими. Пример 1. Культивирование штамма бактерии Bacillus subtilis БАГ-65. Исходную культуру штамм бактерии Bacillus subtilis БАГ-65 хранят на агаризованной среде под вазелиновым маслом при температуре 4°С в течение 1 года и в лиофильно высушенном состоянии. Для выращивания, поддержания и хранения культур используют среду следующего состава: г (или см3) на 1 дм3 среды: Аминопептид60 см 3Триптон 5 гСоевый пептон 1 гЭкстракт дрожжей 1 гАгар-агар 18 гИсходное значение рН доводят раствором NaOH до 7,0-7,2. Стерилизуют среду в автоклаве 121°С в течение 20 мин. Для получения посевного материала в колбах используют среду следующего состава: г (или см 3) на 1 дм3 среды: Триптон1 г Дрожжевой экстракт1 г Глюкоза10 г КН2PO 41 грН среды доводят 20%-ным раствором NaOH до 7,0-7,2. Приготовленную питательную среду разливают в качалочные колбы вместимостью 750 см3 по 500 см3, стерилизуют в автоклаве при 121°С в течение 20 минут. Для засева колб с жидкой питательной средой используют 12-и часовую культуру, выращенную на агаризованной среде. Каждую колбу со средой засевают микробиологической петлей с чашки Петри. Посевной материал выращивают на подвесной качалке (190-200 об./мин) при температуре 29°С. Для получения культуральной жидкости в ферментере используют среду следующего состава, мас.%: (NH4) 2SO45,0-10,0 КН2PO 42,0-6,0 Меласса5,0-100,0 Глюкоза10,0-40,0 Соевый пептон0,5-4,0 Дрожжевой экстракт0,5-5,0Среду для выращивания культур в 10 дм3 ферментере стерилизуют в автоклаве при 1 кгс/см 2 (121°С) в течение 30 минут. Среду инокулируют 12-часовой культурой в объеме 5% от засеваемой среды. Ферментацию проводят при 29°С, аэрации 1 об. воздуха/1 об. среды; 0,15 дм 3·мин на объем ферментера, далее в процессе ферментации pO2 поддерживают на уровне 40-60% от насыщения увеличением расхода воздуха до 3 дм3·мин и скоростью перемешивания среды до 900 об/мин. Поддерживают рН среды 6,8-7,0 автоматической подачей 10% раствора аммиака. При самопроизвольном повышении рН среды выше 7,0 вносят 0,5 дм3 стерильного раствора мелассы. При вспенивании культуральной жидкости подают из колбы с отростком водную эмульсию пеногасителя (пропинол, лапрол и пр.) Культивирование ведут 36-48 часов. Окончание процесса определяют по самопроизвольному повышению рН после последней добавки мелассы. После чего ферментер выдерживают на режиме до повышения pO2 на 15-20%. По окончании ферментации отбирают пробу из ферментера для определения следующих параметров: оптической плотности, стерильности, содержание гексаенов. Полученная культуральная жидкость содержит: действующие вещества - комплекс гексаеновых соединений - 150 мг/дм3. Пример 2. Культивирование штамма актиномицета Streptomyces sindenensis БАГ-55. Исходную культуру штамма актиномицета Streptomyces sindenensis БАГ-55 хранят в лиофильно высушенном состоянии в ампулах и на агаризованной среде при температуре 4°С в течение 6 месяцев. Состав среды для поддержания культуры, мас.%: Крахмал картофельный растворимый 2,00Калий фосфорнокислый двузамещенный 0,10Натрий азотнокислый 0,30Калий хлористый 0,05Магний сернокислый семиводный0,055 Железо сернокислое0,0015 Агар микробиологический2,00 Водадо 1 дм 3рН после стерилизации 6,7-7,0Культуру штамма Streptomyces sindenensis БАГ-55 выращивают на агаризованной среде Чапека с крахмалом в течение 7-12 суток при температуре 28±1°С. Вегетативный посевной материал выращивают в колбах вместимостью 750 см3 с 100 см3 посевной среды следующего состава, мас.%: Глюкоза кристаллическая 1,0Соевая мука 1,0Натрий хлористый 0,5Калий углекислый 0,1Водадо 1 дм3рН среды 6,7-7,0Посевную среду в колбах стерилизуют в автоклаве при давлении 0,06-0,08 МПа (0,6-0,8 кг/см2) в течение 30 минут. Стерильную питательную среду засевают кусочком агара с культурой штамма и помещают на качалку с частотой вращения 3,6-3,8 сек -1 при температуре 28±1°C. Время выращиваания посевного материала 44-48 часов. Культуральную жидкость штамма Streptomyces sindenensis БАГ-55 получают в ферментере АНКУМ - 10 м вместимостью 10 дм3. На стадии культивирования используют питательную среду следующего состава, мас.%: Глюкоза кристаллическая 5,0Мука кукурузная 4,0Мука соевая 2,0Кальций углекислый 0,1Пропинол Б-400 0,1Водадо 1 дм3рН среды 6,7-7,0В процессе ферментации концентрация глюкозы в культуральной жидкости поддерживают на уровне 1-3% подачей стерильного 30% раствора глюкозы через дозатор. Значение рН поддерживают подачей 10% раствора аммиака на уровне 6,9-7,0. Стерильную питательную среду в ферментере засевают посевным материалом из колб. Количество посевного материала составляет 10% от обьема среды в ферментере. Культивирование ведут при температуре 29±0,5°С, скорость перемешивания - 5 сек -1; рН культуральной жидкости поддерживают на уровне 6,9-7,0; значение pO2 поддерживают на уровне 40-60% от насыщения увеличением скорости перемешивания до максимального значения. Далее значение pO2 поддерживают на заданном уровне увеличением подачи воздуха. При самопроизвольном повышении рН, что соответствует полной утилизации глюкозы, подают стерильный 30%-ый раствор глюкозы порциями по 0,1-0,2 дм 3. В конце процесса ферментации происходит самопроизвольное повышение значений pO2 и рН. Гашение пены в процессе ферментации производят стерильным раствором пеногасителя - пропинол Б-400 (или любой другой синтетический пеногаситель). Для контроля биохимических и микробиологических параметров процесса через каждые 12 часов асептично отбирают пробу культуральной жидкости. Из пробы делают высев на отсутствие посторонней микрофлоры, анализы на содержание редуцирующих сахаров и действующего вещества - синденина. Культивирование ведут в течение 5 суток до максимального накопления в культуральной жидкости синденина - 8 г/дм3. В Таблице 2 представлены данные по биологической активности культуральной жидкости Streptomyces sindenensis БАГ-55, подтверждающие щирокий спектр действия культуры на фитопатагены. Пример 3. Получение препарата для защиты от возбудителей болезней сельскохозяйственных культур и винограда. Культуральные жидкости штамма Bacillus subtilis БАГ-65 и Streptomyces sindenensis БАГ-55, полученные как описано в примерах 1 и 2, соответственно, смешивают в соотношении 1:1 по объему. Затем при перемешивании вносят вспомогательные добавки и наполнитель, мас.%: смесь культуральных жидкостей 70,00соевая мука 8,30гидролизат хвойной хлорофилло-каротиновой пасты 4,0диметилсульфоксид 3,00каолин П-2 6,60молочная сыворотка сухая7,50MnSO 4×5Н2О0,24 Н3ВО 30,24 ZnSO4×7Н2O 0,06(NH 4)2MoO4 0,06Полученный образец 20а представляет собой текучую пасту со слабым хвойным запахом. Пример 4. Получение препарата для защиты от возбудителей болезней сельскохозяйственных культур и винограда. Культуральные жидкости штамма Bacillus subtilis БАГ-65 и Streptomyces sindenensis БАГ-55 смешивают в соотношении 3:1 по объему. Затем при перемешивании вносят добавки и наполнитель согласно рецептуре, мас.%: Смесь культуральных жидкостей 48,80Соевая мука 10,10Молочная сыворотка 3,80Диметилсульфоксид 2,30Гидролизат хвойно-каротиновой пасты3,80Мочевина 11,50KNO 35,40 MgSO4×7H2O 4,60KH 2PO49,20 MnSO4×5Н 2О0,12 CuSO4×5H2O 0,10FeSO 4×7Н2О0,10 Н3ВО 30,06 Co(NO3)×6Н2О 0,06(NH 4)2MoO4 0,06Полученный образец 20/1 представляет собой текучую пасту коричневого цвета со слабым хвойным запахом. Пример 5. Тестирование образцов препаратов на тест-культурах фитопатогенных микроорганизмов. Биотестирование проводят на большом наборе тест-культур фитопатогенных микроорганизмов - возбудителей болезней растений. Биологическая активность образцов препаратов представлена в Таблице 3. Биологическую активность полученных партий опытных образцов препарата определяют методом лунок. (Н.С.Егоров В«Выделение микробов-антагонистов и биологические методы учета их антибиотической активностиВ». М., Изд-во Московского Университета, 1957 г.). Наибольший эффект действия у препарата вариант 20а отмечен по отношению к фитопатогенным микроорганизмам, вызывающим болезни сельскохозяйственных культур: корневые гнили озимой пшеницы, ячменя и ржи; корневые гнили озимой ржи; офоболезную гниль корней пшеницы; корневые гнили ячменя и овса; фузариоз зернобобовых; фузариоз корней злаковых. Зона подавления роста фитопатогена соответствовала 25-30 мм. У препарата вариант 20/1 наибольшая активность наблюдается в отношении возбудителей, вызывающих корневые гнили озимой ржи, ячменя; антракноза сельскохозяйственных культур, фузариоза зернобобовых, фузариоза корней злаковых, корневые гнили озимой пшеницы, ячменя и ржи. Зона подавления роста тест-культур - возбудителей болезней была от 25 до 35-40 мм. Пример 6. Тестирование биопрепарата на защитные свойства (устойчивость растений к фитопатогенам). Образцы вариантов препарата получены по примерам 3 и 4. Тестирование биопрепарата на защитные свойства (устойчивость растений к фитопатогенам) проводили на растениях картофеля, табака, сахарной свеклы, винограда, подсолнечника, ржи, пшеницы. Для проверки оценки устойчивости инокулированных биопрепаратами растений к фитопатогенам отдельные листья, семена и целые растения инфицировали грибными и бактериальными микроорганизмами: Sclerotinium scleroyiorum (S), Phomopsis helianthi (P), Fusarium culmorum (F), Ervinia carotovora. Суспензию образцов препарата, разведенного в оптимальной концентрации (1:500, 1:1000,1: 2000), распыляли на поверхности листьев растений, выращенных in vitro. Для исследования влияния препаратов на повышение устойчивости семян к фитопатогенным микроорганизмам, семена подсолнечника, винограда, пшеницы предварительно стерилизуют и затем погружают на 3 минуты в суспензию препарата. После обработки семена переносят на стерильную увлажненную фильтровальную бумагу в чашки Петри и используют в опытах с патогенами. Заражение патогенными микроорганизмами проводят через 3-4 дня после обработки растений препаратом. Действие препарата оценивают в течение одного месяца. Результаты представлены в Таблице 4. Знаком (+) отмечали наблюдаемую повышенную устойчивость растений к действию патогена после обработки препаратом. Знак (-) означает отсутствие эффекта. На чертеже представлены фотографии растений винограда, экспериментально подтверждающие данные Таблицы 4. Образцы вариантов биопрепарата 20а и 20/1 показали быстрое начальное действие и долговременную защиту против возбудителей растений Sclerotinium sclerotiorum, Fusarium culmorum, Phomopsis helianthi Ervinia carotovora на подсолнечнике, винограде и зерновых культурах (рожь, пшеница). Фунгицидное действие длится более 4-х недель, обеспечивая внутреннюю защиту растений на всех стадиях роста и, тем самым, предотвращая заражение. Пример 7. Испытание препарата 20а против комплекса болезней озимой и яровой пшеницы. Схема опыта. 1. Контроль - без обработки. 2. 20а - 0,3 л/га 3. 20а - 0,5 л/га Площадь делянки 50 м, повторность 4-кратная. Место проведения: Рязанский НИПТИ АПК, Рязанского района, Рязанской области. Сорт озимой пшеницы "Московская 39", норма высева - 5,5 млн. штук всхожих семян, предшественник - горчичный сидеральный пар. Учеты болезней проводились до обработки, через 20 дней после обработки по общепринятой методике ВИЗР, 1989 год (Чумаков А.Г., Захарова Т.И. Вредоносность болезней с/х культур. М., ВО В«АгропромиздатВ», 1990). Способ уборки и учета урожая культуры: вручную, методом пробных снопов с учетной площади 1 м2 на каждой опытной делянке; статистическая обработка данных по публикации Б.А.Доспехов. Методика полевого опыта. М., Изд. Высшая школа, 1985. В условиях испытуемого года распространение на пшенице болезни септориоза листьев было сильным в течение всей вегетации, а развитие бурой ржавчины - значительно слабее. Учеты, проведенные перед опрыскиванием и через 20 дней после обработки посевов культуры, выявили сильное развитие септориоза листьев до 27,5% и слабое бурой ржавчины - до 6,3%. Препарат 20а в концентрации 0,3 л/га и 0,5 л/га угнетал развитие возбудителя септориоза листьев от 9,3 до 10,2%. Биологическая эффективность, соответственно, была от 62,9 до 66,2%. При обработке растений препаратом 20а против бурой ржавчины степень развития болезни была в три раза меньше по сравнению с контролем. Так на 20.07.04 степень развития бурой ржавчины в опытном варианте составила 2,1%, а в контроле 6,3%. Биологическая эффективность при этом была 60,3-66,7%. Результаты эксперимента представлены в Таблице 5. Структурный анализ снопового материала растений озимой пшеницы, обработанных препаратом 20а - 0,3 л/га показал большее количество зерен в колосе, увеличение массы 1000 зерен у растений, по сравнению с дозой 0,5 л/га. Под влиянием препарата 20а во всех дозах наблюдалось увеличение высоты растений по сравнению с необработанным контролем. На всех вариантах опыта получена достоверная прибавка (НСР=2,2 ц/га) урожая зерна культуры на 3,1-4,4 ц/га (урожайность зерна на контроле - 36,4 ц/га). Резульаты эксперимента представлены в Таблице 6. Опрыскивание посевов озимой пшеницы в фазу колошения препаратом 20а в концентрации 0,3 и 0,5 л/га способствовало росту и развитию культуры и увеличению урожая зерна на 3,1-4,4 ц/га. Прирост урожая зерна получен за счет увеличения количества зерен в колосе, массы 1000 зерен. В условиях Рязанской области проверяли эффективность препарата 20а на яровой пшенице, сорт "Приокская", норма высева - 6,0 млн. штук всхожих семян, предшественник-горох. Схема опыта идентична схеме, примененной на озимой пшенице. Учеты фитосанитарного состояния посевов яровой пшеницы показали, что основными возбудителями болезней в период колошения - налива зерна были септориоз листьев и бурая ржавчина. Развитие септориоза листьев составило на контрольных делянках - 28,3%, бурой ржавчины - 5,5% (учет через 20 дней после опрыскивания). Препарат 20а в дозе 0,3 л/га снижал степень развития септориоза в 2,3 раза, при этом биологическая эффективность составила 54,8%. Учет степени развития болезни бурой ржавчины снизился до 3,0%, при этом биологическая эффективность была 45,4%. Данные опыта представлены в Таблице 7. Разбор снопового материала яровой пшеницы выявил рост регулирующий эффект от применения разных доз препарата 20а. В результате обработки увеличилась высота растений, длина колоса. Результаты эксперимента представлены в Таблице 8. Опрыскивание посевов препаратом 20а способствовало росту урожая зерна культуры на 3,2-4,6 ц/га по сравнению с необработанным контролем (урожайность в контроле 19,6 ц/га). Следовательно, в условиях вегетационного периода 2004 года опрыскивание вегетирующих растений яровой пшеницы в фазу колошения препаратом 20а в концентрации 0,3 и 0,5 л/га способствовало лучшему росту и развитию культуры, что выражалось в увеличении высоты растений, длины колоса и массы 1000 зерен. Во всех вариантах опыта получена достоверная прибавка урожая зерна яровой пшеницы от 3,2 до 4,6 ц/га, тогда как урожайность на контроле без обработки составляло 19,6 ц/га. Пример 7. Испытания варианта препарата 20/1 против возбудителей болезней винограда. Образец варианта препарат 20/1 был передан на испытания в ОАО В«ЮбилейноеВ» (Краснодарский край). Опыты были заложены на плодоносящем техническом сорте винограда Рислинг. Схема опыта, плодоносящий виноградник, сорт Рислинг. 1. Контроль - без обработки фунгицидами; 2. Препарат 20/1 - 800 г/га; 3. Препарат 20/1 - 400 г/га; 4. Хозобработки - система использования фунгицидов, принятая в хозяйстве - эталон. Опыт заложен по фону трехкратной обработки пестицидами: 13.05.04 - метаксил 2,5 кг/га; 27.05.04 - импакт 0,1 л/га + карате 0,15 л/га + данадим 2,0 л/га; 15.06.04 - сайрен 1,0 л/га + нитрабор 0,3 кг/га. Сроки обработок на опытном участке: 12 июня, 5 и 28 июля 2004 года. По варианту хозобработки применены следующие препараты: 12.06.04 - метаксил 2,5 кг/га; 05.07.04 - метаксил 2,5 кг/га + 0,4 л/га фалькона; 28.07.04 - метаксил 2,5 кг/га + 8 кг/га тиовита. Площадь варианта - 1 га, расход рабочей жидкости - 1000 л/га. Учеты по развитию комплекса болезней проведены на 10-й и 15-й день после очередной обработки. В результате проведенных испытаний установлено, что препарат 20/1 в концентрации 800 г/га оказывает сдерживающее действие на развитие оидиума. Результаты испытаний представлены в Таблице 9. Как видно из Таблицы 9, при первом учете при обработке винограда препаратом 20/1 в концентрации 800 г/га распространенность и развитие болезни оидиумом находилась на уровне эталонного варианта, при последующем учете, степень развития болезни была в три раза меньше по сравнению с контролем и незначительно уступала эталонному варианту (6,5 и 5,2, соответственно). По показателям эффективности варианты хозобработок и препарата 20/1 в концентрации 800 г/га практически не отличались друг от друга, т.е. при сложившихся погодных условиях, чередование препаратов фалькона и тиовита были близкими к трехкратной обработке препаратом 20/1. За 10 дней до уборки урожая на плодоносящих виноградниках грозди при обработке препаратом 20-1 в концентрации 800 г/га и хозобработке были слабо поражены серой гнилью. Выполненность грозди у винограда была лучше в варианте с препаратом 20/1 в концентрации 800 г/га по сравнению с эталоном (130% и соответственно 128%). Биологическая эффективность на 27 августа у препарата 20/1 была на уровне эталона - 98,7%, Таблица 10. Таким образом, показано, что полученный на основе двух новых штаммов микроорганизмов препарат эффективен для защиты растений от комплекса возбудителей болезней сельскохозяйственных культур и винограда. Он обеспечивает защиту от наиболее вредоносных возбудителей широкого набора сельскохозяйственных растений и винограда и обладает ростстимулирующим эффектом. Формула изобретения1. Препарат для защиты растений от возбудителей болезней сельскохозяйственных культур и винограда с ростстимулирующим эффектом, включающий культуральную жидкость штаммов микроорганизмов, отличающийся тем, что в качестве культуральной жидкости штаммов микроорганизмов он содержит культуральные жидкости штамма бактерий Bacillus subtilis БАГ-65 и штамма актиномицета Streptomyces sindenensis БАГ-55, а также вспомогательные добавки и наполнители при следующем соотношении компонентов, мас.%: культуральная жидкость Bacillus subtilis БАГ-65 20-50культуральная жидкость Streptomyces sindenensis БАГ-555-20 вспомогательные добавки и наполнители остальное2. Препарат по п.1, отличающийся тем, что в качестве вспомогательных добавок он включает вещества из ряда минеральные соли и микроэлементы, стимулятор - гидролизат хвойной хлорофилло-каротиновой пасты, протектор - диметилсульфоксид, прилипатель - молочная сыворотка. 3. Препарат по п.1, отличающийся тем, что в качестве наполнителей он содержит соевую муку и каолин. 4. Штамм бактерий Bacillus subtilis БАГ-65, обладающий бактерицидными, фунгицидными и рост стимулирующими свойствами, для получения препарата для защиты растений от возбудителей болезней сельскохозяйственных культур и винограда с ростстимулирующим эффектом. 5. Штамм актиномицета Streptomyces sindenensis БАГ-55, обладающий одновременно фунгицидными и бактерицидными свойствами, для получения препарата для защиты растений от возбудителей болезней сельскохозяйственных культур и винограда с ростстимулирующим эффектом. 6. Способ получения препарата для защиты растений от возбудителей болезней сельскохозяйственных культур и винограда с ростсимулирующим эффектом, заключается в том, что выращивают в условиях подпитки раздельно штамм бактерии Bacillus subtilis БАГ-65 и штамм актиномицета Streptomyces sindenensis БАГ-55, смешивают культуральную жидкость штамма бактерий Bacillus subtilis БАГ-65 культуральную жидкость штамма актиномицета Streptomyces sindenensis БАГ-55 в соотношении 10:1-1:1, в полученную смесь вносят вспомогательные добавки и наполнители, при этом полученная смесь культуральных жидкостей составляет 25-70% от массы препарата, вспомогательные добавки и наполнители - остальное. 7. Способ по п.6, отличающийся тем, что штамм бактерии Bacillus subtilis БАГ-65 выращивают при 25-35°С в течение 2-3 сут, при этом для подпитки используют дробное добавление раствора мелассы. 8. Способ по п.6, отличающийся тем, что штамм актиномицета Streptomyces sindenensis БАГ-55 выращивают при 25-30°С в течение 4-5 сут, при этом для подпитки используют дробное добавление раствора глюкозы. MM4A - Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 06.10.2007 Извещение опубликовано: 10.04.2009 БИ: 10/2009 NF4A Восстановление действия патента СССР или патента Российской Федерации на изобретение Дата, с которой действие патента восстановлено: 10.06.2009 Извещение опубликовано: 10.06.2009 БИ: 16/2009 MM4A Досрочное прекращение действия патента из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 06.10.2010 Дата публикации: 27.12.2011 NF4A Восстановление действия патента Дата, с которой действие патента восстановлено: 27.01.2012 Дата публикации: 27.01.2012 PC4A - Регистрация договора об уступке патента СССР или патента Российской Федерации на изобретение Дата и номер государственной регистрации договора: 20.11.2013 № РД0136188 Лицо(а), передающее(ие) исключительное право: Общество с ограниченной ответственностью "БИО Агат Групп" (RU) Приобретатель исключительного права: Некоммерческая организация "Фонд развития микробиологии и биотехнологий "Нива" (RU) (73) Патентообладатель(и): Некоммерческая организация "Фонд развития микробиологии и биотехнологий "Нива" (RU) Дата внесения записи в Государственный реестр: 20.11.2013 Дата публикации: 27.12.2013 Популярные патенты: 2138949 Комбинированный препарат для борьбы с таежными и лесными клещами, способ борьбы и аттрактант ... особей, а агрессивных - подавляющее большинство. В лабораторной культуре, где сложно провести предварительный отбор агрессивных нимф, их доля обычно не превышает 50%, а показатели аттрактивности образцов не превышают 75%. Для борьбы с клещами и подавления их численности предлагается готовить комбинированные аттрактивно-акарицидные препараты, например, в виде гранул. Такие гранулы с перметрином, лямбдацигалотрином и метатионом были испытаны в лабораторных и полевых условиях и показали высокую эффективность - практически полную гибель клещей при низких дозировках токсиканта в расчете на обрабатываемую площадь и безвредность для нецелевой фауны. Кроме того, в опытах с ... 2285375 Способ обработки почвы и устройство для его осуществления ... плавное изменение глубины обработки почвы. Формула изобретения 1. Способ обработки почвы, включающий предварительную установку глубины обработки на стационаре, заглубление рабочих органов и рыхление, отличающийся тем, что поле разбивают на поперечные участки относительно направления движения агрегата для возделывания на поле разных видов культур, причем при движении агрегата по полю на каждом последующем поперечном участке глубину рыхления изменяют относительно предыдущего в пределах пахотного слоя. 2. Устройство для обработки почвы, содержащее раму, рабочие органы, опорное колесо и механизм изменения положения опорного колеса, отличающееся тем, что механизм выполнен с ... 2056100 Доильный стакан ... срок ее службы, уменьшает наползание доильного стакана на сосок вымени животного во время доения, позволяет извлечь молоко из вымени без операции "машинное додаивание". ФОРМУЛА ИЗОБРЕТЕНИЯ ДОИЛЬНЫЙ СТАКАН, содержащий корпус с установленным на его боковой поверхности патрубком и расположенной внутри него эластичной сосковой трубкой, отличающийся тем, что корпус в средней части на диаметрально противоположных сторонах выполнен вогнутым с деформацией сосковой трубки, а патрубок установлен на одной из вогнутых сторон в месте касания корпуса и сосковой ... 2075933 Композиция для иммунизации растений от различных фитопатогенов ... Один из вариантов конкретного состава используемой композиции представлен в табл.2. Данный состав таблеточной смеси соответствует таблеткам, предназначенным для обработки 1 кг семян овощных культур, либо 1 т семян злаковых культур, либо 4 т посевного картофеля, либо 1 га посевной площади. Так, таблетка массой 0,3 г для данного состава таблеточной смеси при наличии этилового эфира арахидоновой кислоты около 50% в смеси этиловых эфиров жирных кислот содержит содержит примерно 10 мг этилового эфира арахидоновой кислоты. При наличии этиловых эфиров АК и ЭПК около 10% в смеси этиловых эфиров жирных кислот таблетка содержит примерно 2 мг этиловых эфиров АК и ЭПК. В тесте на ускоренное ... 2157603 Способ послепосевного прикатывания озимых культур и каток для его осуществления ... предложенного катка заключается в том, что наружная поверхность каждого выступа выполнена полуцилиндрической, проходящей вдоль всей длины цилиндра и соосной его наружной поверхности, при этом выступы размещены с одинаковым угловым шагом на окружности цилиндра. Радиус полуцилиндра каждого выступа составляет не менее 1/3 радиуса цилиндра. Совокупность вышеперечисленных признаков представляет такую геометрическую форму рабочей поверхности катка, которая, при его вращательно-поступательном движении по полю, как бы создает ее непрерывную "зеркальную" развертку, где выступ катка соответствует низине в создаваемом волновом рельефе поля, а расположенная между выступами ... |
Еще из этого раздела: 2093016 Устройство для водоподачи 2279799 Балансир рыболовный 2215407 Способ создания исходного материала для селекции растений 2061349 Рама универсальной навесной сельскохозяйственной машины 2260943 Способ подращивания личинок осетровых рыб 2235450 Малогабаритная машина для обескрыливания, очистки и сортирования лесных семян 2196403 Почвообрабатывающий модуль 2189708 Машина для формирования гребней 2464765 Сепарирующее устройство корнеклубнеуборочной машины 2421109 Способ роспуска закристаллизовавшегося меда и устройство для его осуществления |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||