Штамм бактерий pseudomonas aureofaciens вкм в-2501 д для биодеградации полициклических ароматических углеводородов в условиях загрязнения почв солями никеляПатент на изобретение №: 2396339 Автор: Анохина Татьяна Орестовна (RU), Сиунова Татьяна Вячеславовна (RU), Сизова Ольга Ивановна (RU), Кочетков Владимир Васильевич (RU), Боронин Александр Михайлович (RU) Патентообладатель: Учреждение Российской академии наук Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина Российской академии наук (RU) Дата публикации: 10 Января, 2010 Начало действия патента: 2 Июля, 2008 Адрес для переписки: 142290, Московская обл., г. Пущино, пр-кт Науки, 5, ИБФМ им Г.К. Скрябина РАН, патентно-лицензионная группа Изобретение относится к биотехнологии и микробиологической промышленности. Штамм бактерий Pseudomonas aureofaciens ВКМ В-2501 Д получен в результате трансформации плазмидой pBS501 штамма Pseudomonas aureofaciens BS1393(pBS216) и имеет лабораторный номер Pseudomonas aureofaciens BS1504. Изобретение позволяет осуществить быструю деградацию ПАУ в почвах при их загрязнении солями никеля, а также защиту растений от токсического воздействия ПАУ и улучшение их роста при культивировании вследствие уменьшения содержания ПАУ в этих почвах за счет биодеградации. 6 табл. Изобретение относится к биотехнологии и микробиологической промышленности и касается получения плазмидосодержащего штамма бактерий, используемого для очистки окружающей среды от полициклических ароматических углеводородов (ПАУ) в условиях загрязнения почв солями никеля. В настоящее время в России очень остро стоит проблема загрязнения почв особо устойчивыми к разложению токсичными соединениями техногенного происхождения. К загрязнителям этого класса относятся органические соединения (нефть, нефтепродукты, полициклические ароматические углеводороды, пестициды), тяжелые металлы и металлоиды (мышьяк). Полициклические ароматические углеводороды (ПАУ) являются приоритетными загрязнителями вследствие повсеместного распространения и отрицательного влияния на живые организмы. ПАУ входят в состав тяжелых фракций нефти (около 5-10%) и попадают в окружающую среду в результате аварийных разливов нефтепродуктов, транспортировки и при переработке нефти. Большое количество ПАУ образуется при неполном сгорании органических соединений и постоянно присутствует в выбросах ТЭЦ, коксо-, газо- и нефтехимических производств. В загрязненных почвах содержание индивидуальных ПАУ могут превышать ПДК в десятки, сотни и даже тысячи раз (Juhasz A.L. and R.Naidu. Bioremediation of high molecular weight polycyclic aromatic hydrocarbons: a review of the microbialdegradation of benzo[a]pyrene. International biodeterioration and biodegradation. 2000. 45: 57-88). Действие ПАУ на живые организмы связано с их токсичными, мутагенными и канцерогенными свойствами. Загрязнение почв тяжелыми металлами (в частности, кобальтом, никелем) представляет серьезную опасность, поскольку, накапливаясь в сельскохозяйственных растениях, данные соединения могут поступать в организм человека и вызывать ряд тяжелых заболеваний. Все чаще загрязнение окружающей среды носит комплексный характер, обусловленный как присутствием органических токсикантов, так и соединений тяжелых металлов. Наличие высоких концентраций тяжелых металлов в почвах значительно снижает скорость деградации органических загрязнителей (Sandrin T.R. and Maier M. Impact of metals on biodegradation of organic pollutants. Environmental Health Perspectives. 2003. V.111. Известен мультиплазмидный штамм Pseudomonas aeruginosa 123, несущий плазмиды ОСТ, САМ, NAH, способный утилизировать октан, камфару, нафталин и салицилат и используемый при биологической очистке воды от нефти и нефтепродуктов (авт. св. SU Однако отсутствуют сведения о способности этого штамма деградировать нефть и нефтепродукты в присутствии тяжелых металлов. Кроме того, Pseudomonas aeruginosa относится к микроорганизмам, являющимися патогенными для человека. Известен патент (патент США Однако в данном патенте отсутствуют какие-либо сведения об эффективности деградации углеводородов и уменьшении их концентрации в воде и почве. Наиболее близкими к предлагаемому изобретению являются штаммы бактерий Pseudomonas stutzeri MEV-S1 (патент RU 2228952, кл. C12N 1/20, 20.05.2004) и Pseudomonas alcaligenes MEV (патент RU 2228953, кл. C12N 1/20, 20.05.2004), используемые для очистки почв, грунтовых и поверхностных вод от нефти и продуктов ее переработки. Данные штаммы утилизируют нефть, мазут, дизельное топливо; полициклические ароматические углеводороды (ПАУ), содержащие от 2 до 4 бензольных колец: нафталин, фенантрен, пирен, флуорен; фенол. Они устойчивы к ионам тяжелых металлов: Pb, Zn, Mo, Fe, Cr. Штаммы продуцируют поверхностно-активные вещества (биосурфактанты). Авторами указанных патентов показано, что данные штаммы могут быть использованы для получения препарата для очистки почвы, грунтовых и поверхностных вод при попадании в окружающую среду нефти и продуктов ее переработки, а также при комбинированном загрязнении углеводородами нефти и металлами: Pb, Zn, Mo, Fe и Cr. Однако отсутствуют сведения о способности этих штаммов деградировать нефть, нефтепродукты и ПАУ в присутствии кобальта и никеля. Кроме того, во всех перечисленных аналогах нет сведений о влиянии штаммов на рост и развитие растений. Фитостимулирующие свойства штаммов являются очень важными при проведении фиторемедиационных технологий, основанных на использовании растений и ассоциированных с растением микроорганизмов для очистки окружающей среды (Назаров А.В., Иларионов С.А. Потенциал использования микробно-растительного взаимодействия для биоремедиации. Биотехнология. 2005. Задачей изобретения является конструирование плазмидосодержащего штамма бактерий для биодеградации (утилизации) ПАУ в условиях загрязнения почв солями никеля. Техническим эффектом, который может быть получен при использовании предлагаемого штамма, является быстрая деградация ПАУ в почвах при их загрязнении солями никеля, а также защита растений от токсичного воздействия ПАУ и улучшение их роста при культивировании вследствие уменьшения содержания ПАУ в этих почвах за счет биодеградации. Поставленная задача достигается конструированием штамма бактерий Pseudomonas aureofaciens BKM В-2501 Д для биодеградации (утилизации) ПАУ в условиях загрязнения почв солями никеля. Исходным бактериальным штаммом для получения предлагаемого плазмидосодержащего штамма является штамм бактерий Pseudomonas aureofaciens BS1393, подавляющий рост многих фитопатогенных грибов и бактерий за счет продуцирования антибиотически активных соединений и используемый для получения на его основе препарата для защиты растений (Воронин A.M., Кочетков В.В. Эффективный биофунгицид для защиты растений. Агро XXI. 2003. Штамм Pseudomonas aureofaciens BS1393 был депонирован во Всероссийской коллекции микроорганизмов под номером BKM B-2188 Д. Этот штамм использован в качестве реципиента для внесения в него плазмид биодеградации и устойчивости к тяжелым металлам по методикам, описанным ранее (Сиунова Т.В., Анохина Т.О., Машукова А.В., Кочетков В.В., Воронин A.M. Ризосферный штамм Pseudomonas chlororaphis, способный к деградации нафталина в присутствии кобальта/никеля. Микробиология. 2007. Т.76. Предлагаемый штамм бактерий Pseudomonas aureofaciens BS1393 (pBS216, pBS501) имеет лабораторный номер Pseudomonas aureofaciens BS1504 и депонирован во Всероссийской коллекции микроорганизмов (ИБФМ РАН) под номером Pseudomonas aureofaciens BKM В-2501 Д. Штамм Pseudomonas aureofaciens BKM B-2501 Д характеризуется следующими признаками. Среды культивирования. Штамм хорошо растет на следующих средах: мясо-пептонном агаре, LB (бакто-триптон - 10 г/л, дрожжевой экстракт - 5 г/л, хлористый натрий - 10 г/л, рН 7,2), Кинг Б (пептон - 20 г/л, K2HPO4 - 1,5 г/л, MgSO4×7Н2О - 1,5 г/л, глицерин - 10 мл/л,), триптозо-соевом агаре (триптозо-соевый экстракт -30 г/л), минеральной синтетической среде М9 (Na2HPO 4 - 6 г/л, KH2PO4 - 3 г/л, NH 4Cl - 1 г/л, NaCl - 0,5 г/л, 1М MgSO4 - 2 мл, 1М CaCl2 - 1 мл, глюкоза - 2 г/л), минеральной синтетической среде М9 с нафталином 1-2 г/л в качестве единственного источника углерода и энергии. Морфология колоний. Морфологию колоний на агаризованных питательных средах определяют после 4-5 суток роста при 28°С. На мясопептонном агаре колонии круглые, гладкие, выпуклые, блестящие, слизистые, желто-оранжевого цвета, однородной структуры. Пигмент зеленый флуоресцирующий, со временем переходящий в желто-оранжевый, диффундирующий в среду. На LB - круглые с ровными краями, гладкие, выпуклые, непрозрачные, желто-оранжевого цвета, диаметр 4-5 мм, пигмент желто-оранжевый, диффундирующий в среду. На триптозо-соевом агаре колонии крупнее, интенсивнее окрашены, более интенсивная диффузия пигмента в среду. На Кинг Б - колонии желто-зеленые, флюоресцирующие, пигмент интенсивный, зеленый, флюоресцирующий, со временем приобретает желто-оранжевую окраску. Со временем в среде образуются игольчатые, оранжевые кристаллы. В жидкой среде Кинг Б в течение суток образуется сильная муть, осадок, зеленый флуоресцирующий пигмент, переходящий на 4-е сутки в желто-оранжевый. На М9 с нафталином - колонии округлые, слабовыпуклые, непрозрачные, светло-коричневые. Культурально-морфологические признаки. Клетки палочковидные, размером (0,6-0,9)×(1,5-2,0) мкм, подвижные, с полярными жгутиками (лофотрих), грамотрицательные, спор не образуют. Очертания концов клеток закругленные. Размеры клеток даны для односуточной культуры, выращенной на мясопептонном агаре при 28°С. Физиолого-биохимические признаки. Прототроф. В факторах роста не нуждается. Не накапливает в клетках поли-бета-оксибутират. Образует феназиновые антибиотики, специфичные для вида Pseudomonas aureofaciens. Аргининдигидролаза имеется. Желатину разжижает, молоко пептонизирует, образуя зеленоватый пигмент. Молекулярный азот не фиксирует. Крахмал не гидролизует. Пектиназная активность отсутствует. Нитраты не редуцирует. Оптимальная температура роста 28-30°С. Не растет при 37°С. Значение рН среды: растет в пределах рН среды от 5,5 до 8,0. Оптимальное для роста значение рН 6,8-7,4. Источники углерода. Использует в качестве источника углерода глюкозу, фруктозу, трегалозу, маннит, глицерин. Не усваивает арабинозу, ксилозу, рамнозу, галактозу, сорбозу, мальтозу, лактозу, адонит, сорбит, дульцит, инулин. Из органических кислот усваивает уксусную, муравьиную, молочную, янтарную, фумаровую, пировиноградную, яблочную, бензойную, салициловую. Не усваивает винную, лимонную, щавелевую, глюконовую кислоты. Использует в качестве источника углерода нафталин, фенантрен. Энергетические субстраты. В качестве источников азота хорошо усваивает (NH4)2 SO4, NH4NO3, пептон, аланин, аргинин. Слабо усваивает KNO3, аспарагин, тирозин, мочевину. Отношение к кислороду. Облигатный аэроб. Нитраты не редуцирует. Устойчивость к антибиотикам. Штамм проявляет устойчивость к стрептомицину (100 мкг/мл), триметоприму (100 мкг/мл), хлорамфениколу (100 мкг/мл), карбеницилину (1000 мкг/мл). Чувствителен к канамицину (50 мкг/мл), гентамицину (20 мкг/мл), тетрациклину (20 мкг/мл). Хромосомная устойчивость к тяжелым металлам. Штамм обладает исходным уровнем хромосомной устойчивости к цинку, кадмию, хромату. Максимальная толерантная концентрация (МТК) цинка - 1,5 мМ, кадмия - 0,2 мМ, хромата - 0,2 мМ. Принципиальные физиологические свойства. Штамм обладает фунгицидными и бактерицидными свойствами. Антагонистическая активность предлагаемого штамма по отношению к фитопатогенным грибам и бактериям не отличается от активности исходного бесплазмидного штамма Pseudomonas aureofaciens BS1393. Принципиальные специфические продукты. Штамм синтезирует гетероциклические феназиновые антибиотики (феназин-1-карбоновую кислоту, 2-оксифеназин-1-карбоновую кислоту и 2-оксифеназин), сидерофоры, индолил-3-уксусную кислоту (ИУК). Устойчивость к тяжелым металлам (кобальту, никелю). Штамм бактерий Pseudomonas aureofaciens BKM В-2501 Д устойчив к катионам никеля и кобальта. Максимальная толерантная концентрация (МТК) хлорида никеля - 400 мкМ, хлорида кобальта - 200 мкМ. Генетические признаки. Штамм бактерий Pseudomonas aureofaciens BKM В-2501 Д содержит природную плазмиду биодеградации нафталина pBS216 (Кочетков В.В., Балакшина В.В., Мордухова Е.А., Боронин A.M. Плазмиды, кодирующие биодеградацию нафталина в ризосферных бактериях рода Pseudomonas. Микробиология. 1997. Т.66. Предлагаемый штамм бактерий Pseudomonas aureofaciens ВКМ В-2501 - Д, устойчивый к тяжелым металлам, был получен в результате трансформации плазмидой pBS501 штамма Pseudomonas aureofaciens BS1393(pBS216). Стабильность плазмид pBS216 и pBS501 (фенотип NAH+ Cor Nir) при культивировании штамма бактерий Pseudomonas aureofaciens ВКМ В-2501 Д в неселективных условиях после 7 пассажей составляет около 50%. Заранее нельзя было ожидать, что при получении предлагаемого бактериального штамма Pseudomonas aureofaciens ВКМ В-2501 Д обе плазмиды будут стабильно поддерживаться в клетке, поскольку стабильность поддержания плазмид и экспрессия плазмидных генов зависит от видовой принадлежности бактериального штамма-хозяина (Anokhina Т.О., Volkova O.V., Puntus I.F., Filonov A.E., Kochetkov V.V., Boronin A.M. Plant growth-promoting Pseudomonas bearing catabolic plasmids: naphthalene degradation and effect on plants. Process Biochemistry. 2006. V.41. P.2417-2423). Селективные условия выращивания. Штамм бактерий Pseudomonas aureofaciens ВКМ В-2501 Д в присутствии тяжелых металлов выращивают в синтетической трис-минеральной среде следующего состава, г/л: трис - 6,06, NaCl - 4,68, KCl - 1,49, NH4Cl - 1,07, Na2SO4 - 0,43, MgCl2×6H2O - 0,2, CaCl 2×2H2O - 0,03, Na2HPO4 ×12H2O - 0,23, FeNH4 цитрат - 5 мг/л, рН 7 (Mergeay M., Nies D., Schlegel H.G., Gerits J., Charles P., Van Gijsegem F. Alcaligenes eutrophus CH34 is a facultative chemolithotroph with plasmid-bound resistance to heavy metals. J. Bacteriol. 1985. V.162. P.328-334). В качестве источника углерода и энергии в среду добавляют глюкозу (2 г/л) или нафталин (1 г/л). Трис-минеральная среда, содержащая минимальное количество фосфат-анионов и трис, используется для предотвращения преципитации Со2+ и Ni2+ и поддержания рН среды, соответственно. Растворы металлов в виде хлорида кобальта (CoCl2×7Н2О) и хлорида никеля (NiCl 2×7H2O), и сульфата кобальта (CoSO 4×6H2O) и сульфата никеля (NiSO4 ) добавляют в среду в концентрации от 20 мкМ до 2 мМ. Условия хранения. Штамм бактерий Pseudomonas aureofaciens BKM В-2501 Д хранят на чашках с трис-минеральной средой с добавлением никеля (100 мкМ) и нафталина (пары). Пересевы на свежие среды - один раз в месяц. Указанный штамм может храниться не менее 1 года в 15% глицерине при -20°С, не более 5 лет под вазелиновым маслом в полужидкой среде следующего состава: питательный бульон (Difco, США) - 4 г/л, NaCl - 5 г/л, агар - 6 г/л, рН 6,8. Сведения по биологической безопасности. Штамм не патогенен для теплокровных животных и человека. Не обладает фитопатогенной активностью, о чем свидетельствует отсутствие мацерации на ломтиках картофеля при нанесении на них уколом живых клеток штамма. Поскольку большинство ПАУ плохо растворимы в воде, при изучении микробиологической деградации этих соединений в качестве модельного соединения часто используют нафталин как наиболее биодоступный (водорастворимый) представитель полиароматических углеводородов. Предлагаемый штамм бактерий Pseudomonas aureofaciens BKM В-2501 Д обладает более высокой жизнеспособностью, скоростью роста, удельной активностью ключевых ферментов биодеградации нафталина и эффективностью его деградации по сравнению с чувствительным вариантом Pseudomonas aureofaciens BS1393 (pB 8216) при выращивании на минеральной среде в присутствии 100 мкМ никеля. Уровень резистентности к никелю и кобальту у предлагаемого штамма Pseudomonas aureofaciens BKM В-2501 Д в 4 раза выше, чем у чувствительного варианта Pseudomonas aureofaciens BS1393(pBS216), независимо от источника углерода в среде выращивания (глюкоза или нафталин) (Таблица 1). Подсчет количества жизнеспособных клеток в культуральной среде показывает, что никель (100 мкМ) значительно ингибирует рост чувствительного штамма Pseudomonas aureofaciens BS1393(pBS216). Через 18 ч культивирования в присутствии никеля КОЕ уменьшается на порядок по сравнению с титром клеток при заражении и достигает около 8,2×106 КОЕ/мл (Таблица 2). Подсчет количества жизнеспособных клеток предлагаемого штамма Pseudomonas aureofaciens BKM В-2501 Д в культуральной среде показывает, что через 18 ч культивирования КОЕ возрастает на 2 порядка по сравнению с титром клеток при заражении независимо от условий культивирования (наличие или отсутствие металла в среде) и достигает около 1,0×10 9 КОЕ/мл. Сохранение активности ферментов биодеградации нафталина у предлагаемого штамма при различных условиях культивирования (наличие или отсутствие ионов никеля) свидетельствует о способности данного штамма эффективно деградировать ПАУ в присутствии хлорида никеля. Во время роста предлагаемого штамма Pseudomonas aureofaciens BKM В-2501 Д никель (100 мкМ) не оказывает ингибирующего влияния на активность ключевых ферментов биодеградации нафталина в отличие от чувствительного штамма Pseudomonas aureofaciens BS1393(pBS216) (Таблица 3). Полученные значения, представленные в Таблице 3, показывают, что в присутствии 100 мкМ хлорида никеля уровни активности нафталин диоксигеназы, салицилат гидроксилазы и катехол-1,2-диоксигеназы у предлагаемого штамма выше в 6, 9 и 8 раз соответственно, чем у чувствительного штамма. В предлагаемом штамме бактерий Pseudomonas aureofaciens ВКМ В-2501 Д низкая активность катехол-2,3-диоксигеназы компенсируется высокой активностью катехол-1,2-диоксигеназы, что обеспечивает полную деградацию нафталина. В присутствии 100 мкМ никеля чувствительный штамм бактерий Pseudomonas aureofaciens BS1393(pBS216) за 36 часов окисляет около 11% нафталина. В присутствии никеля предлагаемый штамм Pseudomonas aureofaciens ВКМ В-2501 Д за 21 час окисляет около 98% нафталина, столько же, сколько чувствительный штамм Pseudomonas aureofaciens BS1393(pBS216), выращенный без добавления металла (Таблица 4). Данные, представленные в Таблице 5, показывают, что инокуляция семян сорго предлагаемым штаммом Pseudomonas aureofaciens ВКМ В-2501 Д способствует повышению всхожести растений и увеличению их биомассы в условиях загрязнения почвы нафталином (1 г/кг) и никелем (400 мг/кг). В загрязненной почве сухой вес одного неинокулированного растения составляет в среднем 45 мг, а растения, обработанного устойчивым штаммом Pseudomonas aureofaciens ВКМ В-2501-Д, - 77,6 мг. Таким образом, биомасса увеличивается в 1,7 раз и становится сравнимой с контрольными растениями, выращенными на чистой почве (Таблица 5). Данные, представленные в Таблице 6, показывают, что инокуляция семян ячменя предлагаемым штаммом Pseudomonas aureofaciens ВКМ В-2501 Д способствует повышению всхожести растений и увеличению их биомассы в условиях загрязнения почвы нафталином (1 г/кг), фенантреном (0,2 г/кг) и никелем (400 мг/кг). В загрязненной почве сухой вес одного неинокулированного растения составляет в среднем 28 мг, а растения, обработанного предлагаемым штаммом Pseudomonas aureofaciens ВКМ В-2501 Д - 44 мг. Таким образом, биомасса увеличивается более чем в 1,5 раза и становится сравнимой с контрольными растениями, выращенными на чистой почве (Таблица 6). В результате инокуляции семян ячменя предлагаемым штаммом также улучшается всхожесть растений. Таким образом, показано, что наличие в среде культивирования солей никеля не препятствует способности предлагаемого штамма Pseudomonas aureofaciens ВКМ В-2501 Д деградировать нафталин (один из ПАУ) и положительно влиять на рост растений в почве, загрязненной нафталином, фенантреном и никелем. Ранее Ветровой с соавт.(Ветрова А.А., Нечаева И.А., Игнатова А.А., Пунтус И.О., Аринбасаров М.У., Филонов А.Е., Боронин A.M. Влияние катаболических плазмид на физиологические параметры бактерий рода Pseudomonas и эффективность биодеструкции нефти. Микробиология. 2007. Т.76. Поскольку плазмида устойчивости к кобальту и никелю pBS501 обеспечивает рост предлагаемого штамма Pseudomonas aureofaciens ВКМ В-2501 Д в присутствии указанных катионов на различных субстратах, мы предполагаем, что наличие в среде культивирования солей кобальта и никеля не будет препятствовать способности штамма Pseudomonas aureofaciens ВКМ В-2501 Д деградировать нефть. Возможность осуществления предлагаемых объектов изобретений подтверждается следующими примерами, но не ограничивается ими. Пример 1. Получение штамма бактерий Pseudomonas aureofaciens ВКМ В-2501-Д, устойчивого к тяжелым металлам. 1-й этап. Электротрансформация штамма бактерий Pseudomonas aureofaciens BS1393 плазмидной ДНК pBS216 (85 т.п.н.), придающей штамму Nah+ фенотип. Штамм бактерий Pseudomonas aureofaciens BS1393 выращивают в 10 мл жидкой среды LB в течение 14-16 ч при 30°С. Дальнейшие манипуляции проводят во льду. Биомассу собирают центрифугированием (5 тыс. об/мин, 2-4 мин) и ресуспендируют в охлажденной деионизованной воде. Отмывку повторяют 4 раза и доводят объем суспензии до 100-150 мкл. В кювету для электропорации ("BioRad") вносят 40 мкл клеточной суспензии и 1 мкл раствора ДНК плазмиды pBS216 (концентрация ДНК составляет 0,02-0,1 мкг/мкл). Условия электротрансформации: напряжение - 1,2 кВ, емкость - 25 пФ, при этом время импульса составляет 4,6-5,2 мсек. Трансформированные клетки подращивают 2 ч в жидкой среде LB при 30°С. Биомассу осаждают в режиме 5 тыс. об/мин, 2 мин, отмывают 1 раз 0,85% раствором NaCl и всю полученную суспензию клеток высевают на минеральную среду М9 с нафталином в качестве единственного источника углерода и энергии. Выросшие колонии расчищают на агаризованной минеральной среде М9 с нафталином до отдельных колоний, которые затем анализируют на наличие плазмидной ДНК общепринятыми электрофоретическими методами. 2-й этап. Электротрансформация штамма бактерий Pseudomonas aureofaciens BS1393(pBS216) плазмидной ДНК pBS501 (65 т.п.н.), придающей штамму Cor Nir фенотип. Подготовку клеток штамма бактерий Pseudomonas aureofaciens BS1393 (pBS216) для электротрансформации проводят, как описано выше для штамма бактерий Pseudomonas aureofaciens BS1393. Клетки штамма бактерий Pseudomonas aureofaciens BS1393 (pBS216) трансформируют плазмидой pBS501, как описано выше. После подращивания клетки высевают на селективную трис-минеральную среду с добавлением хлорида никеля (100 мкМ) и нафталина. Выросшие колонии анализируют на наличие плазмид pBS216 (85 т.п.н.) и pBS501 (размер 65 т.п.н.) общепринятыми электрофоретическими методами. Данные анализа подтверждают, что получен штамм бактерий Pseudomonas aureofaciens BKM В-2501-Д. Пример 2. Физиологические характеристики предлагаемого штамма бактерий Pseudomonas aureofaciens BKM В-2501-Д. Для определения устойчивости штаммов к кобальту и никелю бактерии выращивают в трис-минеральной среде при 24°С. В качестве единственного источника углерода используют глюкозу (2 г/л) или нафталин (1 г/л). Соли металлов CoCl 2×7H2O и NiCl2×6H2 O добавляют в концентрации от 20 мкМ до 2 мМ. Уровень устойчивости определяют согласно методу, описанному ранее (Подольская В.И., Грузина Т.Г., Ульберг З.Р., Сокловская А.С., Грищенко Н.И. Особенности влияния мышьяка на рост бактерий и АТФ-азную активность плазматических мембран. 2002. Прикладная биохимия и микробиология. Том 38. Кинетику роста в периодической культуре на нафталине (1 г/л) в присутствии никеля (100 мкМ) изучают при выращивании микроорганизмов в колбах с трис-минеральной средой (200 мл) согласно общепринятым методам (Перт С. Основы культивирования микроорганизмов и клеток. М.: Мир, 1978. 336 с.). Титр клеток (КОЕ/мл) определяют, высевая соответствующее разведение культуры на агаризованную среду LB. Данные представлены в Таблицах 1, 2. Полученные результаты (Таблица 1) показывают, что МТК никеля и кобальта для предлагаемого штамма Pseudomonas aureofaciens BKM B-2501 Д в 4 раза выше, чем для чувствительного варианта Pseudomonas aureofaciens BS1393(pBS216), независимо от субстрата в среде выращивания (глюкоза или нафталин). В присутствии 100 мкМ никеля в минеральной среде с нафталином наблюдается постепенное отмирание клеток чувствительного штамма Pseudomonas aureofaciens BS1393(pBS216) (Таблица 2). В этих же условиях предлагаемый штамм Pseudomonas aureofaciens BKM B-2501 Д сохраняет жизнеспособность, через 18 ч культивирования титр клеток удваивается по сравнению с начальной плотностью и достигает 1,0×109. Таким образом, наличие плазмиды pBS501, обеспечивающей устойчивость к кобальту и никелю, придает штамму Pseudomonas aureofaciens BKM В-2501 Д дополнительные преимущества при его культивировании в присутствии данных металлов. Пример 3. Удельная активность ключевых ферментов биодеградации нафталина у чувствительного штамма бактерий Pseudomonas aureofaciens BS1393(pBS216) и предлагаемого штамма бактерий Pseudomonas aureofaciens BKM В-2501 Д в присутствии хлорида никеля. Определение активностей ключевых ферментов биодеградации проводят в бесклеточных экстрактах. Для этого штаммы выращивают в трис-минеральной среде в присутствии хлорида никеля (100 мкМ) до оптической плотности 0,3, что соответствует экспоненциальной фазе роста клеток устойчивого штамма Pseudomonas aureofaciens BKM В-2501-Д. В качестве единственного источника углерода и энергии используют нафталин (2 г/л). Клетки осаждают центрифугированием (5000 g, 0°C, 10 мин), дважды отмывают 0,05 М калий-фосфатным буфером рН 7,0. Отмытые клетки ресуспендируют в 4 мл 0,05 М калий-фосфатного буфера рН 7,0, замораживают и разрушают на ИБФМ-прессе (Россия) (7 атм). После дезинтеграции клеточный дебрис и неразрушенные клетки удаляют центрифугированием (32000 g, 0°С, 60 мин). Супернатант немедленно используют в качестве клеточного экстракта для определения активностей ферментов. В реакционную смесь с конечным объемом 3 мл вносят 100-200 мкл экстракта. Определение активностей проводят при 30°С, начиная реакцию внесением клеточного экстракта, на UV-160A спектрофотометре (Shimadzu, Япония). Активность нафталин диоксигеназы определяют спектрофотометрически по уменьшению экстинкции NADH реакционной смеси, содержащей 100 мкМ NADH и 100 мкМ нафталина (спиртовой раствор), бесклеточный экстракт и 0,05 М фосфатный буфер рН 7,5, учитывая эндогенное потребление NADH бесклеточным экстрактом ( Активность салицилат гидроксилазы определяют спектрофотометрически по уменьшению экстинкции NADH реакционной смеси, содержащий 100 мкМ NADH и 100 мкМ салицилат, бесклеточный экстракт и 0,05 М фосфатный буфер рН 7,5, учитывая эндогенное потребление NADH бесклеточным экстрактом ( Активность катехол-2,3-оксигеназы определяют по скорости образования 2-гидроксимуконового полуальдегида в реакционной смеси, содержащей 0,5 мМ катехола, бесклеточный экстракт и 0,05 М Трис-HCl буфер рН 7,5 ( Активность катехол-1,2-оксигеназы определяют по скорости образования цис-цис-муконата в реакционной смеси, содержащей 5 мМ Na ЭДТА, 1 мМ катехола, бесклеточный экстракт, 0,05 М фосфатный буфер рН 7,0 ( Удельную активность ферментов выражают в микромолях потребленного кофактора или образующегося продукта в минуту на 1 мг общего бактериального белка. Определение концентрации белка проводят спектрофотометрически (Kalb V.F., Bernlohr R.W. 1977. A new spectrophotometric assay for protein in cell extract. Anal. Biochem. 82, 362). Результаты представлены в Таблице 3. Удельная активность ключевых ферментов биодеградации нафталина, а именно, нафталин диоксигеназы, салицилат гидроксилазы и катехол-1,2-диоксигеназы в присутствии хлорида никеля (100 мкМ) у предлагаемого штамма Pseudomonas aureofaciens BKM В-2501 Д в 6, 9 и 8 раз соответственно выше, чем у чувствительного Pseudomonas aureofaciens BS1393(pBS216). В предлагаемом штамме низкая активность катехол-2,3-диоксигеназы компенсируется высокой активностью катехол-1,2-диоксигеназы. Наличие ферментативной активности у предлагаемого штамма Pseudomonas aureofaciens BKM В-2501 Д в присутствии 100 мкМ хлорида никеля свидетельствует о его способности эффективно утилизировать нафталин и продукты его деградации. Пример 4. Биодеградация нафталина чувствительным штаммом бактерий Pseudomonas aureofaciens BS1393(pBS216) и предлагаемым штаммом бактерий Pseudomonas aureofaciens BKM В-2501 Д при периодическом культивировании в присутствии хлорида никеля. Штаммы бактерий выращивают в 5 мл трис-минеральной среды с нафталином (1 г/л) в присутствии хлорида никеля (100 мкМ) или без добавления металла. Экстракцию культуральной жидкости проводят равным объемом хлороформа. Хлороформенную фракцию выпаривают под вакуумом и растворяют в метаноле. Идентификацию нафталина и интермедиатов проводят с помощью ВЭЖХ. Условия разделения: колонка с обращенной фазой Spherisorb ODS-2 С 18, Supeico (США) в градиенте 1% уксусная кислота/0-100% метанол за 10 минут. Концентрацию нафталина рассчитывают, учитывая его естественное испарение в контроле без бактерий. В присутствии 100 мкМ никеля чувствительный штамм Pseudomonas aureofaciens BS1393(pBS216) за 36 часов окисляет около 11% нафталина. В присутствии никеля предлагаемый штамм Pseudomonas aureofaciens BKM B-2501 Д за 21 час окисляет около 98% нафталина, столько же, сколько чувствительный штамм Pseudomonas aureofaciens BS1393(pBS216), выращенный без добавления металла (Таблица 4). Пример 5. Демонстрация способности предлагаемого штамма бактерий Pseudomonas aureofaciens BKM В-2501 Д улучшать рост растений сорго при загрязнении почвы нафталином и никелем. Для изучения влияния бактеризации штаммом Pseudomonas aureofaciens BKM В-2501 Д на рост растений сорго в загрязненной почве используют серую лесную почву следующего состава: 91,00% зола, 2,89% С, 1,05% Н, 0,25% N, 0,06% Р, 0,48% Са, 0,14% Mg, 1,20% Fe, 2,47% K, 72,5% SiO2. pH водной вытяжки 7,05. Перед использованием воздушно-сухую почву просеивают через сито с диаметром отверстий 2,0 мм. Почву перемешивают с нафталином (1 г/кг), вносимым в виде пудры. Раскладывают по пластиковым горшкам по 400 г. Затем почву поливают водопроводной водой (200 мл) или раствором сульфата никеля (NiSO4) до конечной концентрации 400 мг/кг почвы. В каждый горшок сажают по 6 проклюнувшихся семян сорго сорта «Пищевое». В вариантах с использованием бактерий семена предварительно инокулируют, выдерживая их в суспензии штаммов плотностью 108 КОЕ/мл в течение 1 ч. Для каждого варианта обработки используют 3 горшка. Растения поливают через 2 суток 100 мл водопроводной воды. Растения выращивают при 12-часовом световом/ темновом периоде при температуре 20°С. Через 7 суток выращивания оценивают всхожесть семян. Через 30 суток растения извлекают из почвы и измеряют общий сухой вес и вес одного растения. Данные, представленные в Таблице 5, показывают, что инокуляция семян сорго предлагаемым штаммом Pseudomonas aureofaciens BKM В-2501 Д способствует повышению всхожести растений и увеличению их биомассы в условиях загрязнения почвы нафталином (1 г/кг) и никелем (400 мг/кг). В загрязненной почве сухой вес одного неинокулированного растения составляет в среднем 45 мг, а растения, обработанного предлагаемым штаммом Pseudomonas aureofaciens ВКМ В-2501 Д - 77,6 мг. Таким образом, биомасса увеличивается в 1,7 раз и становится сравнимой с контрольными растениями, выращенными на чистой почве (Таблица 5). Пример 6. Демонстрация способности предлагаемого штамма бактерий Pseudomonas aureofaciens ВКМ В-2501 Д улучшать рост растений ячменя ярового при загрязнении почвы нафталином, фенантреном и никелем. Для изучения влияния бактеризации штаммом Pseudomonas aureofaciens ВКМ В-2501 Д на рост растений ячменя ярового в загрязненной почве используют серую лесную почву следующего состава: 91,00% зола, 2,89% С, 1,05% Н, 0,25% N, 0,06% Р, 0,48% Са, 0,14% Mg, 1,20% Fe, 2,47% K, 72,5% SiO2; pH водной вытяжки 7,05. Перед использованием воздушно-сухую почву просеивают через сито с диаметром отверстий 2,0 мм. Почву перемешивают с нафталином (1 г/кг) и фенантреном (0,2 г/кг), вносимыми в виде пудры. Раскладывают по пластиковым горшкам по 400 г. Затем почву поливают водопроводной водой (200 мл) или раствором сульфата никеля (NiSO4 ) до конечной концентрации 400 мг/кг почвы. В каждый горшок сажают по 6 проклюнувшихся семян ячменя ярового сорта «Зазерский 85». В вариантах с использованием бактерий семена предварительно инокулируют, выдерживая их в суспензии штаммов плотностью 108 КОЕ/мл в течение 1 ч. Для каждого варианта обработки используют 3 горшка. Растения поливают через 2 суток 100 мл водопроводной воды. Растения выращивают при 12-часовом световом/ темновом периоде при температуре 20°С. Через 7 суток выращивания оценивают всхожесть семян. Через 30 суток растения извлекают из почвы и измеряют общий сухой вес и средний вес одного растения. Данные, представленные в Таблице 6, показывают, что инокуляция семян ячменя предлагаемым штаммом Pseudomonas aureofaciens ВКМ В-2501 Д способствует повышению всхожести растений и увеличению их биомассы в условиях загрязнения почвы нафталином (1 г/кг), фенантреном (0,2 г/кг) и никелем (400 мг/кг). В загрязненной почве сухой вес одного неинокулированного растения составляет в среднем 28 мг, а растения, обработанного предлагаемым штаммом Pseudomonas aureofaciens ВКМ В-2501 Д - 44 мг. Таким образом, биомасса увеличивается более чем в 1,5 раза и становится сравнимой с контрольными растениями, выращенными на чистой почве (Таблица 6). В результате инокуляции семян ячменя предлагаемым штаммом также улучшается всхожесть растений. Таким образом, показано, что предлагаемый штамм бактерий Pseudomonas aureofaciens ВКМ В-2501 Д способен деградировать ПАУ (нафталин) в присутствии никеля. Он также защищает растения от токсичного воздействия ПАУ (нафталин, фенантрен) и улучшает их рост при культивировании на загрязненных почвах. Штамм не токсичен для растений и может быть использован для создания на его основе специального биопрепарата, предназначенного для защиты и улучшения роста растений, растущих на загрязненных почвах. Таблица 1 Максимальная толерантная концентрация кобальта и никеля для чувствительного штамма бактерий Pseudomonas aureofaciens BS1393(pBS216) и предлагаемого штамма бактерий Pseudomonas aureofaciens ВКМ В-2501 Д Штамм Кобальт, мкМ Никель, мкМ глюкозанафталин глюкоза нафталин Pseudomonas aureofaciens BS1393(pBS216) 5050 100100 Pseudomonas aureofaciens ВКМВ-2501Д200 200 400400 Формула изобретенияШтамм бактерий Pseudomonas aureofaciens BKM В-2501 Д для биодеградации полициклических ароматических углеводородов в условиях загрязнения почв солями никеля. Популярные патенты: 2028749 Капустоуборочная машина ... и может быть использовано на полях сельскохозяйственных предприятий, фермерских и кооперативных сельских хозяйств. Известны капустоуборочные машины разных типов, у которых рабочий орган содержит установленный на раме вращающийся барабан с осью, по образующим которого расположены захватывающие элементы, отрезающие устройство и приемный транспортер или же правый и левый шнеки, прижимной транспортер и режущий аппарат, а между шнеками - два дополнительных ножа и другие типы машин. Недостатком известных типов капустоуборочных машин является то, что рабочий орган не обеспечивает надежного захвата качанов капусты, дает большой процент повреждения качанов при уборке и транспортировке по ... 2076583 Способ выращивания растений в теплице и устройство для его осуществления ... оптического излучения 5. Способ выращивания растений в теплице 1 включает посев семян и культивацию рассады в лотки 2 или другие растильни на грунтовом или другом основании с растениями 3. Растения 3 в лотках 2 облучают источниками оптического излучения 5, подвешенными над лотками 2. Для повышения интенсивности облучения растений на участках лотков 2, удаленных от вертикальной оси излучателя 5, по показаниям датчиков 16 плотности облучения коллекторы 14,15 через блок управления 4 подают сигналы на электроприводы 12,17 и 18, служащие для подтяжки ламп 5 в продольном и поперечном направлении с целью изменения частоты и амплитуды колебаний ламп 5 посредством механизмов 7,8 их ... 2471341 Стойло, устройство в стойле и способ монтажа указанного устройства ... этого, состоит в том, чтобы получить устройство, которое является значительно более легким для установки. Сущность изобретенияПроблема, раскрытая выше, решается посредством настоящего стойла и устройства, определенных в независимых пунктах 1 и 9 формулы изобретения. Кроме того, в независимом пункте 15 формулы изобретения определяется способ монтажа заявленного устройства.Заявленное стойло имеет открытую сторону, через которую животное входит в стойло, и противоположный конец для головы животного. Стойло содержит подгрудную доску для позиционирования животного продольно внутри стойла и мат, размещенный на полу стойла. Один передний конец мата и один продольный край подгрудной ... 2189718 Пневматический высевающий аппарат ... присасывающими отверстиями 16 второй накладки 15 за счет разрежения в вакуумной камере 8 и переносятся в зону высева, где отрываются от присасывающего отверстия в результате прекращения подачи вакуума. (Различные известные конструкции сбрасывателей лишних семян нами здесь не приводятся). Мелкие семена 7 из камеры 2 захватываются ячеями первой накладки 13 и транспортируются в зону высева, где отрываются и выпадают из ячей в результате прекращения подачи вакуума. Конфигурация вакуумной камеры неизменна, отсечка вакуума в данном высевающем аппарате в просасывающих отверстиях основания и накладки, в щели и в просасывающем отверстии второй накладки происходит одновременно при ... 2160533 Способ профилактики и коррекции транспортного стресса у крупного рогатого скота ... качестве добавки с концентрированными кормами в количестве от 2 до 3,5 г/кг живой массы в сутки в течение 5-10 суток до транспортировки убойного молодняка на мясокомбинат. В целях отработки оптимальной дозировки и экспозиции были проведены 6 опытов. Для каждого из опытов по принципу аналогов были подобраны 5 групп молодняка по 15 голов в каждой, из которых одна группа контрольных животных (интактные - не получавшие корень солодки) и четыре опытных. В каждом из опытов первая опытная группа до транспортировки получала корень солодки в количестве 2,0 г/кг живой массы в сутки, вторая - 2,5 г/кг; третья - 3,0 г/кг и четвертая - 3,5 г/кг. Различие в опытах заключалось в экспозиции ... |
Еще из этого раздела: 2415552 Питатель молотилки зерноуборочного комбайна 2444885 Посевной агрегат 2391812 Способ выращивания растений в условиях защищенного грунта, устройство для выращивания растений в условиях защищенного грунта и сборно-разборный многоярусный стеллаж для выращивания растений в условиях защищенного грунта 2236787 Способ испытаний опрыскивателей и устройство для его осуществления 2295848 Способ дезинсекции и дезинфекции материалов зернового происхождения и устройство для его осуществления 2406295 Способ экологического мониторинга лесов 2092004 Композиционный состав для обработки растений и их органов 2414114 Зерноуборочный комбайн 2423033 Способ укрепления склонов посевом семян древесных растений 2090040 Машина для возделывания корнеклубневых культур |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
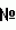 8. P.1093-1101).
8. P.1093-1101).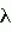 =340 нм,
=340 нм, 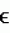 =6,220 мМ-1 см-1) (Dua D. and Meera S. 1981. Purification and characterization of naphthalene oxygenase from Corynebacterium renale. Eur. J. Biochem. 120 (3), 461-465).
=6,220 мМ-1 см-1) (Dua D. and Meera S. 1981. Purification and characterization of naphthalene oxygenase from Corynebacterium renale. Eur. J. Biochem. 120 (3), 461-465).