Способ продуцирования гамет у птицПатент на изобретение №: 2294099 Автор: ПАРДЮ Самюэль Л. (US), ПЕТИТТ Джеймс Н. (US), Д КОСТА Сюзн (US) Патентообладатель: НОРТ КАРОЛИНА СТЕЙТ ЮНИВЕРСИТИ (US) Дата публикации: 10 Марта, 2004 Начало действия патента: 23 Марта, 2001 Адрес для переписки: 129010, Москва, ул. Б.Спасская, 25, стр.3, ООО "Юридическая фирма Городисский и Партнеры", пат.пов. Е.Е.Назиной, рег. № 517 Изобретение относится к области биотехнологии. Предложен способ производства и сбора гамет птиц. Способ предусматривает получение эмбриональных стволовых клеток от птиц видов-доноров и их введение виду-реципиенту птицы in ovo. При этом. вид-реципиент птиц отличается от вида-донора. Далее инкубируют вид-реципиент до вылупления, выращивают до половой зрелости и проводят сбор гамет вида-донора у вида-реципиента. Способ позволяет ускорить получение сперматозоидов у медленно взрослеющих птиц и уменьшить затраты на поддержание стад производителей. Изобретение может быть использовано в птицеводстве. 10 з.п. ф-лы, 1 табл. Область изобретения Настоящее изобретение касается способов переноса эмбриональных стволовых клеток птицам для продуцирования у них гамет. Подобные способы применимы для охраны вымирающих видов птиц, для сокращения времени, необходимого для получения сперматозоидов от медленно взрослеющих птиц, таких, как индейки, уменьшения затрат на поддержание стад производителей и изменения соотношения полов в стадах потомков (т.е. увеличения эффективности производства). Предпосылки данного изобретения Возможность более легкого получения гамет определенных видов птиц была бы исключительно полезна для ветеринарии птиц и в птицеводческих хозяйствах. Для вымирающих видов, таких, как американский журавль, будет крайне полезно иметь готовый запас мужских сперматозоидов. Для коммерческой птицы, такой, как индейка, было бы желательно более быстрое и экономичное получение мужских сперматозоидов. Для производства мяса желательно иметь способы изменения соотношения полов птиц в стаде. Таким образом, есть необходимость в новых способах получения сперматозоидов птиц. Химерами называют организмы, состоящие из клеток, полученных более из чем одной зиготы. Экспериментальные химеры были использованы для изучения взаимодействия между клетками и анализа потомков клеток в процессе развития (А.McLaren, Mammalian Chimeras. Cambridge University Press, Cambridge (1976)). Когда химеры получают, используя материал, полученный от очень ранних эмбрионов, развиваются организмы, содержащие полную смесь соматических тканей. Если начальный материал включает клетки раннего зародыша или их предшественники, полученные в результате этого особи будут производить гаметы с генотипами как донора, так и реципиента. К тому же химеры могут быть внутривидовыми, т.е. между зиготами того же вида, или межвидовыми, т.е. между двумя разными видами. Эмбриональные стволовые клетки (ЭСК) птиц, как и клетки зародыша других позвоночных, являются внегонадными по происхождению и должны претерпеть сложное путешествие для того, чтобы достичь гонады. Перенос бластодермальных клеток и эмбриональных стволовых клеток образовывал зародышевые химеры птиц. Reynaud (J. Embryol. Exp. Morphol. 21:485-507 (1969)), пионер в получении зародышевых химер птиц, сообщал о получении зародышевых химер индейка-курица посредством внутрисосудистого переноса разделенных клеток серповидного тела зародыша в предварительно стерилизованный эмбрион цыпленка (выполнено посредством воздействия на серповидное тело реципиента ультрафиолетом). ЭСК, полученные механическим разъединением эндодермы серповидного тела зародыша (стадия 5), были инъекцированы в кровеносные сосуды эмбриона цыпленка (3-5 дней инкубации). Перед инъекцией эмбрионы реципиента были стерилизованы на стадии 8-10 (Н&Н) ультрафиолетовым излучением; однако стерилизация не была завершена. ЭСК индейки в эмбрионе цыпленка определяли исключительно на основе соотношения их нуклеоплазмы. Такой способ идентификации был сложным и тонким и не мог быть использован для активно делящихся ЭСК индейки, так как делящиеся эмбриональные клетки давали аберрантное нуклеоплазматическое соотношение. В последующих исследованиях перенесенным ЭСК позволяли созревать в гонадах хозяина, и очевидно, они могли дать начало гаметам, но они были неприменимы для оплодотворения (Wilhelm Roux Arch. Dev. Bio. 179:85-110(1976)). Эти сперматозоиды были неспособны оплодотворять индюшачьи яйца. Они оплодотворяли куриные яйца, но нормального развития не происходило. Куриные сперматозоиды были способны активировать яйца, полученные от самок межвидовых химер, но они не вызывали развитие эмбриона. Когда яйца оплодотворяли сперматозоидами индюка, они развивались в ненормальные эмбрионы, которые не жили дольше стадии 38 (Н&Н). Reynaud использовал морфологию как единственную отличительную характеристику в попытке различить зародышевые клетки индюка от эмбриональных клеток цыпленка. Одна только морфология недостаточна для определения химер и должна быть дополнена другими маркерами. Кроме этого, согласно Aig-Gill и Simkiss (Brit. Poul. Sci. 32:427-438 (1991)), присутствие гамет индюка не было показано в пробных спариваниях. Таким образом, осталась потребность в новых способах получения и переноса гамет птиц. Сущность изобретения Способ производства и сбора спермы птиц включает стадии: получения эмбриональных стволовых клеток от птиц вида-донора; введения эмбриональных стволовых клеток птицам вида-реципиента in ovo; инкубирования птицы вида-реципиента до вылупления; и затем сбора спермы вида донора от вида реципиента. Например, видом-донором может быть американский журавль, а реципиентом может быть канадский журавль. В другом примере видом донором может быть индюк, а видом-реципиентом может быть курица. У птиц, в отличии от млекопитающих, самец является гомогаметным полом (ZZ) а самка является гетерогаметным полом (Zw). Поэтому у птиц самка определяет пол потомства, поскольку она продуцирует яйца, несущие Z или w хромосомы. Таким образом, как показано ниже, при переносе эмбриональных стволовых клеток самца эмбриону-хозяину самки, процент продуцируемых этим хозяином яиц, несущих Z-хромосому, увеличивается, как увеличивается и процент потомков-самцов. Увеличение процента потомков мужского пола в стадах бройлеров является экономически желательным благодаря соответствующему увеличению соотношения конверсии пищи и большей эффективности продукции мяса, достигаемой таким образом. Таким образом, вторым аспектом настоящего изобретения является способ увеличения числа птиц-самцов, выведенных из массы яиц, включающий стадии: введения самке птицы in ovo эмбриональных стволовых клеток самца (ZZ); инкубирования самки-птицы до вылупления; выращивание самки-птицы до половой зрелости; и затем размножение для получения массы фертильных птичьих яиц (с соотношением самцы/самки в яйцах, полученных от этой птицы, большим, чем в случае, когда эмбриональные стволовые клетки самца не вводили самке птицы in ovo). В типичном случае далее этот способ включает стадию инкубирования массы птичьих яиц до вылупления (с соотношением самцы/самки, полученных во всей массе яиц, большим, чем в случае, когда эмбриональные стволовые клетки самца не вводили самке птицы in ovo). Самка птицы может быть любого подходящего вида, такого, как курица или индейка, и вводимые эмбриональные стволовые клетки предпочтительно от того же вида, что и самка, которой их вводят. Вышеупомянутые и другие объекты и аспекты настоящего изобретения детально объясняются в описании, приведенном ниже. Подробное описание предпочтительных вариантов осуществления данного изобретения Термины "птица" или "вид птиц" использованы здесь в отношении к любому виду птиц, включая курицу, индейку, утку, гусей, перепела, фазана, страуса, но не ограничиваются ими. Любой из многочисленных других видов птиц может быть использован для осуществления настоящего изобретения, в частности, когда оно используется для охраны вымирающих видов, таких, как американский журавль (где видом-реципиентом был бы канадский журавль). Термин "яйцо" используется по отношению к птичьим яйцам, содержащим живые эмбрионы птиц. Термин "эмбриональные стволовые клетки" или "ЭСК", используется по отношению к наиболее дифференцированной диплоидной линии клеток эмбриона, которые, в конечном итоге, разовьются в гаплоидные гаметы (как сперму, так и яйцеклетки). Термин "антитело SSEA-1" относится к антителу, предпочтительно моноклональному антителу, которое специфически связано со стадиоспецифическим эмбриональным антигеном-1 (SSEA-1; (M.Buehr Exp. Cell. Res. 232:194-207 (1997)). SSEA-1 является углеводным эпитопом, детерминированным связью галактоза Эмбриональные стволовые клетки можно получать и рецептуировать для проведения настоящего изобретения по любой подходящей способике, сохранять, замораживать, культурировать и тому подобное перед использованием, если необходимо. Например, эмбриональные стволовые клетки можно отбирать у эмбринонов-доноров на соответствующей эмбриональной стадии (см., например (V.Hamburger and H.L.Hamilton, A series of Normal Stages in. the Development of the Chick, Journal of Morphology, 68, 49-42 (1951) (Эти стадии относятся к Н&Н стадиям в нем) стадии 4 или эмбриональной стадии серповидного тела, до стадии 30, с клетками отобранными из крови или гонад на более поздних стадиях). Эмбриональные стволовые клетки, в большинстве случаев, по размеру вдвое больше соматических клеток и их легко отличить и отделить на основе размера. Мужские (или гомогаметные) эмбриональные стволовые клетки (ZZ) можно отличить от гетерогаметных эмбриональных стволовых клеток (Zw) любым подходящим способом, таким, как сбор эмбриональных клеток от конкретного донора и типизация других клеток от этого донора, собранных клеток того же хромосомного типа, как типизированных клеток. Клетки могут быть приготовлены для введения животным посредством разделения клеток (т.е. механического разделения) и тонкого примешивания клеток к фармацевтически приемлемому носителю (например, фосфатный буфер, солевой раствор). Эмбриональные стволовые клетки -преимущественно эмбриональные стволовые клетки гонад или эмбриональные стволовые клетки крови ("гонад" или "крови" по отношению к их ткани или происхождению в исходном эмбриональном доноре), наиболее предпочтительно эмбриональные стволовые клетки гонад. Вводимые эмбриональные стволовые клетки могут быть гетерогаметными (Zw) или гомогаметными (ZZ) в зависимости от конкретного объекта введения. ЭСК предпочтительно вводить в физиологически приемлемом носителе, предпочтительно при рН от примерно от 6 до 8 или 8,5; в подходящем количестве для достижения желаемого эффекта (например от 100 до 1000 ЭСК на эмбрион). ЭСК можно вводить без других ингредиентов или клеток, или другие клетки или ингредиенты могут вводиться вместе с ЭСК. Введение эмбриональных стволовых клеток животному-реципиенту in ovo может проводиться в любое подходящее время, когда ЭСК все еще могут мигрировать в развивающиеся гонады. В целом предпочтительно, чтобы введение осуществлялось со стадии 13 или 14 до стадии 18 (Н&Н) развития эмбриона, и наиболее предпочтительно на стадии 15. Для цыпленка, таким образом, временем введения являются дни 1, 2, 3 или 4 эмбрионального развития, наиболее предпочтительно дни от 2 до 2,5. Обычно введение осуществляют посредством инъекции в какую-либо целевую область, такую, как область, определенную амнионом (включая эмбрион), желточный мешок и т.п. Инъекция непосредственно в эмбрион (включая стенку тела эмбриона) предпочтительна, внутрисосудистая или внутрицеломическая инъекция в эмбрион особенно предпочтительна. Способы настоящего изобретения могут быть осуществлены с или без предварительной стерилизации птицы-реципиента in ovo. ("стерилизация" значит приведение к состоянию, при котором продукция гамет практически невозможна). При предпочтительном варианте осуществления данного изобретения эмбриональные стволовые клетки вводят реципиенту in ovo, без предварительной стерилизации. Когда гаметы донора собирают от такого реципиента, их можно собирать в смеси с гаметами донора и использовать в виде подобной смеси или смеси, обработанной для увеличения в ней доли гамет донора. Введение ЭСК можно производить посредством введения ЭСК как таковых или посредством введения клеток-предшественниц, которые развиваются в ЭСК уже в субъекте (в особенности, когда изобретение применяется для того, чтобы изменить соотношение полов в потомстве). Например, введение может производиться посредством инъекции птице бластодермальных клеток, когда бластодермальные клетки дифференцируются в эмбриональные стволовые клетки в птице in vivo. Когда эмбриональные стволовые клетки используют для получения и сбора гамет птиц (сперму, яйцеклетки), эмбриональные стволовые клетки вводят in ovo виду-реципиенту, отличному от вида-донора, от которого были получены ЭСК. Реципиента затем инкубируют до вылупления и выращивают до половой зрелости, и собирают сперматозоиды или яйцеклетки вида донора, все в соответствии со стандартными способиками. Например, в случае вымирающих видов, видом-донором может быть американский журавль, а видом-реципиентом может быть канадский журавль. В другом примере, касающемся коммерческого производства птицы, видом-донором может быть индейка, а видом реципиентом может быть курица. При использовании для увеличения числа или соотношения птиц-самцов, выводящихся из группы яиц, данное изобретение включает введение самке птицы in ovo эмбриональных стволовых клеток самца. Пол птицы in ovo может быть определен предварительно или определен после вылупления. Птицу затем инкубируют до вылупления, при необходимости определяют пол птицы, выращивают до половой зрелости и размножают, скрещивая с подходящим самцом-производителем в соответствии с известными способиками. Всю массу фертильных яиц, отложенных этой птицей, затем собирают и обычным способом инкубируют до вылупления, и получившихся птиц выращивают в течение, как минимум, двух или трех недель. Соотношение самцов к самкам у яиц (или птиц) произведенных данной самки больше, чем полученное в отсутствии введения эмбриональных стволовых клеток самца этой самке in ovo. Подобные способы обычно используют для видов птиц, которые выращивают для производства мяса, таких, как куры, индейки, утки и т.п. Введение эмбриональных стволовых клеток in ovo может осуществляться по любой подходящей методике как вручную, так и автоматическим способом. Предпочтительна инъекция. Механизм введения in ovo не является критичным, но предпочтительно, чтобы способ не повреждал чрезмерно ткани и органы эмбриона или экстраэмбриональные оболочки, окружающие его, так, чтобы данная обработка не уменьшала чрезмерно количество вылупившихся птенцов. Шприц для подкожных инъекций, подходящий для игл примерно от номера 18 до номера 26 удобен для этой цели. В зависимости от точной стадии развития и положения эмбриона, игла длинной в один дюйм может достать как жидкость над птенцом, так и самого птенца. Предварительное отверстие может быть пробито или просверлено в скорлупе до введения иглы, чтобы предотвратить повреждение или затупление иглы. Если нужно, яйцо можно запечатать материалом, в значительной степени непроницаемым для бактерий, таким, как воск или подобным, чтобы предотвратить последующее проникновение нежелательных бактерий. Представляется, что высокоскоростная инъекционная система для эмбрионов птиц будет особенно удобна для применения настоящего изобретения. Многочисленные устройства подобного рода доступны, образцом может служить система EMBREX INVOJECT Настоящее изобретение описано более подробно в последующих не исчерпывающих Примерах. Примеры 1-8 Материал и способы. ПРИМЕР 1 Выделение и верификация плазмиды. Трансформированные DH5 альфа-клетки, полученные др. М.Мацке, были нанесены на лабораторные чашки, содержащие антибиотики ампициллин (20 мкг/л) + метициллин (80 мкг/л) и оставлены расти на ночь при 37°С. Шесть индивидуальных колоний были отобраны и выращивались в течение ночи в 10 мл лабораторных чашках, содержащих вышеуказанные антибиотики. Плазмидную ДНК изолировали из 6 разных колоний, используя подготовительный мини-протокол Qiagen. Для того чтобы проверить идентичность этой плазмиды, нерасщепленные плазмиды, линеаризованная плазмида (EcoR 1) и результат двойного расщепления (EcoR I + Hind III), были отделены на 2% агарозном геле. Две из шести колоний, содержащие вставку, были впоследствии использованы для крупномасштабной изоляции плазмиды (Qiagen). Непереваренная родительская плазмида (рuс18), нерасщепленные рекомбинантные плазмиды, линеаризованная плаэмида (EcoR I/ Hind III/ BamH I) и дважды переваренная плазмида (EcoR I + Hind III и EcoR I + BamH I) были отделены на 2% геле для подтверждения идентичности изолированных плазмид. ПРИМЕР 2. Мечение образца ТМ1 с помощью ПЦР. Была синтезирована пара праймеров на основе их способности амплифицировать вставку в мультиклонируюцийся сайт родительской плазмиды рис 18. Они представляли собой М13 puc - обратный = 5' ААЦ АГЦ ТАТ ГАЦ UAT и М13 puc - прямой - 5' ГТА ААА ЦГА ЦГГ ЦЦА ГТ. Оптимизированная ПЦР смесь состояла из 3 мМ MgCl2 в Taq буфере (Idaho Tech); 0,5 мкМ каждого праймера, 50 нг ДНК (ТМ1) кольцевой денатурированной плазмиды, 5 единиц Taq полимеразы (Promega), 10 мкл ПЦР метящей (dig-labeling) смеси (Boehringer, Mannheim). Объем реакционной смеси доводится до 100 мкл стерильной водой, подготовка ПЦР состоит из начальной денатурации при 96°С в течение 5 минут, с последующими 30 циклами, состоящими из денатурации (94°С) в течение 45 секунд, восстановления (50°С) в течение 55 секунд, и последующего удлинения при 72°С в течение 60 секунд. ПЦР проводили в "Mini Cycler", модель РТС 150 (MJ Research Inc., Massachusetts). После амплификации весь образец был подвергнут электрофорезу в 2% геле. Меченую вставку элюировали из геля, используя Qia набор быстрей экстракции геля (Qiagen) в соответствии с рекомендациями производителя. Образец сохраняли при -20°С и использовали для in situ дот-блот гибридизации. Перед хранением оценивали количество полученной DIG-меченной ДНК в соответствии с системным руководством Genius для гибридизации на фильтре (Boehringer, Mannheim). ПРИМЕР 3 Дот-блот гибридизация Для проверки точности, чувствительности и специфичности-вставки ТМ1 серийное разведение ДНК самца и самки индейки (0-50 нг), ДНК самца и самки курицы (0-2 мкг) и родительской плазмиды, содержащей вставку ТМ1 (10 нг - 1 пг) денатурировали и наносили на нитроцеллюлозную бумагу. Пятно нагревали при 80°С в течение часа и затем использовали для гибридизации. Предварительную гибридизацию и гибридизацию проводили с использованием процедуры Энглера-Блюма [Anal Biochem. 210:235-244 (1993)). Гибридизацию проводили в течение ночи при 68°С; использовали пробу с концентрацией 2,2 нг цДНК в пробе на мл. После гибридизации и тщательной отмывки пятно помещали в промывочный буфер (0,1 М малеиновой кислоты; 0,15 М NaCl pH 7,5). Мембрану инкубировали в блокирующем растворе (промывочный буфер + 3% Tween 20) в течение 30 минут и затем помещали в блокирующий раствор, содержащий коньюгат антидигоксигенин алкалинфосфатазы на полчаса. Мембрану затем дважды промывали в промывочном буфере и затем инкубировали в индикаторном растворе (0,1 М Tris HCl; 0,1 М NaCl; 50 мМ MgCl 2; pH 9,5). В финале гибриды регистрировали, используя хемолюминесцентный субстрат COP-STAR ПРИМЕР 4 Получение межвидовых индейка-курица эмбриональных зародышевых химер. Оплодотворенные яйца индейки инкубировали при 38,5°С в течение 8-8,5 дней (стадия 27-28 Н&Н). Эмбрионы препарировали для получения гонад. Гонады собирали в DMEM и 10% FBS и диспергировали, пропуская их через иглу №30. Клетки культурировали в DMEM 10% FBS до соединения (3-5 [d] дней?). Стромальные клетки диспергировались и образовывали слитный слой, в то время как эмбриональные клетки свободно прикреплялись к стромальным клеткам. Эмбриональные клетки осторожно собирали пипеткой и подсчитывали. Приблизительно 150-300 клеток в 2-5 мкл среды вводили в синус терминалис 60 или 72-часовых эмбрионов курицы. Затем эмбрионы инкубировали в 100 мм чашках Петри или в их собственной скорлупе при 38,5°С в течение 2-5 дней. После инкубации ДНК выделяли из эмбриона (n=18) и использовали для дот-блот анализа с dig-меченным образцом ТМ1. Пример 5 Гибридизация in situ. Гибридизацию in situ проводкой на парафиновых срезах и криосрезах. Эта процедура основана на протоколе Ролигхеда и Линдберга (см. J. Rolighead, Direction of HPV II DNA in paraffin embedded laryngeal tissue with DIG-labeled DNA probe. Ir. Non-radioactive In Situ Hybridization Application Manual Boenringer Mannheim Second Edition, pp 122-125 (1996)) с некоторыми модификациями. Изготовление парафиновых срезов: Гонады извлекают из эмбрионов индейки (9-й день) и эмбрионов курицы на соответствующих стадиях, фиксируют в течение ночи в 4% формальдегиде при 4°C. Гонады промывают в PBS три раза, всего 90 минут. Затем их обезвоживают, заливают в парафин и делают срезы (10 мкм). Срезы размещают на стеклах Probe-On Plus tm (Fisher Scientific). Срезы нагревают при 60°С в течение 30 минут, удаляют парафин в ксилоле и регидратируют в градиенте этанола 99% - вода. Срезы обрабатывают протеиназой К (50 мкг/мл и 100 мкг/мл) в TES (50 мМ Tris HCl рН 7,4; 10 мМ EDTA и 10 мМ NaCl) в течение от 12 до 25 минут при 37°С и при комнатной температуре. Изготовление криосрезов: Область туловища 8,5 дневного эмбриона индейки фиксируют в течение ночи при 4°С в 4% растворе формальдегида в PBS. Были протестированы различные концентрации протеиназы К в TES от 0 до 45 мкг/мл в течение 10, 15 и 20 минут при 37°С. Оптимальными условиями для протеолитической обработкой эмбриональных тканей оказалось: 1,25 мкг/мл при 37°С в течение 15 минут. Приготовление коктейля пробы и слепого [контрольного] коктейля: Коктейль пробы состоял из 10 мкл 50 × раствора Дендхарта, 50 мкл декстран сульфата (50%), 10 мкл ДНК спермы лосося (9,4 мг/мл), 100 мкл 2С XSSC, 500 нг ТМ1 образца, меченного дигоксигенином, и доведен дистиллированной водой до конечного объема 250 мкл. В конце в коктейль было добавлено 250 мкл формамида. Слепой коктейль содержал все вышеуказанные компоненты, за исключением меченной ТМ1 пробы. Коктейль был смешан посредством турбулизации [vortexing] и сохранялся при -20°С. Гибридизация: После протеолитического расщепления как парафиновые, так и криосрезы фиксировали в 0,4% параформальдегиде в течение 5 минут при 4°С. Затем срезы промывали в дистиллированной воде (5 минут) и высушивали на воздухе. Затем 10 или 15 мкл коктейля пробы или слепого коктейля (негативный контроль) были добавлены в каждый срез. Перед денатурацией при 95°С в течение 6 минут срезы были накрыты покрытыми силиконом покровными стеклами. Слайды были затем помещены на минуту на лед и поставлены во влажную камеру на 16-20 часов при 42°С. Тщательная отмывка и регистрация гибрида были подобны тем, которые описаны у Ролигхеда и Линдберга (см. выше), кроме готового субстрата щелочной фосфатазы NBT/BCIP (Amresco), который использовали для регистрации гибридов. После регистрации препараты пыли окрашены водным эозином на несколько секунд и промыты. Образцы монтировали в водной среде, приготовленной из 10 г желатина, растворенного в 60 мл воды при 70-80°С, в которую добавлены 70 мл глицерина и 1 мл фенола. Пример 6. Получение межвидовых эмбриональных химер Курица - Индейка. Эмбрионы кур породы Barred Rock инкубировали до стадии 23-25 (Н&Н). Генитальные гребни десяти эмбрионов вместе с некоторыми прилегающими тканями были помещены в DMEM с добавлением 10% FBS, глутамина, антибиотического и противогрибкового раствора. Их затем дважды отмыли в PBS и инкубировали в 0,02 EDTA при 37°С в течение пятнадцати минут. Добавляли свежую среду и гребни разделяли с помощью игл. Всю клеточную суспензию собирали в 15 мл пробирку и позволили комочкам оседать в течение пары минут. Суспензию клеток собирали и центрифугировали при 1500 об/мин в течение 5 мин. Среду удаляли и жизнеспособность клеток определяли, используя [trypan blue] исключение. Отбирали аликвоты клеточной суспензии и окрашивали при помощи антитела SSEA-1, чтобы определить число введенных эмбриональных клеток. Приблизительно 5 мкл суспензии клеток, содержащей 25-30 ЭСК (процентное содержание ЭСК в клеточной суспензии составляло приблизительно 3,2%; вводили в кровеносный сосуд каждого эмбриона индейки Николаса (n=10) на стадиях развития 13-14 (Н&Н). Эмбрионы инкубировали в стеклянных чашках, закрытых пластиковой пленкой при 37,5°С до стадий 21-25. Всю область туловища эмбрионов-реципиентов фиксировали в 4% параформальдегиде в течение ночи, трижды промывали в РБЗ всего в течение 90 минут, помещали в желатин/сахарозу, замораживали и делали срезы. Так как ЭСК гонад индейки SSEA-1 негативны, а ЭСК гонад курицы SSEA-1 позитивны, антитело против SSEA-1 можно использовать для определения переноса донорских ЭСК курицы в эмбриональные зародышевые химеры. ПРИМЕР 7. Получение межвидовых индейка-курица эмбриональных зародышевых химер. Оплодотворенные яйца индейки инкубировали при 38,5°С в течение 8 8,5 дней (стадия 27-28 Н&H). Эмбрионы препарировали для получения гонад. Их помещали в PBS и инкубировали в 0,02% EDTA при 37°С в течение 20 минут. Добавляли свежую среду и гребни осторожно разделяли с помощью игл. Собирали всю суспензию клеток и центрифугировали при 1500 об/мин в течение 5 минут. Среду удаляли и определяли жизнеспособность клеток. Всю суспензию клеток приготавливали при 37°С в DMEM + 10% FBS в течение 6-7 часов. После культурирования неприкрепленные клетки были осторожно собраны и центрифугированы. Затем 2-3 мкл клеточной суспензии, содержащей примерно 150 ЭСК, вводили в кровеносные сосуды эмбрионам кур на 14 стадии (Н&Н). Затем яйца-реципиенты запечатывали и инкубировали при 37,5°С. Эмбрионы реципиенты собирали на разных стадиях инкубации от стадии 19 до стадии 25. Эмбрионы промывали в PBS дважды; общее время варьировало в зависимости от толщины эмбриона. Эмбрионов опускали в 50% этанол и помещали в парафин. Со срезов удаляли парафин, регидратировали и промывали в PBS. Контролем для способики двойного окрашивания (см. ниже) являлись поперечные срезы двух эмбрионов курицы стадии 26 и двух эмбрионов индейки стадии 24. Сорок два среза генитальной области цыпленка и все серийные срезы генитальной области индейки были окрашены. Всего из 8 куриных эмбрионов-реципиентов были сделаны серии срезов. Пять из восьми эмбрионов были зафиксированы на стадиях 19 и 20. Два эмбриона были зафиксированы на стадии 22 и 23. Последний эмбрион был зафиксирован на стадии 25. Большинство срезов стадий 19 и 20 использовали для двойного окрашивания. Только каждый второй срез эмбрионов стадии 22, 23 и 25 использовали для двойного окрашивания. Пример 8. Двойное окрашивание антителом SSEA-1 и красителем PAS. Иммуногистохимические исследования проводили с использованием набора АВС-АР (Vector Laboratories, Burlingame, California). Срезы трижды промывали в PBS, всего в течение 30 минут. Затем их блокировали в 1,5% козьей сыворотке в PBS в течение 20 минут для уничтожения неспецифического связывания. Затем срезы инкубировали в течение часа с первичным моноклональным антителом на SSEA-1 (клон МС 480, полученный в Developmental Studies Hybridoma Bank, университет Айова, город Айова, Айова). После промывки в PBS срезы эмбрионов инкубировали с биотинилированным вторичным антителом (30 минут), затем промывали в PBS и инкубировали в реактиве Vectastain ABC-AP (30 минут). После финальной промывки в PBS они были окрашены в субстрате щелочной фосфатазы NBT/BCIP (Amresco, Солон, Огайо) в течение 20 минут. Следуя процессу иммуногистохимического окрашивания, срезы промывали водопроводной водой и помещали в перйодную кислоту на 6 минут. Затем срезы промывали в воде в течение 10 минут и окрашивали реактивом Chiff в течение 15 минут. После промывки в водопроводной воде срезы монтировали в водной среде. ПРИМЕРЫ 9-15 Результаты. Мацке и др. (Chromosoma 102: 9-14 (1992)) охарактеризовал повторяющуюся последовательность ДНК, обогащенную на микрохромосомах индейки. Она образована повторяющимся элементом из 41 нуклеотидной пары, представленным в 5% генома (приблизительно 2,2×10 6 копий в диплоидном геноме клетки). Таким образом, данную видоспецифичную последовательность ДНК использовали в ДНК-ДНК гибридизации, чтобы проверить, можно ли использовать это для идентификации ДНК индейки в эмбрионах кур. ПРИМЕР 9. Выделение и верификация плазмиды. Анализ гелевого электрофореза показал, что родительская плазмида puc 18 составляла 2,69 тпн, в то время, как линеаризованная рекомбинантная плазмида, полученная от др. Мацке, составляла примерно 2,8 тпн в длину. Двойное расщепление плазмидной ДНК из колоний №2 и 5 выделило вставку приблизительно в 0,15-0,17 тпн. Это подтвердило, что присланные нам трансформированные клетки DH5 содержали соответствующую рексмбинантную плазмиду. Плазмида содержала фрагмент ТМ1 (149 пн), состоящий из трех копий специфического для индейки повтора в 41 пн. ПРИМЕР 10 ПЦР меченье образца ТМ1. ПЦР амплификация циркулярной плазмидной ДНК с нуклеоткдами, меченными дигоксигенином, привело к получению амплифицирозанного продукта примерно 0,19-0,20 тпн. Увеличение в размерах продукта амплификации по сравнению со вставкой (0,15-0,17 тпн) произошло, вероятно, по причине включения множественных DIG-меченных нуклеотидов. ПЦР меченный образец использовали затем как для экспериментов по дот-блот гибридизации, так и для ДНК-ДКК In situ гибридизации. ПРИМЕР 11 Дот-блот гибридизация. Результаты дот-блот гибридизации (данные не показаны) показали одинаковую интенсивность связи пробы как с образцами ДНК индейки самца, так и самки. Этим подтверждается то, что данная проба не является специфической для пола. Гибридизацию делали на серийных разведениях ДНК индейки от 500 нг до 0 нг ДНК индейки. В образце зарегистрировано всего 0,30 нг ДНК индейки. Гибридизация с 0-2 мкг ДНК курицы, как самца, так и самки, подтвердило, что образец был видоспецифическим и не связывался с ДНК курицы. Различные концентрации ДНК индейки (10 нг - 0 нг) смешивали с 0-2 мкг ДНК курицы. Гибридизация в этой смеси ДНК показала, что только 1,25 нг ДНК индейки могло быть отмечено в 1 мкг ДНК курицы. Пример 12 Получение межвидовых индейка-курица эмбриональных germline химер. Межвидовые эмбриональные зародышевые химеры индейка-курица не были найдены при использовании вышеуказанного протокола дот-блот гибридизации. Причиной этого могло быть существование внутреннего биологического барьера, который мог бы предотвращать миграцию ЭСК гонад индейки в гонады курицы. Это могло быть также из-за технических проблем, т.е. процедура (дот-блот гибридизация) не была достаточно чувствительна для регистрации нескольких донорских эмбриональных клеток в гонадах цыпленка. Последняя причина выглядит более правдоподобной; исходя из этого была сделана попытка создать более чувствительную способику т.е. способику in situ гибридизации для локализации ЭСК донора в реципиенте. ПРИМЕР 13 Анализ in situ гибридизации на срезах индейки. Теоретически маркерная система in situ была бы подходящим маркером для идентификации клеток донора (индейки) в химере. Поскольку маркер находится внутри ядер, он универсален, не проникает в другие клетки и не воздействует на развитие эмбриона реципиента. В настоящем исследовании последовательность ТМ1 избирательно связывалась с ДНК в ядрах клеток индейки (данные не показаны). Никаких позитивных сигналов не было отмечено в клетках курицы (данные не показаны) или срезах, инкубированных со слепым коктейлем (данные не показаны), что указывает на то, что образец был видоспецифичным, без неспецифических сигналов. В идеале, в положительном контроле на срезах эмбрионов индейки все ядра должны были бы окраситься положительно. Однако только небольшой процент клеток окрасился положительно (данные не показаны). Кроме того, была разница в интенсивности сигнала между разными популяциями клеток на одном и том же срезе, при одинаковых условиях ферментативной обработки. Этим показано, что данная способика может давать ложные отрицательные результаты. Уменьшения процента ложных негативных результатов можно достичь, ослабив строгость условий. Однако это может также приводить к увеличению ложных позитивных результатов. В эмбриональных зародышевых химерах клетки донора составляли бы очень маленький процент от всего эмбрионального среза или клеток. К тому же, данная маркерная система определяет лишь меньшинство положительных клеток индейки. Таким образом, in situ гибридизация с ТМ1 пробой не будет эффективным способом определения химер. ПРИМЕР 14 Определение межвидовых эмбриональных химер курица-индейка с использованием окрашивания SSEA-1. Для того чтобы убедиться в отсутствии технических проблем, связанных с способикой, межвидовые курица-индейка зародышевые химеры получали посредством внутрисосудистого переноса эмбриональных клеток гонад курицы. Поскольку существует видовое различие в экспрессии SSEA-1 антигена на ЭСК гонад курицы и индейки, предположили, что антитело SSEA-1 можно использовать для идентификации эмбриональных зародышевых химер курица-индейка. Из пяти выживших эмбрионов четыре были порезаны на криосрезы. В одном из 4-х эмбрионов в дорсальном мезентерии эмбриона индейки было обнаружено 19 SSEA-1 позитивных клеток (данные не показаны), еще 4 куриные зародышевые клетки, меченные SSEA-1, были идентифицированы в генитальном гребне индейки (данные не показаны). Во втором эмбрионе две SSEA-1 положительные клетки были зарегистрированы в окрестностях гонад. В двух оставшихся эмбрионах донорские ЭСК не были отмечены. На основе этих результатов можно заключить, что ЭСК гонад куриных эмбрионов, начиная с 5 дня (стадия, на которой ЭСК являются SSSA-1 положительными), при внутрисосудистом введении в эмбрион индейки на стадии 13, способны к миграции, колонизации гонад и дают начало зародышевым химерам. Таким образом, оказалось, что хемоаттрактант, вырабатываемый гонадами индейки, не является видоспецифичным. Также еще раз подтверждено, что ЭСК гонад курицы сохраняют свою способность к миграции даже после того, как они колонизировали гонады. Низкая эффективность зародышевых химер в данном исследовании может объясняться более малым числом ЭСК донора во вводимой суспензии клеток. Пример 15 Идентификация межвидовых эмбриональных химер индейка-курица с использованием окрашивания SSEA-1 и PAS. Предыдущее исследование показало различие в экспрессии SSEA-1 у ЭСК индейки и курицы. Эти антигенные вариации, связанные со стандартным PAS тестом, потенциально могут быть использованы для идентификации зародышевых химер индейка-курица. Исследования дважды окрашенных срезов эмбриона курицы подтвердили, что ЭСК курицы положительны как к PAS, так и к SSEA-1 (данные не показаны). На контрольных срезах эмбриона курицы не было найдено PAS положительных и SSEA-1 отрицательных эмбриональных клеток. Двойное окрашивание 24 стадии индейки посредством PAS и SSEA-1 подтвердило, что ЭСК индейки, мигрирующие через дорсальный мезентерий и колонизирующие гонады, PAS положительны и не экспрессируют SSEA-1 эпитоп (данные не показаны). Таким образом, двойное окрашивание эмбрионов курицы и индейки установило, что способика двойного окрашивания может быть использована как маркер для идентификации эмбриональных клеток индейки в гонадах курицы. При использовании антитела SSEA-1 вместе со стандартным красителем PAS зародышевые химеры были зафиксированы в четырех из восьми куриных эмбрионов-реципиентов (Табл.1). Приблизительно через 24 часа после инъекции ЭСК индейки в кровеносные сосуды эмбриона курицы SSEA-1 отрицательные и PAS положительные эмбриональные клетки индейки были обнаружены в эмбрионах курицы. ЭСК индейки были зафиксированы вместе с ЭСК курицы в утолщенном целомическом эпителии (данные не показаны). Этот эпителий находился между целомическим углом и мезонефросом, в области будущих гонад. У более старших эмбрионов (стадия 22 и 23) ЭСК донора-индейки были отмечены у обоих эмбрионах-реципиентах курицы. Некоторые зародышевые клетки были расположены в дорсальном мезентерии (данные не показаны), другие мигрировали дальше и колонизировали гонады цыпленка (данные не показаны). Анализ потенциальных химер при помощи способики двойного окрашивания подтвердил, что ЭСК гонад индейки могут быть использованы для получения межвидовых химер. Таблица 1Продукция эмбриональных зародышевых химер индейка-курица. СтадияЧисло эмбрионов, порезанных на срезы Число зародышевых химер 19/2052/5 22/232 2/2251 0/1Хотя ДНК-ДНК гибридизация и была видоспецифичной, эта способика оказалась неспособна выявлять химеры. Способ дот-блот гибридизации был недостаточно чувствителен, чтобы выявлять ЭСК донора, тогда как способ гибридизации in situ имеет высокий процент ложных отрицательных результатов, связанный с способикой. Способ двойного окрашивания является успешным способом идентификации химер индейка-курица. На основе результатов, представленных выше, ЭСК гонад курицы или индейки при внутрисосудистом введении способны мигрировать в гонады и давать начало зародышевым химерам. Таким образом, оказалось, что хемоаттрактант, вырабатываемый гонадами птиц, не является видоспецифичным. Это также доказывает, что ЭСК гонад сохраняют свою способность мигрировать даже после того, как они колонизировали гонады. Получение химер индейка-курица имеет широкое применение. Перенос ЭСК самца индейки пригоден для сперматогенеза индейки в гонадах курицы. Это может ускорить сперматогенез, поскольку время, необходимое для получения спермы у кур - 18 недель, по сравнению с 30-32 неделями у индеек. Возможность культурировать ЭСК и получать зародышевые химеры может уменьшить число высококачественных производителей, которые в настоящее время необходимы для получения потомства. Возможность получения индюшачьей спермы от меньших по размеру и более дешевых птиц также выгодно для птицеводства. Экспериментальные химеры также могут дать модель исследования взаимодействия между зародышевыми и соматическими клетками разных генотипов, на основании чего становится возможным узнать, получают ли при этом соседние клетки какие-либо характеристики эмбриональных клеток. Эта способика может быть также использована для переноса ЭСК от пород с низкой плодовитостью к более плодовитым птицам и для сохранения ЭСК в случае неожиданной гибели или болезни или в случае видов птиц, вымирающих при естественных условиях спаривания (A.Tajima et al. Theriogenology 40:509-519 (1993)). Предшествующее является иллюстрацией настоящего изобретения и не должно истолковываться как его ограничение. Данное изобретение определяется нижеследующими пунктами и эквивалентными положениями, включенными в них. Формула изобретения1. Способ производства и сбора гамет птиц, предусматривающий стадии: получения эмбриональных стволовых клеток от птиц видов-доноров; введения указанных эмбриональных стволовых клеток виду-реципиенту птицы in ovo, где указанный вид-реципиент отличен от указанного вида-донора; инкубирование указанного вида реципиента до вылупления; выращивание указанного реципиента до половой зрелости; с последующим сбором гамет указанного вида-донора у указанного вида-реципиента. 2. Способ по п.1, где указанным видом-донором является американский журавль. 3. Способ по п.2, где указанным видом-реципиентом является канадский журавль. 4. Способ по п.1, где указанным видом-донором является индейка. 5. Способ по п.4, где указанным видом реципиентом является курица. 6. Способ по п.1, где указанная стадия введения осуществляется инъекцией. 7. Способ по п.1, где указанные эмбриональные стволовые клетки выбирают из группы, состоящей из эмбриональных стволовых клеток гонад и эмбриональных стволовых клеток крови. 8. Способ по п.1, где указанная стадия введения осуществляется на стадиях с 13 по 18 эмбрионального развития. 9. Способ по п.1, где указанные эмбриональные стволовые клетки несут пару хромосом (Z), определяющих пол самца. 10. Способ по п.1, где указанные эмбриональные стволовые клетки несут хромосому (w), определяющую пол самки. 11. Способ по п.1, где указанная стадия введения производится без предварительной стерилизации указанной птицы in ovo. Популярные патенты: 2160533 Способ профилактики и коррекции транспортного стресса у крупного рогатого скота ... его изготовления. Технический результат - изыскание эффективного способа снижения отрицательного влияния стресса на организм животных и сокращение потерь живой и убойной массы реализуемого скота при его транспортировке с помощью использования дешевого и более доступного средства. Это достигается использованием адаптогена растительного происхождения корня солодки, измельченного до муки, который скармливают животным вместе с концентрированными кормами в количестве 3,0 г/кг живой массы в сутки за 8 суток до транспортировки. Корень солодки с целью профилактики и коррекции транспортного стресса и снижения потерь живой и убойной массы молодняка крупного рогатого скота при перевозке не ... 2280351 Установка для скашивания сорной растительной массы с берм и откосов канала ... лопастей (SU Авторское свидетельство №1402272. А1, М. кл.4 А 01 В 43/00. Роторный валкователь камней / Л.Ч.Германе, Р.И.Барейтис (СССР). - Заявка №4148661/30-15; Заявлено 04.08.1986; Опубл. 15.06.1988, Бюл. №22 // Открытия. Изобретения. - 1988. - №22). Описанный роторный валкователь камней применительно к решаемой нами проблеме приемлем для удаления предварительно скошенных в растил сорняков.Известен режущий аппарат, включающий ножи, откидные верхние прижимы, установленные на горизонтальных осях, и жесткие нижние прижимы ножей, в котором, с целью снижения потерь урожая и облегчения обслуживания режущего аппарата, верхние прижимы выполнены в виде секций зубчатых гребенок, ... 2177223 Блесна ... по п.1, отличающаяся тем, что головка крючка расположена на оси симметрии блестящего элемента или вне ее. 6. Блесна по п. 1, отличающаяся тем, что она снабжена по меньшей мере одним дополнительным крючком, связанным с головкой основного крючка. 7. Блесна по п.1, отличающаяся тем, что блестящий элемент выполнен из различных материалов с различной удельной массой. 8. Блесна по п.1, отличающаяся тем, что поверхность блестящего элемента снабжена цветной фольгой, и/или светоизлучающим покрытием, и/или люминесцентным, и/или прозрачным. 9. Блесна по п.1, отличающаяся тем, что крючок снабжен незацепляющим элементом. 10. Блесна по п.1, отличающаяся тем, что крючок выполнен с одним, или ... 2452165 Высевающий аппарат зерновой сеялки с централизованным дозированием семян ... и 7.Подача семян W высевающим аппаратом определяется из выражения: где D, d - диаметры внешнего и внутреннего цилиндров, м; KZ - число заходов витка, шт; n - частота вращения цилиндров, с-1; q - насыпная плотность семян, кг/м3; - угол наклона винтовой линии витка, град; 1, 2 - коэф. снижения или повышения подачи в зависимости от поперечного крена сеялки.Как видно из формулы (2), основными факторами, влияющими на производительность и равномерность подачи семян высевающего аппарата, в прямой зависимости являются: диаметр цилиндров, число заходов витков, частота вращения цилиндров, угол наклона винтовой линии витков.Требуемая подача должна соответствовать норме высева семян: ... 2267261 Молочно-доильный комплекс ... что приводит к смешению животных. После дойки животных нужно вернуть на свое место, что требует дополнительных трудозатрат на сортировку и перегон животных.Задача предлагаемого изобретения - снижение энергоемкости доильного оборудования и трудозатрат на проведение дойки при максимальном использовании полезной площади. Задача решается тем, что в молочно-доильном комплексе, включающем помещение для содержания животных, доильную установку с приводом, направляющей и ограничителями, перекрываемые входы и выходы, молочный блок, при двухрядном и более расположении стойл доильные установки расположены по обе стороны помещения в доильных залах, при этом ограничители доильных установок ... |
Еще из этого раздела: 2444885 Посевной агрегат 2121252 Агротранспортная система 2261588 Способ электростимуляции жизнедеятельности растений 2141182 Культиватор 2024226 Производные s- -тиоакриламидов и композиция для предотвращения или ингибирования роста бактерий 2281645 Устройство для размещения цветов и растений с подсветкой (варианты) 2175477 Способ борьбы с тлями 2189718 Пневматический высевающий аппарат 2310308 Способ определения выполненности семян сельскохозяйственных культур и устройство для его осуществления 2492632 Способ орошения |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
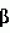 1
1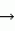 4 фруктоза
4 фруктоза 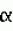 1
1 (описанная в патентах США №№4681063 и 4903625 Hebrank) и патентах США №№4040388, 4469047 и 4593646 Miller. Открытия всех патентов США цитированных здесь, включено сюда во всей полноте посредством ссылки. Все подобные устройства, будучи адаптированными для практики по настоящему изобретению, включают инъектор, содержащий эмбриональные стволовые клетки, рецептуированные, как здесь обсуждалось, при этом инъектор, расположенный так, чтобы делать инъекции в яйцо, перемещаемое аппаратом с соответствующим положением яйца, как обсуждалось выше. Кроме того, инъецирующее устройство может быть снабжено запечатывающим устройством, чтобы запечатывать отверстия в яйце после инъекции.
(описанная в патентах США №№4681063 и 4903625 Hebrank) и патентах США №№4040388, 4469047 и 4593646 Miller. Открытия всех патентов США цитированных здесь, включено сюда во всей полноте посредством ссылки. Все подобные устройства, будучи адаптированными для практики по настоящему изобретению, включают инъектор, содержащий эмбриональные стволовые клетки, рецептуированные, как здесь обсуждалось, при этом инъектор, расположенный так, чтобы делать инъекции в яйцо, перемещаемое аппаратом с соответствующим положением яйца, как обсуждалось выше. Кроме того, инъецирующее устройство может быть снабжено запечатывающим устройством, чтобы запечатывать отверстия в яйце после инъекции.