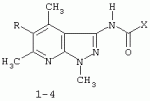
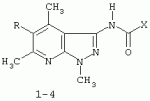
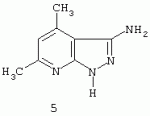
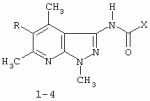
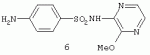Применение 3[(замещенный фенил) карбоксамидо]-1,4,6-триметил-5-r пиразоло [4,5-b]пиридинов в качестве антидотов 2,4-дПатент на изобретение №: 2287275 Автор: Дмитриева Ирина Геннадиевна (RU), Кайгородова Елена Алексеевна (RU), Дядюченко Людмила Всеволодовна (RU), Стрелков Владимир Денисович (RU), Губанова Наталья Яковлевна (RU) Патентообладатель: Федеральное государственное образовательное учреждение высшего профессионального образования Кубанский государственный аграрный университет (RU) Дата публикации: 20 Ноября, 2006 Начало действия патента: 23 Июня, 2005 Адрес для переписки: 350044, г.Краснодар, ул. Калинина, 13, КГАУ, ПИО Описывается применение 3-[(замещенный фенил)карбоксамидо]-1,4,6-триметил-5-R-пиразоло[4,5-b]пиридинов формулы 1-4: 1 R=H, Х=4-метилфенил; 2 R=H, Х=2-метоксифенил; 3 R=Cl, X=2-метоксифенил; 4 R=Cl, X-этил в качестве антидота по отношению к 2,4-дихлорфеноксиуксусной кислоте на подсолнечнике. Технический результат - расширение ряда биологически активных веществ, полученных синтетическим путем, для их применения в сельском хозяйстве в качестве антидотов гербицида 2,4-Д. Это достигается обработкой 3-[(замещенный фенил)карбоксамидо]-1,4,6-триметил-5-R-пиразоло[4,5-b]пиридинами поврежденных гербицидом проростков подсолнечника. 1 табл. Изобретение относится к синтетическим, химическим биологически активным веществам из ряда гетероциклических соединений формулы 1-4: 1 - R=H, Х=4-метилфенил; 2 - R=H, Х=2-метоксифенил; 3 - R=Cl, Х=2-метоксифенил; 4 - R=Cl, Х=этил, в качестве средств защиты растений от фитотоксического действия гербицида 2,4-дихлорорфеноксиуксусной кислоты (антидотов). Заявляемые соединения известны ранее (Каталог Chemical Blok Stok Library, Cas Registry №728887-44-3, 10.08.2004; №728888-08-2, 10.08.2004; №727667-16-5, 10.08.2004 и №728887-48-7, 10.08.2004 соединения 1-4 соответственно),однако их антидотные свойства выявлены впервые. Как известно, подсолнечник является чрезвычайно чувствительной культурой к гербицидам группы 2,4-Д, и в случаях непреднамеренного попадания гербицида на его посевы потери могут составлять в зависимости от дозы до 100% [Д.И.Чкаников, М.С.Соколов. Гербицидное действие 2,4-Д и других галоидфеноксикислот. М.: Наука, 1973]. До сих пор защита вегетирующих растений подсолнечника от повреждающего действия 2,4-Д остается актуальной и нерешенной. К наиболее близким аналогам по структуре заявляемых соединений может быть отнесен 3-амино-4,6-диметил-1Н-пиразоло[4,5-b]-пиридин 5 [Lacan М., Tabakovic К. Syntesis of pirazolo-, and tetrazolopyridines. /Croat. cem. Acta/ 1975, 47, №2, s.127-133]. В качестве аналога по свойствам известен Сульфален [В«Антидот гербицидов гормонального действия 2,4-дихлорфеноксиуксусной кислоты и 4-амино-3,5,6-трихлорпи-колиновой кислотВ» пат. РФ №2043021 от 10.09.95,заявка №5042089 от 14.05.92] 6 Сульфален формулы 6 используется в качестве средства снижения негативного действия гербицида 2,4-Д, он в дозе 200 г/га применяется по поврежденным вегетирующим растениям. В то же время Сульфален широко применяется в качестве антибактериального средства в медицинской практике, его синтез описан в литературе [В.Г.Беликов. Фармацевтическая химия. - М.: Высшая школа. 1985. с.383, 768.] Однако антидотная активность Сульфалена является недостаточно высокой. Задачей настоящего изобретения является расширение арсенала биологически активных веществ, полученных синтетическим путем, для применения их в сельском хозяйстве в качестве антидотов. Это достигается применением 3-[(замещенный фенил)-карбоксамидо]-1,4,6-триметил-5-R-пиразоло[4,5-b]пиридинов 1-4 на проростках подсолнечника. При этом заявляемые соединения получают известным методом - ацилированием 3-амино-1,4,6-триметил-5-R-пиразоло[4,5-b]пиридинов хлорангидридами ароматических и алифатических карбоновых кислот при температуре 10-12°С в среде безводного бензола в присутствии триэтиламина в качестве акцептора хлороводорода [см. Вейганд Хильгетаг.Методы эксперимента в органической химии. - М.: Химия. 1969. с.431]. Исходные 3-амино-1,4,6-триметил-5R-пиразоло[4,5-b]пиридины также получают известным методом [см. З.А.Бомика, М.Б.Андабурская, Ю.Э.Пелчер, Г.Я.Дубур. Некоторые реакции нуклеофильного замещения в ряду 2-хлор-3-цианопиридинов. - ХГС, 1976, №8, с.1085-1088]. Использованный бензол и ацетон абсолютируют известным способом [см.А.Вайсбергер, Э.Проскауэр, Дж.Риддик, Э.Тупс.Органические растворители. М.: Иностранная литература, 1958, с.518]. Изобретение иллюстрируется следующими примерами: Пример 1. 3[-(4-метилфенил)-карбоксамидо]-1,4,6-триметил-пиразоло[4,5-b]пиридин (соединение 1) К суспензии из 0,7 г (0,00370 моль) 3-амино-1,4,6-триметилпиразоло[4,5-b]-пиридина и 0,38 (0,00370 моль) триэтиламина в 20 мл абсолютного бензола прикапывают в течение 40-50 минут раствор 0,69 г(0,00440 моль) 4-метилбензоилхлорида в 10 мл абсолютного бензола, поддерживая температуру реакционной смеси в интервале 10-12°С. По окончании прибавления перемешивают при этой же температуре еще 10-20 минут, затем при комнатной температуре 3 часа. Из реакционной массы осадок отделяют фильтрованием, промывают его теплой водой (3×20 мл), сушат. Маточный раствор упаривают досуха, остаток обрабатывают 15 мл серного эфира, сушат. Оба осадка объединяют, перекристаллизовывают из этанола, получают 1,1 г (72%) целевого продукта 1 в виде белых кристаллов с т.пл. 236-237°С. Найдено, %: С 69,61; Н 6,27; N 18,54. C17H18N4O Вычислено, %: С 69,35; Н 6,18; N18,36. ПМР, Масс-спектр; m/z (относ. интенсивность): 294 М+(28); 134(3); 119(100); 104(5); 91(30); 65(12). Пример 2. 3-[(2-метоксифенил)-карбоксамидо]-1,4,6-триметил-пиразоло [4,5-b]пиридин (соединение 2) К суспензии из 0,6 г (0,00320 моль) 3-амино-1,4,6-триметилпиразоло[4,5-b]-пиридина и 0,32 (0,00320 моль) триэтиламина в 18 мл абсолютного бензола прикапывают в течение 40 минут раствор 0,52 г (0,00380 моль) 2-метоксибензоилхлорида в 10 мл абсолютного бензола, поддерживая температуру реакционной смеси в интервале 10-12°С. По окончании прибавления перемешивают при этой же температуре еще 10-20 минут, затем при комнатной температуре 2 часа. Реакционную массу отделяют от осадка (гидрохлорид триэтиламина), упаривают досуха, остаток обрабатывают 10 мл Et2O. После перекристаллизации из этилацетата получают 0,66 г (68%) целевого соединения 2, в виде белых кристаллов с т.пл. 158-159°С. Найдено %: С 65,51; Н 5,72; N 18.28; C17H18N4O; Вычислено, %: С 65,78; Н 5,86; N 18,05. ПМР, Масс-спектр, m/z (относ. интенсивность): 310 М+(16); 135(100); 104(4); 92(12); 77(22) Пример 3. 3-[(2-метоксифенил)-карбоксамидо]-1,4,6-триметил-5-хлорпиразоло[4,5-b]пиридин (соединение 3). К суспензии из 0,8 г (0,00380 моль) 3-амино-1,4,6-триметил-5-хлорпиразоло[4,5-b]-пиридина и 0,38 (0,00380 моль) триэтиламина в 25 мл абсолютного бензола прикапывают в течение 40-50 минут раствор 0,78 г (0,00456 моль) 2-метоксибензоилхлорида в 10 мл абсолютного бензола, поддерживая температуру реакционной смеси в интервале 10-12°С. По окончании прибавления перемешивают при этой же температуре еще 10-20 минут, затем при комнатной температуре 3 часа. Реакционную массу отделяют от осадка (гидрохлорид триэтиламина), упаривают досуха, остаток обрабатывают 10 мл Et2O. После перекристаллизации из этилацетата получают 0,84 г (64%) целевого соединения 3, в виде белых кристаллов с т.пл. 173-174°С. Найдено, %: С 59,44; Н 4,79; N 16.41; С17Н17ClN 4О Вычислено, %: С 59,20; Н 4,98; N 16,25. ПМР, Масс-спектр, m/z (относ. интенсивность): 344 M+(7); 135(100); 92(11); 77(24). Пример 4. 3-(этилкарбоксамидо)-1,4,6-триметил-5-хлорпиразоло [4,5-b] пиридин (соединение 4) К суспензии из 0,8 г (0,00380 моль) 3-амино-1,4,6-триметил-5-хлорпиразоло[4,5-b]-пиридина и 0,38 (0,00380 моль) триэтиламина в 25 мл абсолютного бензола прикапывают в течение 40-50 минут раствор 0,33 г (0,0043 моль) пропионилхлорида в 10 мл абсолютного бензола, поддерживая температуру реакционной смеси в интервале 10-12°С. По окончании прибавления перемешивают при этой же температуре еще 10-20 минут, затем при комнатной температуре 3 часа. Реакционную массу отделяют от осадка (гидрохлорид триэтиламина), упаривают досуха, остаток обрабатывают 10 мл Et2O. После перекристаллизации из этанола получают 0,67 г (71%) целевого соединения 4, в виде белых кристаллов с т.пл. 194-195°С. Найдено, %: С 54,30; Н 5,52; N 21.18; С12Н15ClN4 О Вычислено, %: С 54,03; Н 5,68; N 21,01. ПМР, Масс-спектр, m/z (относ. интенсивность): 266 М+(5); 210(35); 77(6); 44(100). Пример 5. 3-амино-1,4,6-триметилпиразоло[4,5-b]пиридин (соединение 5) Смесь 1,0 г (0,0061 моль) 2-хлор-3-циано 4,6-диметилпиридина, 1,22 г (0,0244 моль) гидразингидрата и 25 мл безводного этанола кипятят в течение 9 часов. После охлаждения реакционной массы осадок отфильтровывают, промывают на фильтре спиртом, перекристаллизовывают из метанола, получают 0,72 г (73%) целевого соединения 5 в виде кристаллов светло-желтого цвета с т.пл. 239-240°С Найдено %: С 59,39; Н 6,12; N 34,40; C8H10N4 Вычислено, %: С 59,22; Н 6,23; N 34,55. ПМР, Масс-спектр, m/z (относ. интенсивность): 162 М+(100); 133(24); 107(40); 105(32); 92(5); 84(12). Пример 6. Оценка соединений 1-6 на антидотную активность на проростках подсолнечника Проросшие семена подсолнечника с длиной зародышевого корешка 2-4 мм помещали на 1 ч в раствор 2,4-дихлорфеноксиуксусной кислоты (2,4-Д) в концентрации 10-3% в расчете получения 40-60% ингибирования роста гипокотиля. После гербицидного воздействия проростки промывали водой и помещали в растворы испытываемых на антидотную активность веществ в концентрациях 10-2, 10-3, 10 -4, 10-5 (вариант гербицид + антидот). Спустя 1 ч семена промывали водой и раскладывали на полосы фильтровальной бумаги (размер 10×75 см) по 20 штук, которые сворачивали в рулоны и помещали в стаканы с 50 мл воды. Дальнейшее проращивание семян проводили в термостате в течение 3 суток при температуре 28°С. Температура растворов и промывной воды 28°С. Семена варианта В«гербицидВ» (эталон сравнения) выдерживали 1 ч в растворе 2,4-Д в концентрации 10-3 и 1 ч в воде. Семена контрольного варианта 2 часа выдерживали в воде. Повторность опыта трехкратная. В каждой повторности использовали по 20 штук семян. Защитный (антидотный) эффект определяли по увеличению длины гипокотиля и корня в варианте гербицид + антидот относительно названных величин в варианте В«гербицидВ» (эталон). Статистическая обработка экспериментальных данных проведена с использованием t-критерия Стьюдента при Р=0,95. Результаты исследований приведены в таблице. Как видно из данных таблицы, применение на фоне воздействия гербицида предлагаемых в качестве антидотов 3-(замещенный фенилкарбоксамидо)-1,4,6-триметил-1-R-пиразоло[4,5-b]пиридинов 1-4 резко ослабляет токсическое действие гербицида. Соединения 1-4 снижали отрицательное действие 2,4-Д на гипокотиле проростков подсолнечника на 28-41% при использовании в основном в трех и более концентрациях, в то время как соединение 5 (аналог по структуре) защитного действия не проявлял, а величина антидотного эффекта Сульфалена (прототипа) составляла 12-20%. Соединения 1-4 снижали ингибирующее действие 2,4-Д на корни проростков на 29-55% также при использовании в трех и более концентрациях, соединение 5 не увеличивало длину корня проростков, а Сульфален (прототип) проявлял антидотный эффект на уровне 18-28%. Таким образом, применение заявляемых 3-(замещенный фенилкарбоксамидо)-1,4,6-триметил-1-R-пиразоло[4,5-b]пиридинов в качестве антидотов позволяет эффективно защитить подсолнечник от отрицательного воздействия 2,4-Д, а также расширить ассортимент известных антидотов. Таблица.Антидотная активность соединений 1-6 к 2,4-Д на проростках подсолнечника сорта ВНИИМК-8883. Препарат Концентрация, %Длина гипокотиля Длина корня ммК 2,4-Д, %мм К 2,4-Д, %Контроль 068 119 2,4-Д10 -336 35 2,4-Д + соединение 110-2 51141* 54153*10 -343120 48138* 10-448 134*49140* 10-5 48134*53 151*2,4-Д + соединение 210-2 4412246 131*10-3 49136* 48136*10 -446128* 41116 10-545 124*45129* 2,4-Д + соединение 3 10-248 133*50142* 10-3 49136*50 142*10-4 45124 4512910 -546128* 52148* 2.4-Д + соединение 410-2 49236* 55155*10 -347132* 49140* 10-446 128*49140* 10-5 46128*53 151*2,4-Д + соединение 510-2 328939 111*10-3 38106* 339310 -437103 35100 10-538 106*3086 2,4-Д + Сульфален(6) (прототип) 10-2 4011245 128*10-3 42118* 45128*10 -445124* 40114 10-543 120*41118* *Различия между вариантами достоверны при Р=0,95.Формула изобретенияПрименение 3-[(замещенный фенил)карбоксамидо]-1,4,6-триметил-5-R-пиразоло[4,5-b]пиридинов формулы 1-4 где 1. R=H, Х=4-метилфенил; 2. R=H, Х=2-метоксифенил; 3. R=Cl, Х=2-метоксифенил; 4. R=Cl, X-этил, в качестве антидота по отношению к 2,4-дихлорфеноксиуксусной кислоте на подсолнечнике. MM4A - Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 24.06.2007 Извещение опубликовано: 27.01.2009 БИ: 03/2009 Популярные патенты: 2192734 Устройство для производства прессованных кип из корней лекарственных растений ... кип. Устройство включает нижнюю траверсу, вертикально установленные направляющие, верхнюю траверсу, нижнюю матрицу, подвижную верхнюю матрицу, камеру прессования, гидроприводы верхней матрицы и камеры прессования. Гидроприводы гидравлически соединены с гидростанцией. Камера прессования выполнена составной из верхней, средней и нижней подвижных частей. Части камеры прессования имеют опорные кольца на срезах. Верхняя и нижняя части камеры снабжены индивидуальными гидроприводами. Опорное кольцо верхней подвижной части размещено на нижнем срезе на внешней ее поверхности. Опорное кольцо нижней подвижной части смонтировано на верхнем срезе на внутренней поверхности кольца. Опорные ... 2248687 Способ весеннего боронования озимых культур и зубовая борона для его осуществления ... погибнуть.Мало того, что боронование поперек направления сопровождается максимальным выдергиванием растений или надрывом корневой системы, оно вызывает дополнительную неустойчивость хода бороны из-за разного сопротивления почвы в рядках и междурядье. Поэтому забивание поверхности зуба и межзубового пространства растительными остатками значительно, что сначала увеличивает тяговое сопротивление и приводит к выглублению зуба, а затем к образованию просто следа на поверхности почвы. Для устранения такого нарушения агротехнологического процесса необходимо остановить агрегат и очистить зубья, что повлечет за собой значительное удорожание процесса, поэтому в реальных производственных ... 2141182 Культиватор ... действующее на лезвия 33 (34) ножей 32. На поле с сильно развитыми стеблями сорных растений трактор перемещается на заданной передаче по его поверхности. Каток 25 при встрече со стеблями подминает их под себя, максимально приближая к поверхности поля. При перемещении катка 25 стебли удерживаются в напряженном, относительно корней, положении за счет своей длины. Последовательно установленный за катком 25 ножевой барабан 26 режущими кромками своих лезвий 34 производит рубку стеблей с шагом 175 мм. Разрубленные стебли остаются на поверхности поля, создавая при этом мульчирующий слой и, при высыхании, не оказывают вредного (отрицательного) воздействия на работу дисковых сошников ... 2157603 Способ послепосевного прикатывания озимых культур и каток для его осуществления ... кроме того, исключается возможность последующего попадания посторонних комочков почвы в режущий аппарат косилок. В предложенном способе одновременно с выравниванием и уплотнением почвы формируют волновой рельеф поверхности поля с ориентировкой боковин полученных гребней соответственно одной - на север, а противоположной - на юг, против доминирующих ветров и также поперек склона, если он имеется на поле. Совокупность перечисленных существенных признаков предложенного способа послепосевного прикатывания создает разность прогревания и освещенности растений с южной и северной боковин гребней, что, увеличивая степень разнокачественности растений в период осенней подготовки к зиме, ... 2163758 Способ и устройство контроля количества меда в улье ... две другие пластины соединены каждая отдельно экранированными проводниками соответственно с входом усилителя и выходом усилителя, емкостной преобразователь и усилитель образуют инвертирующий усилитель, выход которого соединен с входом устройства выпрямления, а выход устройства выпрямления соединен с первым входом дифференциального усилителя, второй вход которого соединен с выходом устройства для установки нуля, выход дифференциального усилителя соединен с входом измерительного прибора, экраны проводников заземляются, шины устройства установки нуля и шины питания усилителей соединены с выходами блока ... |
Еще из этого раздела: 2088063 Широкозахватный сельскохозяйственный агрегат 2066320 Производные тиазола, способ их получения и способ борьбы с грибками 2015633 Способ переработки отходов животноводческих комплексов и устройство для его осуществления 2482660 Способ выращивания рапса ярового на семена 2453090 Способ минимальной обработки почвы 2485083 Способ получения замещенных пиримидин-5-илкарбоновых кислот 2126616 Устройство управления навесной системой трактора 2005344 Способ облучения живых организмов или растений 2397634 Жалюзийное решето 2075933 Композиция для иммунизации растений от различных фитопатогенов |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||