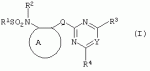
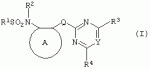
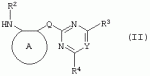
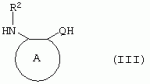
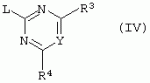
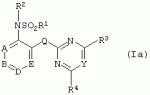
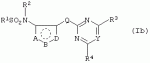
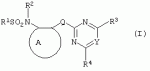
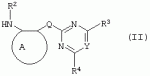
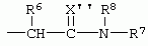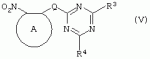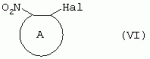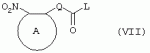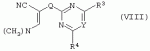Производные сульфонамидов, способ их получения, композиция и способ уничтожения сорняковПатент на изобретение №: 2266904 Автор: ГЕЙТС Питер Стюарт (GB), ДЖОУНС Грэхэм Питер (GB), САУНДЕРС Дэвид Эдвард (GB) Патентообладатель: АГРЕВО Ю-КЕЙ ЛИМИТЕД (GB) Дата публикации: 20 Августа, 1995 Начало действия патента: 2 Ноября, 1992 Адрес для переписки: 129010, Москва, ул. Б.Спасская, 25, стр.3, ООО "Юридическая фирма Городисский и Партнеры", пат.пов. Е.Е.Назиной Изобретение относится к новым сульфонамидам формулы: и их соли, где А представляет собой замещенное или незамещенное бензольное кольцо или 5-членное или 6-членное замещенное или незамещенное гетероароматическое кольцо, выбранное из группы, включающей тиенил, пиразолил, имидазолил, пиридил, где необязательные заместители выбраны из группы, состоящей из галогена, незамещенного или замещенного С1-С4алкила, незамещенного или замещенного С1-С4алкокси, нитро, фенила, фенокси, бензоила и С1-С4алкилкарбоксилата, когда любой алкильный фрагмент в последних указанных заместителях замещен одним или несколькими атомами галогена, С1 -С4алкоксигруппами, циано, и фенилом; Q представляет собой -О-, -S- или группу формулы -СХХ'; Х и X', которые могут быть одинаковыми или разными, представляют собой каждый водород, галоген, циано, алкил, содержащий 1-8 атомов углерода, или группу -ORa, -SRa или один из Х и X' представляет собой гидрокси, а другой принимает значения, определенные выше; Ra означает С1-С8алкил; фенил; Rb означает С1-С8алкил, фенил; Y означает азот или группу CR9; R1 означает С1-С8алкил, незамещенный или замещенный галогеном, цианогруппой, фенилом или С1 -С4алкоксикарбониламиногруппой, или представляет собой фенил; R2 означает Н, С1-С4алкил; R3 и R4, которые могут быть одинаковыми или разными, представляют собой каждый С1-С4 алкил, С1-С4алкоксигруппу, галоген; R 9 означает Н; при условии, что когда Q представляет собой О или -S-, кольцо А представляет собой 5-членное замещенное или незамещенное гетероароматическое кольцо, как определено выше. Соединения формулы I обладают гербицидной активностью, что позволяет использовать их для уничтожения сорняков. Описан способ получения соединения I. 4 н. и 5 з.п. ф-лы, 4 табл. Настоящее изобретение относится к гербицидным сульфонамидам, способам их получения и препаративным формам на их основе. В патентах ЕР №323040 и WO №91/10653 раскрываются гербицидные сульфонамиды, родственные соединениям настоящего изобретения. Одним из объектов настоящего изобретения являются новые сульфонамиды формулы: и их соли, где А представляет собой замещенное или незамещенное бензольное кольцо, или 5-членное замещенное или незамещенное гетероароматическое кольцо; -Q- представляет собой -O-, -S- или группу -CXX'-, X и X', которые могут быть одинаковыми или различными, представляют собой атом водорода, атом галогена, циано-, возможно замещенную алкильную группу, или группу -ORa, -SRa или -COR b; или один из Х или X' представляет собой гидроксильную группу, а другой принимает определенные выше значения; или X и X' вместе образуют группу =O или =S; Ra представляет собой возможно замещенную алкильную, арильную или ацильную группу; Rb представляет собой возможно замещенную алкильную или арильную группу, или принимает значение -ORc или -NRcRd; R c и Rd, которые могут бить одинаковыми или различными, представляют собой атом водорода, возможно замещенную алкильную или арильную группу; Y представляет собой атом азота или группу CR9; R1 представляет собой возможно замещенную алкильную, алкенильную, алкинильную, циклоалкильную, арильную группу, гетероциклическую, бензогетероциклическую или аминогруппу; R2 представляет собой атом водорода, возможно замещенную алкильную или карбоксильную ацильную группу; или группу -SO2R1; R3 и R4, которые могут быть одинаковыми или различными, представляют собой атом водорода, атом галогена, возможно, замещенную алкильную, алкоксильную, циклоалкильную или аминогруппу или возможно замещенную гетероциклическую группу; и R9 представляет собой атом водорода или, возможно, замещенную алкильную группу; при условии, что когда Q принимает значение -O- или -S-, кольцо A представляет собой 5-членное замещенное или незамещенное гетероароматическое кольцо; и при условии, что когда заместитель R1 представляет собой замещенный алкил, он не является группой формулы: где заместитель Х'' представляет собой атом кислорода или серы, а каждый из заместителей R6, R7 и R8 представляет собой атом водорода или, возможно, замещенную алкильную группу. Когда A является 5-членным гетероциклическим кольцом, то он предпочтительно проставляет собой замещенное или незамещенное тиофеновое, фурановое, пиррольное, тиазольное, изотиазольное, пиразольное, имидазольное, оксазольное или изоксазольное кольцо. В кольце A любой из заместителей у атома углерода предпочтительно представляет собой атом галогена, цианогруппы, группу -COOR10 (где заместитель R 10 представляет собой атом водорода или, возможно, замещенную алкильную группу), или, возможно, замещенную алкильную, алкоксильную, арилокси-, гетероциклилокси- или аминогруппу. Предпочтительно такими замещающими группами являются атомы фтора и хлора. Любой из заместителей у атома азота кольца A предпочтительно представляет собой замещенную или незамещенную алкильную, алкоксильную, амино- или арильную группу, особенно метильную группу. Любая из присутствующих алкильных групп в молекуле предпочтительно имеет от 1 до 8 атомов углерода, более предпочтительно от 1 до 6 атомов углерода, особенно от 1 до 4 атомов углерода. Конкретные предпочтительные незамещенные алкильные или алкилсодержащие группы включают метил, этил, н-пропил, изопропил, н-бутил, трет.-бутил, метокси, этокси и н-пропокси. Если любая из алкильных групп в молекуле замещена, то заместителями могут быть, например, один или более атомов галогена (например, фтора, хлора или брома), алкокси- или алкилтиогрупп, содержащих от 1 до 4 атомов углерода (например, метокси- или этокси-), гидрокси-, нитро-, меркапто-, амино-, замещенные аминогруппы, карбамоильные, замещенные карбамоильные, тиокарбамоильные, замещенные тиокарбамоильные, циано-, ацильные, арильные или гетероарильные группы. Особенно предпочтительными замещенными алкилсодержащими группами являются хлорметильная, бромметильная, дихлорметильная, трифторметильная, дифторметокси, цианометильная, метоксиэтильная или этоксиэтильная. Любая из присутствующих алкенильных или алкинильных групп в молекуле предпочтительно имеет от 2 до 6 атомов углерода, например винильная, аллильная или пропаргильная. Любая такая алкенильная или алкинильная группа предпочтительно является незамещенной, хотя, если это необходимо, она может быть замещена, например, галогеном. Любая из присутствующих циклоалкильных групп в молекуле предпочтительно имеет от 3 до 7 атомов углерода,особенно предпочтительны циклопентильная или циклогексильная группа. Они предпочтительно являются незамещенными. Любая из присутствующих арильных групп в молекуле предпочтительно представляет собой фенильную, которая желательно замещена одной или более алкильными, алкокси-, алкоксикарбонильными или алкилтиогруппами, содержащими от 1 до 4 атомов углерода (и которые в свою очередь сами могут быть замещенными), атомами галогена, циано-, аминосульфонильными или нитрогруппами; особенно предпочтительно, чтобы фенильная группа была замещена одним или более атомов хлора, брома или фтора, и/или одной или более метильными, метокси-, трифторметильными, метилтио-, метоксикарбонильными, этоксикарбонильными или нитрогруппами. Любая из гетероциклильных групп в молекуле, не являющаяся кольцом А, предпочтительно представляет собой фурил, тиенил или азотсодержащий гетероцикл, например 5- или 6-членное гетероциклическое кольцо, например пирролил, оксазолил, изоксазолил, изотиазолил, пиримидинил, триазолил или имидазолил. Заместитель R1 также может предпочтительно представлять собой пиридил, фурил, тиенил или бициклическую гетероциклильную группу, например триазолотриазолил, триазолопиримидинил или пиразолопиримидинил. Любая из бензогетероциклильных групп в молекуле предпочтительно представляет собой бензотиофеновую, бензодиоксолановую, хинолиновую, хиназолиновую, бензотиазольную или дигидробензофурановую группу. Любой из атомов галогена в молекуле предпочтительно представляет собой атом фтора, хлора или брома. Любая из замещенных аминогрупп в молекуле может быть моно- или дизамещенной, например, алкилами, содержащими от 1 до 4 атомов углерода, алкенилами, содержащими от 2 до 4 атомов углерода, карбамоильными или ацильными карбоксильными, алкоксикарбонильными, алкилкарбамоильными или диалкилкарбамоильными группами, в которых алкильная группа содержит от 1 до 4 атомов углерода. Используемое здесь понятие "ацил" подразумевает остаток карбоновой, сульфоновой или фосфорсодержащей кислот, например, группы алканоил, алкеноил, алкиноил, циклоалканоил, аралканоил, ароил, карбамоил, тиокарбамоил, алкоксикарбонил, сульфонил, сульфамоил и фосфонил, в которых любые алкильные, алкенильные, алкинильные или арильные группы могут быть замещенными или незамещенными. Особенно предпочтительны группы, в которых R1 может представлять собой метил, хлорметил, бромметил, цианометил, трифторметил или 2,2,2-трифторэтил. Заместитель R2 предпочтительно представляет собой атом водорода. Каждый из R3 и R4 предпочтительно представляет собой атом водорода, метил, метоксигруппу или атом хлора. Особенно предпочтительно, если заместители R 3 и R4 одинаковы и наиболее предпочтительно, когда оба из них представляют собой метоксигруппу. Кольцо A предпочтительно представляет собой бензольное (возможно, замещенное атомами фтора, хлора, брома, метильной, метокси- или этоксигруппами) или пиразольное (возможно, замещенное одной или более метильными группами). Заместитель Q предпочтительно представляет собой -CH2-, -CH(CH3)-, -S- или -O-. Предпочтительными солями соединений формулы I являются соли, образованные сильными основаниями, такими как соли щелочных металлов (например, калия или натрия), соли аминов (например, трифтиламина, диизопропиламина, циклогексиламина или пиперидина). Наиболее предпочтительными соединениями настоящего изобретения являются соединения, которые приведены ниже в Примерах. Другим объектом настоящего изобретения является способ получения сульфонамида формулы I, заключающийся во взаимодействии амина формулы: где заместители А, Q, Y и R2-R4 принимают описанные выше значения, с подходящим сульфоновым ангидридом формулы (R1SO2)2O или сульфонилгалогенидом формулы R1SO2Hal, где Hal является атомом галогена, а заместитель R1 принимает описанные выше значения, с образованием требуемого соединения. Реакция достаточно легко протекает в присутствии основания, например органического основания, такого как пиридин. В свою очередь соединения формулы II могут быть получены реакцией замещенного амина формулы: где A, Q и R2 принимают описанные выше значения, в присутствии основания с соединением формулы: где заместители Y, R3 и R4 принимают описанные выше значения, а заместитель L является уходящей группой, с образованием требуемого соединения. Уходящая группа L может быть любой подходящей для этого группой, однако предпочтительно она представляет собой атом галогена, особенно атом хлора, или метилсульфонильную группу. В качестве основания предпочтительно использовать алкиллитий, например трет.-бутиллитий, и реакцию желательно проводить в среде растворителя, например тетрагидрофурана. Соединения формулы II, в которых заместитель R2 представляет собой атом водорода, альтернативно могут быть получены восстановлением соответствующих нитросоединений формулы: где заместители А, Q, Y, R3 и R4 принимают описанные выше значения. Восстановление удобно осуществлять с помощью хлорида олова(II); альтернативный метод заключается в обработке железом в кислой среде, особенно предпочтительно в трифторуксусной кислоте и/или ее ангидриде, по методикам, которые сами по себе известны. По последней методике первоначально происходит превращение нитрогруппы в группу -NHCOCF3, которая затем превращается в аминогруппу действием основания, например карбоната калия. При необходимости соединения формулы II могут быть превращены в другие соединения формулы II известными методами. Например, соединения формулы II, в которых заместитель Х или X' представляет собой алкильную группу, могут быть получены из соответствующих соединений формулы II, в которых Q представляет собой -CH2-, а R2 - атом водорода, первоначально защитой аминогруппы, например, реакцией соединения с ди-трет.-бутилдикарбонатом, обработкой защищенного соединения алкилирующим агентом, например метилиодидом, в присутствии сильного основания, с последующим снятием защиты аминогруппы, например, трифторуксусной кислотой. В свою очередь соединения формулы V могут быть получены взаимодействием соединения формулы: где заместитель А принимает описанные выше значения, а Hal является атомом галогена, в присутствии основания с соединением, соответствующим формуле IV, в котором заместители R3 и R4 принимают описанные выше значения, а заместитель L представляет собой группу -OH, где заместитель Q принимает описанные выше значения. Альтернативно соединения формулы V могут быть получены реакцией нитросоединения формулы: где заместители A и Q принимают описанные выше значения, а заместитель L представляет собой уходящую группу (предпочтительно атом хлора или имидазол-I-ил), в присутствии основания с соединением формулы R3C(=NH)YHC(=NH)R4, где заместители Y, R3 и R4 принимают описанные выше значения. Предпочтительным основанием является диизопропилэтиламии. Соединения формулы II, где заместитель А представляет собой N-метилпиразольное кольцо, а заместитель R3 - атом водорода, альтернативно могут быть получены реакцией диметиламиноакрилонитрила формулы: где заместители Q, Y, R3 и R4 принимают описанные выше значения, с метилгидразином в уксусной кислоте с образованием целевого соединения. Исходные вещества в описанных выше процессах, в частности особенно соединения формул III, IV, VI, VII и VIII, являются либо известными соединениями, либо могут быть получены известными методами из родственных соединений, которые хорошо известны квалифицированным в этой области специалистам. Соли соединений формулы I могут быть получены известными методами обработкой соответствующих свободных соединений подходящим основанием в подходящем растворителе (например, в эфире). Соединения формулы I, в которых заместитель R2 отличен от атома водорода, альтернативно могут быть получены из солей соединений формулы I реакцией с подходящим алкилирующим или ацилирующим агентом, содержащим требуемую группу R2 , методами, аналогичными известным. Соединения формулы I обладают гербицидной активностью в отношении широкого спектра широколиственных и злаковых сорняков, но являются относительно безопасными для некоторых культур. Следовательно, они могут быть использованы в качестве селективных сербицидов, в частности, для уничтожения большого числа сорняков в посевах зерновых, сахарной свеклы или других культур, например пшеницы, ячменя, кукурузы, сои, масляничного рапса, хлопчатника или риса. Таким образом, еще одним объектом настоящего изобретения является способ уничтожения сорной растительности на участках, засоренных сорняками или на участках, на которых предполагается их появление, который заключается в обработке вышеуказанных участков эффективным количеством одного или более соединений формулы I. Желательными дозами применения соединений формулы I или их солей являются дозы в интервале от 0.001 до 2 кг/га, предпочтительно от 0.005 до 1 кг/га, более предпочтительно от 0.01 до 0.5 кг/га. Другим объектом настоящего изобретения являются препаративные формы, которые содержат одно или более соединений настоящего изобретения в смеси с приемлемым носителем и/или поверхностно-активным веществом. Препаративные формы обычно содержат 0.01 до 99 мас.% соединений настоящего изобретения и обычно первоначально готовятся в виде концентратов, содержащих от 0.5 до 99%, предпочтительно от 0.5 до 85% и более предпочтительно от 10 до 50 мас.% этих соединений. Такие концентраты разбавляются, если необходимо, перед обработкой участков так, чтобы содержание активного ингредиента в используемой рецептуре составляло от 0.01 до 5 мас.%. В качестве носителя может быть использована вода, в которой в некоторых случаях может содержаться органический растворитель, хотя обычно он не используется. Текучий суспензионный концентрат может быть получен путем измельчения соединения с водой, смачивателем и суспендирующим агентом, например с ксантановой смолой. В качестве носителя может быть использован несмешивающийся с водой органический растворитель, например углеводород, кипящий в интервале 130-270°C, например ксилол, в котором растворяется или суспендируется соединение настоящего изобретения. Также может быть получен эмульгирующийся концентрат, содержащий не смешивающийся с водой растворитель и поверхностно-активное вещество так, что концентрат действует как самоэмульгирующееся масло при смешении его с водой. В качестве носителя может быть использован и твердый продукт, который подвергается тонкому измельчению или гранулированию. Примерами приемлемых твердых носителей являются известняк, глины, песок, слюда, мел, аттапульгит, диатомит, перлит, сепиолит, кремнеземы, силикаты, лигносульфонаты и твердые удобрения. Носитель может быть природным или синтетическим материалом, или модифицированным природным продуктом. Смачивающиеся порошки, растворимые или диспергирующиеся в воде, также могут быть получены путем смешения соединения настоящего изобретения в форме частиц с носителем в форме частиц или при разбрызгивании расплавленного соединения на носитель в форме частиц, смешанный со смачивающим агентом и диспергирующим агентом и с последующим измельчением всей порошкообразной смеси. Аэрозольная препаративная форма может быть приготовлена путем смешения соединения настоящего изобретения с пропиллентом, например с полигалогенированными алканами, таким как дихлорфторметан, а также, при необходимости, с растворителем. Понятие "поверхностно-активное вещество" в широком смысле включает материалы, называемые эмульгирующими агентами, диспергирующими агентами и смачивающими агентами. Такие агенты хорошо известны в данной области. Используемые поверхностно-активные вещества могут быть анионными, например, такими как моно- или диэфиры фосфорной кислоты и этоксилированных жирных спиртов, или соли таких эфиров, сульфаты жирных спиртов, такой как додецилсульфат натрия, этоксилированные сульфаты жирных спиртов, этоксилированные сульфаты алкилфенола, лигнинсульфаты, нефтяные сульфонаты, алкиларилсульфонаты, такие как алкилбензолсульфонаты или низшие алкилнафталинсульфонаты, соли сульфированных продуктов конденсации нафталина с формальдегидом, или более сложные сульфонаты, такие как сульфонаты амидов, например сульфированный продукт конденсации олеиновой кислоты и N-метилтаурина или диалкилсульфосукцинаты, например натриевая соль сульфированного диоктилсукцината. Поверхностно-активные вещества могут также представлять собой неионные агенты, например продукты конденсации либо эфиров жирных кислот, жирных спиртов, амидов жирных кислот, либо алкилзамещенных фенолов с этиленоксидом, эфиры жирных кислот с простыми эфирами многоатомных спиртов, например сорбитановые эфиры жирных кислот, продукты конденсации таких эфиров с этиленоксидом, например полиоксиэтиленсорбитановые эфиры жирных кислот, блок-сополимеры этиленоксида и пропиленоксида, ацетиленовые гликоли, такие как 2,4,7,9-тетраметил-5-децин-4,7-диол, или этоксилированные ацетиленовые гликоли. Поверхностно-активные вещества также могут быть катионными агентами, например алкил- и/или арилзамещенными четвертичными аммониевыми соединениями, такими как цетилтриметиламмонийбромид, и этоксилированными жирными третичными аминами. Предпочтительными поверхностно-активными веществами являются этоксилированные сульфаты жирных спиртов, лигнинсульфонаты, алкиларилсульфонаты, соли сульфированных продуктов конденсации нафталина с формальдегидом, олеил-N-метилтаурид натрия, диалкилсульфосукцинаты, этоксилированные алкилфенолы и жирные алкилэтоксилаты. Активные соединения настоящего изобретения, особенно те, которые представлены в приведенных ниже Примерах, могут быть смешаны с другими пестицидами, например с другим гербицидом, фунгицидом или инсектицидом или с регулятором роста растений. Особенно предпочтительно использование другого гербицида. Приемлемыми дополнительными гербицидами являются триэтазин, линурон, МСРА, дихлорпроп, изоксабен, дифлувеникан, метолахлорн, фторметурон, оксифлуорфен, фомесафен, бентазон, прометрин, норфлуразон, хломазон, ЭПТК, имазаквин, более предпочтительно изопротурон, ментибензтиазурон, трифлуралин, иоксинил, бромоксинил, беназолин, мекопроп, флуроксипир, алахлор, ацифлуорфен, лактофен, метрибузин и пендиметалин, и наиболее предпочтительно этофумесат и фенмедифам. Соединения настоящего изобретения могут быть использованы для обработки растений, почвы, наземных и водных площадей и особенно участков, на которых растут культуры или на которых они должны будут выращиваться. Данные соединения обладают как довсходовой, так и послевсходовой активностью. Изобретение иллюстрируется следующими примерами. ПРИМЕР А ПРИМЕР А1 1,1,1-Трифтор-2'-(4,6-диметоксипиримидин-2-илметил)метансульфонанилид (а) 2-(4,6-Диметоксипиримидин-2-илметил)анилин Метод 1 К раствору о-толуидина (5.35 г) в сухом тетрагидрофуране (100 мл) при перемешивании и температуре -70°С в атмосфере азота добавляют по каплям н-бутиллитий (21 мл 2.5 М раствора в гексане). Полученной суспензии дают нагреться до 5°С, получая светло-желтый раствор. В реационную смесь барботируют сухой диоксид углерода в течение приблизительно 6 мин. Растворитель упаривают при перемешивании в высоком вакууме при комнатной температуре. Полученное белое твердое вещество суспендируют в сухом тетрагидрофуране и охлаждают до 70°С в атмосфере азота и по каплям в течение 15 мин добавляют трет.-бутиллитий (70 мл 1.6 М раствора в пентане). Смеси дают нагреться до -15°C и перемешивают при этой температуре в течение 75 мин. Смесь охлаждают до -70°C и добавляют по каплям раствор 4,6-диметокси-2-метилсульфонилпиримидина (10.9 г) в тетрагидрофуране. Смесь перемешивают при -75°C в течение 60 мин и оставляют на ночь при комнатной температуре. Растворитель упаривают в вакууме, к остатку в атмосфере азота при охлаждении водой со льдом добавляют 2 н. соляную кислоту. Затем добавляют 250 мл воды, полученный мутный раствор подщелачивают насыщенным раствором бикарбоната натрия и экстрагируют эфиром (2×400 мл). Объединенные экстракты промывают насыщенным раствором бикарбоната натрия, сушат и упаривают. Полученное оранжевое масло очищают хроматографированием, получают 2 г продукта в виде твердого вещества желтого цвета, т.пл. 82-84°C. Метод 2 (I) 4,6-Диметокси-2-(2-нитробензил)пиримидин К суспензии дихлоргидрата малонимидата (73.2 г) в метиленхлориде (400 мл) при -40°С в атмосфере азота при перемешивании добавляют по каплям диизопропилэтиламин (240 мл), перемешивают в течение 25 мин, получают суспензию A. К суспензии карбонилдиимидазола (53.3 г) в метиленхлориде (400 мл) при перемешивании при комнатной температуре порциями добавляют 2-нитрофенилуксусную кислоту (65.16 г). Полученный раствор перемешивают в течение 10 мин и в течение 30 мин при -40°C при перемешивании добавляют по каплям к суспензии А. Смесь перемешивают при -40°С в течение 45 мин и при комнатной температуре в течение ночи. Раствор промывают водой (400 мл), 2 н. HCl (400 мл) и насыщенным раствором бикарбоната натрия (400 мл), сушат и упаривают. Полученное твердое вещество оранжевого цвета перемешивают с 2-пропанолом (60 мл) в течение 10 мин и фильтруют. Фильтрат промывают 50 мл 2-пропанола и сушат, получают 32.6 г требуемого продукта в виде желтого твердого вещества, т.пл. 92-93°C. (II) 2-(4,6-Диметоксипиримидин-2-илметил)анилин К суспензии дигидрата хлорида олова(II) (133 г) в этаноле (300 мл) при перемешивании добавляют продукт со стадии (I). Смесь кипятят в течение 2 ч, выливают в воду со льдом (2500 мл) и экстрагируют этилацетатом (3×500 мл). Объединенные экстракты промывают насыщенным раствором хлорида натрия, сушат и упаривают, получают 24.3 г требуемого продукта в виде коричневого твердого вещества, т.пл. 82-84°С. (б) 1,1,1-Трифтор-2'-(4,6-диметоксипиримидин-2-илметил)-метансульфонанилид К раствору 2-(4,6-диметоксипиримидин-2-илметил)анилина (0.98 г) и пиридина (0.31 г) в сухом метиленхлориде (15 мл) при -70°C в атмосфере азота порциями добавляют трифторметансульфоновый ангидрид (1.12 г). Полученный оранжевый раствор перемешивают в течение 2 ч при -75°C и дают нагреться до комнатной температуры в течение 1 ч. Смесь промывают водой, сушат, получают красное масло, которое очищают хроматографированием и перекристаллизацией из петролейного эфира 60-80°, получают 0.4 г продукта в виде белого твердого вещества, т.пл. 99-100°C. ПРИМЕР А2 1,1,1-Трифтор-2'-[1-(4,6-диметоксипиримидин-2-ил)этил]метансульфонанилид (а) трет.-Бутил-[2-(4,6-диметоксипиримидин-2-илметил)фенил]карбамат Раствор продукта со стадии (а) Примера А1 (24.1 г) и ди-трет.-бутилдикарбоната (24 г) кипятят в сухом тетрагидрофуране (250 мл) в атмосфере азота в течение 4 ч. Растворитель упаривают, полученное коричневое масло кристаллизуют из гексана (200 мл), получают 28 г требуемого соединения в виде коричневого твердого вещества, т.пл. 98-100°C. (б) трет.-Бутил-[2-[1-(4,6-диметоксипиримидин-2-ил)этил]-фенил]карбамат Продукт с вышеописанной стадии (а) (1 г) растворяют в сухом тетрагидрофуране (20 мл) и в атмосфере азота добавляют тетраметилэтилендиамин (1.1 мл). Раствор охлаждают до -70°C и по каплям добавляют 1.7 М раствор трет.-бутиллития в пентане (4.3 мл). Затем смесь перемешивают при -20°C в течение 1 ч, охлаждают до -70°C и добавляют метилиодид (0.45 г). Реакционной смеси дают нагреться до 0°С и добавляют насыщенный раствор хлорида аммония (25 мл). Смесь экстрагируют тетрагидрофураном (3×50 мл), объединенные экстракты сушат и упаривают, полученное палево-коричневое твердое вещество растирают с гексаном, получают 0.73 г требуемого продукта, т.пл. 119-121°С. (в) 2-[1-(4,6-Диметоксипиримидин-2-ил)этил]анилин Продукт с вышеописанной стадии (б) (5.0 г) добавляют к трифторуксусной кислоте (25 мл) и полученный раствор перемешивают при комнатной температуре в течение 3 ч. Раствор упаривают, остаток растирают с диизопропиловым эфиром и охлаждают смесью сухой лед-ацетон. Твердое вещество отфильтровывают, промывают диизопропиловым эфиром, получают 3.5 г требуемого продукта, т.пл. 136-139°C. (г) 1,1,1-Трифтор-2'-[1-(4,6-диметоксипиримидин-2-ил)этил]-метансульфонанилид Названное соединение получают по методике, аналогичной описанной на стадии (б) Примера А1, используя в качестве исходного продукт с вышеописанной стадии (в), т.пл. 132-133°C. ПРИМЕР A3 1,1,1-Трифтор-2'-(4,6-диметокси-1,3,5-триазин-2-илметил)метансульфонанилид (а) 2,4-Диметокси-6-(2-нитробензил)-1,3,5-триазин К суспензии 2-нитрофенилуксусной кислоты (3.4 г) в метиленхлориде (30 мл) при перемешивании порциями добавляют карбонилдиимидазол (3.34 г) и перемешивают смесь при комнатной температуре в течение 30 мин. Полученный раствор красного цвета при перемешивании добавляют по каплям к суспензии цинковой соли диметилимидодикарбонимидата (3.0 г) в метиленхлориде (25 мл) при -35°C. Реакционную смесь перемешивают при комнатной температуре в течение ночи и выливают в воду (100 мл). Смесь экстрагируют метиленхлоридом (3×50 мл), объединенные экстракты сушат и упаривают. Полученное масло красного цвета растирают с эфиром, получают 1.41 г требуемого продукта в виде твердого вещества палево-коричневого цвета, т.пл. 91.6-92.3°C. (б) 1,1,1-Трифтор-2'-(4,6-диметокси-1,3,5-триазин-2-ил-метил)метансульфонанилид Названное соединение получают по методикам, аналогичным описанным в Примере А1(а), Метод 2(II) и А1(б), используя в качестве исходного продукт с вышеописанной стадии (А), т.пл. 101-108°C. ПРИМЕР А4 N-[3-(4,6-диметоксипиримидин-2-илметил)-2-пиридил]-1,1,1-трифторметансульфонамид (а) трет.-Бутил-(3-метил-2-пиридил)карбамат Раствор 2-амино-3-метилпиридина (20 г) и ди-трет.-бутилдикарбоната (46.8 мл) в сухом тетрагидрофуране кипятят в течение 3 ч и упаривают. Полученное темно-коричневое масло растворяют в этилацетате (400 мл), промывают 1 н. лимонной кислотой (3×200 мл) и насыщенным раствором хлорида натрия, сушат и упаривают. Полученный палево-желтый твердый остаток кристаллизуют из смеси гексан-диизопропиловый эфир (1:2), получают 6.5 г требуемого продукта в виде палево-желтого твердого вещества, т.пл. 135-137°С. (б) трет.-Бутил-[3-(4,6-диметоксипиримидин-2-илметил)-2-пиридил]-карбамат Продукт с вышеописанной стадии (а) (5 г) растворяют в сухом тетрагидрофуране (100 мл) и в атмосфере азота при -70°C добавляют по каплям трет.-бутиллитий (19.2 мл 2.5 М раствора в гептане). Смесь перемешивают при -70°C в течение 20 мин, затем при 5°C в течение 3 ч. Смесь охлаждают до -70°С, добавляют 4,6-диметокси-2-метилсульфонилпиримидин (5.42 г) и перемешивают при -70°С в течение 1 ч и при комнатной температуре в течение ночи. К смеси добавляют насыщенный раствор хлорида аммония (500 мл) и экстрагируют этилацетатом (2×100 мл). Объединенные экстракты промывают насыщенным раствором хлорида натрия (50 мл), сушат и упаривают. Полученное оранжевое масло растирают с гексаном, получают 5.35 г требуемого продукта в виде твердого вещества палево-желтого цвета, т.пл. 89-92°С. (в) N-[3-(4,6-диметоксипиримидин-2-илметил)-2-пиридил]-1,1,1-трифторметансульфонамид Названное соединение получают по методике, аналогичной описанной на стадии (б) Примера А1, используя в качестве исходного продукт с вышеописанной стадии (б), т. пл. 124-126°C. ПРИМЕРЫ А5-А17 Методами, аналогичными описанным выше в Примере А1, могут быть получены следующие соединения формулы Ia, где А представляет собой =CR5; заместитель Q представляет собой -CH2-; заместитель R2 представляет собой Н; В, D и Е принимают значение =CH-; а каждый из заместителей R3 и R4 представляет собой метоксигруппу: ПримерY R5R 1Т.пл. (°С) А5CHН CH2CN116-117 А6CH ClCH2CN 162-163А7 CHClCF 3113-115 А8CHF CH2CN162-163 А9CH FCF3 100-102А10 CHMeCH 2CN A11CHMe CF3 А12N FCH2CN orange oilА13 NFCF 3 А14NMe CH2CN А15N MeCF3 А16 NClCH 2CN31 А17NCl CF3orange oilПРИМЕРЫ А18-А20 Методами, аналогичными описанным выше в Примере А1, могут быть получены следующие соединения формулы Ia, где А представляет собой атом азота; заместитель Q представляет собой -CH2-; заместитель R2 представляет собой Н; В, D и Е принимают значение =CH-; а каждый из заместителей R3 и R4 представляет собой метоксигруппу: ПримерY R1А18 CHCH2 CNА19N CH2CN А20NCF 3ПРИМЕРЫ А21-А68 Описанными выше методами могут быть получены следующие соединения формулы 1а, где заместитель R 2 представляет собой атом водорода; каждый из заместителей R3 и R4 представляет собой метоксигруппу, а заместитель представляет собой -CH-: ExY R1А ВDЕ A21СН CF3N NСНСН A22СН CF3N СНNСН A23СН CF3N СНСНN A24СН CF3СН NNСН A25СН CF3СН NСНN A26СН CF3СН СНNN A27СН CF3CCl NNСН A28СН CF3CCl NСНN A29СН CF3CCl СНNN A30СН CF3CF NNСН A31СН CF3CF NСНN A32СН CF3CF СНNN А33СН СН2CNN NСНСН A34СН СН2CNN СНNСН A35СН CH2CNN СНСНN A36СН СН2CNСН NNСН A37СН СН2CNСН NСНN A38СН CH2CNСН СНNN A39СН СН2CNCCl NNСН А40СН СН2CNCCl NСНN А41СН CH2CNCCl СНNN А42СН СН2CNCF NNСН А43СН СН2CNCF NСНN А44СН CH2CNCF СНNN А45N CF3N NСНСН А46N CF3N СНNСН А47N CF3N СНСНN А48N CF3СН NNСН А49N CF3СН NСНN А50N CF3СН СНNN продолжение A51NCF 3CClN NCHA52 NCF3 CClN CHNА53 NCF3 CClCH NNA54 NCF3 CFN NCHA55 NCF3 CFN CHNA56 NCF3 CFCH NNA57 NCH2 CNNN CHCHA58 NCH2 CNNCH NCHA59 NCH2 CNNCH CHNA60 NCH2 CNCHN NCHA61 NCH2 CNCHN CHNA62 NCH2 CNCHCH NNA63 NCH2 CNCClN NCHA64 NCH2 CNCClN CHNA65 NCH2 CNCClCH NNA66 NСН2 СНCFN NCHA67 NCH2 CNCFN CHNA68 NCH2 CNCFCH NNПРИМЕРЫ А69-А125 Описанными выше методами могут быть получены следующие соединения формулы Ia, где заместитель R2 представляет собой Н; каждый из заместителей R 3 и R4 представляет собой метоксигруппу; А представляет собой =CR5; а заместитель Q представляет собой -CH 2-: ExY R1R 5BD EМ Pt (°C) А69СН CF3Н NСНСН А70СН CF3Н СНNСН А71СН CF3Н СНСНN А72СН CF3Cl NСНСН А73СН CF3Cl СНNСН А74СН CF3Cl СНСНN А75СН CF3F NСНСН А76СН CF3F СНNСН А77СН CF3F СНСНN А78СН CH2CNН NСНСН А79СН CH2CNН СНNСН А80СН СН2CNН СНСНN продолжение А81СНCH 2CNClN CHCH А82 СНCH2CN ClCHN CH А83 СНCH 2CNClCH CHN А84 СНCH2CN FNCH CH А85 СНCH 2CNFCH NCH А86 СНCH2CN FCHCH N А87 NCF 3HN CHCH А88N CF3H CHNCH А89 NCF3 HCHCH N А90 NCF 3ClN CHCH А91N CF3Cl CHNCH А92 NCF3 ClCHCH N А93 NCF 3FN CHCH А94N CF3F CHNCH А95 NCF3 FCHCH N А96 NCH 2CNHN CHCH А97N CH2CNH CHNCH А98 NCH2CN HCHCH N А99 NCH 2CNClN CHCH А100 NCH2CN ClCHN CH А101 NCH 2CNClCH CHN А102 NCH2CN FNCH CH А103 NCH 2CNFCH NCH А104 NCH2CN FCHCH N А105 СНCH 2CNHCH CClCH 175-176А106 СНCH2CN HCHCF CH110-111 А107СНCF 3HCH CFCH112-114 А108СН CF3H CHCBrCH 87-88А109 СНCH2CN FCHCF CH185-186 А110NCH 2CNHCH CHCH 186-188А111 СНCF3 FCHCF CH106-107 А112СНCH 2ClFCH CFCH 140-141А113 СНMeF CHCFCH 173-174А114 СНCH2CN ClCHCCl CH211-214 А115СНCH 2CNFCH CMeCH 178-181 продолжение А116СНСН 2ClClCH CHCH 142-143А117 NCH2CN ClCHCCl CHyellow oil А118СНCH 2CNFCH C(OMe)CH 161-163А119 СНCH2CN OMeCHCF CH189-190 А120СНСН 2CNFCH C(OEt)CH 115-116А121 NCH2Cl FCHCH CH141-142 А122СНCH 2ClFCH CHCH 138-139А123 СНCH2Br FCHCH CH137-138 А124СНCH 2CF3F CHCHCH 141-142А125 СНСН2CF 3ClCH CHCH153-154ПРИМЕРЫ А126-А127 Описанными выше методами могут быть получены следующие соединения формулы Ia, где заместитель R2 представляет собой Н; каждый из заместителей R 3 и R4 представляет собой метоксигруппу; А представляет собой =CR5; а заместитель Q представляет собой -CHMe-: ПримерY R1R 5BD ЕТ.пл. (°С) А126CHCH 2CNHCH CHCH 133-135А127 CHCH2CN ClСНCH CH133-135ПРИМЕР Б ПРИМЕР Б1 N-[3-(4,6-Диметоксипиримидин-2-илтио)-1,5-диметил-1Н-пиразол-4-ил]-1,1,1-трифторметансульфонамид и N-[5-(4,6-диметоксипиримидин-2-илтио)-1,3-диметил-1Н-пиразол-4-ил]-1,1,1-трифторметансульфонамид (а) 5-(4,6-диметоксипиримидин-2-илтио)-3-метил-4-нитро-1H-пиразол К раствору 4,6-диметокси-2-меркаптопиримидина (4.65 г) в водном растворе гидроксида калия (1,7 г в 75 мл воды) по каплям добавляют раствор 1,4-динитро-3-метилпиразола (4.65 г), растворенного в минимальном количестве этанола. Реакция протекает экзотермично и по ее окончании смесь перемешивают в течение 45 мин. Выпавший осадок отфильтровывают, промывают свежей водой, сушат, получают 6.3 г требуемого продукта, т.пл. 175-176°С. (б) 5-(4,6-Диметоксипиримидин-2-илтио)-1,3-диметил-4-нитро-1H-пиразол и 3-(4,6-диметоксипиримидин-2-илтио)-1,5-диметил-4-нитро-1Н-пиразол К смеси 60%-ной суспензии гидрида натрия (0.47 г) и сухого диметилформамида (20 мл) при перемешивании и охлаждении на ледяной бане порциями добавляют продукт с вышеописанной стадии (а) (3.15 г). По окончании добавления смесь перемешивают в течение 10 мин при комнатной температуре и добавляют по каплям метилиодид (1.7 г). Смесь перемешивают при комнатной температуре в течение 2.5 ч, выливают воду со льдом (50 мл), экстрагируют этилацетатом (3×50 мл), объединенные экстракты промывают водой и сушат сульфатом магния. Фильтрацией и последующим упариванием выделяют сырой продукт в виде масла. Сырой продукт подвергают быстрой хроматографии на силикагеле (элюент этилацетат-петролейный эфир 40-60°, 1:1) и выделяют два новых продукта. Упариванием фракций, содержащих чистые вещества, выделяют два различных твердых продукта. По результатам тонкослойной хроматографии (ТСХ) на силикагелевых пластинках (элюент этилацетат-петролейный эфир 40-60°, 1:1) один продукт имеет Rf около 0,75 (по-видимому, 5-(4,6-диметоксипиримидин-2-илтио)-1,3-диметил-4-нитро-1Н-пиразол), а другой - Rf около 0,3 (по-видимому, 3-(4,6-диметоксипиримидин-2-илтио)-1,5-диметил-4-нитро-1Н-пиразол). Выход продукта с Rf 0,75 составляет 1.3 г, т.пл. 124-125°C. Выход продукта с Rf 0,3 составляет 0.82 г, т.пл. 155-156°C. (в) 3-(4,6-Диметоксипиримидин-2-илтио)-1,5-диметил-1H-пиразол-4-амин и 5-(4,6-диметоксипиримидин-2-илтио)-1,3-диметил-1H-пиразол-4-амин Смесь продукта со стадии (б) (Rf 0,3) (2,4 г) и дигидрата хлорида олова(II) (8,7 г) в этаноле (100 мл) перемешивают при кипячении в течение 4 ч. Этанол упаривают в вакууме, остаток перемешивают с водой (100 мл) и подщелачивают твердым бикарбонатом натрия. Добавляют этилацетат (100 мл), полученную эмульсию фильтруют через кизельгуровую прокладку и органический слой отделяют. Осадок промывают этилацетатом (общим количеством 75 мл), а водный слой экстрагируют этилацетатом (2×50 мл). Объединенные органические слои промывают водой (50 мл), отделяют и сушат сульфатом магния. После упаривания этилацетата остается масло, которое кристаллизуется. Сырой продукт очищают быстрой хроматографией на силикагеле (элюент этилацетат), выделяют новый продукт с Rf 0.3 (ТСХ на силикагеле, элюент этилацетат). Упариванием фракций, содержащих чистый новый продукт, получают 1.33 г твердого вещества с т.пл. 104-105°C. Аналогичным методом получают другой изомер, выход 2.6 г, т.пл. 74-75°C. (г) N-[3-(4,6-Диметоксипиридин-2-илтио)-1,5-диметил-1H-пиразол-4-ил]-1,1,1-трифторметансульфонамид (Б1а) и N-[5-(4,6-диметоксипиримидин-2-илтио)-1,3-диметил-1Н-пиразол-4-ил]1,1,1-трифторметансульфонамид (Б1б) К раствору аминопиразола с вышеописанной стадии (в) (Rf 0.3, 1.2 г) в сухом метиленхлориде (30 мл) при перемешивании и при -60°С (охлаждение на бане сухой лед-ацетон) добавляют по каплям раствор трифторметансульфонового ангидрида (1.2 г) в сухом метиленхлориде (10 мл). По окончании добавления температуру смеси медленно доводят до комнатной и перемешивают в течение ночи. Полученный темно-красный раствор разбавляют 100 мл свежего метиленхлорида, промывают водой (25 мл), 1 М HCl (25 мл) и водой (25 мл). Слои разделяют, органический слой сушат сульфатом магния, фильтруют, упаривают, получают полутвердое темно-красное вещество. Быстрой хроматографией на силикагеле (элюент этилацетат-петролейный эфир 40-60°, 1:1) выделяют новый продукт с Rf 0.5 (ТСХ на силикагелевых пластинках, элюент этилацетат-петролейный эфир 40-60°, 1:1). Фракции, содержащие чистый новый продукт, упаривают, получают требуемый продукт (Б1а) в виде белого твердого вещества. Выход 0.83 г, т.пл. 203-204°C. Аналогичным методом получают другой изомер (Б1б), выход 1.8 г, т.пл. 145-146°C. ПРИМЕР Б2 1-Циано-N-[3-(4,6-диметоксипиримидин-2-илтио)-1,5-диметил-1Н-пиразол-4-ил]-1,1,1-трифторметансульфонамид (Б2а) и 1-циано-N-[5-(4,6-диметоксипиримидин-2-илтио)-1,3-диметил-1H-пиразол-4-ил]-1,1,1-трифторметансульфонамид (Б2б) Аминопиразол со стадии (с) Примера Б1 (Rf 0,3, 0,8 г) растворяют в сухом метиленхлориде (10 мл) и при перемешивании добавляют сухой пиридин (0.23 г). Смесь охлаждают до -78°C (на бане сухой лед-ацетон) и порциями добавляют цианометансульфонилхлорид (0,4 г, 0,00285 моля). Смеси дают медленно нагреться до комнатной температуры и перемешивают в течение 2 дней. Затем смесь разбавляют этилацетатом до 100 мл и промывают водой, 1 М HCl, снова водой и разделяют слои. Органический слой фильтруют, сушат сульфатом магния, фильтруют и упаривают. Остаток подвергают быстрой хроматографии на силикагеле (элюент диэтиловый эфир), получают новый продукт с Rf 0,4 (приблизительно) (ТСХ на силикагеле, элюент диэтиловый эфир). Фракции с чистым продуктом объединяют, упаривают, получают требуемый продукт (Б2а) в виде твердого вещества желтого цвета (700 мг), т.пл. 166-167°С. Аналогичным методом получают другой изомер (Б2б) в виде твердого вещества, выход 1,6 г. ПРИМЕР Б3 1-Циано-N-[4-(4,6-диметоксипиримидин-2-илтио)-1-метил-1H-пиразол-5-ил]метансульфонамид (Б3а) и 1-циано-N-[4-(4,6-диметоксипиримидин-2-илтио)-1-метил-1H-пиразол-3-ил]метансульфонамид (Б3б) (а) 2-(4,6-Диметоксипиримидин-2-илтио)-3-(диметиламино)-акрилонитрил Смесь диметилацеталя диметилформамида (5.8 г) и 2-(4,6-диметоксипиримидин-2-илтио)ацетонитрила (5.1 г) перемешивают при 100°С на масляной бане в течение 5 ч и оставляют на ночь при комнатной температуре. Сырой твердый продукт растирают с диизопропиловым эфиром, получают требуемый продукт в виде твердого вещества желтого цвета с выходом 5.4 г. (б) 4-(4,6-Диметоксипиримидин-2-илтио)-1-метилпиразол-3-амин и 4-(4,6-диметоксипиримидин-2-илтио)-1-метилпиразол-5-амин К смеси продукта с вышеописанной стадии (а) (2,6 г) и ледяной уксусной кислоты (10 мл) добавляют по каплям метилгидразин (1,0 г), нагревают на масляной бане до 100°C и выдерживают в течение 3 часов. Смеси дают охладиться и выливают в воду (100 мл). Затем смесь нейтрализуют твердым бикарбонатом натрия и экстрагируют этилацетатом (3×75 мл). Объединенные органические слои промывают водой (30 мл), отделяют, сушат сульфатом магния, фильтруют и упаривают. Полученное масло подвергают быстрой хроматографии на силикагеле (элюент - чистый этилацетат), получают главным образом один продукт (Rf 0.3, ТСХ на силикагеле, элюент этилацетат). Фракции с чистым продуктом объединяют, упаривают, получают не совсем белый продукт с выходом 2.2 г. Спектр 1Н ЯМР указывает, что он представляет собой 50/50 смесь двух возможных изомерных продуктов. Полученные изомеры были разделены с помощью препаративной жидкостной хроматографией высокого давления. Упариванием фракций, содержащих отдельные чистые изомеры, получают оба продукта в виде бесцветных кристаллов. Один из полученных продуктов (А) выделен с выходом 480 мг, т.пл. 110-111°C (по видимому, 4-(4,6-диметоксипиримидин-2-илтио)-1-метилпиразол-5-амин). Другой продукт (Б) (по-видимому, 4-(4,6-диметоксипиримидин-2-илтио)-1-метилпиразол-3-амин), выделен с выходом 800 мг, т.пл. 160-161°C. (в) 1-Циано-N-[4-(4,6-диметоксипиримидин-2-илтио)-1-метил-1H-пиразол-5-ил]метансульфонамид и 1-циано-N-[4-(4,6-диметоксипиримидин-2-илтио)-1-метил-1Н-пиразол-3-ил] метансульфонамид Раствор пиразола (А) с вышеописанной стадии (б) (475 мг) в метиленхлориде (10 мл) охлаждают до -78°C (на бане сухой лед-ацетон) и при перемешивании добавляют пиридин (0,15 мл). С помощью шприца добавляют по каплям раствор цианометансульфохлорида (250 мл) в метиленхлориде (1 мл), затем дают медленно нагреться до комнатной температуры и перемешивают в течение ночи. Смесь разбавляют этилацетатом до 100 мл, промывают водой (30 мл), разбавленной соляной кислотой (2×30 мл) и насыщенным раствором хлорида натрия (30 мл). Органический слой отделяют, сушат сульфатом магния, фильтруют, упаривают, получают не совсем белый твердый продукт (по-видимому, 1-циано-N-[4-(4,6-диметоксипиримидин-2-илтио)-1-метил-1Н-пиразол-5-ил]метансульфонамид) (Б3а). После перекристаллизации из этанола выделяют 350 мг продукта, т.пл. 206-207°C. Другой изомер (Б3б) получают аналогичным методом, используя в качестве исходного пиразол (Б) с вышеописанной стадии (б), выход 650 мг, т.пл. 147-148°C. ПРИМЕР Б4 N-[3-(4,6-Диметокси-1,3,5-триазин-2-ил)-1,5-диметил-1Н-пиразол-4-ил]-1,1,1-трифторметансульфонамид (а) Диэтил-(5-метил-4-нитропиразол-3-ил)малонат К смеси 60%-ной суспензии гидрида натрия (2.3 г) в сухом тетрагидрофуране (100 мл) при перемешивании и охлаждении на ледяной бане добавляют по каплям диэтилмалонат (9.4 г), перемешивают в течение 10 мин, после чего небольшими порциями в течение 10 мин добавляют 1,5-динитро-3-метилпиразол (5.0 г), поддерживая температуру 10-12°C. Смесь перемешивают при комнатной температуре в течение 30 мин и в течение приблизительно 5 мин добавляют по каплям ледяную уксусную кислоту (3 мл). Смесь разбавляют этилацетатом (400 мл), промывают водой (2×30 мл), органический слой отделяют, сушат сульфатом магния, фильтруют и упаривают. Остаток представляет собой масло, которое кристаллизуется при растирании с перролейным эфиром 60-80°С. Получают 7,5 г требуемого продукта в виде палево-желтого твердого вещества, т.пл. 100-102°С. (б) (5-Метил-4-нитропиразол-3-ил)уксусная кислота Смесь гидроксида калия (5.9 г), продукта предыдущей стадии (7.5 г) и 50%-ного водного этанола (100 мл) кипятят при перемешивании в течение 1.5 часа, дают охладиться, упаривают почти досуха, разбавляют водой (100 мл) и подкисляют концентрированной соляной кислотой. Полученную смесь нагревают до приблизительно 80°C в течение 0,5 часа, охлаждают и упаривают досуха. Остаток обрабатывают этилацетатом (100 мл), промывают водой (2×20 мл), органический слой отделяют, сушат сульфатом магния, фильтруют и упаривают. Получают 3.85 г требуемого продукта в виде твердого вещества желтого цвета. (в) Метил-(5-метил-4-нитропиразол-3-ил)ацетат Продукт с предыдущей стадии (3.85 г) растворяют в метаноле (75 мл), содержащем несколько капель концентрированной серной кислоты. Полученную смесь кипятят при перемешивании в течение 2 ч и дают охладиться. Метанол упаривают в вакууме, остаток растворяют в этилацетате, промывают водой, органический слой отделяют, сушат сульфатом магния, фильтруют и упаривают. Получают 4.0 г требуемого продукта в виде твердого вещества кремового цвета, т.пл. 132-133°C. (г) Метил (1,5-диметил-4-нитро-1Н-пиразол-3-ил)ацетат и метил (1,3-диметил-4-нитро-1Н-пиразол-5-ил)ацетат К смеси карбоната калия (2.5 г) и диметилформамида (30 мл) при перемешивании добавляют продукт с предыдущей стадии (3.3 г), в одну порцию добавляют метилиодид (2.6 г), при этом наблюдается умеренно экзотермическая реакция. Смесь перемешивают в течение ночи при комнатной температуре, разбавляют 100 мл воды и экстрагируют диэтиловым эфиром (4×50 мл). Объединенные экстракты промывают водой (30 мл), отделяют, сушат сульфатом магния, фильтруют и упаривают. Получают 3.2 г требуемой изомерной смеси продуктов в виде маслянистого твердого вещества. (д) (1,5-Диметил-4-нитро-1H-пиразол-3-ил)уксусная кислота и (1,3-диметил-4-нитро-1Н-пиразол-5-ил)уксусная кислота К раствору продукта с предыдущей стадии (3.2 г) в этаноле (25 мл) при перемешивании добавляют раствор гидроксида калия (1.7 г) в воде (25 мл) и кипятят при перемешивании в течение 3 ч. Смесь упаривают почти досуха, разбавляют 50 мл воды, подкисляют концентрированной соляной кислотой и упаривают. Остаток растворяют в этилацетате, промывают водой, сушат сульфатом магния, фильтруют и упаривают. Получают 3.2 г требуемой изомерной смеси продуктов в виде твердого вещества оранжевого цвета. (е) 2-(1,3-Диметил-4-нитро-1H-пиразол-5-илметил)-4,6-диметокси-1,3,5-триазин и 2-(1,5-диметил-4-нитро-1Н-пиразол-3-илметил)-4,6-диметокси-1,3,5-триазин Продукт с предыдущей стадии (2.56 г) растворяют в метиленхлориде (50 мл) в атмосфере азота, которую поддерживают в течение всех последующих операций. К смеси добавляют карбонилдиимидазол (2.0 г) и перемешивают в течение 30 мин. Полученную смесь при перемешивании добавляют по каплям к суспензии цинковой соли диметилимидодикарбонимидата (2.1 г) в метиленхлориде (25 мл) при -35°C. Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение ночи. К смеси добавляют воду (50 мл) и метиленхлорид (50 мл), фильтруют через кизельгур, слои разделяют, водный слой экстрагируют метиленхлоридом (3×30 мл). Объединенные органические слои промывают водой, сушат сульфатом магния, упаривают, получают 3,8 г сырого продукта. Быстрой хроматографией на силикагеле (элюент этилацетат) получают два новых продукта, имеющих Rf 0,6 и приблизительно 0,4. Фракции, содержащие продукты, упаривают и получают: Rf 0.6: 1.0 г 2-(1,3-диметил-4-нитро-1Н-пиразол-5-илметил)-4,6-диметокси-1,3,5-триазин в виде кристаллического твердого вещества и Rf 0.4: 1.0 г 2-(1,5-диметил-4-нитро-1Н-пиразол-3-илметил)-4,6-диметокси-1,3,5-триазин, т.пл. 145°C. (ж) 2-(4-Амино-1,5-диметил-4-нитро-1H-пиразол-3-илметил)-4,6-диметокси-1,3,5-триазин К суспензии 10%-ного палладия на угле (приблизительно 10 мг) в воде (5 мл) добавляют раствор боргидрида натрия (0.13 мл) в воде (5 мл). Через смесь пропускают азот и в течение 5 мин по каплям добавляют раствор продукта с предыдущей стадии с Rf 0.4 (0.5 г) в метаноле (30 мл). Смесь выдерживают при комнатной температуре в течение 30 мин, после чего добавляют уксусную кислоту (1 мл). Смесь фильтруют через кизельгур, промывают метанолом и упаривают почти досуха. Остаток разбавляют 15 мл воды, нейтрализуют твердым бикарбонатом натрия, экстрагируют этилацетатом (3×30 мл), сушат сульфатом магния, фильтруют и упаривают. Получают 400 мг требуемого продукта в виде вязкого оранжевого масла. (з) N-[3-(4,6-Диметокси-1,3,5-триазин-2-ил)-1,5-диметил-1Н-пиразол-4-ил]-1,1,1-трифторметансульфонамид К раствору продукта с предыдущей стадии (0.4 г) и пиридина (0.13 мл) в метиленхлориде (15 мл) при перемешивании при -60°С медленно по каплям добавляют раствор трифторметансульфонового ангидрида (0.43 г) в метиленхлориде (5 мл). Смеси дают медленно нагреться до комнатной температуры и перемешивают еще 24 ч. Затем смесь промывают водой (10 мл), отделяют, сушат сульфатом магния, фильтруют и упаривают. Получают 100 мг требуемого продукта в виде палево-желтого вязкого масла. ПРИМЕР Б5 1-Циано-N-[5-(4,6-диметоксипиримидин-2-илтио)-1,2-диметил-1Н-имидазол-4-ил]металсульфонамид (а) 1,2-Диметил-4-бром-5-нитро-1Н-имидазол и 1,2-диметил-5-бром-4-нитро-1H-имидазол 2-Метил-4-бром-5-нитроимидазол (35 г) растворяют в водном растворе гидроксида натрия (7 г). При комнатной температуре по каплям добавляют диметилсульфат (21.3 г) и реакционную смесь перемешивают в течение 2 ч. Выпавший осадок отфильтровывают, промывают водой, сушат, получают 33 г смеси изомеров, которые разделяют хроматографированием (элюент петролейный эфир 60-80° - этилацетат, 8:2). Выделяют 9.4 г 1,2-диметил-4-бром-5-нитро-1Н-имидазола, т.пл. 98-99°C и 19.3 г 1,2-диметил-5-бром-4-нитро-1Н-имидазола, т.пл. 160-162°C. (б) 5-(4,6-Диметоксипиримидин-2-илтио)-1,2-диметил-4-нитро-1H-имидазол К раствору 4,6-диметокси-2-меркаптопиримидина (3.0 г) в водном растворе гидроксида натрия (0.7 г в 100 мл воды) по каплям добавляют раствор 1,2-диметил-5-бром-4-нитро-1H-имидазола (3.9 г) в этаноле (50 мл) и смесь перемешивают при комнатной температуре в течение 6 ч. Выделившийся осадок отфильтровывают, промывают водой, сушат и перекристаллизовывают из ацетонитрила. Получают 3.1 г требуемого продукта, т.пл. 228-230°C. (в) 2,2,2-Трифтор-N-[5-(4,6-диметоксипиримидин-2-илтио)-1,2-диметил-1Н-имидазол-4-ил]ацетамид Смесь продукта с предыдущей стадии (7.0 г), трифторуксусной кислоты (130 мл), трифторуксусного ангидрида (18 мл) и железного порошка (5.0 г) нагревают при перемешивании до 70°C и выдерживают при этой температуре в течение 8 ч. Смесь фильтруют, фильтрат выливают на воду со льдом, подщелачивают 5 н. раствором гидроксида натрия и экстрагируют этилацетатом. Объединенные экстракты сушат сульфатом магния, растворитель упаривают, остаток очищают хроматографированием (элюент петролейный эфир 60-80° - этилацетат, 8:2), получают 5.0 г требуемого продукта, т.пл. 160-162°C. (г) 5-(4,6-диметоксипиримидин-2-илтио)-1,2-диметил-1Н-имидазол-4-амин К раствору продукта с предыдущей стадии (5.4 г) в метаноле (200 мл) добавляют карбонат калия (1.5 г) и реакционную смесь кипятят в течение 6 ч. Смесь фильтруют, фильтрат упаривают, остаток перекристаллизовывают из ацетонитрила, получают 2.6 г требуемого продукта. (д) 1-Циано-N-[5-(4,6-диметоксипиримидин-2-илтио)-1,2-диметил-1Н-имидазол-4-ил]метансульфонамид К раствору продукта с предыдущей стадии (1.0 г) в метиленхлориде (10 мл) добавляют пиридин (0.3 г), охлаждают до -45°C и в одну порцию добавляют цианометилсульфонилхлорид (0.5 г). Смесь перемешивают при -45°C в течение 30 мин, дают нагреться до комнатной температуры и перемешивают в течение ночи при комнатной температуре. Затем смесь выливают в воду, экстрагируют этилацетатом и очищают хроматографированием (элюент петролейный эфир 60-80° - этилацетат, 8:2), получают 0.7 г требуемого продукта, т.пл. 223-225°C. ПРИМЕР Б6 1-Циано-N-[2-(4,6-димитоксипиримидин-2-илтио)-3-тиенил]-метансульфонамид (а) 4,6-Диметокси-2-(3-нитро-2-тиенилтио)пиримидин К раствору гидроксида натрия (1.2 г) в воде (50 мл) добавляют 4,6-диметокси-2-меркаптопиримидин (5.3 г) и смесь перемешивают при комнатной температуре в течение 15 мин. К смеси добавляют раствор 2-хлор-3-нитротиофена (5.0 г) в этаноле (50 мл), перемешивают при комнатной температуре в течение 6 часов, выпавший осадок отфильтровывают, промывают водой, сушат, получают 7.6 г требуемого продукта, т.пл. 199-201°C. (б) N-[2-(4,6-Диметоксипиримидин-2-илтио)-3-тиенил]-2,2,2-трифторацетамид Смесь продукта с предыдущей стадии (2.0 г), трифторуксусной кислоты (50 мл), трифторуксусного ангидрида (5.0 мл) и железного порошка (1.8 г) нагревают при перемешивании до 70°C и выдерживают при этой температуре в течение 8 ч. Смесь фильтруют, фильтрат выливают в воду со льдом, подщелачивают 5 н. раствором гидроксида натрия, экстрагируют этилацетатом, сушат сульфатом магния и упаривают до небольшого объема. Продукт кристаллизуется, давая 1.2 г требуемого продукта, т.пл. 88-90°C. (в) 2-(4,6-Диметоксипиримидин-2-илтио)тиофен-3-амин К раствору продукта с предыдущей стадии (2.2 г) в метаноле (30 мл) добавляют карбонат калия (1.0 г), реакционную смесь нагревают при перемешивании до 40°С и выдерживают при этой температуре в течение 6 ч. Смесь охлаждают, фильтруют, фильтрат упаривают, остаток очищают хроматографированием (элюент петролейный эфир 60-80° - этилацетат, 8:2), получают 1.0 г требуемого продукта в виде оранжевого масла. (г) 1-Циано-N-[2-(4,6-диметоксипиримидин-2-илтио)-3-тиенил]метансульфонамид Раствор продукта с предыдущей стадии (1.2 г) и пиридина (1.0 мл) в метиленхлориде (10 мл) охлаждают до -78°C и при перемешивании по каплям добавляют раствор цианометилсульфонилхлорида (0.6 г) в метиленхлориде (5 мл), поддерживая температуру в интервале от -78 до -60°С. Смесь перемешивают при -78°С в течение 15 мин, дают нагреться до комнатной температуры и перемешивают в течение 16 ч. Затем смесь выливают в воду и экстрагируют метиленхлоридом. Объединенные экстракты сушат сульфатом магния, растворитель упаривают. Твердый остаток очищают хроматографированием (элюент петролейный эфир 60 - 80° - этилацетат, 8:2), получают 0.4 г требуемого продукта, т.пл. 118-120°C. ПРИМЕР Б7 N-[2-(4,6-Диметоксипиримидин-2-илтио)-3-тиенил]-1,1,1-трифторметансульфонамид Раствор продукта со стадии (в) Примера Б6 (1.0 г) и пиридина (0.6 мл) в метиленхлориде (25 мл) охлаждают до -78°C и при перемешивании по каплям добавляют раствор трифторметансульфонового ангидрида (1.1 г) в метиленхлориде (5 мл), поддерживая температуру в интервале от -78 до -60°C. Смесь перемешивают при -78°С в течение 15 мин, дают нагреться до комнатной температуры и перемешивают в течение ночи при комнатной температуре. Затем смесь выливают в воду, экстрагируют метиленхлоридом. Объединенные экстракты сушат сульфатом магния, растворитель упаривают. Твердый остаток очищают хроматографированием (элюент петролейный эфир 60-80° - этилацетат, 8:2), получают требуемый продукт (Б7а), т.пл. 103-104°C, а также соответствующее соединение, где заместитель R2 представляет собой -SO2CF3 (R7б), т.пл. 136-138°С. ПРИМЕР Б8 Описанными выше методами могут быть получены следующие соединения формулы 16, где заместитель R2 представляет собой атом водорода; каждый из заместителей R3 и R4 представляет собой метоксигруппу, а заместитель Q представляет собой -CH2-: YА ВDR 1CH SСНCH CF3СН N(Me)СН CHCF3 СНS СНNCF 3СН SNCH CF3СН N(Me)СН NCF3 СНN(Me) NCHCF 3СН СНSCH CF3СН СНN(Me) CHCF3 СНСН N(Me)CHCF 3СН СНSN CF3СН NS CHCF3 СНN N(Me)CHCF 3СН CClSCH CF3СН CClN(Me) NCF3 СНCCl SNCF 3СН CClN(Me)N CF3СН CFS CHCF3 продолжение CHCFN(Me) NCF3 CHCF SNCF 3CH CFN(Me)N CF3CH CHCH SCF3 CHCH CHN(Me)CF 3CH NCHS CF3CH CHN SCF3 CHCH NN(Me)CF 3CH NCHN(Me) CF3CH CClCH SCF3 CHCCl CHN(Me)CF 3CH CClNS CF3CH CClN N(Me)CF3 CHCF CHSCF 3CH CFCHN(Me) CF3CH CFN SCF3 CHCF NN(Me)CF 3N SCHCH CF3N N(Me)CH CHCF3 NS CHNCF 3N SNCH CF3N N(Me)CH NCF3 NN(Me) NCHCF 3N CHSCH CF3N CHN(Me) CHCF3 NCH N(Me)CHCF 3N CHSN CF3N NS CHCF3 NN N(Me)CHCF 3N CClSCH CF3N CClN(Me) NCF3 NCCl SNCF 3N CClN(Me)N CF3N CFS CHCF3 NCF N(Me)NCF 3 продолжение NCFS NCF3 NCF N(Me)NCF 3N СНСНS CF3N СНСН N(Me)CF3 NN СНSCF 3N СНNS CF3N СНN N(Me)CF3 NN СНN(Me)CF 3N CClСНS CF3N CClСН N(Me)CF3 NCCl NSCF 3N CClNN(Me) CF3N CFСН SCF3 NCF СНN(Me)CF 3N CFNS CF3N CFN N(Me)CF3 СНS СНCHCH 2CNСН N(Me)СНCH CH2CNСН SСН NCH2CN СНS NCHCH 2CNСН N(Me)СНN CH2CNСН N(Me)N CHCH2CN СНСН SCHСН 2CNСН СНN(Me)CH CH2CNСН СНN(Me) CHCH2CN СНСН SNCH 2CNСН NSCH CH2CNСН NN(Me) CHCH2CN СНCCl SCHСН 2CNСН CClN(Me)N CH2CNСН CClS NСН2CN СНCCl N(Me)NCH 2CNСН CFSCH СН2CNСН CFN(Me) NCH2CN СНCF SNСН 2CN продолжение СНCFN(Me) NCH2CN СНСН СНN(Me)CH 2CNСН NСНS CH2CNСН СНN SCH2CN СНСН NN(Me)CH 2CNСН NСНN(Me) CH2CNСН CClСН SCH2CN СНCCl СНN(Me)CH 2CNСН CClNS CH2CNСН CClN N(Me)CH2CN СНCF СНSСН 2CNСН CFСНN(Me) CH2CNСН CFN SCH2CN СНCF NN(Me)CH 2CNN SСНCH CH2CNN N(Me)СН CHСН2CN NS СНNCH 2CNN SNCH СН2CNN N(Me)СН NCH2CN NN(Me) NCHCH 2CNN СНSCH СН2CNN СНN(Me) CHСН2CN NСН N(Me)CHCH 2CNN СНSN СН2CNN NS CHСН2CN NN N(Me)CHСН 2CNN CClSCH СН2CNN CClN(Me) NCH2CN NCCl SNCH 2CNN CClN(Me)N СН2CNN CFS CHCH2CN NCF N(Me)NCH 2CNN CFSN CH2CNN CFN(Me) NCH2CN NСН CHSCH 2CN продолжение NСНСН N(Me)CH2CN NN СНSCH 2CNN СНNS CH2CNN СНN N(Me)CH2CN NN СНN(Me)CH 2CNN CClСНS CH2CNN CClСН N(Me)CH2CN NCCl NSCH 2CNN CClNN(Me) CH2CNN CFСН SCH2CN NCF СНN(Me)CH 2CNN CFNS CH2CNN CFN N(Me)CH2CNПРИМЕР гербицидной активности А (довсходовой) Семена испытуемых видов, которые перечислены ниже, высевают в чашки площадью 8.5 см2, наполненные стерильным суглинком до уровня 2 см от верха, и покрывают слоем суглинка в 2-5 мм. Чашки поливают и затем обрабатывают путем нанесения на поверхность почвы указанных ниже соединений Примеров, составленных в виде раствор/суспензия в смеси ацетона и раствора полиоксиэтилированного (20 молями) монолаурата (смачиватель, 10 г/л) в объемном отношении 3:1. Концентрацию каждого испытываемого соединения и объем применения рассчитывают так, чтобы получить желаемую норму расхода соединения в 200 л/га. После 3-4 недель выращивания в теплице (минимальная температура 16°C для видов, приспособленных к умеренному климату, 21°C для видов, неприспособленных к умеренному климату, при продолжительности фотопериода 16 ч) растения оценивают визуально для выявления любого гербицидного эффекта. Все различия по сравнению с необработанным контролем оценивают по балльной шкале, в соответствии с которой: 0=нет эффекта, 1=1-24% эффекта, 2=25-69% эффекта, 3=70-89% эффекта и 4=90-100% эффекта. Для обозначения видов растений в приведенной ниже таблице используются следующие буквенные обозначения: а - Triticum aestivum (пшеница) б - Hordeum vulgare (ячмень) в - Beta vulgaris (сахарная свекла) г - Brassica napus (рапс) д - Alopecurus myosuroides (лисохвост мышехвостиковидный) е - Avena fatua (овсюг) ж - Elymus repens (пырей) з - Bromus sterilis (костер бесплодный) и - Viola arvensis (фиалка полевая) к - Stellaria media (звездчатка) л - Galium aparine (подмаренник цепкий) м - Matricaria inodora (ромашка непахучая) н - Polygonum lapathifolium (горец бледный) о - Veronica persicae (вероника персидская) Полученные результаты представлены ниже: Примеркг/га абв где жзи клм ноA1 0.251 134 213 124 343 4A30.5 00 240 000 223 423 А60.25 103 410 024 444 34А7 0.251 032 110 034 342 4А80.125 22 342 122 343 424 А90.125 012 220 023 434 24А16 0.1252 144 222 134 443 4А170.063 00 130 000 232 322 А1080.5 002 200 002 224 02А109 0.50 033 001 043 342 4A1110.125 01 110 000 112 303 А1120.125 012 100 013 434 13А114 0.50 022 000 023 131 3А1150.5 00 220 002 343 434 А1160.25 112 410 013 444 24B1 0.50 123 102 122 342 3ПРИМЕР гербицидной активности А (послевсходовой) Перечисленные ниже растения выращивают в теплице (минимальная температура 16°С для видов, приспособленных к умеренному климату, 21°С для видов, неприспособленных к умеренному климату, при продолжительности фотопериода 16 ч) в чашках площадью 8,5 см2, содержащих стерильный суглинок, а затем обрабатывают в камере для опрыскивания на стадии 3-4 листьев соединениями перечисленных ниже Примеров, сформированных в виде раствор/суспензия в смеси ацетона и раствора полиоксиэтилированного, (20 молями) монолаурата (смачиватель, 10 г/л) в объемном отношении 3:1. Концентрацию каждого испытываемого соединения и объем применения рассчитывают так, чтобы получить желаемую норму расхода соединения в 200 л/га. После 3-4 недель выращивания в теплице растения оценивают визуально для выявления любого гербицидного эффекта. Все различия по сравнению с необработанным контролем оценивают по балльной шкале, в соответствии с которой: 0=нет эффекта, 1=1-24% эффекта, 2=25-69% эффекта, 3=70-89% эффекта и 4=90-100% эффекта. Для обозначения видов растений в приведенной ниже таблице используются те же обозначения, что и в Примере гербицидной активности А. Полученные результаты представлены ниже: Пример кг/гааб в гд еж зи кл мно ЕхKg/ha аb сd ef gh ij kl mnА1 0.50 02 40 00 00 24 422 A30.5 00 14 1 00 01 24 412 А50.5 11 13 1 01 12 12 212 А60.25 10 44 2 22 23 34 432 А70.25 11 24 2 22 23 33 423 А80.25 10 44 2 02 04 44 422 А90.125 11 34 0 01 03 34 422 А16 0.03211 3 41 00 02 44 331 А17 0.2500 44 0 00 02 44 431 А109 0.510 44 1 01 02 34 423 А111 0.2500 23 1 00 00 03 302 А112 0.2500 23 0 00 00 24 0 2 А114 0.2500 02 0 00 00 02 000 А115 0.2500 14 0 00 00 23 230 А116 0.2500 44 1 00 02 44 222 А117 0.12500 3 40 00 00 34 222 А118 0.12500 1 00 00 00 03 030 А119 0.06310 1 10 00 00 02 011 В10.5 01 24 2 01 00 33 412ДОПОЛНИТЕЛЬНЫЕ ЭКСПЕРИМЕНТАЛЬНЫЕ ДАННЫЕ Было обнаружено, что помимо соединений, описанных в настоящей заявке, соединения, представленные в таблицах 1 и 4 ниже, также применимы в качестве гербицидов. Они входят в объем формулы изобретения и, таким образом, дополнительно подтверждают заявленный объем изобретения. Тест 1 Соединения 1-А, 1-В, 1-С и 1-D, представленные в таблице 1 ниже, испытывают на гербицидное действие в отношении сорняков при довсходовом и послевсходовом применении в соответствии с ГЕРБИЦИДНЫМИ ПРИМЕРАМИ А и В описания. Результаты испытаний приведены в таблицах 2 и 3 ниже. Результаты доказывают, что соединения обладают ценным гербицидным действием при довсходовом и/или послевсходовом применении. Таблица 1 Соединения формулы (1)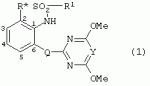 СоединениеR 1Q R2R *Y Ссылка1-А СН2CF3 СН-SCH3 НF NОтносится к пункту 1 изобретения 1-ВСН 3СН-ОН НF СНОтносится к пункту 1 изобретения 1-СCH 2CIСН-ОСН 3Н FСН Относится к пункту 1 изобретения 1-DCF3 CH-FН FСН Относится к пункту 1 изобретения Таблица 2Гербицидное действие при довсходовом применении СоединениеДоза (гАИ/га) Гербицидное действие в отношении AlЕС SE РНSIСН GAМА ST1-А 7544 44 444 441-В 752 22 444 44 41-С 7533 44 --3 431-D 752 33 4-- 44 4Таблица 3 Гербицидное действие при послевсходовом примененииСоединение Доза (гАИ/га) Гербицидное действие в отношении AlЕСSE РН SIСНGA МАST1-А 752 22 233 32 21-В 7522 22 444 441-С 752 32 323 33 2 СоединениеR 1Q R2R *Y Ссылка1-А СН2CF3 СН-SCH3 НF NОтносится к пункту 1 изобретения 1-ВСН 3СН-ОН НF СНОтносится к пункту 1 изобретения 1-СCH 2CIСН-ОСН 3Н FСН Относится к пункту 1 изобретения 1-DCF3 CH-FН FСН Относится к пункту 1 изобретения Таблица 2Гербицидное действие при довсходовом применении СоединениеДоза (гАИ/га) Гербицидное действие в отношении AlЕС SE РНSIСН GAМА ST1-А 7544 44 444 441-В 752 22 444 44 41-С 7533 44 --3 431-D 752 33 4-- 44 4Таблица 3 Гербицидное действие при послевсходовом примененииСоединение Доза (гАИ/га) Гербицидное действие в отношении AlЕСSE РН SIСНGA МАST1-А 752 22 233 32 21-В 7522 22 444 441-С 752 32 323 33 2 Аббревиатуры, используемые в таблицах 2 и 3: АИ=активный ингредиент ЕС=Echinochloa grus-galli SE=Setaria lutescens PH=Pharbitis purpurea SI=Sinapis alba CP=Chrysanthemum segetum GA=Gallium aparine MA=Matricaria inodora ST=Stellaria media - = не испытывался Все отличия от необработанного контроля оценивают в соответствии с показателем, где 0 - отсутствие эффекта, 1=1-24%, 2=25-69%, 3=70-89% и 4=90-100% действие. Таблица 4 Гербициды формулы (I')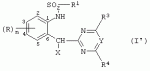 №R 1(R)nR 3R4 YXТ. пл. (°C) 1CH2CI 2-CIOCH3 OCH8NS-C6H5 58-622CH2Cl 4-NO2ОСН3 ОСН3NS-C6H5 80-823CH2Cl 2-С6Н5ОСН9 ОСН3NS-C6H5 смола4CH3CF3 2-FОСН3 ОСН3NS-C6H5 56-605CH2CF3 2,4-F2ОСН3 ОСН3NS-C6H5 81-846CH2CF3 4-NO2ОСН3 ОСН3NS-C6H5 смола7CH2Cl 2,4-F2ОСН3 ОСН3NS-C2H5 122-1238 CF32,4-F2ОСН3 ОСН3N S-C6H572-82 9СН32-F ОСН3ОСН3N S-CH3смола 10СН92,4-F2 ОСН3ОСН3N S-CH3смола 11СН32-СОС6Н5 ОСН3ОСН3 NS-CH3смола 12CH2Cl 2-FОСН3ОСН3 СНS-CH3смола 13CH2Cl НОСН3ОСН3 NS-CH3смола 14CH2Cl 2-FОСН3ОСН3 NS-CH3смола 15CH2Cl 2,4-F2ОСН3ОСН3 NS-CH3 смола16CH2Cl 4-NO2ОСН3 ОСН3NS-CH3 137-14017 CH2Cl4-OCF3ОСН3 ОСН3N S-CH3смола 18CH2Cl2-С6Н5 ОСН3ОСН3 NS-CH3158-161 19CH2Cl 2-ОС6Н5ОСН3ОСН3 NS-CH3 124-12820 CH2Cl2-СO2СН3ОСН3 ОСН3N S-CH3смола 21CH2Cl3-CF3 ОСН3ОСН3 NS-CH3смола 22CH2CF3 2-FОСН3ОСН3 СНS-CH3смола 23CH2CF8 2-ClОСН3 ОСН3NS-CH3 115-11724 CH2CF32,4-F2ОСН3 ОСН3N S-CH3смола 25CH2CN2-F ОСН3ОСН3СН S-CH3147 26CF32-F ОСН3ОСН3N S-CH3143 29CF34-OCF3 ОСН3ОСН3N S-CH372-75 30СН2С6Н52-F ОСН3ОСН3 СНS-CH3смола 31СН2С6Н5 2-FОСН3 ОСН3NS-CH3 72-7732NHCO2CH3 2-FОСН3 ОСН3СНS-CH3 113-11533 CH2Cl2-FОСН3 ОСН3СН ОН153-155 34CH2CF32-F ОСН3ОСН3СН ОН143-145 35CH2CN2-Cl ОСН3ОСН3СН ОН172 (разл) 36CF32-F ОСН3ОСН3СН ОН94-9637 CF32-Cl ОСН3ОСН3СН ОН12038 С6Н52-F ОСН3ОСН3СН ОН153-154 №R 1(R)nR 3R4 YXТ. пл. (°C) 1CH2CI 2-CIOCH3 OCH8NS-C6H5 58-622CH2Cl 4-NO2ОСН3 ОСН3NS-C6H5 80-823CH2Cl 2-С6Н5ОСН9 ОСН3NS-C6H5 смола4CH3CF3 2-FОСН3 ОСН3NS-C6H5 56-605CH2CF3 2,4-F2ОСН3 ОСН3NS-C6H5 81-846CH2CF3 4-NO2ОСН3 ОСН3NS-C6H5 смола7CH2Cl 2,4-F2ОСН3 ОСН3NS-C2H5 122-1238 CF32,4-F2ОСН3 ОСН3N S-C6H572-82 9СН32-F ОСН3ОСН3N S-CH3смола 10СН92,4-F2 ОСН3ОСН3N S-CH3смола 11СН32-СОС6Н5 ОСН3ОСН3 NS-CH3смола 12CH2Cl 2-FОСН3ОСН3 СНS-CH3смола 13CH2Cl НОСН3ОСН3 NS-CH3смола 14CH2Cl 2-FОСН3ОСН3 NS-CH3смола 15CH2Cl 2,4-F2ОСН3ОСН3 NS-CH3 смола16CH2Cl 4-NO2ОСН3 ОСН3NS-CH3 137-14017 CH2Cl4-OCF3ОСН3 ОСН3N S-CH3смола 18CH2Cl2-С6Н5 ОСН3ОСН3 NS-CH3158-161 19CH2Cl 2-ОС6Н5ОСН3ОСН3 NS-CH3 124-12820 CH2Cl2-СO2СН3ОСН3 ОСН3N S-CH3смола 21CH2Cl3-CF3 ОСН3ОСН3 NS-CH3смола 22CH2CF3 2-FОСН3ОСН3 СНS-CH3смола 23CH2CF8 2-ClОСН3 ОСН3NS-CH3 115-11724 CH2CF32,4-F2ОСН3 ОСН3N S-CH3смола 25CH2CN2-F ОСН3ОСН3СН S-CH3147 26CF32-F ОСН3ОСН3N S-CH3143 29CF34-OCF3 ОСН3ОСН3N S-CH372-75 30СН2С6Н52-F ОСН3ОСН3 СНS-CH3смола 31СН2С6Н5 2-FОСН3 ОСН3NS-CH3 72-7732NHCO2CH3 2-FОСН3 ОСН3СНS-CH3 113-11533 CH2Cl2-FОСН3 ОСН3СН ОН153-155 34CH2CF32-F ОСН3ОСН3СН ОН143-145 35CH2CN2-Cl ОСН3ОСН3СН ОН172 (разл) 36CF32-F ОСН3ОСН3СН ОН94-9637 CF32-Cl ОСН3ОСН3СН ОН12038 С6Н52-F ОСН3ОСН3СН ОН153-154 Все соединения, представленные в таблице 4 выше, получают в соответствии со способами, описанными в данном изобретении. Данные соединения также испытывают на гербицидное действие при довсходовом и послевсходовом применении. Испытанные соединения проявляют гербицидную активность с оценкой от "хорошо" до "отлично" (от 70 до 100% по сравнению с контролем) в отношении важных видов сорных растений, таких как: Sinapis alba, Matricaria inodora, Chrysanthemum segetum, Avena sativa, Stellaria media, Echinochloa crus-galli, Lolium multiflorum, Setaria spp, Abutilon theophrasti, Amaranthus retroflexus and Panicum miliaceum при довсходовом применении в дозе 0,5 кг и менее активного ингредиента на гектар. Кроме того, испытанные соединения обладают гербицидной активностью с оценкой от "хорошо" до "отлично" в отношении важных видов сорных растений, таких как: Sinapis alba, Echinochloa crus-galli, Lolium rnultrflorum, Matricaria inodora, Chrysanthemum segetum, Setaria spp., Abutilon theophrasti, Amaranthus retroflexus, Panicum miliaceum and Avena sativa при послевсходовом применении в дозе 0,5 кг и менее активного ингредиента на гектар. Из представленных выше дополнительных данных видно, что заявленный объем притязаний для соединений формулы (I) является достаточно обоснованным и полностью подтвержденным, и что арильные группы могут быть замещены различными заместителями без потери полезного гербицидного действия. Кроме того, заместители Х на мостике СХХ'' могут быть модифицированы в объеме пункта 1 для включения Х или X', которые представляют собой фенилтио, алкилтио, алкокси, галоген, гидрокси и т.п. их производные (или предшественники), такие как фенокси. ДОПОЛНИТЕЛЬНЫЕ ЭКСПЕРИМЕНТАЛЬНЫЕ ДАННЫЕ Исследовались гербициды формулы (I') где No.R1 (R)n R3R 4YХ Т зам. (°С)I'-а CHF2- ОСН3ОСН 3СНОН 103-105I'-b CHF22-СН 2-ОСН3ОСН 3ОСН3 СНОН76-77 I'-сCHF 22-СН2-СН 3ОСН3 ОСН3СН ОН120-121Соединения, представленные в таблице, получены способом, представленным в заявке. Соединения были проверены в полевых условиях на гербицидную активность против сорняков, типичных для рисовых полей. Условия проверки и полученные результаты. Семена сорняков были высеяны в грунт под слоем воды толщиной 3 см. Испытуемые соединения использовали в форме стандартных композиций на водной основе. После обработки растений их содержали 28 дней в тепличных условиях. После этого сорняки были оценены путем сравнения с контролем (необработанные растения). Результаты представлены ниже. ДозаСоединение (граммов ДВ/га) Гербицидное действие (показатель эффективности) против ЕС МОSCI'-а 2505 55 65 455 15 355 I'-b250 555 65 555 15 555 I'-с250 555 65 555 15 555Обозначения EC=Echinochloa oryzicola МО=Monoochoria vaginalis SC=Scirpus juncoides Эффективность соединений выражена при помощи оценочной шкалы: 0=отсутствие эффекта - 9% эффект; 1=10-29%; 2=30-49% 3=50-69% 4=70-89%; 5=90-100% эффект. Под эффектом понимается величина разности количества сорняков при обработке и в контроле по отношению к контролю. Формула изобретения1. Сульфонамиды формулы и их соли, где А представляет собой замещенное или незамещенное бензольное кольцо или 5-членное или 6-членное замещенное или незамещенное гетероароматическое кольцо, выбранное из группы, включающей тиенил, пиразолил, имидазолил, пиридил, где необязательные заместители выбраны из группы, состоящей из галогена, незамещенного или замещенного алкила, содержащего 1-4 атомов углерода, незамещенного или замещенного алкокси, содержащего 1-4 атомов углерода, нитро, фенила, фенокси, бензоила и алкилкарбоксилата, содержащего 1-4 атомов углерода в алкильном фрагменте, когда любой алкильный фрагмент в последних указанных заместителях замещен одним или несколькими атомами галогена, алкоксигруппами, содержащими 1-4 атомов углерода, циано и фенилом; Q представляет собой -О-, -S- или группу формулы -СХХ'; Х и X', которые могут быть одинаковыми или разными, представляют собой каждый водород, галоген, циано, алкил, содержащий 1-8 атомов углерода, или группу -ORa, -SRa или один из Х и X' представляет собой гидрокси, а другой принимает значения, определенные выше; Ra представляет собой алкил, содержащий 1-8 атомов углерода, или фенил; Rb представляет собой алкил, содержащий 1-8 атомов углерода, или фенил; Y представляет собой азот или группу CR9; R 1 представляет собой алкил, содержащий 1-8 атомов углерода, незамещенный или замещенный галогеном, цианогруппой, фенилом или алкоксикарбониламиногруппой, содержащей 1-4 атомов углерода в алкильном фрагменте, или представляет собой фенил; R 2 представляет собой водород или алкил, содержащий 1-4 атомов углерода; R3 и R4, которые могут быть одинаковыми или разными, представляют собой каждый алкил, содержащий 1-4 атомов углерода, алкоксигруппу, содержащую 1-4 атомов углерода, или галоген; R9 представляет собой водород, при условии, что когда Q представляет собой О или -S-, кольцо А представляет собой 5-членное замещенное или незамещенное гетероароматическое кольцо, как определено выше. 2. Сульфонамиды по п.1, где R1 представляет собой метил, хлорметил, бромметил, цианометил или трифторметил. 3. Сульфонамиды по п.1 или 2, где R2 представляет собой водород. 4. Сульфонамиды по любому из пп.1-3, где R3 представляет собой метил, метокси-группу или хлор, и R4 представляет собой метил или метокси-группу. 5. Сульфонамиды по любому из пп.1-4, где А представляет собой фенил, необязательно замещенный F, Cl, Br, метилом или метокси-группой, или представляет собой пиразолил, замещенный одной или несколькими метальными группами. 6. Сульфонамиды по любому из пп.1-5, где Q представляет собой СН2. 7. Гербицидная композиция, содержащая 0,01-99 мас.% одного или нескольких соединений формулы (I) по любому из пп.1-6 и 1-99,99 мас.% подходящего носителя и/или поверхностно-активного вещества. 8. Способ уничтожения сорняков на участках, засоренных сорняками или на которых предполагается их появление, включающий применение к указанному участку эффективного количества одного или более соединений по любому из пп.1-6. 9. Способ получения сульфонамида формулы I по п.1, где кольцо А представляет собой фенил, который может иметь 1-2 заместителя, выбранных из атома галогена, низшего алкила, низшего алкоксила, или представляет собой ненасыщенный пятичленный гетероцикл с атомом серы или двумя атомами азота и который может быть замещен двумя низшими алкилами, R1 представляет собой низшую алкильную группу, замещенную атомами галогена, циано, R2 представляет собой водород, Q представляет собой -S-, группу (CH2)n, которая может быть замещена низшим алкилом, n=1 или 2, R3 и R4 - одинаковые и представляют собой низшую алкоксигруппу, Y представляет собой азот или группу CR9, где R9 представляет водород, включающий взаимодействие соединения формулы II где значения A, R1, R2, Q, n, R 3, R4, Y приведены выше, с сульфоновым ангидридом формулы (R1SO2)2O или сульфонилгалогенидом формулы R1SO2Hal, где Hal представляет галоген. Популярные патенты: 2195644 Монитор для определения качества зерна ... и те же зерна в течение одинаковых временных интервалов. Диодные матрицы, наоборот, должны считывать информацию последовательно, так что, например, любой данный элемент формирует сигнал от объема зерна, если этот объем отличается от объемов, на которые реагировали предыдущие пикселы. Отношение сигнал/шум системы можно улучшить усреднением данных по циклу, состоящему из многих измерений. Выше была упомянута процедура вычисления спектра поглощения. В этой связи следует указать, что для помещения шторки 47 в закрывающее положение между концом коллектора 20 и оптическим блоком 46 может быть задействован шаговый двигатель 43 (фиг. 3). Когда шторка 47 находится в этой позиции, указанный ... 2066320 Производные тиазола, способ их получения и способ борьбы с грибками ... in vitro /Pseudocercosporella herpotrichoides. PhI/. Этот тест оценивают in vitro активность соединений против грибка, вызывающего церкоспореллез пшеницы. Испытуемое соединение растворяют или суспендируют в ацетоне и добавляют к расплавленному наполовину агару декстрозы картофеля с получением 100 ч/млн соединения и 3,5% ацетона. После затвердевания агара пластинки инокулировали заглушкой диаметром 6 мм из смеси агар/мицеллы, взятой из культуры P. herpotrichoides в возрасте 14 дней. Пластинки инкубировали при 20oС в течение 12 дней и оценивали радиальный рост из инокулированной заглушки. /i/ Активность против фузариоза in vitro /Fusarium species, FsI/. Это испытание оценивают ... 2201065 Приемная часть осевого сепаратора ... части ротора внутренней поверхности снабжен спиральными направляющими ребрами, высота которых по направлению к окончанию приемной части увеличивается настолько, насколько уменьшается радиус описанной окружности заборной части ротора. Таким образом, в целом на верхнем участке приемной части расстояние между кромками направляющих ребер и изнашиваемыми накладками остается постоянным и небольшим. Внутренняя поверхность нижнего кожуха приемной части известным образом оснащена направляющими ребрами, которые также способствуют транспортированию массы, но имеют постоянную высоту. Нижний подвесной кожух приемной части оснащен вырезами для того, чтобы сепарация свободного зерна из слоя ... 2054235 Лесопосадочная машина ... Отсутствие в машине механизма нормированной загрузки и саженцев в посадочный аппарат и надлежащих условий работы оператора отрицательно скажутся на производительности этой машины. Наиболее близкой по технической сущности является лесопосадочная машина, включающая раму, поворотный относительно рамы поводок, шарнирно закрепленный на поводке сошник с размещенным в его полости захватно-высаживающим механизмом, имеющим качающийся на оси двухплечий рычаг, и аппараты управления [1] Основные недостатки известной машины следующие. Отсутствие механизма удержания саженца в вертикальном положении до момента его заделки прикатывающими катками предопределяет низкое качество посадки. ... 2423807 Культиватор (варианты) и фреза для него ... для установки оси 5 в раме 1 способов. Далее, в стойке 7 предусмотрен вертикальный ряд отверстий 8, которые выполнены с возможностью совмещения с отверстием или отверстиями во втором плече переходника 6. При совмещении соответствующего отверстия 8 стойки 7 с отверстием/отверстиями второго плеча переходника 6 в них вставляется стержневой фиксатор. За счет указанного мероприятия возможно регулирование уровня культиватора над почвой и тем самым регулирование глубины рыхления почвы.В показанном варианте осуществления опора 3 выполнена без непосредственного привода и приводится во вращение при толкании культиватора сзади оператором и/или за счет развиваемого при работе рабочим органом ... |
Еще из этого раздела: 2175477 Способ борьбы с тлями 2165701 Фунгицидная композиция и способ обработки культур для борьбы или профилактики грибковых заболеваний 2197817 Поплавок для рыболовных удочек и снастей 2054862 Гидравлический режущий аппарат 2099929 Почвенная растительная смесь для культурных газонов и способ их создания 2175177 Агромост с оснасткой для прокладки и уплотнения постоянных грунтовых колей 2227965 Способ возделывания бахчевых культур и устройство для его осуществления 2381650 Синергические фунгицидные комбинации биологически активных веществ и их применение для борьбы с нежелательными фитопатогенными грибами 2475025 Средство для обработки семян зерновых и зернобобовых культур, пораженных фузариозом 2272399 Зерноуборочный комбайн |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||