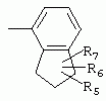
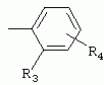
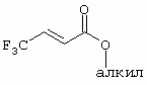
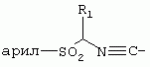
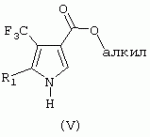
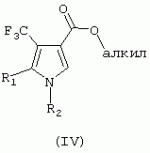
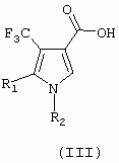
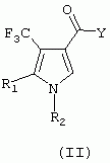
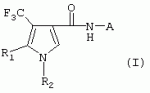
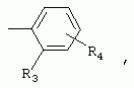
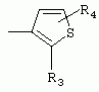
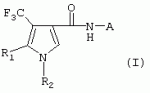
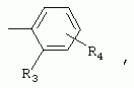
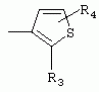
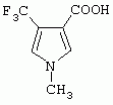
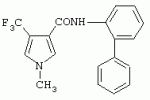
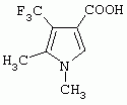
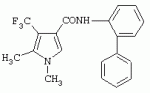
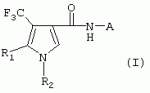
ТрифторметилпирролкарбоксамидыПатент на изобретение №: 2264388 Автор: ЭБЕРЛЕ Мартин (CH), ВАЛЬТЕР Харальд (CH) Патентообладатель: ЗИНГЕНТА ПАРТИСИПЭЙШНС АГ (CH) Дата публикации: 10 Июля, 2003 Начало действия патента: 10 Августа, 1999 Адрес для переписки: 101000, Москва, М.Златоустинский пер., 10, кв.15, ЕВРОМАРКПАТ, пат.пов. И.А.Веселицкой, рег. №11 Изобретение относится к новым трифторметилпирролкарбоксамидам формулы I где: R1 обозначает Н, С1-С 4алкил, R2 обозначает С1 -С4алкил, С1-С4галоалкил, С 1-С4алкокси-С1-С4алкил, циано или C1-С6алкилкарбонил, и А обозначает группу где R3 обозначает C1-С 6алкил, C1-С6галоалкил, С3 -С6алкенил, С3-С7циклоалкил, С1-С4алкил-С3-С7циклоалкил, С4-С7циклоалкенил, С1-С 4алкил-С4-С7циклоалкенил, фенил, нафтил или фенокси, или замещенный фенил или замещенную феноксигруппу, где заместители представляют собой 1-3 группы, независимо друг от друга выбранных из ряда, включающего галоген, С1 -С4алкил, С1-С4алкокси, циано, С1-С4алкилкарбонил, С1-С 4галоалкил, С1-С4галоалкокси, метилендиокси, дифторметилендиокси или фенил; R4 обозначает водород, галоген или С1-С4алкил; и R5, R6 и R7 каждый означает C1-С6алкил. Соединения I используют для борьбы с фитопатогенными организмами или предупреждения поражения ими культивируемых растений 4 н. и 6 з.п. ф-лы, 11 табл. Настоящее изобретение относится к новым трифторметилпирролкарбоксамидам, обладающим бактерицидной активностью, в частности фунгицидной активностью. Изобретение также относится к способу получения этих соединений, агрохимическим композициям, содержащим в качестве действующего вещества по меньшей мере одно из новых соединений, приготовлению указанных композиций и к применению действующих веществ или композиций для борьбы с фитопатогенными микроорганизмами, предпочтительно грибами, или для предотвращения заражения растений этими микроорганизмами в сельском хозяйстве и в садоводстве. Трифторметилпирролкарбоксамиды по настоящему изобретению имеют общую формулу I где: R1 обозначает водород, галоген, С1-С4галоалкил или С1-С 4алкил, R2 обозначает С1-С 4алкил, С1-4галоалкил, С1 -С4алкокси-С1-С4алкил, циано, С1-С4алкилсульфонил, фенилсульфонил, ди(С 1-С4алкил)аминосульфонил, С1 -С6алкилкарбонил, бензоил или замещенный фенилсульфонил или бензоил и А обозначает группу где R3 обозначает С1-С 6алкил, С1-С6галоалкил, С2 -С6алкенил, С2-С6галоалкенил, С2-С6алкинил, С1-С6 алкокси, C1-С6галоалкокси, С3 -С6алкенилокси, С2-С6галоалкенилокси, С2-С6алкинилокси, С3-С7 циклоалкил, С1-С4алкил-С3 -С7циклоалкил, С4-С7циклоалкенил, С1-С4алкил-С4-С7циклоалкенил, С3-С7циклоалкилокси, С1-С 4алкил-С3-С7циклоалкилокси, С 5-С7циклоалкенилокси, С1-С4 алкил-С5-С7циклоалкенилокси, фенил, нафтил, фенокси, нафтилокси или замещенный фенил или фенилоксигруппу, где заместители представляют собой 1-3 группы, независимо друг от друга выбранные из ряда, включающего галоген, С1 -С4алкил, С1-С4алкокси, С 1-С4алкилтио, циано, С1-С4 алкоксикарбонил, С1-С4алкилкарбонил, С 1-С4галоалкил, С1-С4галоалкокси, метилендиокси или дифторметилендиокси или фенил; R 4 обозначает водород, галоген, С1-С4 алкил, С1-С4галоалкил, С1-С 4алкокси или С1-С4галоалкокси; и R5, R6 и R7 независимо друг от друга выбирают из ряда, включающего С1-С6 алкил, С3-С7циклоалкил или С3 -С7циклоалкил-С1-С4алкил. Амиды никотиновой кислоты с фунгицидными свойствами, которые могут применяться в сельскохозяйственной практике, описаны в ЕР-А-0545099. Описанные соединения при их практическом применении не всегда удовлетворяют потребностям современного сельского хозяйства. При создании изобретения неожиданно установлено, что соединения формулы I обладают улучшенными биологическими свойствами, что делает возможным их применение в практике сельского хозяйства и садоводства. Если в соединениях формулы I присутствуют асимметричные атомы углерода, то эти соединения могут находиться в оптически активной форме. Изобретение относится к чистым изомерам, таким как энантиомеры и диастереомеры, а также ко всем возможным смесям изомеров, например, смесям диастереомеров, рацематов или смесям рацематов. В контексте настоящего описания алкил обозначает метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, изопентил, втор-пентил, трет-пентил и неопентил. Предпочтительным является неразветвленный алкил. Следует отметить, что акил, как часть других радикалов, таких как алкокси, алкилтио, галоалкил, алкилциклоалкил, алкилциклоалкокси, алкилкарбонил, алкилсульфонил, алкиламино и т.д., имеет аналогичые значения. Под галогеном обычно понимают фтор, хлор, бром или йод. Предпочтительными являются фтор, хлор или бром. Следует понимать, что галоген, как часть других радикалов, таких как галоалкил, галоалкокси, галоалкенил, галоалкенилокси или галофенил и т.д., имеет аналогичные значения. Количество заместителей замещенного фенилсульфонила и бензоила может варьироваться от 1 до 5, и их предпочтительно выбирают независимо друг от друга из ряда, включающего галоген, С1-С4алкил, С1-C 4алкокси, С1-С4алкилтио, циано, С 1-С4алкоксикарбонил, С1-С 4алкилкарбонил, С1-С4галоалкил, С 1-C4галоалкокси, метилендиокси или дифторметилендиокси или фенил. Если фенильные группы, как части фенила, фенилсульфонила, фенокси и бензолила замещены таким радикалами, то они представляют собой 2-хлорфенил, 3-хлорфенил, 4-хлорфенил, 2-фторфенил, 3-фторфенил, 4-фторфенил, 2,4-дихлорфенил, 3,4-дихлорфенил, 3,5-дихлорфенил, 2,4-дифторфенил, 3,4-дифторфенил, 3,5-дифторфенил, 2-трифторметилфенил, 3-трифторметилфенил, 4-трифторметилфенил, 2-трифторметоксифенил, 3-трифторметоксифенил, 4-трифторметоксифенил, 4-метилфенил, 4-этилфенил, 4-изопропилфенил, 4-трет-бутилфенил, 3,4-диметилфенил, 2,4,6-триметилфенил, 3-хлор-4-фторфенил, 4-хлор-3-фторфенил, 4-бифенил, 3-бифенил и т.п. Определенная подгруппа действующих веществ представлена таким соединениями формулы I, в которых R1 обозначает водород или С1-С4алкил, R2 обозначает С1-С4алкил и А обозначает обозначает группу R3 обозначает С1-С6алкил, С1-С6галоалкил, С2-С6 алкенил, С2-С6галоалкенил, С2 -С6алкинил, С1-С6алкокси, С 1-С6галоалкокси, С2-С6 алкенилокси, С2-С6галоалкенилокси, С 2-С6алкинилокси, C3-С7 циклоалкил, С1-С4алкил-С3-С 7циклоалкил, С4-С7циклоалкенил, С 1-С4алкил-С4-С7циклоалкенил, С3-С7циклоалкилокси, С1-C 4алкил-С3-С7циклоалкилокси, С 5-С7циклоалкенилокси, С1-С4 алкил-С5-С7циклоалкенилокси, фенил, нафтил, фенил, замещенный 1-3 группами, независимо друг от друга выбранных из ряда, включающего галоген, С1-С4алкил, С1-С4алкокси, С1-С4 алкилтио, циано, С1-С4алкоксикарбонил, С1-С4алкилкарбонил, С1-С 4галоалкил, С1-С4галоалкокси, метилендиокси или дифторметилендиокси или фенил; R4 обозначает водород или С1-C4алкил; и R5 , R6 и R7 независимо друг от друга выбирают из ряда, включающего С1-С6алкил, С3-C7циклоалкил или С3-С 7циклоалкил-С1-С4алкил. В этой группе соединений формулы I предпочтительными являются соединения, в которых а) R1 обозначает водород или метил или б) R2 обозначает метил, или в) R 3 обозначает фенил или фенил, замещенный галогеном. Другая предпочтительная подгруппа включает соединения формулы I, в которых R1 обозначает водород или метил, R 2 обозначает метил и R3 обозначает фенил или фенил, замещенный галогеном. Конкретными предпочтительными соединениями являются: N-(2-бифенилил)-1-метил-4-трифторметилпиррол-3-карбоксамид, N-(4'-хлор-2-бифенилил)-4-трифторметилпиррол-3-карбоксамид, N-(4'-фтор-2-бифенилил)-4-трифторметилпиррол-3-карбоксамид, N-[2-(4-фторфенил)-3-тиенил]-4-трифторметилпиррол-3-карбоксамид, N-[2-(4-хлорфенил)-3-тиенил]-4-трифторметилпиррол-3-карбоксамид, N-(3',4'-дифтор-2-бифенилил)-4-трифторметилпиррол-3-карбоксамид, N-(3'-трифторметил-2-бифенилил)-4-трифторметилпиррол-3-карбоксамид и N-(4'-хлор-3'-фтор-2-бифенилил)-4-трифторметилпиррол-3-карбоксамид. Соединения формулы I могут быть получены согласно следующей реакционной схеме 1. Схема 1: где A, R1 и R2 имеют значения, указанные для формулы I, Х и Y обозначают уходящие группы, алкил обозначает фрагмент (низш.)алкила и арил обозначает фенил или толил. Уходящие группы Х и Y предпочтительно обозначают атомы галогена, но также могут обозначать фрагменты смешанных ангидридов, например, -ОСО-алкил, -О-РО (алкил)2, -O-С(=N-алкил), триазолил и т.п. В другом варианте введение радикалов R2 и А может быть осуществлено другим образом согласно схеме 2. Схема 2: где A, R1, R2 X и Y имеют значения, указанные для схемы 1. В определенных вариантах замещения может оказаться предпочтительным применять защитную группу в положении 1 пиррольного кольца для того, чтобы избежать побочных взаимодействий в процессе реакции амидирования на карбонильной функции в положении 3. Приемлемыми защитными группами являются бензил и т.п. Также введение и отщепление защитной группы осуществляют во время обычных реакций бензилирования и гидролиза. Новые карбоксамиды формулы I предпочтительно получают взаимодействием активированной карбоновой кислоты формулы II с ароматическим амином. В зависимости от уходящей группы Y реакцию проводят в присутствии связывающего кислоту агента. Предпочтительно используют инертные растворители, но также могут применяться смеси водных растворителей, соответствующие условиям реакции Шоттена-Баумана. Активации достигают в результате взаимодействия пирролкарбоновой кислоты III с активирующим агентом, таким как галогенид, например, тионилхлорид или оксалилхлорид, с получением соответствующего ацилхлорида (Y обозначает хлор), или с помощью любого другого общего метода активации связывания, известного из литературы. Карбоновые кислоты формулы III могут быть получены из соответствующих эфиров путем гидролиза с использованием стандартных условий гидролиза. N-алкилирование пирролкарбоновых эфиров формулы V для получения N-алкилированных пирролкарбоновых эфиров формулы IV может быть осуществлено взаимодействием пирролкарбоновых эфиров формулы V с алкилирующим агентом, таким как диалкилсульфат, алкилгалогенид или алкилсульфонат, с использованием стандартных условий. Пирролкарбоновые эфиры формулы V, как правило, могут быть получены согласно протоколу ван Лейсена, т.е. взаимодействием алкилакрилата с арилсульфонилизоцианидом в присутствии основания. Типичные основания, которые могут применяться согласно схеме 1, включают гидриды металлов, алкоголяты металлов и гидроксиды металлов. Может применяться любой растворитель, инертный в данных реакционных условиях. Репрезентативные растворители включают простые эфиры (диэтиловый эфир, диметоксиэтан, ТГФ и т.п.), полярные апротонные растворители, такие как ДМСО, ДМФ, ДМА, или протонные растворители, такие как спирты. Также могут применяться смеси таких растворителей. Во многих случаях могут использоваться условия реакции фазового перехода, которые естественно требуют двухфазной реакционной системы. Предпочтительно всю последовательность реакций, представленных на схеме 1, проводят как реакцию в одном сосуде. Неожиданно было установлено, что новые соединения формулы I обладают очень ценным для практических целей спектром активностей в отношении защиты растений от болезней, вызываемых грибами, а также бактериями и вирусами. Соединения формулы I в качестве действующих веществ обладают способностью предупреждать заражение и/или уничтожать вредителей растений и могут применяться в сельскохозяйственном секторе и других областях. Новые соединения не только отличаются высокой активностью даже в низких концентрациях, но и хорошей переносимостью растениями и безопасностью для окружающей среды. Они обладают ценным лечебным, профилактическим и системным действием, и могут применяться для защиты многих видов культурных растений. С помощью соединений формулы I можно ингибировать развитие или уничтожать вредителей, которые встречаются на растениях или на частях (плодах, цветках, листьях, стеблях, клубнях, корнях) различных культур полезных растений, при этом защита, например, от фитопатогенных микроорганизмов также распространяется на те части растений, которые формируются в более поздний период. Соединения формулы I также могут применяться в качестве агентов для обработки материала для размножения растений, прежде всего семенного материала (плодов, клубней, зерен) и для защиты черенков растений (например, риса) от поражения грибами и для защиты от почвообитающих фитопатогенных грибов. Сединения формулы I обладают эффективностью, например, в отношении фитопатогенных грибов из следующих классов: несовершенные грибы Fungi imperfecti (например, Botrytis, Pycicularia, Helminthosporium, Fusarium, Septoria, Cercospora и Alternaria) и Basidiomycetes (например, Rhizoctonia, Hemileia, Puccinia). Кроме того, они обладают активностью в отношении грибов из классов Ascomycetes (например, Venturia и Erysiphe, Podosphaera, Monilinia, Uncinula) и классов Oomycetes (например, Phytophthora, Pythium, Plasmopara). Особенно высокая активность обнаружена в отношении возбудителя настоящей мучнистой росы (Erysiphe spp.). Кроме того, новые соединения формулы I эффективны в отношении фитопатогенных бактерий и вирусов (например, в отношении Xanthomonas spp., Pseudomonas spp., Erwinia amylovora, а также в отношении вируса мозаики табака). Подлежащие защите культурные растения, подпадающие под объем настоящего изобретения, включают, например, следующие виды растений: зерновые (пшеница, ячмень, рожь, овсы, рис, кукуруза, сорго и родственные культуры); свекольные (сахарная свекла и кормовая свекла); семечковые, косточковые, плодовые и ягодные культуры (яблони, груши, сливы, персики, миндаль, вишни, земляники, малины и ежевики); бобовые растения (бобы, чечевица, горох, соя); масличные культуры (рапс, горчица, мак, маслины, подсолнечниковые, кокос, клещевина, какао-бобы, арахис); огуречные растения (тыквы, огурцы, дыни); волокнистые растения (хлопчатник, лен, конопля, джут); цитрусовые культуры (апельсины, лимоны, грейпфруты, мандарины); овощные культуры (шпинат, салат, спаржа, капустные, моркови, луки, томаты, картофель, сладкий перец); лавровые культуры (авокадо, коричное дерево, камфарное дерево); или такие растения, как табак, орехи, кофе, баклажаны, сахарный тростник, чай, перец, винограды, хмель, бананы, природные каучуконосы, а также декоративные растения. Соединения формулы I используют в немодифицированной форме или предпочтительно вместе с адъювантами, обычно применяемыми для изготовления препаративных форм. Для этой цели их преимущественно готовят известным способом с получением, например, эмульсионных концентратов, покрывающих паст, готовых к применению растворов для опрыскивания или разбавляемых растворов, разбавленных эмульсий, смачивающихся порошков, растворимых порошков, дустов, гранул, а также инкапсулированием, например, в полимерных веществах. В зависимости от типа композиции способы обработки, такие как опрыскивание, обработка в виде тумана, опыливание, разбрасывание, нанесение покрытия или полив, выбирают в соответствии с поставленными целями и конкретными условиями. Соединения также могут содержать дополнительные адъюванты, такие как стабилизаторы, пеногасители, регуляторы вязкости, связующие вещества или прилипатели, а также удобрения, доноры микроэлементов или другие композиции, способствующие достижению нужных воздействий. Приемлемые носители и адъюванты могут быть твердыми или жидкими и представляют собой вещества, которые обычно применяются для изготовления препаративных форм, такие как, например, природные или регенерированные минеральные вещества, растворители, диспергирующие агенты, смачивающие агенты, прилипатели, загустители, связующие агенты или удобрения. Такие носители описаны, например, в WO 97/33890. Соединения формулы I, как правило, используют в виде композиции, и они могут вноситься на возделываемую площадь или на подлежащее обработке растение одновременно или последовательно с другими соединениями. Эти дополнительные соединения могут представлять собой, например, удобрения или доноры микроэлементов или другие препараты, которые влияют на рост растений. Они также могут представлять собой гербициды избирательного действия, а также инсектициды, фунгициды, бактерициды, нематоциды, моллюскициды или смеси из нескольких указанных препаратов, при необходимости с дополнительными носителями, поверхностно-активными веществами или усиливающими проникновение адъювантами, обычно применяемыми в области приготовления препаративных форм. Соединения формулы I могут быть смешаны с другими фунгицидами, в результате чего неожиданно может быть получено синергетическое действие. Предпочтительными компонентами таких смесей являются: азолы, такие как азаконазол, битертанол, пропиконазол, дифеноконазол, диниконазол, ципроканазол, эпоксиконазол, флухинконазол, флусилазол, флутриафол, гексаконазол, имазалил, имибенконазол, ипконазол, тебуконазол, тетраконазол, фенбуконазол, метконазол, миклобутанил, перфуразоат, пенконазол, бромуконазол, пирифенокс, прохлораз, триадимефон, триадименол, трифлумизол, тритиконазол; пиримидинилкарбинолы, такие как анцимидол, фенаримол, нуаримол; 2-аминопиридины, такие как бупиримат, диметиримол, этиримол; морфолины, такие как додеморф, фенпропидин, фенпропиморф, спироксамин, тридеморф; анилинопиримидины, такие как ципродинил, мепанипирим, пириметанил; пирролы, такие как фенпиклонил, флудиоксонил; фениламиды, такие как беналаксил, фуралаксил, металаксил, R-металаксил, офурас, оксадиксил; бензимидазолы, такие как беномил, карбендазим, дебакарб, фуберидазол, тиабендазол; дикарбоксимиды, такие как хлозолинат, дихлозолин, ипродин, миклозолин, процимидон, винклозолин; карбоксамиды, такие как карбоксин, фенфурам, флутоланил, мепронил, оксикарбоксин, тифлузамид; гуанидины, такие как гуазатин, додин, иминоктадин; стробилурины, такие как азоксистробин, крезоксимметил, метоминостробин, SSF-129, метил-2-[(2-трифторметил)пирид-6-илоксиметил]-3-метоксиакрилат или O-метоксим метилового эфира 2-[ дитиокарбаматы, такие как фербам, манкоцеб, манеб, метирам, пропинеб, тирам, цинеб, цирам; N-галометилтиокарбоксимиды, такие как каптафол, каптан, дихлофлуанид, флуромид, фолпет, толифлуанид; медьсодержащие соединения, такие как Бордосская жидкость, гидроксид меди, оксихлорид меди, сульфат меди, оксид меди(1), манкоппер, оксин меди; нитрофенольные производные, такие как динокаб, нитротал-изопропил; фосфорорганические производные, такие как эдифенфос, ипробенфос, изопротиолан, фосдифен, пиразофос, токлофос-метил; другие соединения различного строения, такие как ацибензолар-S-метил, анилазин, бластицидин-S, хинометионат, хлоронеб, хлороталонил, цимоксанил, дихлон, дихломезин, дихлоран, диэтофенкарб, диметоморф, дитианон, этридиазол, фамоксадон, фенамидон, фентин, феримзон, флуазинам, флусульфамид, фенгексамид, фосэтил алюминий, гиммексазол, касугамицин, метасульфокарб, пенцикурон, фталид, полиоксины, пробеназол, пропамокарб, пирохилон, хиноксифен, хинтозен, сера, триазоксид, трициклазол, трифорин, валидамицин, (S)-5-метил-2-метилтио-5-фенил-3-фениламино-3,5-дигидроимидазол-4-он (RPA 407213), 3,5-дихлор-N-(3-хлор-1-этил-1-метил-2-оксопропил)-4-метилбензамид (RH-7281), N-аллил-4,5-диметил-2-триметилсилилтиофен-3-карбоксамид (MON 65500), 4-хлор-4-циан-N,N-диметил-5-пара-толилимидазол-1-сульфонамид (IKF-916), N-(1-циан-1,2-диметилпропил)-2-(2,4-дихлорфенокси)пропионамид (АС 382042) или ипроваликарб (SZX 722). Предпочтительным способом применения соединения формулы I или сельскохозяйственной композиции, содержащей по меньшей мере одно из этих соединений, является обработка листьев. Частота обработок и норма расхода зависят от риска поражения соответствующим патогеном. Однако соединения формулы I также могут проникать в растение через корневую систему из почвы (системное действие) при насыщении места обитания растений жидкой композицией или при внесении веществ в твердой форме в почву, например, в форме гранул (почвенное внесение). В случае культур риса-падди такие гранулы могут быть внесены в определенных количествах на затопленные рисовые поля. Соединения формулы I также могут применяться для обработки семенного материала (нанесение покрытия) либо путем погружения зерен или клубней в жидкую композицию фунгицида, либо путем нанесения на них покрытия с помощью сухой композиции. Препаративную форму, т.е. композиции, содержащие соединение формулы I и при необходимости твердый или жидкий адъювант, получают известным методом, например, путем тщательного смешения и/или размалывания соединения с наполнителями, например, растворителями, твердыми носителями и необязательно с поверхностно-активными веществами (детергентами). Агрохимические композиции, как правило, содержат от 0,1 до 99 мас.%, предпочтительно от 0,1 до 95 мас.% соединения формулы I, от 99,9 до 1 мас.%, предпочтительно от 99,8 до 5 мас.% твердого или жидкого адъюванта и от 0 до 25 мас.%, предпочтительно от 0,1 до 25 мас.% поверхностно-активного вещества. Предпочтительные нормы расхода обычно составляют от 5 г до 2 кг действующего вещества (д.в.) на гектар (га), предпочтительно от 10 г до 1 кг д.в./га, наиболее предпочтительно от 20 г до 600 г д.в./га. При использовании для протравливания семян нормы расхода предпочтительно составляют от 10 мг до 1 г действующего вещества на 1 кг семян. В то время, как концентрированные композиции являются более предпочтительными в качестве поступающих в продажу продуктов, непосредственный потребитель, как правило, применяет разбавленные композиции. Следующие примеры даны с целью более подробной иллюстрации изобретения и не направлены на ограничение его объема. Температуры даны в градусах Цельсия. Применялись следующие сокращения: tпл - температура плавления; tкип - температура кипения; "ЯМР" обозначает спектр ядерного магнитного резонанса; "МС" обозначает масс-спектр; "%" обозначает мас.%, если соответствующие концентрации не приведены в других единицах. Примеры получения Пример Р 1: N-(2-бифенилил)-1-метил-4-трифторметилпиррол-3-карбоксамид а) 1-Метил-4-трифтометилпиррол-3-карбоновая кислота Гидрид натрия (8,0 г 75%-ной дисперсии в масле) суспендируют при +5°С в смеси ДМСО (300 мл) и диэтилового эфира (100 мл). По каплям через капельную воронку добавляют раствор этил-4,4,4-трифторкротоната (20 г) и TOSMIC (23 г) в ДМСО (100 мл) с такой скоростью, чтобы температура не превышала 10°С. После перемешивания реакционной смеси в течение еще 1 ч при комнатной температуре при охлаждении добавляют метилйодид (15,6 мл). После выдерживания в течение 2 ч при комнатной температуре реакционную смесь сливают на ледяную крошку. После повторной экстракции простым эфиром, промывки объединенных органических фаз соляным раствором и выпаривания растворителя при пониженном давлении получают смесевой продукт в виде масла светло-янтарного цвета. Неочищенный смесевой продукт выдерживают при 60°С в смеси этанола (100 мл) и гидроксида натрия (50 мл 30%-ного водного раствора). После промывки раствора простым эфиром, подкисления водной фазы концентрированной соляной кислотой и фильтрации получают 1-метил-4-трифторметилпиррол-3-карбоновую кислоту в виде твердого кристаллического вещества. 1H-ЯМР (CDCl3): 7,24 (d, 1Н), 6,88 (d, 1H), 3,63 (s, 3Н). б) N-(2-бифенилил)-1-метил-4-трифторметилпиррол-3-карбоксамид Раствор 1-метил-4-трифторметилпиррол-3-карбоновой кислоты (1,9 г) и оксалилхлорида (0,9 мл) в метиленхлориде (20 мл) перемешивают при комнатной температуре в присутствии каталитического количества ДМФ. Растворитель выпаривают при пониженном давлении, получая твердое кристаллическое вещество. Это твердое вещество растворяют в метиленхлориде (10 мл) и добавляют при 0°С к раствору 2-бифениламина (1,7 г) и триэтиламина (4,2 мл) в метиленхлориде (20 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. После выпаривания растворителя при пониженном давлении, добавления воды и фильтрации получают N-(2-бифенилил)-1-метил-4-трифторметилпиррол-3-карбоксамид. 1H-ЯМР (CDCl2): 8,37 (d, 1Н), 7,60 (s, br, 1H), 7,48-7,14 (m, 8H), 7,03 (d, 1H), 6,88 (d, 1H), 3,63 (s, 3Н). Пример Р 2: N-(2-бифенилил)-1,5-диметил-4-трифторметилпиррол-3-карбоксамид а) 1,5-Диметил-4-трифторметилпиррол-3-карбоновая кислота Смесь, включающую TOSMIC (20 г), метилйодид (18,5 г) и хлорид N-бензилтриэтиламмония (1 г) в метиленхлориде (100 мл) и водного раствора гидроксида (30 мл 50%-ного раствора), перемешивают при 5°С в течение 3 ч. По каплям через капельную воронку добавляют раствор этил-4,4,4-трифторкротоната (20 г) в метиленхлориде (50 мл) с такой скоростью, чтобы температура не превышала 25°. После перемешивания реакционной смеси в течение еще 1 ч при комнатной температуре добавляют при охлаждении избыток метилйодида. После выдерживания в течение 2 ч при комнатной температуре реакционную смесь сливают на ледяную крошку. После повторной экстракции простым эфиром, промывки объединенных органических фаз соляным раствором и выпаривания растворителя получают неочищенный смесевой продукт. Чистое промежуточное вещество получают после хроматографии на силикагеле. Гидролиз осуществляют в условиях, описанных в примере 1 а), получая 1,5-диметил-4-трифторметилпиррол-3-карбоновую кислоту в виде бесцветного твердого кристаллического вещества. 1H-ЯМР (d6-ДМСО): 12,04 (s, br, 1H), 7,50 (s, 1H), 3,58 (s, 3H), 2,27 (s, 3H). 6) N-(2-бифенилил)-1,5-диметил-4-трифторметилпиррол-3-карбоксамид Раствор 1,5-диметил-4-трифторметилпиррол-3-карбоновой кислоты (1,9 г) и оксалилхлорида (0,9 мл) в метиленхлориде (20 мл) перемешивают при комнатной температуре в присутствии каталитического количества ДМФ. Растворитель выпаривают при пониженном давлении, получая твердое кристаллическое вещество. Это твердое вещество растворяют в метиленхлориде (10 мл) и добавляют при 0°С к раствору 2-бифениламина (1,7 г) и триэтиламина (4,2 мл) в метиленхлориде (20 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. После выпаривания растворителя при пониженном давлении, добавления воды и фильтрации получают N-(2-бифенилил)-1,5-диметил-4-трифторметилпиррол-3-карбоксамид. 1H-ЯМР (CDCl3): 8,39 (d, 1H), 7,58 (s, br, 1H), 7,48-7,14 (m, 9H), 3,58 (s, 3H), 2,27 (s, 3H). Следующие соединения получают аналогичным образом, используя аналогичные методы. Таблица 1: Соединения формулы I, в которых R1 обозначает водород, R2 обозначает метил и А соответствует одной строчке в таблице А. Таблица 2: Соединения формулы I, в которых R1 и R2 обозначают метил и А соответствует одной строчке в таблице А. Таблица 3: Соединения формулы I, в которых R1 обозначает водород, R2 обозначает этил и А соответствует одной строчке в таблице А. Таблица 4: Соединения формулы I, в которых R1 обозначает водород, R2 обозначает метоксиметил и А соответствует одной строчке в таблице А. Таблица 5: Соединения формулы I, в которых R1 обозначает водород, R2 обозначает циано и А соответствует одной строчке в таблице А. Таблица 6: Соединения формулы I, в которых R1 обозначает водород, R2 обозначает метилсульфонил и А соответствует одной строчке в таблице А. Таблица 7: Соединения формулы I, в которых R1 обозначает водород, R2 обозначает фенилсульфонил и А соответствует одной строчке в таблице А. Таблица 8: Соединения формулы I, в которых R1 обозначает водород, R2 обозначает ацетил и А соответствует одной строчке в таблице А. Таблица 9: Соединения формулы I, в которых R1 обозначает водород, R2 обозначает метоксиацетил и А соответствует одной строчке в таблице А. Таблица 10: Соединения формулы I, в которых R1 обозначает водород, R2 обозначает бензоил и А соответствует одной строчке в таблице А. Таблица 11: Соединения формулы I, в которых R1 обозначает водород, R2 обозначает 4-фтообензоил и А соответствует одной строчке в таблице А. Соед. №А 01 02 02 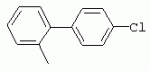 03 03 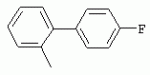 04 04 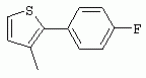 05 05 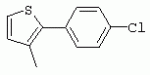 06 06 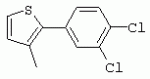 07 07 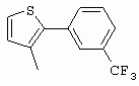 08 08 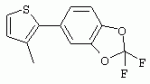 09 09 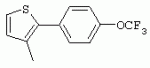 10 10 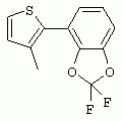 11 11 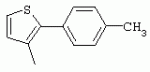 12 12 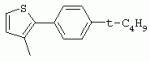 13 13 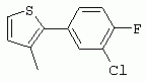 14 14 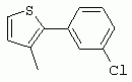 15 15 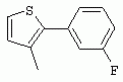 16 16 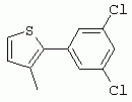 17 17 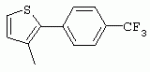 18 18 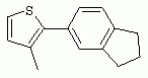 19 19 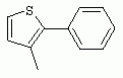 20 20 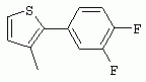 21 21 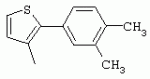 22 22 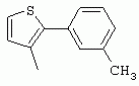 23 23 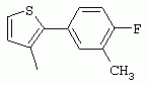 24 24 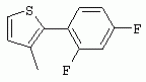 25 25 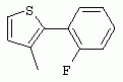 26 26 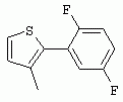 27 27 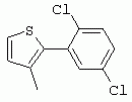 28 28 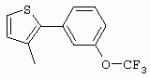 29 29 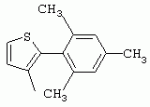 30 30 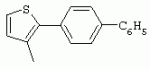 31 31 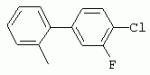 32 32 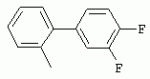 33 33 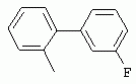 34 34 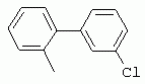 35 35 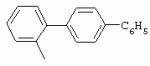 36 36 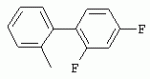 37 37 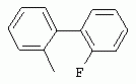 38 38 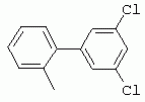 39 39 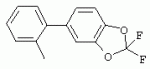 40 40 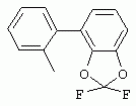 41 41 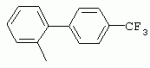 42 42 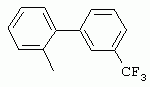 43 43 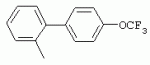 44 44 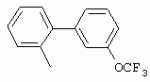 45 45  46 46 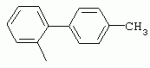 47 47 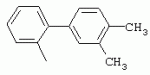 48 48 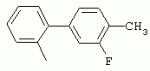 49 49 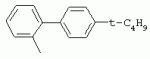 50 50 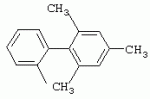 51 51  52 52  53 53  54 54  55 55 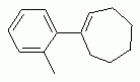 56 56 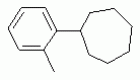 57 57 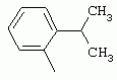 58 58 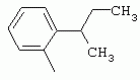 59 59 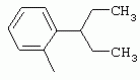 60 60 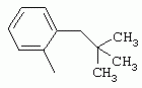 61 61 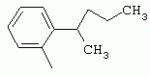 62 62 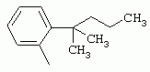 63 63 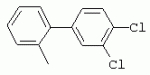 64 64 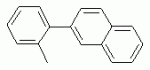 65 65 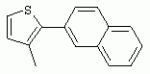 66 66 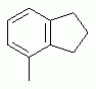 67 67 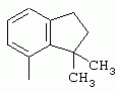 68 68 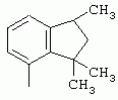 69 69 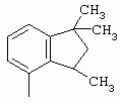 70 70 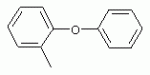 71 71 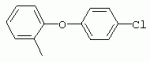 72 72 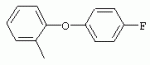 73 73 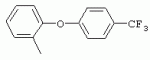 74 74 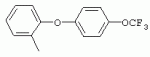 75 75 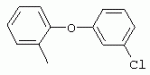 76 76 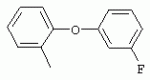 Таблица 12 Физико-химические данные отобранных соединений из приведенных выше таблиц 1-11Соединение № Физико-химические данные tпл [°С] или 1Н-ЯМР (CDCl 3)1.01 8,37 (d, 1H), 7,60 (s, br, 1H), 7,48-7,14 (m, 8H), 7,03 (s, 1H), 6,88 (s, 1H), 3,63 (s, 3H); tпл 100-102. 1.028,27 (d, 1H), 7,50 (s, br, 1H), 7,46-7,18 (m, 7H), 7,10 (d, 1H), 6,88 (s, 1H), 3,63 (s, 3H).1.03 8,30 (d, 1H), 7,52 (s, br, 1H), 7,44-7,12 (m, 8H), 6,88 (s, 1H),3,63 (s, 3H); tпл 151-153. 1.047,85 (d, 1H), 7,74 (s, br, 1H), 7,44 (dd, 2H), 7,30 (s, 1H), 7,28 (s, 1H), 7,13 (dd, 2H), 6,93 (s, 1H), 3,68 (s, 3H); t пл 127-129.1.05 7,84 (d, 1H), 7,74 (s, br, 1H), 7,49 (s, 4H), 7,30 (d, 1H), 7,28 (d, 1H), 6,96 (d, 1H), 3,68 (s, 3H); tпл 142-145.1.30 7,89 (d, 1H), 7,76-7,25 (m, 12H), 6,95 (s, 1H), 3,69 (s, 3H); tпл 168-169. 1.35tпл 160-161. 1.388,25 (d, 1H), 7,50 (s, br, 1H), 7,45-7,08 (m, 7H), 6,68 (s, 1H), 3,65 (s, 3H); смола1.40 tпл 122-123. 1.42tпл 142-143. 1.71t пл 63-65.1.72 tпл 112-114. 1.76смола 2.02tпл 163-165. 2.03смола 2.05смола 2.35t пл 124-125.2.71 смола3.01 смола3.02 смола3.03 смола3.71 смола Соединение №Физико-химические данные tпл [°C] или 1H-ЯМР (CDCl3) 4.02смола 4.03смола 4.71смола 5.02смола 5.03смола 5.71смола 8.02смола 8.03смола 8.04смола 8.05смола 8.71смола Таблица 12 Физико-химические данные отобранных соединений из приведенных выше таблиц 1-11Соединение № Физико-химические данные tпл [°С] или 1Н-ЯМР (CDCl 3)1.01 8,37 (d, 1H), 7,60 (s, br, 1H), 7,48-7,14 (m, 8H), 7,03 (s, 1H), 6,88 (s, 1H), 3,63 (s, 3H); tпл 100-102. 1.028,27 (d, 1H), 7,50 (s, br, 1H), 7,46-7,18 (m, 7H), 7,10 (d, 1H), 6,88 (s, 1H), 3,63 (s, 3H).1.03 8,30 (d, 1H), 7,52 (s, br, 1H), 7,44-7,12 (m, 8H), 6,88 (s, 1H),3,63 (s, 3H); tпл 151-153. 1.047,85 (d, 1H), 7,74 (s, br, 1H), 7,44 (dd, 2H), 7,30 (s, 1H), 7,28 (s, 1H), 7,13 (dd, 2H), 6,93 (s, 1H), 3,68 (s, 3H); t пл 127-129.1.05 7,84 (d, 1H), 7,74 (s, br, 1H), 7,49 (s, 4H), 7,30 (d, 1H), 7,28 (d, 1H), 6,96 (d, 1H), 3,68 (s, 3H); tпл 142-145.1.30 7,89 (d, 1H), 7,76-7,25 (m, 12H), 6,95 (s, 1H), 3,69 (s, 3H); tпл 168-169. 1.35tпл 160-161. 1.388,25 (d, 1H), 7,50 (s, br, 1H), 7,45-7,08 (m, 7H), 6,68 (s, 1H), 3,65 (s, 3H); смола1.40 tпл 122-123. 1.42tпл 142-143. 1.71t пл 63-65.1.72 tпл 112-114. 1.76смола 2.02tпл 163-165. 2.03смола 2.05смола 2.35t пл 124-125.2.71 смола3.01 смола3.02 смола3.03 смола3.71 смола Соединение №Физико-химические данные tпл [°C] или 1H-ЯМР (CDCl3) 4.02смола 4.03смола 4.71смола 5.02смола 5.03смола 5.71смола 8.02смола 8.03смола 8.04смола 8.05смола 8.71смола Процессы, позволяющие получить композиции соединений формулы I, такие как эмульсионные концентраты, растворы, гранулы, дусты и смачивающиеся порошки, описаны в WO 97/33890. Биологические примеры: Фунгицидная активность Пример В-1: Активность в отношении Puccinia recondita на шпенице (бурая ржавчина пшеницы) Однонедельные растения пшеницы сорта Arina обрабатывают композицией тестируемого соединения (0,02% действующего вещества) в камере для опрыскивания. Через 1 день после обработки растения пшеницы инокулируют путем опрыскивания опытных растений суспензией спор (1×105 уредоспор/мл). После инкубации в течение 2 дней при 20°С и 95%-ной относительной влажности растения выдерживают в теплице в течение 8 дней при 20°С и 60%-ной относительной влажности. Признаки болезни оценивают через 10 дней после инокуляции. Соединения из таблиц 1-11 проявили достаточно высокую активность в этих опытах (поражение <20%). Пример В-2: Активность в отношении Podosphaera leucotricha на яблонях (настоящая мучнистая роса яблонь) Пятинедельные саженцы яблонь сорта McIntosh обрабатывают композицией тестируемого соединения (0,002% действующего вещества) в камере для опрыскивания. Через 1 день после обработки растения яблонь инокулируют путем встряхивания растений, зараженных настоящей мучнистой росой яблонь, над опытными растениями. После инкубации в течение 12 дней при 22°С и 60%-ной относительной влажности и световом режиме 14/10 ч (день/ночь) оценивают признаки болезни. Соединения из таблиц 1-11 проявили достаточно высокую активность в этом опыте. Соединения 1.01, 1.02, 1.03, 1.04, 1.05, 1.30, 1.35, 1.38, 1.39, 1.40, 1.42, 1.71, 1.72, 1.76, 2.02, 2.03, 2.05, 2.35, 2.71, 3.01, 3.02, 3.03, 3.71, 4.02, 4.03, 4.71, 5.02, 5.03, 5.71, 8.02, 8.03, 8,04 и 8.71 проявили очень высокую эффективность (поражение <20%). Пример В-3: Активность в отношении Venturia inaequalis на яблонях (парша яблонь) Четырехнедельные саженцы яблонь сорта McIntosh обрабатывают композицией тестируемого соединения (0,02% действующего вещества) в камере для опрыскивания. Через 1 день после обработки растения яблонь инокулируют путем опрыскивания опытных растений суспензией спор (4×10 5 конидий/мл). После инкубации в течение 4 дней при 21°С и 95%-ной относительной влажности растения выдерживают в теплице в течение 4 дней при 21°С и 60%-ной относительной влажности. После дополнительной инкубации в течение 4 дней при 21°С и 95%-ной относительной влажности оценивают признаки болезни. Соединения из таблиц 1-11 проявили достаточно высокую активность в этом опыте. Соединения 1.01, 1.02, 1.03, 1.04, 1.05, 1.30, 1.35, 1.38, 1.39, 1.40, 1.42, 1.71, 1.72, 1.76, 2.02, 2.03, 2.05, 2.35, 2.71, 3.01, 3.02, 3.03, 3.71, 4.02, 4.03, 4.71, 5.02, 5.03, 5.71, 8.02, 8.03, 8,04 и 8.71 проявили высокую эффективность (поражение <20%). Пример В-4: Активность в отношении Erysiphe graminis на ячмене (настоящая мучнистая роса ячменя) Однонедельные растения ячменя сорта Express обрабатывают композицией тестируемого соединения (0,02% действующего вещества) в камере для опрыскивания. Через 1 день после обработки растения ячменя инокулируют путем встряхивания растений, зараженных настоящей мучнистой росой, над тестируемыми растениями. После инкубации в теплице в течение 6 дней 20°С/18°С (день/ночь) и 60%-ной относительной влажности оценивают признаки болезни. Соединения из таблиц 1-11 проявили достаточно высокую активность в этом опыте. Соединения 1.01, 1.02, 1.03, 1.04, 1.05, 1.30, 1.35, 1.38, 1.39, 1.40, 1.42, 1.71, 1.72, 1.76, 2.02, 2.03, 2.05, 2.35, 2.71, 3.01, 3.02, 3.03, 3.71, 4.02, 4.03, 4.71, 5.02, 5.03, 5.71, 8.02, 8.03, 8,04 и 8.71 проявили высокую эффективность (поражение <20%). Пример В-5: Активность в отношении Botrytis cinerea на яблонях (серая гниль яблок) В яблоках сорта Golden Delicious высверливают 3 отверстия и каждое заполняют по каплям 30 мкл композиции тестируемого соединения (0,002% действующего вещества). Через 2 ч после обработки в места обработки пипеткой вносят 50 мкл суспензии спор В.cinerea (4×105 конидий/мл). После инкубации в течение 7 дней при 22°С в вегетационной камере оценивают признаки болезни. Соединения из таблиц 1-11 проявили достаточно высокую активность в этом опыте. Соединения 1.01, 1.02, 1.03, 1.04, 1.05, 1.30, 1.35, 1.38, 1.39, 1.40, 1.42, 1.71, 1.72, 1.76, 2.02, 2.03, 2.05, 2.35, 2.71, 3.01, 3.02, 3.03, 3.71, 4.02, 4.03, 4.71, 5.02, 5.03, 5.71, 8.02, 8.03, 8,04 и 8.71 проявили очень высокую эффективность (поражение <10%). Пример В-6: Активность в отношении Botrytis cinerea на винограде (серая гниль винограда) Пятинедельные чубуки винограда сорта Gutedel обрабатывают композицией тестируемого соединения (0,002% действующего вещества) в камере для опрыскивания. Через 2 дня после обработки растения винограда инокулируют путем опрыскивания опытных растений суспензией спор (1×10 конидий/мл). После инкубации в теплице в течение 4 дней при 21°С и относительной влажности 95% оценивают признаки болезни. Соединения из таблиц 1-11 проявили достаточно высокую активность в этом опыте. Соединения 1.01, 1.02, 1.03, 1.04, 1.05, 1.30, 1.35, 1.38, 1.39, 1.40, 1.42, 1.71, 1.72, 1.76, 2.02, 2.03, 2.05, 2.35, 2.71, 3.01, 3.02, 3.03, 3.71, 4.02, 4.03, 4.71, 5.02, 5.03, 5.71, 8.02, 8.03, 8,04 и 8.71 проявили очень высокую эффективность (поражение <10%). Пример В-7: Активность в отношении Botrytis cinerea на томатах (серая гниль томатов) Четырехнедельные растения томатов сорта Roter Gnom обрабатывают композицией тестируемого соединения (0,002% действующего вещества) в камере для опрыскивания. Через 2 дня после обработки растения томатов инокулируют путем опрыскивания опытных растений суспензией спор (1×10 5 конидий/мл). После инкубации в вегетационной камере в течение 4 дней при 21°С и относительной влажности 95% оценивают признаки болезни. Соединения из таблиц 1-11 проявили достаточно высокую активность в этом опыте. Соединения 1.01, 1.02, 1.03, 1.04, 1.05, 1.30, 1.35, 1.38, 1.39, 1.40, 1.42, 1.71, 1.72, 1.76, 2.02, 2.03, 2.05, 2.35, 2.71, 3.01, 3.02, 3.03, 3.71, 4.02, 4.03, 4.71, 5.02, 5.03, 5.71, 8.02, 8.03, 8,04 и 8.71 проявили очень высокую эффективность (поражение <10%). Пример В-8: Активность в отношении Pyrenophora teres на ячмене (сетчатая пятнистость ячменя) Однонедельные растения ячменя сорта Express обрабатывают композицией тестируемого соединения (0,002% действующего вещества) в камере для опрыскивания. Через 2 дня после обработки растения ячменя инокулируют путем опрыскивания опытных растений суспензией спор (3×104 конидий/мл). После инкубации в течение 2 дней при 20°С и относительной влажности 95% растения выдерживают в теплице в течение 2 дней при 20°С и относительной влажности 60%. Признаки болезни оценивают через 4 дня после инокуляции. Соединения из таблиц 1-11 проявили достаточно высокую активность в этом опыте. Соединения 1.01, 1.02, 1.03, 1.04, 1.05, 1.30, 1.35, 1.38, 1.39, 1.40, 1.42, 1.71, 1.72, 1.76, 2.02, 2.03, 2.05, 2.35, 2.71, 3.01, 3.02, 3.03, 3.71, 4.02, 4.03, 4.71, 5.02, 5.03, 5.71, 8.02, 8.03, 8,04 и 8.71 проявили высокую эффективность (поражение <20%). Пример В-9: Активность в отношении Septoria nodorum на пшенице (септориоз листьев пшеницы) Однонедельные растения пшеницы сорта Arina обрабатывают композицией тестируемого соединения (0,02% действующего вещества) в камере для опрыскивания. Через 1 день после обработки растения пшеницы инокулируют путем опрыскивания опытных растений суспензией спор (5×105 конидий/мл). После инкубации в течение 1 дня при 20°С и 95%-ной относительной влажности растения выдерживают в теплице в течение 10 дней при 20°С и 60%-ной относительной влажности. Признаки болезни оценивают через 11 дней после инокуляции. Соединения из таблиц 1-11 проявили достаточно высокую активность в этом опыте. Соединения 1.01, 1.02, 1.03, 1.04, 1.05, 1.30, 1.35, 1.38, 1.39, 1.40, 1.42, 1.71, 1.72, 1.76, 2.02, 2.03, 2.05, 2.35, 2.71, 3.01, 3.02, 3.03, 3.71, 4.02, 4.03, 4.71, 5.02, 5.03, 5.71, 8.02, 8.03, 8,04 и 8.71 проявили высокую эффективность (поражение <20%). Таблица Физико-химические данные для ряда соединений приведенной ниже структурной формулы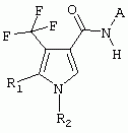 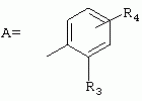 Соед-е № R1R 2R3 R4Темп. пл., °С 1Н Me Соед-е № R1R 2R3 R4Темп. пл., °С 1Н Me 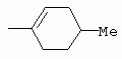 Нсмола 2Н Me Нсмола 2Н Me 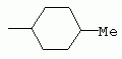 Н127-29 3Н Me Н127-29 3Н Me 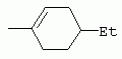 Нсмола 4Н Me Нсмола 4Н Me 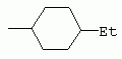 Н130-32 5Н Me Н130-32 5Н Me 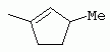 Нсмола 6Н Me Нсмола 6Н Me 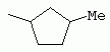 Н116-19 7Н Me Н116-19 7Н Me 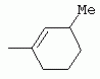 Нсмола Продолжение таблицы 8НMe Нсмола Продолжение таблицы 8НMe 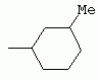 H93-95 9Н Me H93-95 9Н Me 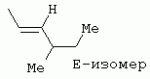 HМасло 10Н Me HМасло 10Н Me 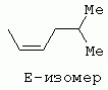 Hмасло 11Н Me Hмасло 11Н Me 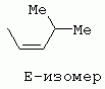 H73-75 12Н MeCHFCH2CH(Me) 2H105-07 13Н MeCHF(CH2) 4MeH108-10 14Н. MeCHFCH2С(Ме) 3H136-38 15Н MeCFMeCH2CH(Me) 2H73-75 16Н Me H73-75 12Н MeCHFCH2CH(Me) 2H105-07 13Н MeCHF(CH2) 4MeH108-10 14Н. MeCHFCH2С(Ме) 3H136-38 15Н MeCFMeCH2CH(Me) 2H73-75 16Н Me 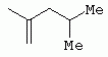 H86-88 17Н Me H86-88 17Н Me 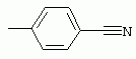 H211-12 18Н Me H211-12 18Н Me 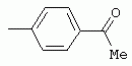 H164-68 H164-68
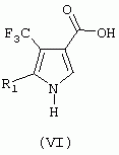
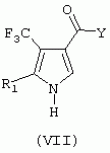
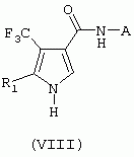
Формула изобретения1. Трифторметилпирролкарбоксамид формулы I где R1 обозначает водород или С1 -С4алкил; R2 обозначает С1 -С4алкил, С1-С4галоалкил, С 1-С4алкокси-С1-С4алкил, циано или С1-С6алкилкарбонил; А обозначает группу где R3 обозначает C1-С 6алкил, C1-С6галоалкил, С2 -С6алкенил, С3-С7циклоалкил, С1-С4алкил-С3-С7циклоалкил, С4-С7циклоалкенил, С1-С 4алкил-С4-С7циклоалкенил, фенил, нафтил или фенокси, или замещенный фенил или замещенную феноксигруппу, где заместители представляют собой 1-3 группы, независимо друг от друга выбранных из ряда, включающего галоген, С1 -С4алкил, С1-С4алкокси, циано, С1-С4алкилкарбонил, С1-С 4галоалкил, С1-С4галоалкокси, метилендиокси, дифторметилендиокси или фенил; R4 обозначает водород, галоген или С1-С4алкил; R5, R6 и R7 каждый означает C1-С4алкил. 2. Соединение формулы I по п.1, где R1 обозначает водород или С 1-С4алкил, R2 обозначает С 1-С4алкил; А обозначает группу где R3 обозначает C1-С6 алкил, C1-С6галоалкил, С2-С 6алкенил, С3-С7циклоалкил, С 1-С4алкил-С3-С7циклоалкил, С4-С7циклоалкенил, С1-С 4алкил-С4-С7 циклоалкенил, фенил или нафтил, фенил, замещенный 1-3 группами, независимо друг от друга выбранных из ряда, включающего галоген, C1-C 4алкил, С1-С4алкокси, циано, С1-С4алкилкарбонил, С1-С 4галоалкил, C1-C4галоалкокси, метилендиокси, дифторметилендиокси или фенил; R4 обозначает водород, галоген или С1-С4алкил; R5, R6 и R7 каждый означает C1-С6алкил. 3. Соединение по п.1 или 2, где R1 обозначает водород или метил. 4. Соединение по п.1 или 2, где R2 обозначает метил. 5. Соединение по п.1 или 2, где R3 обозначает фенил или фенил, замещенный галогеном. 6. Соединение по п.1 или 2, где R1 обозначает водород или метил, R 2 обозначает метил и R3 обозначает фенил или фенил, замещенный галогеном. 7. Соединение по п.1, выбранное из группы, включающей N-(2-бифенилил)-1-метил-4-трифторметилпиррол-3-карбоксамид, N-(4'-хлор-2-бифенилил)-4-трифторметилпиррол-3-карбоксамид, N-(4'-фтор-2-бифенилил)-4-трифторметилпиррол-3-карбоксамид, N-[2-(4-фторфенил)-3-тиенил]-4-трифторметилпиррол-3-карбоксамид, N-[2-(4-хлорфенил)-3-тиенил]-4-трифторметилпиррол-3-карбоксамид, N-(3',4'-дифтор-2-бифенилил)-4-трифторметилпиррол-3-карбоксамид, N-(3'-трифторметил-2-бифенилил)-4-трифторметилпиррол-3-карбоксамид и N-(4'-хлор-3'-фтор-2-бифенилил)-4-трифторметилпиррол-3-карбоксамид. 8. Способ получения соединений формулы I по п.1, включающий взаимодействие в присутствии основания алкилакрилата формулы где алкил обозначает (низш.)алкил, с арилсульфонилизоцианидом формулы где R1 имеет значения, указанные в п.1 для формулы I, и арил обозначает фенил или толил, с получением пирролкарбонового эфира формулы V где R1 имеет значения, указанные в п.1 для формулы I, и алкил обозначает (низш.)алкил, последующее его N-алкилирование в присутствии основания алкилирующим агентом R2X, где R2 имеет значения, указанные в п.1 для формулы I, a X означает уходящую группу, с получением N-алкилированного пирролкарбонового эфира формулы IV где R1 и R2 имеют значения, указанные в п.1 для формулы I, и алкил обозначает (низш.)алкил, превращение его путем гидролиза в карбоновую кислоту формулы III где R1 и R2 имеют значения, указанные в п.1 для формулы I, активацию полученной карбоновой кислоты любой известной реакцией связывания и последующую обработку полученного активированного производного карбоновой кислоты формулы II где R1 и R2 имеют значения, указанные в п.1 для формулы I, a Y означает уходящую группу, ароматическим амином А-NH2, где А имеет значения, указанные в п.1 для формулы I, с получением целевого продукта. 9. Способ получения соедиения формулы I по п.1, включающий гидролиз пирролкарбонового эфира формулы V где R1 имеет значения, указанные в п.1 для формулы I, и алкил обозначает (низш.)алкил, с последующей активацией полученной при этом карбоновой кислоты формулы VI где R1 имеет значения, указанные в п.1 для формулы I, любой известной реакцией связывания, обработку полученного активированного производного карбоновой кислоты формулы VII где R1 имеет значения, указанные в п.1 для формулы I, a Y означает уходящую группу, ароматическим амином A-NH2, где А имеет значения, указанные в п.1 для формулы I, с получением пирролкарбоксамида формулы VIII где R1 и А имеют значения, указанные в п.1 для формулы I, причем стадию амидирования можно проводить с использованием защитной группы, и последующее алкилирование пирролкарбоксамида формулы VIII в присутствии основания алкилирующим агентом R2X, где R2 имеет значения указанные в п.1 для формулы I, a X означает уходящую группу, с получением целевого продукта. 10. Способ борьбы с фитопатогенными организмами или предупреждения поражения ими культивируемых растений путем нанесения соединения формулы I по п.1 на растения, их части или места их обитания. MM4A - Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 11.08.2007 Извещение опубликовано: 20.07.2010 БИ: 20/2010 Популярные патенты: 2279799 Балансир рыболовный ... - крючок-тройник, укрепленный на трейлере.Недостатки известного балансира:- крыло крепится к головке и цилиндрической части корпуса крепежными элементами, что обусловливает непрочность конструкции балансира: крылья ломаются даже при поклевке рыбы; - крылья имеют размер и форму, не обеспечивающие большой дальности полета балансира при его включении в работу;- большая площадь поверхности крыла создает высокое сопротивление движению балансира в воде: встречный поток быстро снижает скорость балансира и амплитуду его движения.Технический результат заявляемого изобретения заключается в том, что достигается большая дальность полета балансира при его высокой прочности, улучшаются его ... 2121252 Агротранспортная система ... применения мостового устройства выполнят роль направляющих. При обширных полях с длиною до 200 км доставка рабочих железнодорожным транспортом при скорости 40-50 км/ч в один конец займет 4-5 ч, столько же обратно. При скорости 100 км/ч на дорогу уйдет 4 ч. В более скоростном варианте 400 км/ч - 30 минут в один конец оптимальный вариант, но резко ужесточаются требования к путепроводу, требуется ограждение трассы, что удорожает строительство, но не решает полностью проблемы безопасности и препятствует миграции животных. Все эти проблемы решаются в данном предложении. Аппараты также могут быть составлены в поезд из 6-8 штук. Для транспортировки пассажиров целесообразно использовать ... 2144756 Селекционная сеялка для посева семян в кассеты ... коленчатый рычаг 25, увлекающий за собой шатун 26, который тянет по направляющим 5 каретку 4, т. е. весь блок семенных банок 3. Их разгрузочные камеры 11 сдвигаются примерно на 15 - 20 мм в сторону от рядка ячеек 16 высевающего барабана 12. В этот момент ящик 19 достигает крайнего заднего положения, заканчивается посев семян в последний (первый от оператора) поперечный ряд ячеек кассеты 18, так называемый, "рабочий ход". Возвратный ход ящика 19 является "холостым". Во время него разгрузочные камеры 11 семенных банок 3 скользят по гладкой поверхности высевающего барабана 12 и ни одно семя не покидает их пределов. На самой последней фазе возвратного хода задний конечный роликовый ... 2073513 Способ профилактики технологических стрессов молодняка крупного рогатого скота ... обмен веществ, что в конечном счете обеспечивает сокращение потерь мясной продукции и сохранение ее качества. Источники информации 1. Фомичев Ю.П. Левантин Д.Л. Предубойные стрессы и качество говядины. М. Россельхозиздат, 1981, 166 с. 2. Бабур М. А. Гуркало С.Я. Влияние транквилизатора БД-98 (феназепама) при откорме крупного рогатого скота на привесы, качество мяса и характер морфологических изменений в паренхиматозных органах/ Разработка лечебно-профилактических мер против незаразных и заразных заболеваний сельскохозяйственных животных и их апробация в комплексах и специализированных хозяйствах. Одесса, 1985, с.73-75. 3. Плященко С. И. Сидоров В.Т. Казакевич В.К. Алешин ... 2053664 Медогонка ... как рамки для полного выделения меда с двух сторон установлены поворотно вокруг своей оси и, кроме того, такое расположение рамок приводит к перебросу меда с одной кассеты на другую в зоне, близкой к оси ротора, а следовательно, вызывает его взмульчивание и требует затем процесс его отстаивания, влияет на качество меда. Кроме того, медогонка также конструктивно сложна, из-за механизмов повоpота металлоемка из-за необходимости применения кассет, предохраняющих соты от разрушения, так как в этом случае центробежная сила прикладывается перпендикулярно к площадке рамки с сотами, недостаточно удобна в процессе обслуживания. Известна медогонка, состоящая из бака с расположенным в нем ... |
Еще из этого раздела: 2154938 Способ охлаждения молока на животноводческих фермах и устройство для его осуществления 2500104 Способ приготовления препарата костной ткани и набор для его осуществления 2261588 Способ электростимуляции жизнедеятельности растений 2468582 Инсектицидно-фунгицидный состав и способ борьбы с вредителями и болезнями крестоцветных культур 2177223 Блесна 2112361 Контроллер программируемого управления поливом 2199195 Мостовая сельскохозяйственная платформа "сотка" 2105446 Плоскорежущая лапа 2241327 Многоопорная дождевальная машина 2487516 Почвообрабатывающая машина |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
 или
или 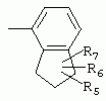
 или
или 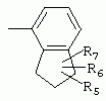
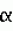 {[(
{[(
 или
или