Способ получения трансгенной мыши, не содержащей функциональный рецептор-1 рилизинг-фактора кортикотропина, способ идентификации агониста или антагониста рилизинг- фактора кортикотропина, урокортина или лиганда семейства рилизинг-фактора кортикотропина иПатент на изобретение №: 2236127 Автор: ЛИ Куо-Фен (US), ВЕЙЛ Вайли (US) Патентообладатель: РИСЕРЧ ДИВЕЛОПМЕНТ ФАУНДЕЙШН (US) Дата публикации: 20 Сентября, 2004 Начало действия патента: 30 Марта, 1999 Адрес для переписки: 129010, Москва, ул. Б. Спасская, 25, стр. 3, ООО "Юридическая фирма Городисский и Партнеры", пат.пов. Н.Г.Лебедевой Изображения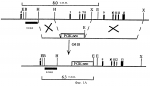 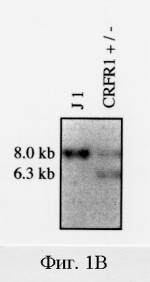 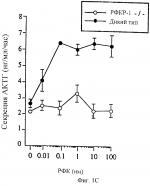 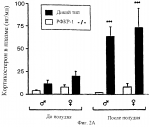 Изобретение относится к генной инженерии, эндокринологии и нейроэндокринологии. Предложен способ создания трансгенной мыши, не содержащей функциональный рецептор-1 рилизинг-фактора кортикотропина. Предложенный способ предусматривает получение позитивных эмбриональных стволовых клеток путем введения в них трансгена рецептора-1 рилизинг-фактора кортикотропина. Далее полученные позитивные эмбриональные стволовые клетки вводят в мышиную бластоцисту с дальнейшим развитием из нее трансгенной мыши. Кроме того, предложен способ идентификации агониста рилизинг-фактора кортикотропина, урокортина или лиганда семейства рилизинг-фактора кортикотропина. Данный способ предусматривают введение тестируемого соединения или соединения плацебо трансгенной мыши, параллельное введение рилизинг-фактора кортикотропина, урокортина или лиганда семейства рилизинг-фактора кортикотропина мыши дикого типа с последующей оценкой и сравнением уровня реакции тревоги, эндокринного ответа на стресс и ритмов локомоторной активности у трансгенных мышей и мышей дикого типа. Кроме того, предложен способ идентификации антагониста рилизинг-фактора кортикотропина, урокортина или лиганда семейства рилизинг-фактора кортикотропина. Данный способ предусматривает введение тестируемого соединения или соединения плацебо трансгенной мыши, параллельное введение рилизинг-фактора кортикотропина, урокортина или лиганда семейства рилизинг-фактора кортикотропина мыши дикого типа с последующей оценкой и сравнением уровня реакции тревоги, эндокринного ответа на стресс и ритмов локомоторной активности у каждой мыши. Также предложен способ скрининга соединений, которые являются аналогами или агонистами кортикостерона или кортикотропина, с использованием такой мыши. Данный способ предусматривает введение самке трансгенной мыши после зачатия тестируемого соединения с последующим определением состояния легких у потомства, полученного от данной самки. Предложенная трансгенная мышь может быть использована в эндокринологии и нейроэндокринологии как модельное животное для анализа роли рецептора рилизинг-фактора в развитии организма, оценки его биологических функций. Предложенные способы могут быть использованы для получения антагонистов рецептора-1 рилизинг-фактора кортикотропина, которые могут быть использованы для лечения или диагностики различных нейропсихиатрических нарушений и для улучшения обучаемости и памяти в случаях слабоумия. 4 н. и 3 з.п. ф-лы, 20 ил.
Перекрестная ссылка на близкие заявки Данная заявка испрашивает приоритет предварительной заявки на патент США, имеющей порядковый номер 60/079874, поданной 30 марта 1998 г., которая в настоящее время отозвана. Сведения о государственном финансировании Данное изобретение частично было выполнено благодаря финансированию, полученному по гранту DK-26741 от National Institutes of Health. Поэтому федеральное правительство имеет определенные права на данное изобретение. Область изобретения Данное изобретение в основном относится к области эндокринологии и нейроэндокринологии. Более конкретно, данное изобретение связано с вопросами, касающимися рецептора-1 рилизинг-фактора кортикотропина и животных с недостаточностью рецептора-1 рилизинг-фактора кортикотропина. Описание уровня техники Выживаемость организма зависит от поддержания гомеостаза в ответ на условия стресса. Гомеостаз поддерживается благодаря адаптивным ответам, направленным на нейтрализацию действия неблагоприятных стимулов (Chrousos et al., 1992). Как правило, эти адаптивные ответы возникают в результате стимуляции нервных путей, связанных с самозащитой, а именно с вниманием, возбуждением и агрессивностью, и в результате ингибирования путей, которые обеспечивают вегетативные функции, такие как рост, размножение и питание (Chrousos et al., 1992). Рилизинг-фактор кортикотропина (РФК) является основным интегрирующим звеном эндокринного, нейроэндокринного, вегетативного и поведенческого ответов на стресс у млекопитающих (Owens and Nemeroff, 1991; Vale et al., 1981). Нарушение регуляции ответа на стресс приводит в итоге к довольно тяжелым психологическим и физиологическим последствиям. Действительно, хроническая гиперактивация системы рилизинг-фактора кортикотропина связана со многими аффективными расстройствами, такими как страх, неврастеническая анорексия и меланхолическая депрессия (Chrousos et al., 1992; Orth, 1992). Кроме этой роли в ответе на стресс рилизинг-фактор кортикотропина также вовлечен в контроль познавательной деятельности. Известно, что рилизинг-фактор кортикотропина повышает обучаемость и улучшает память у грызунов (Behan et al., 1995, Diamant and de Wied, 1993, Koob and Bloom, 1985, Liang and Lee, 1988), и изменения в системе рилизинг-фактора кортикотропина связаны с некоторыми нейродегенеративными заболеваниями, такими как болезнь Альцгеймера и Паркинсона (De Souza, 1995). Однако влияние на развитие и физиологию этих зависящих от рилизинг-фактора кортикотропина путей, вовлеченных в явления, связанные со стрессом, и в познавательную деятельность, недостаточно выяснены. Представления о плейотропной природе системы рилизинг-факторов кортикотропина недавно были расширены в результате открытия урокортина (УКН), второго представителя семейства рилизинг-факторов кортикотропина млекопитающих. Охарактеризованная последовательность урокортина среднего мозга крыс только на 45% сходна с последовательностью рилизинг-фактора кортикотропина (Vaughan et al., 1995). Хотя точная функция урокортина неизвестна, этот пептид может имитировать многие биологические воздействия рилизинг-фактора кортикотропина in vitro и in vivo (Spina et al., 1996; Turnbull et al., 1996; Vaughan et al., 1995) несмотря на то, что отличается по параметрам эффективности действия. Биологическое действие представителей семейства рилизинг-факторов кортикотропина опосредовано связыванием со специфичными высоко аффинными мембранными рецепторами, которые относятся к подсемейству связывающих G-белки рецепторов, которые связывают небольшие лиганды, включая секретин, вазоактивный пептид кишечника и рилизинг-фактор гормона роста (Serge and Goldring, 1993). У нескольких видов были охарактеризованы два различных подтипа рецепторов рилизинг-фактора кортикотропина, рецептор-1 рилизинг-фактора кортикотропина и рецептор-2 рилизинг-фактора кортикотропина (Grigoriadis et al., 1996; Vale et al., 1997). Аминокислотные последовательности рецептора-1 рилизинг-фактора кортикотропина и рецептора-2 рилизинг-фактора кортикотропина сходны примерно на 71% (Grigoriadis et al., 1996; Vale et al., 1997), рецепторы отличаются по фармакологическим свойствам и уникальны по характеру экспрессии в головном мозгу и периферических тканях. Во взрослом организме экспрессия рецептора-1 рилизинг-фактора кортикотропина ограничена в основном отделами головного мозга, включая ствол мозга, мозжечок, кору головного мозга и медиальную перегородку, а также гипофиз (Chalmers et al., 1995; Potter et al., 1994). В отличие от этого рецептор-2 рилизинг-фактора кортикотропина экспрессируется в некоторых периферических тканях, включая сердце, скелетную мускулатуру, желудочно-кишечный тракт и эпидидимис (Kishimoto et al., 1995; Lovenberg et al., 1995; Perrin et al., 1995; Stenzel et al., 1995), и экспрессия в мозгу преобладает в области латеральной перегородки и области гипоталамуса (Chalmers et al., 1995; Perrin et al., 1995). Хотя рецепторы каждого из подтипов могут связывать и рилизинг-фактор кортикотропина и урокортин, урокортин проявляет примерно в 40 раз более высокое сродство к рецептору-2 рилизинг-фактора кортикотропина, чем рилизинг-фактор кортикотропина (Vaughan et al., 1995). Эти результаты свидетельствуют о том, что урокортин может быть предполагаемым эндогенным лигандом рецептора-2 рилизинг-фактора кортикотропина. Однако специфичные молекулы рецептора рилизинг-фактора кортикотропина, которые инициируют каждый из различных адаптивных ответов на неблагоприятные стимулы, точно не установлены. Роль различных компонентов системы рилизинг-факторов кортикотропина в развитии освещена неполно. В ходе эмбрионального и неонатального развития происходит временная и пространственная регуляция экспрессии рилизинг-фактора кортикотропина, и у мышей, содержащих молчащий ген рилизинг-фактора кортикотропина, проявляются эндокринные нарушения и аномалии развития (Muglia et al., 1995). Кроме того, рецепторы рилизинг-фактора кортикотропина присутствуют в отдельных областях головного мозга крыс уже на 15 день эмбрионального развития, и их экспрессия регулируется в ходе развития в ранний неонатальной период жизни (Avishai-Eliner et al., 1996; Insel et al., 1988). Однако существование различных подтипов рецептора рилизинг-фактора кортикотропина и дополнительных родственных рилизинг-фактору кортикотропина лигандов делает необходимым проведение систематического анализа биологических путей, опосредованных каждым из подтипов рецепторов рилизинг-фактора кортикотропина. Таким образом, для предшествующего уровня техники характерен недостаток в понимании роли в развитии организма системы рилизинг-фактора кортикотропина, подтипов рецепторов рилизинг-фактора кортикотропина и отсутствие линий животных с недостаточностью рецептора-1 рилизинг-фактора кортикотропина. Данное изобретение представляет собой осуществление этой давно необходимой и долгожданной работы в этой области. Сущность изобретения Чтобы проанализировать специфическую роль в развитии и биологические функции путей, опосредованных рецептором рилизинг-фактора кортикотропина, благодаря гомологичной рекомбинации в эмбриональных стволовых клетках были получены мыши с недостаточностью рецептора-1 рилизинг-фактора кортикотропина. Обнаружено, что рецептор-1 рилизинг-фактора кортикотропина совершенно необходим как для развития надпочечника, так и для обеспечения нормального эндокринного ответа на стресс. Кроме того, у мутантных по рецептору-1 рилизинг-фактора кортикотропина мышей проявлялась ослабленная реакция тревоги и изменялся циркадный ритм локомоторной активности. Мыши с недостаточностью рецептора-1 рилизикг-фактора кортикотропина представляют собой удобную модельную систему для характеристики подтипов рецепторов рилизинг-фактора кортикотропина, участвующих в обеспечении различных адаптивных ответов на стресс и в познавательной деятельности. Целенаправленное нарушение гена рецептора-1 рилизинг-фактора кортикотропина отчетливо показало специфическую роль в развитии организма рецептора-1 рилизинг-фактора кортикотропина, который позволяет обеспечить секрецию АКТГ, достаточную для постнатального развития, и функционирование продуцирующей кортикостероиды области надпочечника. Мутация гена рецептора-1 рилизинг-фактора кортикотропина позволила также доказать ключевую роль этого рецептора в опосредовании эндокринного и поведенческого ответов на стресс и выявить новую функцию зависимых от рецептора-1 рилизинг-фактора кортикотропина путей в модулировании ритмов локомоторной активности. Для четкого разграничения вклада каждого из представителей системы рилизинг-фактора кортикотропина в развитие организма и поддержания гомеостаза необходимо создание животных с мутациями, которые затрагивают другие компоненты сигнальных путей рилизинг-фактора кортикотропина, причем эти животные затем могут быть скрещены с линиями мышей, описанными в данном изобретении. Одной из целей данного изобретения является создание трансгенных мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина. В одном осуществлении данного изобретения разработан способ получения трансгенных мышей, имеющих существенную недостаточность рецептора-1 рилизинг-фактора кортикотропина. В еще одном осуществлении данного изобретения разработан способ, с помощью которого может быть идентифицирован агонист или антагонист рилизинг-фактора кортикотропина, урокортин или близкие лиганды, которые действуют не через рецептор-1 рилизинг-фактора кортикотропина, а через другие рецепторы. Следующий и дальнейшие аспекты, признаки и преимущества данного изобретения будут очевидны из последующего описания предпочтительных в настоящее время осуществлении. Эти осуществления даны с целью раскрытия сущности изобретения. Краткое описание чертежей Прилагаемые чертежи включены сюда с тем, чтобы перечисленные выше признаки, преимущества и объекты изобретения стали очевидными и могли быть поняты в деталях. Эти чертежи являются частью подробного описания. Однако следует отметить, что прилагаемые чертежи лишь иллюстрируют предпочтительные осуществления изобретения и их не следует рассматривать как ограничение объема притязаний изобретения. На фигуре 1 показано создание мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина. Фигура 1А: (вверху) геномная организация гена рецептора-1 рилизинг-фактора кортикотропина, показаны экзоны 4-13. (В середине) конструкция, которая целенаправленно используется для гомологичной рекомбинации. Фрагмент HindIII-Xbal (экзоны 5-8), кодирующий последние двенадцать аминокислот первого внеклеточного домена и последовательность до четвертого трансмембранного домена, был удален и замещен кассетой PGK-neo. (Внизу) полученный в результате гомологичной рекомбинации мутантный локус. Фигура 1В: нарушенный аллель рецептора-1 рилизинг-фактора кортикотропина был идентифицирован путем Саузерн-анализа с использованием внешней по отношению к отделу делеции BamHI-HindIII пробы, которая позволяет выявить полосу дикого типа длиной 8,0 т.п.н. и мутантную полосу длиной 6,3 т.п.н. соответственно; J1 (родительская линия ЭС клеток), J1- +/- по рецептору-1 рилизинг-фактора кортикотропина (ЭС клон гетерозиготный по мутации). Фигура 1С: стимулированная рилизинг-фактором кортикотропина (РФК) секреция АКТГ в монослойных культурах из целых гипофизов, собранных от мышей дикого типа и мутантов по рецептору-1 рилизинг-фактора кортикотропина (рецептор-1 рилизинг-фактора кортикотропина -/-). На фигуре 2 показаны мутантные мыши с недостаточностью рецептора-1 рилизинг-фактора кортикотропина (РФКР-1) в надпочечниках. Фигура 2А: заметно сниженные концентрации кортикостерона в плазме мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина. Образцы крови собирали от самцов и самок дикого типа и мышей, мутантных по рецептору-1 рилизинг-фактора кортикотропина (рецептор-1 рилизинг-фактора кортикотропина -/-) утром (6 утра) и после полудня (4 после полудня), и определяли концентрации кортикостерона в плазме (среднее В± стандартное отклонение; ***Р<0,001). Фигура 2В: мутантные по рецептору-1 рилизинг-фактора кортикотропина мыши с выраженной атрофией надпочечников. Сделаны срезы надпочечников самок мышей дикого типа и мышей -/- по рецептору-1 рилизинг-фактора кортикотропина, окрашены гематоксилином и эозином. Отмечена явная гипоплазия отдела пучковой зоны zona fasciculata (ZF), в котором происходит наработка кортикостерона. Отделы клубочковой зоны zona glomerulosa (ZG), сетчатой зоны zona retlcularis (ZR) и мозгового вещества (М) оставались относительно неизменными. Фигура 2С: развитие клеток, вырабатывающих кортикотропины у мышей, мутантных по рецептору-1 рилизинг-фактора кортикотропина. Приготовлены срезы гипофизов мышей дикого типа и мышей -/- по рецептору-1 рилизинг-фактора кортикотропина, и клетки, вырабатывающие кортикотропины были локализованы с помощью анти-АКТГ антител. Не наблюдалось различий в количестве кортикотропинвырабатывающих клеток. (А) передняя доля гипофиза, (I) промежуточная доля. На фигуре 3 показан повышенный уровень экспрессии рилизинг-фактора кортикотропина при неизменном уровне экспрессии аргинин вазопрессина в гипоталамусе мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина. В результате иммуногистохимической локализации рилизинг-фактора кортикотропина (фигура 3А) и аргинин вазопрессина (фигура 3В) в паравентрикулярных ядрах гипоталамуса (ПВЯ) мышей дикого типа и мышей -/- по рецептору-1 рилизинг-фактора кортикотропина показан повышенный уровень экспрессии рилизинг-фактора кортикотропина у мутантных животных. В других отделах мозга, продуцирующих рилизинг-фактор кортикотропина, в частности в миндалевидном теле, уровень экспрессии не был увеличен (данные не показаны). На фигуре 4 показан ослабленный эндокринный ответ на стресс у мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина. Были измерены базальные уровни и уровни после стресса АКТГ (фигура 4А) и кортикостерона (фигура 4В) у мышей дикого типа и мутантных мышей обоих полов, которых подвергали 10-минутному физическому ограничению движения (среднее В± стандартное отклонение; *Р<0,05, ***Р<0,001). На фигуре 7 показано гормональное восстановление дефекта надпочечников у мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина. Фигура 7А: на окрашенных гематоксилином и эозином срезах надпочечников, собранных от мышей дикого типа и мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина на 3 день постнатального развития, не выявляются различия в морфологии надпочечников во время раннего постнатального периода. Фигура 7В: надпочечники, собранные от мышей -/- по рецептору-1 рилизинг-фактора кортикотропина, которых дважды в день, начиная с 10-21 дня постнатального развития, обрабатывали АКТГ или одним растворителем. Отмечен увеличенный размер и толщина отдела zona fasciculata надпочечников, мутантных по рецептору-1 рилизинг-фактора кортикотропина мышей, обработанных АКТГ. Фигура 7С: концентрации АКТГ в плазме на 10 день постнатальной жизни в образцах, собранных от мышей -/- по рецептору-1 рилизинг-фактора кортикотропина или мышей дикого типа (среднее В± стандартное отклонение; **Р<0,02). В соответствии с данным изобретением могут быть использованы традиционные молекулярно-биологические, микробиологические технологии и технологии рекомбинантных ДНК, разработанные в данной области. Такие технологии полно раскрыты в литературе. Смотри, например, Maniatis, Fritsch and Sambrook, "Molecular Cloning: A Laboratory Manual" (1982); "DNA Cloning: A Practical Approach," Volumes I and II (D.N. Glover ed. 1984); "Oligonucleotide Synthesis"(M.J. Gait ed. 1984); "Nucleic Acid Hybridization" [B.D. Hames and S.J. Higgins eds. (1985)]; "Transcription and Translation" [B.D. Hames and S.J. Higgins eds. (1984)]; "Animal Cell Culture" [R.I. Freshney, ed. (1986)]; "Immobilized Cells And Enzymes" [IRL Press, (1986)]; В. Perbal, "A Practical Guide To Molecular Cloning" (1984). Поэтому, если здесь фигурируют следующие термины, то их следует понимать так, как изложено ниже. Термин “молекула ДНК” относится к полимерной форме дезоксирибонуклеотидов (аденин, гуанин, тимин или цитозин) либо в одноцепочечной форме, либо в форме двухцепочечной спирали. Этот термин относится только к первичной и вторичной структуре молекулы, при этом молекула может иметь любую третичную форму без ограничения. Таким образом, этот термин включает в себя двухцепочечную ДНК, обнаруживаемую наряду с другими формами в виде линейных молекул ДНК (например, фрагменты рестрикции), вирусов, плазмид и хромосом. При обсуждении здесь приводятся структуры в соответствии со стандартным правилом обозначения последовательностей в направлении от 5' к 3' концу вдоль нетранскрибируемой цепи ДНК (т.е. цепи, имеющей последовательность гомологичную мРНК). “Вектор” представляет собой репликон, такой как плазмида, фаг или космида, к которому может быть присоединен другой фрагмент ДНК так, чтобы могла осуществляться репликация присоединенного фрагмента. “Репликон” представляет собой генетический элемент (например, плазмиду, хромосому, вирус), который функционирует in vivo как автономная единица репликации ДНК; т.е. способен к репликации под своим собственным контролем. Термин “точка начала репликации” относится к таким последовательностям ДНК, которые принимают участие в синтезе ДНК. “Контролирующая экспрессию последовательность” - это последовательность ДНК, которая контролирует и регулирует транскрипцию и трансляцию другой последовательности ДНК. Кодирующая последовательность в клетке является “оперативно сцепленной” или “под контролем” последовательности, контролирующей транскрипцию или трансляцию, тогда, когда РНК-полимераза транскрибирует мРНК с кодирующей ее последовательности, с этой мРНК затем транслируется белок, информация о котором записана в кодирующей последовательности. Как правило, экспрессирующие векторы, содержащие промоторные последовательности, которые способствуют эффективной транскрипции и трансляции встроенного фрагмента ДНК, используются в соответствии с выбранным хозяином. Обычно экспрессирующий вектор содержит начало репликации, промотор(ры), терминатор(ры), а также специфичные гены, которые способны обеспечить селекцию клеток по фенотипу, обычно называемые “селектируемыми маркерными генами” или “селектируемыми маркерами”. Ферментация и культивирование трансформированных хозяев может проводиться в соответствии со способами, известными в данном области, с помощью которых достигается оптимальный рост клеток. “Кодирующая последовательность” ДНК представляет собой двухцепочечную последовательность ДНК, с которой in vivo транскрибируется и транслируется полипептид в том случае, когда эта последовательность помещена под контроль соответствующей регуляторной последовательности. Границы кодирующей последовательности определяются стартовым кодоном на 5' (амино) конце и стоп кодоном трансляции на 3' (карбоксильном) конце. Кодирующая последовательность может включать в себя прокариотические последовательности, кДНК, синтезированную на мРНК эукариот, геномные последовательности ДНК эукариот (например, млекопитающих) и даже синтетические последовательности ДНК, но при этом, не ограничиваясь только названными последовательностями. Сигнал полиаденилирования и последовательность терминации транскрипции обычно будут локализованы вблизи 3' конца кодирующей последовательности. “кДНК” является сокращенным определением ДНК-копии или комплементарной ДНК и является продуктом реакции обратной транскрипции с мРНК транскрипта. “Экзон” представляет собой экспрессируемую последовательность, транскрибируемую в генном локусе, тогда как “интрон” представляет собой неэкспрессируемую последовательность, находящуюся в генном локусе. Последовательности, контролирующие транскрипцию и трансляцию, представляют собой регуляторные последовательности ДНК, такие как промоторы, энхансеры, сигналы полиаденилирования, терминаторы и им подобные, которые обеспечивают экспрессию кодирующей последовательности в клетке-хозяине. “Цис-элемент” - это нуклеотидная последовательность, называемая также “консенсусной последовательностью” или “мотивом”, которая взаимодействует с другими белками, которые могут стимулировать или подавлять экспрессию специфичного генного локуса. В состав кодирующей последовательности может быть также включена “сигнальная последовательность”. Эта последовательность кодирует сигнальный пептид, расположенный на N-конце полипептида, который сообщается с клеткой-хозяином и направляет полипептид в соответствующее место в клетке. Сигнальная последовательность может быть ассоциирована с рядом белков, присущих прокариотам и эукариотам. “Промоторная последовательность” представляет собой регуляторный отдел ДНК, способный связывать РНК полимеразу в клетке и инициировать транскрипцию кодирующей последовательности ниже по течению (3’ направление). В соответствии с целью данного изобретения промоторная последовательность определена как последовательность, ограниченная на 3' конце сайтом инициации транскрипции и расположенная выше по течению (5' направление) так, чтобы включить минимальное число нуклеотидов или элементов, необходимых для инициации транскрипции на уровне, который превышает фоновый уровень и может быть обнаружен. В составе промоторной последовательности может быть выявлен сайт инициации транскрипции, а также связывающий белки домен (последовательность консенсуса), ответственный за связывание РНК-полимеразы. Часто, но не всегда промоторы эукариот содержат ТАТА-боксы и САТ-боксы. Промоторы прокариот содержат в дополнение к -10 и -35 последовательностям консенсуса последовательности Шайн-Далгарно (Shine-Dalgarno). Термином “олигонуклеотид” обозначается молекула, состоящая из двух или более дезоксирибонуклеотидов, предпочтительно более чем из трех. Его точный размер зависит от многих факторов, которые, в свою очередь, зависят от основного назначения и применения олигонуклеотида. Используемый здесь термин “праймер” относится к олигонуклеотиду, который получают либо естественным путем в виде очищенного продукта переваривания рестриктазами, либо синтетическим путем и который способен действовать как точка инициация синтеза, если помещается в условия, при которых индуцируется синтез продукта удлинения праймера, который комплементарен "цепи нуклеиновой кислоты”, т.е. в присутствии нуклеотидов и индуцирующих агентов, таких как ДНК-полимераза, и соответствующий температуре и рН. Праймер может быть либо одноцепочечным, либо двухцепочечным и должен быть достаточно длинным, чтобы направлять синтез продукта необходимой протяженности в присутствии индуцирующего агента. Точная длина праймера будет зависеть от многих факторов, включая температуру, источник получения праймера и используемый способ. Например, для применения в целях диагностики в зависимости от сложности последовательности мишени олигонуклеотидный праймер обычно содержит 15-25 или более нуклеотидов, хотя он может содержать меньше нуклеотидов. Праймеры выбираются так, чтобы они существенно были комплементарны разным цепям конкретной последовательности ДНК мишени. Это означает, что праймеры должны быть комплементарны в такой степени, которая достаточна для гибридизации с соответствующими им цепями. Поэтому не требуется, чтобы последовательность праймера была точным отражением последовательности матрицы. Например, к 5' концу праймера может быть присоединен некомплементарный нуклеотидный фрагмент, при этом сохраняется комплементарность цепи ДНК остальной части последовательности праймера. В альтернативном случае некомплементарные основания или более длинные последовательности могут быть встроены в праймер при условии, что последовательность праймера будет достаточно комплементарна последовательности или будет к тому же гибридизоваться и тем самым формировать матрицу для синтеза протяженного продукта. Термины “эндонуклеазы рестрикции” и “ферменты рестрикции” в том смысле, в котором здесь используются, относятся к ферментам, которые разрезают двухцепочечную ДНК внутри или вблизи специфичной нуклеотидной последовательности. Термин “технология рекомбинантной ДНК” относится к технологиям объединения двух гетерологичных молекул ДНК обычно в результате лигирования ДНК различных организмов в условиях in vitro. Рекомбинантные молекулы ДНК, как правило, получают в экспериментах, используемых в генетической инженерии. К синонимам термина относятся “сплайсинг генов”, “молекулярное клонирование” и “генетическая инженерия”. Конечным продуктом этих манипуляций является “рекомбинант”, “рекомбинантная молекула” или “трансген”. Клетка оказывается “трансформированной”, “трансфицированной” или “трансдуцированной” экзогенной или гетерологичной ДНК тогда, когда такая ДНК введена внутрь клетки. Трансформирующая ДНК может быть либо интегрирована в геном клетки (ковалентно связана), либо оставаться неинтегрированной. Например, в клетках прокариот, дрожжей и млекопитающих трансформирующая ДНК может сохраняться в эписомном элементе, таком как вектор или плазмида. Что касается клеток эукариот, стабильно трансформированная клетка - это такая клетка, в которой трансформирующая ДНК оказывается интегрированной в хромосому, так что она наследуется дочерними клетками посредством репликации хромосомы. Показателем этой стабильности является способность эукариотической клетки порождать линии клеток или клоны, состоящие их популяции дочерних клеток, которые содержат трансформирующую ДНК. “Клон” - это популяция клеток, полученных от одной единственной клетки или клетки-предшественницы путем митоза. “Линия клеток” - это клон исходной клетки, который способен стабильно расти в условиях in vitro, сменяя много поколений. Организм, такой как растение или животное, который трансформирован экзогенной ДНК, называется “трансгенным”. Термин “хозяин” в используемом здесь смысле относится не только к прокариотам, но также и к эукариотам, таким как клетки дрожжей, растений и животных. Молекула рекомбинантной ДНК или ген, который кодирует белок по данному изобретению, может быть использован для трансформации хозяина с помощью любой технологии, общеизвестной специалистам, постоянно работающим в этой области. Одним из предпочтительных вариантов является применение векторов, содержащих кодирующие последовательности гена, в целях трансформации прокариот. В качестве хозяина могут использоваться прокариоты Е. coli, S. tymphimurium, Serratia marcescens и Bacillus subtilis. К хозяевам эукариотам относятся дрожжи, такие как Pichia pastoris, клетки млекопитающих и клетки насекомых, и более предпочтительно клетки растений, такие как Arabidopsis thaliana и Tabaccum nicotiana. Две последовательности ДНК вЂњв достаточной степени гомологичны” в том случае, когда, по меньшей мере, примерно 75% (предпочтительно, по меньшей мере, примерно 80% и более предпочтительно, по меньшей мере, примерно 90% и 95%) нуклеотидов совпадают на участке последовательности ДНК определенной протяженности. Последовательности, которые в достаточной степени гомологичны, могут быть идентифицированы путем сравнения последовательностей с помощью стандартных компьютерных программ, имеющихся для банков данных последовательностей, или в экспериментах по Саузерн-гибридизации, например, в жестких условиях, которые установлены для конкретной системы. Подходящие условия гибридизации подбираются специалистами в данной области. Смотри, например, Maniatis et al., указано выше; DNA Cloning, Vols. I and II, указано выше; Nucleic Acid Hybridization, указано выше. “Гетерологичный” отдел конструкции ДНК - это идентифицируемый участок ДНК в пределах большей по размеру молекулы ДНК, который в природе не ассоциирован с этой большей по размеру молекулой ДНК. Таким образом, в том случае, когда гетерологичный отдел кодирует ген млекопитающих, ген будет, как правило, фланкирован ДНК, которая не фланкирует геномную последовательность ДНК млекопитающих в геноме исходного организма. В другом примере кодирующая последовательность представляет собой конструкцию, в которой кодирующая последовательность как таковая не встречается в природе (например, кДНК, в которой геномная кодирующая последовательность содержит интроны или синтетические последовательности, имеющие кодоны, отличные от таковых в нативном гене). Как было здесь установлено, аллельные варианты или мутационные события, происходящие естественным путем, не увеличивают гетерологичный отдел ДНК. Стандартное Нозерн-блот исследование может быть использовано для установления относительных количеств мРНК в клетке или ткани, полученных из растений или других трансгенных тканей, в соответствии с традиционной технологией Нозерн-гибридизации, которая известна специалистам, постоянно работающим в этой области. В альтернативном случае может быть использовано стандартное Саузерн-блот исследование для подтверждения наличия и определения числа копий гена в трансгенных системах в соответствии с традиционной технологией Саузерн-гибридизации, известной специалистам, постоянно работающим в данной области. И в случае применения Нозерн-блота, и в случае Саузерн-блота используются гибридизационные зонды, например радиоактивно-меченная кДНК, или фрагмент последовательности ДНК, длиной, по меньшей мере, равной 20 (предпочтительно, по меньшей мере, 30, более предпочтительно, по меньшей мере, 50 и наиболее предпочтительно, по меньшей мере, 100), следующих друг за другом нуклеотидов. Зонд для ДНК гибридизации может быть помечен любым из многочисленных способов, известных специалистам в данной области. В большинстве случаев меткой в этих исследованиях служат радиоактивные элементы, ферменты, химические вещества, которые способны к флуоресценции при действии ультрафиолетового излучения, и другие. Известно большое количество флуоресцирующих материалов, и они могут быть использованы в качестве метки. К ним относятся, например, флуоресцеин, родамин, аурамин, Texas красный, АМСА синий и Lucifer желтый. Особым материалом для регистрации являются антикроличьи антитела, полученные у коз и конъюгированные с флуоресцеином с помощью изотиоцианата. Белки могут быть также помечены радиоактивным элементом или ферментом. Радиоактивную метку можно обнаружить любым доступным в настоящее время способом счета. Предпочтительно изотопы можно выбрать из группы, в которую входят 3H, 14С, 32P, 35S, 36Cl, 51Cr, 57Co, 58Co, 59Fe, 90Y, 125I, 131I и 186Re. Также применяются ферментные метки, они могут быть обнаружены с помощью любой используемой в настоящее время колориметрической, спектрофотометрической, флуороспектрофотометрической, амперометрической или газометрической технологии. Фермент конъюгируют с выбранной частицей в результате реакции образования межмолекулярных мостиков, в частности, с помощью карбодиимида, диизоцианатов, глутаральдегида и им подобных. Многие ферменты, которые можно использовать в этих процедурах, известны и могут быть применены. Предпочтительными ферментами являются пероксидаза, Целью данного изобретения является создание трансгенных мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина. Такая недостаточность приводит в итоге к ослабленной реакции тревоги у мышей, ослабленному эндокринному ответу на стресс и измененным ритмам локомоторной активности по сравнению с контрольными мышами. Впоследствии эти мыши могут быть скрещены с мышами других линий, чтобы получить потомство. Объектом данного изобретения является также способ, с помощью которого могут быть идентифицированы агонисты или антагонисты рилизинг-фактора кортикотропина, урокортин или родственные лиганды, которые действуют не через рецептор-1 рилизинг-фактора кортикотропина, а через другие рецепторы. Способ включает в себя введение тестируемого соединения или плацебо трансгенным мышам с недостаточностью рецептора-1 рилизинг-фактора кортикотропина и определение влияния тестируемого соединения или плацебо на уровень развития реакции тревоги, эндокринный ответ на стресс и ритмы локомоторной активности у мышей. Изменение уровня реакции тревоги, эндокринного ответа на стресс или ритмов локомоторной активности служит признаком агониста или антагониста рилизинг-фактора кортикотропина, урокортина или родственных лигандов, действующих не через рецептор-1 рилизинг-фактора кортикотропина, а через другой рецептор. Этими другими рецепторами могут быть рецептор-2 рилизинг-фактора кортикотропина или новые, не известные ранее рецепторы рилизинг-фактора кортикотропина. Целью данного изобретения является также способ получения трансгенных мышей, обладающих существенной недостаточностью рецептора-1 рилизинг-фактора кортикотропина. Этот способ включает в себя получение позитивных ЭС клеток путем введения в эмбриональные стволовые клетки трансгена рецептора-1 рилизинг-фактора кортикотропина, полученного на основе гена рецептора-1 рилизинг-фактора кортикотропина мышей. Трансген включает в себя ген, кодирующий селектируемый маркер, в положении от 5 до 8 экзона гена рецептора-1 рилизинг-фактора кортикотропина, при этом ЭС клетки, которые выживают и растут в условиях отбора на селектируемый маркер, являются позитивными ЭС клетками, и трансгенных мышей получают путем введения позитивных ЭС клеток в бластоциты C57BL/6. Эти трансгенные мыши могут быть скрещены, чтобы получить трансгенных мышей, гомозиготных по трансгену. Целью данного изобретения является также способ скрининга соединений, которые являются аналогами или агонистами кортикостерона или кортикотропина. Этот способ включает в себя проведение скрещивания между гомозиготной самкой мыши и гомозиготным самцом мыши, каждый из которых имеет недостаточность рецептора-1 рилизинг-фактора кортикотропина, введение соединения самке мыши после зачатия и гистологическое определение состояния легких в потомстве, рожденном от самки мыши. Отсутствие дисплазии, альвеолярного коллапса и реактивной эмфиземы с внутриальвеолярным кровотечением и отложениями гемосидерина являются показателями аналога или агониста кортикостерона или кортикотропина. Целью данного изобретения является также способ ослабления респираторного дистресс-синдрома новорожденных, заключающийся во введении фармацевтически приемлемой дозы кортикостерона in utero плоду, в случае, если для него предполагается проявление респираторного дистресс-синдрома новорожденных. Следующие примеры даны с целью иллюстрации различных вариантов изобретения и не подразумевают ограничение данного изобретения каким-либо образом. Пример 1 Конструирование целевого вектора, получение культуры клеток ЭС и проверка нуль-мутации Клонированная геномная ДНК, соответствующая локусу рецептора-1 рилизинг-фактора кортикотропина, была выделена из библиотеки геномной ДНК мышей линии 129. Целевая конструкция была создана посредством замещения экэонов 5-8 гена рецептора-1 рилизинг-фактора кортикотропина, кодирующих последовательность белка, начиная от последних 12 аминокислот первого внеклеточного домена и до четвертого трансмембранного домена, на кассету PGK-nео (фигура 1). Полученную в итоге плазмидную ДНК линеаризовали NotI и путем электропорации вводили в эмбриональные стволовые (ЭС) клетки J1, как описано (Lee et al., 1992). После селекции в 0,2 мг/мл G418 в течение 7-9 дней были отобраны индивидуальные клоны, резистентные к неомицину, и 50% клеток из каждого клона распределяли в 96-луночные планшеты для замораживания и оставшиеся 50% в 24-луночные планшеты для выделения ДНК. Проводили скрининг колоний на присутствие нарушенной аллели рецептора-1 рилизинг-фактора кортикотропина путем Саузерн-анализа, используя внешний по отношению к отделу делеции BamHI/HindIII фрагмент геномной ДНК, который гибридизуется с 5' концом целевой конструкции (фигура 1А). Клоны ЭС клеток, содержащие EcoRI фрагмент длиной 6,3 т.п.н., который является диагностическим признаком гомологичных рекомбинантов, получали с частотой 1 из 83. Клетки из позитивных ЭС клонов путем инъекции вводили в бластоциты C57BL/6 и получали химерных мышей, как описано (Lee et al., 1992). Передачу мутантного аллеля через зародышевую линию клеток определяли путем Саузерн-анализа концевых ДНК, собранных от мышат F1 с цветом шерсти агути (фигура 1В). Наличие делеции в гене рецептора-1 рилизинг-фактора кортикотропина также подтверждали путем ПЦР-анализа с обратной транскриптазой РНК, выделенной из мозжечков гомозиготных мутантных мышей и мышей дикого типа, с использованием праймеров, комплементарных экзонам 6 и 8 (отдел делеции). В качестве позитивного контроля для всех реакций была амплифицирована мРНК GAPDH. Первичные культуры клеток из целых гипофизов мышей использовали для того, чтобы подтвердить наличие делеции в гене рецептора-1 рилизинг-фактора кортикотропина, результатом которой является появление нуль-мутации. Коротко, целые гипофизы собирали от мутантных самок 8-10-недельного возраста и контрольных мышей (примерно по 10 мышей в группе) и диспергировали, как описано (Vale et al., 1983). Затем клетки промывали в полной среде (bPJ) с добавлением 2% фетальной сыворотки теленка и высевали для получения монослоя (1,2 Пример 2 Гистологический, иммуногистохимический анализы и in situ гибридизация Для гистологического анализа проводили перфузию мутантных мышей и мышей дикого типа (примерно 8-10-недельного возраста, если не оговорено особо) 4% параформальдегидом и ткани иссекали (легкие, надпочечники и т.д.) и вторично фиксировали в течение 24 часов при 4 Пример 3 Отбор проб крови и анализ гормонов Для всех анализов на гормоны животных (примерно 8-10-недельного возраста, если не оговорено особо) перед отбором образцов крови путем кровопускания в заглазничной части глаза помещали на ночь по одному в накрытые тканью клетки. Образцы крови собирали в течение сорока пяти секунд после раскрывания клетки, и образцы немедленно помещали на лед в пробирках, содержащих ЭДТА. Образцы плазмы до анализа хранили при -20 Пример 4 Анализ поведения Поведенческую реакцию мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина в окружающей среде, которая вызывает страх, тестировали с помощью постановки задачи выхода при смене света и темноты и сравнивали с поведением контрольных мышей (n=6 самцов мышей в каждой группе). Всех мышей, используемых в экспериментах по оценке поведения, помещали отдельно. Тестирование проводили на белом открытом поле (50 Локомоторную активность измеряли в больших клетках из плексигласа (42 Локомоторный ответ в этом новом окружении, который тестировали во время световой фазы цикла, использовали в качестве контроля локомоторной активности в тесте на реакцию тревоги. Локомоторный ответ записывали в течение 180 минут и оценивали первые 5 минут для сравнения с 5-минутным выполнением задачи выхода при смене темноты и света. Спустя два месяца, регистрировали локомоторную активность в течение 48 часов при наличии пищи и воды. Базальной локомоторной активностью считали активность в течение 24 часового периода, следующего за 12-часовым привыканием к клеткам, используемым для работы. Локомоторный ответ регистрировали в каждой фазе и рассчитывали процент увеличения активности во время темновой фазы по сравнению со световой фазой цикла. Для сравнения множеств данных локомоторной активности двух групп использовали t-критерий Стьюдента, а также выполняли факториальный анализ - варианты повторных измерений (анализ вариантов), считая принадлежность к группе (дикого типа и мутантных животных) как фактор, определяемой разницей в объектах, а временной ход локомоторной активности как фактор, определяемый самим объектом. Сравнение между группами при выполнении задачи выхода при смене темноты и света выполняли с помощью U-критерия Манна-Уитни (Mann-Whitney). Пример 5 Избавление от дисплазии легких с помощью введения кортикостероидов in utero Гомозиготные по рецептору-1 рилизинг-фактора кортикотропина самцов и самок мышей перекрестно скрещивали, и спаривание подтверждали по наличию копулятивной пробки (этот момент определяется как день 0 эмбрионального развития). Начиная с 12 дня эмбрионального развития, беременных самок обрабатывали кортикостероном в дозе 25 мкг/мл (Sigma, St Louis, МО), присутствующим в питьевой воде, вплоть до 14 дня постнатального развития для оценки выживаемости новорожденных. Легкие обработанных кортикостероном мутантных мышей, необработанных мутантных мышей и необработанных контрольных мышей также собирали в 1 день постнатального развития для гистологического анализа, как описано выше. Пример 6 Избавление мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина от дефекта надпочечников с помощью гормонов Мутантное потомство, которое рождалось с применением стратегии восстановления кортикостероном, описанной выше, использовали для того, чтобы определить влияние возмещения недостатка АКТГ на развитие надпочечников. Коротко, начиная с 10-21 дня постнатального развития животным дважды в день проводили подкожные инъекции АКТГ крыс в дозе 10 нг/г веса тела в растворителе (0,1 М фосфатный буфер, 0,1% бычий сывороточный альбумин, 0,01% аскорбиновая кислота, рН 7,3) или инъекции одного растворителя. Затем надпочечники обработанных АКТГ мутантных мышей (n=4) и мутантных мышей, обработанных только растворителем (n=3), собирали и подготавливали, как описано выше. Пример 7 Получение мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина Чтобы получить мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина, был сконструирован целевой вектор, в котором часть гена рецептора-1 рилизинг-фактора кортикотропина, колирующая последние двенадцать аминокислот первого внеклеточного домена и по четвертый трансмембранный домен, заменяли кассетой гена резистентности к неомицину (фигура 1А). Поэтому в результате трансляции, получаемой в таком случае нарушенной мРНК рецептора-1 рилизинг-фактора кортикотропина, образуется рецепторный белок, не способный включаться в мембрану клеток и, следовательно, нефункциональный. Шесть из пятисот колоний, среди которых проводили скрининг на резистентность к неомицину, были позитивны, что было определено с помощью Саузерн-анализа с помощью внешней по отношению к отделу делеции пробы (фигура 1В). Клетки двух линий ЭС клеток мишеней инъецировали в бластоциты C57BL/6, чтобы получить мышей, которые могут дать начало химерным животным, и получить перенос нарушенного аллеля в зародышевую линию клеток. В общем, гомозиготные мутантные мыши, родившиеся в результате спаривания гетерозигот, развивались нормально и были фертильными. Однако наблюдали, что показатель смертности самцов мышей, мутантных по рецептору-1 рилизинг-фактора кортикотропина, составлял 15%. В большинстве случаев животные не погибали в возрасте от 3 до 12 недель, и смертность не наблюдали ни в случае самок мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина, ни в случае контрольных мышей. ПЦР-анализ при комнатной температуре мРНК, выделенной из гипофизов гомозиготных мутантных животных, подтвердил наличие делеции в гене рецептора-1 рилизинг-фактора кортикотропина (данные не показаны). Чтобы определить, приводит ли делеция в гене рецептора-1 рилизинг-фактора кортикотропина к нуль-мутации, культивируемые клетки гипофиза мышей дикого типа и мутантных мышей обрабатывали в течение 1 часа от 0 до 100 нМ рилизинг-фактора кортикотропина и измеряли уровни АКТГ в культуральной среде. Обработка клеток гипофиза дикого типа рилизинг-фактором кортикотропина приводила к зависящему от дозы увеличению секреции АКТГ (фигура 1С). В отличие от этого обработка клеток гипофиза с дефицитом рецептора-1 рилизинг-фактора кортикотропина рилизинг-фактором кортикотропина в дозе от 0 до 100 нМ не приводила к увеличению секреции АКТГ (фигура 1С). Таким образом, целенаправленная мутация приводила к появлению нарушенного гена рецептора-1 рилизинг-фактора кортикотропина, который был не способен к продукции функционального рецепторного белка. Пример 8 У мышей в случае отсутствия рецептора-1 рилизинг-фактора кортикотропина проявляется резко выраженная недостаточность надпочечников Известно, что зависимые от рилизинг-фактора кортикотропина пути играют ключевую роль в регуляции системы гипоталамус-гипофиз-надпочечники (ГГН) и в осуществлении многих ответов центральной нервной системы на стресс (Owens and Nemeroff, 1991). В качестве начальной оценки функционирования системы ГГН у мутантных мышей собирали образцы плазмы от самцов и самок дикого типа и мутантных мышей в 6:00 утра и 4:00 после полудня. Мутанты по рецептору-1 рилизинг-фактора кортикотропина (самцы и самки) имели очень низкие концентрации кортикостерона в плазме по сравнению с мышами дикого типа. В частности, характерное ежедневное повышение циркулирующего кортикостерона, которое происходит во второй половине дня, у мутантных мышей отсутствует (фигура 2А). Гистологический анализ надпочечников, собранных у мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина, позволил выявить анатомическую основу наблюдаемой эндокринной недостаточности. У мутантных животных проявляется заметная атрофия zona fasciculate, отдела надпочечников, который отвечает за продукцию кортикостерона (фигура 2В). В отличие от этого zona glomerulosa, zona reticularis и мозговое вещество надпочечников мутантных мышей выглядели нормально. Более того, концентрации альдостерона в плазме мутантных мышей, который продуцируется в отделе zona glomerulosa надпочечников, были сходны с концентрациями, наблюдаемыми у мышей дикого типа (данные не показаны). Поэтому недостаточность надпочечников у мышей с дефицитом рецептора-1 рилизинг-фактора кортикотропина, по-видимому, специфично связана с отделом надпочечника, который продуцирует кортикостерон. Рилизинг-фактор кортикотропина может стимулировать пролиферацию in vivo кортикотропинвырабатывающих клеток (клетки гипофиза, продуцирующие АКТГ; Gertz et al., 1987) и АКТГ гипофиза питает отдел надпочечника, который продуцирует кортикостерон (Idelman, 1970). Поэтому была определена общая морфология и состав клеток гипофиза мутантных мышей, чтобы определить, действительно ли имел место дефект развития кортикотропинвырабатывающих клеток. Гистологический и иммуноцитохимический анализ гипофизов мутантных мышей не выявил наблюдаемых анатомических дефектов (данные не показаны) и показал наличие нормального состава кортикотропинвырабатывающих клеток (фигура 2С). Базальный уровень секреции АКТГ in vitro (фигура 1С) и содержание АКТГ в отделенных друг от друга (диспергированных) клетках гипофиза взрослых мутантных мышей были сходны с этими показателями для мышей дикого типа. Более того, базальные концентрации циркулирующего АКТГ у мутантных мышей в первой половине дня (смотри фигуру 4В) и во второй половине дня не отличались от концентраций у контрольных мышей. При исследовании окрашенных по Нисслю срезов различных отделов мозга, включая перегородку, гиппокамп и миндалевидное тело, также не было обнаружено каких-либо явных анатомических дефектов у мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина. Пример 9 Увеличенный уровень экспрессии рилизинг-фактора кортикотропина в паравентрикулярных ядрах гипоталамуса у мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина Рецептор-1 рилизинг-фактора кортикотропина является преобладающим подтипом рецепторов рилизинг-фактора кортикотропина, экспрессируемых в гипофизе и отделах мозга, которые участвуют в опосредовании большинства различных биологических действий рилизинг-фактора кортикотропина (Grigoriadis et al., 1996). Отсутствие зависимых от рецептора-1 рилизинг-фактора кортикотропина путей у мутантных животных потенциально может быть компенсировано изменениями в локализации и/или уровне экспрессии других компонентов системы рилизинг-фактора кортикотропина. Поэтому были проведены иммуногистохимический анализ и гибридизация in situ, чтобы охарактеризовать изменения в экспрессии других ключевых компонентов системы рилизинг-фактора кортикотропина в мозгу и гипофизе мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина. Иммуногистохимический анализ показал, что экспрессия рилизинг-фактора кортикотропина в паравентрикулярном ядре гипоталамуса (ПВЯ) у мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина была заметно увеличена по сравнению с экспрессией у мышей дикого типа (фигура 3А). В ПВЯ мутантных мышей была также обнаружена повышенная экспрессия мРНК рилизинг-фактора кортикотропина по сравнению с экспрессией мРНК у мышей дикого типа. Аргинин вазопрессин (АВП), образуется преимущественно в тех же нейронах паравентрикулярного ядра, в которых синтезируется рилизинг-фактор кортикотропина, и АВП также является ключевым регулятором функции кортикотропинвырабатывающих клеток. В отличие от рилизинг-фактора кортикотропина, не наблюдалось заметного изменения в экспрессии АВП в паравентрикулярном ядре мутантных мышей (фигура 3В). В других отделах мозга, которые продуцируют рилизинг-фактор кортикотропина, таких как миндалевидное тело, экспрессия рилизинг-фактора кортикотропина у мутантных мышей не отличалась от экспрессии в контроле. Следовательно, недостаточность рецептора-1 рилизинг-фактора кортикотропина приводит к специфичному усилению экспрессии рилизинг-фактора кортикотропина в паравентрикулярном ядре у мутантных мышей. Не наблюдалось изменений в пространственном распределении или уровнях экспрессии рецептора-2 рилизинг-фактора кортикотропина в мозгу или гипофизе мутантных мышей. Подобным образом центральная экспрессия урокортина в среднем мозгу мутантных мышей была сходна с экспрессией, наблюдаемой в контроле. Пример 10 У мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина проявляется ослабленный эндокринный ответ на стресс Гормональный ответ на стресс запускается благодаря увеличению секреции рилизинг-фактора кортикотропина в систему гипоталамус-гипофиз-воротная вена паравентрикулярными нейронами гипоталамуса, что приводит к повышенной секреции АКТГ кортикотропинвырабатывающими клетками гипофиза и сопутствующему повышению секреции кортикостероидов надпочечником (Owens and Nemeroff, 1991). Чтобы определить, нарушен ли гипофизарный и адренальный ответ на стресс у животных с недостаточностью рецептора-1 рилизинг-фактора кортикотропина, и самцов и самок дикого типа, и мутантных мышей подвергали стрессу путем физического ограничения подвижности в течение 10 минут в 8:00 утра. Были измерены концентрации кортикостерона и АКТГ в образцах плазмы, собранных перед воздействием и сразу же после воздействия стресса. Контрольные животные, самцы и самки, отвечали значительным увеличением секреции АКТГ и кортикостерона на физическое ограничение подвижности (фигуры 4А и 4В соответственно). В отличие от этого стресс, вызванный ограничением подвижности, не приводил к заметному увеличению уровня циркулирующего АКТГ у мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина (фигура 4А) и конечное увеличение уровня кортикостерона было также заметно подавлено по сравнению с мышами дикого типа (фигура 4В). Эти результаты показывают, что эндокринный ответ на стресс у мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина существенно нарушен. Пример 11 Мыши, мутантные по рецептору-1 рилизинг-фактора кортикотропина, проявляют ослабленную реакцию тревоги Адаптационные изменения, свидетельствующие о состоянии тревоги, являются основным компонентом ответа на стресс, и была показана заметная роль рилизинг-фактора кортикотропина в опосредовании поведенческой реакции на стресс (Кооb, 1994). Поэтому была проведена оценка поведенческой реакции на стресс мышей, у которых отсутствует рецептор-1 рилизинг-фактора кортикотропина. Поведенческие реакции мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина в ответ на окружение, вызывающее состояние тревоги, тестировали с помощью постановки задачи выхода при смене темноты и света, и эти реакции сравнивали с реакциями контрольных мышей. У мутантных мышей наблюдалась тенденция выходить из маленькой камеры на открытое поле (окружение, вызывающее состояние тревоги) с коротким запозданием по сравнению с мышами дикого типа, и они значительно дольше находились на открытом поле (Р<0,05; фигура 5А). Среднее время, затрачиваемое на открытое поле при каждом выходе, было также выше для мутантных мышей по сравнению с мышами дикого типа (19,9 В± 7,53 против 3,8 В± 3,2 сек; Р<0,05). Пример 12 У мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина наблюдаются измененные ритмы локомоторной активности Циркадные ритмы в экспрессии рилизинг-фактора кортикотропина (Moldow and Fischman, 1984; Owens et al., 1990) и нескольких поведенческих реакций, включая локомоторную активность, четко установлены. Однако потенциальная роль системы рилизинг-фактора кортикотропина в модулировании ритмичных изменений в поведении не определена. Поэтому были охарактеризованы ритмы локомоторной активности у мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина и мышей дикого типа. Базальный уровень локомоторной активности оценивали в течение 24 часового периода, состоящего из 12 часов в условиях освещения и 12 часов в условиях темноты, после периода привыкания к аппаратуре для тестирования (фигура 5С). Обе группы, и мыши дикого типа, и мутантные мыши, показали нормальное увеличение активности во время темновой фазы по сравнению со световой фазой цикла (Р<0,001 и Р<0,01 для дикого типа и мутантных мышей соответственно). Однако локомоторная активность мутантных мышей была значительно выше, чем мышей дикого типа во время световой фазы (Р<0,05), но не отличалась во время темновой фазы цикла (фигура 5D) и, следовательно, выраженное в процентах увеличение активности во время темновой фазы по сравнению со световой фазой цикла было ниже (Р<0,001) у мутантных мышей (56,70 Пример 13 Неонатальная смертность потомства гомозиготных самок, мутантных по рецептору-1 рилизинг-фактора кортикотропина, и спасение благодаря обработке кортикостероном in utero Как отмечено ранее, потомство, родившееся от мышей, гетерозиготных по мутации рецептора-1 рилизинг-фактора кортикотропина, было жизнеспособным при рождении, и для него было обнаружено нормальное значение выживаемости в неонатальном возрасте. Для того чтобы далее охарактеризовать репродуктивную способность и способность к развитию мутантов по рецептору-1 рилизинг-фактора кортикотропина, проводили перекрестное скрещивание самцов и самок гомозиготных мутантных мышей. Хотя особенно заметных, очевидных различий в плодовитости мутантов по рецептору-1 рилизинг-фактора кортикотропина не наблюдалось, фактически все потомство, рожденное от гомозиготных самок, мутантных по рецептору-1 рилизинг-фактора кортикотропина, погибало в течение 48 часов после рождения. При наличии наблюдаемого дефекта надпочечников у мутантных самок и хорошо описанной потребности в кортикостероидах при неонатальном развитии легких (Ballard, 1989) наиболее вероятно, что эти животные умирают от респираторного дистресса после рождения. Действительно, гистологический анализ легких, собранных в 1 день после рождения, выявил заметную дисплазию легких у потомства, родившегося от гомозиготных мутантных самок мышей по сравнению с легкими мышат, родившихся от контрольных мышей (фигуры 6А и 6В). В легких мутантных мышей наблюдался альвеолярный коллапс и реактивная эмфизема с внутриальвеолярным кровотечением и отложениями гемосидерина (фигура 6В). Затем было определено, может ли обработка кортикостероном предотвратить дисплазию легких в неонатальный период и сопутствующую повышенную смертность потомства, родившегося от гомозиготных мутантных мышей. Результаты этих экспериментов показали, что обработка гомозиготных мутантных самок in utero кортикостероном, добавляемым в питьевую воду, начиная с 12 дня эмбрионального развития и до 14 дня постнатального развития, приводит к развитию нормальных легких у их потомства. Гистологический анализ легких, собранных в 1 день постнатального развития после обработки кортикостероном in utero, показал нормальную структуру легких с тонкими альвеолярными перегородками и нормальным увеличением объема воздушного пространства (фигура 6С). Обработка кортикостероном in utero также приводит к нормальной степени выживаемости в неонатальный период развития потомства, родившегося от гомозиготных мутантных самок (данные не показаны). Эти результаты и тот факт, что потомство, родившееся от перекрестного скрещивания гетерозиготных мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина, оказывается нормальным, позволяют сделать заключение о том, что неадекватное развитие легких и пониженная выживаемость в постнатальный период потомства, родившегося от гомозиготных мутантных по рецептору-1 рилизинг-фактора кортикотропина мышей, является результатом недостаточной продукции кортикостерона у матерей во время позднего периода беременности и в неонатальный период. Пример 14 Избавление от дефекта надпочечников мышей, мутантных по рецептору-1 рилизинг-фактора кортикотропина, с помощью гормонов Для того чтобы определить причины, связанные с развитием, и/или эндокринную основу выраженной атрофии надпочечников у гомозиготных животных, а также выяснить, был ли дефект надпочечников первым проявлением во время перехода от пренатального к постнатальному периоду жизни, было проведено дальнейшее изучение характеристик мышей, мутантных по рецептору-1 рилизинг-фактора кортикотропина. Поскольку установлено, что для поддержания нормальной продукции кортикостероидов надпочечниками абсолютно необходим АКТГ (Colby et al., 1974), было необходимо определить, была ли атрофия надпочечников прямым результатом отсутствия зависимых от рецептора-1 рилизинг-фактора кортикотропина сигнальных путей или была косвенно вызвана недостаточной трофической поддержкой гормоном (АКТГ) во время развития надпочечников. Чтобы определить, возникает ли дефект в период между пренатальным и постнатальным развитием, надпочечники контрольных мышей и мутантных мышей собирали на 3 день постнатального развития и проводили гистологическое исследование. Явных отличий в морфологии надпочечников мутантных мышей не было обнаружено (фигура 7А), что свидетельствует о том, что дефект надпочечников проявлялся позже во время постнатальной жизни. Затем была начата схема обработки АКТГ, чтобы определить, сохраняют ли надпочечники мутантных мышей способность отвечать на экзогенный АКТГ сокращением атрофии в отделе zona fasciculate. Инъекции АКТГ, проводимые дважды в день, начиная с 10-21 дня постнатального развития, приводили как к увеличению размера надпочечников, так и к увеличению ширины отдела zona fasciculate по сравнению с инъекциями растворителя, проводимыми мутантным мышам (фигура 7В). Следовательно, надпочечники мутантных мышей сохраняют способность отвечать на обработку экзогенным трофическим гормоном (АКТГ). Дефект надпочечников может быть результатом пониженных концентраций циркулирующего АКТГ у мутантных мышей во время периода нормального постнатального развития надпочечников. Чтобы убедиться в том, что мутантные мыши имели недостаточность АКТГ во время развития надпочечников, были собраны образцы плазмы от гомозиготных мутантных мышей и мышей дикого типа на 10 день постнатального развития. Исследование концентраций АКТГ в плазме показало, что у мутантных мышей существенно более низкие концентрации АКТГ на 10 день постнатального развития по сравнению с контрольными мышами (фигура 7С; Р<0,02). Следовательно, механизм, приводящий к дефекту надпочечников у мутантных животных, по-видимому, можно приписать недостаточной продукции АКТГ во время раннего постнатального периода жизни. Эти результаты свидетельствуют о том, что опосредованная рецептором-1 рилизинг-фактора кортикотропина продукция АКТГ гипофизом безусловно является критическим фактором для нормального постнатального развития и формирования надпочечников в ходе развития. В данном изобретении мыши с целенаправленным нарушением локуса рецептора-1 рилизинг-фактора кортикотропина получены путем направленного введения гена в эмбриональные стволовые клетки. Культивируемые клетки гипофизов, собранных от мутантных животных, не в состоянии реагировать повышением секреции АКТГ на обработку рилизинг-фактором кортикотропина, подтверждая тем самым, что мутация проявляется в отсутствие функции рецептора. Поскольку известно, что рецептор-1 рилизинг-фактора кортикотропина широко распространен в пределах мозга и гипофиза (Chalmers et al., 1995; Potter et al., 1994) и во время пренатального и постнатального периодов развития наблюдается временная и пространственная регуляция рецепторов рилизинг-фактора кортикотропина (Avishai-Eliner et al., 1996; Insel et al., 1988), можно предположить, что отсутствие опосредованных рецептором-1 рилизинг-фактора кортикотропина путей должно приводить к выраженным дефектам развития у мутантных животных. Действительно, у мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина обнаруживается резко выраженная атрофия отдела zona fascilulata надпочечника. Наблюдаемый дефект надпочечников как таковой сказывается на взрослых животных в виде заметного снижения концентраций циркулирующего кортикостерона, что подтверждает структурные и функциональные аномалии у мутантов по рецептору-1 рилизинг-фактора кортикотропина. У мышей с целенаправленным нарушением гена рилизинг-фактора кортикотропина также выявляется сходный дефект надпочечников (Muglia et al., 1995). Можно предположить два потенциально возможных объяснения дефекта надпочечников у этих линий мышей. Атрофия надпочечников у мутантных мышей может быть вызвана косвенным образом вследствие отсутствия во время развития стимулируемой рилизинг-фактором кортикотропина секреции АКТГ гипофизом или может быть прямым результатом удаления зависимого от рилизинг-фактора кортикотропина/рецептора-1 рилизинг-фактора кортикотропина пути развития надпочечников. И рилизинг-фактор кортикотропина, и сайты связывания рилизинг-фактора кортикотропина обнаруживаются в надпочечниках, но экспрессия лиганда и рецептора ограничена мозговым веществом (Hashimoto et al., 1984; Suda et al., 1984; Udelsman et al., 1986). Обработка культивируемых клеток мозгового вещества надпочечников (хромаффинные клетки) рилизинг-фактором кортикотропина способствует секреции катехоламинов и мет-энкефалина (Udelsman et al., 1986). Хотя сообщалось, что эти факторы стимулируют функцию коры надпочечников in vitro (Kapas et al., 1995; Walker et al., 1988), поток крови внутри надпочечника направлен от коры к мозговому веществу (Udelsman et al., 1986). Поэтому маловероятно, что факторы, выходящие из мозгового вещества надпочечников в ответ на рилизинг-фактор кортикотропина, могут оказывать трофическое воздействие на развитие коры надпочечников. Эти результаты отчетливо подтверждают альтернативную гипотезу о том, что недостаточность надпочечников у животных, мутантных по рецептору-1 рилизинг-фактора кортикотропина, опосредована недостаточной секрецией АКТГ. Наблюдаемый дефект надпочечников у мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина структурно и функционально сходен с дефектом надпочечников, наблюдаемым после гипофизэктомии. У животных после гипофизэктомии возмещение недостатка АКТГ совершенно необходимо для поддержания отдела zona fasciculate (Idelman, 1970; Wyllie et al., 1973) и для нормальной продукции кортикостероидов (Colby et al., 1974). Очевидно существует критическое временное окно во время постнатального развития, когда зависимая от рецептора-1 рилизинг-фактора кортикотропина секреция АКТГ абсолютно необходима для полного развития надпочечников. Проявление дефекта надпочечников во время пренатального развития у мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина, по-видимому, маловероятно. Начальная дифференцировка коры надпочечников происходит во время пренатального периода жизни (Daikoku et al., 1976) и гистологический анализ надпочечников, собранных на 3 день постнатального развития, не позволяет обнаружить заметных различий между мутантами по рецептору-1 рилизинг-фактора кортикотропина и мышами дикого типа. Следовательно, дефект надпочечников у мышей, мутантных по рецептору-1 рилизинг-фактора кортикотропина, по-видимому, проявляется преимущественно во время постнатального периода жизни. В данном исследовании концентрации АКТГ в плазме мутантных животных на 10 день постнатального развития были существенно ниже, чем концентрации в контроле, и возмещение недостатка АКТГ, начиная с 10-21 дня постнатального развития, ликвидирует атрофию надпочечников. Однако уровни циркулирующего АКТГ у взрослых мутантных животных были сходны с уровнями у контрольных мышей. Тот факт, что мутантные животные не подвергаются сильному ингибирующему влиянию кортикостерона на синтез и секрецию АКТГ (Keller-Wood and Dallman, 1984), может объяснять сходные уровни АКТГ у животных, у которых отсутствует рецептор-1 рилизинг-фактора кортикотропина. Однако видимо нормальные концентрации циркулирующего АКТГ у взрослых мутантных животных не достаточны для восстановления развития и нормального функционирования надпочечников. Поэтому дефект надпочечников, по-видимому, является результатом отсутствия опосредованной рецептором-1 рилизинг-фактора кортикотропина секреции АКТГ во время раннего постнатального периода жизни. В отличие от дефекта надпочечников не было обнаружено анатомических дефектов в мозгу и гипофизе мутантных животных. Этот результат до некоторой степени неожидан, поскольку сообщалось, что рилизинг-фактор кортикотропина является митогеном для продуцирующих АКТГ клеток гипофиза in vivo (Gertz et al., 1987) и экспрессия рецептора-1 рилизинг-фактора кортикотропина инициируется в определенных отделах мозга в определенные периоды времени в ходе развития (Avishai-Eliner et al., 1996). Появление и созревание кортикотропинвырабатывающих клеток были также нормальными у мышей с недостаточностью рилизинг-фактора кортикотропина (Muglia et al., 1995). Поэтому маловероятно, что для нормального развития кортикотропинвырабатывающих клеток критичной является потребность в рилизинг-факторе кортикотропина/рецепторе-1 рилизинг-фактора кортикотропина. Однако установлена необходимость в опосредованной рецептором-1 рилизинг-фактора кортикотропина продукции АКТГ во время раннего постнатального периода жизни, поскольку у мутантных по рецептору-1 рилизинг-фактора кортикотропина мышей отчетливо выявляются пониженные уровни циркулирующего АКТГ во время периода неонатального развития. Мутация гена рецептора-1 рилизинг-фактора кортикотропина не сопровождается компенсационными изменениями в локализации и уровне экспрессии рецептора рилизинг-фактора кортикотропина второго подтипа (рецептор-2 рилизинг-фактора кортикотропина). Однако компенсирующее увеличение экспрессии основного лиганда рецептора-1 рилизинг-фактора кортикотропина было обнаружено в ПВЯ мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина. Увеличение уровня мРНК и белка рилизинг-фактора кортикотропина было обнаружено ограниченно только в ПВЯ и не выявлялось в других отделах мозга, продуцирующих рилизинг-фактор кортикотропина, таких как миндалевидное тело. Увеличенная экспрессия рецептора-1 рилизинг-фактора кортикотропина в ПВЯ могла быть опосредована по принципу обратной связи ослаблением негативного действия кортикостероидов. У крыс экспрессия и рилизинг-фактор кортикотропина и аргинин вазопрессина в ПВЯ ингибируется кортикостероидами (Sawchenko, 1987) и возрастает при эктомии надпочечников (Sawchenko, 1984). Однако экспрессия аргинин вазопрессина (другого ключевого регулятора секреции АКТГ) в ПВЯ мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина не отличалась от экспрессии у контрольных животных. Несмотря на это нормальные уровни циркулирующего АКТГ у взрослых мутантных мышей не могли быть вызваны усиленной стимуляцией аргинин вазопрессином кортикотропной функции. Самки, мутантные по рецептору-1 рилизинг-фактора кортикотропина, были фертильными и не проявляли заметных репродуктивных аномалий. Для потомства, рожденного от гетерозиготных мутантных самок, показана нормальная выживаемость в неонатальный период, хотя потомство, рожденное от гомозиготных мутантных самок, погибало через сорок восемь часов после рождения из-за дисплазии легких. О сходной этиологии и смертности в неонатальный период сообщалось как для мышей с недостаточностью рилизинг-фактора кортикотропина (Muglia et al., 1995), так и для мышей с целенаправленным нарушением гена рецептора глюкокортикоидов (Cole et al., 1995). Неонатальная смертность в потомстве гомозиготных мутантных по рецептору-1 рилизинг-фактора кортикотропина самок была результатом недостаточности кортикостерона в материнском организме, приводящей к неадекватному развитию легких плода/новорожденных мышей. В данном изобретении выживаемость потомства была восстановлена в результате дополнительного введения кортикостерона, начиная in utero. Сходный принцип был использован для спасения потомства, рожденного от гомозиготных мутантных по рилизинг-фактору кортикотропина мышей (Muglia et al., 1995), и обработка кортикостероном обычно используется для лечения синдрома респираторного дистресса преждевременно родившихся детей (Ballard, 1989). Чтобы исследовать последствия недостаточности рецептора-1 рилизинг-фактора кортикотропина для поведения, сравнивали поведение мышей дикого типа и мутантных по рецептору-1 рилизинг-фактора кортикотропина мышей при выполнении задачи выхода при смене темноты и света, заключающегося в свободно выбираемом ответе на вызывающее стресс окружение. Мыши, мутантные по рецептору-1 рилизинг-фактора кортикотропина, находились на освещенном открытом поле в течение более длительного периода времени, чем мыши дикого типа. Таким образом, мутантные мыши проявляли большее стремление к окружению, которое, как обычно считается, вызывает неприязнь у грызунов (Archer, 1973; Crawley and Goodwin, 1980; Denenbergh, 1967; Misslin, 1989), и были менее чувствительны к этому стимулу, который подобен анксиогенным стимулам. В остром эксперименте локомоторная активность мышей, мутантных по рецептору-1 рилизинг-фактора кортикотропина, при тестировании в новом окружении не отличалась от активности контрольных мышей, что свидетельствует о том, что ослабленная реакция тревоги у мутантных животных не является следствием отличия в реактивности на новизну. Предшествующие исследования показали, что действие рилизинг-фактора кортикотропина на крыс, подобное анксиогенному действию, не зависит от активации системы гипофиз-надпочечник (Britton et al., 1986). Предыдущие данные, полученные на крысах, которым инъецировали в центральную нервную систему антагонисты рилизинг-фактора кортикотропина и антисмысловые олигонуклеотиды, также свидетельствуют о том, что поведенческие и физиологические ответы на стресс могут зависеть от действия рилизинг-фактора кортикотропина в системе мозга (Martinez et al., 1997; Skutella et al., 1994; Swiergiel et al., 1993; Takahashi et al., 1989). Кроме того, имеются также сообщения о том, что обработка крыс непептидным антагонистом рецептора рилизинг-фактора кортикотропина СР-154526, обладающего высокой селективностью по отношению к рецептору-1 рилизинг-фактора кортикотропина, ингибирует анксиогенное действие рилизинг-фактора кортикотропина, введенного в центральную нервную систему (Schuiz et al., 1996). Следовательно, ослабленный ответ на анксиогенные стимулы у мышей, мутантных по рецептору-1 рилизинг-фактора кортикотропина, по-видимому, не обусловлен изменениями профилей кортикостеронов. В совокупности эти результаты показывают, что ослабление активности рилизинг-фактора кортикотропина облегчает исследования, проводимые в условиях стресса. Эти результаты согласуются с данными, широко представленными в литературе, которые показывают, что введение рилизинг-фактора кортикотропина в центральную нервную систему инициирует поведенческие реакции при стрессе (Berridge and Dunn, 1986; Koob, 1994; Morimoto et al., 1993; Takahashi et al., 1989; Liang et al., 1992), и четко показывают, что зависимые от рилизинг-фактора кортикотропина пути, вовлеченные в поведенческие реакции при стрессе, опосредованы рецептором-1 рилизинг-фактора кортикотропина. Несмотря на то, что циркадные изменения концентраций рилизинг-фактора кортикотропина в гипоталамусе (Moldow and Fischman, 1984; Owens et al., 1990) и поведенческих реакций, таких как локомоторная активность, хорошо установлены, функциональная роль путей, зависимых от рилизинг-фактора кортикотропина, в модулировании ритмичной локомоторной активности не показана. Ритмичный цикл локомоторной активности нарушается в результате мутации у мышей с недостаточностью рецептора-1 рилизинг-фактора кортикотропина. У этих животных менее выражен ритм смены активности между темновым и световым периодами по сравнению с животными дикого типа, по-видимому, в результате увеличения активности в световой фазе цикла смены света и темноты. Здесь не может быть исключено влияние хронической недостаточности кортикостероидов на ритмичный цикл локомоторной активности у мышей, мутантных по рецептору-1 рилизинг-фактора кортикотропина, и этот вопрос требует дальнейшего изучения. Однако это маловероятно, поскольку предыдущие исследования на крысах показали, что эктомия надпочечников не влияет на локомоторную активность во время световой фазы (Iuvone and Hartesveldt, 1977). Хотя на сегодняшний день описаны два специфичных подтипа рецепторов рилизинг-фактора кортикотропина, точная роль, которую эти рецепторы играют в опосредовании биологических ответов на рилизинг-фактор кортикотропина или близкие рилизинг-фактору кортикотропина лиганды как в спокойных условиях, так и в условиях стресса, окончательно не выяснены. Экспрессия рецептора-1 рилизинг-фактора кортикотропина в мозгу и гипофизе четко регулируется при стрессе (Rabadan-Diehl et al., 1996; Rivest et al., 1995), а также рилизинг-фактором кортикотропина и другими модуляторами (Mansi et al., 1996; Pozzoli et al., 1996), хотя экспрессия рецептора-2 рилизинг-фактора кортикотропина конститутивна при сходных условиях (Rivest et al., 1995). Эти результаты еще более подтверждают возможность того, что рецептор-1 рилизинг-фактора кортикотропина является в условиях стресса основным рецептором мозга для рилизинг-фактора кортикотропина. В данных экспериментах было четко показано, что классический эндокринный ответ на стресс и поведенческие реакции при стрессе опосредованы рецептором-1 рилизинг-фактора кортикотропина. Однако индуцируемое в условиях стресса снижение концентраций тестостерона в сыворотке не наблюдалось у самцов мышей, мутантных по рецептору-1 рилизинг-фактора кортикотропина, что указывает на то, что адаптивные ответы животных на стресс опосредованы не только рецептором-1 рилизинг-фактора кортикотропина. Дополнительные исследования могут точно определить, какие еще ответы на стресс опосредованы рецептором-1 рилизинг-фактора кортикотропина, и определить роль опосредованных рецептором-1 рилизинг-фактора кортикотропина путей в познавательной деятельности. Дальнейшее выяснение точной роли каждого из подтипов рецепторов рилизинг-фактора кортикотропина может привести к созданию и применению специфичных антагонистов рецепторов рилизинг-фактора кортикотропина для лечения и/или диагностики различных нейропсихиатрических нарушений и для улучшения обучаемости и памяти в случаях слабоумия. Источники информации 1. Archer, J. (1973). Anim. Behav. 21, 205-235. 2. Avishai-Eliner, et al. (1996). Brain Res. Dev. Brain Res. 91:159-163. 3. Ballard, P. L. (1989). Endocr. Rev. 10, 165-181. 4. Behan, D. P., et al. (1995). Nature 378, 284-287. 5. Berridge, С. W., et al. (1986). Regul. Pept. 16, 83-93. 6. Britton, К. Т., et al. (1986). Life Sci. 39, 1281-1286. 7. Chalmers, D. Т., et al. (1995). J. Neurosci. 15, 6340-6350. 8. Chan, receptor-. K., et al. (1993). J. Neurosci. 13, 5126-5138. 9. Chrousos, G. P., et al. (1992). J. Am. Med. Assoc. 267, 1244-1252. 10. Colby, H. D., et al. (1974). Endocrinology 94, 1346-50. 11. Cole, Т. J., et al. (1995). Genes Dev. 9, 1608-1621. 12. Crawley, J., et al. (1980). Pharmacol. Biochem. Behav. 13, 167-170. 13. Daikoku, S., et al. (1976). Cell Tissue Res. 168, 549-59. 14. De Souza, E. B. (1995). Psychoneuroendocrinology 20, 789-819. 15. Denenbergh, V. (1967). In Biology and Behavior: Neurophysiology 5 and Emotion, D. Glass, ed. (New York: Rockefeller University Press and Russell Sage Foundation), pp. 161-190. 16. Diamant, M., et al. (1993). Neuroendocrinology 57, 1071-81. 17. Gertz, В. J., et al. (1987). Endocrinology 120, 381-388. 18. Grigoriadis, D. E., et al. (1996). Ann. N. Y. Acad. Sci. 780, 60-80. 19. Hashimoto, К., et al. (1984). Peptides 5, 707-711. 20. Idelman, S. (1970). Int. Rev. Cytol. 27, 181-281. 21. Insel, Т. R., et al. (1988). J. Neurosci. 8, 4151-4158. 22. Iuvone, P. M. et al. (1977). Behav Biol 19, 228-237 Kapas, S., et al. (1995). J. Endocrinol. 144, 503-510. 23. Keller-Wood, M. E., et al. (1984). Endocr. Rev. 5, 1-24. 24. Kishimoto, et al. (1995). Proc. Natl. Acad. Sci. USA 92, 1108-1112. Koob, G., et al. (1994). Semin. Neurosci. 6, 221-229. 25. Koob, G. F., et al. (1985). Fed. Proc. 44, 259-63. 26. Lee, К. F., et al. (1992). Cell 69, 737-749. 27. Liang, К. С., et al. (1988). Psychopharmacology (Beri) 96, 232-6. 28. Liang, К. С., et al. (1992). J Neurosci. 12, 2303-2312. Lovenberg, T. W., et al. (1995). Endocrinology 136, 4139-4142. 29. Mansi, J. A., et al. (1996). Endocrinology 137, 4619-4629. 30. Martinez, V., et al. (1997). J. Pharmacol. Exp. Ther. 280, 754-760. 31. Misslin, R., et al. (1989). Behav. Process. 18, 119-132. 32. Moldow, R L., et al. (1984). Peptides 5, 1213-1215. 33. Morimoto, A., et al. (1993). J. Physiol. (Lond) 460, 221-229. 34. Muglia, L., et al. (1995). Nature 373, 427-432. 35. Orth, D. N. (1992). Endocr. Rev. 13, 164-191. 36. Owens, M. J., et al. (1990). Neuroendocrinology 52, 626-631. 37. Owens, M. J., et al. (1991). Pharmacol. Rev. 43, 425-473. 38. Perrin, M., et al. (1995). Proc. Natl. Acad. Sci. USA 92, 2969-2973. 39. Potter, E., et al. (1994). Proc. Natl. Acad. Sci. USA 91, 8777-8781. 40. Pozzoli, G., et al. (1996). Endocrinology 137, 65-71. 41. Rabadan-Diehl, С., et al. (1996). Endocrinology 137, 3808-3814. 42. Rivest, S., et al. (1995). J. Neurosci. 15, 2680-2695. 43. Sawchenko, P. E. (1987). J. Neurosci. 7, 1093-1106. Sawchenko, et al. (1984). Proc. Natl. Acad. Sci. USA 81, 1883-1887. 44. Schuiz, D., et al. (1996). Proc. Natl. Acad. Sci. USA 93, 10477-10482. 45. Segre, G. V., et al. (1993). Trends Endocrinol. Metab. 4, 309-314. 46. Skutella, Т., et al. (1994). Neuroreport 5, 2181-2185. 47. Spina, M., et al. (1996). Science 273, 1561-1564. Stenzel, P., et al. (1995). Mol. Endocrinol. 9, 637-645. 48. Suda, Т., et al. (1984). J. Clin. Endocrinol. Metab. 58, 919-924. 49. Swiergiel, A. H., et al. (1993). Brain Res. 623, 229-234. 50. Takahashi, L. K., et al. (1989). Behav. Neurosci. 103, 648-654. 51. Turnbull, A. V., et al. (1996). Eur. J. Pharmacol. 303, 213-216. 52. Udelsman, R, et al. (1986). Nature 319, 147-150. 53. Vale, W., et al. (1981). Science 213, 1394-1397. 54. Vale, W., et al. (1997). The Endocrinologist 7, 3S-9S. 55. Vale, W., et al. (1983). In Methods in Enzymology: Neuroendocrine Peptides, P. M. Conn, ed. (New York: Academic Press), pp. 565-577. Vaughan, J., et al. (1995). Nature 378, 287-292. 56. Walker, S. W., et al, (1988). Mol. Cell. Endocrinol, 57, 139-147. 57. Wyllie, A. H., et al. (1973). J. Pathol. 111, 85-94. 58. Xu, M., et al. (1994). Cell 79, 729-742. Любые патенты или публикации, указанные в этом перечне, показывают уровни специалистов в данной области, к которым данное изобретение имеет отношение. Кроме того, эти патенты и публикации включены здесь в результате ссылки в таком же объеме, как если бы каждая отдельная публикация была конкретно и отдельно указана в виде включенной здесь ссылки. Каждый специалист в данной области без труда поймет, что данное изобретение вполне приспособлено для достижения целей, получения результатов и может быть полезно в указанных случаях, а также пригодно для достижения тех целей, результатов и применения, которые теоретически здесь заложены. В связи с этим, представленные здесь примеры, в которых отдельно описаны способы, процедуры, обработки, молекулы и специфичные соединения, являются показательными предпочтительными вариантами, являются иллюстративными и не призваны ограничить рамки изобретения. Специалисты в данной области могут внести изменения и найти другие применения, которые соответствуют сущности изобретения, определяемой рамками формулы изобретения. Формула изобретения1. Способ получения трансгенной мыши, не содержащей функциональный рецептор-1 рилизинг-фактора кортикотропина, предусматривающий следующие стадии: а) получение позитивных ЭС-клеток путем введения в эмбриональные стволовые клетки трансгена рецептора-1 рилизинг-фактора кортикотропина, полученного на основе гена рецептора-1 рилизинг-фактора кортикотропина мыши, приведенного на фиг. 1А, причем указанный трансген содержит селектируемый маркер, состоящий, по существу, из кассеты PGK-neo вместо участка от экзона 5 до экзона 8 указанного гена рецептора-1 рилизинг-фактора кортикотропина, причем ЭС-клетки, которые выживают и растут в условиях отбора по указанному селектируемому маркеру, являются позитивными ЭС-клетками; b) последующее введение указанных позитивных ЭС-клеток в бластоцисты С57BL/6 с получением указанной мыши; и с) идентификация получающегося в результате гомологичной рекомбинации трансгенного потомства путем анализа нуклеиновых кислот, где у указанной трансгенной мыши ослаблена реакция тревоги, снижен эндокринный ответ на стресс и изменены ритмы локомоторной активности по сравнению с контрольной мышью. 2. Способ по п.1, отличающийся тем, что дополнительно предусматривает стадию скрещивания указанных трансгенных мышей. 3. Способ идентификации агониста рилизинг-фактора кортикотропина, урокортина или лиганда семейства рилизинг-фактора кортикотропина, который действует через рецепторы, отличные от рецептора-1 рилизинг-фактора кортикотропина, предусматривающий следующие стадии: а) введение тестируемого соединения или соединения плацебо трансгенной мыши, полученной способом по п.2, b) введение рилизинг-фактора кортикотропина, урокортина или лиганда семейства рилизинг-фактора кортикотропина мыши дикого типа; с) определение уровня реакции тревоги, эндокринного ответа на стресс и ритмов локомоторной активности как у указанной трансгенной мыши, так и у мыши дикого типа; и d) сравнение уровня реакции тревоги, эндокринного ответа на стресс и ритмов локомоторной активности, где эффекты, вызванные указанным тестируемым соединением, имитирующим эффекты, вызываемые рилизинг-фактором кортикотропина, урокортином или лигандом семейства рилизинг-фактора кортикотропина, свидетельствуют о том, что агонист рилизинг-фактора кортикотропина, урокортина или лиганда семейства рилизинг-фактора кортикотропина действует через рецептор, отличный от рецептора-1 рилизинг-фактора кортикотропина. 4. Способ по п.3, отличающийся тем, что указанный рецептор, отличный от рецептора-1 рилизинг-фактора кортикотропина, выбран из группы, состоящей из рецептора-2 рилизинг-фактора кортикотропина и рецепторов семейства рилизинг-фактора кортикотропина. 5. Способ идентификации антагониста рилизинг-фактора кортикотропина, урокортина или лиганда семейства рилизинг-фактора кортикотропина, который действует через рецептор, отличный от рецептора-1 рилизинг-фактора кортикотропина, предусматривающий следующие стадии: a) введение тестируемого соединения или соединения плацебо трансгенной мыши, полученной способом по п.2; b) введение рилизинг-фактора кортикотропина, урокортина или лиганда семейства рилизинг-фактора кортикотропина трансгенной мыши, полученной способом по п.2; c) определение влияния тестируемого соединения, плацебо и рилизинг-фактора кортикотропина, урокортина или лиганда семейства рилизинг-фактора кортикотропина на уровень реакции тревоги, эндокринный ответ на стресс и ритмы локомоторной активности у каждой мыши; и d) сравнение уровня реакции тревоги, эндокринного ответа на стресс и ритмов локомоторной активности у каждой мыши, где тестируемое соединение считается антагонистом, если оно вызывает эффекты, не вызываемые плацебо, где указанные эффекты противоположны эффектам, вызываемым рилизинг-фактором кортикотропина, урокортином или лигандом семейства рилизинг-фактора кортикотропина. 6. Способ по п.5, отличающийся тем, что указанный рецептор, отличный от рецептора-1 рилизинг-фактора кортикотропина, выбран из группы, состоящей из рецептора-2 рилизинг-фактора кортикотропина и рецепторов семейства рилизинг-фактора кортикотропина. 7. Способ скрининга соединений, которые являются аналогами или агонистами кортикостерона или кортикотропина, предусматривающий следующие стадии: a) проведение спаривания гомозиготных самки мыши, полученной способом по п.2, и самца мыши, полученного способом по п.2; b) введение фармацевтически приемлемой дозы указанного соединения указанной самке мыши после зачатия; и c) гистологическое определение состояния легких у потомства, рожденного указанной самкой мыши, при котором отсутствие дисплазии, альвеолярного коллапса и реактивной эмфиземы с внутриальвеолярным кровотечением и отложениями гемосидерина является показателем аналога или агониста кортикостерона, или кортикотропина. MM4A - Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 31.03.2007 Извещение опубликовано: 20.07.2010 БИ: 20/2010 Популярные патенты: 2185064 Вещество, обладающее пестицидной активностью, способ его получения, пестицидная композиция и способ контролирования вредителей ... vicina, Ceratitis capitata, Chironomus tentans, Chrysomya rufifacies, Cochliomyia mecallaria, Culex sp., Culiseta inornata, Dacus oleae, Delia antiqua, Delia platura, Delia radicum, Drosophila melanogaster, Eupeodes corollae, Glossina austeni, Glossina brevipalpis, Glossina fuscipes, Glossina morsitans centralis, Glossina morsitans morsitans, Glossina morsitans submorsitans, Glossina pallidipes, Glossina palpalis gambiensis, Glossina palpatis palpalis, Glossina tachinoides, Haemagogusequinus, Haematobia irritans, Hypoderma bovis, Hypodermalineatum, Leucopis ninae, Luciliacuprina, Luciliasericata, Lutzomyia longlpaipis, Lutzomyia shannoni, Lycoriella mali, Mayetiola ... 2236124 Способ создания местообитания и адаптации молоди объектов аквакультуры в водных экосистемах ... этологических механизмов адаптации молоди к естественной среде необходим дополнительный технологический блок - компактная экосистема с обучающей средой. Структурный состав биотопов такой экосистемы имитирует необходимое и достаточное разнообразие природного (нативного) водоема и способен обеспечивать все этапы жизненного цикла рыб. Выпущенная в относительно комфортные условия молодь обучается адекватно реагировать на различные биотопически значимые стимулы (даже на человека - оператора обучающего технологического блока). Формируются эквимотивационные стайки, одновременно происходит уход (скат) и элиминация хищником одиночных не организованных в стаи особей. Устойчивость ... 2091023 Способ защиты растений от заболеваний, вызванных нематодами ... паразитическими нематодами у растений и животных. С 40-х гг. стали доступными многие химикаты, активные против нематод, паразитирующих на растениях. Они часто проявляли нежелательные токсические воздействия; например, фумигант дибромхлорпропан был снят с продажи в 1977 г. так как он вызывал бесплодие у работающих. Во время 60-х гг. нематоциды фумигантного типа были вытеснены гранулированными системными нематоцидами. Они использовались с тех пор, типичным соединением являлся оксамил. Эти соединения являлись главным образом производными оксикарбаматов и органофосфатов, и из-за их токсичности они использовались под жестким контролем. Следовательно, было бы хорошо иметь ... 2139657 Инсектицидная композиция ... не передаваемые непосредственно от человека к человеку, переносятся насекомыми-переносчиками, такими как мухи, комары, блохи, тараканы и т.д. Поскольку указанные вредные насекомые обитают в местах проживания человека, защита от них чрезвычайно необходима. Для уничтожения вредных насекомых применяются, как правило, инсектицидные препараты. Известна инсектицидная композиция для уничтожения вредных насекомых, содержащая перметрин (GB, 1601095, A 01 N 25/00, 1981). Известная композиция недостаточно эффективна из-за отсутствия остаточной инсектицидной активности. Известен инсектицидный препарат, содержащий в качестве активного вещества ципермертин (Патент США, 5242907, А 01 N 25/00, ... 2415560 Способ выращивания корнесобственных саженцев винограда ... опилок и 0,1 части азотного удобрения, закладывают его на дно траншеи с оставлением воздушного пространства в траншее не менее 10 см, производят посадку черенков осенью под углом 40-50°, траншею укрывают досками или листовым шифером, сверху насыпают холмик из почвы высотой 20-30 см и укрывают слоем соломы или опилок высотой не менее 25 см (RU, патент 2240679 С1. МПК7 A01G 17/02. Способ выращивания озимых саженцев винограда в открытом грунте из осенней лозы / В.В.Кравцов (RU), А.В.Кравцов (RU), O.H.Белицкая (RU), А.С.Белицкий (RU). - Заявка 2003121737/12; заявлено 14.07.2003; опубл. 27.11.2004). К недостаткам описанного способа выращивания саженцев винограда в открытом ... |
Еще из этого раздела: 2440721 Способ определения вредоносности насекомых комплекса "гнус" для крупного рогатого скота 2209542 Контейнер 2196418 Устройство для укладки, сушки и хранения прессованного сена и соломы в рулонах 2446659 Способ и устройство для органического возделывания зерновых культур 2459398 Способ рекультивации почв, загрязненных минерализованными водами 2182420 Устройство для перерезания стволов деревьев 2195808 Способ хранения корнеплодов, картофеля и капусты 2154629 Производные оксима, способ их получения, фунгицидное средство и способ борьбы с грибковыми заболеваниями 2473211 Приспособление для автоматической дойки молочного скота 2391804 Почвообрабатывающий каток |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
 -глюкуронидаза,
-глюкуронидаза,  105 клеток/лунку/0,5 мл) в 48-луночные планшеты Costar, предварительно покрытые поли-d-лизином (20 мкг/мл). После 3 дней роста клетки выдерживали 2 часа в среде bPJ, содержащей 0,1% БСА и обрабатывали в течение 1 часа 0-100 нМ рилизинг-фактора кортикотропина в свежей среде. Среду собирали и измеряли секрецию АКТГ с помощью набора для радиоиммунологического анализа (Diagnostic Products Corporation).
105 клеток/лунку/0,5 мл) в 48-луночные планшеты Costar, предварительно покрытые поли-d-лизином (20 мкг/мл). После 3 дней роста клетки выдерживали 2 часа в среде bPJ, содержащей 0,1% БСА и обрабатывали в течение 1 часа 0-100 нМ рилизинг-фактора кортикотропина в свежей среде. Среду собирали и измеряли секрецию АКТГ с помощью набора для радиоиммунологического анализа (Diagnostic Products Corporation). С. Затем ткани заливали в парафин, делали срезы толщиной 7 мм и красили гематоксилином и эозином перед проведением определения. Для иммуногистохимической локализации рилизинг-фактора кортикотропина, аргинин вазопрессина (АВП) и урокортина в мозгу и АКТГ в гипофизе животным проводили перфузию 4% параформальдегидом и готовили пластинки тканей толщиной 30 мм. Проводили иммуногистохимический анализ локализации рилизинг-фактора кортикотропина и АВП (Chan et al., 1993), урокортина (Vaughan et al., 1995) и АКТГ (Potter et al., 1994). Для анализа с помощью in situ гибридизации мышей анестезировали и перфузировали солевым раствором, после чего 4% параформальдегидом в 0,1 М боратном буфере. Ткани хранили в течение ночи при 4
С. Затем ткани заливали в парафин, делали срезы толщиной 7 мм и красили гематоксилином и эозином перед проведением определения. Для иммуногистохимической локализации рилизинг-фактора кортикотропина, аргинин вазопрессина (АВП) и урокортина в мозгу и АКТГ в гипофизе животным проводили перфузию 4% параформальдегидом и готовили пластинки тканей толщиной 30 мм. Проводили иммуногистохимический анализ локализации рилизинг-фактора кортикотропина и АВП (Chan et al., 1993), урокортина (Vaughan et al., 1995) и АКТГ (Potter et al., 1994). Для анализа с помощью in situ гибридизации мышей анестезировали и перфузировали солевым раствором, после чего 4% параформальдегидом в 0,1 М боратном буфере. Ткани хранили в течение ночи при 4 4,37), чем у мышей дикого типа (89,26В±3,20). Повышенная активность мышей, мутантных по рецептору-1 рилизинг-фактора кортикотропина, была особенно явной во время последних часов светового цикла (фигура 5С). Следовательно, мыши, мутантные по рецептору-1 рилизинг-фактора кортикотропина, для которых обнаружены измененные ритмы локомоторной активности, проявляют повышенную активность в то время, когда мыши дикого типа обычно менее активны.
4,37), чем у мышей дикого типа (89,26В±3,20). Повышенная активность мышей, мутантных по рецептору-1 рилизинг-фактора кортикотропина, была особенно явной во время последних часов светового цикла (фигура 5С). Следовательно, мыши, мутантные по рецептору-1 рилизинг-фактора кортикотропина, для которых обнаружены измененные ритмы локомоторной активности, проявляют повышенную активность в то время, когда мыши дикого типа обычно менее активны.