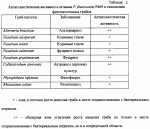
Штамм бактерий pseudomonas fluorescens p469 для получения преперата против болезней растений, вызываемых фитопатогенными грибами и бактериямиПатент на изобретение №: 2235771 Автор: Асланян Е.М. (RU), Галкина Н.Н. (RU), Добрица А.П. (RU), Коломбет Л.В. (RU), Корецкая Н.Г. (RU), Кочетков В.В. (RU) Патентообладатель: Государственное унитарное предприятие "Государственный научный центр прикладной микробиологии" (RU) Дата публикации: 20 Апреля, 2004 Начало действия патента: 13 Мая, 2002 Адрес для переписки: 142279, Московская обл., Серпуховский р-н, г. Оболенск, ГНЦ ПМ Изобретение относится к биотехнологии и сельскому хозяйству, может быть использовано для получения бактериального препарата против болезней растений, вызываемых фитопатогенными грибами и бактериями, из родов Alternaria, Colletotrichum, Fusarium, Rhizoctonia, Phoma, Phytophthora, Oospora, Erwinia и Pseudomonas. Штамм Pseudomonas fluorescens P469 ЦКМ В-1982 выделен из ризосферы озимой пшеницы Краснодарского края. Штамм хорошо растет на различных средах, в том числе синтетических, в условиях аэрации при 30 Изобретение относится к биотехнологии и касается нового бактериального штамма Pseudomonas fluorescens P469, обладающего супрессорной активностью в отношении фитопатогенных грибов и бактерий из родов Alternaria, Colletotrichum, Fusarium, Rhizoctonia, Phoma, Phytophthora, Oospora, Erwinia и Pseudomonas, который может быть использован для получения бактериального препарата для защиты растений от фитопатогенов. Известны штаммы рода Pseudomonas, предназначенные для защиты растений от грибных и бактериальных патогенов (US №5232850). Однако целевое применение этих штаммов ограничено. Наиболее близким к предлагаемому изобретению является штамм бактерий Pseudomonas putida BKM В-1743Д (патент SU №1805849 A3), предназначенный для получения препарата, используемого для стимуляции роста растений и защиты растений от грибных и бактериальных патогенов. Однако данный штамм имеет более узкий круг супрессируемых фитопатогенов по сравнению с заявляемым штаммом. Задачей изобретения является получение нового штамма Pseudomonas fluorescens, обладающего способностью к подавлению роста широкого круга фитопатогенных грибов и бактерий, и создание на его основе препарата против болезней растений, вызываемых грибными и бактериальными патогенами. Поставленная задача решается тем, что предлагается штамм Pseudomonas fluorescens P469, выделенный из ризосферы озимой пшеницы Краснодарского края, с использованием селективной агаризованной среды Кинга В. Основными критериями отбора служили стимуляция роста растений и подавление роста фитопатогенных грибов и бактерий из родов Alternaria, Colletotrichum, Fusarium, Rhizoctonia, Phoma, Phytophthora, Oospora, Erwinia и Pseudomonas. Штамм Р. fluorescens P469 характеризуется следующими свойствами: Культурально-морфологические признаки Клетки подвижные, палочковидные, с полярными жгутиками, грамотрицательные, спор не образуют. Штамм хорошо растет на следующих средах: МПБ (мясопептонный бульон), LB (триптон - 10 г/л, дрожжевой экстракт - 5 г/л, хлористый натрий - 10 г/л, рН 7,2), Кинга Б (пептон - 20 г/л, глицерин - 10 мл/л, MgSO4 Двухсуточные колонии на ПА сероватые, слизистые, плоские, выпуклые к центру, диаметр 1,5-2 мм. Пигмент зеленый, диффундирующий в среду. Под ультрафиолетом зона вокруг колоний флуоресцирует зеленым светом. Физиолого-биохимические признаки Облигатный аэроб, температурный оптимум роста 28-30 Устойчивость к антибиотикам Штамм проявляет устойчивость к стрептомицину (100 мкг/мл), ампициллину (200 мкг/мл) и тетрациклину (10 мкг/мл). Условия хранения Штамм бактерий Р. fluorescens P469 хранят на чашках или косяках с МПА, ПА или со средой Кинга Б при 5-7 Штамм Р. fluorescens P469 может быть использован в производстве препарата для комплексной защиты растений от широкого круга грибных и бактериальных фитопатогенов. Штамм мало патогенен для теплокровных животных (относится к IV группе патогенности), не токсичен для растений. Штамм Р. fluorescens P469 депонирован в Центральной коллекции микроорганизмов РАΠ“Биопрепарат”, коллекционный номер ЦКМ В-1982. Пример 1, демонстрирующий отсутствие фитотоксичности у штамма Р. fluorescens P469. Суспензию клеток штамма Р. fluorescens P469 для испытаний готовят следующим образом: в колбу емкостью 750 мл наливают 250 мл стерильной среды LB, вносят 1-2 мл стационарной культуры исследуемого штамма и инкубируют с аэрацией (250 об/мин) при 28 Фитотоксическую активность штамма рассчитывают по формуле: А=(100-Д0/Дк где А - показатель фитотоксичности; Д0 - средний показатель параметра в опыте; Дк - средний показатель параметра в контроле. Фитотоксичными считаются те штаммы, показатель фитотоксичности которых превышает 30%. Отрицательные значения показателя А свидетельствуют о стимулирующем эффекте. Показатели фитотоксичности штамма Р. fluorescens P469 имеют отрицательные значения (таблица 1), свидетельствующие о наличие стимулирующего эффекта. Всхожесть семян в контроле 100%. Пример 2, демонстрирующий антагонизм штамма Р. fluorescens P469 в отношении фитопатогенных бактерий. В качестве тест-объектов используют следующие штаммы фитопатогенных бактерий (в скобках указано вызываемое патогеном заболевание): Pseudomonas solanacearum №9049 (бурая гниль или вилт картофеля), Pseudomonas sp. № 37 (клубневая гниль картофеля), № 115 (мягкая гниль капусты), № 116 (мягкая гниль картофеля) и Erwinia carotovora pv. carotovora S39 (резиновая гниль картофеля). Тестирование антагонистической активности проводят в чашках Петри методом лунок. Используют метод двух слоев, при котором нижним слоем служит голодный агар (в количестве 20 мл на чашку Петри), а верхним (10 мл) питательная среда, оптимальная для роста того или иного патогена: сахарозопептонный агар для Pseudomonas spp. и картофельно-сахарозный агар или Кинга Б для Erwinia carotovora pv. carotovora. Клетки фитопатогенов вносят поверхностно. Для этого на поверхность застывшего слоя питательной среды наносят 0,2 мл суспензии патогена и растирают шпателем. Концентрация суспензии тест-культур должна соответствовать 10 ЕД стандарта мутности. Затем в агаровом слое делают лунки диаметром 8-10 мм и вносят в них по 0,1 мл культуры штамма Р. fluorescens P469, которые для этого растят в среде LB при 28 Чашки инкубируют при 28 Зоны угнетения роста бактерий Erwinia carotovora pv. carotovora S39 составляют 5 мм, a Pseudomonas solanacearum № 9049, Pseudomonas sp. № 37, Erwinia carotovora pv. carotovora № 115 и Erwinia carotovora pv. carotovora № 116 - 15-20 мм, что указывает на антагонистическую активность штамма Р. fluorescens P469 в отношении этих видов фитопатогенов. Пример 3, демонстрирующий антагонистическую активность штамма Р. fluorescens P469 в отношении фитопатогенных грибов Oospora lactis и Phoma esigia. Осуществляют аналогично примеру 2, но в качестве индикаторных тест-объектов используют штаммы грибов Oospora lactis № 5 (резиновая гниль картофеля) и Phoma esigia № 6 (фомозная гниль), и клетки фитопатогенов вносят глубинно (0,18 мл суспензии на 10 мл среды) в составе верхнего слоя питательной среды, в качестве которой используют картофельно-сахарозный агар. Зоны угнетения роста грибов Oospora lactis № 5 и Phoma esigia № 6 штаммом Р. fluorescens P469 составляет в этих условиях 10-30 мм, что показывает антагонистические возможности штамма Р. fluorescens P469 в отношении этих фитопатогенных микроорганизмов. Пример 4, демонстрирующий антагонистическую активность штамма Р. fluorescens P469 в отношении фитопатогенных грибов из родов Alternaria, Fusarium, Colletotrichum, Phytophthora и Rhizoctonia. Тестирование антагонистической активности проводят в чашках Петри с питательным агаром методом штриха. Готовят суспензию штамма Р. fluorescens P469 с плотностью 109 кл/мл, смывая клетки с бактериального газона стерильным раствором 0,9% NaCl. Суспензии фитопатогенных грибов готовят, смывая мицелиальную и споровую массу с газонов грибов на среде Чапека. По диаметральной линии чашки Петри с питательным агаром на основе гидролизата кильки штрихом засевают суспензию патогенного гриба и перпендикулярно к нему - штрихом - суспензии анализируемых бактериальных культур. Чашки инкубируют при 28-30 Пример 5, демонстрирующий антагонистическую активность штамма P. fluorescens P469 в отношении фитопатогенного гриба Gaeumannomyces graminis var. ritici. На чашку Петри с агаризованной средой Каннера сеют бактериальный штамм Р. fluorescens P469 (пятном диаметром 5 мм на расстоянии 3-3,5 см от центра чашки) из суспензии, приготовленной как в примере 4, и выращивают в течение 2 суток для достижения полного синтеза вторичных метаболитов. Затем в центр чашки Петри на поверхность питательного агара помещают сегмент мицелия (диаметром 9 мм) грибного штамма Gaeumannomyces graminis var. tritici, вызывающего офиоболезную гниль корней пшеницы. Мицелий для этого эксперимента выращивают на глюкозокартофельном агаре при комнатной температуре в течение 7 суток. Чашки Петри заклеивают парафильмом для поддержания необходимой влажности и инкубируют при комнатной температуре в течение 5-7 суток. Наличие зоны подавления роста мицелия G. graminis var. tritici штаммом Р. fluorescens P469 свидетельствует об антагонистической активности бактериального штамма в отношении указанного фитопатогенного гриба. Таким образом, штамм Pseudomonas fluorescens P469 обладает способностью к подавлению роста широкого спектра фитопатогенных микроорганизмов (фитопатогенных грибов и бактерий из родов Alternaria, Colletotrichum, Fusarium, Rhizoctonia, Phoma, Phytophthora, Oospora, Erwinia и Pseudomonas), основных возбудителей болезней зерновых культур и картофеля. Штамм не токсичен для растений в рекомендуемых для обработок концентрациях и может быть использован для создания на его основе препарата, предназначенного для профилактической обработки клубней картофеля (защита от гнилей), а также всходов с целью защиты от фитофтороза. Формула изобретенияШтамм бактерий Pseudomonas fluorescens P469 (коллекционный номер ЦКМ В-1982) для получения препарата против болезней растений, вызываемых фитопатогенными грибами и бактериями. MM4A - Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 14.05.2006 Извещение опубликовано: 10.05.2007 БИ: 13/2007 Популярные патенты: 2235464 Гербицидно-действующее средство ... описаниям изобретений Часть описания, где обнаружена ошибка: Кол.17, строка 30 Напечатано: приведены втаблицах 4-6. Следует читать: приведены в таблицах 4-6. Номер и год публикации бюллетеня: 25-2004 Извещение опубликовано: 27.04.2005 БИ: 12/2005 PD4A - Изменение наименования обладателя патента СССР или патента Российской Федерации на изобретение (73) Новое наименование патентообладателя: БАЙЕР КРОПСАЙЕНС АГ (DE) Адрес для переписки: 101000, Москва, ул. Мясницкая, 13, стр.5 Извещение опубликовано: 20.05.2008 БИ: ... 2241322 Навесное устройство трактора ... этой конструкции является отсутствие возможности регулирования направления силы тяги в зависимости от рельефа поля и недопустимая по агрономическим требованиям неравномерность глубины обработки.Наиболее близким техническим решением к заявляемому объекту относится навесное устройство трактора, включающее опорные стойки, подъемные рычаги, центральную верхнюю тягу с амортизатором, раскосы и нижние тяги (Трактор Т-150. Устройство и инструкция по эксплуатации. Под ред. В.П.Кашубы и И.А.Коваля. - М: Колос, 1978, С.188...191). Недостатками известной конструкции являются отсутствие возможности копирования рельефа поверхности поля в поперечно-вертикальной плоскости движения трактора и ... 2160981 Способ создания плантаций солодки голой на обесструктуренных почвах в орошаемом земледелии ... до 2%, подтопление минерализованными водами до 80 - 90 см. Солодка голая транспирирует громадное количество воды. Это способствует понижению уровня грунтовых вод, а с другой стороны является причиной их минерализации. Солодка транспирирует до 10000 м3/га грунтовой воды. При высоком уровне грунтовых вод солодка голая на площади плантации 1 га выносит до 15700 м3 воды. Вместе с этим растения амаранта накапливают в своих клетках часть солей, а другую их часть - перерабатывают и видоизменяют качественно, превращая их в усваиваемые формы. Как правило, бывшие орошаемые поля и участки сохраняют до настоящего времени прямоугольные контуры. Даже при орошении полей капельным дождеванием ... 2415542 Пневматический высевающий аппарат ... сдвигового регистра, второй вход второго элемента И соединен с выходом второго триггера, вход которого соединен с первым входом блока контроля, вход сдвига «влево» сдвигового регистра соединен с первым входом блока контроля, пятый выход сдвигового регистра соединен с входом сигнализатора.Пневматический высевающий аппарат (фиг.1) содержит корпус 1, заборную камеру 2 и вакуумную камеру (не показана), между которыми на горизонтальном валу 3 установлен высевающий диск 4 с присасывающими отверстиями 5 и пластинчатый отражатель 6 для удаления «лишних» семян, примыкающий к торцевой плоскости высевающего диска, рядом с высевающим диском 4 на горизонтальном валу 3 ... 2229783 Способ посева семян трав и кустарников для создания пастбищ ... ... |
Еще из этого раздела: 2137365 Способ отпугивания биологических существ 2113779 Агромост 2423033 Способ укрепления склонов посевом семян древесных растений 2069949 Устройство для направленной передачи наследственной информации 2261583 Выгрузное устройство бункера зерноуборочного комбайна 2452155 Лапа культиватора 2434381 Технологическая линия для приготовления и раздачи влажных кормов 2175177 Агромост с оснасткой для прокладки и уплотнения постоянных грунтовых колей 2215407 Способ создания исходного материала для селекции растений 2485762 Ракета для активного воздействия на облака |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
 С, рН 6,8-7,5. Штамм Pseudomonas fluorescens P469 обладает способностью к подавлению роста широкого круга фитопатогенных грибов и бактерий, стимулирует рост растений. 2 табл.
С, рН 6,8-7,5. Штамм Pseudomonas fluorescens P469 обладает способностью к подавлению роста широкого круга фитопатогенных грибов и бактерий, стимулирует рост растений. 2 табл.
 7Н2О - 1,5 г/л), ПА (питательном агаре на основе гидролизата кильки (ДИПС, г. Махачкала) - 35 г/л), на минимальной синтетической среде М9 следующего состава: К2НРO4 - 7 г/л, KH4PO4 - 3 г/л, NH4
7Н2О - 1,5 г/л), ПА (питательном агаре на основе гидролизата кильки (ДИПС, г. Махачкала) - 35 г/л), на минимальной синтетической среде М9 следующего состава: К2НРO4 - 7 г/л, KH4PO4 - 3 г/л, NH4 Cl - 1 г/л, глюкоза - 2 г/л.
Cl - 1 г/л, глюкоза - 2 г/л.