Способ получения производных 2-анилинопиримидинаПатент на изобретение №: 2014327 Автор: Адольф Хубеле[DE] Патентообладатель: Циба-Гейги АГ (CH) Дата публикации: 15 Июня, 1994 Использование: в сельском хозяйстве как обладающие фунгицидной и инсектицидной активностью. Сущность изобретения - способ получения производных 2 - анилинопиримидина общей формулы 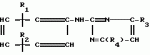 где R1 и R2 -независимо друг от друга означают водород, галоген, C1-C3 -алкил, C1-C2 - галогеналкил, C1-C3 - алкокси или C1-C3 - галогеналкокси, R3 - водород, C1-C4 -алкил, или замещенный гидроксигруппой C1-C4 - алкил, циклопропил или замещенный метилом циклопропил; R4-C3-C6 -циклопропил или замещенный одинаково или различно метилом и/или галогеном, вплоть до трехкратного, (C3-C6) -циклоалкил. Реагент I: соль фенилгуанидина формулы где R1 и R2 -независимо друг от друга означают водород, галоген, C1-C3 -алкил, C1-C2 - галогеналкил, C1-C3 - алкокси или C1-C3 - галогеналкокси, R3 - водород, C1-C4 -алкил, или замещенный гидроксигруппой C1-C4 - алкил, циклопропил или замещенный метилом циклопропил; R4-C3-C6 -циклопропил или замещенный одинаково или различно метилом и/или галогеном, вплоть до трехкратного, (C3-C6) -циклоалкил. Реагент I: соль фенилгуанидина формулы 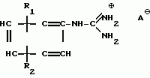 где A где A - анион минеральной кислоты или гуанидин формулы - анион минеральной кислоты или гуанидин формулы 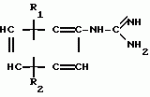 . Реагент II: дикетон: R3C(O)CH2C(O)R4; циклизацию ведут при температуре 60 - 160В°С.
Изобретение относится к способу получения производных 2-анилинопиримидина - новых биологически активных соединений/ которые могут найти применение в сельском хозяйстве как обладающие фунгицидной и инсектицидной активностью. Известны N-пиримидиниланилиновые соединения/ эффективные против поражающих растения грибов. Однако эти соединения обладают недостаточно высокой фунгицидной активностью/ инсектицидная активность у них отсутствует. Цель изобретения - способ получения новых производных 2-анилинопиримидина малотоксичных/ обладающих высокой фунгицидной активностью и проявляющих/ кроме того/ инсектицидное действие. Поставленная цель достигается описываемым способом получения производных 2-антилинопиримидина общей формулы . Реагент II: дикетон: R3C(O)CH2C(O)R4; циклизацию ведут при температуре 60 - 160В°С.
Изобретение относится к способу получения производных 2-анилинопиримидина - новых биологически активных соединений/ которые могут найти применение в сельском хозяйстве как обладающие фунгицидной и инсектицидной активностью. Известны N-пиримидиниланилиновые соединения/ эффективные против поражающих растения грибов. Однако эти соединения обладают недостаточно высокой фунгицидной активностью/ инсектицидная активность у них отсутствует. Цель изобретения - способ получения новых производных 2-анилинопиримидина малотоксичных/ обладающих высокой фунгицидной активностью и проявляющих/ кроме того/ инсектицидное действие. Поставленная цель достигается описываемым способом получения производных 2-антилинопиримидина общей формулы 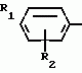 NH NH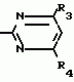 (I) где R1и R2независимо друг от друга означают водород/ галоген/ С1-С3-алкил/ С1-С2-галогеналкил/ С1-С3-алкокси или С1-С3-галогеналкокси; R3-водород/ С1-С4-алкил или замещенный галогеном или гидроксигруппой С1-С4-алкил/ циклопропил или замещенный метилом циклопропил; R4-C3-C6-циклопропил или замещенный одинаково или различно метилом и/или галогеном/ вплоть до трехкратного/ С3-С6-циклоалкил/ заключающийся в том/ что соль фенилгуанидина формулы (I) где R1и R2независимо друг от друга означают водород/ галоген/ С1-С3-алкил/ С1-С2-галогеналкил/ С1-С3-алкокси или С1-С3-галогеналкокси; R3-водород/ С1-С4-алкил или замещенный галогеном или гидроксигруппой С1-С4-алкил/ циклопропил или замещенный метилом циклопропил; R4-C3-C6-циклопропил или замещенный одинаково или различно метилом и/или галогеном/ вплоть до трехкратного/ С3-С6-циклоалкил/ заключающийся в том/ что соль фенилгуанидина формулы 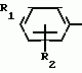 NH NH C C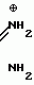  A A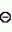 (IIa) в которой (IIa) в которой 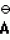 - означает анион минеральной кислоты или гуанидин формулы - означает анион минеральной кислоты или гуанидин формулы 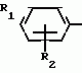 NH NH C C (IIб) подвергают циклизации с дикетоном формулы R3- (IIб) подвергают циклизации с дикетоном формулы R3-  - CH2- - CH2-  - R4 (III) при температуре 60-160 - R4 (III) при температуре 60-160 С с последующим выделением целевого продукта. Примеры получения. Пример 1. Получение 2-фениламино-4-метил-6-циклопропилпиримидина (соединение 1.01). С с последующим выделением целевого продукта. Примеры получения. Пример 1. Получение 2-фениламино-4-метил-6-циклопропилпиримидина (соединение 1.01). 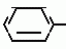 NH NH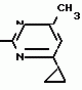 10 г (51 ммоль) кислого карбоната фенилгуанидина и 9/7 г (77 ммоль) 1-циклопропил-1/3-бутандиона нагревают при перемешивании 6 ч до 110 10 г (51 ммоль) кислого карбоната фенилгуанидина и 9/7 г (77 ммоль) 1-циклопропил-1/3-бутандиона нагревают при перемешивании 6 ч до 110 С/ при этом начинающееся выделение двуокиси углерода увеличивается с продолжением реакции. После охлаждения до комнатной температуры темно-коричневую эмульсию смешивают с 50 мл диэтилового эфира/ дважды промывают водой порциями по 20 мл/ высушивают над сульфатом натрия/ фильтруют и испаряют растворитель. Оставшееся темно-коричневое масло (10/1 г) очищают колончатой хроматографией через силикагель (диэтиловый эфир/толуол 5:3). После испарения элюирующей смеси коричневое масло кристаллизуют и перекристаллизовывают из смеси диэтиловый эфир/петролейный эфир при 30-50 С/ при этом начинающееся выделение двуокиси углерода увеличивается с продолжением реакции. После охлаждения до комнатной температуры темно-коричневую эмульсию смешивают с 50 мл диэтилового эфира/ дважды промывают водой порциями по 20 мл/ высушивают над сульфатом натрия/ фильтруют и испаряют растворитель. Оставшееся темно-коричневое масло (10/1 г) очищают колончатой хроматографией через силикагель (диэтиловый эфир/толуол 5:3). После испарения элюирующей смеси коричневое масло кристаллизуют и перекристаллизовывают из смеси диэтиловый эфир/петролейный эфир при 30-50 С. Получают светло-коричневые кристаллы; т.пл. 67-69 С. Получают светло-коричневые кристаллы; т.пл. 67-69 С. Выход 8/55 г (38 ммоль) (74/5% от теории). Пример 2 Получение 2-анилино-4-формилдиэтилацетат-6-циклопропилпиримидина (соединение 1/02). С. Выход 8/55 г (38 ммоль) (74/5% от теории). Пример 2 Получение 2-анилино-4-формилдиэтилацетат-6-циклопропилпиримидина (соединение 1/02). 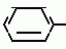 NH NH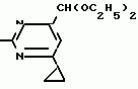 11/7 г (59/2 ммоль) кислого карбоната фенилгуанидина и 13/3 г (62/2 ммоль) 1-циклопропил-3-формилдиэтилацеталь-1/3-пропандиона в 40 мл этанола нагревают при перемешивании до температуры кипения флегмы/ при этом выделение двуокиси углерода увеличивается с продолжительностью реакции. После охлаждения до комнатной температуры темно-коричневую эмульсию смешивают с 80 мл диэтилового эфира/ дважды промывают водой порциями по 30 мл/ высушивают над сульфатом натрия/ фильтруют и растворитель испаряют. Оставшееся темно-коричневое масло (17 г) очищают с помощью колончатой хроматографии над силикагелем (толуол/этилацетат 5:2). После испарения элюирующей смеси остается красновато-коричневое масло с показателем преломления n2D0 1/5815. Выход 15 г (48 ммоль/ 81/1% от теории). Пример 3. Получение 2-анилино-4-формил-6-циклопропилпиримидина (соединение 2.1). 11/7 г (59/2 ммоль) кислого карбоната фенилгуанидина и 13/3 г (62/2 ммоль) 1-циклопропил-3-формилдиэтилацеталь-1/3-пропандиона в 40 мл этанола нагревают при перемешивании до температуры кипения флегмы/ при этом выделение двуокиси углерода увеличивается с продолжительностью реакции. После охлаждения до комнатной температуры темно-коричневую эмульсию смешивают с 80 мл диэтилового эфира/ дважды промывают водой порциями по 30 мл/ высушивают над сульфатом натрия/ фильтруют и растворитель испаряют. Оставшееся темно-коричневое масло (17 г) очищают с помощью колончатой хроматографии над силикагелем (толуол/этилацетат 5:2). После испарения элюирующей смеси остается красновато-коричневое масло с показателем преломления n2D0 1/5815. Выход 15 г (48 ммоль/ 81/1% от теории). Пример 3. Получение 2-анилино-4-формил-6-циклопропилпиримидина (соединение 2.1). 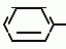 NH NH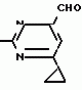 12/3 г (39/3 ммоль 2-анилино-4-формилдиэтилацеталь-6-циклопропилпиримидина/ 4 г (39/3 ммоль) концентрированной соляной кислоты и 75 мл воды нагревают при интенсивном перемешивании 14 ч при 500 12/3 г (39/3 ммоль 2-анилино-4-формилдиэтилацеталь-6-циклопропилпиримидина/ 4 г (39/3 ммоль) концентрированной соляной кислоты и 75 мл воды нагревают при интенсивном перемешивании 14 ч при 500 С и после добавления 2 г (19/6 ммоль) концентрированной соляной кислоты перемешивают еще 24 ч при этой температуре. После охлаждения до комнатной температуры к суспензии бежевого цвета добавляют 50 мл этилацетата и нейтрализуют добавлением 7 мл 30% -ным едким натром. Раствор этилацетата затем отделяют/ высушивают над сульфатом натрия/ фильтруют и растворитель испаряют. Для очистки окрашенное в коричневый цвет твердое вещество перекристаллизовывают из 20 мл изопропанола при добавлении активированного угля. Желтоватые кристаллы плавятся при 112-114 С и после добавления 2 г (19/6 ммоль) концентрированной соляной кислоты перемешивают еще 24 ч при этой температуре. После охлаждения до комнатной температуры к суспензии бежевого цвета добавляют 50 мл этилацетата и нейтрализуют добавлением 7 мл 30% -ным едким натром. Раствор этилацетата затем отделяют/ высушивают над сульфатом натрия/ фильтруют и растворитель испаряют. Для очистки окрашенное в коричневый цвет твердое вещество перекристаллизовывают из 20 мл изопропанола при добавлении активированного угля. Желтоватые кристаллы плавятся при 112-114 С. Выход 7/9 г (33 ммоль/ 84% от теории). Пример 4. Получение 2-анилин-4-гидроксиметил-6-циклопропилпиримидина (соединение 1.04). С. Выход 7/9 г (33 ммоль/ 84% от теории). Пример 4. Получение 2-анилин-4-гидроксиметил-6-циклопропилпиримидина (соединение 1.04). 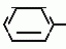 NH NH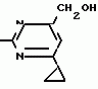 а)К 14/1 г (59 ммоль) 2-анилино-4-формил-6-циклопропилпиримидина в 350 мл абсолютного метанола в течение 15 мин при перемешивании при комнатной температуре/ порциями добавляют 2/3 г (60 ммоль) боргидрида натрия/ при этом реакционная смесь при выделении водорода нагревается до 28 а)К 14/1 г (59 ммоль) 2-анилино-4-формил-6-циклопропилпиримидина в 350 мл абсолютного метанола в течение 15 мин при перемешивании при комнатной температуре/ порциями добавляют 2/3 г (60 ммоль) боргидрида натрия/ при этом реакционная смесь при выделении водорода нагревается до 28 С. Через 4 ч реакционную смесь подкисляют прикапыванием 10 мл концентрированной соляной кислоты; по каплям добавляют 120 мл 10%-ного раствора гидрокарбоната натрия и непосредственно после этого разбавляют 250 мл воды. Выпавший осадок отфильтровывают/ высушивают/ растворяют полностью в 600 мл диэтилового эфира при нагревании/ обрабатывают активированным углем и фильтруют. Прозрачный фильтрат испаряют до появления мути/ разбавляют петролейным эфиром и отфильтровывают светло-желтую кристаллическую пыль; т.пл.123-125 С. Через 4 ч реакционную смесь подкисляют прикапыванием 10 мл концентрированной соляной кислоты; по каплям добавляют 120 мл 10%-ного раствора гидрокарбоната натрия и непосредственно после этого разбавляют 250 мл воды. Выпавший осадок отфильтровывают/ высушивают/ растворяют полностью в 600 мл диэтилового эфира при нагревании/ обрабатывают активированным углем и фильтруют. Прозрачный фильтрат испаряют до появления мути/ разбавляют петролейным эфиром и отфильтровывают светло-желтую кристаллическую пыль; т.пл.123-125 С. Выход 10/8 г (44/8 ммоль/ 75/9% от теории). б) 5/9 г (23 ммоль) 2-анилино-4-метоксиметил-6-циклопропилпиримидина/ полученного из фенилгуанидина и 1-циклопропил-4-метокси-1/3-бутандиона/ растворяют в 200 мл дихлорметана и охлаждают до -68 С. Выход 10/8 г (44/8 ммоль/ 75/9% от теории). б) 5/9 г (23 ммоль) 2-анилино-4-метоксиметил-6-циклопропилпиримидина/ полученного из фенилгуанидина и 1-циклопропил-4-метокси-1/3-бутандиона/ растворяют в 200 мл дихлорметана и охлаждают до -68 С. К легко окрашенному раствору при интенсивном перемешивании медленно в течение 30 мин по каплям добавляют 6/8 г (27 ммоль) бортрибромида/ непосредственно после этого удаляют охлаждающую баню и перемешивают еще 2 ч при комнатной температуре. После добавления 150 г воды со льдом выпавший сырой продукт отфильтровывают и перекристаллизовывают из метанола при применении активированного угля. Светло-желтые кристаллы плавятся при 124-126 С. К легко окрашенному раствору при интенсивном перемешивании медленно в течение 30 мин по каплям добавляют 6/8 г (27 ммоль) бортрибромида/ непосредственно после этого удаляют охлаждающую баню и перемешивают еще 2 ч при комнатной температуре. После добавления 150 г воды со льдом выпавший сырой продукт отфильтровывают и перекристаллизовывают из метанола при применении активированного угля. Светло-желтые кристаллы плавятся при 124-126 С. Выход 4/7 г (19/5 ммоль/ 84/7% от теории). К 12 г (50 ммоль) 2-фениламино-4-гидроксиметил-6-циклопропилпиримидина и 0/4 г (50 ммоль) пиридина в 350 мл диэтилового эфира по каплям добавляют в течение 30 мин при перемешивании 15/6 г (75 ммоль) тионилбромида в 50 мл диэтилового эфира. После 2 ч перемешивания при комнатной температуре добавляют еще 0/4 г (50 ммоль) пиридина и нагревают 5 ч до температуры кипения флегмы. После охлаждения до комнатной температуры добавляют 200 мл воды с добавлением 140 мл насыщенного раствора гидрокарбоната натрия устанавливают значение рН раствора 7. После отделения фазы диэтилового эфира дважды промывают водой порциями по 100 мл/ высушивают над сульфатом натрия/ фильтруют и растворитель испаряют. Оставшееся коричневое масло очищают с помощью колончатой хроматографии через силикагель (толуол/хлороформ/диэтиловый эфир/петролейный эфир); т. кип. 50-70 С. Выход 4/7 г (19/5 ммоль/ 84/7% от теории). К 12 г (50 ммоль) 2-фениламино-4-гидроксиметил-6-циклопропилпиримидина и 0/4 г (50 ммоль) пиридина в 350 мл диэтилового эфира по каплям добавляют в течение 30 мин при перемешивании 15/6 г (75 ммоль) тионилбромида в 50 мл диэтилового эфира. После 2 ч перемешивания при комнатной температуре добавляют еще 0/4 г (50 ммоль) пиридина и нагревают 5 ч до температуры кипения флегмы. После охлаждения до комнатной температуры добавляют 200 мл воды с добавлением 140 мл насыщенного раствора гидрокарбоната натрия устанавливают значение рН раствора 7. После отделения фазы диэтилового эфира дважды промывают водой порциями по 100 мл/ высушивают над сульфатом натрия/ фильтруют и растворитель испаряют. Оставшееся коричневое масло очищают с помощью колончатой хроматографии через силикагель (толуол/хлороформ/диэтиловый эфир/петролейный эфир); т. кип. 50-70 С: 5/3/1/1. После испарения элюирующей смеси желтое масло разбавляют смесью диэтиловый эфир); т. кип. 50-70 С: 5/3/1/1. После испарения элюирующей смеси желтое масло разбавляют смесью диэтиловый эфир); т. кип. 50-70 С и ставят на холод для кристаллизации. Желтая кристаллическая пыль плавится при 77/5-79/5 С и ставят на холод для кристаллизации. Желтая кристаллическая пыль плавится при 77/5-79/5 С. Выход 9/7 (32 ммоль)/ 64% от теории. Пример 5. Получение 2-фениламино-4-фторметил-6-циклопропилпиримидина (соединение 1/34). С. Выход 9/7 (32 ммоль)/ 64% от теории. Пример 5. Получение 2-фениламино-4-фторметил-6-циклопропилпиримидина (соединение 1/34). 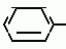 NH NH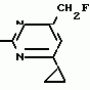 а) 3/9 г (12/8 ммоль) 2-фениламино-4-бромэтил-6-циклопропилпиримидина/ 1/5 г (12/8 ммоль) высушенного возгонкой фторида калия и 0/3 г (1/13 ммоль) 18-краун-6-эфира нагревают в 50 мл ацетонитрила 40 ч до температуры кипения флегмы. После этого добавляют дополнительно 0/75 г (13 ммоль) фторида калия и нагревают 22 ч. Для полного прохождения реакции еще раз добавляют 0/75 г (13 ммоль) высушенного возгонкой фторида калия и 0/1 г (0/38 ммоль) 18-краун-6-эфира и дополнительно нагревают 24 ч до температуры кипения флегмы. После охлаждения до комнатной температуры суспензию смешивают с 150 мл диэтилового эфира/ трижды промывают водой порциями по 20 мл/ высушивают над сульфатом натрия/ фильтруют и растворитель испаряют. Оставшееся коричневое масло очищают с помощью колончатой хроматографии через силикагель (толуол/хлороформ/диэтиловый эфир/петролейный эфир; т. кип. 50-70 а) 3/9 г (12/8 ммоль) 2-фениламино-4-бромэтил-6-циклопропилпиримидина/ 1/5 г (12/8 ммоль) высушенного возгонкой фторида калия и 0/3 г (1/13 ммоль) 18-краун-6-эфира нагревают в 50 мл ацетонитрила 40 ч до температуры кипения флегмы. После этого добавляют дополнительно 0/75 г (13 ммоль) фторида калия и нагревают 22 ч. Для полного прохождения реакции еще раз добавляют 0/75 г (13 ммоль) высушенного возгонкой фторида калия и 0/1 г (0/38 ммоль) 18-краун-6-эфира и дополнительно нагревают 24 ч до температуры кипения флегмы. После охлаждения до комнатной температуры суспензию смешивают с 150 мл диэтилового эфира/ трижды промывают водой порциями по 20 мл/ высушивают над сульфатом натрия/ фильтруют и растворитель испаряют. Оставшееся коричневое масло очищают с помощью колончатой хроматографии через силикагель (толуол/хлороформ/диэтиловый эфир/петролейный эфир; т. кип. 50-70 С/ 5/3/1/1. После испарения элюирующей смеси желтое масло вносят в 10 мл петролейного эфира (т.кип. 50-70 С/ 5/3/1/1. После испарения элюирующей смеси желтое масло вносят в 10 мл петролейного эфира (т.кип. 50-70 С) и помещают на холод для кристаллизации. Желтые кристаллы плавятся при 48-52 С) и помещают на холод для кристаллизации. Желтые кристаллы плавятся при 48-52 С. Выход 2/1 г (8/6 ммоль)/ 67/5% от теории. б) К суспензии 9/1 г (37/8 ммоль) 2-фениламино-4-гидроксиметил-6-циклопропилпиримидина в 80 мл дихлорметана при перемешивании в течение 1 ч по каплям медленно добавляют 6/1 г (37/8 ммоль) диэтиламинотиотрифторида в 15 мл дихлорметана. После добавления 50 мл ледяной воды по каплям добавляют 50 мл 10%-ного водного раствора гидрокарбоната натрия. По окончании выделения двуокиси углерода органическую фазу отделяют и водную фазу дважды экстрагируют дихлорметаном порциями 20 мл. Соединенные растворы дихлорметана промывают водой (15 мл)/ высушивают над сульфатом натрия/ фильтруют и испаряют растворитель. Оставшееся череное масло очищают с помощью колончатой хроматографии через силикагель /толуол/хлороформ/диэтиловый эфир; т.кип. 50-70 С. Выход 2/1 г (8/6 ммоль)/ 67/5% от теории. б) К суспензии 9/1 г (37/8 ммоль) 2-фениламино-4-гидроксиметил-6-циклопропилпиримидина в 80 мл дихлорметана при перемешивании в течение 1 ч по каплям медленно добавляют 6/1 г (37/8 ммоль) диэтиламинотиотрифторида в 15 мл дихлорметана. После добавления 50 мл ледяной воды по каплям добавляют 50 мл 10%-ного водного раствора гидрокарбоната натрия. По окончании выделения двуокиси углерода органическую фазу отделяют и водную фазу дважды экстрагируют дихлорметаном порциями 20 мл. Соединенные растворы дихлорметана промывают водой (15 мл)/ высушивают над сульфатом натрия/ фильтруют и испаряют растворитель. Оставшееся череное масло очищают с помощью колончатой хроматографии через силикагель /толуол/хлороформ/диэтиловый эфир; т.кип. 50-70 С/ 5/3/1/1. После испарения элюирующей смеси желтое масло разбавляют 20 мл петролейного эфира (т.пл. 50-70 С/ 5/3/1/1. После испарения элюирующей смеси желтое масло разбавляют 20 мл петролейного эфира (т.пл. 50-70 С) и помещают на холод для кристаллизации. Желтоватые кристаллы плавятся при 50-52 С) и помещают на холод для кристаллизации. Желтоватые кристаллы плавятся при 50-52 С. Выход 4/9 г (20/1 ммоль/ 53% от теории). Пример 6. Получение 2-гидрокси-4-метил-циклопропилпиримидина. HO С. Выход 4/9 г (20/1 ммоль/ 53% от теории). Пример 6. Получение 2-гидрокси-4-метил-циклопропилпиримидина. HO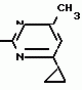 . 6 г (100 ммоль) мочевины и 12/6 г (100 ммоль) 1-циклопропил-1/3-бутадиона при комнатной температуре смешивают в 35 мл этанола с 15 мл концентрированной соляной кислоты. После 10-дневного стояния при комнатной температуре испаряют на роторном испарителе при температуре бани максимально 45 . 6 г (100 ммоль) мочевины и 12/6 г (100 ммоль) 1-циклопропил-1/3-бутадиона при комнатной температуре смешивают в 35 мл этанола с 15 мл концентрированной соляной кислоты. После 10-дневного стояния при комнатной температуре испаряют на роторном испарителе при температуре бани максимально 45 С. Остаток растворяют в 20 мл этанола/ при этом очень быстро осаждается гидрохлорид реакционного продукта. При перемешивании добавляют 20 мл диэтилового эфира/ выпавшие белые кристаллы отфильтровывают и промывают смесью этанола и диэтилового эфира и высушивают. В результате испарения фильтрата и перекристаллизации из смеси этанола и диэтилового эфира (1:2) получают дополнительное количество гидрохлорида. Белые кристаллы плавятся при температуре выше 230 С. Остаток растворяют в 20 мл этанола/ при этом очень быстро осаждается гидрохлорид реакционного продукта. При перемешивании добавляют 20 мл диэтилового эфира/ выпавшие белые кристаллы отфильтровывают и промывают смесью этанола и диэтилового эфира и высушивают. В результате испарения фильтрата и перекристаллизации из смеси этанола и диэтилового эфира (1:2) получают дополнительное количество гидрохлорида. Белые кристаллы плавятся при температуре выше 230 С. Выход гидрохлорида 12/6 г (67/7 ммоль/ 67/5% от теории). Пример 7. Получение 2-хлор-4-метил-6-циклопропил-пиримидина (соединение 3.1). Cl С. Выход гидрохлорида 12/6 г (67/7 ммоль/ 67/5% от теории). Пример 7. Получение 2-хлор-4-метил-6-циклопропил-пиримидина (соединение 3.1). Cl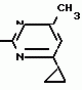 52/8 г (0/24 ммоль) гидрохлорида 2-гидрокси-4-метил-6-циклопропилпиримидина при перемешивании при комнатной температуре вносят в смесь 100 мл (1/1 ммоль) оксихлорида фосфора и 117 г (0/89 ммоль) диэтиланилина/ при этом температура поднимается до 63 52/8 г (0/24 ммоль) гидрохлорида 2-гидрокси-4-метил-6-циклопропилпиримидина при перемешивании при комнатной температуре вносят в смесь 100 мл (1/1 ммоль) оксихлорида фосфора и 117 г (0/89 ммоль) диэтиланилина/ при этом температура поднимается до 63 С. После нагревания в течение 2 ч до 110 С. После нагревания в течение 2 ч до 110 С охлаждают до комнатной температуры и реакционную смесь при перемешивании переносят в смесь воды со льдом и метиленхлорида. Органическую фазу отделяют и промывают до нейтральной реакции насыщенным водным раствором гидрокарбоната натрия. После испарения растворителя получают 116/4 г масла/ которое состоит из продукта реакции и диэтиланилина. Отделение диэтиланилина и очистку сырого реакционного продукта осуществляют с помощью колончатой хроматографии через силикагель (гексан/диэтилацетат 3:1). Через несколько дней закристаллизовавшееся бесцветное масло имеет показатель преломления n2D5 1/5419. Выход 35/7 г (0/21 ммоль/ 87/5% от теории); т.пл. 33-34 С охлаждают до комнатной температуры и реакционную смесь при перемешивании переносят в смесь воды со льдом и метиленхлорида. Органическую фазу отделяют и промывают до нейтральной реакции насыщенным водным раствором гидрокарбоната натрия. После испарения растворителя получают 116/4 г масла/ которое состоит из продукта реакции и диэтиланилина. Отделение диэтиланилина и очистку сырого реакционного продукта осуществляют с помощью колончатой хроматографии через силикагель (гексан/диэтилацетат 3:1). Через несколько дней закристаллизовавшееся бесцветное масло имеет показатель преломления n2D5 1/5419. Выход 35/7 г (0/21 ммоль/ 87/5% от теории); т.пл. 33-34 С. Пример 8. Получение 2-(м-фторфениламино)-4-этил-6-циклопропилпиримидина (соединение 1/63). С. Пример 8. Получение 2-(м-фторфениламино)-4-этил-6-циклопропилпиримидина (соединение 1/63).  NH NH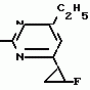 Раствор 5/5 г (50 ммоль) 3-фторанилина и 9/3 г (55 моль) 2-хлор-4-метил-6-циклопропилпиримидина в 100 мл этанола при перемешивании добавлением 5 мл концентрированной соляной кислоты доводят до рН 1 и непосредственно после этого нагревают 18 ч до температуры кипения флегмы. После охлаждения до комнатной температуры коричневую эмульсию доводят до щелочной реакции добавлением 10 мл 30%-ного аммиака/ выливают в 100 мл воды со льдом дважды экстрагируют диэтиловым эфиром порциями по 150 мл. Соединенные экстракты промывают 50 мл воды/ высушивают над сульфатом натрия/ фильтруют и испаряют растворитель. Оставшиеся желтоватые кристаллы очищают перекристаллизацией из смеси диизопропиловый эфир (петролейный эфир); т. кип. 50-70 Раствор 5/5 г (50 ммоль) 3-фторанилина и 9/3 г (55 моль) 2-хлор-4-метил-6-циклопропилпиримидина в 100 мл этанола при перемешивании добавлением 5 мл концентрированной соляной кислоты доводят до рН 1 и непосредственно после этого нагревают 18 ч до температуры кипения флегмы. После охлаждения до комнатной температуры коричневую эмульсию доводят до щелочной реакции добавлением 10 мл 30%-ного аммиака/ выливают в 100 мл воды со льдом дважды экстрагируют диэтиловым эфиром порциями по 150 мл. Соединенные экстракты промывают 50 мл воды/ высушивают над сульфатом натрия/ фильтруют и испаряют растворитель. Оставшиеся желтоватые кристаллы очищают перекристаллизацией из смеси диизопропиловый эфир (петролейный эфир); т. кип. 50-70 С. Белые кристаллы плавятся при 87-89 С. Белые кристаллы плавятся при 87-89 С. Выход 8/3 г (34 ммоль/ 68% от теории). Пример 9. Получение 2-(п-фторфениламино)-4-метил-6-циклопропилпиримидина (соединение 1/21). F С. Выход 8/3 г (34 ммоль/ 68% от теории). Пример 9. Получение 2-(п-фторфениламино)-4-метил-6-циклопропилпиримидина (соединение 1/21). F NH NH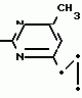 24/8 г (0/115 ммоль) гидрокарбоната 4-фторфенилгуанидина и 17/5 г (0/138 ммоль) 1-циклопропил-1/3-бутандиона в 150 мл метанола нагревают при перемешивании 24 ч при температуре кипения флегмы/ причем образование двуокиси углерода через некоторое время явно уменьшается. Полученный темно-коричневый прозрачный раствор обрабатывают еще теплым активированным углем/ фильтруют и фильтрат испаряют на роторном испарителе до отделения кристаллической массы и при перемешивании выливают в 500 мл воды. Выпавшие кристаллы отфильтровывают/ промывают небольшим количеством холодного этанола/ высушивают и перекристаллизовывают из смеси диизопропилового эфира и петролейного эфира (50-70 24/8 г (0/115 ммоль) гидрокарбоната 4-фторфенилгуанидина и 17/5 г (0/138 ммоль) 1-циклопропил-1/3-бутандиона в 150 мл метанола нагревают при перемешивании 24 ч при температуре кипения флегмы/ причем образование двуокиси углерода через некоторое время явно уменьшается. Полученный темно-коричневый прозрачный раствор обрабатывают еще теплым активированным углем/ фильтруют и фильтрат испаряют на роторном испарителе до отделения кристаллической массы и при перемешивании выливают в 500 мл воды. Выпавшие кристаллы отфильтровывают/ промывают небольшим количеством холодного этанола/ высушивают и перекристаллизовывают из смеси диизопропилового эфира и петролейного эфира (50-70 С). Окрашенные в бежевый цвет кристаллы плавятся при 89-91 С). Окрашенные в бежевый цвет кристаллы плавятся при 89-91 С. Пример 10. Получение 2-фениламино-4-метил-6-(2-метилциклопропил)-пиримидина (соединение 1/13). С. Пример 10. Получение 2-фениламино-4-метил-6-(2-метилциклопропил)-пиримидина (соединение 1/13).  NH NH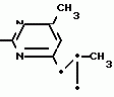 62/2 г (0/3 ммоль) 95%-ного гидрокарбоната фенилгуанидина помещают в 300 мл изопропанола и при перемешивании при внешней температуре 124 62/2 г (0/3 ммоль) 95%-ного гидрокарбоната фенилгуанидина помещают в 300 мл изопропанола и при перемешивании при внешней температуре 124 С нагревают до температуры кипения флегмы 78 С нагревают до температуры кипения флегмы 78 С/ причем образуется суспензия/ окрашенная в бежевый цвет. В течение 40 мин прикапывают 42/1 г (0/3 ммоль) 1-(2-метилциклопропил)-1/3-бутандиона/ при этом тотчас же начинается энергичное выделение диоксида углерода. По окончании прикапывания реакционную смесь нагревают 6 ч при перемешивании при температуре кипения флегмы и после снижения наружной температуры отгоняют 200 мл изопропанола с помощью конденсатора. После удаления обогрева при внутренней температуре 60 С/ причем образуется суспензия/ окрашенная в бежевый цвет. В течение 40 мин прикапывают 42/1 г (0/3 ммоль) 1-(2-метилциклопропил)-1/3-бутандиона/ при этом тотчас же начинается энергичное выделение диоксида углерода. По окончании прикапывания реакционную смесь нагревают 6 ч при перемешивании при температуре кипения флегмы и после снижения наружной температуры отгоняют 200 мл изопропанола с помощью конденсатора. После удаления обогрева при внутренней температуре 60 С при перемешивании медленно добавляют 100 мл воды к коричневому раствору/ который после добавления воды начинает медленно мутнеть. После 12-часового перемешивания при комнатной температуре охлаждают в течение 1 ч до +5 С при перемешивании медленно добавляют 100 мл воды к коричневому раствору/ который после добавления воды начинает медленно мутнеть. После 12-часового перемешивания при комнатной температуре охлаждают в течение 1 ч до +5 С и в течение двух последующих часов до +3 С и в течение двух последующих часов до +3 С. Выпавшую кашицу из кристаллов отфильтровывают/ промывают 40 мл холодной смеси (1:1) изопропанола и воды и высушивают белые кристаллы; т.пл. 73-74 С. Выпавшую кашицу из кристаллов отфильтровывают/ промывают 40 мл холодной смеси (1:1) изопропанола и воды и высушивают белые кристаллы; т.пл. 73-74 С. Выход 51/4 г (0/215 ммоль/ выход от теории 75/3%). Пример 11. Получение 2-фениламино-4-этил-6-циклопропилпиримидина (соединение 1/06). С. Выход 51/4 г (0/215 ммоль/ выход от теории 75/3%). Пример 11. Получение 2-фениламино-4-этил-6-циклопропилпиримидина (соединение 1/06).  NH NH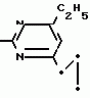 27 г (0/2 ммоль) фенилгуанидина в 200 мл диметилформамида при перемешивании при комнатной температуре смешивают с 6 мл уксусной кислоты. После нагревания до 50 27 г (0/2 ммоль) фенилгуанидина в 200 мл диметилформамида при перемешивании при комнатной температуре смешивают с 6 мл уксусной кислоты. После нагревания до 50 С прикапывают в течение 0/5 ч при перемешивании 28 г (0/2 ммоль) 1-циклопропил-1/3-пентандиона и при перемешивании нагревают последующие 2 ч до 150 С прикапывают в течение 0/5 ч при перемешивании 28 г (0/2 ммоль) 1-циклопропил-1/3-пентандиона и при перемешивании нагревают последующие 2 ч до 150 С. После охлаждения до комнатной температуры испаряют растворитель в вакууме и при перемешивании темно-коричневую реакционную смесь выливают в 500 мл воды. После установления рН 9 с помощью немного разбавленной щелочи (NaOH) дважды экстрагируют водную фазу диэтиловым эфиром порциями по 150 мл/ соединенные экстракты промывают 200 мл воды и высушивают над сульфатом натрия/ фильтруют и эфир испаряют. Оставшееся масло дистиллируют в высоком вакууме; т.кип. 125-129 С. После охлаждения до комнатной температуры испаряют растворитель в вакууме и при перемешивании темно-коричневую реакционную смесь выливают в 500 мл воды. После установления рН 9 с помощью немного разбавленной щелочи (NaOH) дважды экстрагируют водную фазу диэтиловым эфиром порциями по 150 мл/ соединенные экстракты промывают 200 мл воды и высушивают над сульфатом натрия/ фильтруют и эфир испаряют. Оставшееся масло дистиллируют в высоком вакууме; т.кип. 125-129 С 1 Па. Желтое масло через некоторое время затвердевает; т.пл. 42-45 С 1 Па. Желтое масло через некоторое время затвердевает; т.пл. 42-45 С. Все соединения формулы I/ их физико-химические константы/ полученные описываемым способом/ приведены в табл.1. В нижеприведенных табл. 2/ 3 и 4 в качестве примеров названы промежуточные соединения предложенного изобретения. Проведены биологические испытания производных 2-анилинопиримидина/ полученных описываемым способом. Биологические примеры. Пример 1. Действие против Venturia inaequalis на ростках яблони. Резидуально-протективное действие. Саженцы яблони со свежими побегами 10-20 см длиной были опрысканы бульоном для разбрызгивания (0/006% активного вещества)/ приготовленного из смачивающегося активного компонента. Через 24 ч обработанные растения заражали суспензией спор грибов. Растения инкубировали затем в течение 5 дней при 90-100% относительной влажности воздуха/ в последующие 10 дней выдерживали в теплице при 20-24 С. Все соединения формулы I/ их физико-химические константы/ полученные описываемым способом/ приведены в табл.1. В нижеприведенных табл. 2/ 3 и 4 в качестве примеров названы промежуточные соединения предложенного изобретения. Проведены биологические испытания производных 2-анилинопиримидина/ полученных описываемым способом. Биологические примеры. Пример 1. Действие против Venturia inaequalis на ростках яблони. Резидуально-протективное действие. Саженцы яблони со свежими побегами 10-20 см длиной были опрысканы бульоном для разбрызгивания (0/006% активного вещества)/ приготовленного из смачивающегося активного компонента. Через 24 ч обработанные растения заражали суспензией спор грибов. Растения инкубировали затем в течение 5 дней при 90-100% относительной влажности воздуха/ в последующие 10 дней выдерживали в теплице при 20-24 С. Через 15 дней после заражения оценивали поражение струпьями. Соединения табл.1 показали против Venturia inaequalis хорошую активность (поражение менее 20%). Так/ соединения NN 1,01, 1,06, 1.12, 1.13, 1.21, 1.28, 1.34, 1.35, 1.36, 1.38, 1.44, 1.45, 1.48, 1.51, 1.54, 1.56, 1.58, 1.63, 1.68, 1.71, 1.78, 1.86 и 1.87 сокращают поражение Venturia до 0-10%. Но необработанные зараженные контрольные растения были поражены однако на 100%. Пример 2. Действие против Botrytis cinerea на фруктах-яблоках. Резидуально-протективное действие. Искусственно поврежденные яблоки были обработаны так/ что бульон для разбрызгивания (0/002% активного вещества)/ полученного из смачивающегося порошка активного вещества/ разбрызгивали на поврежденные места. Обработанные фрукты непосредственно после этого заражали суспензией спор гриба и в течение недели выдерживали при высокой влажности воздуха приблизительно при 20 С. Через 15 дней после заражения оценивали поражение струпьями. Соединения табл.1 показали против Venturia inaequalis хорошую активность (поражение менее 20%). Так/ соединения NN 1,01, 1,06, 1.12, 1.13, 1.21, 1.28, 1.34, 1.35, 1.36, 1.38, 1.44, 1.45, 1.48, 1.51, 1.54, 1.56, 1.58, 1.63, 1.68, 1.71, 1.78, 1.86 и 1.87 сокращают поражение Venturia до 0-10%. Но необработанные зараженные контрольные растения были поражены однако на 100%. Пример 2. Действие против Botrytis cinerea на фруктах-яблоках. Резидуально-протективное действие. Искусственно поврежденные яблоки были обработаны так/ что бульон для разбрызгивания (0/002% активного вещества)/ полученного из смачивающегося порошка активного вещества/ разбрызгивали на поврежденные места. Обработанные фрукты непосредственно после этого заражали суспензией спор гриба и в течение недели выдерживали при высокой влажности воздуха приблизительно при 20 С. При оценке подсчитывали покрытые плесенью поврежденные места и отсюда определяли фунгицидное действие испытываемого вещества. Соединения из табл. 1 показывают против Botrytis хорошую активность (поражение менее 20%). Так/ например/ соединения NN 1.01, 1.04, 1.06, 1.08, 1.12, 1.13, 1.20, 1.21, 1.22, 1.28, 1.31, 1.33, 1.34, 1.35, 1.36, 1.38, 1.40, 1.43, 1.44, 1.45, 1.48, 1.51, 1.54, 1.56, 1.58, 1.63, 1.65, 1.67, 1.68, 1.71, 1.78, 1.81, 1.86, 1.87 и 1.88 снижали поражение Botrytis до 0-10% . Но необработанные зараженные контрольные растения имели поражение Botrytis 100%. Пример 3. Действие против Erysiphae graminis на ячмене. а) Резидуально-протективное действие. Растения ячменя высотой около 8 см были опрысканы бульоном для разбрызгивания (0/006% активного вещества)/ приготовленного из смачивающегося порошка активного вещества. Через 3-4 ч обработанные растения были опылены спорами гриба. Зараженные растения ячменя помещали в теплицу при температуре около 22 С. При оценке подсчитывали покрытые плесенью поврежденные места и отсюда определяли фунгицидное действие испытываемого вещества. Соединения из табл. 1 показывают против Botrytis хорошую активность (поражение менее 20%). Так/ например/ соединения NN 1.01, 1.04, 1.06, 1.08, 1.12, 1.13, 1.20, 1.21, 1.22, 1.28, 1.31, 1.33, 1.34, 1.35, 1.36, 1.38, 1.40, 1.43, 1.44, 1.45, 1.48, 1.51, 1.54, 1.56, 1.58, 1.63, 1.65, 1.67, 1.68, 1.71, 1.78, 1.81, 1.86, 1.87 и 1.88 снижали поражение Botrytis до 0-10% . Но необработанные зараженные контрольные растения имели поражение Botrytis 100%. Пример 3. Действие против Erysiphae graminis на ячмене. а) Резидуально-протективное действие. Растения ячменя высотой около 8 см были опрысканы бульоном для разбрызгивания (0/006% активного вещества)/ приготовленного из смачивающегося порошка активного вещества. Через 3-4 ч обработанные растения были опылены спорами гриба. Зараженные растения ячменя помещали в теплицу при температуре около 22 С и оценивали повреждение грибом через 10 дней. Соединения табл. 1 показали против Erysiphae хорошую активность (поражение менее 20%). Так/ например/ соединения NN 1.1, 1.06, 1.12, 1.13, 1.21, 1.28, 1.34, 1.35, 1.36, 1.38, 1.44, 1.45, 1.48, 1.51, 1.20, 1.63, 1.78, 1.86 и 1.87 снижали поражение Erysiphae до 0-10%. Но необработанные зараженные контрольные растения/ напротив/ имели поражения 100%. Описание опыта. Сравнение активности биологически активных веществ по изобретению с уровнем техники. 1. Соединение (PS/5-16701/1+2/+E) X1 С и оценивали повреждение грибом через 10 дней. Соединения табл. 1 показали против Erysiphae хорошую активность (поражение менее 20%). Так/ например/ соединения NN 1.1, 1.06, 1.12, 1.13, 1.21, 1.28, 1.34, 1.35, 1.36, 1.38, 1.44, 1.45, 1.48, 1.51, 1.20, 1.63, 1.78, 1.86 и 1.87 снижали поражение Erysiphae до 0-10%. Но необработанные зараженные контрольные растения/ напротив/ имели поражения 100%. Описание опыта. Сравнение активности биологически активных веществ по изобретению с уровнем техники. 1. Соединение (PS/5-16701/1+2/+E) X1 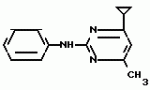 Соединение 1.01 X2 Соединение 1.01 X2  NH NH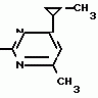 Соединение 1.13 X3 Соединение 1.13 X3 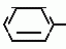 NH NH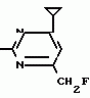 Соединение 1.34 X4 Соединение 1.34 X4 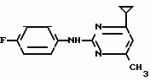 Соединение 1.21 X5 Соединение 1.21 X5 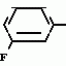 NH NH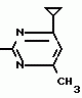 Соединение 1.35 Известные соединения Y1 Соединение 1.35 Известные соединения Y1  NH NH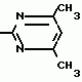 Соединение 1 (2) Y Соединение 1 (2) Y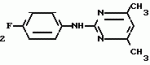 Соединение 35 (2) Y3 Соединение 35 (2) Y3 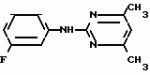 Соединение 34 (2) Y4 Соединение 34 (2) Y4 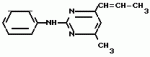 Соединение 37 (1) Y5 Соединение 37 (1) Y5 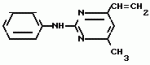 Соединение 36 (1) Проведение опыта Действие против Nilaparvata lugeus при нанесении в воде на растения риса. К растениям риса Varietat Nohrin 29/ выращенным в течение 3 недель в фарфоровых горшках/ добавляли в отстоявшейся воде водную эмульсию/ приготовленную с активным веществом/ подлежащим испытанию/ с концентрацией 100 ppm. Через 1/ 2 и 3 недели после нанесения растения риса были заражены N-3 нимфами в количестве 20 штук. Опыт проводили в теплице при 26 Соединение 36 (1) Проведение опыта Действие против Nilaparvata lugeus при нанесении в воде на растения риса. К растениям риса Varietat Nohrin 29/ выращенным в течение 3 недель в фарфоровых горшках/ добавляли в отстоявшейся воде водную эмульсию/ приготовленную с активным веществом/ подлежащим испытанию/ с концентрацией 100 ppm. Через 1/ 2 и 3 недели после нанесения растения риса были заражены N-3 нимфами в количестве 20 штук. Опыт проводили в теплице при 26 С 60% относительной влажности воздуха с продолжительностью освещения 16 ч. Через 5 дней оценивали количество погибших подвергнутых испытанию животных (% смертности)/ по сравнению с необработанными контрольными образцами. Результаты представлены ниже. Проведенные испытания показали/ что соединения по изобретению обладают более высокой фунгицидной активностью/ чем соединения-аналоги/ кроме того они обладают инсектицидным действием. При этом они малотоксичны и обладают хорошей совместимостью по отношению к растениям. С 60% относительной влажности воздуха с продолжительностью освещения 16 ч. Через 5 дней оценивали количество погибших подвергнутых испытанию животных (% смертности)/ по сравнению с необработанными контрольными образцами. Результаты представлены ниже. Проведенные испытания показали/ что соединения по изобретению обладают более высокой фунгицидной активностью/ чем соединения-аналоги/ кроме того они обладают инсектицидным действием. При этом они малотоксичны и обладают хорошей совместимостью по отношению к растениям.
Формула изобретенияСПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-АНИЛИНОПИРИМИДИНА общей формулы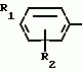 NH NH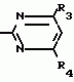 где R1 и R2 независимо друг от друга - водород, галоген, С1 - С3-алкил, С1 - С2-галогеналкил, С1 - С3-алкокси или С1 - С3-галогеналкокси; R3 - водород, С1 - С4-алкил, или замещенный галогеном или гидроксигруппой С1 - С4-алкил, циклопропил или замещенный метилом циклопропил; R4 - С3 - С6-циклоалкил или замещенный одинаково или различно от одного до трех раз метилом и/или галогеном С3 - С6-циклоалкил, отличающийся тем, что соль фенилгуанидина общей формулы где R1 и R2 независимо друг от друга - водород, галоген, С1 - С3-алкил, С1 - С2-галогеналкил, С1 - С3-алкокси или С1 - С3-галогеналкокси; R3 - водород, С1 - С4-алкил, или замещенный галогеном или гидроксигруппой С1 - С4-алкил, циклопропил или замещенный метилом циклопропил; R4 - С3 - С6-циклоалкил или замещенный одинаково или различно от одного до трех раз метилом и/или галогеном С3 - С6-циклоалкил, отличающийся тем, что соль фенилгуанидина общей формулы 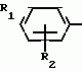 NH NH C C  A A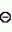 где где 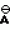 - анион минеральной кислоты, или гуанидин общей формулы - анион минеральной кислоты, или гуанидин общей формулы 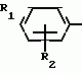 NH NH C C подвергают циклизации с дикетоном общей формулы R3- подвергают циклизации с дикетоном общей формулы R3-  - CH2- - CH2- 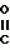 - R4 при необходимости в растворителе при 60 - 160oС с последующим выделением целевого продукта. - R4 при необходимости в растворителе при 60 - 160oС с последующим выделением целевого продукта.
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 28.09.1998 Номер и год публикации бюллетеня: 10-2001 Извещение опубликовано: 10.04.2001 Популярные патенты: 2121263 Способ лесоводственной оценки технологического комплекса машин ... объективности оценки проводят экспериментальную рубку леса в период, когда погодные условия не могут вызвать существенное изменение влажности почвы, характерной данным условиям произрастания (в сухих и свежих условиях влажности почв нельзя проводить рубки в период затяжных дождей). В качестве показателей оценки используют принятые в лесоводственной нормативной и инструктивной литературе, например показатели, характеризующие состояние почвенного покрова, - площадь технологических элементов, требуемая для выполнения лесосечных работ; повреждение почвенного покрова на технологических элементах и в пасеках; показатели, характеризующие состояние фитоценоза, - площадь участков с ... 2409937 Растение с высоким содержанием ребаудиозида а ... метанола для получения, по меньшей мере, 972 частей Ребаудиозида А к Стевиозиду с чистотой ... 2165137 Машина для уборки корней лекарственных растений ... признаками, идентичными всем существенным признакам заявленного изобретения. Предложенные ближайшие аналоги устройства позволили выявить совокупность существенных по отношению к усматриваемому заявителями техническому результату отличительных признаков в заявленном устройстве, изложенных в формуле изобретения. Следовательно, заявленное изобретение соответствует требованию "новизна" по действующему законодательству. Для проверки соответствия заявленного изобретения требованию изобретательского уровня заявители провели дополнительный поиск известных технических решений с целью выявления признаков, совпадающих с отличительными от ближайшего аналога признаками заявленного изобретения. ... 2060651 Бытовой инкубатор ... размещенных с шагом на рамочном каркасе, и соединенные с ним последовательно переменные резистор и параллельно термистор, размещенные снаружи корпуса, при этом оба подключены к низковольтному источнику питания. Система переворота яиц состоит из сетчатого подвижного поддона лотка, размещенного на рамочном каркасе, неподвижных поперечных упоров яиц, толкателей поддона, установленных в отверстиях, выполненных в поперечных стенках корпуса, и ограничителей перемещения поддона. Увлажнитель содержит кювету с водой, размещенную под днищем корпуса, испаритель с капиллярным подсосом воды из кюветы и установленный на дополнительный нагреватель, размещенный под нагревателем системы обогрева. ... 2093022 Устройство для выпаивания животных ... цилиндрами с поршнями; основной и дополнительный мерные цилиндры радиально закреплены на обойме; обойма установлена с возможностью вращения относительно неподвижной цапфы; в боковой поверхности обоймы выполнены отверстия, причем их число равно количеству мерных цилиндров; в неподвижной цапфе выполнены и отводящий каналы и поперечно расположенные им пазы; подводящий канал сообщен с питающим трубопроводом, а отводящий с выгрузным патрубком; приспособление для изменения доз включает неподвижный элемент и подвижный элемент; подвижный элемент выполнен в виде нижней части и вертикальных стержней, перемещающихся в направляющих; в виде полуокружностей равного диаметра; горизонтальные оси ... |
Еще из этого раздела: 2400069 Способ защиты материалов от микробного разрушения 2494593 Способ повышения селена в чесноке горной зоны 2399194 Способ и устройство контроля воздушного режима в корнеобитаемой среде 2462864 Устройство составления экономичного кормового рациона и экономичного кормления животных и птиц 2051971 Способ определения биологической активности -эндотоксинов различных патотипов bacileus thuringiensis 2192734 Устройство для производства прессованных кип из корней лекарственных растений 2150199 Способ закрепления элемента рыболовной снасти, выполненного с внутренней полостью, к леске 2438305 Способ выращивания цыплят-бройлеров 2076603 Способ повышения урожайности сельскохозяйственных культур 2091023 Способ защиты растений от заболеваний, вызванных нематодами |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||