Инсектицидная композицияПатент на изобретение №: 2009642 Автор: Такахиро Макабе[JP], Томоюки Огура[JP], Ясуо Кавамура[JP], Татсуо Нумата[JP], Киминори Хирата[JP], Масаки Кудо[JP], Тосиро Мияке[JP], Хироси Харуяма[JP] Патентообладатель: Ниссан Кемикал Индастриз Лтд. (JP) Дата публикации: 30 Марта, 1994 Изображения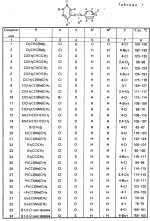  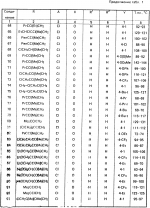 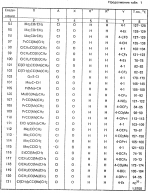 Использование: сельское хозяйство, химические средства защиты растений. Сущность изобретения: инсектицидная композиция содержит производное 3/2H/-пиридазинона ф-лы 1, приведенной в тексте описания, где R-C4-C5-алкенил, CH2C(CH3)2OCH, G-Ra G - водород или RbO, Rb-C1-C2 -алкил, Ra -галоген- C3-C8 -алкилен, дихлор- C3-C6 -алкилен, трихлор- C3-C4 -алкилен, хлор- C3-C4 -алкилен, 2-хлорциклогексил, 2-хлорциклооктил, 3-хлортетрагидропиранил-2, 2-хлортетрагидрофуранил, А-хлор, бром, метил, X-кислород, сера, J-CH2Q, CH-C6H4(Y), CH2CH2OC6H4-Y-4, 2-CH2-CH(CH3)OC5H4N, (CH3)C  CBr, Y -в 4 положении CBr, Y -в 4 положении 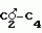 -алкил, трифторметил, C1-C3 -алкокси, трифторметокси, фенокси, галоген, нитро, циано, метилсульфинил, метилсульфонил, во 2 положении водород, трифторметил, одновременно в 3 и 4 положениях водород, хлор, метилендиокси, Y1 -водород, хлор, метил, Q-5-метилтиенил-2, 2(4)-бромтиенил-2, 5-йодтиенил-2, нафтил, C5H3NR3, R3 -галоген, этокси, изопропокси- 5 - 25 мас. % , целевые добавки - остальное. 4 табл.
Изобретение относится к химическим средствам борьбы с вредителями сельского хозяйства, а именно к инсектицидной композиции на основе производного 3(2Н)-пиридазинона. Известны инсектицидные композиции на основе производных 3(2Н)-пиридазинона общей формулы (I) -алкил, трифторметил, C1-C3 -алкокси, трифторметокси, фенокси, галоген, нитро, циано, метилсульфинил, метилсульфонил, во 2 положении водород, трифторметил, одновременно в 3 и 4 положениях водород, хлор, метилендиокси, Y1 -водород, хлор, метил, Q-5-метилтиенил-2, 2(4)-бромтиенил-2, 5-йодтиенил-2, нафтил, C5H3NR3, R3 -галоген, этокси, изопропокси- 5 - 25 мас. % , целевые добавки - остальное. 4 табл.
Изобретение относится к химическим средствам борьбы с вредителями сельского хозяйства, а именно к инсектицидной композиции на основе производного 3(2Н)-пиридазинона. Известны инсектицидные композиции на основе производных 3(2Н)-пиридазинона общей формулы (I) 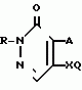  где R - С1-С6-алкил, А-С1-С6-алкил, галоген, Х - кислород, сера, Q-C(R1)(R2)(B) где R - С1-С6-алкил, А-С1-С6-алкил, галоген, Х - кислород, сера, Q-C(R1)(R2)(B) , m - 0,1, R1, R2 - водород, низкий алкил, галогеналкил, 4-трет-бутилфенил, У - имеет разные значения, и общей формулы (II) , m - 0,1, R1, R2 - водород, низкий алкил, галогеналкил, 4-трет-бутилфенил, У - имеет разные значения, и общей формулы (II) 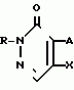  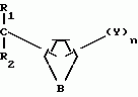  где R - C2-С6 - алкил, А-С1-С6 - алкил, галоген, Х - кислород, сера, R1, R2 - водород, С1-С6 - алкил, В-CH= СH, -N= CH, -N= N-, S, O, -NR3, R3 - водород, С1-С3 - алкил, Y - имеет разные значения. Однако они недостаточно эффективны. Целью изобретения является усиление инсектицидной активности. Указанная цель достигается за счет композиции, содержащей активный ингредиент - производное 3(2Н)-пиридазинона общей формулы где R - C2-С6 - алкил, А-С1-С6 - алкил, галоген, Х - кислород, сера, R1, R2 - водород, С1-С6 - алкил, В-CH= СH, -N= CH, -N= N-, S, O, -NR3, R3 - водород, С1-С3 - алкил, Y - имеет разные значения. Однако они недостаточно эффективны. Целью изобретения является усиление инсектицидной активности. Указанная цель достигается за счет композиции, содержащей активный ингредиент - производное 3(2Н)-пиридазинона общей формулы 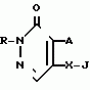 R-C4-C5 - алкенил, СH2C(СH3)2OCH3, G-Ra, в которой G - водород или RbO, Rb-C1-C2 - алкил, Ra - галогензамещенная алкиленовая группа, имеющая от 3 до 8 атомов углерода, дихлорзамещенная алкиленовая группа, имеющая от 3 до 6 атомов углерода, трихлорзамещенная алкиленовая группа, имеющая от 3 до 4 атомов углерода, хлорзамещенная алкениленовая группа, имеющая от 3 до 4 атомов углерода, 2-хлорциклогексил, 2-хлорциклооктил, 3-хлортетрагидропиранил-2, 2-хлортетрагидрофуранил, А - хлор, бром, метил, Х - кислород, сера J-CH2Q, CH R-C4-C5 - алкенил, СH2C(СH3)2OCH3, G-Ra, в которой G - водород или RbO, Rb-C1-C2 - алкил, Ra - галогензамещенная алкиленовая группа, имеющая от 3 до 8 атомов углерода, дихлорзамещенная алкиленовая группа, имеющая от 3 до 6 атомов углерода, трихлорзамещенная алкиленовая группа, имеющая от 3 до 4 атомов углерода, хлорзамещенная алкениленовая группа, имеющая от 3 до 4 атомов углерода, 2-хлорциклогексил, 2-хлорциклооктил, 3-хлортетрагидропиранил-2, 2-хлортетрагидрофуранил, А - хлор, бром, метил, Х - кислород, сера J-CH2Q, CH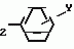 , CH2CH2O , CH2CH2O Y1, -CH2- Y1, -CH2-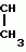 - O - O , (CH2)3C , (CH2)3C CBr , Y - в 4 положении С2-C4 - алкил, трифторметил, С1-С3 - алкокси, трифторметокси, фенокси, галоген, нитро, циано, метилсульфинил, метилсульфонил, во втором положении - водород, трифторметил, одновременно в 3 и 4 положениях - водород, хлор, метилендиокси. Y - водород, хлор, метил, Q-5 - метилтиенил-2, 2-бромтиенил-2, 5-йодтиенил-2, 4-бромтиенил-2, нафтил или CBr , Y - в 4 положении С2-C4 - алкил, трифторметил, С1-С3 - алкокси, трифторметокси, фенокси, галоген, нитро, циано, метилсульфинил, метилсульфонил, во втором положении - водород, трифторметил, одновременно в 3 и 4 положениях - водород, хлор, метилендиокси. Y - водород, хлор, метил, Q-5 - метилтиенил-2, 2-бромтиенил-2, 5-йодтиенил-2, 4-бромтиенил-2, нафтил или 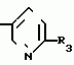 , R3 - галоген, этокси, изопропокси, и целевые добавки при следующем соотношении ингредиентов, мас. % : активный ингредиент 5-25 целевые добавки остальное Активные ингредиенты получают по следующим схемам: Cхема I Cпособ I-а , R3 - галоген, этокси, изопропокси, и целевые добавки при следующем соотношении ингредиентов, мас. % : активный ингредиент 5-25 целевые добавки остальное Активные ингредиенты получают по следующим схемам: Cхема I Cпособ I-а 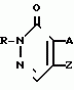      соединение изобретения (I) Cпособ I-б соединение изобретения (I) Cпособ I-б 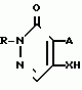  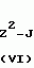  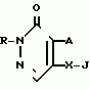 соединение изобретения (I) Cхема 2 Способ 2-а соединение изобретения (I) Cхема 2 Способ 2-а 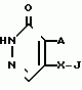    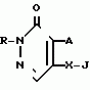 соединение изобретения (I) Cпособ 2-б соединение изобретения (I) Cпособ 2-б 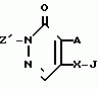    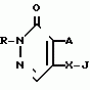 соединение изобретения (I) Cпособ 2-с соединение изобретения (I) Cпособ 2-с 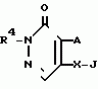  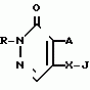  соединение изобретения (I) В приведенных выше схемах 1-2, А, Х, и J имеют указанные значения, а Z1 представляет собой атом галогена или азольную группу; Z2представляет собой атом галогена, алкилсульфонатную группу и арилсульфонатную группу; Z3 представляет собой атом галогена, R3 представляет собой соединения, содержащие двойную связь, а R4 представляет собой заместители, содержащие реакционноспособную функциональную группу. В реакциях, указанных в схемах 1-2, в качестве растворителя могут использоваться такие низшие спирты, как метанол и этанол; такие кетоны, как ацетон и метилэтилкетон, такие углеводороды, как бензол и толуол; такие эфиры, как изопропиловый эфир, тетрагидрофуран и 1,4-диоксан; такие амиды, как N, N-диметилформамид и триамид гексаметилфосфорной кислоты, такие галогенированные углеводороды, как дихлорметан и дихлорэтан. Если необходимо, то такие растворители могут использоваться в смеси друг с другом или в смеси с водой. В качестве основания могут использоваться такие неорганические основания, как гидрид натрия, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, бикарбонат натрия и такие органические основания, как метилат натрия, этилат натрия, триэтиламин, пиридин и т. п. Если необходимо, то в реакционную смесь в качестве катализатора можно добавлять такую соль четвертичного аммония, как хлористый триэтилбензиламмоний и т. п. Температура реакционной смеси может лежать в интервале от -20oC до температуры кипения используемого растворителя, предпочтительно в интервале от -5oC до температуры кипения используемого растворителя. Иногда, для конкретной реакции следует подбирать молярное соотношение исходных реагентов. Однако лучше всего использовать исходные вещества в эквимолярном или близком к нему соотношении. Если говорить более подробно, то в способе I-a cхемы (I) cоединение изобретения формулы (I) может быть получено по реакции заместителя ZI cоединения формулы (III) со спиртами или тиолами формулы (IV) в среде подходящего растворителя и в присутствии основания. Z1, предпочтительно, представляет собой атом галогена, особенно, атом хлора или брома, азолы, особенно, I-имидазол. В качестве растворителя предпочтительно использовать N, N-диметил- формамид, метанол, этанол, толуол, а также смесь толуол-вода. В качестве основания предпочтительно использовать неорганическое основание, особенно, карбонат натрия, карбонат калия, гидроксид натрия и гидроксид калия. Температура такой реакции предпочтительно лежит в интервале 20-50oC. В такой реакции образование целевого соединения может сопровождаться побочным образованием продуктов замещения спиртов или тиолов формулы (IV) в положение 4 пиридазинового кольца. В таком случае для очистки целевых соединений изобретения побочные продукты следует удалять из реакционной смеси, в таком случае необходимое разделение и очистку осуществляют путем традиционных методов, таких как перекристаллизация, колонная хроматография и т. п. Согласно способу I-б cоединения изобретения могут быть получены по реакции производных пиридазинона формулы (V) c алкилгалогенидами или алкилсульфонатами формулы (VI) в среде подходящего растворителя и в присутствии основания. Z2 предпочтительно, представляет собой атом хлора или брома. В качестве растворителя предпочтительно использовать N, N-диметилформамид, метанол, этанол, ацетонитрил, толуол, а также смесь толуола с водой. В качестве основания предпочтительно использовать неорганические основания, особенно, карбонат натрия, карбонат калия, гидроксид натрия и гидроксид калия. Температура реакции, предпочтительно, лежит в интервале 20-120oC, при условии: если ХП пиридазинонового производного формулы (V) представляет собой ОН, то температура, предпочтительно, лежит в интервале 20-120oC, а соли ХН представляет собой SН, то температура предпочтительно составляет 20-50oC. Согласно способу 2-а схемы (2), соединения изобретения могут быть получены путем алкилирования положения 2 пиридазиновых производных формулы (VII) c помощью R-Z2 формулы (VIII). Согласно такой методике соединения изобретения могут быть легко получены путем добавления неорганических или органических оснований в реакционную систему с целью повышения реакционной способности пиридазиноновых производных формулы (VII). Согласно способу 2-б cхемы (2) соединения изобретения формулы (I) могут быть получены путем добавления N-галоген пиридазинонов формулы (IХ) к олефину формулы (Х). соединение изобретения (I) В приведенных выше схемах 1-2, А, Х, и J имеют указанные значения, а Z1 представляет собой атом галогена или азольную группу; Z2представляет собой атом галогена, алкилсульфонатную группу и арилсульфонатную группу; Z3 представляет собой атом галогена, R3 представляет собой соединения, содержащие двойную связь, а R4 представляет собой заместители, содержащие реакционноспособную функциональную группу. В реакциях, указанных в схемах 1-2, в качестве растворителя могут использоваться такие низшие спирты, как метанол и этанол; такие кетоны, как ацетон и метилэтилкетон, такие углеводороды, как бензол и толуол; такие эфиры, как изопропиловый эфир, тетрагидрофуран и 1,4-диоксан; такие амиды, как N, N-диметилформамид и триамид гексаметилфосфорной кислоты, такие галогенированные углеводороды, как дихлорметан и дихлорэтан. Если необходимо, то такие растворители могут использоваться в смеси друг с другом или в смеси с водой. В качестве основания могут использоваться такие неорганические основания, как гидрид натрия, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, бикарбонат натрия и такие органические основания, как метилат натрия, этилат натрия, триэтиламин, пиридин и т. п. Если необходимо, то в реакционную смесь в качестве катализатора можно добавлять такую соль четвертичного аммония, как хлористый триэтилбензиламмоний и т. п. Температура реакционной смеси может лежать в интервале от -20oC до температуры кипения используемого растворителя, предпочтительно в интервале от -5oC до температуры кипения используемого растворителя. Иногда, для конкретной реакции следует подбирать молярное соотношение исходных реагентов. Однако лучше всего использовать исходные вещества в эквимолярном или близком к нему соотношении. Если говорить более подробно, то в способе I-a cхемы (I) cоединение изобретения формулы (I) может быть получено по реакции заместителя ZI cоединения формулы (III) со спиртами или тиолами формулы (IV) в среде подходящего растворителя и в присутствии основания. Z1, предпочтительно, представляет собой атом галогена, особенно, атом хлора или брома, азолы, особенно, I-имидазол. В качестве растворителя предпочтительно использовать N, N-диметил- формамид, метанол, этанол, толуол, а также смесь толуол-вода. В качестве основания предпочтительно использовать неорганическое основание, особенно, карбонат натрия, карбонат калия, гидроксид натрия и гидроксид калия. Температура такой реакции предпочтительно лежит в интервале 20-50oC. В такой реакции образование целевого соединения может сопровождаться побочным образованием продуктов замещения спиртов или тиолов формулы (IV) в положение 4 пиридазинового кольца. В таком случае для очистки целевых соединений изобретения побочные продукты следует удалять из реакционной смеси, в таком случае необходимое разделение и очистку осуществляют путем традиционных методов, таких как перекристаллизация, колонная хроматография и т. п. Согласно способу I-б cоединения изобретения могут быть получены по реакции производных пиридазинона формулы (V) c алкилгалогенидами или алкилсульфонатами формулы (VI) в среде подходящего растворителя и в присутствии основания. Z2 предпочтительно, представляет собой атом хлора или брома. В качестве растворителя предпочтительно использовать N, N-диметилформамид, метанол, этанол, ацетонитрил, толуол, а также смесь толуола с водой. В качестве основания предпочтительно использовать неорганические основания, особенно, карбонат натрия, карбонат калия, гидроксид натрия и гидроксид калия. Температура реакции, предпочтительно, лежит в интервале 20-120oC, при условии: если ХП пиридазинонового производного формулы (V) представляет собой ОН, то температура, предпочтительно, лежит в интервале 20-120oC, а соли ХН представляет собой SН, то температура предпочтительно составляет 20-50oC. Согласно способу 2-а схемы (2), соединения изобретения могут быть получены путем алкилирования положения 2 пиридазиновых производных формулы (VII) c помощью R-Z2 формулы (VIII). Согласно такой методике соединения изобретения могут быть легко получены путем добавления неорганических или органических оснований в реакционную систему с целью повышения реакционной способности пиридазиноновых производных формулы (VII). Согласно способу 2-б cхемы (2) соединения изобретения формулы (I) могут быть получены путем добавления N-галоген пиридазинонов формулы (IХ) к олефину формулы (Х). 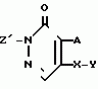       - -  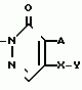 Способ 2-б представляет собой соответствующий процесс получения соединений изобретения формулы (I) со ссылкой на технологию, раскрытую в патенте Великобритании 999448. Z1 предпочтительно представляет собой атом галогена, особенно атом хлора или брома и вода. Согласно такому способу, соединения формулы (I) могут быть получены по реакции пиридазиноновых производных формулы (IХ) c эквимолярным или избыточным количеством (порядка 10-кратного молярного избытка) олефина формулы (Х) при температуре в интервале -5oC -120oC. Такая реакция может протекать достаточно гладко даже при разбавлении реакционной системы подходящим растворителем. В качестве растворителя предпочтительно использовать углеводороды, галогенированные углеводороды, кетоны, эфиры, низшие спирты, более предпочтительно использовать бензол, толуол, гексан, гептан, метилен, хлорид, хлороформ, четыреххлористый углеводород, метил, этил, кетон, метил, изобутил, кетон, изопропиловый эфир, 1,4-диоксан, метанол, этанол. В том случае, когда используют олефин формулы (Х) c низкой температурой кипения, хорошие результаты могут быть получены с использованием такого реактора для работы под давлением, как автоклав. Используемый в качестве исходных веществ N-галогенпиридазиноновые производные могут быть синтезированы в соответствии с методом, раскрытым в патенте ФРГ N 1122069 или по несколько усовершенствованному способу. Способ 2-c схемы (2) представляет собой метод получения соединений изобретения формулы (1) путем химической модификации функциональных групп в N-заместителе (R4) пиридазиноновых производных формулы (ХI) путем их превращения в целевой N-заместитель. Получение соединений изобретения подробно описано в следующих примерах. Препаративный пример 1. Синтез 5-(4-трет-бутилбензилтио)-4-хлор- 2[(2,2-дихлор-1,1-диметил)-этил] -3(2H)-пиридазинона. Соединение 2. В 10 мл метанола растворяют 0,73 г 4,5-дихлор-2-[(2,2-дихлор-1,1-диметил)-этил] -3(1Н)-пиридазинона и 0,45 г 4-трет-бутилбензил меркаптана. Полученный в результате раствор суспендируют в присутствии 0,27 г карбоната натрия и затем в течение 3 ч перемешивают при комнатной температуре. Раствор переливают в ледяную воду и отфильтровывают. Полученные таким образом кристаллы перекристаллизовывают из смеси бензол-гексан с образованием 0,8 г целевого соединения. Температура плавления (т. пл. ): 162-163oC. Препаративный пример 2. Синтез 4-бром-5-(4-хлорбензилокси) -2-[(2,3-дихлор-2-метил)-пропил] -3(-2-)-пирид- азинона. Соединение 10. В 10 мл N, N-диметилформамида растворяют 1,90 г 4,5-дибром-2-[(2,3-дихлор-2-метил)-пропил] -3(2)-пиридазинона и 0,71 г 4-хлорбензилового спирта. Полученный раствор суспендируют в 0,33 г порошкообразного гидрооксида калия. Реакционную смесь перемешивают в течение ночи при комнатной температуре. Полученный в результате раствор переливают в ледяную воду и экстрагируют бензолом. Экстракт промывают насыщенным рассолом и затем водой и растворитель удаляют дистилляцией при пониженном давлении. Полученное таким образом масло отделяют и очищают методом колонной хроматографии (на силикагеле проводя элюирование хлороформом) с образованием 1,10 г целевого соединения. Т. пл. 112-114oC. Препаративный пример 3. Синтез 1-(3 -бромпропил)-4-хлор-5-(4I-хлорбензилокси)-3(2)-пиридазинона. Соединение 15. К смешанному растворителю, состоящему из 150 мл воды и 150 мл этанола, добавляют 22,3 г 4,5-дихлор-2(3I-гидроксипопил)-3-(2Н)-пиридазинона (0,1 моль) и 19,6 г гидроксида калия (0,35 моль) и затем полученную смесь в течение 10 ч нагревают с обратным холодильником. После завершения реакции этанол удаляют при пониженном давлении и добавляют воду для фильтрации нерастворимого материала. Фильтрат подкисляют разбавленной хлористоводородной кислотой и полученные кристаллы отфильтровывают. Полученные в результате кристаллы промывают водой и сушат с образованием 14,5 г 4-хлор-5-гидрокси-2(3I-гидроксипропил)-3(2)-пиридазинона. К 150 мл N, N-диметилформамида добавляют 10,2 г 4-хлор-5-гидрокси-2(3I-гидрооксипропил)-3(2)-пиридазинона (0,05 моль), 8,4 г 4-хлорбензил хлорида (0,052 моль) и 10,4 г безводного карбоната калия (0,075 моль) и полученную систему нагревают в течение 3 ч при температуре 100-120oC. После завершения реакции смешанный раствор переливают в воду и экстрагируют этилацетатом. Полученный в результате раствор промывают водой и затем 5% -ным водным раствором гидроксида натрия и, наконец, насыщенным рассолом. Полученный раствор сушат над безводным сульфатом натрия и растворитель удаляют дистилляцией при пониженном давлении. Полученный таким образом твердый продукт промывают н-гексаноном и сушат с получением 12,3 г 4-хлор-5-(4-хлорбензилокси)-2-(3I-гидроксипропил)-3(2)-пиридазинона. К 170 мл хлороформа добавляют 9,9 г 4-хлор-5-(4I-хлорбензилокси)-2(3 -гидроксипропил)-3(2)-пиридазинона (0,03 моль) и медленно добавляют 9,4 г бромистого тионила (0,045 моль) при перемешивании в течение 2 ч при температуре -5 - +5oC. После завершения реакции полученный раствор понемногу разбавляют водой и хлороформный слой отделяют. Этот слой промывают водой и затем 5% -ным водным раствором бикарбоната натрия и после этого промывают насыщенным рассолом и сушат над безводным сульфатом натрия, а растворитель удаляют дистилляцией при пониженном давлении. Полученный таким образом твердый продукт перекристаллизовывают из смешанного растворителя н-гексан-бензол с получением 5,2 г 2-(3 -бромпропил)-4-хлор-5-(4 -хлорбензилокси)-3(2)-пиридазинона. Т. пл. 83-87oC. Препаративный пример 4. Cинтез 4-хлор-2-(2-хлор-2-метил)-пентил-5- (4-иодбензилокси)-3(2)-пиридазинона. (Соединение 26). Повторяют методику, описанную в примере 2, с использованием 1,42 г 4,5-дихлор-2 (2-хлор-2-метил)-пентил)-3(2)-пирид- азинона и 1,17 г 4-иодбензилового спирта с получением 1,72 г целевого соединения. Т. пл. 114-115оС. Препаративный пример 5. Синтез 4-хлор-2-(2-хлор-2-метилпентил)-5- (4-этилбензилокси)-3-(2Н)-пиридазинона (соединение 62). В 20 мл N, N-диметилформамида добавляют 1,2 г 2-(3-хлор-2-метилпентил)-4,5-дихлор-3(2Н)-пиридазинона и 0,64 г 4-этилбензилового спирта и к полученной смеси добавляют 0,31 г порошкообразного гидроксида калия и полученную смесь охлаждают льдом, перемешивают в течение дня при комнатной температуре. Затем повторяют методику примера 2 с получением 600 мг целевого соединения. Т. пл. 81-83oC. Препаративный пример 6. Синтез 4-хлор-2-(2-хлор-2-метилпентил)-5-I(4-трифторметилбензилокси)-3(2Н)- пиридазинона. (Соединение 41). В 20 мл N, N-диметилформамида растворяют 1,2 г 2-(2-хлори-2-метилпентил)-4,5-дихлор-3(2Н)-пиридазинона и 0,78 г 4-трифторметилбензилового спирта и к полученной смеси добавляют 1,46 г безводного карбоната калия. Полученный раствор перемешивают в течение 8 ч при 50oC. Затем повторяют методику примера 2 с получением 1,0 г целевого соединения. Т. пл. 105-106oC. Препаративный пример 7. Синтез 4-хлор-2-(2-хлор-2-метилпропил)-5- [(2-иод-5-пиридин)-метокси] -3(2Н)-пиридазинона и 4-хлор-5-[(2-иод-5- пиридил)-метокси] -2-[2-метил-1- пропенил)-3(2Н)-пиридазинона. (Соединение 150 и 166). В 10 мл N, N-диметилформамида растворяют 1,4 г 2-(2-хлор-2-метилпропил)-4,5-дихлор-3(2Н)-пиридазинона и 1,29 г 2-иод-5-пиридилметанола, в смесь добавляют 0,33 г порошкообразного гидроксида калия при охлаждении системы льдом. Полученный раствор перемешивают в течение дня при комнатной температуре. Затем повторяют методику примера 2 с получением 0,74 г 4-хлор-2-(2-хлор-2-метилпропил)-5- (2-иод-5-пиридил)-метокси)-3(2Н)-пиридази- нона (т. пл. 119-123oC) и 0,24 г 4-хлор-5-[(2-иод-5-пиридил)-метокси] -2-(2-метил-1-про- пинил)-3(2Н)-пиридазинона (т. пл. 141-142oC). Препаративный пример 8. Синтез 2-(2-хлор-3-метилпропил)-5-(4-иодбензилокси) -4-метил-3(2Н)-пиридазинона. (Соединение 115). В 5 мл N, N-диметилформамида растворяют 0,33 г 5-хлор-2-(хлор-2-метилпропил)-4-метил-3(2Н)-пиридазинона и 0,33 г 4-иодбензилового спирта, к смеси добавляют 0,1 г порошкообразного гидроксида калия при охлаждении системы льдом. Затем повторяют методику примера 2 с получением 0,3 г целевого соединения. Т. пл. 121-125oC. Препаративный пример 9. Синтез 4,5-дихлор-2-(3-хлортетрагидро-2-пиранил) -3(2Н)-пиридазинона. В 20 мл хлористого метилена растворяют 4 г 2,4,5-трихлор-3(2Н)-пиридазинона и по каплям добавляют 2,5 г 2,3-дигидропирана при охлаждении системы льдом. Полученный раствор перемешивают в течение 30 мин и отфильтровывают побочный продукт 4,5-дихлор-3(2Н)-пиридазинон. Фильтрат подвергают дистилляции при пониженном давлении. Полученное таким образом масло отделяют методом колонной хроматографии (на силикагеле, проводя элюирование бензолом) с образованием 1,5 г транс-формы в виде первой фракции (т. пл. 136-137oC) и 1,3 г цис-формы в виде второй фракции (т. пл. 109-110oC). 1Н-ЯМР (СDCl3). Способ 2-б представляет собой соответствующий процесс получения соединений изобретения формулы (I) со ссылкой на технологию, раскрытую в патенте Великобритании 999448. Z1 предпочтительно представляет собой атом галогена, особенно атом хлора или брома и вода. Согласно такому способу, соединения формулы (I) могут быть получены по реакции пиридазиноновых производных формулы (IХ) c эквимолярным или избыточным количеством (порядка 10-кратного молярного избытка) олефина формулы (Х) при температуре в интервале -5oC -120oC. Такая реакция может протекать достаточно гладко даже при разбавлении реакционной системы подходящим растворителем. В качестве растворителя предпочтительно использовать углеводороды, галогенированные углеводороды, кетоны, эфиры, низшие спирты, более предпочтительно использовать бензол, толуол, гексан, гептан, метилен, хлорид, хлороформ, четыреххлористый углеводород, метил, этил, кетон, метил, изобутил, кетон, изопропиловый эфир, 1,4-диоксан, метанол, этанол. В том случае, когда используют олефин формулы (Х) c низкой температурой кипения, хорошие результаты могут быть получены с использованием такого реактора для работы под давлением, как автоклав. Используемый в качестве исходных веществ N-галогенпиридазиноновые производные могут быть синтезированы в соответствии с методом, раскрытым в патенте ФРГ N 1122069 или по несколько усовершенствованному способу. Способ 2-c схемы (2) представляет собой метод получения соединений изобретения формулы (1) путем химической модификации функциональных групп в N-заместителе (R4) пиридазиноновых производных формулы (ХI) путем их превращения в целевой N-заместитель. Получение соединений изобретения подробно описано в следующих примерах. Препаративный пример 1. Синтез 5-(4-трет-бутилбензилтио)-4-хлор- 2[(2,2-дихлор-1,1-диметил)-этил] -3(2H)-пиридазинона. Соединение 2. В 10 мл метанола растворяют 0,73 г 4,5-дихлор-2-[(2,2-дихлор-1,1-диметил)-этил] -3(1Н)-пиридазинона и 0,45 г 4-трет-бутилбензил меркаптана. Полученный в результате раствор суспендируют в присутствии 0,27 г карбоната натрия и затем в течение 3 ч перемешивают при комнатной температуре. Раствор переливают в ледяную воду и отфильтровывают. Полученные таким образом кристаллы перекристаллизовывают из смеси бензол-гексан с образованием 0,8 г целевого соединения. Температура плавления (т. пл. ): 162-163oC. Препаративный пример 2. Синтез 4-бром-5-(4-хлорбензилокси) -2-[(2,3-дихлор-2-метил)-пропил] -3(-2-)-пирид- азинона. Соединение 10. В 10 мл N, N-диметилформамида растворяют 1,90 г 4,5-дибром-2-[(2,3-дихлор-2-метил)-пропил] -3(2)-пиридазинона и 0,71 г 4-хлорбензилового спирта. Полученный раствор суспендируют в 0,33 г порошкообразного гидрооксида калия. Реакционную смесь перемешивают в течение ночи при комнатной температуре. Полученный в результате раствор переливают в ледяную воду и экстрагируют бензолом. Экстракт промывают насыщенным рассолом и затем водой и растворитель удаляют дистилляцией при пониженном давлении. Полученное таким образом масло отделяют и очищают методом колонной хроматографии (на силикагеле проводя элюирование хлороформом) с образованием 1,10 г целевого соединения. Т. пл. 112-114oC. Препаративный пример 3. Синтез 1-(3 -бромпропил)-4-хлор-5-(4I-хлорбензилокси)-3(2)-пиридазинона. Соединение 15. К смешанному растворителю, состоящему из 150 мл воды и 150 мл этанола, добавляют 22,3 г 4,5-дихлор-2(3I-гидроксипопил)-3-(2Н)-пиридазинона (0,1 моль) и 19,6 г гидроксида калия (0,35 моль) и затем полученную смесь в течение 10 ч нагревают с обратным холодильником. После завершения реакции этанол удаляют при пониженном давлении и добавляют воду для фильтрации нерастворимого материала. Фильтрат подкисляют разбавленной хлористоводородной кислотой и полученные кристаллы отфильтровывают. Полученные в результате кристаллы промывают водой и сушат с образованием 14,5 г 4-хлор-5-гидрокси-2(3I-гидроксипропил)-3(2)-пиридазинона. К 150 мл N, N-диметилформамида добавляют 10,2 г 4-хлор-5-гидрокси-2(3I-гидрооксипропил)-3(2)-пиридазинона (0,05 моль), 8,4 г 4-хлорбензил хлорида (0,052 моль) и 10,4 г безводного карбоната калия (0,075 моль) и полученную систему нагревают в течение 3 ч при температуре 100-120oC. После завершения реакции смешанный раствор переливают в воду и экстрагируют этилацетатом. Полученный в результате раствор промывают водой и затем 5% -ным водным раствором гидроксида натрия и, наконец, насыщенным рассолом. Полученный раствор сушат над безводным сульфатом натрия и растворитель удаляют дистилляцией при пониженном давлении. Полученный таким образом твердый продукт промывают н-гексаноном и сушат с получением 12,3 г 4-хлор-5-(4-хлорбензилокси)-2-(3I-гидроксипропил)-3(2)-пиридазинона. К 170 мл хлороформа добавляют 9,9 г 4-хлор-5-(4I-хлорбензилокси)-2(3 -гидроксипропил)-3(2)-пиридазинона (0,03 моль) и медленно добавляют 9,4 г бромистого тионила (0,045 моль) при перемешивании в течение 2 ч при температуре -5 - +5oC. После завершения реакции полученный раствор понемногу разбавляют водой и хлороформный слой отделяют. Этот слой промывают водой и затем 5% -ным водным раствором бикарбоната натрия и после этого промывают насыщенным рассолом и сушат над безводным сульфатом натрия, а растворитель удаляют дистилляцией при пониженном давлении. Полученный таким образом твердый продукт перекристаллизовывают из смешанного растворителя н-гексан-бензол с получением 5,2 г 2-(3 -бромпропил)-4-хлор-5-(4 -хлорбензилокси)-3(2)-пиридазинона. Т. пл. 83-87oC. Препаративный пример 4. Cинтез 4-хлор-2-(2-хлор-2-метил)-пентил-5- (4-иодбензилокси)-3(2)-пиридазинона. (Соединение 26). Повторяют методику, описанную в примере 2, с использованием 1,42 г 4,5-дихлор-2 (2-хлор-2-метил)-пентил)-3(2)-пирид- азинона и 1,17 г 4-иодбензилового спирта с получением 1,72 г целевого соединения. Т. пл. 114-115оС. Препаративный пример 5. Синтез 4-хлор-2-(2-хлор-2-метилпентил)-5- (4-этилбензилокси)-3-(2Н)-пиридазинона (соединение 62). В 20 мл N, N-диметилформамида добавляют 1,2 г 2-(3-хлор-2-метилпентил)-4,5-дихлор-3(2Н)-пиридазинона и 0,64 г 4-этилбензилового спирта и к полученной смеси добавляют 0,31 г порошкообразного гидроксида калия и полученную смесь охлаждают льдом, перемешивают в течение дня при комнатной температуре. Затем повторяют методику примера 2 с получением 600 мг целевого соединения. Т. пл. 81-83oC. Препаративный пример 6. Синтез 4-хлор-2-(2-хлор-2-метилпентил)-5-I(4-трифторметилбензилокси)-3(2Н)- пиридазинона. (Соединение 41). В 20 мл N, N-диметилформамида растворяют 1,2 г 2-(2-хлори-2-метилпентил)-4,5-дихлор-3(2Н)-пиридазинона и 0,78 г 4-трифторметилбензилового спирта и к полученной смеси добавляют 1,46 г безводного карбоната калия. Полученный раствор перемешивают в течение 8 ч при 50oC. Затем повторяют методику примера 2 с получением 1,0 г целевого соединения. Т. пл. 105-106oC. Препаративный пример 7. Синтез 4-хлор-2-(2-хлор-2-метилпропил)-5- [(2-иод-5-пиридин)-метокси] -3(2Н)-пиридазинона и 4-хлор-5-[(2-иод-5- пиридил)-метокси] -2-[2-метил-1- пропенил)-3(2Н)-пиридазинона. (Соединение 150 и 166). В 10 мл N, N-диметилформамида растворяют 1,4 г 2-(2-хлор-2-метилпропил)-4,5-дихлор-3(2Н)-пиридазинона и 1,29 г 2-иод-5-пиридилметанола, в смесь добавляют 0,33 г порошкообразного гидроксида калия при охлаждении системы льдом. Полученный раствор перемешивают в течение дня при комнатной температуре. Затем повторяют методику примера 2 с получением 0,74 г 4-хлор-2-(2-хлор-2-метилпропил)-5- (2-иод-5-пиридил)-метокси)-3(2Н)-пиридази- нона (т. пл. 119-123oC) и 0,24 г 4-хлор-5-[(2-иод-5-пиридил)-метокси] -2-(2-метил-1-про- пинил)-3(2Н)-пиридазинона (т. пл. 141-142oC). Препаративный пример 8. Синтез 2-(2-хлор-3-метилпропил)-5-(4-иодбензилокси) -4-метил-3(2Н)-пиридазинона. (Соединение 115). В 5 мл N, N-диметилформамида растворяют 0,33 г 5-хлор-2-(хлор-2-метилпропил)-4-метил-3(2Н)-пиридазинона и 0,33 г 4-иодбензилового спирта, к смеси добавляют 0,1 г порошкообразного гидроксида калия при охлаждении системы льдом. Затем повторяют методику примера 2 с получением 0,3 г целевого соединения. Т. пл. 121-125oC. Препаративный пример 9. Синтез 4,5-дихлор-2-(3-хлортетрагидро-2-пиранил) -3(2Н)-пиридазинона. В 20 мл хлористого метилена растворяют 4 г 2,4,5-трихлор-3(2Н)-пиридазинона и по каплям добавляют 2,5 г 2,3-дигидропирана при охлаждении системы льдом. Полученный раствор перемешивают в течение 30 мин и отфильтровывают побочный продукт 4,5-дихлор-3(2Н)-пиридазинон. Фильтрат подвергают дистилляции при пониженном давлении. Полученное таким образом масло отделяют методом колонной хроматографии (на силикагеле, проводя элюирование бензолом) с образованием 1,5 г транс-формы в виде первой фракции (т. пл. 136-137oC) и 1,3 г цис-формы в виде второй фракции (т. пл. 109-110oC). 1Н-ЯМР (СDCl3).  , ТМС): транс-форма: 1,50-2,20 (мультиплет 4Н), 3,50-4,60 (мультиплет, 3Н), 5,86 (дублет, 1Н, 10 гц), 7,77 (синглет, 1Н), циф-форма: 1,90-2,50 (мультиплет, 4Н), 3,50-4,60 (мультиплет, 3Н), 6,05 (дублет, 1Н, 3 гц), 7,83 (синглет, 1Н). Препаративный пример 10. Синтез 4,5-дихлор-2-(2,3-дихлор-2-пропенил)-3(2Н)-пиридазинона. К смеси 10,8 г 4,5-дихлор-3(2Н)-пиридазинона и 9,5 г безводного карбоната калия добавляют 65 мл N, N-диметилформамида и полученную смесь перемешивают в течение 10 мин при комнатной температуре. Затем добавляют 10,0 г 1,2,3-трихлор-1-пропена (смесь Е-формы и Z-формы), полученный раствор перемешивают в течение 6 ч при 40oC. Этот раствор переливают в большое количество воды и смесь экстрагируют бензолом, растворитель удаляют дистилляцией при пониженном давлении с получением 6,0 г целевого соединения (смесь Е-формы и Z-формы). Полученное таким образом соединение разделяют на изомеры (т. пл. 93,7-94,6oC и 112,8-114,8oC) методом колонной хроматографии (на силикагеле, проводя элюирование бензолом). 1Н-ЯМР (CDCl3, , ТМС): транс-форма: 1,50-2,20 (мультиплет 4Н), 3,50-4,60 (мультиплет, 3Н), 5,86 (дублет, 1Н, 10 гц), 7,77 (синглет, 1Н), циф-форма: 1,90-2,50 (мультиплет, 4Н), 3,50-4,60 (мультиплет, 3Н), 6,05 (дублет, 1Н, 3 гц), 7,83 (синглет, 1Н). Препаративный пример 10. Синтез 4,5-дихлор-2-(2,3-дихлор-2-пропенил)-3(2Н)-пиридазинона. К смеси 10,8 г 4,5-дихлор-3(2Н)-пиридазинона и 9,5 г безводного карбоната калия добавляют 65 мл N, N-диметилформамида и полученную смесь перемешивают в течение 10 мин при комнатной температуре. Затем добавляют 10,0 г 1,2,3-трихлор-1-пропена (смесь Е-формы и Z-формы), полученный раствор перемешивают в течение 6 ч при 40oC. Этот раствор переливают в большое количество воды и смесь экстрагируют бензолом, растворитель удаляют дистилляцией при пониженном давлении с получением 6,0 г целевого соединения (смесь Е-формы и Z-формы). Полученное таким образом соединение разделяют на изомеры (т. пл. 93,7-94,6oC и 112,8-114,8oC) методом колонной хроматографии (на силикагеле, проводя элюирование бензолом). 1Н-ЯМР (CDCl3, 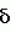 , ТМС): Изометр I: (т. пл. 93,7-94,6oC): 5,15 (синглет, 2Н), 6,47 (синглет, 1Н, 7,84 (синглет, 1Н). Изомер 2: (т. пл. 112,8-114,8oC) 5,00 (синглет, 2Н), 6,70 (синглет 1Н), 7,84 (синглет, 1Н). Препаративный пример 11. Синтез 4,5-дихлор-2-(2-метил-2-пропенил)-3(2Н)-пиридазинона. В 50 мл N, N-диметилформамиде суспендируют 10 г 4,5-дихлор-3(2Н)-пиридазинона, 27 г 3-хлор-2-метилпропена и 8,4 г карбоната калия. Полученный раствор перемешивают в течение 5 ч при 40oC. Затем повторяют методику примера 2 с получением 4,9 г целевого соединения. Т. пл. 52-54oC. Препаративный пример 12. Синтез 2-(2-хлор-2-метилпропил)-4,5-дихлор-3(2Н)-пиридазинона. В 100 мл четыреххлористого углерода растворяют 4 г 4,5-дихлор-2(2-метил-2-пропенил-3(2Н)-пиридазинона и 0,1 г хлористого трифторметил аммония, в полученную систему добавляют 30 мл концентрированной хлористоводородной кислоты. Полученный раствор перемешивают и промывают водой, сушат над безводным сульфатом натрия и удаляют растворитель путем дистилляции при пониженном давлении с получением 4,7 г целевого соединения, Т. пл. 61-66oC. Физические свойства соединений, полученных согласно любому из примеров 1-8, представлены в табл. 1-3. В таблицах приняты следующие сокращения: Me - метил, Et - этил, Pr - пропил, Bu - бутил, Pеn - пентил, Heх - гексил, Ph - незамещенный фенил, t - третичный, S - вторичный, i - изо. Q1-Q8 в табл. 1-3 представляют собой группы, отвечающие следующим структурным формулам: Q2 , ТМС): Изометр I: (т. пл. 93,7-94,6oC): 5,15 (синглет, 2Н), 6,47 (синглет, 1Н, 7,84 (синглет, 1Н). Изомер 2: (т. пл. 112,8-114,8oC) 5,00 (синглет, 2Н), 6,70 (синглет 1Н), 7,84 (синглет, 1Н). Препаративный пример 11. Синтез 4,5-дихлор-2-(2-метил-2-пропенил)-3(2Н)-пиридазинона. В 50 мл N, N-диметилформамиде суспендируют 10 г 4,5-дихлор-3(2Н)-пиридазинона, 27 г 3-хлор-2-метилпропена и 8,4 г карбоната калия. Полученный раствор перемешивают в течение 5 ч при 40oC. Затем повторяют методику примера 2 с получением 4,9 г целевого соединения. Т. пл. 52-54oC. Препаративный пример 12. Синтез 2-(2-хлор-2-метилпропил)-4,5-дихлор-3(2Н)-пиридазинона. В 100 мл четыреххлористого углерода растворяют 4 г 4,5-дихлор-2(2-метил-2-пропенил-3(2Н)-пиридазинона и 0,1 г хлористого трифторметил аммония, в полученную систему добавляют 30 мл концентрированной хлористоводородной кислоты. Полученный раствор перемешивают и промывают водой, сушат над безводным сульфатом натрия и удаляют растворитель путем дистилляции при пониженном давлении с получением 4,7 г целевого соединения, Т. пл. 61-66oC. Физические свойства соединений, полученных согласно любому из примеров 1-8, представлены в табл. 1-3. В таблицах приняты следующие сокращения: Me - метил, Et - этил, Pr - пропил, Bu - бутил, Pеn - пентил, Heх - гексил, Ph - незамещенный фенил, t - третичный, S - вторичный, i - изо. Q1-Q8 в табл. 1-3 представляют собой группы, отвечающие следующим структурным формулам: Q2 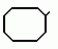 Q1 Q1 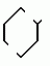 Q3 Q3 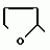 Q4 Q4  Q5 Q5  Q6 Q6 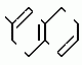 Q7 Q7 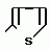   Примеры получения композиций. Рецептурный пример 1: Эмульгируемый концентрат, ч. : Соединение изобретения 5 Ксилол 70 N, N-диметилформамид 20 Солпол 2680 (смесь не- ионного поверхностно-ак- тивного агента и анионного поверхностного активного агента, выпускаемого Того Кэмикал Ко, ЛТД, Япония) 5 Рецептурный пример 2: Эмульгируемый концентрат Соединение изобретения 10 Ксилол 70 N, N-диметилформамид 5 Солпол 2680 10 Пиперонил бутилат 5 Рецептурный пример 3: Эмульгируемый концентрат Соединение изобретения 20 Ксилол 50 N, N-диметилформамид 7 Солпол 2680 3 Пиперонил бутилат 20 Рецептурный пример 4: Эмульгируемый концентрат Соединение изобретения 25 Ксилол 50 N, N-диметилформамид 2 Солпол 2680 20 Пиперонил бутилат 3 В соответствующих приведенных эмульгируемых концентратах каждый компонент такого эмульгируемого концентрата подвергают тщательному перемешиванию целью получения соответствующего концентрата. В ходе использования эмульгируемые концентраты разбавляют водой до соотношения 1: 15000-1: 20000 и применяют с нормой 0,005-50 кг активного ингредиента на гектар. Рецептурный пример 5: Смачиваемые порошки, ч. : Соединение изобретения: 5 Зиклит РFP/торговое наименование смесь као- лина и серицита, выпус- каемая Зиклит Майнинг Индестриз, Ко, Лтд. 85 Солпол 5039 (торговое наименование, анионный поверхностно-активный агент, выпускаемый Того Кэмикал, Ко, Лтд, Япония) 6 Карплекс 80 (торговое наименование, белая сажа, выпускаемая Шио- ноги Сейиаку, К. К. Япония) 4 Рецептурный пример 6: Смачиваемые порошки: Соединение изобретения 10 Зиклит РFP 80 Cолпол 5039 6 Карплекс 80 4 Рецептурный пример 7: Смачиваемые порошки: Соединение изобретения 25 Зиклит РFP 66 Солпол 5039 (анионный поверхностно-активный агент, выпускаемый Того Кемикал Ко, ЛТД, Япония) 4 Карплекс 80 2 Лигнин сульфонат кальция 3 В приведенных смачиваемых порошках каждый компонент рецептуры тщательно размешивали и измельчали с образованием соответствующего смачиваемого порошка. Перед использованием смачиваемые порошки разбавляли водой до концентраций порядка 1: 15000-1: 20000 и применяли с нормой расхода 0,005-50 кг активного ингредиента на гектар. Рецептурный пример 8: Дусты, ч. : Cоединение изобретения 10 Карплекс 80 0,2 Глина 89 Диизопропил фосфат 0,8 Рецептурный пример 9: Дусты, ч. : Cоединение изобретения 30 Карплекс 80 1 Глина 67 Диизопропил фосфат 2 Рецептурный пример 10: Гранулы (1), ч. : Соединение изобретения 5 Бентонит 54 Тальк 40 Лигнин сульфонат кальция Рецептурный пример 11. Гранулы (1), ч. : Соединение изобретения 30 Бентонит 37 Тальк 30 Лигнин сульфонат кальция 3 Все компоненты указанных рецептур тщательно смешивали друг с другом и измельчали, вводили небольшое количество воды и проводили смешивание с перемешиванием. Полученную в результате смесь гранулировали с помощью экструзионного гранулятора и сушили с образованием гранул. В ходе использования такие гранулы применяли с нормой расхода 0,005-50 кг активного ингредиента на гектар. Рецептурный пример 12: Cпособные к истечению рецептуры, ч. : Соединение изобретения 15 Солпол 3353 15 Люнокс 1000 С 5 Вода 65 Ниже приведены испытательные примеры, в которых подробно описано действие соединений изобретения в качестве инсектицидов. Испытательный пример 1: Инсектицидное испытание на цикадке зеленой рисовой (Nephotellix cincticeps). 50% Эмульгируемый концентрат (или 25% смачиваемый порошок) соединения изобретения разбавляют водой, содержащей распределитель с получением раствора с концентрацией соединения изобретения 500 ч/мин. На стеблях и листве рисового растения, находящегося в горшочке площадью 1/20000 ара достаточно обильно применяют полученный в результате раствор и затем растение сушат на воздухе. Через 20 с после этого в чашу выпускали 20 находящихся во второй возрастной стадии нимф цикадки зеленой рисовой (Nephotelliх cincticeps), которая обладала устойчивостью к воздействию фосфорорганических инсектицидов и карбаматных инсектицидов. Обработанное таким образом рисовое растение покрывают цилиндрической проволочной сеткой и помещают в термостатированную камеру. Через 30 дней подсчитывают число цикадок, паразитирующих на рисовом растении, и определяют смертность в соответствии со следующим уравнением: Смертность (% ) = Примеры получения композиций. Рецептурный пример 1: Эмульгируемый концентрат, ч. : Соединение изобретения 5 Ксилол 70 N, N-диметилформамид 20 Солпол 2680 (смесь не- ионного поверхностно-ак- тивного агента и анионного поверхностного активного агента, выпускаемого Того Кэмикал Ко, ЛТД, Япония) 5 Рецептурный пример 2: Эмульгируемый концентрат Соединение изобретения 10 Ксилол 70 N, N-диметилформамид 5 Солпол 2680 10 Пиперонил бутилат 5 Рецептурный пример 3: Эмульгируемый концентрат Соединение изобретения 20 Ксилол 50 N, N-диметилформамид 7 Солпол 2680 3 Пиперонил бутилат 20 Рецептурный пример 4: Эмульгируемый концентрат Соединение изобретения 25 Ксилол 50 N, N-диметилформамид 2 Солпол 2680 20 Пиперонил бутилат 3 В соответствующих приведенных эмульгируемых концентратах каждый компонент такого эмульгируемого концентрата подвергают тщательному перемешиванию целью получения соответствующего концентрата. В ходе использования эмульгируемые концентраты разбавляют водой до соотношения 1: 15000-1: 20000 и применяют с нормой 0,005-50 кг активного ингредиента на гектар. Рецептурный пример 5: Смачиваемые порошки, ч. : Соединение изобретения: 5 Зиклит РFP/торговое наименование смесь као- лина и серицита, выпус- каемая Зиклит Майнинг Индестриз, Ко, Лтд. 85 Солпол 5039 (торговое наименование, анионный поверхностно-активный агент, выпускаемый Того Кэмикал, Ко, Лтд, Япония) 6 Карплекс 80 (торговое наименование, белая сажа, выпускаемая Шио- ноги Сейиаку, К. К. Япония) 4 Рецептурный пример 6: Смачиваемые порошки: Соединение изобретения 10 Зиклит РFP 80 Cолпол 5039 6 Карплекс 80 4 Рецептурный пример 7: Смачиваемые порошки: Соединение изобретения 25 Зиклит РFP 66 Солпол 5039 (анионный поверхностно-активный агент, выпускаемый Того Кемикал Ко, ЛТД, Япония) 4 Карплекс 80 2 Лигнин сульфонат кальция 3 В приведенных смачиваемых порошках каждый компонент рецептуры тщательно размешивали и измельчали с образованием соответствующего смачиваемого порошка. Перед использованием смачиваемые порошки разбавляли водой до концентраций порядка 1: 15000-1: 20000 и применяли с нормой расхода 0,005-50 кг активного ингредиента на гектар. Рецептурный пример 8: Дусты, ч. : Cоединение изобретения 10 Карплекс 80 0,2 Глина 89 Диизопропил фосфат 0,8 Рецептурный пример 9: Дусты, ч. : Cоединение изобретения 30 Карплекс 80 1 Глина 67 Диизопропил фосфат 2 Рецептурный пример 10: Гранулы (1), ч. : Соединение изобретения 5 Бентонит 54 Тальк 40 Лигнин сульфонат кальция Рецептурный пример 11. Гранулы (1), ч. : Соединение изобретения 30 Бентонит 37 Тальк 30 Лигнин сульфонат кальция 3 Все компоненты указанных рецептур тщательно смешивали друг с другом и измельчали, вводили небольшое количество воды и проводили смешивание с перемешиванием. Полученную в результате смесь гранулировали с помощью экструзионного гранулятора и сушили с образованием гранул. В ходе использования такие гранулы применяли с нормой расхода 0,005-50 кг активного ингредиента на гектар. Рецептурный пример 12: Cпособные к истечению рецептуры, ч. : Соединение изобретения 15 Солпол 3353 15 Люнокс 1000 С 5 Вода 65 Ниже приведены испытательные примеры, в которых подробно описано действие соединений изобретения в качестве инсектицидов. Испытательный пример 1: Инсектицидное испытание на цикадке зеленой рисовой (Nephotellix cincticeps). 50% Эмульгируемый концентрат (или 25% смачиваемый порошок) соединения изобретения разбавляют водой, содержащей распределитель с получением раствора с концентрацией соединения изобретения 500 ч/мин. На стеблях и листве рисового растения, находящегося в горшочке площадью 1/20000 ара достаточно обильно применяют полученный в результате раствор и затем растение сушат на воздухе. Через 20 с после этого в чашу выпускали 20 находящихся во второй возрастной стадии нимф цикадки зеленой рисовой (Nephotelliх cincticeps), которая обладала устойчивостью к воздействию фосфорорганических инсектицидов и карбаматных инсектицидов. Обработанное таким образом рисовое растение покрывают цилиндрической проволочной сеткой и помещают в термостатированную камеру. Через 30 дней подсчитывают число цикадок, паразитирующих на рисовом растении, и определяют смертность в соответствии со следующим уравнением: Смертность (% ) = 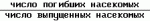 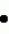 100 Для каждого соединения такое испытание проводят дважды. Было установлено, что наивысшие эффекты порядка 100% смертности дают следующие соединения: Cоединения NN 7,8,10,12, 13,15,20 , 21,22,23, 25,26,31,32,33,35,36,37,38,52-55,57,58,62,64,68,73,80,81,83-94, 96,98,100-103, 104,105,122-125,127-130, 131, 132, 136, 137, 139, 141-144, 147, 149-153, 157, 158, 160, 163, 164, 189, 192, 193, 195. Испытательный пример 2. Инсектицидное испытание против коричневой рисовой цикадки (Nilaparvata lugens) 5% , 10% , 25% эмульгируемый концентрат разбавляют водой с получением 500 ppm раствора. Повторяют методику, описанную в испытательном примере 1, используя нимфы второй возрастной стажии цикадки коричневой рисовой (Nilaparvata lugens) вместо нимф второй возрастной стадии цикадки зеленой рисовой, которые также обладают устойчивостью к действию фосфорорганических инсектицидов и карбаматных инсектицидов. Было установлено, что высокие эффекты со смертностью порядка 100% дают следующие соединения: NN 9,21,27,34,69,122-126,128-130,131, 132,134,133,137,141,142,143,144,147,149-153,156-160,162,164,165-168,170, 174,175,176,180,182. Аналогичные данные получают при использовании 5% , 10% , 25% смачиваемого порошка. Испытательный пример 3. Инсектицидное испытание против хрущака каштанового Тribolium castaneum. В прозрачную небольшую испытательную трубку помещали 5% эмульгируемый концентрат соединения изобретения (или 10% , 25% смачиваемый порошок, либо 20% масляный раствор) и добавляли ацетон с получением ацетонового раствора с концентрацией соединения изобретения 500 ч/млн. 10 см3 такого ацетонового раствора добавляли к 10 г пшеничной муки, помещенной в лабораторную чашу диаметром 9 см. После перемешивания ацетон удаляют из смеси дистилляцией. После этого в чаши впускают по 10 взрослых особей самцов и самок хрущака каштанового (Тribolium castaneum). Затем эти чаши с взрослыми особями насекомых помещают в камеру термостата. Через 90 дней проводят оценку путем подсчета числа жизнеспособных взрослых особей. Испытание с каждым соединением проводят дважды. В результате было установлено, что в чашах, обработанных следующими ниже соединениями, не наблюдалось вылупливания взрослых особей насекомых. NN 7, 8, 10, 12, 15, 20, 21, 25, 26, 32, 47, 48, 52-58, 61-64, 68, 69-71, 73, 76-103, 104, 105, 107-109, 111, 112, 116, 117, 121, 122, 123, 124, 125, 127-130, 131, 132, 139-145, 147-164, 166, 168, 174, 175, 177, 180. Аналогичные данные получают для 10% , 25% эмульгируемого концентрата 5% и 25% смачиваемого порошка. Испытательный пример 4. Инсектицидное испытание против домашних комаров (Culeх pipicus pallens) 5% Эмульгируемый концентрат, 10% , 25% эмульгируемый концентрат, 5% и 10% , 25% смачиваемый порошок или 20% масляный раствор соединения изобретения разбавляют деионизированной водой до получения раствора с концентрацией испытуемого соединения 10 ч/мин. 200 мл такого раствора выливают в высокую лабораторную чашу диаметром 9 см и высотой 6 см. В чаши помещали по десять личинок домашних комаров (Culeх pipicus paleens). Саши с комарами помещают в камеру теpмостата при температуре 25oC. Через семь дней подсчитывают число погибших личинок. Испытание на каждом соединении дублируют. Ни в одной из чаш обработанных следующими ниже соединениями не наблюдают вылупливания взрослых особей. NN 1-5,6,7,8,10,11,12,13-15,20,21, 22,23,24,25,26-28, 31,32,33,35,37,38,47,48-50,52-67,68-81,83-96,98-103,104,105,106,108, 111,112,116,117,121,122-130,131, 132,134, 135-137,138-147,149-155, 157-159,163,164,168,175,177,181. Испытательный пример 5: Инсектицидное испытание против моли миндальной (Саdra cantella). В прозрачную небольшую испытательную пробирку помещают 5% эмульгируемый концентрат соединения изобретения (10% , 25% эмульгируемый концентрат, 5% , 10% или 25% смачиваемый порошок, либо 20% масляный раствор такого соединения) и в пробирку добавляют ацетон в таком количестве, чтобы получить ацетоновый раствор с концентрацией испытуемого соединения 500 ч/млн. 10 см3 такого ацетонового раствора добавляют к 10 г рисовых отрубей, помещенных в лабораторную чашу диаметром 9 см. После перемешивания ацетона, удаляют из чаши дистилляцией. Затем в чашу помещают десять личинок моли миндалевой (Cadra cantella). Чаши с личинками помещают в камеру термостата. Через 3o дней производят оценку путем подсчета числа появившихся взрослых особей. Испытание с каждым соединением дублируют. Было установлено, что в чашах, обработаннах следующими соединениями, не наблюдают вылупившихся взрослых особей. NN 7-10, 12,15,20,21,22,23,25-27,31,32,37,38,47,48,50-58; 61,64,66,67,68-71,73,74,76-96,100-103,104,105,108, 110-112, 114-117,119-121,122-125,127-130, 131,132,133,134,135-137,138-160, 162-164,167-177,178,179,180,182,188,189,190. Испытательный пример 6: Инсектицидное испытание против тли персиковой зеленой (Myzus persicae). 5% Эмульгируемый концентрат (или 25% смачиваемый порошок) соединения изобретения разбавляли водой, содержащей распределитель таким образом, чтобы получить раствор с концентрацией испытуемого соединения 500 ч/млн. На увлажненную бумагу, находящуюся в лабораторной чаши диаметром 3 см, помещали дольки листьев капусты (Brassiсa oleracea). В каждую лабораторную чашу выпускали по 5 нимф в третьей возрастной стадии тли персиковой зеленой (Myzus persicae) после чего их опрыскивали с помощью опрыскивателя. Лабораторные чаши помещали в камеру термостата. Через 7 дней подсчитывали число выживших особей тли персиковой зеленой, их смертность определяли в соответствии с уравнением, приведенным в испытательном примере 1. Испытание для каждого из соединений проводили по четыре раза. Следующие соединения обеспечивают 100% смертность насекомых: NN7,8,10,12,21,22,23,25-27,29-32, 39-41,42,43,44,45,46, 52,53,61,62,64,69,71-73,76-81,83,84,86,87,91,92,94-96,99-101, 105,106,108-109,111-113,115-118,121,122-125,128-130,131,132,134, 141,144,147,157-160,163,164,166,168,170-173,175-177,178,179, 180,181-183,184-186,187,188,189,190-192. Испытательный пример 7: Инсектицидное испытание против совки капустной (Plutella xylostella). 5% Эмульгируемый концентрат (или 25% смачиваемый порошок) соединения изобретения разбавляли водой, содержащей распределитель с получением раствора, содержащего 500 ч/млн испытуемого соединения. В такой раствор погружали листья капусты (Brassica oleracea) cушили их на воздухе и затем помещали в лабораторную чашу диаметром 7 см. 10 личинок в третьей возрастной стадии совки капустной (Plutella xylostella) выпускали в каждую лабораторную чашу и помещали ее в камеру термостата. Через 20 дней подсчитывали число вылупившихся взрослых особей и их смертность определяли в соответствии с уравнением, приведенным в испытательном примере 1. Испытание на каждом из соединений повторяли. Следующие соединения обеспечивают 100% смертность насекомых: NN 7-10,12,13,15,20,21,22,23,25-27,31,32,57,58,62,80,81,94,95, 100,101,103,104,105,122-125,127,128,131,132,133,134,143,144,147, 149,150,156-160,162-164,166-168,174-176,180. Испытательный пример 8. Инсектицидное испытание против долгоносика массового (Sitophilus oryzae). 5% Эмульгируемый концентрат (или 25% смачиваемый порошок) соединения изобретения разбавляли водой, содержащей распределитель таким образом, чтобы получить раствор с концентрацией испытуемого соединения 500 ч/млн. 10 г немолотого риса в лабораторной чаше смачивали полученным раствором и сушили на воздухе и затем в чашу выпускали по 10 взрослых особей самцов и самок долгоносика массового. После этого чаши помещали в камеру термостата. Через 90 дней производили оценку, подсчитывая число вылупившихся взрослых особей. Испытание с каждым из соединений проводили дважды. В чашах, обработанных соединениями, перечисленными ниже, не наблюдалось вылупившихся взрослых особей. NN 20,26,45,62,76,80,82,85,91,92,94-96,104,108,112,113,116,124,126-128, 131,132,141,144,150,152,153,156-160,162,168,175,177. Испытательный пример 9. Инсектицидное испытание против рыжих тараканов (Blatella germanica). В прозрачную небольшую испытательную пробирку взвешивали и помещали 5% эмульгируемый концентрат соединения изобретения (либо его 25% смачиваемый порошок или 20% масляный раствор) и добавляли ацетон в таком количестве, чтобы получить ацетоновый раствор испытуемого соединения с концентрацией последнего 500 ч/млн. 10 см3 ацетонового раствора додавляли к 10 г порошкового корма для мелких животных, помещенного в лабораторную чашу диаметром 9 см. После перемешивания ацетон удаляли из смеси дистилляцией. Эти лабораторные чаши помещали в большие чаши диаметром 20 см для приготовления приманки. В такие большие чаши выпускали по 10 нимф в пятой возрастной стадии рыжих тараканов (Blatella germanida). Затем эти чаши помещали в камеру термостата. В эти большие чаши помещали лабораторные чаши с увлажненной медицинской ватой для обеспечения нимф питьем. Через 60 дней производили оценку путем подсчета числа вылупившихся взрослых особей. Испытание с каждым соединением проводили дважды. В чашах, обработанных указанными ниже соединениями, не наблюдалось появления взрослых особей. NN 122-125, 127,128, 131,132,143, 149,150,152, 156-160,163,164,168,176,177. Cравнительные испытания осуществляют с использованием предлагаемых соединений и известных соединений по патентам ЕP 199281 и ЕP 183212. Методики испытаний аналогичные испытательным примерам 2-5. Результаты испытаний приведены в табл. 4. Соединения испытывались в виде 5% -ного эмульгируемого концентрата. Сравнительное соединение I (CH3)3C- 100 Для каждого соединения такое испытание проводят дважды. Было установлено, что наивысшие эффекты порядка 100% смертности дают следующие соединения: Cоединения NN 7,8,10,12, 13,15,20 , 21,22,23, 25,26,31,32,33,35,36,37,38,52-55,57,58,62,64,68,73,80,81,83-94, 96,98,100-103, 104,105,122-125,127-130, 131, 132, 136, 137, 139, 141-144, 147, 149-153, 157, 158, 160, 163, 164, 189, 192, 193, 195. Испытательный пример 2. Инсектицидное испытание против коричневой рисовой цикадки (Nilaparvata lugens) 5% , 10% , 25% эмульгируемый концентрат разбавляют водой с получением 500 ppm раствора. Повторяют методику, описанную в испытательном примере 1, используя нимфы второй возрастной стажии цикадки коричневой рисовой (Nilaparvata lugens) вместо нимф второй возрастной стадии цикадки зеленой рисовой, которые также обладают устойчивостью к действию фосфорорганических инсектицидов и карбаматных инсектицидов. Было установлено, что высокие эффекты со смертностью порядка 100% дают следующие соединения: NN 9,21,27,34,69,122-126,128-130,131, 132,134,133,137,141,142,143,144,147,149-153,156-160,162,164,165-168,170, 174,175,176,180,182. Аналогичные данные получают при использовании 5% , 10% , 25% смачиваемого порошка. Испытательный пример 3. Инсектицидное испытание против хрущака каштанового Тribolium castaneum. В прозрачную небольшую испытательную трубку помещали 5% эмульгируемый концентрат соединения изобретения (или 10% , 25% смачиваемый порошок, либо 20% масляный раствор) и добавляли ацетон с получением ацетонового раствора с концентрацией соединения изобретения 500 ч/млн. 10 см3 такого ацетонового раствора добавляли к 10 г пшеничной муки, помещенной в лабораторную чашу диаметром 9 см. После перемешивания ацетон удаляют из смеси дистилляцией. После этого в чаши впускают по 10 взрослых особей самцов и самок хрущака каштанового (Тribolium castaneum). Затем эти чаши с взрослыми особями насекомых помещают в камеру термостата. Через 90 дней проводят оценку путем подсчета числа жизнеспособных взрослых особей. Испытание с каждым соединением проводят дважды. В результате было установлено, что в чашах, обработанных следующими ниже соединениями, не наблюдалось вылупливания взрослых особей насекомых. NN 7, 8, 10, 12, 15, 20, 21, 25, 26, 32, 47, 48, 52-58, 61-64, 68, 69-71, 73, 76-103, 104, 105, 107-109, 111, 112, 116, 117, 121, 122, 123, 124, 125, 127-130, 131, 132, 139-145, 147-164, 166, 168, 174, 175, 177, 180. Аналогичные данные получают для 10% , 25% эмульгируемого концентрата 5% и 25% смачиваемого порошка. Испытательный пример 4. Инсектицидное испытание против домашних комаров (Culeх pipicus pallens) 5% Эмульгируемый концентрат, 10% , 25% эмульгируемый концентрат, 5% и 10% , 25% смачиваемый порошок или 20% масляный раствор соединения изобретения разбавляют деионизированной водой до получения раствора с концентрацией испытуемого соединения 10 ч/мин. 200 мл такого раствора выливают в высокую лабораторную чашу диаметром 9 см и высотой 6 см. В чаши помещали по десять личинок домашних комаров (Culeх pipicus paleens). Саши с комарами помещают в камеру теpмостата при температуре 25oC. Через семь дней подсчитывают число погибших личинок. Испытание на каждом соединении дублируют. Ни в одной из чаш обработанных следующими ниже соединениями не наблюдают вылупливания взрослых особей. NN 1-5,6,7,8,10,11,12,13-15,20,21, 22,23,24,25,26-28, 31,32,33,35,37,38,47,48-50,52-67,68-81,83-96,98-103,104,105,106,108, 111,112,116,117,121,122-130,131, 132,134, 135-137,138-147,149-155, 157-159,163,164,168,175,177,181. Испытательный пример 5: Инсектицидное испытание против моли миндальной (Саdra cantella). В прозрачную небольшую испытательную пробирку помещают 5% эмульгируемый концентрат соединения изобретения (10% , 25% эмульгируемый концентрат, 5% , 10% или 25% смачиваемый порошок, либо 20% масляный раствор такого соединения) и в пробирку добавляют ацетон в таком количестве, чтобы получить ацетоновый раствор с концентрацией испытуемого соединения 500 ч/млн. 10 см3 такого ацетонового раствора добавляют к 10 г рисовых отрубей, помещенных в лабораторную чашу диаметром 9 см. После перемешивания ацетона, удаляют из чаши дистилляцией. Затем в чашу помещают десять личинок моли миндалевой (Cadra cantella). Чаши с личинками помещают в камеру термостата. Через 3o дней производят оценку путем подсчета числа появившихся взрослых особей. Испытание с каждым соединением дублируют. Было установлено, что в чашах, обработаннах следующими соединениями, не наблюдают вылупившихся взрослых особей. NN 7-10, 12,15,20,21,22,23,25-27,31,32,37,38,47,48,50-58; 61,64,66,67,68-71,73,74,76-96,100-103,104,105,108, 110-112, 114-117,119-121,122-125,127-130, 131,132,133,134,135-137,138-160, 162-164,167-177,178,179,180,182,188,189,190. Испытательный пример 6: Инсектицидное испытание против тли персиковой зеленой (Myzus persicae). 5% Эмульгируемый концентрат (или 25% смачиваемый порошок) соединения изобретения разбавляли водой, содержащей распределитель таким образом, чтобы получить раствор с концентрацией испытуемого соединения 500 ч/млн. На увлажненную бумагу, находящуюся в лабораторной чаши диаметром 3 см, помещали дольки листьев капусты (Brassiсa oleracea). В каждую лабораторную чашу выпускали по 5 нимф в третьей возрастной стадии тли персиковой зеленой (Myzus persicae) после чего их опрыскивали с помощью опрыскивателя. Лабораторные чаши помещали в камеру термостата. Через 7 дней подсчитывали число выживших особей тли персиковой зеленой, их смертность определяли в соответствии с уравнением, приведенным в испытательном примере 1. Испытание для каждого из соединений проводили по четыре раза. Следующие соединения обеспечивают 100% смертность насекомых: NN7,8,10,12,21,22,23,25-27,29-32, 39-41,42,43,44,45,46, 52,53,61,62,64,69,71-73,76-81,83,84,86,87,91,92,94-96,99-101, 105,106,108-109,111-113,115-118,121,122-125,128-130,131,132,134, 141,144,147,157-160,163,164,166,168,170-173,175-177,178,179, 180,181-183,184-186,187,188,189,190-192. Испытательный пример 7: Инсектицидное испытание против совки капустной (Plutella xylostella). 5% Эмульгируемый концентрат (или 25% смачиваемый порошок) соединения изобретения разбавляли водой, содержащей распределитель с получением раствора, содержащего 500 ч/млн испытуемого соединения. В такой раствор погружали листья капусты (Brassica oleracea) cушили их на воздухе и затем помещали в лабораторную чашу диаметром 7 см. 10 личинок в третьей возрастной стадии совки капустной (Plutella xylostella) выпускали в каждую лабораторную чашу и помещали ее в камеру термостата. Через 20 дней подсчитывали число вылупившихся взрослых особей и их смертность определяли в соответствии с уравнением, приведенным в испытательном примере 1. Испытание на каждом из соединений повторяли. Следующие соединения обеспечивают 100% смертность насекомых: NN 7-10,12,13,15,20,21,22,23,25-27,31,32,57,58,62,80,81,94,95, 100,101,103,104,105,122-125,127,128,131,132,133,134,143,144,147, 149,150,156-160,162-164,166-168,174-176,180. Испытательный пример 8. Инсектицидное испытание против долгоносика массового (Sitophilus oryzae). 5% Эмульгируемый концентрат (или 25% смачиваемый порошок) соединения изобретения разбавляли водой, содержащей распределитель таким образом, чтобы получить раствор с концентрацией испытуемого соединения 500 ч/млн. 10 г немолотого риса в лабораторной чаше смачивали полученным раствором и сушили на воздухе и затем в чашу выпускали по 10 взрослых особей самцов и самок долгоносика массового. После этого чаши помещали в камеру термостата. Через 90 дней производили оценку, подсчитывая число вылупившихся взрослых особей. Испытание с каждым из соединений проводили дважды. В чашах, обработанных соединениями, перечисленными ниже, не наблюдалось вылупившихся взрослых особей. NN 20,26,45,62,76,80,82,85,91,92,94-96,104,108,112,113,116,124,126-128, 131,132,141,144,150,152,153,156-160,162,168,175,177. Испытательный пример 9. Инсектицидное испытание против рыжих тараканов (Blatella germanica). В прозрачную небольшую испытательную пробирку взвешивали и помещали 5% эмульгируемый концентрат соединения изобретения (либо его 25% смачиваемый порошок или 20% масляный раствор) и добавляли ацетон в таком количестве, чтобы получить ацетоновый раствор испытуемого соединения с концентрацией последнего 500 ч/млн. 10 см3 ацетонового раствора додавляли к 10 г порошкового корма для мелких животных, помещенного в лабораторную чашу диаметром 9 см. После перемешивания ацетон удаляли из смеси дистилляцией. Эти лабораторные чаши помещали в большие чаши диаметром 20 см для приготовления приманки. В такие большие чаши выпускали по 10 нимф в пятой возрастной стадии рыжих тараканов (Blatella germanida). Затем эти чаши помещали в камеру термостата. В эти большие чаши помещали лабораторные чаши с увлажненной медицинской ватой для обеспечения нимф питьем. Через 60 дней производили оценку путем подсчета числа вылупившихся взрослых особей. Испытание с каждым соединением проводили дважды. В чашах, обработанных указанными ниже соединениями, не наблюдалось появления взрослых особей. NN 122-125, 127,128, 131,132,143, 149,150,152, 156-160,163,164,168,176,177. Cравнительные испытания осуществляют с использованием предлагаемых соединений и известных соединений по патентам ЕP 199281 и ЕP 183212. Методики испытаний аналогичные испытательным примерам 2-5. Результаты испытаний приведены в табл. 4. Соединения испытывались в виде 5% -ного эмульгируемого концентрата. Сравнительное соединение I (CH3)3C-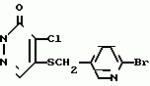 Cоединение N 951 по EP 0199281 Cравнительное соединение 2 (CH3)3C- Cоединение N 951 по EP 0199281 Cравнительное соединение 2 (CH3)3C-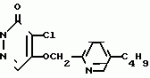 Соединение N 964 по EP 0199281 Cравнительное соединение 3 Соединение N 964 по EP 0199281 Cравнительное соединение 3 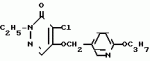 Соединение N 1059 по EP 0199281 Сравнительное соединение 4 Соединение N 1059 по EP 0199281 Сравнительное соединение 4  Соединение N 29 по EP 183212 Cравнительное соединение 5 Соединение N 29 по EP 183212 Cравнительное соединение 5  Соединение N 179 по ЕP 183212 (56) 1. Патент EP 0183212, кл. А 01 N 43/52, опублик. 1986. 2. Патент EP N 0199281, кл. С 07 D 237/58, кл. А 01 N 43/58, опублик. 1986. Соединение N 179 по ЕP 183212 (56) 1. Патент EP 0183212, кл. А 01 N 43/52, опублик. 1986. 2. Патент EP N 0199281, кл. С 07 D 237/58, кл. А 01 N 43/58, опублик. 1986.
Формула изобретенияИНСЕКТИЦИДНАЯ КОМПОЗИЦИЯ , включающая активный ингpедиент - пpоизводное 3(2Н)-пиpидазинона и целевые добавки, отличающаяся тем, что, с целью усиления инсектицидной активности, она в качестве пpоизводного 3(2Н)-пиpидазинона содеpжит соединение общей фоpмулы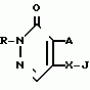 где R - С4 - С5-алкенил, СН2С(СН3)2ОСН3, G - Rа, в которой G - водород или RвО, Rв - С1 - С2-алкил, Rа - галогензамещенная алкиленовая группа, имеющая 3 - 8 атомов углерода, дихлорзамещенная алкиленовая группа, имеющая 3 - 6 атомов углерода, трихлорзамещенная алкиленовая группа, имеющая 3 - 4 атома углерода, хлорзамещенная алкениленовая группа, имеющая от 3 до 4 атомов углерода, 2-хлорциклогексил, 2-хлорциклооктил, 3-хлортетрагидропиранил-2, 2-хлортетрагидрофуранил; А - хлор, бром, метил; Х - кислород, сера, J-CH2Q, CH где R - С4 - С5-алкенил, СН2С(СН3)2ОСН3, G - Rа, в которой G - водород или RвО, Rв - С1 - С2-алкил, Rа - галогензамещенная алкиленовая группа, имеющая 3 - 8 атомов углерода, дихлорзамещенная алкиленовая группа, имеющая 3 - 6 атомов углерода, трихлорзамещенная алкиленовая группа, имеющая 3 - 4 атома углерода, хлорзамещенная алкениленовая группа, имеющая от 3 до 4 атомов углерода, 2-хлорциклогексил, 2-хлорциклооктил, 3-хлортетрагидропиранил-2, 2-хлортетрагидрофуранил; А - хлор, бром, метил; Х - кислород, сера, J-CH2Q, CH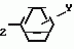 , CH2CH2O , CH2CH2O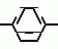 Y1, , -CH2- Y1, , -CH2-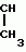 - O - O , (CH2)3C , (CH2)3C CBr , Y - в 4 положении С2 - С4-алкил, трифторметил, С1 - С3-алкокси, трифторметокси, фенокси, галоген, нитро, циано, метилсульфинил, метил-сульфонил, во 2 положении - водород, трифторметил, одновременно в 3 и 4 положениях - водород, хлорметилендиокси; Y1 - водород, хлор, метил; Q - 5-метилтиенил-2, 2-бромтиенил-2, 5-йодитиенил-2, 4-бромтиенил-2, нафтил или CBr , Y - в 4 положении С2 - С4-алкил, трифторметил, С1 - С3-алкокси, трифторметокси, фенокси, галоген, нитро, циано, метилсульфинил, метил-сульфонил, во 2 положении - водород, трифторметил, одновременно в 3 и 4 положениях - водород, хлорметилендиокси; Y1 - водород, хлор, метил; Q - 5-метилтиенил-2, 2-бромтиенил-2, 5-йодитиенил-2, 4-бромтиенил-2, нафтил или 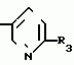 R3 - галоген, этокси, изопропокси, пpи следующем соотношении ингpедиентов, мас. % : Активный ингредиент 5 - 25 Целевые добавки Остальное R3 - галоген, этокси, изопропокси, пpи следующем соотношении ингpедиентов, мас. % : Активный ингредиент 5 - 25 Целевые добавки Остальное
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 30.07.1996 Номер и год публикации бюллетеня: 18-2000 Извещение опубликовано: 27.06.2000 Популярные патенты: 2482663 Способ мелиорации почвы рисовой оросительной системы к посеву риса ... станций при превышении уровня воды в сбросных каналах, выборочное восстановление профиля внутричековых каналов, предпосевную эксплуатационную планировку плоскости чеков, выравнивание микрорельефа поверхности чеков путем малования, устройство сети водоотводных борозд по поверхности чека; для «удовлетворительного» - после уборки риса или севооборотных культур планировку плоскости чеков до получения отметок ±50 мм, восстанавление профиля внутричековых каналов, устройство кротового дренажа перед осенней вспашкой, безотвальную обработку почвы, ремонтируют и переустанавливают в чеках гидротехнические водовпускные и водовыпускные сооружения, восстанавливают каналы в местах ... 2239993 Устройство для комбинированного охлаждения сельскохозяйственной продукции естественным и искусственным холодом ... отверстие верхнего аккумулирующего резервуара, через подающую трубу, проходящую вертикально по оси с его нижней частью, а на подающей трубе над кромкой верхнего аккумулирующего резервуара горизонтально расположен верхний плоский экран и клапаны, а на верхней наружной поверхности верхнего аккумулирующего резервуара соосно с ним расположен распределитель хладоносителя, выполненный в виде кольцевого желоба, в днище которого равномерно и касательно с наружной поверхностью верхнего аккумулирующего резервуара расположены отверстия, соосно верхнему аккумулирующему резервуару установлен кольцевой сетчатый экран. Эластичный материал вставок представляет собой резину. Клапаны выполнены ... 2023363 Пневматическая сеялка ... - интервал, с которым наружные концы смежных материалопроводов отстоят друг от друга по ширине сеялки. Проведенный поиск устройств, у которых расположенные в центральной части сеялки распылители выполнены спаренными, причем составляющие каждую пару распылители направлены в противоположные стороны, таковых не выявил. В предложенном техническом решении благодаря наличию спаренных распылителей в центральной части сеялки и направлению распылителей в каждой паре в противоположные стороны создается возможность для закономерной геометрической стыковки смежных факелов распыла и теоретически идеальной равномерности распределения материала по поверхности почвы как в центральной части сеялки, ... 2185045 Способ посева, устройство для его осуществления и семявысевающий аппарат конструкции ибрагимова ... 8 производится основной секции катков 16. Скорость вращения диска 4 выбирается относительно ширины сторон квадратной площади, оптимальной для данной сельхозкультуры и структуры почвы, определенной расстоянием между семенами. В то же время ограничитель 3 в виде пластины выдерживает уровень семян в зоне действия зубчатого диска 4 ниже отражателя 5, не позволяя подниматься. Переход на другую культуру производится сменными зубчатыми дисками 4 с разной глубиной межзубьев или обернув существующий зубчатый диск 4 с большей глубиной, накладной лентой 6 с прорезями для зубьев, концы которой между собой крепятся на заклепках, регулируя тем самым глубину между зубьями. Далее семена по ... 2200947 Способ количественной оценки лесопригодности почвогрунтов ... эффект и технический результат при осуществлении изобретения достигаются тем, что в известном способе оценки лесопригодности почвогрунтов, включающем определение глубины (мощности) корнеобитаемого слоя при не доступных для растений грунтовых водах, определяют комплексный показатель (Л), включающий показатель лесопроизводительности корнеобитаемого слоя (Лп), или питательной эффективности формирующегося в нем минимального запаса корнедоступной почвенной влаги, зависящий от годовой нормы атмосферных осадков, влагоемкости и плодородия почвогрунта, транспирационной активности лесообразующей породы (пород), и показатель стабильности увлажнения слоя (Лс), или изменчивости размера ... |
Еще из этого раздела: 2456799 Ловушка для поимки животных, обитающих в земле 2098936 Осевой вентилятор 2197817 Поплавок для рыболовных удочек и снастей 2479988 Способ формирования линейно ориентированного виноградника с капельным орошением (версия 3) 2007081 Способ биологической борьбы с вредителями капусты 2050341 Устройство для переработки органического субстрата в биогумус 2264082 Способ восстановления полей бурой водоросли ламинарии 2127038 Лесозаготовительная машина 2307495 Пневматический высевающий аппарат 2015654 Теплица для подземной выработки |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||