Полициклические соединения, способ и штамм для их получения, противопаразитная композиция и способ подавления паразитарных инфекцийПатент на изобретение №: 2139874 Автор: Анне В.Домбровски (US), Ричард Г.Эндрис (US), Грегори Л.Хелмс (US), Отто Д.Хенсенс (US), Джон Г.Ондейка (US), Дан А.Остлинд (US), Джон Д.Полишук (US), Дебора Л.Цинк (US) Патентообладатель: Мерк энд Ко., Инк. (US) Дата публикации: 20 Октября, 1999 Начало действия патента: 27 Октября, 1994 Адрес для переписки: 103735, Москва, ул.Ильинка, 5/2, Союзпатент, Лебедевой Н.Г. Изображения    Изобретение относится к новым полициклическим соединениям общей формулы 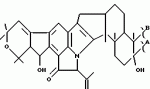 где А представляет собой водород, а В является группой формулы где А представляет собой водород, а В является группой формулы 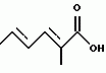 либо А и В, взятые вместе, образуют циклическую группу либо А и В, взятые вместе, образуют циклическую группу 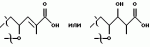 которые получают при ферментации из штамма вида Nodulisporium МF 5954 (АТСС 74245). Соединения являются весьма сильными эктопаразитоцидами, противопаразитарными средствами и инсектицидами. 5 с. и 4 з.п. ф-лы, 3 ил., 1 табл.
, , , которые получают при ферментации из штамма вида Nodulisporium МF 5954 (АТСС 74245). Соединения являются весьма сильными эктопаразитоцидами, противопаразитарными средствами и инсектицидами. 5 с. и 4 з.п. ф-лы, 3 ил., 1 табл.
, , , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУПредпосылки создания изобретения Хорошо известные такие новые противопаразитарные средства, как авермектины, которые раскрываются в патентах США NN 4 310 519 и 4 199 569. Однако, такие авермектиновые соединения, несмотря на то, что являются сильными средствами против внутренних и наружных паразитов, структурно весьма существенно отличаются от соединений настоящего изобретения. Авермектины, будучи макроциклическими веществами, выделяемыми из актиномицетов, не относятся к полициклическим метаболитам грибов, о которых здесь идет речь. В работе Jesus et al., J. Chem. Soc. Perkin Trans I, pg 697-701 (1984), описываются метаболиты грибов, идентифицированные как джантитремы (janthitrems), с полициклической структурой, которые, однако, не имеют некоторых структурных элементов соединений настоящего изобретения. Краткое изложение сущности изобретения Настоящее изобретение относится к получению новых противопаразитарных средств и эктопаразитоцидных средств. Таким образом, целью настоящего изобретения является раскрытие таких новых соединений. Другой целью является предложить новый способ получения таких соединений. Еще одна цель состоит в том, чтобы описать микроорганизм, применяемый для получения таких соединений, и условия ферментации, пригодные для такого продуцирования. Еще одной целью является описание композиций и способов применения соединений настоящего изобретения в качестве противопаразитарных средств. Другие цели станут очевидными при чтении следующего далее описания. Краткое описание чертежей Фиг. 1, 2 и 3 представляют собой спектры протонного ядерного магнитного резонанса соединений 1, 2 и 3 соответственно. На чертежах некоторые резонансные пики отмечены "X". Эти пики являются результатом присутствия растворителя и не являются существенными в структуре соединений. Фиг. 1 является спектром ядерного магнитного резонанса соединения 1, записанным при 500 МГц в CD2Cl2 на ЯМР-спектрометре Varian Unity 500 при 25oC. Химические сдвиги указываются в m.g. (ррм) относительно ТМС (тетраметилсилан) при нулевом значении m.g., используя пик растворителя при 5.32 в качестве внутреннего стандарта. Отмечаются только характеристические пики. Фиг. 2 представляет собой спектр ядерного магнитного резонанса, записанный при 400 МГц CD2Cl2 на ЯМР-спектрометре Varian Unity 400 при 25oC. Химические сдвиги указываются в м. д. относительно ТМС при нулевом значении m.g. , используя пик растворителя при 5.32 в качестве внутреннего стандарта. Отмечаются только характеристические пики. Фиг. 2 представляет собой спектр ядерного магнитного резонанса, записанный при 400 МГц CD2Cl2 на ЯМР-спектрометре Varian Unity 400 при 25oC. Химические сдвиги указываются в м. д. относительно ТМС при нулевом значении m.g. , используя пик растворителя при  5.32 в качестве внутреннего стандарта. Отмечаются только характеристические пики. Фиг. 3 представляет собой спектр ядерного магнитного резонанса соединения 3, записанный при 300 МГц в CDCl3 на ЯМР-спектрометре Varian XL300 при температуре окружающей среды. Химические сдвиги указываются в m.g. относительно ТМС при нулевом значении m.g., используя пик растворителя при 5.32 в качестве внутреннего стандарта. Отмечаются только характеристические пики. Фиг. 3 представляет собой спектр ядерного магнитного резонанса соединения 3, записанный при 300 МГц в CDCl3 на ЯМР-спектрометре Varian XL300 при температуре окружающей среды. Химические сдвиги указываются в m.g. относительно ТМС при нулевом значении m.g., используя пик растворителя при  7.24 в качестве внутреннего стандарта. Оцениваются только характеристические пики. Подробное описание изобретения Настоящее изобретение относится к новым соединениям уникального строения. Настоящее изобретение также относится к новому способу получения соединений настоящего изобретения в сбраживаемой среде вида Nodulisporium или его мутанта. Соединения настоящего изобретения имеют следующую структуру: 7.24 в качестве внутреннего стандарта. Оцениваются только характеристические пики. Подробное описание изобретения Настоящее изобретение относится к новым соединениям уникального строения. Настоящее изобретение также относится к новому способу получения соединений настоящего изобретения в сбраживаемой среде вида Nodulisporium или его мутанта. Соединения настоящего изобретения имеют следующую структуру: 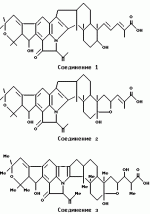 Приведенные выше структурные формулы даются без определенной стереохимии в некоторых положениях и с определенной стереохимией в других положениях, а настоящее изобретение следует истолковывать как охватывающее все такие стереоизомеры. В частности, стереоизомеры при различных асимметрических центрах могут ориентироваться либо в Приведенные выше структурные формулы даются без определенной стереохимии в некоторых положениях и с определенной стереохимией в других положениях, а настоящее изобретение следует истолковывать как охватывающее все такие стереоизомеры. В частности, стереоизомеры при различных асимметрических центрах могут ориентироваться либо в 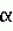 -, либо -, либо 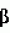 - положении таких групп, находящихся ниже или выше общей плоскости молекулы, соответственно. Соединения настоящего изобретения находят свое основное применение в качестве противопаразитарных средств при лечении и/или для профилактики и лечения заболеваний, вызываемых паразитами, например членистоногими паразитами, такими как клещи, вши, блохи, и другими кусающими насекомыми на домашних животных и птице, такими как Tenophalides, Ixodes, Psoroptes, Lucilia и Hemotobia. Они также эффективны для лечения паразитарных заболеваний у других животных, в том числе у человека. Оптимальное количество, которое используется для получения наилучших результатов, будет зависеть, конечно, от вида животного, которое лечат, и типа и тяжести паразитарной инфекции и инвазии. Как правило, с предлагаемым новым соединением хорошие результаты получают при пероральном приеме от 0.001 до 100 мг на кг массы тела животного, причем такая общая доза дается в один прием или раздельными дозами, в течение относительно небольшого промежутка времени, такого как 1-5 дней. На животных отличные результаты при борьбе с такими паразитами новыми соединениями настоящего изобретения получают при введении от 0.025 до 50 мг на кг массы тела в однократной дозе. Повторные обработки делаются, когда требуется бороться с реинфекциями, и они зависят от вида паразита и хозяйственных методов, которые используются. Технические приемы введения таких веществ животным известны специалистам в области ветеринарии. Соединения настоящего изобретения также активны против домашних вредителей, таких как тараканы, вид Blatella, муравьев (Solenopsis), платяной моли, вид Tineola, антренуса, вид Attagenus, и домашней мухи Musca domestica. Соединения настоящего изобретения также пригодны для применения против вредителей хранящегося зерна, таких как вид Tribolium, вид Tenebrio, и вредителей сельскохозяйственных растений, таких как клещик паутинный (вид Tetranychus), тля, мигрирующие прямокрылые Acyrthiosiphon, такие как саранча, и насекомые в стадии незрелости, живущие в тканях растения. Соединения пригодны в качестве нематоцидов для борьбы с нематодами и паразитами растений, такими как вид Meloidogyne, что может иметь большое значение для сельского хозяйства. Соединения настоящего изобретения могут вводиться перорально в форме единичной стандартной дозы, такой как капсула, болюс или таблетка, или в виде жидкой формы лекарства, т.е., как правило, раствора, суспензии или дисперсии активного ингредиента, как правило, в воде, вместе с суспендирующим агентом, таким как бентонит, и смачивателем или подобным эксципиентом. Жидкие композиции, как правило, содержат также противовспениватель. Жидкие лекарственные формулировки обычно содержат от 0.001 до 1.0 мас.% активных соединений. Предпочтительные жидкие лекарственные формулировки могут содержать от 0.01 до 0.1 мас.% активного соединения. Капсулы и болюсы содержат активный ингредиент, смешанный с носителем-связующим, таким как крахмал, тальк, стеарат магния или дикальцийфосфат. Когда желательно вводить соединения настоящего изобретения в форме сухой твердой единичной дозы, обычно применяют капсулы, болюсы или таблетки, содержащие нужное количество соединений настоящего изобретения. Такие лекарственные формы получают путем тщательного и однородного перемешивания активного ингредиента с соответствующими разбавителями, наполнителями, дезинтеграторами и/или связующими, такими как крахмал, лактоза, тальк, стеарат магния, растительные смолы и т.п. Формулировки таких единичных лекарственных форм могут широко варьировать в отношении их общей массы и содержания противопаразитарного средства в зависимости от таких факторов, как тип домашнего животного, которое лечат, тяжести и типа инфекции и массы хозяина. Когда соединения настоящего изобретения должны даваться животному с кормом, их тщательно диспергируют в пище или посыпают пищу этими веществами в форме пилюль, и такая пища затем может добавляться в конечный корм или, необязательно, скармливаться отдельно. С другой стороны, противопаразитарные соединения настоящего изобретения могут вводиться животным парентерально, например, посредством интраруминальной, внутримышечной, внутритрахиальной или подкожной инъекции, при этом активный ингредиент растворяют или диспергируют в жидком носителе. Для парентерального введения активное вещество подходящим образом смешивают с приемлемым носителем, предпочтительно с растительным маслом, таким как арахисовое масло, хлопковое масло или подобное. Используются также другие парентеральные носители, такие как органические препараты, использующие золь-кетальные (solketal), глицериновые, формальдегидные и водные парентеральные формулировки. Соединения настоящего изобретения растворяют или суспендируют для введения в парентеральной формулировке; такие формулировки обычно содержат от 0.55 мас.% до 5 мас.% соединения настоящего изобретения. Когда описанные здесь соединения вводят в качестве компонентов корма для животных или растворенными или суспендированными в питьевой воде, делаются композиции, в которых активные соединения тщательно диспергируются в инертном носителе или разбавителе. Под инертным носителем подразумевается носитель, который не будет взаимодействовать с противопаразитарным средством и который можно без опасений вводить животным. Предпочтительно носитель для введения с кормом представляет собой носитель, который является или может являться ингредиентом рациона животного. Подходящие композиции включают пищевые премиксы или добавки, в которых соединения настоящего изобретения присутствуют в больших количествах и которые являются подходящими для непосредственного скармливания животному или для добавления в корм или во время, или после стадии промежуточного разбавления или смешения. Типичные носители или разбавители, подходящие для таких композиций, включают, например, очищенные сушеные зерна, кукурузную муку, цитрусовую муку, остатки сбраживания, измельченные устричные раковины, пшеничные отходы, растворимые мелассы, муку из кочерыжек кукурузных початков, выжимки пищевых бобов, соевую муку грубого помола, дробленый известняк и т. п. Соединения настоящего изобретения тщательно диспергируют в носителе такими способами, как измельчение, перемешивание, перемалывание или обработка в барабане. Композиции, содержащие от 0.005 мас.% до 2.0 мас.% соединения настоящего изобретения, являются особенно подходящими в качестве кормовых премиксов. Пищевые добавки, которые непосредственно скармливают животному, содержат от 0.0002 мас.% до 0.3 мас.% соединения настоящего изобретения. Такие добавки вводят в корм животного в таком количестве, чтобы получить в конечном корме концентрацию активного соединения, желательную для лечения и борьбы с паразитарными заболеваниями. Хотя нужная концентрация соединений настоящего изобретения будет меняться в зависимости от факторов, ранее упомянутых, как и от конкретно используемого соединения, соединения настоящего изобретения, как правило, загружают в корм до концентрации от 0.001 до 0.2%, чтобы достичь нужного противопаразитарного действия. Кроме того, когда соединение должно добавляться к корму животного, можно использовать высушенный мицелиальный осадок из ферментационного бульона. Мицелии содержат преобладающую часть активности, и, так как уровень активности мицелия можно определить, его можно добавлять непосредственно в корм животного. Соединения настоящего изобретения также пригодны для борьбы с сельскохозяйственными вредителями, которые причиняют вред культурам во время роста или при хранении. Чтобы осуществить защиту от таких сельскохозяйственных вредителей, соединения применяют, используя известные технические приемы, в виде составов для разбрызгивания, дустов, эмульсий и т.п., для обработки растущих культур или хранящихся культур. Противопаразитарная активность соединений настоящего изобретения может быть определена путем перорального введения через пищу образца отдельного соединения, смеси таких соединений, концентрированного экстракта и т.п. мышам, которые инфицированы 3 днями ранее соответствующим паразитом. На 11, 12 и 13 день после начала лечения проверяют фекалии мышей на присутствие яиц, и на следующий день мышей умерщвляют и определяют число личинок, присутствующих в проксимальной части тонкой кишки. Активность соединения наблюдают, когда имеется существенное уменьшение числа яиц и личинок по сравнению с зараженными, не обработанными лекарственным препаратом контрольными образцами. Новые соединения настоящего изобретения получают путем брожения штамма гриба рода Nodulisporium. Одна из таких культур обозначается MF-5954 в коллекции культур Merk & Co., Inc., Rahway, New Jersey. Продуцирующий штамм MF-5954 депонирован в постоянной коллекции American Type Culture Collection на 12301 Parklawn Drive, Rockville, Md. 20852 и имеет инвентарный номер 74245. Депозит осуществлен 21 сентября 1993 согласно Будапештскому Договору о международном признании депозита микроорганизмов для целей патентных процедур. Морфологические и культуральные характеристики вида MF-5954 Nodulisporium являются следующими. MF-5954 (продуцирует L-954967) выделяют как JP337 - эндофитный грибок из ткани древесного растения путем метода поверхностной стирилизации Bills и Polishook (1991). В последующем описании названия цветов с большой буквы даются по Ridgway (1912). На arape с отваром из кукурузной муки (Difco) колония достигает диаметра 42 мм через 6 суток при 25oC, относительной влажности 50% и световом периоде 12 ч при люминисцентном излучении. Растущая пленка колонии погружается, поверхность, сдавленная до опушенной, неокрашена во всем объеме; эксудат и растворимый пигмент отсутствуют; обратная сторона не окрашена, присутствует приятный сладковатый запах. На агаре с отваром из овсяной муки (Difco) колония достигает диаметра 42 мм через 6 суток при тех же условиях. Пленка колонии сдавливается до отдельных пушистых участков, центр колонии от желто-коричневого /желтый марс (Mars Yellow), сырая сиенна (Raw Sienna)/ до светлого желто-коричневого /светлый желто-оранжевый (Light Orange Yellow), сурьмяно-оранжевый (Antimony Yellow)/ на полпути к краю; край чистый белый; эксудат, запах и растворимый пигмент отсутствуют; обратная сторона светло-коричневая. На картофельном агаре с сахарозой (Singleton, et al, 1992) колония достигает диаметра 43 мм через 6 суток при тех же условиях. Пленка колонии сдавливается до отдельных пушистых участков, красновато-коричневых /красновато-коричневый виноградный (Light Russet-Vinaceous)/ в центре колонии, бледнеющих до гиалиновых на краю, край неотчетливый; эксудат, запах и растворимый пигмент отсутствуют; обратная сторона красно- коричневая /темно-бордовая (Dark Vinaceous)/. При 37oC на arape из отвара кукурузной муки и в темноте колония через 6 суток достигает диаметра 82 мм; пленка колонии пушистая на всем протяжении за исключением точки инокулирования, где пленка сдавленная, белая; край целый, белый; эксудат и растворимый пигмент отсутствуют; обратная сторона неокрашенная; присутствует приятный сладковатый запах. Гифы гиалиновые до светло-коричневых, имеющие перегородки, со стенками от гладких до слегка шероховатых, толстостенные, ширина 2.5 - 3.5 мкм. Конидиофоры мононематозные (mononematous), прямостоящие, 150 - 400 х 3.0 - 4.0 мкм, кистеобразно разветвленные, гиалиновые до светло-коричневых, имеющие перегородки, толстостенные, от гладких до едва шероховатых и бородавчатых, иногда с напоминающими оливу окружающими выступами (диаметр 2.5 мкм). Конидиогенные клетки голобластические, терминальные, 16 - 24 х 1.5 - 2.0 мкм, от едва шероховатых до бородавчатых, цилиндрические, искривленные в апексе. Конидии от обратнояйцевидных до продолговато-эллиптических с усеченной точкой присоединения, 4.1 - 5.7 х 1.6 - 2.5 мкм, гиалиновые без перегородок, тонкостенные, продуцированные симподиально из апекса конидиогенной клетки, накапливающиеся в виде апикальной кисти на зубчиках. MF-5954 относят к роду грибов Nodulisporium (Hyphomycetes. Deuteromycotina). Ключевые таксономические характеристики этого рода включают мононематозные кондиофоры, которые типично разветвлены, и симподулезное продуцирование конидий. Кроме того, конидиальные рождающие пространства являются терминальными или интеркалярными и узловатыми вследствие обильного конидиального продуцирования (Jong and Rogers, 1972). Эти особенности отличают род Nodulisporium от других подобных грибов, таких как Geniculosporium, Hylocladium и Ustilina. Эти роды являются бесполым (анаморфным) состоянием многих грибов xylariaceous (Ascomycotina), таких как Hypoxylon, Xylaria, Rosellinia и т.п. В отличие от большинства изолятов Nodulisporium, MF-5954 хорошо растет при 37oC, но не обнаруживает каких-либо других отличительных особенностей, которые связывают его с известными видами. Следовательно, он определяется как вид Nodulisporium. С указанными сведениями можно ознакомиться в нижеперечисленных источниках: Bills, G. F. and Polishook, J.D. 1991 "Microfungi from Carpinus caroliniana". Can. J. Bot. 69 (7): 1477-1482; Jong, S.C. and Rogers, J.D. 1972 "Illustrations and descriptions of conidial states of some Hypoxylon species". Wash. State Agric. Exp. Sta. Tech. Bull. No. 71. 51 p; Ridgway, R. 1912. Color standards and color nomenclature. Publ. by the author, Washington, D.C. 43p. + 53 pl; Singleton, L.L., Mihail, J.D. and Rush, C.M. (Eds) 1992. Methods for research on soliborne phytopatogenic fungi, appendix A, p. 247. APS Press, St. Paul, Minnesota. Соединения настоящего изобретения продуцируются во время аэробного брожения (ферментации) подходящей твердой или жидкой питательной среды при описанных далее условиях продуцирующим штаммом вида Nodulisporium. Водные и твердые среды, такие как среды, используемые для продуцирования многих антибиотических веществ, являются подходящими для применения в способе получения этих полициклических соединений. Такие питательные среды содержат источники углерода и азота, усваиваемые микроорганизмом, и обычно содержат мало неорганических солей. Кроме того, среда ферментации может содержать следы металлов, необходимых для роста микроорганизмов и продуцирования нужных соединений. Они обычно присутствуют в достаточной концентрации в комплексных источниках углерода и азота, которые могут использоваться как источники питания, но могут, конечно, при желании, добавляться в среду отдельно. Вообще, подходящими источниками усваиваемого углерода в питательной среде являются углеводы, такие как сахара, например глюкоза, мальтоза, лактиза, декстрин, церелоза, кукурузная мука, овсяная мука и т.п., и крахмалы. Точное количество источника углерода, которое используется в среде, будет зависеть, в частности, от других ингредиентов среды, но, как правило, считается, что удовлетворительное количество углевода в среде составляет от 1 до 150 мг/л. Такие источники углерода могут использоваться по отдельности или в одной и той же среде могут сочетаться несколько таких источников углерода. Различные источники азота, такие как дрожжевые гидролизаты, дрожжевые автолизаты, дрожжевые клетки, томатная паста, кукурузная мука, овсяная мука, соевый жмых, казеиновые гидролизаты, дрожжевые экстракты, жидкости от замачивания кукурузы, растворимые очистки, хлопковый жмых, мясной экстракт и подобные материалы, легко усваиваются видом Nodulisporium при продуцировании соединения настоящего изобретения. Различные источники азота могут использоваться по отдельности или в сочетании в количестве, составляющем в среде от 1 до 5 мг/л. К числу питательных неорганических солей, которые могут быть включены в культуральную среду, относятся обычные соли, которые могут дать ионы натрия, калия, магния, аммония, кальция, фосфат-, сульфат-, хлорид-, карбонат-ионы и подобные ионы. Включаются также следовые количества металлов, таких как железо, цинк, марганец, медь, бор, молибден и т.п. Следует отметить, что среды, описанные ниже и в примерах, являются только иллюстрациями широкого разнообразия сред, которые могут использоваться, и не предназначаются для ограничения. Далее приводятся примеры сред, пригодных для выращивания штаммов вида Nodulisporium MF-5954, АТСС 74245. Состав среды на скошенном arape Дрожжевой экстракт - 4 г Солодовый экстракт - 10 г Глюкоза - 4 г Бактоагар - 20 г Дистиллированная вода - 1000 мл pH 7 Состав сред для посева и производственных питательных сред Среда для посева Компонент - г/л Дрожжевой экстракт - 4.0 Солодовый экстракт - 8.0 Глюкоза - 4.0 Junlon - 1.5 Среду готовят с дистиллированной водой, доводят pH до 7.0 перед стерилизацией, и разливают по 50 мл в 250-мл колбы Эрленмейера без мешалок (unbaffled). Используют ватные пробки. Стерилизацию проводят при 121oC в течение 20 минут. Производственная питательная среда А 1. Твердая часть Вносят 1250 см3 вермикулита в 4-л вращающуюся колбу. Пробка с латексным уплотнением; автоклавируют в течение 60 мин, плюс сушка в течение 30 мин. 2. Жидкая часть Компонент - г/л Глюкоза - 150.0 Мочевина - 4.0 NZ-амин, тип А - 4.0 K2HPO4 - 0.5 MgSO4 - положении таких групп, находящихся ниже или выше общей плоскости молекулы, соответственно. Соединения настоящего изобретения находят свое основное применение в качестве противопаразитарных средств при лечении и/или для профилактики и лечения заболеваний, вызываемых паразитами, например членистоногими паразитами, такими как клещи, вши, блохи, и другими кусающими насекомыми на домашних животных и птице, такими как Tenophalides, Ixodes, Psoroptes, Lucilia и Hemotobia. Они также эффективны для лечения паразитарных заболеваний у других животных, в том числе у человека. Оптимальное количество, которое используется для получения наилучших результатов, будет зависеть, конечно, от вида животного, которое лечат, и типа и тяжести паразитарной инфекции и инвазии. Как правило, с предлагаемым новым соединением хорошие результаты получают при пероральном приеме от 0.001 до 100 мг на кг массы тела животного, причем такая общая доза дается в один прием или раздельными дозами, в течение относительно небольшого промежутка времени, такого как 1-5 дней. На животных отличные результаты при борьбе с такими паразитами новыми соединениями настоящего изобретения получают при введении от 0.025 до 50 мг на кг массы тела в однократной дозе. Повторные обработки делаются, когда требуется бороться с реинфекциями, и они зависят от вида паразита и хозяйственных методов, которые используются. Технические приемы введения таких веществ животным известны специалистам в области ветеринарии. Соединения настоящего изобретения также активны против домашних вредителей, таких как тараканы, вид Blatella, муравьев (Solenopsis), платяной моли, вид Tineola, антренуса, вид Attagenus, и домашней мухи Musca domestica. Соединения настоящего изобретения также пригодны для применения против вредителей хранящегося зерна, таких как вид Tribolium, вид Tenebrio, и вредителей сельскохозяйственных растений, таких как клещик паутинный (вид Tetranychus), тля, мигрирующие прямокрылые Acyrthiosiphon, такие как саранча, и насекомые в стадии незрелости, живущие в тканях растения. Соединения пригодны в качестве нематоцидов для борьбы с нематодами и паразитами растений, такими как вид Meloidogyne, что может иметь большое значение для сельского хозяйства. Соединения настоящего изобретения могут вводиться перорально в форме единичной стандартной дозы, такой как капсула, болюс или таблетка, или в виде жидкой формы лекарства, т.е., как правило, раствора, суспензии или дисперсии активного ингредиента, как правило, в воде, вместе с суспендирующим агентом, таким как бентонит, и смачивателем или подобным эксципиентом. Жидкие композиции, как правило, содержат также противовспениватель. Жидкие лекарственные формулировки обычно содержат от 0.001 до 1.0 мас.% активных соединений. Предпочтительные жидкие лекарственные формулировки могут содержать от 0.01 до 0.1 мас.% активного соединения. Капсулы и болюсы содержат активный ингредиент, смешанный с носителем-связующим, таким как крахмал, тальк, стеарат магния или дикальцийфосфат. Когда желательно вводить соединения настоящего изобретения в форме сухой твердой единичной дозы, обычно применяют капсулы, болюсы или таблетки, содержащие нужное количество соединений настоящего изобретения. Такие лекарственные формы получают путем тщательного и однородного перемешивания активного ингредиента с соответствующими разбавителями, наполнителями, дезинтеграторами и/или связующими, такими как крахмал, лактоза, тальк, стеарат магния, растительные смолы и т.п. Формулировки таких единичных лекарственных форм могут широко варьировать в отношении их общей массы и содержания противопаразитарного средства в зависимости от таких факторов, как тип домашнего животного, которое лечат, тяжести и типа инфекции и массы хозяина. Когда соединения настоящего изобретения должны даваться животному с кормом, их тщательно диспергируют в пище или посыпают пищу этими веществами в форме пилюль, и такая пища затем может добавляться в конечный корм или, необязательно, скармливаться отдельно. С другой стороны, противопаразитарные соединения настоящего изобретения могут вводиться животным парентерально, например, посредством интраруминальной, внутримышечной, внутритрахиальной или подкожной инъекции, при этом активный ингредиент растворяют или диспергируют в жидком носителе. Для парентерального введения активное вещество подходящим образом смешивают с приемлемым носителем, предпочтительно с растительным маслом, таким как арахисовое масло, хлопковое масло или подобное. Используются также другие парентеральные носители, такие как органические препараты, использующие золь-кетальные (solketal), глицериновые, формальдегидные и водные парентеральные формулировки. Соединения настоящего изобретения растворяют или суспендируют для введения в парентеральной формулировке; такие формулировки обычно содержат от 0.55 мас.% до 5 мас.% соединения настоящего изобретения. Когда описанные здесь соединения вводят в качестве компонентов корма для животных или растворенными или суспендированными в питьевой воде, делаются композиции, в которых активные соединения тщательно диспергируются в инертном носителе или разбавителе. Под инертным носителем подразумевается носитель, который не будет взаимодействовать с противопаразитарным средством и который можно без опасений вводить животным. Предпочтительно носитель для введения с кормом представляет собой носитель, который является или может являться ингредиентом рациона животного. Подходящие композиции включают пищевые премиксы или добавки, в которых соединения настоящего изобретения присутствуют в больших количествах и которые являются подходящими для непосредственного скармливания животному или для добавления в корм или во время, или после стадии промежуточного разбавления или смешения. Типичные носители или разбавители, подходящие для таких композиций, включают, например, очищенные сушеные зерна, кукурузную муку, цитрусовую муку, остатки сбраживания, измельченные устричные раковины, пшеничные отходы, растворимые мелассы, муку из кочерыжек кукурузных початков, выжимки пищевых бобов, соевую муку грубого помола, дробленый известняк и т. п. Соединения настоящего изобретения тщательно диспергируют в носителе такими способами, как измельчение, перемешивание, перемалывание или обработка в барабане. Композиции, содержащие от 0.005 мас.% до 2.0 мас.% соединения настоящего изобретения, являются особенно подходящими в качестве кормовых премиксов. Пищевые добавки, которые непосредственно скармливают животному, содержат от 0.0002 мас.% до 0.3 мас.% соединения настоящего изобретения. Такие добавки вводят в корм животного в таком количестве, чтобы получить в конечном корме концентрацию активного соединения, желательную для лечения и борьбы с паразитарными заболеваниями. Хотя нужная концентрация соединений настоящего изобретения будет меняться в зависимости от факторов, ранее упомянутых, как и от конкретно используемого соединения, соединения настоящего изобретения, как правило, загружают в корм до концентрации от 0.001 до 0.2%, чтобы достичь нужного противопаразитарного действия. Кроме того, когда соединение должно добавляться к корму животного, можно использовать высушенный мицелиальный осадок из ферментационного бульона. Мицелии содержат преобладающую часть активности, и, так как уровень активности мицелия можно определить, его можно добавлять непосредственно в корм животного. Соединения настоящего изобретения также пригодны для борьбы с сельскохозяйственными вредителями, которые причиняют вред культурам во время роста или при хранении. Чтобы осуществить защиту от таких сельскохозяйственных вредителей, соединения применяют, используя известные технические приемы, в виде составов для разбрызгивания, дустов, эмульсий и т.п., для обработки растущих культур или хранящихся культур. Противопаразитарная активность соединений настоящего изобретения может быть определена путем перорального введения через пищу образца отдельного соединения, смеси таких соединений, концентрированного экстракта и т.п. мышам, которые инфицированы 3 днями ранее соответствующим паразитом. На 11, 12 и 13 день после начала лечения проверяют фекалии мышей на присутствие яиц, и на следующий день мышей умерщвляют и определяют число личинок, присутствующих в проксимальной части тонкой кишки. Активность соединения наблюдают, когда имеется существенное уменьшение числа яиц и личинок по сравнению с зараженными, не обработанными лекарственным препаратом контрольными образцами. Новые соединения настоящего изобретения получают путем брожения штамма гриба рода Nodulisporium. Одна из таких культур обозначается MF-5954 в коллекции культур Merk & Co., Inc., Rahway, New Jersey. Продуцирующий штамм MF-5954 депонирован в постоянной коллекции American Type Culture Collection на 12301 Parklawn Drive, Rockville, Md. 20852 и имеет инвентарный номер 74245. Депозит осуществлен 21 сентября 1993 согласно Будапештскому Договору о международном признании депозита микроорганизмов для целей патентных процедур. Морфологические и культуральные характеристики вида MF-5954 Nodulisporium являются следующими. MF-5954 (продуцирует L-954967) выделяют как JP337 - эндофитный грибок из ткани древесного растения путем метода поверхностной стирилизации Bills и Polishook (1991). В последующем описании названия цветов с большой буквы даются по Ridgway (1912). На arape с отваром из кукурузной муки (Difco) колония достигает диаметра 42 мм через 6 суток при 25oC, относительной влажности 50% и световом периоде 12 ч при люминисцентном излучении. Растущая пленка колонии погружается, поверхность, сдавленная до опушенной, неокрашена во всем объеме; эксудат и растворимый пигмент отсутствуют; обратная сторона не окрашена, присутствует приятный сладковатый запах. На агаре с отваром из овсяной муки (Difco) колония достигает диаметра 42 мм через 6 суток при тех же условиях. Пленка колонии сдавливается до отдельных пушистых участков, центр колонии от желто-коричневого /желтый марс (Mars Yellow), сырая сиенна (Raw Sienna)/ до светлого желто-коричневого /светлый желто-оранжевый (Light Orange Yellow), сурьмяно-оранжевый (Antimony Yellow)/ на полпути к краю; край чистый белый; эксудат, запах и растворимый пигмент отсутствуют; обратная сторона светло-коричневая. На картофельном агаре с сахарозой (Singleton, et al, 1992) колония достигает диаметра 43 мм через 6 суток при тех же условиях. Пленка колонии сдавливается до отдельных пушистых участков, красновато-коричневых /красновато-коричневый виноградный (Light Russet-Vinaceous)/ в центре колонии, бледнеющих до гиалиновых на краю, край неотчетливый; эксудат, запах и растворимый пигмент отсутствуют; обратная сторона красно- коричневая /темно-бордовая (Dark Vinaceous)/. При 37oC на arape из отвара кукурузной муки и в темноте колония через 6 суток достигает диаметра 82 мм; пленка колонии пушистая на всем протяжении за исключением точки инокулирования, где пленка сдавленная, белая; край целый, белый; эксудат и растворимый пигмент отсутствуют; обратная сторона неокрашенная; присутствует приятный сладковатый запах. Гифы гиалиновые до светло-коричневых, имеющие перегородки, со стенками от гладких до слегка шероховатых, толстостенные, ширина 2.5 - 3.5 мкм. Конидиофоры мононематозные (mononematous), прямостоящие, 150 - 400 х 3.0 - 4.0 мкм, кистеобразно разветвленные, гиалиновые до светло-коричневых, имеющие перегородки, толстостенные, от гладких до едва шероховатых и бородавчатых, иногда с напоминающими оливу окружающими выступами (диаметр 2.5 мкм). Конидиогенные клетки голобластические, терминальные, 16 - 24 х 1.5 - 2.0 мкм, от едва шероховатых до бородавчатых, цилиндрические, искривленные в апексе. Конидии от обратнояйцевидных до продолговато-эллиптических с усеченной точкой присоединения, 4.1 - 5.7 х 1.6 - 2.5 мкм, гиалиновые без перегородок, тонкостенные, продуцированные симподиально из апекса конидиогенной клетки, накапливающиеся в виде апикальной кисти на зубчиках. MF-5954 относят к роду грибов Nodulisporium (Hyphomycetes. Deuteromycotina). Ключевые таксономические характеристики этого рода включают мононематозные кондиофоры, которые типично разветвлены, и симподулезное продуцирование конидий. Кроме того, конидиальные рождающие пространства являются терминальными или интеркалярными и узловатыми вследствие обильного конидиального продуцирования (Jong and Rogers, 1972). Эти особенности отличают род Nodulisporium от других подобных грибов, таких как Geniculosporium, Hylocladium и Ustilina. Эти роды являются бесполым (анаморфным) состоянием многих грибов xylariaceous (Ascomycotina), таких как Hypoxylon, Xylaria, Rosellinia и т.п. В отличие от большинства изолятов Nodulisporium, MF-5954 хорошо растет при 37oC, но не обнаруживает каких-либо других отличительных особенностей, которые связывают его с известными видами. Следовательно, он определяется как вид Nodulisporium. С указанными сведениями можно ознакомиться в нижеперечисленных источниках: Bills, G. F. and Polishook, J.D. 1991 "Microfungi from Carpinus caroliniana". Can. J. Bot. 69 (7): 1477-1482; Jong, S.C. and Rogers, J.D. 1972 "Illustrations and descriptions of conidial states of some Hypoxylon species". Wash. State Agric. Exp. Sta. Tech. Bull. No. 71. 51 p; Ridgway, R. 1912. Color standards and color nomenclature. Publ. by the author, Washington, D.C. 43p. + 53 pl; Singleton, L.L., Mihail, J.D. and Rush, C.M. (Eds) 1992. Methods for research on soliborne phytopatogenic fungi, appendix A, p. 247. APS Press, St. Paul, Minnesota. Соединения настоящего изобретения продуцируются во время аэробного брожения (ферментации) подходящей твердой или жидкой питательной среды при описанных далее условиях продуцирующим штаммом вида Nodulisporium. Водные и твердые среды, такие как среды, используемые для продуцирования многих антибиотических веществ, являются подходящими для применения в способе получения этих полициклических соединений. Такие питательные среды содержат источники углерода и азота, усваиваемые микроорганизмом, и обычно содержат мало неорганических солей. Кроме того, среда ферментации может содержать следы металлов, необходимых для роста микроорганизмов и продуцирования нужных соединений. Они обычно присутствуют в достаточной концентрации в комплексных источниках углерода и азота, которые могут использоваться как источники питания, но могут, конечно, при желании, добавляться в среду отдельно. Вообще, подходящими источниками усваиваемого углерода в питательной среде являются углеводы, такие как сахара, например глюкоза, мальтоза, лактиза, декстрин, церелоза, кукурузная мука, овсяная мука и т.п., и крахмалы. Точное количество источника углерода, которое используется в среде, будет зависеть, в частности, от других ингредиентов среды, но, как правило, считается, что удовлетворительное количество углевода в среде составляет от 1 до 150 мг/л. Такие источники углерода могут использоваться по отдельности или в одной и той же среде могут сочетаться несколько таких источников углерода. Различные источники азота, такие как дрожжевые гидролизаты, дрожжевые автолизаты, дрожжевые клетки, томатная паста, кукурузная мука, овсяная мука, соевый жмых, казеиновые гидролизаты, дрожжевые экстракты, жидкости от замачивания кукурузы, растворимые очистки, хлопковый жмых, мясной экстракт и подобные материалы, легко усваиваются видом Nodulisporium при продуцировании соединения настоящего изобретения. Различные источники азота могут использоваться по отдельности или в сочетании в количестве, составляющем в среде от 1 до 5 мг/л. К числу питательных неорганических солей, которые могут быть включены в культуральную среду, относятся обычные соли, которые могут дать ионы натрия, калия, магния, аммония, кальция, фосфат-, сульфат-, хлорид-, карбонат-ионы и подобные ионы. Включаются также следовые количества металлов, таких как железо, цинк, марганец, медь, бор, молибден и т.п. Следует отметить, что среды, описанные ниже и в примерах, являются только иллюстрациями широкого разнообразия сред, которые могут использоваться, и не предназначаются для ограничения. Далее приводятся примеры сред, пригодных для выращивания штаммов вида Nodulisporium MF-5954, АТСС 74245. Состав среды на скошенном arape Дрожжевой экстракт - 4 г Солодовый экстракт - 10 г Глюкоза - 4 г Бактоагар - 20 г Дистиллированная вода - 1000 мл pH 7 Состав сред для посева и производственных питательных сред Среда для посева Компонент - г/л Дрожжевой экстракт - 4.0 Солодовый экстракт - 8.0 Глюкоза - 4.0 Junlon - 1.5 Среду готовят с дистиллированной водой, доводят pH до 7.0 перед стерилизацией, и разливают по 50 мл в 250-мл колбы Эрленмейера без мешалок (unbaffled). Используют ватные пробки. Стерилизацию проводят при 121oC в течение 20 минут. Производственная питательная среда А 1. Твердая часть Вносят 1250 см3 вермикулита в 4-л вращающуюся колбу. Пробка с латексным уплотнением; автоклавируют в течение 60 мин, плюс сушка в течение 30 мин. 2. Жидкая часть Компонент - г/л Глюкоза - 150.0 Мочевина - 4.0 NZ-амин, тип А - 4.0 K2HPO4 - 0.5 MgSO4 7H2O - 0.25 KCl - 0.25 ZnSO4 7H2O - 0.25 KCl - 0.25 ZnSO4 7H2O - 0.9 CaCO3 - 16.5 Среду готовят с дистиллированной водой (pH не регулируют). Разливают 425 мл в 1-л колбы Эрленмейера. Используют ватные пробки, и среду стерилизуют при 121oC в течение 15 минут. Производственная питательная среда В Компонент - г/л Глицерин - 75.0 Глюкоза - 10.0 Ардамин PH - 5.0 (NH4)2SO4 - 2.0 Соевый жмых - 5.0 Томатная паста - 5.0 Цитрат натрия - 2.0 Среду готовят с дистиллированной водой, доводят pH до 7.0 перед стерилизацией. Среду разливают по 50 мл в 250-мл колбы Эрленмейера без мешалки. Колбы закрывают ватными пробками, и автоклавируют при 121oC в течение 20 минут. Брожение (ферментирование), использующее вид Nodu-lisporium, можно проводить при температуре в интервале от 20oC до 40oC. Для получения оптимальных результатов наиболее удобно проводить такое брожение при температуре в интервале от 22oC до 36oC. Наиболее предпочтительна температура в интервале от 22oC до 27oC. Величина pH питательной среды, подходящая для продуцирования соединений настоящего изобретения, может изменяться от 6.5 до 8.0, и предпочтительным является интервал от 6.8 до 7.3. Ферментацию в небольших масштабах удобно осуществлять, помещая подходящее количество питательной среды в колбу, применяя известные технические приемы стерилизации, инокулируя колбу либо спорами, либо вегетативной клеточной культурой вида Nodulisporium, неплотно закрывая колбу ватной пробкой и давая возможность ферментации протекать при постоянной комнатной температуре 25oC на роторном шейкере при скорости вращения от 95 до 300 об/мин в течение 7-35 суток. При работе в большом масштабе предпочтительно проводить брожение в подходящих чанах, снабженных мешалками и средствами для аэрирования сбраживаемой среды. Питательную среду готовят в чане и после стерилизации инокулируют источником вегетативной клеточной культуры вида Nodulisporium. Дают возможность брожению продолжаться в течение 7-25 суток при перемешивании и/или аэрировании питательной среды при температуре в интервале от 22 до 27oC. Степень аэрирования зависит от ряда факторов, таких как размер ферментера, скорость перемешивания и подобного. Как правило, при сбраживании в крупном масштабе перемешивание осуществляют при 95-300 об/мин и при подаче воздуха от 50 до 500 литров в минуту (л/мин). Выделение соединений настоящего изобретения из цельной культуральной жидкости и извлечение соединения осуществляют посредством экстракции растворителем и применения хроматографического фракционирования, применяя различные технические приемы хроматографии и системы растворителей. Соединения настоящего изобретения обладают незначительной растворимостью в воде, но растворяются в органических растворителях. Это свойство можно использовать для извлечения соединения из цельной культуральной жидкости. Хотя можно использовать любой органический растворитель, предпочтительно применять растворитель, несмешивающийся с водой, такой как этилацетат, метиленхлорид, хлороформ и подобные растворители. Как правило, желательно провести несколько экстракций, чтобы добиться максимального извлечения. Растворитель извлекает соединения настоящего изобретения, а также другие вещества, которые не обладают противопаразитарной активностью соединений настоящего изобретения. Если растворитель является растворителем, несмешивающимся с водой, слои разделяют, и органический растворитель концентрируют при пониженном давлении. Остаток помещают в хроматографическую колонку, содержащую предпочтительно силикагель. Колонка удерживает нужный продукт и некоторые примеси, но многие примеси, особенно неполярные, проходят сквозь колонку. Колонку для дальнейшего удаления примесей промывают умеренно полярным растворителем, таким как метиленхлорид или хлороформ, и затем промывают смесью метиленхлорида или хлороформа с органическими растворителями, из которых предпочтительными являются ацетон, метанол, этанол и подобные растворители. Растворитель испаряют, и остаток далее хроматографируют, применяя колоночную хроматографию, тонкослойную хроматографию, препаративную тонкослойную хроматографию, жидкостную хроматографию высокого давления и т.п., с силикагелем, оксидом алюминия, ионно-обменными смолами, декстрановым гелем и подобными материалами в качестве хроматографической среды, и с различными растворителями и сочетаниями растворителей в качестве элюента. Для обнаружения присутствия соединения настоящего изобретения и его выделения можно использовать тонкослойную хроматографию, жидкостную хроматографию и препаративную тонкослойную хроматографию. Применение упомянутых выше технических приемов, а также других приемов, известных специалистам в этой области техники, будет давать очищенные композиции, содержащие соединения настоящего изобретения. Присутствие нужного соединения определяют посредством проверки различных хроматографических фракций на биологическую активность или по их физико-химическим характеристикам. Оба соединения определяют посредством подробного анализа различных спектральных характеристик соединений, в частности, по их спектрам ядерного магнитного резонанса, масс-спектрам, ультрафиолетовым и инфракрасным спектрам. Пример 1 1. Культура. MF-5954 получают на скошенном агаре и используют для приготовления FVM (замороженные вегетативные мицелии). Часть скошенного агара асептически переносят в среду для посева А (50 мл, 250-мл колба без мешалки). Полученное инкубируют на ротационном шейкере при ходе 5 см (2 дюйма), 220 об/мин, в течение 3 суток при 25oC, относительной влажности (rh) 85% и получают биомассу. Части биомассы переносят в стерильные пробирки, содержащие глицерин, и замораживают (в виде FVM). Их содержат при конечной концентрации 10-15% глицерина при -75oC. Вторичные FVM получают из первичных FVM путем переноса 1.0 мл оттаявшего первичного FVM в среду для посева и инкубации в течение 2-3 суток при 25oC, 220 об/мин, и замораживания, как упоминается выше. 2. Посев. Пробирку с замороженным (FVM) оттаивают при комнатной температуре и используют 0.5-1.0 мл для инокулирования посевными культурами MF-5954 50 мл среды для посева А. Выращивание проводят на ротационном шейкере (220 об/мин) в течение 2-3 суток при 25oC, 85% rh. Иногда применяют вторую стадию. Для ее осуществления 1 мл с первой посевной стадии, описанной выше, разбавляют 50 мл свежей среды А и инкубируют в течение 24-30 часов при 25oC, 220 об/мин., 85% rh. 3. Продуцирование. Композиция, представляющая собой производственную питательную среду А, является твердым субстратом сбраживаемой среды. Аликвоту посева помещают в 425 мл производственной питательной среды А. Колбу энергично вращают, чтобы диспергировать биомассу. Содержимое распределяют путем выливания в 4-л роллер-культуральный сосуд, который содержит 1250 см3 крупнозернистого вермикулита. Содержимое роллер-колбы встряхивают/перемешивают, чтобы обеспечить однородное инокулирование и покрытие. Роллер-колбы инкубируют в горизонтальном положении, вращая их со скоростью приблизительно 4 об/мин на аппарате для вращающихся колб Wheaton, при 22-25oC, 50-75% rh, в течение 19-28 суток, и получают вторичный метаболит в сбраживаемой среде. Проверяют ряд жидких сред для продуцирования соединения настоящего изобретения, с тем чтобы легче можно было осуществить сбраживание в больших сосудах. Обнаружено продуцирование только в небольшом числе испытанных жидких сред. Используют жидкую производственную питательную среду В. Посевные культуры инокулируют так, как описано выше, и выращивают на ротационном шейкере, 220 об/мин, в течение 3 суток при 25oC и 85% rh. Для инокулирования каждой производственной колбы, содержащей 50 мл, используют аликвоту посева (1 мл) (2% инокуляции). Колбы инкубируют на ротационном шейкере (220 об/мин) в течение 21-28 суток при 25oC, 50% rh. Два способа продуцирования, по существу, эквивалентны по количеству производимого продукта. Однако, второй способ (жидкая производственная питательная среда В) имеет то преимущество, что его можно перенести в сосуды с мешалками, с тем чтобы можно было получить большое количество. Способ с твердой производственной питательной средой (роллер-колбы со средой А) расширить и перенести. Более крупные емкости (22-л чаны) также используются для продуцирования соединений настоящего изобретения из этой культуры. Пример 2 Очистка и предварительные исследования Двенадцать 2-литровых роллер-колб, содержащих культуру, выращенную на среде в течение 21 суток, экстрагируют 650 мл метилэтилкетона (МЭК), каждый в течение 4 часов, на вращающем устройстве при 100 об/мин. Экстракты фильтруют, объединяют и упаривают досуха под вакуумом до массы 8 г. Это вещество растворяют в 20 мл метиленхлорида и загружают в 800-мл колонку с силикагелем (E. Merck) в смеси метиленхлорида с метанолом (95: 5). Для элюирования используют по одному объему колонки каждого из следующих растворителей: метиленхлорид: метанол - 95: 5, 9: 1, 3: 1, 1: 1 и метанол. Собирают фракции по 40 мл, и наибольшую активность имеют фракции 51-55, что определяется биоиспытаниями (Lucilia). Фракции объединяют и упаривают досуха под вакуумом, и получают массу 200 мг. Этот образец растворяют в 8.5 мл метанола и загружают в колонку с сефадексом LH20 (Pharmacia) в метаноле, и собирают 13-мл фракции при скорости потока 6.5 мл/мин. Определяют активность, которая присутствует в 41-50 фракциях, и эти фракции объединяют и высушивают, получают массу 90 г. Продукт растворяют в 0.5 метанола, и два впрыскивания, сделанные в колонку для ЖХВР Eka Nobel С-18 (9.6 мм x 250 мм) при комнатной температуре, контролируют при 270 нм при скорости потока 4 мл/мин. Используют систему растворителей, которая представляет собой смесь ацетонитрила с водой, 70: 30, с 0.1% ТФК (TFA), и активный материал выделяют в виде фракций 26-27 при первом выделении и фракций 27-28 при втором выделении. Чистоту соединений проверяют аналитической ЖХВР, колонка Eka-Nobel (4.6 мм x 250 мм, С-18) при скорости потока 1 мл/мин, при 40oC, а также ТСХ для некоторых систем растворителей. Объединенные фракции концентрируют под вакуумом и экстрагируют метиленхлоридом, сушат и получают 4.8 мг чистого соединения (соединения 1). Последующие фракции из вышеупомянутой колонки также являются биоактивными; их можно объединить и доработать до сухого состояния под вакуумом, получая массу 1.4 г. Твердое вещество несколько раз промывают метанолом, и содержащиеся компоненты имеют УФ-спектры, подобные спектрам соединения 1. Эти спектроскопические свойства используют для контроля дальнейших стадий очистки, и биоактивность подтверждают определяют, в конце концов, на чистых соединениях. Так, метанольный раствор, содержащий 500 мг, фракционируют на 250-мл колонке с сефадексом LH-20 в метаноле. Основная масса содержится в таких объединенных фракциях. Материал сушат и снова растворяют в 3 мл метанола, и проводят 1-мл впрыскивания на препаративной колонке С-18 Zorbax (22.5 мм х 250 мм) при комнатной температуре, используя систему растворителей ацетонитрил-вода, 80-20, (0.1% ТФК) при скорости потока 8 мл/мин, с УФ-детекцией при 270 нм, и собирают 8-мл фракции. Фракции 29 каждого из трех фракционирований объединяют и получают соединение 2, и фракции 21-22 содержат соединение 3. Оба раствора концентрируют этилацетатом, экстракты промывают водой и сушат. Соединение 2 имеет массу 1.8 мг, и соединение 3 имеет массу 1.0 мг. Оба соединения характеризуются как аналоги соединения 1 ЯМР и масс-спектральными исследованиями. Масс-спектры при бомбардировке ускоренными атомами (FAB) регистрируются на масс-спектрометре JEOL HX11O. FAB-спектр получают с применением матрицы дитиотреит: дитиоэритрит (20/80). Точные измерения массы осуществляют при высоком разрешении с ультрастандартом 1960 (Fomblin) в качестве соединения сравнения. Важные данные критического высокого разрешения приводятся в таблице в конце описания (соединение 1). Данные 13C ЯМР Спектры 13С ЯМР регистрируют в CD2Cl2 при 100 и 125 МГц на спектрометрах Varian Unity 400 и 500, соответственно, при 25oC. Химические сдвиги приводятся в м. g. относительно тетраметилсилана (ТМС) при нулевом значении м. g. , используя пик растворителя 53.8 m.g. в качестве внутреннего стандарта, Соединение 1 (125 МГц): 198.0, 172.6, 162.0, 154.7, 154.6, 148.0, 140.0, 138.4, 135.9, 134.0, 125.9, 125.1, 122.7, 122.0, 121.8, 117.5*, 116.7, 113.1, 76.8, 76.4*, 75.3, 73.9, 72.6, 58.2, 56.1, 48.0, 47.8, 45.2, 39.1, 32.3, 32.0, 30.1, 29.9, 27.8, 26.0, 25.7, 24.7, 23.5, 19.6, 18.1*, 15.1, 12.6, 11.2 m.g. Число атомов углерода 43 находится в соответствии с молекулярной формулой C43H53NO6, полученной из масс-спектров FAB высокого разрешения. Соединение 2 (100 МГц): 198.1, 172.0, 162.0, 154.8, 147.1, 140.1, 138.3, 135.9, 134.0, 126.8, 122.6, 122.0, 121.8, 117.8*, 116.7, 113.2, 106.9, 76.6*, 75.3, 73.9, 73.3, 72.7, 58.2, 55.5, 49.6, 48.1, 44.5, 41.3, 39.5, 32.0, 30.4, 30.1, 30.0, 29.9, 27.8, 26.0, 24.8, 23.4, 18.0*, 17.7, 16.7, 15.3, 12.5 m. g. Число атомов углерода 43 находится в соответствии с молекулярной формулой C43H53NO7, полученной масс-спектрометрией FAB высокого разрешения. *Атомы углерода, отмеченные звездочкой, наблюдаются как атомы с широким резонансом. Данные 1H ЯМР Спектры 1H ЯМР регистрируют на спектрометрах при 300, 400 или 500 МГц. Химические сдвиги указываются в m. g. относительно ТМС при нулевом значении m.g., используя пики растворителя в качестве внутренних стандартов. Соединение 1 (см. фиг. 1) (500 МГц): 7H2O - 0.9 CaCO3 - 16.5 Среду готовят с дистиллированной водой (pH не регулируют). Разливают 425 мл в 1-л колбы Эрленмейера. Используют ватные пробки, и среду стерилизуют при 121oC в течение 15 минут. Производственная питательная среда В Компонент - г/л Глицерин - 75.0 Глюкоза - 10.0 Ардамин PH - 5.0 (NH4)2SO4 - 2.0 Соевый жмых - 5.0 Томатная паста - 5.0 Цитрат натрия - 2.0 Среду готовят с дистиллированной водой, доводят pH до 7.0 перед стерилизацией. Среду разливают по 50 мл в 250-мл колбы Эрленмейера без мешалки. Колбы закрывают ватными пробками, и автоклавируют при 121oC в течение 20 минут. Брожение (ферментирование), использующее вид Nodu-lisporium, можно проводить при температуре в интервале от 20oC до 40oC. Для получения оптимальных результатов наиболее удобно проводить такое брожение при температуре в интервале от 22oC до 36oC. Наиболее предпочтительна температура в интервале от 22oC до 27oC. Величина pH питательной среды, подходящая для продуцирования соединений настоящего изобретения, может изменяться от 6.5 до 8.0, и предпочтительным является интервал от 6.8 до 7.3. Ферментацию в небольших масштабах удобно осуществлять, помещая подходящее количество питательной среды в колбу, применяя известные технические приемы стерилизации, инокулируя колбу либо спорами, либо вегетативной клеточной культурой вида Nodulisporium, неплотно закрывая колбу ватной пробкой и давая возможность ферментации протекать при постоянной комнатной температуре 25oC на роторном шейкере при скорости вращения от 95 до 300 об/мин в течение 7-35 суток. При работе в большом масштабе предпочтительно проводить брожение в подходящих чанах, снабженных мешалками и средствами для аэрирования сбраживаемой среды. Питательную среду готовят в чане и после стерилизации инокулируют источником вегетативной клеточной культуры вида Nodulisporium. Дают возможность брожению продолжаться в течение 7-25 суток при перемешивании и/или аэрировании питательной среды при температуре в интервале от 22 до 27oC. Степень аэрирования зависит от ряда факторов, таких как размер ферментера, скорость перемешивания и подобного. Как правило, при сбраживании в крупном масштабе перемешивание осуществляют при 95-300 об/мин и при подаче воздуха от 50 до 500 литров в минуту (л/мин). Выделение соединений настоящего изобретения из цельной культуральной жидкости и извлечение соединения осуществляют посредством экстракции растворителем и применения хроматографического фракционирования, применяя различные технические приемы хроматографии и системы растворителей. Соединения настоящего изобретения обладают незначительной растворимостью в воде, но растворяются в органических растворителях. Это свойство можно использовать для извлечения соединения из цельной культуральной жидкости. Хотя можно использовать любой органический растворитель, предпочтительно применять растворитель, несмешивающийся с водой, такой как этилацетат, метиленхлорид, хлороформ и подобные растворители. Как правило, желательно провести несколько экстракций, чтобы добиться максимального извлечения. Растворитель извлекает соединения настоящего изобретения, а также другие вещества, которые не обладают противопаразитарной активностью соединений настоящего изобретения. Если растворитель является растворителем, несмешивающимся с водой, слои разделяют, и органический растворитель концентрируют при пониженном давлении. Остаток помещают в хроматографическую колонку, содержащую предпочтительно силикагель. Колонка удерживает нужный продукт и некоторые примеси, но многие примеси, особенно неполярные, проходят сквозь колонку. Колонку для дальнейшего удаления примесей промывают умеренно полярным растворителем, таким как метиленхлорид или хлороформ, и затем промывают смесью метиленхлорида или хлороформа с органическими растворителями, из которых предпочтительными являются ацетон, метанол, этанол и подобные растворители. Растворитель испаряют, и остаток далее хроматографируют, применяя колоночную хроматографию, тонкослойную хроматографию, препаративную тонкослойную хроматографию, жидкостную хроматографию высокого давления и т.п., с силикагелем, оксидом алюминия, ионно-обменными смолами, декстрановым гелем и подобными материалами в качестве хроматографической среды, и с различными растворителями и сочетаниями растворителей в качестве элюента. Для обнаружения присутствия соединения настоящего изобретения и его выделения можно использовать тонкослойную хроматографию, жидкостную хроматографию и препаративную тонкослойную хроматографию. Применение упомянутых выше технических приемов, а также других приемов, известных специалистам в этой области техники, будет давать очищенные композиции, содержащие соединения настоящего изобретения. Присутствие нужного соединения определяют посредством проверки различных хроматографических фракций на биологическую активность или по их физико-химическим характеристикам. Оба соединения определяют посредством подробного анализа различных спектральных характеристик соединений, в частности, по их спектрам ядерного магнитного резонанса, масс-спектрам, ультрафиолетовым и инфракрасным спектрам. Пример 1 1. Культура. MF-5954 получают на скошенном агаре и используют для приготовления FVM (замороженные вегетативные мицелии). Часть скошенного агара асептически переносят в среду для посева А (50 мл, 250-мл колба без мешалки). Полученное инкубируют на ротационном шейкере при ходе 5 см (2 дюйма), 220 об/мин, в течение 3 суток при 25oC, относительной влажности (rh) 85% и получают биомассу. Части биомассы переносят в стерильные пробирки, содержащие глицерин, и замораживают (в виде FVM). Их содержат при конечной концентрации 10-15% глицерина при -75oC. Вторичные FVM получают из первичных FVM путем переноса 1.0 мл оттаявшего первичного FVM в среду для посева и инкубации в течение 2-3 суток при 25oC, 220 об/мин, и замораживания, как упоминается выше. 2. Посев. Пробирку с замороженным (FVM) оттаивают при комнатной температуре и используют 0.5-1.0 мл для инокулирования посевными культурами MF-5954 50 мл среды для посева А. Выращивание проводят на ротационном шейкере (220 об/мин) в течение 2-3 суток при 25oC, 85% rh. Иногда применяют вторую стадию. Для ее осуществления 1 мл с первой посевной стадии, описанной выше, разбавляют 50 мл свежей среды А и инкубируют в течение 24-30 часов при 25oC, 220 об/мин., 85% rh. 3. Продуцирование. Композиция, представляющая собой производственную питательную среду А, является твердым субстратом сбраживаемой среды. Аликвоту посева помещают в 425 мл производственной питательной среды А. Колбу энергично вращают, чтобы диспергировать биомассу. Содержимое распределяют путем выливания в 4-л роллер-культуральный сосуд, который содержит 1250 см3 крупнозернистого вермикулита. Содержимое роллер-колбы встряхивают/перемешивают, чтобы обеспечить однородное инокулирование и покрытие. Роллер-колбы инкубируют в горизонтальном положении, вращая их со скоростью приблизительно 4 об/мин на аппарате для вращающихся колб Wheaton, при 22-25oC, 50-75% rh, в течение 19-28 суток, и получают вторичный метаболит в сбраживаемой среде. Проверяют ряд жидких сред для продуцирования соединения настоящего изобретения, с тем чтобы легче можно было осуществить сбраживание в больших сосудах. Обнаружено продуцирование только в небольшом числе испытанных жидких сред. Используют жидкую производственную питательную среду В. Посевные культуры инокулируют так, как описано выше, и выращивают на ротационном шейкере, 220 об/мин, в течение 3 суток при 25oC и 85% rh. Для инокулирования каждой производственной колбы, содержащей 50 мл, используют аликвоту посева (1 мл) (2% инокуляции). Колбы инкубируют на ротационном шейкере (220 об/мин) в течение 21-28 суток при 25oC, 50% rh. Два способа продуцирования, по существу, эквивалентны по количеству производимого продукта. Однако, второй способ (жидкая производственная питательная среда В) имеет то преимущество, что его можно перенести в сосуды с мешалками, с тем чтобы можно было получить большое количество. Способ с твердой производственной питательной средой (роллер-колбы со средой А) расширить и перенести. Более крупные емкости (22-л чаны) также используются для продуцирования соединений настоящего изобретения из этой культуры. Пример 2 Очистка и предварительные исследования Двенадцать 2-литровых роллер-колб, содержащих культуру, выращенную на среде в течение 21 суток, экстрагируют 650 мл метилэтилкетона (МЭК), каждый в течение 4 часов, на вращающем устройстве при 100 об/мин. Экстракты фильтруют, объединяют и упаривают досуха под вакуумом до массы 8 г. Это вещество растворяют в 20 мл метиленхлорида и загружают в 800-мл колонку с силикагелем (E. Merck) в смеси метиленхлорида с метанолом (95: 5). Для элюирования используют по одному объему колонки каждого из следующих растворителей: метиленхлорид: метанол - 95: 5, 9: 1, 3: 1, 1: 1 и метанол. Собирают фракции по 40 мл, и наибольшую активность имеют фракции 51-55, что определяется биоиспытаниями (Lucilia). Фракции объединяют и упаривают досуха под вакуумом, и получают массу 200 мг. Этот образец растворяют в 8.5 мл метанола и загружают в колонку с сефадексом LH20 (Pharmacia) в метаноле, и собирают 13-мл фракции при скорости потока 6.5 мл/мин. Определяют активность, которая присутствует в 41-50 фракциях, и эти фракции объединяют и высушивают, получают массу 90 г. Продукт растворяют в 0.5 метанола, и два впрыскивания, сделанные в колонку для ЖХВР Eka Nobel С-18 (9.6 мм x 250 мм) при комнатной температуре, контролируют при 270 нм при скорости потока 4 мл/мин. Используют систему растворителей, которая представляет собой смесь ацетонитрила с водой, 70: 30, с 0.1% ТФК (TFA), и активный материал выделяют в виде фракций 26-27 при первом выделении и фракций 27-28 при втором выделении. Чистоту соединений проверяют аналитической ЖХВР, колонка Eka-Nobel (4.6 мм x 250 мм, С-18) при скорости потока 1 мл/мин, при 40oC, а также ТСХ для некоторых систем растворителей. Объединенные фракции концентрируют под вакуумом и экстрагируют метиленхлоридом, сушат и получают 4.8 мг чистого соединения (соединения 1). Последующие фракции из вышеупомянутой колонки также являются биоактивными; их можно объединить и доработать до сухого состояния под вакуумом, получая массу 1.4 г. Твердое вещество несколько раз промывают метанолом, и содержащиеся компоненты имеют УФ-спектры, подобные спектрам соединения 1. Эти спектроскопические свойства используют для контроля дальнейших стадий очистки, и биоактивность подтверждают определяют, в конце концов, на чистых соединениях. Так, метанольный раствор, содержащий 500 мг, фракционируют на 250-мл колонке с сефадексом LH-20 в метаноле. Основная масса содержится в таких объединенных фракциях. Материал сушат и снова растворяют в 3 мл метанола, и проводят 1-мл впрыскивания на препаративной колонке С-18 Zorbax (22.5 мм х 250 мм) при комнатной температуре, используя систему растворителей ацетонитрил-вода, 80-20, (0.1% ТФК) при скорости потока 8 мл/мин, с УФ-детекцией при 270 нм, и собирают 8-мл фракции. Фракции 29 каждого из трех фракционирований объединяют и получают соединение 2, и фракции 21-22 содержат соединение 3. Оба раствора концентрируют этилацетатом, экстракты промывают водой и сушат. Соединение 2 имеет массу 1.8 мг, и соединение 3 имеет массу 1.0 мг. Оба соединения характеризуются как аналоги соединения 1 ЯМР и масс-спектральными исследованиями. Масс-спектры при бомбардировке ускоренными атомами (FAB) регистрируются на масс-спектрометре JEOL HX11O. FAB-спектр получают с применением матрицы дитиотреит: дитиоэритрит (20/80). Точные измерения массы осуществляют при высоком разрешении с ультрастандартом 1960 (Fomblin) в качестве соединения сравнения. Важные данные критического высокого разрешения приводятся в таблице в конце описания (соединение 1). Данные 13C ЯМР Спектры 13С ЯМР регистрируют в CD2Cl2 при 100 и 125 МГц на спектрометрах Varian Unity 400 и 500, соответственно, при 25oC. Химические сдвиги приводятся в м. g. относительно тетраметилсилана (ТМС) при нулевом значении м. g. , используя пик растворителя 53.8 m.g. в качестве внутреннего стандарта, Соединение 1 (125 МГц): 198.0, 172.6, 162.0, 154.7, 154.6, 148.0, 140.0, 138.4, 135.9, 134.0, 125.9, 125.1, 122.7, 122.0, 121.8, 117.5*, 116.7, 113.1, 76.8, 76.4*, 75.3, 73.9, 72.6, 58.2, 56.1, 48.0, 47.8, 45.2, 39.1, 32.3, 32.0, 30.1, 29.9, 27.8, 26.0, 25.7, 24.7, 23.5, 19.6, 18.1*, 15.1, 12.6, 11.2 m.g. Число атомов углерода 43 находится в соответствии с молекулярной формулой C43H53NO6, полученной из масс-спектров FAB высокого разрешения. Соединение 2 (100 МГц): 198.1, 172.0, 162.0, 154.8, 147.1, 140.1, 138.3, 135.9, 134.0, 126.8, 122.6, 122.0, 121.8, 117.8*, 116.7, 113.2, 106.9, 76.6*, 75.3, 73.9, 73.3, 72.7, 58.2, 55.5, 49.6, 48.1, 44.5, 41.3, 39.5, 32.0, 30.4, 30.1, 30.0, 29.9, 27.8, 26.0, 24.8, 23.4, 18.0*, 17.7, 16.7, 15.3, 12.5 m. g. Число атомов углерода 43 находится в соответствии с молекулярной формулой C43H53NO7, полученной масс-спектрометрией FAB высокого разрешения. *Атомы углерода, отмеченные звездочкой, наблюдаются как атомы с широким резонансом. Данные 1H ЯМР Спектры 1H ЯМР регистрируют на спектрометрах при 300, 400 или 500 МГц. Химические сдвиги указываются в m. g. относительно ТМС при нулевом значении m.g., используя пики растворителя в качестве внутренних стандартов. Соединение 1 (см. фиг. 1) (500 МГц):  0.96 (3H, с.), 1.07(3Н, с.), 1.12(3H, с. ), 1.14(3H, с. ), 1.31(3H, с.), 1.33(3H, с.), 1.42(3H, с.), ~ 1.46(3Н, ш. с.), 1.96(3H, д., J=1 Гц), 2.32(1Н, д.д., J=11.14 Гц), 2.75(1Н, д. д., J=6.5, 14 Гц), 2.81(1Н, д.д., J=3, 6.0 Гц), 2.85(1Н, м.), 3.43(1Н, м. ), 4.96 (1Н, ш.с.), 5.09(1Н, с.), 5.20(1Н, ш.с.), 5.22(1Н, д., J=6.0 Гц), 5.95(1Н, д. , J= 15 Гц), 6.06 (1Н, д., J=3 Гц), 6.40(1Н, д.д, J=11,15 Гц), 7.3(1Н, ш.д., J~11 Гц), 7.71 (1Н, с.) Соединение 2 (см. фиг. 2) (400 МГц): 0.96 (3H, с.), 1.07(3Н, с.), 1.12(3H, с. ), 1.14(3H, с. ), 1.31(3H, с.), 1.33(3H, с.), 1.42(3H, с.), ~ 1.46(3Н, ш. с.), 1.96(3H, д., J=1 Гц), 2.32(1Н, д.д., J=11.14 Гц), 2.75(1Н, д. д., J=6.5, 14 Гц), 2.81(1Н, д.д., J=3, 6.0 Гц), 2.85(1Н, м.), 3.43(1Н, м. ), 4.96 (1Н, ш.с.), 5.09(1Н, с.), 5.20(1Н, ш.с.), 5.22(1Н, д., J=6.0 Гц), 5.95(1Н, д. , J= 15 Гц), 6.06 (1Н, д., J=3 Гц), 6.40(1Н, д.д, J=11,15 Гц), 7.3(1Н, ш.д., J~11 Гц), 7.71 (1Н, с.) Соединение 2 (см. фиг. 2) (400 МГц):  0.95 (3H, с.), 1.07(3H, с.), 1.122(3H, с. ), 1.126(3H, с.), 1.31 (3H, с.), 1.34(3H, с.), 1.42(6H, с.), 1.73(1Н, д.д., J=9.5, 12.5 Гц), 1.86(3H, д., J=1.5 Гц), 2.34(1Н, ш.д.д., J= 7.5, 12,5 Гц), 2.36(1Н, д.д., J=11,14 Гц), 2.78(1Н, д.д., J=6.5, 14 Гц), 2.81(1Н, д.д., J=3, 6.5 Гц), 2.93(1Н, м.), 4.88(H, ш.к., J~8 Гц), 5.00 (1Н, ш. с. ), 5.10(1Н, с. ), 5.20(1Н, д. к., J~1 Гц), 5.21(1Н, д., J=6.5 Гц), 6.06(1Н, д., J=3 Гц), 6.93 (1Н, д.к., J=8, 1.5), 7.72(1Н, с.). Соединение 3 (см. фиг. 3) (300 МГц): 0.95 (3H, с.), 1.07(3H, с.), 1.122(3H, с. ), 1.126(3H, с.), 1.31 (3H, с.), 1.34(3H, с.), 1.42(6H, с.), 1.73(1Н, д.д., J=9.5, 12.5 Гц), 1.86(3H, д., J=1.5 Гц), 2.34(1Н, ш.д.д., J= 7.5, 12,5 Гц), 2.36(1Н, д.д., J=11,14 Гц), 2.78(1Н, д.д., J=6.5, 14 Гц), 2.81(1Н, д.д., J=3, 6.5 Гц), 2.93(1Н, м.), 4.88(H, ш.к., J~8 Гц), 5.00 (1Н, ш. с. ), 5.10(1Н, с. ), 5.20(1Н, д. к., J~1 Гц), 5.21(1Н, д., J=6.5 Гц), 6.06(1Н, д., J=3 Гц), 6.93 (1Н, д.к., J=8, 1.5), 7.72(1Н, с.). Соединение 3 (см. фиг. 3) (300 МГц):  0.91 (3H,с.), 1.05(3H, с.), 1.09(3H, с.), 1.11(3H, д., J~7.5 Гц), 1.13(3H, с.), 1.33(H, с.), 1.34(3H, с. ), 1.47(3H, с. ), 2.30 (1Н, д.д., J=10.5, 13.5 Гц), 2.72(1Н, д.д., J=6.5, 13.5 Гц), 2.87 (1Н, д. д., J=3, 6.0 Гц), 4.00(1Н, д.д., J=2.5, 10.5 Гц), 4.58(1Н, м.), 5.02(1Н, ш.с.), 5.07(1Н, с.), 5.17(1Н, ш.с.), 5.23 (1Н, д., J= 6.0 Гц), 6.02(1Н, д., J=3 Гц), 7.67 (1Н, с.). Сокращения: с. = синглет, д. = дублет, к. = квартет, ш. = широкий, м. = мультиплет, J = константа взаимодействия 1H-1H в герцах ( 0.91 (3H,с.), 1.05(3H, с.), 1.09(3H, с.), 1.11(3H, д., J~7.5 Гц), 1.13(3H, с.), 1.33(H, с.), 1.34(3H, с. ), 1.47(3H, с. ), 2.30 (1Н, д.д., J=10.5, 13.5 Гц), 2.72(1Н, д.д., J=6.5, 13.5 Гц), 2.87 (1Н, д. д., J=3, 6.0 Гц), 4.00(1Н, д.д., J=2.5, 10.5 Гц), 4.58(1Н, м.), 5.02(1Н, ш.с.), 5.07(1Н, с.), 5.17(1Н, ш.с.), 5.23 (1Н, д., J= 6.0 Гц), 6.02(1Н, д., J=3 Гц), 7.67 (1Н, с.). Сокращения: с. = синглет, д. = дублет, к. = квартет, ш. = широкий, м. = мультиплет, J = константа взаимодействия 1H-1H в герцах (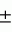 0.5 Гц), 0.5 Гц), 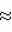 = приблизительно. Пример испытаний А: в отношении личинок комаров Методика: личинки Aedes aegypti в возрасте 1 суток в водной среде, дополненной дрожжами Baker, обрабатывают испытуемым соединением в DMCO. Число двигающихся (живых) личинок подсчитывалось через 24 и 48 часов после обработки; через 48 часов регистрируют число личинок, прошедших линьку. Оценку активности личинок в баллах осуществляют через 48 часов по следующей шкале оценок: 3 - нет движущихся личинок; 2 - по меньшей мере 50% личинок не движутся; 1 - по меньшей мере 50% личинок движутся, но ни одна не завершила линьку; 0 - более 50% личинок движутся и некоторые завершили линьку. Результаты: Соединение 1: концентрации от 0,4 ч/млн и выше (до 50 ч/млн) - оценка 3; концентрации от 0,1 ч/млн и ниже -оценка 0; Соединение 2: концентрации от 2 ч/млн и выше (до 50 ч/млн) - оценка 3; концентрации от 0,4 ч/млн и ниже - оценка 0; Соединение 3: концентрации от 2 ч/млн и выше (до 50 ч/млн) - оценка 3; концентрации от 0,2 ч/млн и ниже оценка 0; Пример испытаний В: в отношении личинок Lucillia serricata Методика: Личинки первой возрастной стадии Lucillia serricata культивируют в среде из сыворотки крови ягнят, закрытой небольшим ватным тампоном. Испытуемые соединения вносили в культуры в растворах DMCO, метилэтилкетона и метиленхлорида. Активность соединений оценивали в течение 48 часов после обработки, регистрируя движение и нормальный рост личинок. Шкала оценок соединений: 3 - полностью активны; 2 - частично активны; 1 - слабоактивны; 0 - отсутствие активности. Результаты: Соединение 1: концентрации от 0,8 ч/млн и выше (до 200 ч/млн) - оценка 3; концентрации от 0,02 ч/млн и ниже -оценка 0; Соединение 2: концентрации от 20 ч/млн и выше (до 200 ч/млн) - оценка 3; концентрация 4 ч/млн - оценка 1; концентрации от 2 ч/млн и ниже -оценка 0; Соединение 3: концентрации от 20 ч/млн и выше (до 200 ч/млн) - оценка 3; концентрации от 4 ч/млн и ниже оценка 0; = приблизительно. Пример испытаний А: в отношении личинок комаров Методика: личинки Aedes aegypti в возрасте 1 суток в водной среде, дополненной дрожжами Baker, обрабатывают испытуемым соединением в DMCO. Число двигающихся (живых) личинок подсчитывалось через 24 и 48 часов после обработки; через 48 часов регистрируют число личинок, прошедших линьку. Оценку активности личинок в баллах осуществляют через 48 часов по следующей шкале оценок: 3 - нет движущихся личинок; 2 - по меньшей мере 50% личинок не движутся; 1 - по меньшей мере 50% личинок движутся, но ни одна не завершила линьку; 0 - более 50% личинок движутся и некоторые завершили линьку. Результаты: Соединение 1: концентрации от 0,4 ч/млн и выше (до 50 ч/млн) - оценка 3; концентрации от 0,1 ч/млн и ниже -оценка 0; Соединение 2: концентрации от 2 ч/млн и выше (до 50 ч/млн) - оценка 3; концентрации от 0,4 ч/млн и ниже - оценка 0; Соединение 3: концентрации от 2 ч/млн и выше (до 50 ч/млн) - оценка 3; концентрации от 0,2 ч/млн и ниже оценка 0; Пример испытаний В: в отношении личинок Lucillia serricata Методика: Личинки первой возрастной стадии Lucillia serricata культивируют в среде из сыворотки крови ягнят, закрытой небольшим ватным тампоном. Испытуемые соединения вносили в культуры в растворах DMCO, метилэтилкетона и метиленхлорида. Активность соединений оценивали в течение 48 часов после обработки, регистрируя движение и нормальный рост личинок. Шкала оценок соединений: 3 - полностью активны; 2 - частично активны; 1 - слабоактивны; 0 - отсутствие активности. Результаты: Соединение 1: концентрации от 0,8 ч/млн и выше (до 200 ч/млн) - оценка 3; концентрации от 0,02 ч/млн и ниже -оценка 0; Соединение 2: концентрации от 20 ч/млн и выше (до 200 ч/млн) - оценка 3; концентрация 4 ч/млн - оценка 1; концентрации от 2 ч/млн и ниже -оценка 0; Соединение 3: концентрации от 20 ч/млн и выше (до 200 ч/млн) - оценка 3; концентрации от 4 ч/млн и ниже оценка 0;
ФОРМУЛА ИЗОБРЕТЕНИЯ1. Полициклические соединения общей формулы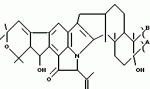 где А представляет собой водород, а В является группой формулы где А представляет собой водород, а В является группой формулы 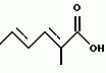 либо А и В, взятые вместе, образуют циклическую группу: либо А и В, взятые вместе, образуют циклическую группу: 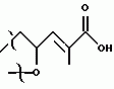 или или 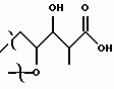 2. Способ получения соединения по п.1, включающий ферментацию штамма-продуцента в питательной среде, содержащей источники углерода, азота и микроэлементов, с последующим выделением целевого продукта, отличающийся тем, что в качестве продуцента ферментируют штамм гриба Nodulisporium MF 5954 (АТСС 74245). 3. Способ подавления паразитарных инфекций путем применения к зараженному живому организму эффективного количества активного вещества, отличающийся тем, что в качестве такого вещества используют соединение по п.1. 4. Способ по п.3, отличающийся тем, что зараженным живым организмом является организм животного. 5. Способ по п.3, отличающийся тем, что зараженным организмом является растение или растительная культура, а применение включает обработку растений или почвы, в которой они произрастают. 6. Противопаразитная композиция, включающая инертный носитель и активный компонент, отличающаяся тем, что в качестве активного компонента включает соединение по п.1. 7. Композиция по п.6, полезная для лечения паразитарных инфекций растений. 8. Композиция по п.6, полезная для лечения паразитарных инфекций животных. 9. Штамм гриба Nodulisporium MF 5954 (АТСС 74245) - продуцент соединения по п.1. 2. Способ получения соединения по п.1, включающий ферментацию штамма-продуцента в питательной среде, содержащей источники углерода, азота и микроэлементов, с последующим выделением целевого продукта, отличающийся тем, что в качестве продуцента ферментируют штамм гриба Nodulisporium MF 5954 (АТСС 74245). 3. Способ подавления паразитарных инфекций путем применения к зараженному живому организму эффективного количества активного вещества, отличающийся тем, что в качестве такого вещества используют соединение по п.1. 4. Способ по п.3, отличающийся тем, что зараженным живым организмом является организм животного. 5. Способ по п.3, отличающийся тем, что зараженным организмом является растение или растительная культура, а применение включает обработку растений или почвы, в которой они произрастают. 6. Противопаразитная композиция, включающая инертный носитель и активный компонент, отличающаяся тем, что в качестве активного компонента включает соединение по п.1. 7. Композиция по п.6, полезная для лечения паразитарных инфекций растений. 8. Композиция по п.6, полезная для лечения паразитарных инфекций животных. 9. Штамм гриба Nodulisporium MF 5954 (АТСС 74245) - продуцент соединения по п.1.Популярные патенты: 2188534 Способ уборки льна-долгунца ... которым расстилается по льнищу для дальнейшей вылежки стеблей в тресту или формирования паковок льносоломы. Предлагаемый способ уборки льна-долгунца проверен в полевых условиях с использованием изготовленного образца льноуборочной машины. Формула изобретения Способ уборки льна-долгунца, включающий теребление льна с расстилом вытеребленных стеблей в ленту, сушку неочесанного льна в ленте, подбор просохшей ленты, очес семенных коробочек со стеблей, оборачивание ленты и ее повторный расстил для последующей вылежки в тресту или формирования паковок льносоломы, отличающийся тем, что оборачивание ленты производят после ее подбора до очеса семенных коробочек со стеблей. MM4A - ... 2414113 Способ и комплекс для обработки зерна, семян или плодоовощной продукции озоном ... высота насыпи или штабеля. В комплекс может быть введен распределительный коллектор 21 (фиг.3, 4), размещенный вдоль насыпи 10 или штабеля 11 и соединенный с одной стороны гибкими эластичными трубами 22 с перфорированной трубой 1, выполненной из n-ного количества перфорированных труб 20, а с другой стороны - с подводящим рукавом 9. Чехол 12 может быть расположен на трубах 23 (фиг.1, 2, 3, 4), размещенных на насыпи 10 или штабеле 11, изогнутых по форме сечения насыпи 10 или штабеля 11 (фиг.5. 6) и равномерно размещенных по их длине (фиг.1, 2, 3, 4).Чехол 12 может быть расположен на трубе 24, размещенной наверху насыпи 10 (фиг.7) или штабеля 11 параллельно их основанию.Способ ... 2399200 Устройство для обработки роговых образований животных, например крупного рогатого скота ... пилу, расположенную соосно с наружной дисковой пилой, имеющей габаритные размеры, равные размерам внутренней дисковой пилы, и расположенную в непосредственной близости от нее, при этом привод внутренней дисковой пилы выполнен с возможностью встречного вращения относительно наружной дисковой пилы, причем оно кроме основной части имеет дополнительную часть, причем основная часть имеет в корпусе-рукоятке автономный источник электроэнергии или преобразователь электротока, а дополнительная часть содержит емкость с двумя раздельными герметичными полостями, имеющими внизу конусные гнезда для размещения и перемещения в них конусных частей штоков, снабженных металлическими экранами с ... 2157612 Способ уборки корней растений, преимущественно лакрицы, и устройство для его осуществления ... на дополнительной раме, снабжен поперечными горизонтальным и наклонным транспортерами и штангой с распылителями жидкости, гидравлически соединенной с прицепной емкостью; дополнительная рама соединена шарнирно с основной рамой и снабжена пневматическими колесами, размещенными на флюгерных вилках; штанга c распылителями жидкости соединена с прицепной емкостью посредством дистанционно управляемого вентиля; снабженная контрольным манометром прицепная емкость соединена пневмопроводом с рессивером и компрессором агрегатируемого трактора; рабочий орган для подкапывания корнесодержащего пласта выполнен в виде U-образного лемеха, рабочий орган для подъема корнесодержащего пласта ... 2166252 Способ удаления костного мозга из губчатых костных трансплантатов ... эвакуации из биологических структур патологического содержимого и отработанных промывных жидкостей. Спонгиоза, являясь биологической тканью, рассматривается как капиллярно-пористая структура, заполненная водными растворами ионов и молекул различных веществ. "Ультразвуковой насос" способен обеспечить очистку труднодоступных узких полостей губчатой костной ткани, разрушая клетки и клеточные структуры, в том числе и жировые. Были проведены испытания по удалению костного мозга из губчатых костных трансплантатов по известной методике (Приказ министра здравоохранения СССР, N 482, г. Москва от 14.06.72) и по предлагаемому способу с использованием ультразвуковых колебаний. Нативный ... |
Еще из этого раздела: 2028763 Измельчитель древесной поросли 2260932 Способ уборки льна и тресты при неблагоприятных погодных условиях 2245013 Устройство для обмолота легкоповрежденных культур на примере нута (варианты) 2078495 Устройство для транспортирования кормов в хранилищах башенного типа 2233582 Устройство для охлаждения молока 2241322 Навесное устройство трактора 2479996 Экологический комплекс для аквакультуры и рекультивации морских вод 2120709 Рама плуга 2053661 Устройство для сколачивания ульевых рамок 2269892 Способ выращивания цыплят-бройлеров |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||