Среда для консервации роговицы донораПатент на изобретение №: 2138163 Автор: Каспаров А.А., Розинова В.Н., Ямскова В.П., Наим Ю.Н. Патентообладатель: Розинова Вера Николаевна Дата публикации: 27 Сентября, 1999 Начало действия патента: 20 Июня, 1997 Адрес для переписки: 119021, Москва, ул.Россолимо, д.11, НИИ ГБ РАМН, Розиновой В.Н. Изображения  Изобретение относится к области медицины, а именно - к офтальмологии, и может найти применение при создании банка роговиц. В используемой жидкой питательной среде подобраны оптимальные соотношения составляющих компонентов для переживания донорского корнеосклерального лоскута, что способствует сохранению адекватной плотности заднего эпителия роговицы в процессе ее консервирования и обеспечивает поддержание нормальной толщины и прозрачности роговицы у больных с пересаженными трансплантатами из среды с адгелоном. Технический результат - повышение качества консервированного трансплантата для сквозной кератопластики за счет стимулирования адгелоном регенерации поврежденного эндотелия роговицы донора. 2 ил. , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУИзобретение относится к области медицины, а именно к офтальмологии, и может найти применение при создании банка роговиц. Известен способ консервации донорских роговиц в жидких питательных средах, позволяющий создать запас высококачественной, жизнеспособной донорской ткани для осуществления успешной сквозной кератопластики (СКП) (Cornealsurgery. Theory, Technique and Tissue. Ed. F.S. Brightbill, M.D. The C.N. Mosby, Company. S.T. Louis-Washington, D.C.-Toronto, 1986, 775 p.). Консервация донорских роговиц в жидких питательных средах была начата Mc Carey B.E. и Kaufman H.E. в 1974 году (Invest. Ophthalmol., - 1974, - 13, - 165 - 173). Созданная этими исследователями среда М-К представляла собой смесь среды Е-199, декстрана, бикарбонатного буфера, пенициллина и стрептомицина. Позднее ряд исследователей представили данные об использовании питательной среды для консервации роговиц в комплексе с хондроитин сульфатом (среда K-Sol) /Stein R.M., Bourne W.M., Campbell R.J./Arch. Ophthalmol., - 1986, - vol. 104, - p.p. 1358 - 1361/. Консервация роговиц в среде K-Sol дала наиболее хорошие результаты по сравнению со средой М-К (в ней значительно менее выражен отек роговицы). Недостатком этого способа являются неизбежные механические повреждения эндотелия роговицы в процессе оценки, стерилизации, выкраивания корнеосклерального лоскута из донорских глаз при создании глазного банка, а также ограничение сроков хранения в этих средах пригодных для СКП трансплантатов до 4 - 5 суток. Сравнительный анализ переживания донорских роговиц в средах М-К, K-Sol и среде с адгелоном показал, что роговицы, хранившиеся в среде с адгелоном характеризовались более высоким уровнем поддержания структурной и функциональной целостности: при сроках хранения до 7 суток включительно целостность эндотелиального монослоя была сохранена. Послеоперационный подсчет эндотелиальных клеток (ЭК) и пахиметрия в зеркальном микроскопе у больных с пересаженными трансплантатами из среды с адгелоном также показали лучшую сохранность роговичной ткани и ее функции, по сравнению с трансплантатами, хранившимися в среде М-К и K-Sol. Технический результат, достигаемый изобретением, - возможность стимулировать репаративную регенерацию поврежденных элементов роговицы, неизбежных при ручных и инструментальных манипуляциях с донорскими глазами при заготовке корнеосклеральных трансплантатов, благодаря чему восстанавливается структурная организация клеточных элементов, в частности заднего эпителия роговицы (ЗЭР). Сохранение адекватной плотности ЗЭР в процессе консервирования донорского материала обеспечивает поддержание нормальной толщины и прозрачности роговицы, т.е. значительно улучшает качество трансплантата для СКП. Сущность изобретения заключается в достижении упомянутого технического результата благодаря использованию среды для среднепродолжительной консервации роговицы донора, содержащей питательную среду культуры тканей Т-199, HEPES-буфер для стабилизации pH среды до 7,3, декстран-40, смесь антибиотиков, витамины, электролиты, глюкозу и адгелон с возможным разбросом ингредиентов на 1 л среды 199 в пределах: HEPES-буфер (IM) - 15 мМ - 20 мМ - 25 мМ декстран (мол.вес 40000) - 25 г - 30 г - 50 г (2,5% - 3,5% - 5%) ампициллин - 100 мг - 150 мг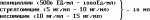 глицин (2,0 мг/л) - 1 мл глицин (2,0 мг/л) - 1 мл 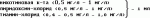 биотин - 0,05 мг - 0,1 мг - 0,5 мг фолиевая к-та - 0,5 мг - 1,0 мг хлорид кальция - 166,0 мг - 332 мг сульфат магния - 120,0 мг - 180 мг фосфат калия - 80 мг - 160 мг - 170 мг глюкоза - 100 г - 450 г адгелон - 10-13 М/мл р-ра - 5 мл Оптимальное соотношение составляющих веществ в используемой среде указано в методике приготовления среды. Методика приготовления среды и консервация в ней роговицы донора осуществляется следующим образом. В стерильном боксе (ламинарном шкафу) берется флакон с готовой средой 199 (1,0 л) фирмы Sigma (США), куда с соблюдением всех правил асептики стерильной мерной пипеткой добавляется 20 мМ HEPES-буфера (1 М) фирмы Sigma (США), отдельной стерильной пипеткой из готового флакона со 100 мл смеси антибиотиков (пенициллин-стрептомицин-неомицин) той же фирмы вливается 10 мл вышеуказанных антибиотиков в концентрации 5000 ЕД/мл, 5 мг/мл, 10 мг/мл соответственно и высыпается 100 мг ампициллина для инъекций из отдельного флакона фирмы Pharmachim (Болгария). Из готового пузырька с 25 мл смеси витаминов фирмы Bio Whittaker (США) другой пипеткой добавляется 1 мл витаминного раствора, содержащего 2,0 мг/л глицина, 0,5 мг/л никотиновой к-ты, 0,5 мг/л витамина B6, 0,5 мг/л витамина B1. Раздельные навески биотина (0,05 мг) фирмы Sigma (США) и фолиевой к-ты (0,5 мг) этой же фирмы делались в боксе на торсионных весах со стерильными чашечками, после чего высыпались во флакон со средой. Таким же образом туда добавлялись стерильные навески электролитов (332 мг хлорида кальция, 180 мг сульфата магния и 170 мг фосфата калия) фирмы Sigma. Стерильный порошок глюкозы той же фирмы отвешивался на стерильных чашках аптекарских весов (450 г), после чего высыпался в флакон со средой. Далее в полученный состав добавляли 5 мл адгелона (мол. масса 6 килодальтон) в концентрации 10-13 М/мл раствора, полученного в Институте биологии развития им. Н.К. Кольцова РАН из супернатанта сыворотки крови животных и человека. Трупные глаза забираются не позднее 12 часов с момента констатации смерти донора. Перед консервированием роговицы донорских глаз тщательно исследовались в щелевой лампе фирмы "Opton" для выявления эпителиальной и стромальной патологии. Контроль состояния ЗЭР осуществлялся с помощью зеркального энотелиального микроскопа фирмы "Keeler-Canon", который позволял провести пахиметрию и морфометрический анализ ЗЭР. Для консервации донорских роговиц отбирались лишь те, потери в плотности ЭК которых не превышали 15% и которые содержали не менее 2500 ЭК в 1 мм2. После биомикроскопического осмотра роговицы, формы и размеров зрачка, делалась адреналиновая проба (0,1% р-р солянокислого адреналина). Глаза с положительной адреналиновой пробой перед иссечением из них корнеосклерального лоскута стерилизовались в течение 5-7 минут по разработанному в нашем отделе способу в смеси раствора хлоргексидина и гентамицина соответственно 0,02% и 0,125% концентрации (А.А. Каспаров с соавт., 1990). Затем кадаверные глаза дважды ополаскивались в стерильном физиологическом р-ре, после чего из них выкраивался корнеосклеральный лоскут, который помещался в стерильный контейнер с герметически закрывающейся крышкой, содержащим 20 мл питательной среды с адгелоном. Законсервированные роговицы хранились при тем-ре 4oC в холодильнике. Все манипуляции осуществлялись в стерильном боксе с соблюдением всех правил асептики и проведением посевов на стерильность в бактериологической лаборатории заготовленных роговиц. Полученные трансплантаты хранились в среде с адгелоном в течение 1 - 7 дней, после чего использовались для СКП больным с разнообразной патологией роговицы. За время переживания роговицы в жидкой питательной среде кровь этого донора тестировалась на гепатоциты B и C, СПИД и сифилис. Перед СКП эндотелиальный монослой консервированной парной роговицы исследовался в световом микроскопе на плоскостных пленочных препаратах, импрегнированных азотнокислым серебром и окрашенных гематоксилином, что позволяло осуществлять качественную и количественную оценку состояния ЗЭР. В послеоперационном периоде трансплантаты реципиентов изучались с помощью зеркального микроскопа в сроки 1 неделя и 3 месяца после СКП. Примеры характеристик донорских роговиц, консервированных в жидкой питательной среде с адгелоном, использованных для СКП. Пример 1. Донор - муж. 30 лет, скончался в результате механической асфиксии (повешение). Срок после смерти до аутопсии (выделения глазных яблок) - 10 часов; срок после смерти до консервации роговиц в питательной среде с адгелоном - 12 часов. Количество ЭК в 1 мм2 при зеркальной микроскопии глаз донора перед консервацией: OD - 2900; OS - 3000. Срок консервации роговиц в питательной среде - 4 суток. Состояние ЭК на плоскостном пленочном препарате правой роговицы спустя 4 суток хранения оставалось без изменений по сравнению нормой (фиг. 1-а). На фиг. 1-б - эндотелий роговицы, хранившейся в среде М-К в течение 4-х дней: видны участки с усиленной аргирофилией ЭК (некробиотические изменения клеток). Произведена субтотальная кератопластика реципиенту 47 лет с герпетическим кератитом, микроперфорацией роговицы, десцементоцеле. Для операции была использована роговица левого глаза донора, хранившаяся в среде с адгелоном в течение 4 суток. Операционный и послеоперационный периоды - без осложнений. Сквозной трансплантат роговицы с 1-х суток до 3-х месяцев оставался прозрачным; количество ЭК к 3-му месяцу послеоперационного периода - 2500. Пример 2. Донор - муж. 28 лет, скончался от отравления этиловым спиртом. Срок после смерти до вскрытия - 11 часов; срок после смерти до консервации роговиц в питательной среде с адгелоном - 12 часов. Количество ЭК в 1 мм2 при зеркальной микроскопии глаз донора перед консервацией роговицы: OD - 3100; OS - 3100. Срок консервации роговиц в питательной среде - 7 суток. В правой роговице спустя 7 суток ее хранения целостность эндотелиального монослоя была сохранена; в отдельных полях зрения можно было видеть единичные крупные моноядерные ЭК, которые свидетельствовали о регенерационных процессах и новообразовании монослоя (фиг. 2-а). На фиг. 2-б - эндотелий роговицы, хранившейся в среде K-Sol в течение 7 дней: видна деструкция ЭК (до 20%). Произведена ургентная СКП больной 56 лет с гнойным кератоиридоциклитом, начинающимся эндофтальмитом. Для СКП была использована роговица левого глаза донора, хранившаяся в среде с адгелоном в течение 7 суток. Операционный и послеоперационный периоды без осложнений. Сквозной трансплантат роговицы в первые сутки был полупрозрачным, а через 3 месяца - прозрачный; количество ЭК к 3-му месяцу послеоперационного периода - 2210. Изобретение поясняется микрофотографиями. биотин - 0,05 мг - 0,1 мг - 0,5 мг фолиевая к-та - 0,5 мг - 1,0 мг хлорид кальция - 166,0 мг - 332 мг сульфат магния - 120,0 мг - 180 мг фосфат калия - 80 мг - 160 мг - 170 мг глюкоза - 100 г - 450 г адгелон - 10-13 М/мл р-ра - 5 мл Оптимальное соотношение составляющих веществ в используемой среде указано в методике приготовления среды. Методика приготовления среды и консервация в ней роговицы донора осуществляется следующим образом. В стерильном боксе (ламинарном шкафу) берется флакон с готовой средой 199 (1,0 л) фирмы Sigma (США), куда с соблюдением всех правил асептики стерильной мерной пипеткой добавляется 20 мМ HEPES-буфера (1 М) фирмы Sigma (США), отдельной стерильной пипеткой из готового флакона со 100 мл смеси антибиотиков (пенициллин-стрептомицин-неомицин) той же фирмы вливается 10 мл вышеуказанных антибиотиков в концентрации 5000 ЕД/мл, 5 мг/мл, 10 мг/мл соответственно и высыпается 100 мг ампициллина для инъекций из отдельного флакона фирмы Pharmachim (Болгария). Из готового пузырька с 25 мл смеси витаминов фирмы Bio Whittaker (США) другой пипеткой добавляется 1 мл витаминного раствора, содержащего 2,0 мг/л глицина, 0,5 мг/л никотиновой к-ты, 0,5 мг/л витамина B6, 0,5 мг/л витамина B1. Раздельные навески биотина (0,05 мг) фирмы Sigma (США) и фолиевой к-ты (0,5 мг) этой же фирмы делались в боксе на торсионных весах со стерильными чашечками, после чего высыпались во флакон со средой. Таким же образом туда добавлялись стерильные навески электролитов (332 мг хлорида кальция, 180 мг сульфата магния и 170 мг фосфата калия) фирмы Sigma. Стерильный порошок глюкозы той же фирмы отвешивался на стерильных чашках аптекарских весов (450 г), после чего высыпался в флакон со средой. Далее в полученный состав добавляли 5 мл адгелона (мол. масса 6 килодальтон) в концентрации 10-13 М/мл раствора, полученного в Институте биологии развития им. Н.К. Кольцова РАН из супернатанта сыворотки крови животных и человека. Трупные глаза забираются не позднее 12 часов с момента констатации смерти донора. Перед консервированием роговицы донорских глаз тщательно исследовались в щелевой лампе фирмы "Opton" для выявления эпителиальной и стромальной патологии. Контроль состояния ЗЭР осуществлялся с помощью зеркального энотелиального микроскопа фирмы "Keeler-Canon", который позволял провести пахиметрию и морфометрический анализ ЗЭР. Для консервации донорских роговиц отбирались лишь те, потери в плотности ЭК которых не превышали 15% и которые содержали не менее 2500 ЭК в 1 мм2. После биомикроскопического осмотра роговицы, формы и размеров зрачка, делалась адреналиновая проба (0,1% р-р солянокислого адреналина). Глаза с положительной адреналиновой пробой перед иссечением из них корнеосклерального лоскута стерилизовались в течение 5-7 минут по разработанному в нашем отделе способу в смеси раствора хлоргексидина и гентамицина соответственно 0,02% и 0,125% концентрации (А.А. Каспаров с соавт., 1990). Затем кадаверные глаза дважды ополаскивались в стерильном физиологическом р-ре, после чего из них выкраивался корнеосклеральный лоскут, который помещался в стерильный контейнер с герметически закрывающейся крышкой, содержащим 20 мл питательной среды с адгелоном. Законсервированные роговицы хранились при тем-ре 4oC в холодильнике. Все манипуляции осуществлялись в стерильном боксе с соблюдением всех правил асептики и проведением посевов на стерильность в бактериологической лаборатории заготовленных роговиц. Полученные трансплантаты хранились в среде с адгелоном в течение 1 - 7 дней, после чего использовались для СКП больным с разнообразной патологией роговицы. За время переживания роговицы в жидкой питательной среде кровь этого донора тестировалась на гепатоциты B и C, СПИД и сифилис. Перед СКП эндотелиальный монослой консервированной парной роговицы исследовался в световом микроскопе на плоскостных пленочных препаратах, импрегнированных азотнокислым серебром и окрашенных гематоксилином, что позволяло осуществлять качественную и количественную оценку состояния ЗЭР. В послеоперационном периоде трансплантаты реципиентов изучались с помощью зеркального микроскопа в сроки 1 неделя и 3 месяца после СКП. Примеры характеристик донорских роговиц, консервированных в жидкой питательной среде с адгелоном, использованных для СКП. Пример 1. Донор - муж. 30 лет, скончался в результате механической асфиксии (повешение). Срок после смерти до аутопсии (выделения глазных яблок) - 10 часов; срок после смерти до консервации роговиц в питательной среде с адгелоном - 12 часов. Количество ЭК в 1 мм2 при зеркальной микроскопии глаз донора перед консервацией: OD - 2900; OS - 3000. Срок консервации роговиц в питательной среде - 4 суток. Состояние ЭК на плоскостном пленочном препарате правой роговицы спустя 4 суток хранения оставалось без изменений по сравнению нормой (фиг. 1-а). На фиг. 1-б - эндотелий роговицы, хранившейся в среде М-К в течение 4-х дней: видны участки с усиленной аргирофилией ЭК (некробиотические изменения клеток). Произведена субтотальная кератопластика реципиенту 47 лет с герпетическим кератитом, микроперфорацией роговицы, десцементоцеле. Для операции была использована роговица левого глаза донора, хранившаяся в среде с адгелоном в течение 4 суток. Операционный и послеоперационный периоды - без осложнений. Сквозной трансплантат роговицы с 1-х суток до 3-х месяцев оставался прозрачным; количество ЭК к 3-му месяцу послеоперационного периода - 2500. Пример 2. Донор - муж. 28 лет, скончался от отравления этиловым спиртом. Срок после смерти до вскрытия - 11 часов; срок после смерти до консервации роговиц в питательной среде с адгелоном - 12 часов. Количество ЭК в 1 мм2 при зеркальной микроскопии глаз донора перед консервацией роговицы: OD - 3100; OS - 3100. Срок консервации роговиц в питательной среде - 7 суток. В правой роговице спустя 7 суток ее хранения целостность эндотелиального монослоя была сохранена; в отдельных полях зрения можно было видеть единичные крупные моноядерные ЭК, которые свидетельствовали о регенерационных процессах и новообразовании монослоя (фиг. 2-а). На фиг. 2-б - эндотелий роговицы, хранившейся в среде K-Sol в течение 7 дней: видна деструкция ЭК (до 20%). Произведена ургентная СКП больной 56 лет с гнойным кератоиридоциклитом, начинающимся эндофтальмитом. Для СКП была использована роговица левого глаза донора, хранившаяся в среде с адгелоном в течение 7 суток. Операционный и послеоперационный периоды без осложнений. Сквозной трансплантат роговицы в первые сутки был полупрозрачным, а через 3 месяца - прозрачный; количество ЭК к 3-му месяцу послеоперационного периода - 2210. Изобретение поясняется микрофотографиями.
ФОРМУЛА ИЗОБРЕТЕНИЯСреда для консервирования роговицы донора, содержащая питательную среду культуры ткани Т-199, HEPES-буфер для стабилизации рН среды до 7,3; декстран -40, антибиотик, отличающаяся тем, что он дополнительно содержит витамины: глицин, никотиновая кислота, пиридоксин-хлорид, тиамин-хлорид, биотин, фолиевая кислота; электролиты: хлорид кальция (безводный), сульфат магния (безводный), фосфат калия, а также смесь антибиотиков: ампициллин, пенициллин, стрептомицин, неомицин; глюкозу и адгелон при следующем соотношении компонентов на 1 л Т-199: Глицин - 2,0 мг Витамины: Никотиновая кислота (0,5 мг/л), пиридоксин-хлорид (0,5 мг/л) и тиамин-хлорид (0,5 мг/л) - 1 мл Биотин - 0,05 мг Фолиевая кислота - 0,5 мг Электролиты: Хлорид кальция (безводный) (Са++) - 332 мг Сульфат магния (безводный) (Мg++) - 180 мг Фосфат калия (К+) - 170 мг Смесь антибиотиков: Ампициллин - 100 мг Пенициллин (5000 ЕД/мл), стрептомицин (5 мг/мл) и неомицин (10 мг/мл) - 10 мл Глюкоза (450 г, 45%) и адгелон (10-13М/мл раствора) - 5 млПопулярные патенты: 2166252 Способ удаления костного мозга из губчатых костных трансплантатов ... и перекисью водорода воздействуют на губчатые костные трансплантаты низкочастотными ультразвуковыми колебаниями частотой 24,5 - 28,5 кГц в течение 1 минуты, после чего, произведя отмывку трансплантатов проточной водой, помещают губчатые костные трансплантаты в спирто-эфирный раствор, выдерживая их в последнем 0,5-1,5 часа. На фиг. 1 представлена нативная губчатая костная ткань; на фиг. 2 - губчатая костная ткань, отмытая по известной методике; на фиг. 3 - губчатая костная ткань, отмытая по предлагаемому способу. Способ осуществляют следующим образом. Сначала проводят механическое удаление с костей мышечной, хрящевой и сухожильной тканей. Далее размельчают спонгиозу до кусочков ... 2460269 Малогабаритный картофелеуборочный комбайн ... 23.Работа малогабаритного картофелеуборочного комбайна осуществляется следующим образом. При поступательном движении уборочного агрегата диски 3 и опорно-ходовые колеса свободно перекатываются между гребнями. Прутки нижней ветви клубнеприемного элеватора 11 подобно ребристому катку, перекатываясь по вершине гребня, частично разрушают комки почвы, наклоняют и прижимают ботву к поверхности гребня. Лемех 14 отделяет пласт почвы (ворох) от основного массива, частично деформирует и разрушает его. Перемещению пласта по криволинейной поверхности лемеха 14 способствует нижняя ветвь клубнеприемного пруткового элеватора 11. Разваливание пласта по сторонам предотвращается дисками 3. Эти ... 2115638 Способ переработки органических отходов животного происхождения в кормовой белок и биогумус ... нейтральные компоненты - песок, фосфориты, перепрелые листья, солому, опилки - с последующим образованием гранулированного продукта с размером частиц 2 - 20 мм и влажностью 70 - 90%. 3. Способ по п.1 или 2, отличающийся тем, что червей вносят в количестве 26 - 50 тыс. особей на 1 м2 питательной смеси. 4. Способ по любому из пп.1 - 3, отличающийся тем, что в процессе компостирования питательная смесь находится в контакте с червями в течение 14 - 21 суток. 5. Способ по любому из пп.1 - 3, отличающийся тем, что в процессе компостирования черви находятся в питательной смеси 90 - 180 суток. 6. Способ по любому из пп.1 - 5, отличающийся тем, что для отделения червей от полученного ... 2195644 Монитор для определения качества зерна ... имеет пространственное разрешение приблизительно 13 мкм. Частотное разрешение определяется выбранной шириной полосы (задаваемой линейно перестраиваемым фильтром 50), деленной на число ПЗС-ячеек. В предпочтительном варианте осуществления изобретения ПЗС-матрица представляет собой матрицу из 1024 элементов, воспринимающую излучение в интервале от приблизительно 570 до приблизительно 1120 нм. Кроме того, такой приемник 52, как ПЗС-матрица, как правило, чувствителен к температуре, поэтому обычно желательна его термостабилизация. В предпочтительном варианте осуществления изобретения благодаря компактности схемы оптического модуля 46 и относительно близкого расположения ЛПФ 50 и ... 2050099 Косилка с всасывающим устройством ... быть то, что до заявляемого решения никто не использовал путь решения задачи выравнивания скоростей и давлений в конфузоре, хотя технических решений по этому вопросу очень много. Упрощение конструкции и изготовления конфузора очевидно без доказательств. Эффективность процесса выравнивания скоростей и давления проверена экспериментально, с использованием наиболее современных методов исследования воздушных потоков в конфузоре. На фиг. 1 представлен конфузор с заборным щитком, вид сверху; на фиг. 2 то же, с подетальным изображением конфузора; на фиг. 3 то же, вид сбоку; на фиг. 4 вид Б на фиг. 2; на фиг. 5 разрез А-А на фиг. 2 с прямолинейной образующей в продольном сечении ... |
Еще из этого раздела: 2182420 Устройство для перерезания стволов деревьев 2437864 Способ микробиологической переработки птичьего помета 2161391 Комбинированная почвообрабатывающая посевная машина 2060618 Пневматический высевающий аппарат 2477044 Искусственная рыболовная приманка (варианты) 2422377 Биоцидный концентрат 2236787 Способ испытаний опрыскивателей и устройство для его осуществления 2049387 Инкубатор индивидуального пользования 2492623 Портативный электроинструмент с управлением спусковым механизмом 2021671 Машина для уборки льна-долгунца |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||