Способ замораживания красных кровяных клеток и рама для замораживания красных кровяных клетокПатент на изобретение №: 2073972 Автор: Майкл Джон Глинн Томас[GB], Сюзан Хелен Белл[GB], Стюарт Грехем Нэш[GB], Эрнст Сидней Пэрри[GB] Патентообладатель: Министр обороны Великобритании (GB) Дата публикации: 27 Февраля, 1997 Адрес для переписки: подача заявки31.01.1990 публикация патента27.02.1997 Изображения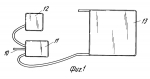 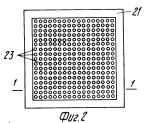 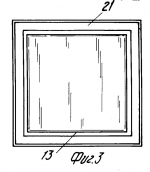 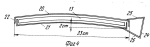 Использование: для замораживания красных кровяных клеток с целью их долговременного хранения без потери их свойств. Сущность изобретения: способ замораживания стандартного объема донорской крови для значительного хранения и последующего получения чистого материала для переливания, который предполагает ее центрифугирование для отделения красных кровяных клеток от плазмы и тромбоцитов до объема глобулярной массы последних не менее 90%, перенос красных кровяных клеток в мешок для замораживания, содержащий оксиэтиловый крахмал ОЭК при соотношении веса ОЭК к объему красных кровяных клеток не более 7%, предпочтительно 6%. Устройство выполнено в виде рамы для размещения мешка с замораживаемой смесью (жидкий азот). Рама состоит из двух дугообразных перфорированных алюминиевых пластин, закраины которых изогнуты навстречу друг другу и являются направляющими для плоско-параллельного перемещения пластин. Пластины скреплены прижимными элементами из упругого материала. 2 с. и 8 з.п. ф-лы, 4 ил. , , , , , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУИзобретение относится к замораживанию красных кровяных клеток (эритроцитов) с целью их долговременного хранения без потери свойств, необходимых для использования при переливании крови. Способы сохранения крови для использования при переливании крови хорошо известны. Обычно ее хранят охлажденной до 4oС. В этих условиях она сохраняет жизнеспособность на протяжении примерно 5 недель. В связи с этим, чтобы обеспечить непрерывный запас пригодной для переливания крови, приходится постоянно возобновлять его, пользуясь услугами доноров. К сожалению, выдаются периоды, например период рождественских праздников, когда поступление донорской крови значительно снижается. Случается также, что во время стихийных бедствий и катастроф ощущается недостаток пригодной для переливания крови в тех или иных районах. Кроме того, становится все больше людей, желающих иметь запас собственной крови, например на случай определенных видов хирургических операций. Все это делает весьма актуальной проблему длительного хранения крови и разработки соответствующих методик. Сохранение крови на протяжении длительных периодов возможно благодаря ее охлаждению до очень низкой температуры. Однако, к сожалению, кровь нельзя замораживать в цельномвиде. Обычно ее хранят в стандартных емкостях примерно на 450 мл, что соответствует объему крови, получаемой от донора за один прием. При переливании больному обычно вводят определенное количество таких стандартных объемов. Замораживание одного объема сопровождается гемолизом красных кровяных клеток, что делает кровь непригодной для дальнейшего переливания. В процессе гемолиза происходит освобождение калия, обладающего кардиотоксическим действием, и материала стромы (клеточных остатков), которые могут отрицательно влиять на почечную функцию. Принято считать, что пригодные для переливания крови эритроциты могут быть гемолизированы не более чем на 1% Методика хранения крови при низкой температуре предполагает ее центрифугирование с целью отделения плазмы и тромбоцитов от красных кровяных телец и последующее смешение эритроцитов с криопротектором. Эту смесь замораживают при очень низкой температуре, обычно используя жидкий озон. В качестве криопротектора наиболее часто используют глицерин. К сожалению, он обладает токсической активностью, в связи с чем препараты красных кровяных клеток, предназначенные для переливания, предварительно приходится несколько раз отмывать, чтобы освободиться от глицерина. Эта процедура требует использования дорогостоящего оборудования, высокой квалификации персонала и стерильных производственных площадей. На промывку единиц хранения препарата затрачивается приблизительно 20 мин, причем теряется от 15 до 20% клеток. Более перспективен в качестве криопротектора оксиэтиловыйкрахмал (ОЭК) или левосан. В патенте США N 3758382 приведено описание способа смешивания цельной крови объемом 55 мл, содержащей антикоагулянт (подкисленный дестрозо-цитрат), с 40%-ным ОЭК (вес/объем) со средним молекулярным весом 40000 70000 до конечной концентрации ОЭК 12 14% (вес/объем). Смесь погружают в жидкий азот при -190oC и перемешивают со скоростью 200 оборотов в минуту до замерзания. После хранения при -140oС на протяжении недели смесь оттаивают, погружают ее в водяную баню при 47oС на 60 с при непрерывном перемешивании со скоростью 160 циклов в минуту. Таким путем достигается выход красных кровяных клеток порядка 99% (в среднем 97,4%). Используемые для замораживания этим методом объемы крови (55 мл) составляют лишь часть стандартной единицы хранения, что вызывает нежелательные последствия при использовании обычной процедуры переливания. Разрабатывая процесс криоконсервации стандартных единиц хранения крови, авторы патента США N 4018911 предложили способ замораживания с применением ОЭК, имеющего молекулярный вес в среднем 150000. При этом кровь центрифугируют для отделения красных кровяных телец от плазмы и тромбоцитов и часть плазмы смешивают с ОЭК. Последнее необходимо для защиты красных кровяных клеток. Полученную таким образом смесь объединяют с примерно равным объемом эритроцитов таким образом, чтобы конечная концентрация ОЭК составляла приблизительно 14% На этой стадии исходный стандартныйобъем донорской крови (450 мл) уменьшается до 405 мл. Смесь плазмы и ОЭК вместе с добавленными красными кровяными тельцами помещают в мешочек, который после дополнительного перемешивания закрепляют в держателе, установленном на маятниковой качалке. Держатель представляет собой устройство из двух перфорированных металлических пластин, скрепленных между собой и сидящих на шарнирах. Мешочек с кровью находится между пластинами, причем постоянство поперечного сечения во время замораживания обеспечивается высокой жесткостью конструкции, которая достигается изготовлением перфорированных пластин из нержавеющей стали. Постоянство поперечного сечения ускоряет замораживание, в процессе которого стальные пластинки не позволяют мешочку смещаться во время перемешивания крови. Встряхивание мешочка с кровью производится в жидком азоте, в который в вертикальном положении помещают держатель с закрепленной в нем емкостью. Встряхивание содержимого мешочка (405 мл) необходимо из-за достаточно большого объема препарата и для поддержания достаточно высокой скорости замораживания, чтобы свести до минимума гемолиз красных кровяных клеток. Накануне переливания замороженную кровь оттаивают, погружая мешочек в водяную баню при 54oС в условиях механического перемешивания в течение 1 мин. Кровь пригодна для переливания сразу после оттаивания (при условии, что степень гемолиза не превышает допустимой величины). Это и являетсяосновным преимуществом описанного способа по сравнению с методикой замораживания крови с глицерином. Данный способ возможен потому, что внеклеточный криопротектор ОЭК не обладает токсическими и иммуногенными свойствами, что сближает его с имеющимся в организме гликогеном и не требует удаления перед использованием крови для целей переливания. В патенте США N 4018911 описано применение этого способа для замораживания материала объемом не более 25 мл, в результате которого выход красных кровяных клеток после оттаивания составляет 99,2% 87,3% этих клеток в изотоническом растворе сохраняют стабильность на протяжении получаса. В то же время, результаты замораживания этим методом стандартных единиц хранения донорской крови оказались значительно скромнее: выход клеток составлял 97,2% а стабильность в изотоническом растворе не превышала 75,7% Использование ОЭК в качестве криопротектора при хранении замороженных эритроцитов, тромбоцитов, лейкоцитов, клеток костного мозга и других органов описано в заявке на Британский патент N 2046772А. Согласно предлагаемому способу клетки крови или органов разделяют, например, посредством центрифугирования, с последующими фильтрацией и адсорбцией. Заявка содержит краткое описание процесса замораживания эритроцитов после постадийного отделения одних типов клеток от других (в отсутствие центрифугирования, по-видимому, чтобы сохранить некоторое количество плазмы вместе с клетками) и добавления 10% -ного раствора ОЭК до получения отношения концентраций ОЭК и эритроцитов 2:3.Выход красных кровяных клеток составляет при этом 95 98% Материалы заявки свидетельствуют о возможности хранения и последующего получения красных кровяных клеток с использованием в качестве криопротекторас ОЭК, при приемлемом уровне гемолиза и в очень небольших объемах (25 мл в соответствии с патентом США N 4018911). Тем не менее, этот способ не позволяет хранить и получать красные кровяные клетки в количествах, которые необходимы для целей переливания. Кроме того, его применение сопровождается слишком большой изменчивостью выхода эритроцитов под воздействием разнообразных факторов даже в случае использования номинально идентичных проб. В результате, несмотря на высокую эффективность переливания крови с применением красных кровяных телец, замороженных в присутствии ОЭК в качестве криопротектора, до сих пор отсутствует способ снижения степени гемолиза эритроцитов до приемлемого уровня при достаточном постоянстве выхода клеток. Предлагаемое изобретение касается способа замораживания красных кровяных клеток с использованием ОЭК в качестве криопротектора, который включает следующие операции: центрифугирование единицы хранения донорской крови для отделения красных кровяных клеток от плазмы и тромбоцитов, смешивание красных кровяных клеток с ОЭК и замораживание смеси. Способ отличается тем, что перед смешиванием объем глобулярной массы красных кровяных телец составляет не менее 90% и что концентрация ОЭК в смеси не превышает 7% концентрации эритроцитов (вес/объем). Объем глобулярной массыили гематокрит является общепринятым гематологическим показателем, определение которого содержится, в частности, на стр. 32 "Руководства по практической гематологии" (Practical Halmatology, bysir John V.Davie and S.M.Lewis, 6th Edition churehill Living stone, 1984, ISBN 044301981-9). Однако следует отметить, что в отличие от известных способов, предлагаемый метод предполагает практически полное отсутствие плазмы в смеси. Кроме того, несмотря на отсутствие защитного действия плазмы, этот метод требует значительно меньшего количества ОЭК при пересчете на количество красных кровяных клеток (вес/объем). Помимо меньшей степени гемолиза, преимущество предлагаемого метода состоит также в том, что смесь не содержит многочисленных белков, которые могут присутствовать в плазме, в том числе факторов, вызывающих свертывание крови (например, фактора 8). Еще одно преимущество вытекает из низкой концентрации ОЭК. Установлено, что в результате смешивания ОЭК с плазмой развивается прогрессирующая тенденция к снижению растворимости некоторых протеинов, особенно факторов свертываемости, компонентов комплемента, иммуноглобулинов и фибропектина, по мере повышения концентрации ОЭК (см. S.Bell M. Sc Thesis, Library of Brunel University). Эти протеины образуют агрегаты, которые обусловливают молочно-белый цвет плазмы. При попадании в нативную плазму как in vivo, так и in vitro эти агрегаты служат очагами дальнейшей концентрации белков, в то время как ОЭК приобретает способность взаимодействовать с более значительными количествами белков свежей плазмы. Образующиеся при этом обломки выводятся макрофагами, что может сопровождаться временным уменьшением иммунокомпетентности больного. Поскольку одновременно нарушается функция факторов свертываемости и фибропектина, время кровотечения увеличивается пропорционально "дозе" ОЭК. Последний обычно используют в форме 40%-ного раствора (вес/объем) при среднем молекулярном весе ОЭК в диапазоне 150000 200000. Оптимальный объем подобран исходя из стандартной единицы хранения донорской крови (450 мл) и содержит 200 мл красных кровяных клеток, смешанных с 35 мл 40%-ного раствора ОЭК. Таким образом, конечный объем препарата для замораживания составляет 235 мл. Красные кровяные клетки можно обрабатывать коагулянтами и консервантами (такими, например, как лимоннокислый декстрозофосфат аденин, ЛКДФА, лимоннокислый декстрозофосфат, ЛКДФ, или гепарин), прежде чем смешивать их с ОЭК. Желательно проводить заморозку в жидком азоте, причем смесь должна находиться в мешке, который размещают в раме из двух параллельных перфорированных пластин, которые могут слегка перемещаться относительно друг друга, оставаясь при этом параллельными. Рекомендуется изготавливать раму из алюминиевых пластин изогнутой формы, причем кривизна должна иметь цилиндрическую или, предпочтительно, сферическую конфигурацию. Установлено, что содержимое мешка для замораживания весьма чувствительно к его локальному утолщению во время этого процесса. Смесь имеет тенденцию расширяться при понижении температуры, в связи с чем рамы известных конструкций либо деформируются для компенсации этого расширения, либо препятствуют ему, что приводит к поломке системы. Использование параллельных пластин, смещающихся относительно друг друга, позволяет избежать местного утолщения. В изобретении используется такой объем стандартной единицы хранения (235 мл), который обеспечивает замораживание смеси с требуемой скоростью в отсутствие встряхивания мешка, как это предусматривается известными способами. Это значительно снижает уровень требований к оборудованию, упрощает процедуру замораживания и позволяет устранить возможные причины гемолиза (механическое повреждение клеток при встряхивании). Рекомендуется переносить красные кровяные клетки в мешок для замораживания сразу после центрифугирования, причем мешок должен содержать заранее добавленный раствор ОЭК. Замороженную в соответствии с описанным способом кровь непосредственно перед использованием для переливанияпогружают в подогретую до 43,5oС воду примерно на 10 мину, т.е. до тех пор, пока смесь не охладится примерно до температуры человеческого тела. При этом ее не встряхивают во избежание возможного дополнительного гемолиза. Установлено, что использование вышеописанного способа замораживания и оттаивания крови в объеме, приближающемся к стандартному объему донорской крови, обеспечивает выход устойчивых в изотоническом растворе клеток в течение 1/2 ч, равный 91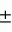 0,75% при среднем выходе оттаявших клеток 99,1 0,75% при среднем выходе оттаявших клеток 99,1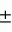 0,12% Кровь пригодна для вливания больным через 11 мин после взятия замороженного материала из жидкого азота. Составной частью настоящего изобретения является аппарат, описание которого дается ниже в порядке примера, со ссылками на прилегаемые схематические чертежи. Фиг. 1 схематическое изображение процедуры получения стандартного объема донорской крови и последующих операций, вплоть до смешивания ОЭК и красных кровяных клеток в мешке для замораживания. Фиг. 2 изображение в плане пластины, которая используется в составе рамы согласно изобретению. Фиг. 3 изображение в плане, соответствующем фиг. 1, которое демонстрирует положение мешка для замораживания относительно пластины. Фиг. 4 срез через раму, показывающий положение мешка между двух пластин. Стандартный объем донорской крови, 450 мл (не показан), через трубку 10 поступает в мешок 11, содержащий антикоагулянт или консервант (ЛКДФА). Мешок герметично закрыт и помещен в центрифугу (не показана). Центрифугирование мешка 11 сопровождается отделением плазмы и тромбоцитов, которые оттекают в мешок 12. Красные кровяные клетки общим объемом 200 мл, сконденсированные до объема глобулярной массы не менее 90% поступают в мешок 13, в который предварительно добавляют 35 мл оксиэтилового крахмала (ОЭК), желательно в форме 40%-ного раствора (вес/объем) при молекулярном весе 150000 200000. В результате концентрация ОЭК в жидкости, омывающей красные кровяные клетки, составляет приблизительно 25,5% а содержание ОЭК составляет 7% содержания эритроцитов (вес/объем). Оптимальное содержание ОЭК равно 6% (по весу) к объему эритроцитов. Мешок для замораживания крови 13 должен быть плоским, узким и иметь квадратную форму. Мешок герметично закрывают после поступления в него эритроцитов и выхода воздуха. После этого смесь ОЭК и красных кровяных клеток перемешивают, например, переворачивая его или круговыми движениями, вручную, на протяжении нескольких минут. Все процедуры, от взятия крови у донора до запечатывания мешка 13, проводят в стерильных условиях. Желательно, чтобы все элементы аппарата, от трубки 10 до мешка 13, составляли единое целое и не имели разрывов, а все необходимые разъемы осуществлялись таким образом, чтобы разделение элементов сопровождалось немедленным перекрыванием образовавшихся отверстий. Центрифугирование и смешивание красных кровяных клеток с ОЭК проводят общепринятыми для этих целей способами (см. например, патент США N 4018911), в связи с чем эти процедуры здесь не описываются. Рама для фиксации мешка со смесью во время замораживания представляют собой конструкцию из двух пластин 10 и 21, которые имеют квадратную форму и изогнуты таким образом, что кривизна имеет сферическую конфигурацию, причем радиус наружной поверхности сферы приблизительно на 3 мм больше радиуса внутренней поверхности, и обе поверхности концентричны. Сферичность конструкции может быть, например, такой, чтобы допускать смещение на 2 см по центральной оси рамы при длине последней 33 см (установлено, что такой размер рамы в наибольшей степени соответствует требованиям, предъявляемым к условиям замораживания стандартного объема донорской крови). По краям обеих пластин 20 и 21 имеются закраины в виде направляющих 22, с помощью которых пластины размещаются одна относительно другой. Пластины изготавливают из алюминия или другого металла, обладающего хорошей теплопроводностью. Пластины имеют многочисленные отверстия 23, на долю которых приходится до половины их поверхности. Мешок для замораживания 13 помещают на пластину 21 таким образом, чтобы он полностью покрывал перфорированную поверхность. После этого на первую пластину 21 и мешок 13 помещают вторую пластину 20, которая удерживается в требуемом положении с помощью нескольких прижимных элементов 24, один из которых показана фиг. 4. Рабочие участки 25 прижимных элементов 24 отличаются определенной гибкостью и располагаются таким образом, чтобы они захватывали края пластин 20 и 21 на самой кромке, там где они не нависают над мешком 13. Конструкцию из пластин 20 и 21 и заключенного между ними мешка 13 помещают в вертикальном положении в емкость с жидким азотом (не показан). При этом происходит быстрое замораживание смеси ОЭК с красными кровяными тельцами (примерно в течение 30 с). Смесь имеет тенденцию к расширению по мере замораживания однако, благодаря гибкости рабочих участков 25 прижимных элементов 24, пластины 20 и 21 могут несколько смещаться и тем самым компенсировать это расширение. В то же время изгиб пластин 20 и 21 предохраняет их от деформации. В результате по всей их длине сохраняется параллельность и обеспечивается равномерная толщина мешка во всех точках его поверхности. Это имеет очень большое значение, поскольку ранее было установлено, что расширение мешка во время замораживания сопровождается локальным усилением гемолиза эритроцитов. Замороженную вышеописанным способом кровь можно длительное время хранить при температуре жидкого азота. Перед использованием для переливания материалы вынимают из морозильной камеры и погружают в воду, нагретую примерно до 435oС на 10 мин, не перемешивая. На протяжении этого времени температура смеси понижается, желательно до температуры человеческого тела, после чего ее можно использовать для вливания. Установлено, что при использовании описанного метода уровень гемолиза не превышает 1% что значительно ниже, чем в случаях применения известных методов замораживания и подготовки крови для целей переливания. В табл. 1 приведена подробная характеристика 10 проб, замороженных и оттаянных вышеописанным способом. В аппарате для замораживания использованы пластины с толщиной перфорированных участков 0,9 мм, при толщине неперфорированных кромок 1,2 мм. В табл. 2 представлены наиболее важные показатели, свидетельствующие о том, что эффективность достатки кислорода и выживаемость красных кровяных клеток при использовании вышеописанного метода существенно не изменяются. Таким образом, предлагаемый способ позволяет сохранять стандартныеобъемы красных кровяных клеток с достаточно высоким выходом и при воспроизводимой степени гемолиза, которая применима для целей переливания крови. Дополнительным преимуществом описанного способа является то обстоятельство, что стандартный объем уменьшен до 235 мл, поскольку это позволяет одновременно производить сливание одному больному большего количества таких объемов (т.е. большее количество красных кровяных клеток). Трансфузионная смесь практически не содержит нежелательных примесей, представляющих опасность для больного, а содержание в ней ОЭК гораздо меньше, чем в смесях, получаемых с помощью известных способов замораживания. Дополнительным преимуществом является то обстоятельство, что весь описанный процесс гораздо проще нежели аналогичные процессы, используемые в настоящее время, поскольку он не требует применения специальной аппаратуры для обеспечения вибрации рамы с закрепленным в ней мешком со смесью, подлежащей замораживанию. Кроме того, техника оттаивания доступна лицам, не имеющим специальной подготовки, которые уже через 10 мин работы могут получить отличный результат, имея в своем распоряжении всего лишь ведерко подогретой воды. Следует отметить, что данное изобретение предполагает возможность модификации вышеописанного метода и аппарата для его реализации. В частности, пластины 20 и 21 в идеальном случае должны иметь сферическую конфигурацию, однако допускается использование пластин с кривизной цилиндрической конфигурации или изогнутых под углом, если такая конструкция обеспечивает их параллельность при смещении относительно друг друга во время замораживания смеси. Точно также, вместо алюминия можно использовать другие материалы. Важно подчеркунть, что предлагаемый способ пригоден для замораживания небольших объемов материала, хотя исходно он предназначен для работы со стандартными единицами хранения крови, поскольку это в большей степени соответствует сложившейся практике получения донорской крови и ее переливания. Так, например, его можно использовать при замораживании для последующего хранения мини-мешков квадратной формы с размером сторон 5 см. Это может быть необходимо для экспериментальной работы или для хранения редких типов крови. 0,12% Кровь пригодна для вливания больным через 11 мин после взятия замороженного материала из жидкого азота. Составной частью настоящего изобретения является аппарат, описание которого дается ниже в порядке примера, со ссылками на прилегаемые схематические чертежи. Фиг. 1 схематическое изображение процедуры получения стандартного объема донорской крови и последующих операций, вплоть до смешивания ОЭК и красных кровяных клеток в мешке для замораживания. Фиг. 2 изображение в плане пластины, которая используется в составе рамы согласно изобретению. Фиг. 3 изображение в плане, соответствующем фиг. 1, которое демонстрирует положение мешка для замораживания относительно пластины. Фиг. 4 срез через раму, показывающий положение мешка между двух пластин. Стандартный объем донорской крови, 450 мл (не показан), через трубку 10 поступает в мешок 11, содержащий антикоагулянт или консервант (ЛКДФА). Мешок герметично закрыт и помещен в центрифугу (не показана). Центрифугирование мешка 11 сопровождается отделением плазмы и тромбоцитов, которые оттекают в мешок 12. Красные кровяные клетки общим объемом 200 мл, сконденсированные до объема глобулярной массы не менее 90% поступают в мешок 13, в который предварительно добавляют 35 мл оксиэтилового крахмала (ОЭК), желательно в форме 40%-ного раствора (вес/объем) при молекулярном весе 150000 200000. В результате концентрация ОЭК в жидкости, омывающей красные кровяные клетки, составляет приблизительно 25,5% а содержание ОЭК составляет 7% содержания эритроцитов (вес/объем). Оптимальное содержание ОЭК равно 6% (по весу) к объему эритроцитов. Мешок для замораживания крови 13 должен быть плоским, узким и иметь квадратную форму. Мешок герметично закрывают после поступления в него эритроцитов и выхода воздуха. После этого смесь ОЭК и красных кровяных клеток перемешивают, например, переворачивая его или круговыми движениями, вручную, на протяжении нескольких минут. Все процедуры, от взятия крови у донора до запечатывания мешка 13, проводят в стерильных условиях. Желательно, чтобы все элементы аппарата, от трубки 10 до мешка 13, составляли единое целое и не имели разрывов, а все необходимые разъемы осуществлялись таким образом, чтобы разделение элементов сопровождалось немедленным перекрыванием образовавшихся отверстий. Центрифугирование и смешивание красных кровяных клеток с ОЭК проводят общепринятыми для этих целей способами (см. например, патент США N 4018911), в связи с чем эти процедуры здесь не описываются. Рама для фиксации мешка со смесью во время замораживания представляют собой конструкцию из двух пластин 10 и 21, которые имеют квадратную форму и изогнуты таким образом, что кривизна имеет сферическую конфигурацию, причем радиус наружной поверхности сферы приблизительно на 3 мм больше радиуса внутренней поверхности, и обе поверхности концентричны. Сферичность конструкции может быть, например, такой, чтобы допускать смещение на 2 см по центральной оси рамы при длине последней 33 см (установлено, что такой размер рамы в наибольшей степени соответствует требованиям, предъявляемым к условиям замораживания стандартного объема донорской крови). По краям обеих пластин 20 и 21 имеются закраины в виде направляющих 22, с помощью которых пластины размещаются одна относительно другой. Пластины изготавливают из алюминия или другого металла, обладающего хорошей теплопроводностью. Пластины имеют многочисленные отверстия 23, на долю которых приходится до половины их поверхности. Мешок для замораживания 13 помещают на пластину 21 таким образом, чтобы он полностью покрывал перфорированную поверхность. После этого на первую пластину 21 и мешок 13 помещают вторую пластину 20, которая удерживается в требуемом положении с помощью нескольких прижимных элементов 24, один из которых показана фиг. 4. Рабочие участки 25 прижимных элементов 24 отличаются определенной гибкостью и располагаются таким образом, чтобы они захватывали края пластин 20 и 21 на самой кромке, там где они не нависают над мешком 13. Конструкцию из пластин 20 и 21 и заключенного между ними мешка 13 помещают в вертикальном положении в емкость с жидким азотом (не показан). При этом происходит быстрое замораживание смеси ОЭК с красными кровяными тельцами (примерно в течение 30 с). Смесь имеет тенденцию к расширению по мере замораживания однако, благодаря гибкости рабочих участков 25 прижимных элементов 24, пластины 20 и 21 могут несколько смещаться и тем самым компенсировать это расширение. В то же время изгиб пластин 20 и 21 предохраняет их от деформации. В результате по всей их длине сохраняется параллельность и обеспечивается равномерная толщина мешка во всех точках его поверхности. Это имеет очень большое значение, поскольку ранее было установлено, что расширение мешка во время замораживания сопровождается локальным усилением гемолиза эритроцитов. Замороженную вышеописанным способом кровь можно длительное время хранить при температуре жидкого азота. Перед использованием для переливания материалы вынимают из морозильной камеры и погружают в воду, нагретую примерно до 435oС на 10 мин, не перемешивая. На протяжении этого времени температура смеси понижается, желательно до температуры человеческого тела, после чего ее можно использовать для вливания. Установлено, что при использовании описанного метода уровень гемолиза не превышает 1% что значительно ниже, чем в случаях применения известных методов замораживания и подготовки крови для целей переливания. В табл. 1 приведена подробная характеристика 10 проб, замороженных и оттаянных вышеописанным способом. В аппарате для замораживания использованы пластины с толщиной перфорированных участков 0,9 мм, при толщине неперфорированных кромок 1,2 мм. В табл. 2 представлены наиболее важные показатели, свидетельствующие о том, что эффективность достатки кислорода и выживаемость красных кровяных клеток при использовании вышеописанного метода существенно не изменяются. Таким образом, предлагаемый способ позволяет сохранять стандартныеобъемы красных кровяных клеток с достаточно высоким выходом и при воспроизводимой степени гемолиза, которая применима для целей переливания крови. Дополнительным преимуществом описанного способа является то обстоятельство, что стандартный объем уменьшен до 235 мл, поскольку это позволяет одновременно производить сливание одному больному большего количества таких объемов (т.е. большее количество красных кровяных клеток). Трансфузионная смесь практически не содержит нежелательных примесей, представляющих опасность для больного, а содержание в ней ОЭК гораздо меньше, чем в смесях, получаемых с помощью известных способов замораживания. Дополнительным преимуществом является то обстоятельство, что весь описанный процесс гораздо проще нежели аналогичные процессы, используемые в настоящее время, поскольку он не требует применения специальной аппаратуры для обеспечения вибрации рамы с закрепленным в ней мешком со смесью, подлежащей замораживанию. Кроме того, техника оттаивания доступна лицам, не имеющим специальной подготовки, которые уже через 10 мин работы могут получить отличный результат, имея в своем распоряжении всего лишь ведерко подогретой воды. Следует отметить, что данное изобретение предполагает возможность модификации вышеописанного метода и аппарата для его реализации. В частности, пластины 20 и 21 в идеальном случае должны иметь сферическую конфигурацию, однако допускается использование пластин с кривизной цилиндрической конфигурации или изогнутых под углом, если такая конструкция обеспечивает их параллельность при смещении относительно друг друга во время замораживания смеси. Точно также, вместо алюминия можно использовать другие материалы. Важно подчеркунть, что предлагаемый способ пригоден для замораживания небольших объемов материала, хотя исходно он предназначен для работы со стандартными единицами хранения крови, поскольку это в большей степени соответствует сложившейся практике получения донорской крови и ее переливания. Так, например, его можно использовать при замораживании для последующего хранения мини-мешков квадратной формы с размером сторон 5 см. Это может быть необходимо для экспериментальной работы или для хранения редких типов крови.
ФОРМУЛА ИЗОБРЕТЕНИЯ1. Способ замораживания красных кровяных клеток путем помещения их в мешок, закрепленный в раме, образованной из двух параллельных перфорированных пластин, при этом используют оксиэтиловый крахмал (ОЭК) в качестве криопротектора, центрифугируют единицы крови с последующим выделением из красных кровяных клеток плазмы и тромбоцитов, смешивают красные кровяные клетки с ОЭК и замораживают смесь, отличающийся тем, что до момента смешивания красные кровяные клетки имеют объем глобулярной массы не менее 90% а содержание ОЭК в смеси составляет не более 7% от объема красных кровяных клеток. 2. Способ по п. 1, отличающийся тем, что содержание ОЭК равно 6% от объема красных кровяных клеток. 3. Способ по пп. 1 и 2, отличающийся тем, что ОЭК используется в виде раствора 40%-ного ОЭК. 4. Способ по пп. 1-3, отличающийся тем, что ОЭК имеет средний молекулярный вес в диапазоне 150000 200000. 5. Способ по пп. 1-4, отличающийся тем, что единица крови основывается на стандартном объеме донорской крови в 450 мл. 6. Способ по пп. 1-5, отличающийся тем, что красные кровяные клетки обрабатывают перед моментом смешивания с ОЭК антикоагулянтном. 7. Способ по пп. 1-6, отличающийся тем, что замораживание происходит в жидком азоте. 8. Рама для замораживания красных кровяных клеток, содержащая две параллельные пластины из теплопроводного материала с перфорированным участком и закраинами, установленные с зазором друг относительно друга для размещения мешка с замораживаемой смесью, скрепленные прижимными элементами и выполненные с возможностью плоско-параллельного перемещения по направляющим, отличающаяся тем, что пластины выполнены из алюминия дугообразными, направляющие в виде изогнутых навстречу друг другу свободных концов закраин, а прижимные элементы из упругого материала, при этом толщины перфорированного участка и закраины равны соответственно 0,9 и 1,2 мм. 9. Рама по п. 8, отличающаяся тем, что пластины выполнены цилиндрической конфигурации. 10. Рама по п. 8, отличающаяся тем, что пластины выполнены сферической конфигурации.Популярные патенты: 2076583 Способ выращивания растений в теплице и устройство для его осуществления ... и создание в теплице требуемого климатического режима, включающее поддержание заданной суммарной интенсивности светового потока, излучаемого линейными источниками оптического излучения, расположенными над и вдоль вегетационных лотков. Известно устройство для выращивания растений в теплице, содержащее систему культивации, включающую размещенные рядами вегетационные лотки и систему создания требуемого климатического режима, включающую узел облучения растений с блоком управления и линейными источниками оптического излучения, установленными в держателях первой группы, и над и вдоль вегетационных лотков. Недостаток известного способа выращивания растений и устройства для его ... 2450505 Порционное устройство для вытирания семян трав ... При этом терочные поверхности стакана (боковая цилиндрическая поверхность и дно) выполнены гладкими.По сравнению с предыдущими данное устройство проще, позволяет обрабатывать малые порции материала, быстро производить очистку при переходе на другую культуру и сорт.По совокупности существенных признаков и технической сущности данное устройство наиболее близко заявляемому и принято за прототип.Недостатками прототипа являются отсутствие таймера (реле времени вытирания порции материала), затрудняющее управление процессом вытирания, и гладкие терочные поверхности (без рифления), что способствует скольжению материала по ним с минимальным участием сил трения и увеличивает время обработки ... 2106082 Устройство для укладки подстилочного навоза в бурт ... навоза. 3. Разделение навоза в отстойниках-накопителях. 4. Разделение жидкого навоза механическими средствами. 5. Разделение жидкого навоза с полной биологической обработкой жидкой фракции. 6. Разделение жидкого навоза с частичной биологической обработкой жидкой фракции. Для реализации этих способов обработки бесподстилочного навоза разработано несколько комплексов и видов средств механизации из них: комплексных насосных станций, несколько видов резервуаров осветительных стоков, отделителей механических включений, перемешивающие устройства, виброгрохоты, шнекопрессы, виброфильтры, горизонтальные и наклонные транспортеры, обезвоживающие бункеры-дозаторы, дуговые сита, установки ... 2195801 Картофелекопатель швыряльного типа ... низкая производительность в связи с тем, что он оснащен одним лемехом; высокие потери клубней вследствие засыпания их почвой; невозможность подбора клубней сразу после прохода копателя; повышенные повреждения клубней, особенно при работе на сухой почве. Задачей изобретения является создание простого и энергоэкономичного картофелекопателя, обеспечивающего высокую интенсивность процесса сепарации клубней и обладающего улучшенной эксплуатационной надежностью. Сущность изобретения заключается в следующем. Картофелекопатель снабжен вторым лемехом. Оба лемеха плоские. Ротор установлен с возможностью подачи клубненосной массы с лемехов в сторону, обратную направлению движения ... 2479996 Экологический комплекс для аквакультуры и рекультивации морских вод ... устройства 34 соединяют с блоком 31 программного управления (БПУ) с помощью электрокабеля 35 или радиофицированного приемно-передающего устройства 36. Выходы БПУ 31 подсоединяют к входам аэратора 6 и помпы 5, а также с помощью электрокабеля 35 или радиофицированного приемно-передающего устройства 36 к электрокранам 25 разводящих труб 29. Комплекс устанавливают в зонах повышенного загрязнения водной среды, например в районе буровых платформ, глубоководных пирсах, под свайными причалами и на других гидротехнических сооружениях. Моллюски являются активными фильтратами, питающимися за счет извлечения из воды пищевых компонентов и способны накапливать вредные и токсические вещества, ... |
Еще из этого раздела: 2165141 Тепличный гидропонный комплекс 2502793 Масло, семена и растения подсолнечника с модифицированным распределением жирных кислот в молекуле триацилглицерина 2264082 Способ восстановления полей бурой водоросли ламинарии 2049387 Инкубатор индивидуального пользования 2165134 Корнеподрезающий рабочий орган машины для добычи лакричного сырья 2269892 Способ выращивания цыплят-бройлеров 2476068 Фильтр для использования при переработке пищевых продуктов 2027341 Бункер для сыпучих материалов 2271095 Многофункциональное устройство 2236124 Способ создания местообитания и адаптации молоди объектов аквакультуры в водных экосистемах |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||