Производные пиридина, способ их получения, инсектицидная композицияПатент на изобретение №: 2083562 Автор: Тадааки Токи[JP], Тору Коянаги[JP], Масаюки Морита[JP], Тецуо Йонеда[JP], Тихару Кагимото[JP], Хироси Окада[JP] Патентообладатель: Исихара Сангио Кайся Лтд. (JP) Дата публикации: 10 Июля, 1997 Адрес для переписки: подача заявки22.07.1993 публикация патента10.07.1997 Изображения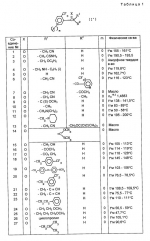   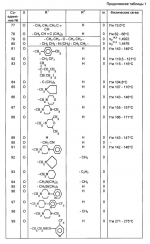 Использование: сельское хозяйство, средства защиты растений. Сущность изобретения: продукт формулы 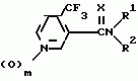 X - атом кислорода или серы; R1- H, низший алкил, который может быть замещен, низший алкенил, низший алкинил, C3-C6-циклоалкил, C(W")R3, W" -атом кислорода или серы, R3 - низший алкил, низший алкокси, /низший алкил/ тио, /низший алкил/ амино; SO2R4, R4 - низший алкил, ди /низший алкил/ амино, NHR5, R5 - 2-пиридил; R2 - водород, низший алкил, который может быть замещен низшим алкокси или /низший алкил/-карбонилокси, C(O)R3, R3 - низший алкил, низший алкокси, /низший алкил/тио, трифторметилпиридил, SO2R4, R4 - низший алкил; R1 и R2, взятые вместе, образуют группу C(R6)(R7), R6 и R7 - низший алкокси, /низший алкил/ тио; R1 и R2 вместе с атомом азота образуют морфолиновое кольцо, 2-цианимино-3-метил-1,3-диазолидиновое кольцо, m - 0 или 1. Реагент I: 4-трифторметилпиридин-3-карбоновой кислоты или ее реакционноспособное производное. Реагент II: HN(R1)R2, инсектицидная композиция на основе продукта. 3 с. и 6 з.п. ф-лы, 1 табл.
, , , , X - атом кислорода или серы; R1- H, низший алкил, который может быть замещен, низший алкенил, низший алкинил, C3-C6-циклоалкил, C(W")R3, W" -атом кислорода или серы, R3 - низший алкил, низший алкокси, /низший алкил/ тио, /низший алкил/ амино; SO2R4, R4 - низший алкил, ди /низший алкил/ амино, NHR5, R5 - 2-пиридил; R2 - водород, низший алкил, который может быть замещен низшим алкокси или /низший алкил/-карбонилокси, C(O)R3, R3 - низший алкил, низший алкокси, /низший алкил/тио, трифторметилпиридил, SO2R4, R4 - низший алкил; R1 и R2, взятые вместе, образуют группу C(R6)(R7), R6 и R7 - низший алкокси, /низший алкил/ тио; R1 и R2 вместе с атомом азота образуют морфолиновое кольцо, 2-цианимино-3-метил-1,3-диазолидиновое кольцо, m - 0 или 1. Реагент I: 4-трифторметилпиридин-3-карбоновой кислоты или ее реакционноспособное производное. Реагент II: HN(R1)R2, инсектицидная композиция на основе продукта. 3 с. и 6 з.п. ф-лы, 1 табл.
, , , , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУИзобретение относится к амидным соединениям и их солям, способам их получения и пестицидным композициям, содержащим их в качестве активных ингредиентов. Известны различные соединения в качестве активных ингредиентов для пестицидов. Однако их химические структуры отличны от амидных соединений согласно настоящему изобретению. До настоящего времени в качестве активных ингредиентов для пестицидов, таких как инсектициды, применялись фосфороорганические соединения, карбаматные соединения и пиретроидные соединения. В результате некоторые вредные насекомые за последние годы приобрели сопротивляемость к таким инсектицидам. Поэтому существует потребность в пестициде, эффективном против вредителей, имеющих такую сопротивляемость. Далее, провели научные исследования и разработки нового пестицида, который эффективнее против вредных насекомых и безопаснее для рыб, водных панцирных животных и домашних животных или который имеет более широкий пестицидный спектр. Целью настоящего изобретения является создание амидных соединений, имеющих пестицидную активность, способов их получения и пестицидных композиций, их содержащих. Авторы настоящего изобретения провели обширные исследования с целью разработки пестицидов и нашли, что амидные соединения, имеющие определенную специфическую химическую структуру, обладают отличными пестицидными свойствами. Настоящее изобретение выполнено на основе данного открытия. Так, настоящее изобретение предлагает амидное соединение формулы (1) или его соль: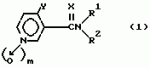 где X представляет собой атома кислорода или атом серы; Y представляет собой галоидалкильную группу; каждый R1 и R2, независимо друг от друга, представляет собой атом водорода, алкильную группу, которая может быть замещена, алкенильную группу, которая может быть замещена, алкинильную группу, которая может быть замещена, -C(W")R3, S(O)nR4 или -NHR5, либо R1 и R2 вместе образуютC(R6)R7 или вместе с соседним атомом азота образуют C4-5 5- или 6-членную гетероциклическую группу, которая может содержать атом азота или атом кислорода; R3 представляет собой алкильную группу, которая может быть замещена, алкенильную группу, которая может быть замещена, алкинильную группу, которая может быть замещена, циклоалкильную группу, которая может быть замещена, арильную группу, которая может быть замещена, алкоксильную группу, алкилтиогруппу или моно- или диалкиламиногруппу; R4 представляет собой алкильную группу или диалкиламиногруппу; R5 представляет собой алкильную группу или арильную группу; каждый из R6 и R7 независимо друг от друга представляет собой алкоксильную группу или алкилтиогруппу; W" представляет собой атом кислорода или атом серы; m есть 0 или 1; n 1 или 2; способ получения указанного амидного соединения и содержащую его пестицидную композицию. Ниже настоящее изобретение описывается подробно со ссылками на предпочтительные варианты. В формуле (I) Y представляет собой галоидалькильную группу, такую как CF3, CHF2, CH2F, CF2CI, CFCI2, CCI3, CH2CF3, CF2CF3, CHBr2, CH2Br и тому подобное. Предпочтительно Y представляет собой галоидалкильную группу, имеющую от 1 до 2 атомов углерода и от 1 до 5 атомов галогена, предпочтительнее трифторметил. Заместителем алкильной группы, которая может быть замещена, алкенильной группы, которая может быть замещена, алкинильной группы, которая может быть замещена или циклоалькильной группы, которая может быть замещена, в определении каждого R1, R2 и R3 в формуле (1) может быть, например, атом галогена; алкокси; адкилтио; триалкилсилил; фенил; фенил, замещенный галогеном, алкилом, алкокси, нитро или галоидалкилом; фенил, замещенный феноксигруппой, которая может быть замещена алкокси или алколтио; фенокси; фенилтио; амино; аминогруппа, замещенная одним или двумя алкилами; C2-6 циклическая аминогруппа; морфолино; замещенная алкил морфолиногруппа; 1-пиперидинил; 1-пиперидинил, замещенный алкилом, фенилом, пиридилом или трифторметилпиридилом; гидрокси; циано; циклоалкил; амино; - C(W2)R8, где N2 представляет собой атом кислорода или атом серы, R8 представляет собой атом водорода, амино, аминогруппу, замещенную одним или двумя алкилами, алкил, алкокси, алкилтио или арил или OC(W2)R9 (где R9 представляет собой алкил или арил, замещенный галоидалкилом); или алкилсульфонил. Когда вышеупомянутый заместитель является иминогруппой, он может образовывать амидиногруппу или имидатную группу вместе с аминогруппой или алкоксигруппой. Заместитель для алкильной группы, которая может быть замещена, в определении каждого R1 и R2 включает, например, 4-галоидалкил-3-пиридинкарбоксамидную группу, N-метил-4-галоидалкил-3-пиридинкарбоксамидную группу, и 4-галоидалкил-3-пиридинкарбоксамид-N-алкиленоксигруппу. Химическая структура формулы (1), содержащая такой заместитель, может быть представлена, например, следующей формулой: где X представляет собой атома кислорода или атом серы; Y представляет собой галоидалкильную группу; каждый R1 и R2, независимо друг от друга, представляет собой атом водорода, алкильную группу, которая может быть замещена, алкенильную группу, которая может быть замещена, алкинильную группу, которая может быть замещена, -C(W")R3, S(O)nR4 или -NHR5, либо R1 и R2 вместе образуютC(R6)R7 или вместе с соседним атомом азота образуют C4-5 5- или 6-членную гетероциклическую группу, которая может содержать атом азота или атом кислорода; R3 представляет собой алкильную группу, которая может быть замещена, алкенильную группу, которая может быть замещена, алкинильную группу, которая может быть замещена, циклоалкильную группу, которая может быть замещена, арильную группу, которая может быть замещена, алкоксильную группу, алкилтиогруппу или моно- или диалкиламиногруппу; R4 представляет собой алкильную группу или диалкиламиногруппу; R5 представляет собой алкильную группу или арильную группу; каждый из R6 и R7 независимо друг от друга представляет собой алкоксильную группу или алкилтиогруппу; W" представляет собой атом кислорода или атом серы; m есть 0 или 1; n 1 или 2; способ получения указанного амидного соединения и содержащую его пестицидную композицию. Ниже настоящее изобретение описывается подробно со ссылками на предпочтительные варианты. В формуле (I) Y представляет собой галоидалькильную группу, такую как CF3, CHF2, CH2F, CF2CI, CFCI2, CCI3, CH2CF3, CF2CF3, CHBr2, CH2Br и тому подобное. Предпочтительно Y представляет собой галоидалкильную группу, имеющую от 1 до 2 атомов углерода и от 1 до 5 атомов галогена, предпочтительнее трифторметил. Заместителем алкильной группы, которая может быть замещена, алкенильной группы, которая может быть замещена, алкинильной группы, которая может быть замещена или циклоалькильной группы, которая может быть замещена, в определении каждого R1, R2 и R3 в формуле (1) может быть, например, атом галогена; алкокси; адкилтио; триалкилсилил; фенил; фенил, замещенный галогеном, алкилом, алкокси, нитро или галоидалкилом; фенил, замещенный феноксигруппой, которая может быть замещена алкокси или алколтио; фенокси; фенилтио; амино; аминогруппа, замещенная одним или двумя алкилами; C2-6 циклическая аминогруппа; морфолино; замещенная алкил морфолиногруппа; 1-пиперидинил; 1-пиперидинил, замещенный алкилом, фенилом, пиридилом или трифторметилпиридилом; гидрокси; циано; циклоалкил; амино; - C(W2)R8, где N2 представляет собой атом кислорода или атом серы, R8 представляет собой атом водорода, амино, аминогруппу, замещенную одним или двумя алкилами, алкил, алкокси, алкилтио или арил или OC(W2)R9 (где R9 представляет собой алкил или арил, замещенный галоидалкилом); или алкилсульфонил. Когда вышеупомянутый заместитель является иминогруппой, он может образовывать амидиногруппу или имидатную группу вместе с аминогруппой или алкоксигруппой. Заместитель для алкильной группы, которая может быть замещена, в определении каждого R1 и R2 включает, например, 4-галоидалкил-3-пиридинкарбоксамидную группу, N-метил-4-галоидалкил-3-пиридинкарбоксамидную группу, и 4-галоидалкил-3-пиридинкарбоксамид-N-алкиленоксигруппу. Химическая структура формулы (1), содержащая такой заместитель, может быть представлена, например, следующей формулой: 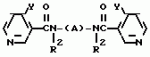 где Y и R2 имеют вышеуказанные значения, а А представляет собой где Y и R2 имеют вышеуказанные значения, а А представляет собой 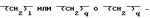 , l есть целое число от 1 до 4 и q есть 1 или 2. Конкретно, соединение согласно формуле представляет собой димер, в котором соединения формулы (1) соединены, например, алкиленовой цепью. Аналогично, соединение согласно настоящему изобретению включает тример, основанный на той же концепции. Заместителем арильной группы, которая может быть замещена, в определении R3 в формуле (1) может быть, например, атом галогена, алкил, галоидалкил, алкокси, галоидалкокси, алкилтио, циклоалкил, циклоалкокси, алкоксикарбонил, алкилкарбонил, алкилкарбонилокси, арил, арилокси, арилтио, амино, аминогруппа, замещенная одним или двумя алкилами, циано, нитро или гидрокси. В формуле (1) алкильная группа или алкильная часть, включенная в R1 или R2, может быть, например, алкильной группой или алкильной частью, имеющей от 1 до 6 атомов углерода, такой как метильная группа, этильная группа, пропильная группа, бутильная группа, пентильная группа или гексильная группа, и в случае 3 и более атомов углерода иметь линейную или разветвленную изомерную структуру. Алкенильная группа, включенная в R1 и R2, может, например, быть группой, имеющей от 2 до 6 атомов углерода, такой как этенильная группа, пропенильная группа, бутенильная группа, пентенильная группа или гексенильная группа и в случае трех и более атомов углерода может иметь линейную или разветвленную изомерную структуру. Алкильная группа, включенная в R1 и R2, может, например, быть группой, имеющей от 2 до 6 атомов углерода, такой как этинильная группа, пропильная группа, бутинильная группа, пентинильная группа или гексинильная группа и в случае трех и более атомов углерода может иметь линейную или разветвленную изомерную структуру. Циклоалкильная группа, включенная в R1 или R2, может, например, быть группой, имеющей от 3 до 8 атомов углерода, циклопентильная группа или циклогексильная группа. В формуле (1) C4-5 5- или 6-членная гетероциклическая группа, которая может содержать атом азота или атом кислорода, образованная R1 и R2 вместе с соседним атомом азота, может, например, быть морфолиногруппой, пирролидиногруппой, пиперидиногруппой, 1-имидазолидильной группой, 2-цианоимино-3-метил-1-имидазолидильной группой, 1-пиперадинильной группой или 4-метил-2-пиперадинильной группой. Арильная группа, упомянутая в определении формулы (1), может быть, например, фенильной группой, тиенильной группой, фуранильной группой, пиридильной группой, нафтильной группой, бензотиенильной группой, бензофуранильной группой или хинолинильной группой. Соединение формулы (1) может образовывать соль с кислотным веществом или основным веществом. Соль с кислотным веществом может быть неорганической солью, такой как гидрохлорид, гидробромид, фосфат, сульфат или нитрат. Соль с основным веществом может быть солью неорганического или органического основания, такой как натриевая соль, калиевая соль, кальциевая соль, аммониевая соль или диметиламиновая соль. Амидное соединение или его соль согласно настоящему изобретению предпочтительно является следующим соединением: (1) Соединение формулы (1) или его соль, в которой X является атомом кислорода. (2) Соединение формулы (1) или его соль, в которой каждый R1 и R2, которые независимы друг от друга, представляют собой атом водорода, алкильную группу, которая может быть замещена на -C(W1)R3, или R1 и R2 вместе образуют C(R6)R7, является атомом кислорода или атомом серы, R3 представляет собой алкильную группу, которая может быть замещена, арильную группу, которая может быть замещена, или алкоксильную группу, и каждое R6 и R7, которые независимы друг от друга, представляют собой алкоксильную группу или алкилтиогруппу. Более предпочтительно соединение формулы (1) или его соль, в которой X представляет собой атом кислорода, каждое из R1 и R2, которые независимы друг от друга, представляет собой атом водорода, алкильную группу, алкоксиалкильную группу, алкиламиноалкильную группу, C2-6 циклическую аминоалкильную группу, гидроасиалкильную группу, цианоалкильную группу, тиокарбамоилалкильную группу, алкилкарбонилоксиалкильную группу, алкилкарбонильную группу, арилкарбонильную группу, трифторметил-замещенную арилкарбонильную группу, алкокситиокарбонильную группу или алкоксикарбонильную группу или R1 и R2 вместе образуютC(R6)R7, и R6 и R7 представляют собой алкоксильную группу и алкилтиогруппу, соответственно. Конкретные примеры предпочтительных соединений включают следующие соединения: 4-трифторметил-3-пиридинкарбоксамид, N-цианометилл-4-трифторметил-3-пиридинкарбоксамид, N-тиокарбамоилметил-4-трифторметил-3-пиридинкарбоксамид, N-этоксиметил-4-трифторметил-3-приридинкарбоксамид, N-изопропиламинометил-4-трифторметил-3-пиридинкарбоксамид, N-цианометил-N, N-бис(4-трифторметилникотиноил)амин, N-ацетил-N-цианометил-4-трифторметил-3-пиридинкарбоксамид, N-цианометил-N-метил-4-трифторметилпиридин-3-карбоксамид, O-метиловый эфир N-(4-трифторметилникотиноил)тиокарбаминовой кислоты, N-метил-4-трифторметилпиридин-3-карбоксамид, N-(N", N"-диметиламинометил)-4-трифторметилпиридин-3-карбоксамид, N-(1-пиперидинил)-4-трифторметилпиридин-3-карбоксамид, N-цианометиловый эфир N-(4-трифторметилникотиноил) аминометилпивалиновой кислоты, O, S-диметиловый эфир N-(4-трифторметилникотинол) иминомуравьиной кислоты, N-гидроксиметил-4-трифторметил-3-пиридинкарбоксамид, N-ацетил-4-трифторметило-3-пиридинкарбоксамид или метиловый эфир N-(4-трифторметилникотиноил)карбамаминовой кислоты или 1-оксид этих соединений. Соединение формулы (1) или его соль могут быть получены, например, следующим способом (А): , l есть целое число от 1 до 4 и q есть 1 или 2. Конкретно, соединение согласно формуле представляет собой димер, в котором соединения формулы (1) соединены, например, алкиленовой цепью. Аналогично, соединение согласно настоящему изобретению включает тример, основанный на той же концепции. Заместителем арильной группы, которая может быть замещена, в определении R3 в формуле (1) может быть, например, атом галогена, алкил, галоидалкил, алкокси, галоидалкокси, алкилтио, циклоалкил, циклоалкокси, алкоксикарбонил, алкилкарбонил, алкилкарбонилокси, арил, арилокси, арилтио, амино, аминогруппа, замещенная одним или двумя алкилами, циано, нитро или гидрокси. В формуле (1) алкильная группа или алкильная часть, включенная в R1 или R2, может быть, например, алкильной группой или алкильной частью, имеющей от 1 до 6 атомов углерода, такой как метильная группа, этильная группа, пропильная группа, бутильная группа, пентильная группа или гексильная группа, и в случае 3 и более атомов углерода иметь линейную или разветвленную изомерную структуру. Алкенильная группа, включенная в R1 и R2, может, например, быть группой, имеющей от 2 до 6 атомов углерода, такой как этенильная группа, пропенильная группа, бутенильная группа, пентенильная группа или гексенильная группа и в случае трех и более атомов углерода может иметь линейную или разветвленную изомерную структуру. Алкильная группа, включенная в R1 и R2, может, например, быть группой, имеющей от 2 до 6 атомов углерода, такой как этинильная группа, пропильная группа, бутинильная группа, пентинильная группа или гексинильная группа и в случае трех и более атомов углерода может иметь линейную или разветвленную изомерную структуру. Циклоалкильная группа, включенная в R1 или R2, может, например, быть группой, имеющей от 3 до 8 атомов углерода, циклопентильная группа или циклогексильная группа. В формуле (1) C4-5 5- или 6-членная гетероциклическая группа, которая может содержать атом азота или атом кислорода, образованная R1 и R2 вместе с соседним атомом азота, может, например, быть морфолиногруппой, пирролидиногруппой, пиперидиногруппой, 1-имидазолидильной группой, 2-цианоимино-3-метил-1-имидазолидильной группой, 1-пиперадинильной группой или 4-метил-2-пиперадинильной группой. Арильная группа, упомянутая в определении формулы (1), может быть, например, фенильной группой, тиенильной группой, фуранильной группой, пиридильной группой, нафтильной группой, бензотиенильной группой, бензофуранильной группой или хинолинильной группой. Соединение формулы (1) может образовывать соль с кислотным веществом или основным веществом. Соль с кислотным веществом может быть неорганической солью, такой как гидрохлорид, гидробромид, фосфат, сульфат или нитрат. Соль с основным веществом может быть солью неорганического или органического основания, такой как натриевая соль, калиевая соль, кальциевая соль, аммониевая соль или диметиламиновая соль. Амидное соединение или его соль согласно настоящему изобретению предпочтительно является следующим соединением: (1) Соединение формулы (1) или его соль, в которой X является атомом кислорода. (2) Соединение формулы (1) или его соль, в которой каждый R1 и R2, которые независимы друг от друга, представляют собой атом водорода, алкильную группу, которая может быть замещена на -C(W1)R3, или R1 и R2 вместе образуют C(R6)R7, является атомом кислорода или атомом серы, R3 представляет собой алкильную группу, которая может быть замещена, арильную группу, которая может быть замещена, или алкоксильную группу, и каждое R6 и R7, которые независимы друг от друга, представляют собой алкоксильную группу или алкилтиогруппу. Более предпочтительно соединение формулы (1) или его соль, в которой X представляет собой атом кислорода, каждое из R1 и R2, которые независимы друг от друга, представляет собой атом водорода, алкильную группу, алкоксиалкильную группу, алкиламиноалкильную группу, C2-6 циклическую аминоалкильную группу, гидроасиалкильную группу, цианоалкильную группу, тиокарбамоилалкильную группу, алкилкарбонилоксиалкильную группу, алкилкарбонильную группу, арилкарбонильную группу, трифторметил-замещенную арилкарбонильную группу, алкокситиокарбонильную группу или алкоксикарбонильную группу или R1 и R2 вместе образуютC(R6)R7, и R6 и R7 представляют собой алкоксильную группу и алкилтиогруппу, соответственно. Конкретные примеры предпочтительных соединений включают следующие соединения: 4-трифторметил-3-пиридинкарбоксамид, N-цианометилл-4-трифторметил-3-пиридинкарбоксамид, N-тиокарбамоилметил-4-трифторметил-3-пиридинкарбоксамид, N-этоксиметил-4-трифторметил-3-приридинкарбоксамид, N-изопропиламинометил-4-трифторметил-3-пиридинкарбоксамид, N-цианометил-N, N-бис(4-трифторметилникотиноил)амин, N-ацетил-N-цианометил-4-трифторметил-3-пиридинкарбоксамид, N-цианометил-N-метил-4-трифторметилпиридин-3-карбоксамид, O-метиловый эфир N-(4-трифторметилникотиноил)тиокарбаминовой кислоты, N-метил-4-трифторметилпиридин-3-карбоксамид, N-(N", N"-диметиламинометил)-4-трифторметилпиридин-3-карбоксамид, N-(1-пиперидинил)-4-трифторметилпиридин-3-карбоксамид, N-цианометиловый эфир N-(4-трифторметилникотиноил) аминометилпивалиновой кислоты, O, S-диметиловый эфир N-(4-трифторметилникотинол) иминомуравьиной кислоты, N-гидроксиметил-4-трифторметил-3-пиридинкарбоксамид, N-ацетил-4-трифторметило-3-пиридинкарбоксамид или метиловый эфир N-(4-трифторметилникотиноил)карбамаминовой кислоты или 1-оксид этих соединений. Соединение формулы (1) или его соль могут быть получены, например, следующим способом (А): 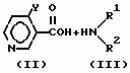 или его реакционноспособное производное или его реакционноспособное производное 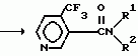 (1-1) В вышеприведенных формулах Y, R1 и R2 имеют вышеуказанное значение. Реакционноспособным производным 4-галоидалкилпиридин-3-карбоновой кислоты формулы (II) может быть, например, галоидангидрид кислоты, сложный эфир или ангидрид кислоты. Вышеприведенную реакцию проводят обычно в присутствии растворителя, если необходимо, в присутствии основания. Растворителем может быть, например, ароматический углеводород, такой как бензол или толуол; эфир, такой как диэтиловый эфир или тетрагидрофуран; галогенированный углеводород, такой как метиленхлорид или хлороформ; или апротонный полярный растворитель, такой как ацетонитрил, диметилформамид или пиридин. Эти растворители могут применяться по отдельности или в комбинации как смесь. Основанием может быть, например, третичный амин, такой как триметиламин, триэтиламин или пиридин; гидроксид щелочного металла, такой как гидроксид натрия или гидроксид калия; карбонат щелочного металла, такой как карбонат натрия или карбонат калия; или алкоксид щелочного металла, такой как метоксид натрия или этоксид натрия. Когда реагентом является 4-галоидалкилпиридин-3-карбоновая кислота, обычно применяют агент конденсации, такой как дициклогексилкарбодиимид, N, N"-карбонилдимидазол или 1-этил-3-(3-диметиламинопропил)карбодиимид. Температура вышеприведенной реакции обычно лежит в пределах от -50 до +100oC. Однако, когда реакционноспособным производным является галоидангидрид кислоты или ангидрид кислоты, температура предпочтительно оставляет от 0 до 30oC, а когда реакционноспособным производным является сложный эфир, температура предпочтительно составляет от 50 до 100oC. Время реакции составляет обычно от 0,1 до 24 ч. Соединение формулы (1), в котором m равно 1, т. е. соединение следующей формулы (1-2), может быть получено реакцией соединения вышеприведенной формулы (1-1) с окисляющим агентом. (1-1) В вышеприведенных формулах Y, R1 и R2 имеют вышеуказанное значение. Реакционноспособным производным 4-галоидалкилпиридин-3-карбоновой кислоты формулы (II) может быть, например, галоидангидрид кислоты, сложный эфир или ангидрид кислоты. Вышеприведенную реакцию проводят обычно в присутствии растворителя, если необходимо, в присутствии основания. Растворителем может быть, например, ароматический углеводород, такой как бензол или толуол; эфир, такой как диэтиловый эфир или тетрагидрофуран; галогенированный углеводород, такой как метиленхлорид или хлороформ; или апротонный полярный растворитель, такой как ацетонитрил, диметилформамид или пиридин. Эти растворители могут применяться по отдельности или в комбинации как смесь. Основанием может быть, например, третичный амин, такой как триметиламин, триэтиламин или пиридин; гидроксид щелочного металла, такой как гидроксид натрия или гидроксид калия; карбонат щелочного металла, такой как карбонат натрия или карбонат калия; или алкоксид щелочного металла, такой как метоксид натрия или этоксид натрия. Когда реагентом является 4-галоидалкилпиридин-3-карбоновая кислота, обычно применяют агент конденсации, такой как дициклогексилкарбодиимид, N, N"-карбонилдимидазол или 1-этил-3-(3-диметиламинопропил)карбодиимид. Температура вышеприведенной реакции обычно лежит в пределах от -50 до +100oC. Однако, когда реакционноспособным производным является галоидангидрид кислоты или ангидрид кислоты, температура предпочтительно оставляет от 0 до 30oC, а когда реакционноспособным производным является сложный эфир, температура предпочтительно составляет от 50 до 100oC. Время реакции составляет обычно от 0,1 до 24 ч. Соединение формулы (1), в котором m равно 1, т. е. соединение следующей формулы (1-2), может быть получено реакцией соединения вышеприведенной формулы (1-1) с окисляющим агентом. 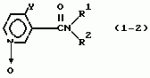 где Y, R1 и R2 имеют вышеуказанное значение. Эту реакцию обычно проводят в присутствии растворителя. В качестве растворителя можно упомянуть, например, уксусную кислоту. В качестве окисляющего агента обычно применяют пероксид водорода. Температура реакции обычно лежит в пределах от 50 до 100oC, и время реакции составляет обычно от 6 до 24 ч. Соединение формулы (1), в которой X представляет собой атом серы, может быть получено по реакции соединения вышеприведенной формулы (1-1) с агентом сульфинирования, таким как пентасульфид фосфора. Реакцию проводят обычно в присутствии растворителя. В качестве растворителя предпочтительно применяют толуол или ксилол. Температура вышеприведенной реакции обычно лежит между 80 и 150oC, предпочтительно между 110 и 130oC. Время реакции составляет обычно от 1 до 12 ч. Далее, соединение формулы (1) или его соль могут быть получены, например, следующим способом (В): где Y, R1 и R2 имеют вышеуказанное значение. Эту реакцию обычно проводят в присутствии растворителя. В качестве растворителя можно упомянуть, например, уксусную кислоту. В качестве окисляющего агента обычно применяют пероксид водорода. Температура реакции обычно лежит в пределах от 50 до 100oC, и время реакции составляет обычно от 6 до 24 ч. Соединение формулы (1), в которой X представляет собой атом серы, может быть получено по реакции соединения вышеприведенной формулы (1-1) с агентом сульфинирования, таким как пентасульфид фосфора. Реакцию проводят обычно в присутствии растворителя. В качестве растворителя предпочтительно применяют толуол или ксилол. Температура вышеприведенной реакции обычно лежит между 80 и 150oC, предпочтительно между 110 и 130oC. Время реакции составляет обычно от 1 до 12 ч. Далее, соединение формулы (1) или его соль могут быть получены, например, следующим способом (В): 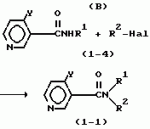 В вышеприведенных формулах Y, R1 и R2 имеют вышеуказанное значение при условии, что здесь R2 отличен от водорода, а HaI является атомом галогена. Реакция по способу (В) может проводиться так же, как и реакция по вышеуказанному способу (А). Далее, можно упомянуть другие способы получения соединений формулы (1) или их солей, например следующие: В вышеприведенных формулах Y, R1 и R2 имеют вышеуказанное значение при условии, что здесь R2 отличен от водорода, а HaI является атомом галогена. Реакция по способу (В) может проводиться так же, как и реакция по вышеуказанному способу (А). Далее, можно упомянуть другие способы получения соединений формулы (1) или их солей, например следующие: 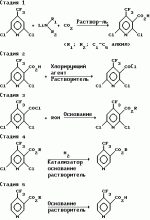 В вышеприведенных формулах R" и R являются алкильными группами, R" представляет собой атом водорода или алкильную группу. Реакция по вышеуказанному способу (C-1) может проводиться в присутствии растворителя или основания. Растворитель может быть, например, ароматическим углеводородом, таким как бензол или толуол; эфир, такой как тетрагидрофуран; галогенированный углеводород, такой как метиленхлорид или хлороформ; или апротонный полярный растворитель, такой как ацетонитрил, диметилформамид или пиридин. Эти растворители могут применяться по отдельности или в комбинации как смесь. В качестве основания предпочтительно применяют основание, такое как триэтиламин или пиридин. Температура вышеприведенной реакции обычно лежит между 0 и 50oC, предпочтительно между 20 и 40oC, и время реакции составляет обычно от 1 до 6 ч. Реакция первой половины вышеуказанного способа (С-2) может проводиться в присутствии хлористоводородного газа и растворителя. Растворитель, например, может быть эфиром, таким как тетрагидрофуран или диэтилэфир; галогенированным углеводородом, таким как метиленхлорид или хлороформ; или ароматическим углеводородом, таким как бензол или нитробензол. Эти растворители могут применяться по отдельности или в комбинации как смесь. Температура реакции обычно лежит в пределах от -10 до +30oC, предпочтительно от -5 до 10oC, а время реакции составляет обычно от 4 до 168 ч. Вторая половина реакции может проводиться в присутствии растворителя. Растворителем может быть, например, спирт, такой как метанол или этанол. Температура реакции лежит обычно в пределах от 0 до 80oC, предпочтительно от 20 до 50oC, а время реакции составляет обычно от 1 до 8 ч. Реакция вышеуказанного способа (С-3) может проводиться в присутствии растворителя. Растворителем может быть, например, вода или спирт, такой как метанол или этанол. Такие растворители могут применяться в отдельности или в комбинации как смесь. Температура реакции обычно лежит в пределах от 10 до 100oC, предпочтительно от 20 до 80oC, а время реакции обычно составляет от 1 до 12 ч. Реакция вышеуказанного способа (С-4) может проводиться при тех же условиях, что и в способе (С-3). Реакция вышеуказанного способа (С-5) может проводиться в присутствии хлористоводородного газа и растворителя. Растворителем может быть, например, эфир, такой как диметоксиэтан или диоксан. Температура реакции обычно лежит в пределах от -50 до +50oC, предпочтительно от -30 до +20oC. Время реакции составляет обычно от 1 до 8 ч. Реакции вышеуказанного способа (С-6) являются трехстадийными. Реакция первой стадии проводится в присутствии растворителя. Растворителем может быть, например, ароматической углеводород, такой как бензол или толуол; эфир, такой как диэтилэфир или тетрагидрофуран; галогенированный углеводород, такой как метиленхлорид или хлороформ; или апротонный полярный растворитель, такой как ацетонитрил или диметилформамид. Такие растворители могут применяться по отдельности или в комбинации как смесь. Температура реакции обычно лежит между 30 и 120oC, предпочтительно между 50 и 80oC, и время реакции обычно составляет от 1 до 12 ч. Реакция второй стадии проводится в присутствии растворителя. Растворителем может быть, например, тот же растворитель, что и упомянут для реакции первой ступени. Температура реакции обычно лежит между 0 и 100oC, предпочтительно между 20 и 50oC, а время реакции составляет обычно от 1 до 12 ч. Реакция третьей стадии проводится в присутствии растворителя и основания. Растворителем может быть, например, апротонный полярный растворитель, такой как ацетонитрил или диметилформамид. Основанием может быть, например, гидрид щелочного металла, такой как гидрид натрия или гидрид калия; гидроксид щелочного металла, такой как гидроксид натрия или гидроксид калия; алкоксид щелочного металла, такой как метоксид натрия или этоксид натрия; или третичный амин, такой как триэтиламин или пиридин. Температура реакции обычно лежит в пределах от 0 до 100oC, предпочтительно от 20 до 50oC, а время реакции обычно составляет от 1 до 12 ч. Среди соединений формулы (I), соединение, в котором X представляет собой атом кислорода, Y представляет CF3, а R1 и R2 одновременно являются атомами водорода, т. е. 4-трифторметил-3-пиридинкарбоксамид, может быть получено по вышеуказанному способу (А) с использованием аммиака в качестве соединения формулы (III). Иначе говоря, оно может быть получено следующим образом из 2,6-дихлор-3-циано-4-трифторметилпиридина: В вышеприведенных формулах R" и R являются алкильными группами, R" представляет собой атом водорода или алкильную группу. Реакция по вышеуказанному способу (C-1) может проводиться в присутствии растворителя или основания. Растворитель может быть, например, ароматическим углеводородом, таким как бензол или толуол; эфир, такой как тетрагидрофуран; галогенированный углеводород, такой как метиленхлорид или хлороформ; или апротонный полярный растворитель, такой как ацетонитрил, диметилформамид или пиридин. Эти растворители могут применяться по отдельности или в комбинации как смесь. В качестве основания предпочтительно применяют основание, такое как триэтиламин или пиридин. Температура вышеприведенной реакции обычно лежит между 0 и 50oC, предпочтительно между 20 и 40oC, и время реакции составляет обычно от 1 до 6 ч. Реакция первой половины вышеуказанного способа (С-2) может проводиться в присутствии хлористоводородного газа и растворителя. Растворитель, например, может быть эфиром, таким как тетрагидрофуран или диэтилэфир; галогенированным углеводородом, таким как метиленхлорид или хлороформ; или ароматическим углеводородом, таким как бензол или нитробензол. Эти растворители могут применяться по отдельности или в комбинации как смесь. Температура реакции обычно лежит в пределах от -10 до +30oC, предпочтительно от -5 до 10oC, а время реакции составляет обычно от 4 до 168 ч. Вторая половина реакции может проводиться в присутствии растворителя. Растворителем может быть, например, спирт, такой как метанол или этанол. Температура реакции лежит обычно в пределах от 0 до 80oC, предпочтительно от 20 до 50oC, а время реакции составляет обычно от 1 до 8 ч. Реакция вышеуказанного способа (С-3) может проводиться в присутствии растворителя. Растворителем может быть, например, вода или спирт, такой как метанол или этанол. Такие растворители могут применяться в отдельности или в комбинации как смесь. Температура реакции обычно лежит в пределах от 10 до 100oC, предпочтительно от 20 до 80oC, а время реакции обычно составляет от 1 до 12 ч. Реакция вышеуказанного способа (С-4) может проводиться при тех же условиях, что и в способе (С-3). Реакция вышеуказанного способа (С-5) может проводиться в присутствии хлористоводородного газа и растворителя. Растворителем может быть, например, эфир, такой как диметоксиэтан или диоксан. Температура реакции обычно лежит в пределах от -50 до +50oC, предпочтительно от -30 до +20oC. Время реакции составляет обычно от 1 до 8 ч. Реакции вышеуказанного способа (С-6) являются трехстадийными. Реакция первой стадии проводится в присутствии растворителя. Растворителем может быть, например, ароматической углеводород, такой как бензол или толуол; эфир, такой как диэтилэфир или тетрагидрофуран; галогенированный углеводород, такой как метиленхлорид или хлороформ; или апротонный полярный растворитель, такой как ацетонитрил или диметилформамид. Такие растворители могут применяться по отдельности или в комбинации как смесь. Температура реакции обычно лежит между 30 и 120oC, предпочтительно между 50 и 80oC, и время реакции обычно составляет от 1 до 12 ч. Реакция второй стадии проводится в присутствии растворителя. Растворителем может быть, например, тот же растворитель, что и упомянут для реакции первой ступени. Температура реакции обычно лежит между 0 и 100oC, предпочтительно между 20 и 50oC, а время реакции составляет обычно от 1 до 12 ч. Реакция третьей стадии проводится в присутствии растворителя и основания. Растворителем может быть, например, апротонный полярный растворитель, такой как ацетонитрил или диметилформамид. Основанием может быть, например, гидрид щелочного металла, такой как гидрид натрия или гидрид калия; гидроксид щелочного металла, такой как гидроксид натрия или гидроксид калия; алкоксид щелочного металла, такой как метоксид натрия или этоксид натрия; или третичный амин, такой как триэтиламин или пиридин. Температура реакции обычно лежит в пределах от 0 до 100oC, предпочтительно от 20 до 50oC, а время реакции обычно составляет от 1 до 12 ч. Среди соединений формулы (I), соединение, в котором X представляет собой атом кислорода, Y представляет CF3, а R1 и R2 одновременно являются атомами водорода, т. е. 4-трифторметил-3-пиридинкарбоксамид, может быть получено по вышеуказанному способу (А) с использованием аммиака в качестве соединения формулы (III). Иначе говоря, оно может быть получено следующим образом из 2,6-дихлор-3-циано-4-трифторметилпиридина: 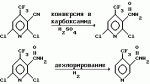 Стадию (D-1) осуществляют путем проведения реакции 2,6-дихлор-3-циано-4-4трифторметилпиридина с концентрированной серной кислотой. Стадию (D-2) осуществляют путем проведения реакции водорода с 2,6-дихлор-4-трифторметил-3-пиридинкарбоксамидом, полученным на предыдущей стадии (D-1), в присутствии растворителя, катализатора и основания. Растворителем может быть, например, спирт, такой как метанол или этанол, или эфир, такой как тетрагидрофуран. Катализатором может быть, например, палладий или палладий (II)хлорид. Основанием может быть, например, ацетат натрия, гидроксид натрия, гидроксид калия или триэтиламин. Температура реакции на стадии (D-2) обычно лежит между 0 и 100oC, а время реакции обычно составляет от 1 до 24 ч. Далее, на вышеуказанной стадии (D-1) аналогичная реакция может быть проведена с использованием 2,6-дибром-3-циан-4-трифторметилпиридина вместо 2,6-дихлор-3-циан-4-трифторметилпиридина. Этот 2,6-дибром-3-циан-4-трифторметилпиридин может быть получен путем реакции 3-циано-2,6-дигидрокси-4-трифторметилпиридина с бромирующим агентом, таким как оксибромид фосфора. Среди соединений формулы (II) соединение, в котором Y представляет собой CF3, т.е. 4-трифторметилпиридин-3-карбоновая кислота, является известным соединением и коммерчески доступно. Далее, 4-галоидалкилпиридин-3-карбоновая кислота может быть получена, например, следующим образом. Стадию (D-1) осуществляют путем проведения реакции 2,6-дихлор-3-циано-4-4трифторметилпиридина с концентрированной серной кислотой. Стадию (D-2) осуществляют путем проведения реакции водорода с 2,6-дихлор-4-трифторметил-3-пиридинкарбоксамидом, полученным на предыдущей стадии (D-1), в присутствии растворителя, катализатора и основания. Растворителем может быть, например, спирт, такой как метанол или этанол, или эфир, такой как тетрагидрофуран. Катализатором может быть, например, палладий или палладий (II)хлорид. Основанием может быть, например, ацетат натрия, гидроксид натрия, гидроксид калия или триэтиламин. Температура реакции на стадии (D-2) обычно лежит между 0 и 100oC, а время реакции обычно составляет от 1 до 24 ч. Далее, на вышеуказанной стадии (D-1) аналогичная реакция может быть проведена с использованием 2,6-дибром-3-циан-4-трифторметилпиридина вместо 2,6-дихлор-3-циан-4-трифторметилпиридина. Этот 2,6-дибром-3-циан-4-трифторметилпиридин может быть получен путем реакции 3-циано-2,6-дигидрокси-4-трифторметилпиридина с бромирующим агентом, таким как оксибромид фосфора. Среди соединений формулы (II) соединение, в котором Y представляет собой CF3, т.е. 4-трифторметилпиридин-3-карбоновая кислота, является известным соединением и коммерчески доступно. Далее, 4-галоидалкилпиридин-3-карбоновая кислота может быть получена, например, следующим образом. 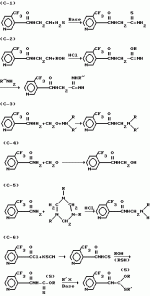 Стадия 1 может осуществляться путем проведения реакции 2,6-дихлор-4-галоидалкилпиридина с газообразным или твердым диоксидом углерода в присутствии литийдиалкиламида (предпочтительно литийдиизопропиламида) и растворителя. Растворителем может быть эфир, такой как тетрагидрофуран или диэтиловый эфир. Температура реакции обычно лежит между -100 и +20oC, предпочтительно от -80 до -20oC, а время реакции составляет от 1 до 12 ч. Стадия 2 может осуществляться путем проведения реакции 2,6-дихлор-4-галоидалкилпиридин-3-карбоновой кислоты, образовавшейся на стадии 1, с хлорирующим агентом в присутствии растворителя. Хлорирующим агентом может быть тионилхлорид или пентахлорид фосфора, а растворителем может быть ароматический углеводород, такой как бензол или толуол. Температура реакции лежит обычно в пределах от 20 до 120oC, предпочтительно от 50 до 100oC, а время реакции составляет от 1 до 6 ч. Стадия 3 может осуществляться путем проведения реакции 2,6-дихлор-4-галоидалкилпиридин-3-карбоновой кислоты, образовавшейся на стадии 2, со спиртом в присутствии основания. Спиртом может быть метанол или этанол, а основанием может быть третичное основание, такое как триэтиламин или пиридин. Температура реакции лежит обычно в пределах от 0 до 80oC, предпочтительно от 20 до 50oC, а время реакции составляет от 1 до 12 ч. Стадия 4 осуществляется путем проведения реакции эфира 2,6-дихлор-4-галоидалкилпиридин-3-карбоновой кислоты, образовавшегося на стадии 3, с водород-газом в присутствии растворителя, катализатора и основания. Растворителем может быть спирт, такой как метанол или этанол, или эфир, такой как тетрагидрофуран; катализатором может быть палладий или палладий(II)хлорид и основанием может быть третичное основание, такое как триэтиламин или пиридин, или ацетат натрия. Температура реакции лежит обычно в пределах от 0 до 100oC, предпочтительно от 20 до 50oC, а время реакции составляет от 1 до 24 ч. Стадия 5 осуществляется путем проведения реакции эфира 4-галоидалкилпиридин-3-карбоновой кислоты, образовавшегося на стадии 4, с основанием в присутствии растворителя. Растворителем может быть вода или спирт, такой как метанол или этанол, и применяться по отдельности или в комбинации как смесь. Основанием может быть гидроксид щелочного металла, такой как гидроксид натрия или гидроксид калия. Температура реакции обычно лежит в пределах от 0 до 100oC, предпочтительно от 20 до 80oC, а время реакции составляет от 1 до 12 ч. Кроме того, реакционноспособное производное может быть получено из соединения формулы (II). Синтез хлорангидрида кислоты может осуществляться путем реакции 4-галоидалкилпиридин-3-карбоновой кислоты с хлорирующим агентом, таким как тионилхлорид или трихлорид фосфора, если необходимо, в присутствии каталитического количества диметилформамида при температуре дефлегмации. Реакционноспособное производное формулы (II), иное чем 4-галоидалкил-3-пиридинкарбонилхлорид, может быть получено способом, подобным обычному способу превращения бензойной кислоты в реакционноспособное производное. Например, бромангидрид кислоты может быть получен путем реакции 4-галоидалкилпиридин-3-карбоновой кислоты с бромирующим агентом, таким как трибромид фосфора, оксибромид фосфора или ацетилбромид; ангидрид кислоты может быть получен путем реакции 4-галоидалкилпиридин-3-карбоновой кислоты или ее хлорангидрида с осушающим агентом; сложный эфир может быть получен путем реакции 4-галоидалкилпиридин-3-карбоновой кислоты со спиртом. Соединения в соответствии с настоящим изобретением проявляют прекрасные свойства как активные ингредиенты для пестицидов, например инсектицидов, митицидов, нематоцидов и почвенных пестицидов. Например, они эффективны против клещей, паразитирующих на растениях, таких как клещик паутинный двупятнистый (Tetranychus urticae), клещик паутинный карминный (Tetranychus cinnabarinus) или клещик красный цитрусовый (Panonychus citri), или клещик корневой (Rhizoglyphus echinopus); тлей, таких как тля персиковая (Myzus persicae) или тля хлопковая (Aphis gossypii); сельскохозяйственных вредных насекомых, таких как моль капустная (Plutella xylostella), капустный походный червь (Mamestra brassicae), обычная совка (Spodoptera litura), колорадский картофельный жук (Leptinotarsa decemlineata), плодожорка яблоневая (Laspeyresia pomonella), совка хлопковая (Heliothis zea), совка табачная (Heliothis virescens), долгоносик хлопковый (Anthonomus grandis), шелкопряд непарный (Lymantria dispar), тыквенный листоед (Aulacophora femoralis), дельфациды, leafhoppers, червецы, клопы, белокрылки, трипсы, кузнечики, anthomyiid flies, scarabs, совка ипсилон (Agrotis ipsilon), совка (Agrotis segetum) или муравьи; насекомых, вредных с точки зрения гигиены, таких как клещ тропический крысиный, (Ornithonyssus bacoti), тараканы, муха комнатная (Musca domestica) или комар обыкновенный (Culex pipiens pallens); насекомых-вредителей зерна при его хранении, таких как моль зерновая (Sitotroga cerealella), зеновка фасолевая азуки (Callosobruchus chinensis), хрущик малый мучной (Tribolium confusum) или мучной червь; насекомых, повреждающих предметы быта, таких как моль шубная (Tinea pellionella), кожеед черный (Anthrenus scrophularidae), или ринотермиды; и других паразитов на домашних животных, таких как блохи, вши или мухи. Далее, они также эффективны против нематод вредителей растений, таких как нематоды корневых наростов, нематоды цистовые, нематоды корнепоражающие, нематоды рисовые белокончиковые (Aphelenchoides besseyi), нематоды клубничных бутонов (Nothotylenchus acris), или нематоды сосновые (Bursaphelenchus lignicolus). Далее они эффективны также против почвенных вредителей. Эти почвенные вредители включают брюхоногих, таких как слизни или улитки, или isopods, таких как pillbugs или sowbugs. Среди них соединения согласно настоящему изобретению особенно эффективны против тлей, таких как тля персиковая или тля хлопковая. Далее, они эффективны против вредных насекомых, таких как тли, приобретшие стойкость к фосфороорганическим, карбаматным и/или синтетическим пиретроидным инсекцтиидам. Более того, соединения согласно настоящему изобретению обладают прекрасными системными свойствами и при обработке почвы соединениями согласно настоящему изобретению уничтожаются не только вредные насекомые, вредные клещи, вредные нематоды, вредные брюхоногие и вредные изоподы в почве, но также и вредная растительность. При применении в качестве ингредиентов для инсектицидов, митицидов, нематоцитов или почвенных пестицидов соединения согласно настоящему изобретению могут быть включены в рецептуру вместе с сельскохозяйственными добавками с получением различных форм, таких как дусты, гранулы, вододиспергируемые гранулы, смачивающиеся порошки, эмульгируемые концентраты, суспензионные концентраты, растворимые концентраты, водорастворимые порошки, текучие композиции, аэрозоли или пасты, композиции ультра малого объема и другие подобные сельскохозяйственные химикаты. Когда такие композиции действительно находят применение, они применяются как таковые или после разбавления подходящими разбавителями, как то: вода, до получения заданной концентрации. Такие композиции обычно составляются на 0,1-90 вес.ч. из активного ингредиента и на 10-99,9 вес.ч. сельскохозяйственных добавок. В качестве сельскохозяйственных добавок можно упомянуть носители, эмульгаторы, суспендирующие агенты, диспергаторы, расширители, средства, усиливающие проникновение, смачиватели, загустители или стабилизаторы. Их можно добавлять в каждом случае по мере необходимости. Носители можно классифицировать на твердые и жидкие носители. В качестве твердых носителей можно упомянуть порошки животного и растительного происхождения, такие как крахмал, активированный уголь, соевая мука, пшеничная мука, древесная мука или порошковое молоко; или минеральные порошки, такие как тальк, каолин, бентонит, карбонат кальция, цеолит, диатомная земля, белая сажа, глина или глинозем. В качестве жидких носителей можно упомянуть воду; спирты, такие как изопропиловый спирт, или этиленгликоль; кетоны, такие как циклогексанон или метилэтилкетон; эфиры, такие как диоксан или тетрагидрофуран; алифатические углеводороды, такие как керосиновый газойль и тому подобное; ароматические углеводороды, такие как ксилол, триметилбензол, тетраметилбензол, метилнафталин или сольвент-нафта; галогенированные углеводороды, такие как хлорбензол; амиды кислот, такие как диметилацетамид; сложные эфиры, такие как глицериновый эфир жирной кислоты; нитрилы, такие как ацетонитрил; серосодержащие соединения, такие как диметилсульфоксид. Далее, соединения согласно настоящему изобретению могут применяться в комбинации с другими сельскохозяйственными химикатами, такими как инсектициды, митициды, нематоциды, фунгициды, антивирусные средства, аттрактанты, гербициды или регуляторы роста растений, как требуется в каждом случае. В некоторых случаях эффективность может быть повышена с помощью таких комбинаций. Например, в качестве инсектицидов, митицидов или нематоцидов можно упомянуть следующие. Органические фосфатные соединения: O-(бром-2-хлорфенил) O-этил S-пропил фосфоротиоат (обычное название: профенофос), O-(2,2-дихлорвинил) O,O-диметилфосфат (обычное название: дихлорвос), O-этил O-/3-метил-4-(метилтио)фенил/ N-изопропил фосфороамидат (обычное название: фенамифос), O,O-демитил O-(4-нитро-м-толил)фосфоротионат (обычное название: фенитритион), O-этил O-(4-нитрофенил)фенил фосфоротиоат, O, O-диэтил O-(2-изопропил-6-метилпиримидин-4-ил)фосфоротиоат (обычное название: диазинон), O, O-диметил O-(3,5,6-трихлор-2пиридил) фосфоротиоат (обычное название; Хлорпирифос-метил), O,S-диметил N-ацетилфосфороамидотионат (обычное название: ацефат), O-(2,4-дихлорфенил) O-этил S-пропил фосфородитиоат (обычное название: протиофос) и (RS)-S-втор. -бутил O-этил 2-оксо-1,3-тиазолидин-3-ил фосфоротиоат (обычное название: фостиазат). Карбаматные соединения: 1-нафтил N-метилкарбамат (обычное название: карбарил), 2-изопропилфенил N-метилкарбомат (обычное название: пропоксур), 2-метил-2-(метилтио) пропиональдегид O-метилкарбамоилоксим (обычное название: альдикарб), 2,3-дигидро-2,2-диметилбензофуран-7-ил N-метилкарбамат (обычное название: карбофуран), диметил N, N"-/тиобис/(метилимино)карбопилокси//бисэтанимидотиоат (обычное название: тиодикарб), S-метил N-(метилкарбамоилокси)тиоацетамидат (обычное название: метомил), N, N-диметил-2-метилкарбамоилксиимино-2-(метилтио) ацетамид (обычное название: оксамил), 2-(этилтиометил)фенил N-метилкарбамат (обычное название: этиофенкарб), 2-демитиламино-5,6-диметилпиримидин-4-ил N, N-диметилкарбамат (обычное название: пиримикарб) и 2-втор.-бутилфенил N-метилкарбамат (обычное название: пенобукарб). Производные нереистоксина: S,S"-2-диметиламинотриметиленбис (тиокарбамат) (обычное название: картап) и N,N-диметил-1,2,3-тритиан-5-иламин (обычное название: Тиоциклан). Хлорорганические соединения: 2,2,2-трихлор-1,1-бис(4-хлорфенил) этанол (обычное название: дикофол) и 4-хлорфенил-2,4,5-трихлорфенилсульфон (обычное название: Тетрадифон). Металлорганические соединения: Бис/трис(2-метил-2-фенилпропил)олово/оксид (обычное название: фенбутатин оксид). Пиретроидные соединения: (RS)- Стадия 1 может осуществляться путем проведения реакции 2,6-дихлор-4-галоидалкилпиридина с газообразным или твердым диоксидом углерода в присутствии литийдиалкиламида (предпочтительно литийдиизопропиламида) и растворителя. Растворителем может быть эфир, такой как тетрагидрофуран или диэтиловый эфир. Температура реакции обычно лежит между -100 и +20oC, предпочтительно от -80 до -20oC, а время реакции составляет от 1 до 12 ч. Стадия 2 может осуществляться путем проведения реакции 2,6-дихлор-4-галоидалкилпиридин-3-карбоновой кислоты, образовавшейся на стадии 1, с хлорирующим агентом в присутствии растворителя. Хлорирующим агентом может быть тионилхлорид или пентахлорид фосфора, а растворителем может быть ароматический углеводород, такой как бензол или толуол. Температура реакции лежит обычно в пределах от 20 до 120oC, предпочтительно от 50 до 100oC, а время реакции составляет от 1 до 6 ч. Стадия 3 может осуществляться путем проведения реакции 2,6-дихлор-4-галоидалкилпиридин-3-карбоновой кислоты, образовавшейся на стадии 2, со спиртом в присутствии основания. Спиртом может быть метанол или этанол, а основанием может быть третичное основание, такое как триэтиламин или пиридин. Температура реакции лежит обычно в пределах от 0 до 80oC, предпочтительно от 20 до 50oC, а время реакции составляет от 1 до 12 ч. Стадия 4 осуществляется путем проведения реакции эфира 2,6-дихлор-4-галоидалкилпиридин-3-карбоновой кислоты, образовавшегося на стадии 3, с водород-газом в присутствии растворителя, катализатора и основания. Растворителем может быть спирт, такой как метанол или этанол, или эфир, такой как тетрагидрофуран; катализатором может быть палладий или палладий(II)хлорид и основанием может быть третичное основание, такое как триэтиламин или пиридин, или ацетат натрия. Температура реакции лежит обычно в пределах от 0 до 100oC, предпочтительно от 20 до 50oC, а время реакции составляет от 1 до 24 ч. Стадия 5 осуществляется путем проведения реакции эфира 4-галоидалкилпиридин-3-карбоновой кислоты, образовавшегося на стадии 4, с основанием в присутствии растворителя. Растворителем может быть вода или спирт, такой как метанол или этанол, и применяться по отдельности или в комбинации как смесь. Основанием может быть гидроксид щелочного металла, такой как гидроксид натрия или гидроксид калия. Температура реакции обычно лежит в пределах от 0 до 100oC, предпочтительно от 20 до 80oC, а время реакции составляет от 1 до 12 ч. Кроме того, реакционноспособное производное может быть получено из соединения формулы (II). Синтез хлорангидрида кислоты может осуществляться путем реакции 4-галоидалкилпиридин-3-карбоновой кислоты с хлорирующим агентом, таким как тионилхлорид или трихлорид фосфора, если необходимо, в присутствии каталитического количества диметилформамида при температуре дефлегмации. Реакционноспособное производное формулы (II), иное чем 4-галоидалкил-3-пиридинкарбонилхлорид, может быть получено способом, подобным обычному способу превращения бензойной кислоты в реакционноспособное производное. Например, бромангидрид кислоты может быть получен путем реакции 4-галоидалкилпиридин-3-карбоновой кислоты с бромирующим агентом, таким как трибромид фосфора, оксибромид фосфора или ацетилбромид; ангидрид кислоты может быть получен путем реакции 4-галоидалкилпиридин-3-карбоновой кислоты или ее хлорангидрида с осушающим агентом; сложный эфир может быть получен путем реакции 4-галоидалкилпиридин-3-карбоновой кислоты со спиртом. Соединения в соответствии с настоящим изобретением проявляют прекрасные свойства как активные ингредиенты для пестицидов, например инсектицидов, митицидов, нематоцидов и почвенных пестицидов. Например, они эффективны против клещей, паразитирующих на растениях, таких как клещик паутинный двупятнистый (Tetranychus urticae), клещик паутинный карминный (Tetranychus cinnabarinus) или клещик красный цитрусовый (Panonychus citri), или клещик корневой (Rhizoglyphus echinopus); тлей, таких как тля персиковая (Myzus persicae) или тля хлопковая (Aphis gossypii); сельскохозяйственных вредных насекомых, таких как моль капустная (Plutella xylostella), капустный походный червь (Mamestra brassicae), обычная совка (Spodoptera litura), колорадский картофельный жук (Leptinotarsa decemlineata), плодожорка яблоневая (Laspeyresia pomonella), совка хлопковая (Heliothis zea), совка табачная (Heliothis virescens), долгоносик хлопковый (Anthonomus grandis), шелкопряд непарный (Lymantria dispar), тыквенный листоед (Aulacophora femoralis), дельфациды, leafhoppers, червецы, клопы, белокрылки, трипсы, кузнечики, anthomyiid flies, scarabs, совка ипсилон (Agrotis ipsilon), совка (Agrotis segetum) или муравьи; насекомых, вредных с точки зрения гигиены, таких как клещ тропический крысиный, (Ornithonyssus bacoti), тараканы, муха комнатная (Musca domestica) или комар обыкновенный (Culex pipiens pallens); насекомых-вредителей зерна при его хранении, таких как моль зерновая (Sitotroga cerealella), зеновка фасолевая азуки (Callosobruchus chinensis), хрущик малый мучной (Tribolium confusum) или мучной червь; насекомых, повреждающих предметы быта, таких как моль шубная (Tinea pellionella), кожеед черный (Anthrenus scrophularidae), или ринотермиды; и других паразитов на домашних животных, таких как блохи, вши или мухи. Далее, они также эффективны против нематод вредителей растений, таких как нематоды корневых наростов, нематоды цистовые, нематоды корнепоражающие, нематоды рисовые белокончиковые (Aphelenchoides besseyi), нематоды клубничных бутонов (Nothotylenchus acris), или нематоды сосновые (Bursaphelenchus lignicolus). Далее они эффективны также против почвенных вредителей. Эти почвенные вредители включают брюхоногих, таких как слизни или улитки, или isopods, таких как pillbugs или sowbugs. Среди них соединения согласно настоящему изобретению особенно эффективны против тлей, таких как тля персиковая или тля хлопковая. Далее, они эффективны против вредных насекомых, таких как тли, приобретшие стойкость к фосфороорганическим, карбаматным и/или синтетическим пиретроидным инсекцтиидам. Более того, соединения согласно настоящему изобретению обладают прекрасными системными свойствами и при обработке почвы соединениями согласно настоящему изобретению уничтожаются не только вредные насекомые, вредные клещи, вредные нематоды, вредные брюхоногие и вредные изоподы в почве, но также и вредная растительность. При применении в качестве ингредиентов для инсектицидов, митицидов, нематоцитов или почвенных пестицидов соединения согласно настоящему изобретению могут быть включены в рецептуру вместе с сельскохозяйственными добавками с получением различных форм, таких как дусты, гранулы, вододиспергируемые гранулы, смачивающиеся порошки, эмульгируемые концентраты, суспензионные концентраты, растворимые концентраты, водорастворимые порошки, текучие композиции, аэрозоли или пасты, композиции ультра малого объема и другие подобные сельскохозяйственные химикаты. Когда такие композиции действительно находят применение, они применяются как таковые или после разбавления подходящими разбавителями, как то: вода, до получения заданной концентрации. Такие композиции обычно составляются на 0,1-90 вес.ч. из активного ингредиента и на 10-99,9 вес.ч. сельскохозяйственных добавок. В качестве сельскохозяйственных добавок можно упомянуть носители, эмульгаторы, суспендирующие агенты, диспергаторы, расширители, средства, усиливающие проникновение, смачиватели, загустители или стабилизаторы. Их можно добавлять в каждом случае по мере необходимости. Носители можно классифицировать на твердые и жидкие носители. В качестве твердых носителей можно упомянуть порошки животного и растительного происхождения, такие как крахмал, активированный уголь, соевая мука, пшеничная мука, древесная мука или порошковое молоко; или минеральные порошки, такие как тальк, каолин, бентонит, карбонат кальция, цеолит, диатомная земля, белая сажа, глина или глинозем. В качестве жидких носителей можно упомянуть воду; спирты, такие как изопропиловый спирт, или этиленгликоль; кетоны, такие как циклогексанон или метилэтилкетон; эфиры, такие как диоксан или тетрагидрофуран; алифатические углеводороды, такие как керосиновый газойль и тому подобное; ароматические углеводороды, такие как ксилол, триметилбензол, тетраметилбензол, метилнафталин или сольвент-нафта; галогенированные углеводороды, такие как хлорбензол; амиды кислот, такие как диметилацетамид; сложные эфиры, такие как глицериновый эфир жирной кислоты; нитрилы, такие как ацетонитрил; серосодержащие соединения, такие как диметилсульфоксид. Далее, соединения согласно настоящему изобретению могут применяться в комбинации с другими сельскохозяйственными химикатами, такими как инсектициды, митициды, нематоциды, фунгициды, антивирусные средства, аттрактанты, гербициды или регуляторы роста растений, как требуется в каждом случае. В некоторых случаях эффективность может быть повышена с помощью таких комбинаций. Например, в качестве инсектицидов, митицидов или нематоцидов можно упомянуть следующие. Органические фосфатные соединения: O-(бром-2-хлорфенил) O-этил S-пропил фосфоротиоат (обычное название: профенофос), O-(2,2-дихлорвинил) O,O-диметилфосфат (обычное название: дихлорвос), O-этил O-/3-метил-4-(метилтио)фенил/ N-изопропил фосфороамидат (обычное название: фенамифос), O,O-демитил O-(4-нитро-м-толил)фосфоротионат (обычное название: фенитритион), O-этил O-(4-нитрофенил)фенил фосфоротиоат, O, O-диэтил O-(2-изопропил-6-метилпиримидин-4-ил)фосфоротиоат (обычное название: диазинон), O, O-диметил O-(3,5,6-трихлор-2пиридил) фосфоротиоат (обычное название; Хлорпирифос-метил), O,S-диметил N-ацетилфосфороамидотионат (обычное название: ацефат), O-(2,4-дихлорфенил) O-этил S-пропил фосфородитиоат (обычное название: протиофос) и (RS)-S-втор. -бутил O-этил 2-оксо-1,3-тиазолидин-3-ил фосфоротиоат (обычное название: фостиазат). Карбаматные соединения: 1-нафтил N-метилкарбамат (обычное название: карбарил), 2-изопропилфенил N-метилкарбомат (обычное название: пропоксур), 2-метил-2-(метилтио) пропиональдегид O-метилкарбамоилоксим (обычное название: альдикарб), 2,3-дигидро-2,2-диметилбензофуран-7-ил N-метилкарбамат (обычное название: карбофуран), диметил N, N"-/тиобис/(метилимино)карбопилокси//бисэтанимидотиоат (обычное название: тиодикарб), S-метил N-(метилкарбамоилокси)тиоацетамидат (обычное название: метомил), N, N-диметил-2-метилкарбамоилксиимино-2-(метилтио) ацетамид (обычное название: оксамил), 2-(этилтиометил)фенил N-метилкарбамат (обычное название: этиофенкарб), 2-демитиламино-5,6-диметилпиримидин-4-ил N, N-диметилкарбамат (обычное название: пиримикарб) и 2-втор.-бутилфенил N-метилкарбамат (обычное название: пенобукарб). Производные нереистоксина: S,S"-2-диметиламинотриметиленбис (тиокарбамат) (обычное название: картап) и N,N-диметил-1,2,3-тритиан-5-иламин (обычное название: Тиоциклан). Хлорорганические соединения: 2,2,2-трихлор-1,1-бис(4-хлорфенил) этанол (обычное название: дикофол) и 4-хлорфенил-2,4,5-трихлорфенилсульфон (обычное название: Тетрадифон). Металлорганические соединения: Бис/трис(2-метил-2-фенилпропил)олово/оксид (обычное название: фенбутатин оксид). Пиретроидные соединения: (RS)- -циано-3-феноксибензил (RS)-2-(4-хлорфенил)-3-метилбутилат (обычное название: фенвалерат), 3-феноксибензил (IRS)-цис, транс-3-(2,2-дихлорвинил) 2,2-диметилциклопропанкарбоксилат (обычное название: перметрин), (RS)-a-циано-3-феноксибензил (IRS)-цис, транс-3-(2,2-дихлорвинил-2,2-диметилциклопропанкарбоксилат (обычное название: циперметрин), (S)-a-циано-3-феноксибензил (IR)-цис-3-(2,2-дибромвинил)-2,2-диметилциклопропанкарбоксилат (обычное название: дельтаметрин), (RS)-a-циано-3-феноксибензил (IRS)-цис, транс-3-(2-хлор-3,3,3-трифторпропенил)-2,2- диметилциклопропанкарбоксилат (обычное название: цигалотрин), 4-метил-2,3,5,6-тетрафторбензил-3-(2-хлор-3,3,3-трифтор-1-пропенил)-2,2- диметилциклопропанкарбоксилат (обычное название: Тефлутрин) и 2-(4-этоксифенил)-2-метилпропил 3-феноксибензил эфир (обычное название: этофенпрокс). Бензоилмочевинные соединения: 1-(4-хлорфенил)-3-(2,6-дифторбензоил) мочевина (обычное название: дифлубензурон), 1-/3,5-дихлоро-4-(3-хлор-5-трифторметил-2-пиридилокси) фенил/-2(2,6-дифторбензоил) мочевина (обычное название: хлорфлуазурон) и 1-(3,5-дихлор-2,4-дифторфенил)-3-(2,6-дифторбензоил) мочевина (обычное название: тефлубензурон). Соединения, подобные юношескому гормону: изопропил (2E, 4E) 11/метокси-3,7,11-триметил-2,4-додекадиеноат (обычное название: метопрен). Пиридазиноновые соединения: 2-т-бутил-5-(4-т-бутилбензилтио)-4-хлор-3(2H) пиридазинон (обычное название: пиридабен). Пиразольные соединения: т-бутил 4-/(1,3-диметил-5-феноксипиразол-4-ил)- метилен-амино-оксиметил/бензоат (обычное название: фенпироксимат), 5-амино-1-(2,6-дихлор-a, a, a-трифтор-п-толил)-4-трифторметилсульфинилпиразол-3-карбонитрил (обычное название: фипронил), N -(4-трет. -бутилбензил)-4-хлор-3-этил-1-метилпиразол-5-карбоксамид (обычное название: тебуфенпирад). Нитросоединения: 1-(6-хлор-3-пиридилметил)-N-нитро-имидазолидин-2-илиденамин (обычное название: имидаклоприд), 1-/N-(6-хлор-3-пиридилметил)-N-этиламино/-1-метиламино-2-нитроэтилен (обычное название: нитепирам), N1-/(6-хлор-3-пиридил)метил/-N2-циано-N1-метил ацетамидин (выложенная заявка на Европейский патент N 456826), 1-(6-хлор-3-пиридилметил)-2-(1-нитро-2-аллилтиоэтилиден)-имидазолидин (выложенная заявка на Европейский патент N 437781), 1-(6-хлор-3-пиридилметил)-2-(1-нитро-2-(1-нитроэтилтио-этилиден) имидазолиден (выложенная заявка на Европейский патент N 437781) и 1-(6-хлор-3-пиридилметил)-2-(1-нитро-2-b-метилаллилтиоэтилиден) имидазолидин (выложенная заявка на Европейский патент N 437781). Гидразиновые соединения: N1-т-бутил-N1-3,5-диметилбензоил-N-бензо/ /2-карбогидразид, N1-т-бутил-N1-3,5-диметилбензоил-N-4,5,6,7-тетрагидробензо/b/ тиофен-2-карбогидразид, N1-т-бутил-N1-3,5-диметилбензоил-N-5,6-дигидро-4H-циклопента/b/ тиофен-2-карбогидразид и N1-т-бутил-N1-3,5-диметилбензоил-N-4-этилфенилкарбогидразид (обычное название: тебуфенозид). Динитросоединения. Сероорганические соединения. Мочевинные соединения. Триазиновые соединения. Другие соединения: 2-трет. -бутиламино-3-изопропил-5-фенил-3,4,5,6-тетрагидро-2H-1,3,5-тиадиазин-4-он (обычное название: бупрофезин), транс-(4-хлорфенил)-N-циклогексил-4-метил-2-оксотиазолидинон-3-карбоксамид (обычное название: гекситиазокс), N-метилбис(2,4-ксилилиминометил)амин (обычное название: амитраз), N1-(4-хлор-о-толил)N, N-диметилформамидин (обычное название: хлордимеформ) и (4-этоксифенил)-/3/фтор-3-феноксифенил)пропил/(диметил)-силан (обычное название: силафлуфен), этил (3-трет. -бутил-1-1иметилкарбамоил-1H-1,2,4-триазол-5-илтио)ацетат (обычное название: триазамат), 4,5-дигидро-6-метил-4-(3-пиридилметиленамино)-1,2,4-триазин-3(2H)-он (обычное название: пиметрозин), 5-хлор-N-/2-/4-(2-этоксиэтил)-2,3-диметилфенокси/этил/-6-этилпирамидин-4-амин (обычное название: Пиримидифен), 4-бром-2-(4-хлорфенил)-1-этоксиметил-5-трифторметилпиррол-3-карбонитрил (японская патентная публикация, не прошедшая экспертизу, N 104042/1989). Соединение в соответствии с настоящим изобретением может также применяться в смеси или комбинации с микробными сельскохозяйственными химикатами, такими как В.Т. и вирусы насекомых, и антибиотиками, такими как авермицин и мильбемицин. Конкретные примеры активных ингредиентов вышеупомянутых фунгицидов включают следующие соединения. Пиримидинаминные соединения: 2-анилино-4-метил-6-(1-пропинил)пиримидин (раскрыт в японской патентной публикации, не прошедшей экспертизу, N 208581/1989). Азольные соединения: 1-(4-хлорфенокси)-3,3-диметил-1-(1H-1,2,4-триазол-1-ил)-бутанон (обычное название: триадимефон), 1-(бифенил-4-илокси)-3,3-диметил-1-(1H-1,2,4-триазол-1-ил)-бутан-2-ол (обычное название: битертанол), 1-/N-(4-хлор-2-трифторметилфенил)-2-пропоксиацетимидоил/-имидазол (обычное название: трифлумизол), 1-/2-(2,4-дихлорфенил)-4-этил-1,3-диоксолан-2-ил-метил/-1H-1,2,4-триазол (обычное название: этаконазол), 1-/2-(2,4-дихлорфенил)-4-пропил-1,3-диоксолан-2-ил-метил/-1H-1,2,4-триазол (обычное название: пропиконазол), 1-/2-(2,4-дихлорфенил)пентил/-1H-1,2,4-триазол (обычное название: пенконазол), бис(4-фторфенил)(метил)(1H-1,2,4-триазол-1-ил-метил)-силан (обычное название: флюсилазол), 2-(4-4-хлорфенил)-2-(1H-1,2,4-триазол-1-ил-метил)гексан-нитрил (обычное название: миклобутанил), (2 RS, 3 RS)-2-(4-хлорфенил)-3-циклопропил-1-(1H-1,2,4-триазол-1-ил)бутан-2-ол (обычное название: ципроконазол), (RS)-1-(4-хлорфенил)-4,4-диметил-3-(1H-1,2,4-триазол-1-илметил)пентан-3-ол (обычное название: тербуконазол), (RS)-2(2,4-дихлорфенил)-1-(1H-1,2,4-триазол-1-ил)гексан-2-ол (обычное название: гексаконазол), (2RS, 5RS)-5-(2,4-дихлорфенил)тетрагидро-5-(1H-1,2,4-триазол-1-илметил)-2-фурил 2,2,2-трифторэтил эфир (обычное название: фурконазол-цис) и N-пропил-N-/2-(2,4,6-трихлорфенокси)этил/-имидазол-1-карбоксамид (обычное название: прохлораз). Хиноксалиновые соединения: 6-метил-1,3-дитиоло-/4,5-b/хиноксалин-2-он (обычное название: хинометионат). Дитиокарбаматные соединения: марганцевый этиленбис (дитиокарбамат)полимер (обычное название: манеб), цинковое этиленбис (дитиокарбамат)полимер (обычное название: цинеб), комплекс цинка с марганец этиленбис (дитиокарбаматом) (обычное название: манкозеб), дицинк бис (диметилдитиокарбамат) этиленбис(дитиокарбамат) (обычное название: поликарбамат) и цинк пропиленбис (дитиокарбамат)полимер (обычное название: пропинеб). Хлорорганические соединения: 4,5,6,7-тетрахлорфталид (обычное название: фталид), тетрахлоризофталонитрил (обычное название: хлорофталинил) и пентахлорнитробензол (обычное название: Хинтозен). Бензамидазоловые соединения: метил 1-(бутилкарбамоил)бензимидазол-2-илкарбамат (обычное название: беномил), диметил 4,4"-(о-фенилен)бис(3-тиоаллофанат) (обычное название: тиофанат-метил) и метил бензимидазол-2-илкарбамат (обычное название: карбендазим). Пиридинаминные соединения: 3-хлор-N-(3-хлор-2,6-динитро-4-a, -циано-3-феноксибензил (RS)-2-(4-хлорфенил)-3-метилбутилат (обычное название: фенвалерат), 3-феноксибензил (IRS)-цис, транс-3-(2,2-дихлорвинил) 2,2-диметилциклопропанкарбоксилат (обычное название: перметрин), (RS)-a-циано-3-феноксибензил (IRS)-цис, транс-3-(2,2-дихлорвинил-2,2-диметилциклопропанкарбоксилат (обычное название: циперметрин), (S)-a-циано-3-феноксибензил (IR)-цис-3-(2,2-дибромвинил)-2,2-диметилциклопропанкарбоксилат (обычное название: дельтаметрин), (RS)-a-циано-3-феноксибензил (IRS)-цис, транс-3-(2-хлор-3,3,3-трифторпропенил)-2,2- диметилциклопропанкарбоксилат (обычное название: цигалотрин), 4-метил-2,3,5,6-тетрафторбензил-3-(2-хлор-3,3,3-трифтор-1-пропенил)-2,2- диметилциклопропанкарбоксилат (обычное название: Тефлутрин) и 2-(4-этоксифенил)-2-метилпропил 3-феноксибензил эфир (обычное название: этофенпрокс). Бензоилмочевинные соединения: 1-(4-хлорфенил)-3-(2,6-дифторбензоил) мочевина (обычное название: дифлубензурон), 1-/3,5-дихлоро-4-(3-хлор-5-трифторметил-2-пиридилокси) фенил/-2(2,6-дифторбензоил) мочевина (обычное название: хлорфлуазурон) и 1-(3,5-дихлор-2,4-дифторфенил)-3-(2,6-дифторбензоил) мочевина (обычное название: тефлубензурон). Соединения, подобные юношескому гормону: изопропил (2E, 4E) 11/метокси-3,7,11-триметил-2,4-додекадиеноат (обычное название: метопрен). Пиридазиноновые соединения: 2-т-бутил-5-(4-т-бутилбензилтио)-4-хлор-3(2H) пиридазинон (обычное название: пиридабен). Пиразольные соединения: т-бутил 4-/(1,3-диметил-5-феноксипиразол-4-ил)- метилен-амино-оксиметил/бензоат (обычное название: фенпироксимат), 5-амино-1-(2,6-дихлор-a, a, a-трифтор-п-толил)-4-трифторметилсульфинилпиразол-3-карбонитрил (обычное название: фипронил), N -(4-трет. -бутилбензил)-4-хлор-3-этил-1-метилпиразол-5-карбоксамид (обычное название: тебуфенпирад). Нитросоединения: 1-(6-хлор-3-пиридилметил)-N-нитро-имидазолидин-2-илиденамин (обычное название: имидаклоприд), 1-/N-(6-хлор-3-пиридилметил)-N-этиламино/-1-метиламино-2-нитроэтилен (обычное название: нитепирам), N1-/(6-хлор-3-пиридил)метил/-N2-циано-N1-метил ацетамидин (выложенная заявка на Европейский патент N 456826), 1-(6-хлор-3-пиридилметил)-2-(1-нитро-2-аллилтиоэтилиден)-имидазолидин (выложенная заявка на Европейский патент N 437781), 1-(6-хлор-3-пиридилметил)-2-(1-нитро-2-(1-нитроэтилтио-этилиден) имидазолиден (выложенная заявка на Европейский патент N 437781) и 1-(6-хлор-3-пиридилметил)-2-(1-нитро-2-b-метилаллилтиоэтилиден) имидазолидин (выложенная заявка на Европейский патент N 437781). Гидразиновые соединения: N1-т-бутил-N1-3,5-диметилбензоил-N-бензо/ /2-карбогидразид, N1-т-бутил-N1-3,5-диметилбензоил-N-4,5,6,7-тетрагидробензо/b/ тиофен-2-карбогидразид, N1-т-бутил-N1-3,5-диметилбензоил-N-5,6-дигидро-4H-циклопента/b/ тиофен-2-карбогидразид и N1-т-бутил-N1-3,5-диметилбензоил-N-4-этилфенилкарбогидразид (обычное название: тебуфенозид). Динитросоединения. Сероорганические соединения. Мочевинные соединения. Триазиновые соединения. Другие соединения: 2-трет. -бутиламино-3-изопропил-5-фенил-3,4,5,6-тетрагидро-2H-1,3,5-тиадиазин-4-он (обычное название: бупрофезин), транс-(4-хлорфенил)-N-циклогексил-4-метил-2-оксотиазолидинон-3-карбоксамид (обычное название: гекситиазокс), N-метилбис(2,4-ксилилиминометил)амин (обычное название: амитраз), N1-(4-хлор-о-толил)N, N-диметилформамидин (обычное название: хлордимеформ) и (4-этоксифенил)-/3/фтор-3-феноксифенил)пропил/(диметил)-силан (обычное название: силафлуфен), этил (3-трет. -бутил-1-1иметилкарбамоил-1H-1,2,4-триазол-5-илтио)ацетат (обычное название: триазамат), 4,5-дигидро-6-метил-4-(3-пиридилметиленамино)-1,2,4-триазин-3(2H)-он (обычное название: пиметрозин), 5-хлор-N-/2-/4-(2-этоксиэтил)-2,3-диметилфенокси/этил/-6-этилпирамидин-4-амин (обычное название: Пиримидифен), 4-бром-2-(4-хлорфенил)-1-этоксиметил-5-трифторметилпиррол-3-карбонитрил (японская патентная публикация, не прошедшая экспертизу, N 104042/1989). Соединение в соответствии с настоящим изобретением может также применяться в смеси или комбинации с микробными сельскохозяйственными химикатами, такими как В.Т. и вирусы насекомых, и антибиотиками, такими как авермицин и мильбемицин. Конкретные примеры активных ингредиентов вышеупомянутых фунгицидов включают следующие соединения. Пиримидинаминные соединения: 2-анилино-4-метил-6-(1-пропинил)пиримидин (раскрыт в японской патентной публикации, не прошедшей экспертизу, N 208581/1989). Азольные соединения: 1-(4-хлорфенокси)-3,3-диметил-1-(1H-1,2,4-триазол-1-ил)-бутанон (обычное название: триадимефон), 1-(бифенил-4-илокси)-3,3-диметил-1-(1H-1,2,4-триазол-1-ил)-бутан-2-ол (обычное название: битертанол), 1-/N-(4-хлор-2-трифторметилфенил)-2-пропоксиацетимидоил/-имидазол (обычное название: трифлумизол), 1-/2-(2,4-дихлорфенил)-4-этил-1,3-диоксолан-2-ил-метил/-1H-1,2,4-триазол (обычное название: этаконазол), 1-/2-(2,4-дихлорфенил)-4-пропил-1,3-диоксолан-2-ил-метил/-1H-1,2,4-триазол (обычное название: пропиконазол), 1-/2-(2,4-дихлорфенил)пентил/-1H-1,2,4-триазол (обычное название: пенконазол), бис(4-фторфенил)(метил)(1H-1,2,4-триазол-1-ил-метил)-силан (обычное название: флюсилазол), 2-(4-4-хлорфенил)-2-(1H-1,2,4-триазол-1-ил-метил)гексан-нитрил (обычное название: миклобутанил), (2 RS, 3 RS)-2-(4-хлорфенил)-3-циклопропил-1-(1H-1,2,4-триазол-1-ил)бутан-2-ол (обычное название: ципроконазол), (RS)-1-(4-хлорфенил)-4,4-диметил-3-(1H-1,2,4-триазол-1-илметил)пентан-3-ол (обычное название: тербуконазол), (RS)-2(2,4-дихлорфенил)-1-(1H-1,2,4-триазол-1-ил)гексан-2-ол (обычное название: гексаконазол), (2RS, 5RS)-5-(2,4-дихлорфенил)тетрагидро-5-(1H-1,2,4-триазол-1-илметил)-2-фурил 2,2,2-трифторэтил эфир (обычное название: фурконазол-цис) и N-пропил-N-/2-(2,4,6-трихлорфенокси)этил/-имидазол-1-карбоксамид (обычное название: прохлораз). Хиноксалиновые соединения: 6-метил-1,3-дитиоло-/4,5-b/хиноксалин-2-он (обычное название: хинометионат). Дитиокарбаматные соединения: марганцевый этиленбис (дитиокарбамат)полимер (обычное название: манеб), цинковое этиленбис (дитиокарбамат)полимер (обычное название: цинеб), комплекс цинка с марганец этиленбис (дитиокарбаматом) (обычное название: манкозеб), дицинк бис (диметилдитиокарбамат) этиленбис(дитиокарбамат) (обычное название: поликарбамат) и цинк пропиленбис (дитиокарбамат)полимер (обычное название: пропинеб). Хлорорганические соединения: 4,5,6,7-тетрахлорфталид (обычное название: фталид), тетрахлоризофталонитрил (обычное название: хлорофталинил) и пентахлорнитробензол (обычное название: Хинтозен). Бензамидазоловые соединения: метил 1-(бутилкарбамоил)бензимидазол-2-илкарбамат (обычное название: беномил), диметил 4,4"-(о-фенилен)бис(3-тиоаллофанат) (обычное название: тиофанат-метил) и метил бензимидазол-2-илкарбамат (обычное название: карбендазим). Пиридинаминные соединения: 3-хлор-N-(3-хлор-2,6-динитро-4-a, , , -трифтортолил)-5-трифторметил-2-пиридинамин (обычное название: флуазинам). Цианоацетамидные соединения: 1-(2-циано-2-метоксииминоацетил)-3-этилмочевина (обычное название: цимоксанил). Фениламидные соединения: метил N-(2-метоксиацетил)-N-(2,6-ксилил)-D,L-аланинат (обычное название: металаксил), 2-метокси-N-(2-оксо-1,3-оксазолидин-3-ил)ацето-2", 6"-ксидидид (обычное название: оксадиксил), ( -трифтортолил)-5-трифторметил-2-пиридинамин (обычное название: флуазинам). Цианоацетамидные соединения: 1-(2-циано-2-метоксииминоацетил)-3-этилмочевина (обычное название: цимоксанил). Фениламидные соединения: метил N-(2-метоксиацетил)-N-(2,6-ксилил)-D,L-аланинат (обычное название: металаксил), 2-метокси-N-(2-оксо-1,3-оксазолидин-3-ил)ацето-2", 6"-ксидидид (обычное название: оксадиксил), (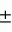 )-a-2-хлор-N-(2,6-ксилилацетамидо)-g-бутиролактон (обычное название: офурац), метил V-фенилацетил-N-(2,6-ксилил)-DL-алинат (обычное название: ваналаксил), метил N-(2-фуроил)-N-(2,6-ксилил)-DL-аланинат (обычное название: фуралаксил) и ( )-a-2-хлор-N-(2,6-ксилилацетамидо)-g-бутиролактон (обычное название: офурац), метил V-фенилацетил-N-(2,6-ксилил)-DL-алинат (обычное название: ваналаксил), метил N-(2-фуроил)-N-(2,6-ксилил)-DL-аланинат (обычное название: фуралаксил) и (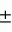 )-a-/N-(3-хлорфенил)циклопропанкарбоксамидо/-g-бутиролактон (обычное название: ципрофурам). Соединения сульфоновых кислот: N-дихлорфторметилтио-N", N"-диметил-N-фенилсульфамид (обычное название: дихлофлуанид). Медные соединения: гидроксид меди (II) (обычное название: гидроксид меди), (8-хинолинолат меди (обычное название: оксин-медь). Изоксазольные соединения: 5-метилизоксазол-3-ол (обычное название: гидроксиизоксазол). Фосфороорганические соединения: алюминий трис(этилфосфонат) (обычное название: фосетил-ал), 0,2,6-дихлор-n-толил-0,0-диметилфосфоротиоат (обычное название: толкофос-метил), S-бензил 0,0-диизопропил фосфоротиоат, О-этил S,S-дифенил фосфородитиоат и кислый алюминий этилфосфонат. N-галогентиоалкильные соединения: N-(трихлорметилтио)циклогекс-4-ен-1,3-дикарбоксимид (обычное название: каптан), N-(1,1,2,2-тетрахлорэтилтио)циклогекс-4-ен-1,2-дикарбоксимид (обычное название: каптофол) и N-(трихлорметилтио)фталимид (обычное название: фольпет). Дикарбоксимидные соединения: N-(3,5-дихлорфенил)-1,2-диметилциклопропан-1,2-дикарбоксимид (обычное название: процимидон), 3-(3,5-дихлорфенил-N-изопропил-2,4-диоксоимидазолидин-1-карбоксамид (обычное название: ипродион) и (RS)-3-(3,5-дихлорфенил)-5-метил-5-винил-1,3-оксазолидин-2,4-дион (обычное название: винклозолин). Бензанилидные соединения: a,a,a-трифтор-3"-изопропокси-о-толуанилид (обычное название: флутоланил) и 3"-изопропокси-о-толуанилид (обычное название: мепронил). Бензамидные соединения: 2-(1,3-диметилпиразол-4-илкарбониламино)-4-метил-3- пентеннитрил (раскрыт в британском патенте N 2190375) и a-(никотиниламино)-(3-фторфенил)ацетонитрил (раскрыт в японской выложенной заявке на патент N 135364/1988). Пиперазиновые соединения: N, N"-/пиперазин-1,4-диилбис(трихлорметил)метилен/-диформамид (обычное название: трифорин). Пиридиновые соединения: 2",4"-дихлор-2-(3-пиридил)ацетофенон 0-метилоксим (обычное название: пирифенокс). Карбинольные соединения: ( )-a-/N-(3-хлорфенил)циклопропанкарбоксамидо/-g-бутиролактон (обычное название: ципрофурам). Соединения сульфоновых кислот: N-дихлорфторметилтио-N", N"-диметил-N-фенилсульфамид (обычное название: дихлофлуанид). Медные соединения: гидроксид меди (II) (обычное название: гидроксид меди), (8-хинолинолат меди (обычное название: оксин-медь). Изоксазольные соединения: 5-метилизоксазол-3-ол (обычное название: гидроксиизоксазол). Фосфороорганические соединения: алюминий трис(этилфосфонат) (обычное название: фосетил-ал), 0,2,6-дихлор-n-толил-0,0-диметилфосфоротиоат (обычное название: толкофос-метил), S-бензил 0,0-диизопропил фосфоротиоат, О-этил S,S-дифенил фосфородитиоат и кислый алюминий этилфосфонат. N-галогентиоалкильные соединения: N-(трихлорметилтио)циклогекс-4-ен-1,3-дикарбоксимид (обычное название: каптан), N-(1,1,2,2-тетрахлорэтилтио)циклогекс-4-ен-1,2-дикарбоксимид (обычное название: каптофол) и N-(трихлорметилтио)фталимид (обычное название: фольпет). Дикарбоксимидные соединения: N-(3,5-дихлорфенил)-1,2-диметилциклопропан-1,2-дикарбоксимид (обычное название: процимидон), 3-(3,5-дихлорфенил-N-изопропил-2,4-диоксоимидазолидин-1-карбоксамид (обычное название: ипродион) и (RS)-3-(3,5-дихлорфенил)-5-метил-5-винил-1,3-оксазолидин-2,4-дион (обычное название: винклозолин). Бензанилидные соединения: a,a,a-трифтор-3"-изопропокси-о-толуанилид (обычное название: флутоланил) и 3"-изопропокси-о-толуанилид (обычное название: мепронил). Бензамидные соединения: 2-(1,3-диметилпиразол-4-илкарбониламино)-4-метил-3- пентеннитрил (раскрыт в британском патенте N 2190375) и a-(никотиниламино)-(3-фторфенил)ацетонитрил (раскрыт в японской выложенной заявке на патент N 135364/1988). Пиперазиновые соединения: N, N"-/пиперазин-1,4-диилбис(трихлорметил)метилен/-диформамид (обычное название: трифорин). Пиридиновые соединения: 2",4"-дихлор-2-(3-пиридил)ацетофенон 0-метилоксим (обычное название: пирифенокс). Карбинольные соединения: (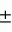 )-2,4"-дихлор-a-(пиримидин-5-ил)бенгидроловый спирт (обычное название: фенаримол) и ( )-2,4"-дихлор-a-(пиримидин-5-ил)бенгидроловый спирт (обычное название: фенаримол) и (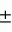 )-2,4"-дифтор-a-(1H-1,2,4-триазол-1-илметил)бензигидриловый спирт (обычное название: флютриафол). Пиперидиновые соединения: (RS)-1-/3-(4-трет. -бутилфенил)-2-метилпропил/пиперидин (обычное название: фенпропидин). Морфолиновые соединения: ( )-2,4"-дифтор-a-(1H-1,2,4-триазол-1-илметил)бензигидриловый спирт (обычное название: флютриафол). Пиперидиновые соединения: (RS)-1-/3-(4-трет. -бутилфенил)-2-метилпропил/пиперидин (обычное название: фенпропидин). Морфолиновые соединения: (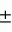 )-цис-4-/3-(4-трет. -бутилфенил)-2-метилпропил/-2,6-диметилморфолин (обычное название: фенпроиморф). Оловоорганические соединения: гидроксид трифенилолова (обычное название: фентин гидроксид) и ацетат трифенилолова (обычное название: фентин ацетат). Мочевинные соединения: 1-(4-хлорбензил)-1-циклопентил-3-фенилмочевина (обычное название: пенцисурон). Соединения циппамовой (коричной) кислоты: (E )4-/3(4-хлорфенил)-3-(3,4-диметоксифенил)акрилоил/-морфолин (обычное название: диметофорф). Фенилкарбоматные соединения: изопропил 3,4-диэтоксикарбанилат (обычное название: диэтофенкарб). Цианпиррольные соединения: 3-циан-4-(2,2-дифтор-1,3-бенодиоксол-4-ил)-пиррол) (обычное название: сафир) и 3-(2",3"-дихлорфенил)-4-цианопиррол (обычное название: фенпиклонил). Пиридинаминные соединения: 3-хлор-V-(3-хлор-2,6-динитро-4-a, a, a-трифтортолил)-5-трифторметил-2-пиридинамин (обычное название: флуазинам). Другие активные ингредиенты фунгицидов включают антрахиновые соединения, кротонокислотные соединения, антибиотики и другие соединения, такие как: диизопропиловый эфир 1,3-дитиолан-2-илиденмалоновой кислоты (обычное название: изопротиолан), 5-метил-1,2,4-триазоло/3,4-b/бензотиазол (обычное название: трициклозол), 1,2,5,6-тетрагидропирроло/3,2,1-ij/хинолин-4-он (обычное название: пирохилон), 6-(3,5-дихлор-4-метилфенил)-3(2H)-пиридазинон (обычное название: дикломезин), 3-аллил-окси-1,2-бензотиазол-1,1-диоксид (обычное название: пробепазол). Подходящее весовое соотношение соединения согласно настоящему изобретению к другим сельскохозяйственным химикатам при смешении, когда оно используется в смеси или комбинации, в общем может быть в пределах от 1:300 до 300:1, предпочтительно в пределах от 1:100 до 100:1. Пестициды в соответствии с настоящим изобретением применяются при концентрации активного ингредиента от 0,1 до 500000 ч./млн, предпочтительно от 1 до 100000 ч./млн. Концентрация активного ингредиента может быть произвольно изменена в зависимости от рецептуры, способа, цели, времени или места применения и состояния насекомых-вредителей. Например, водные вредные насекомые могут быть уничтожены нанесением рецептуры, имеющей вышеупомянутую концентрацию, на место вспышки и, таким образом, концентрация активного ингредиента в воде меньше, чем вышеупомянутые пределы. Количество наносимого активного ингредиента на единицу площади поверхности обычно составляет от приблизительно 0,5 до 5000 г, предпочтительно от 10 до 1000 г на гектар. Однако в определенных специальных случаях это количество может выходить за указанные пределы. Различные рецептуры, содержащие соединения в соответствии с настоящим изобретением или их разбавленные композиции, могут наноситься способами, обычно применяемыми для этой цели, такими как распыление (т.е. распрыскивание, разбрызгивание, туманообразование, распыление, рассеивание порошка или зерен или диспергирование в воде), внесение в почву (т.е. смешивание или пропитка), нанесение на поверхность (т.е. покрытие, нанесение порошка или обкладка) или пропитка с целью получения отравленного корма. Далее, возможно кормить домашних животных кормом, содержащим вышеуказанный активный ингредиент и контролировать вспышку или рост численности вредителей, особенно насекомых, с помощью экскрементов животных. Далее, активный ингредиент может наноситься методом так называемого ультрамалого объема. При этом методе композиция может быть составлена на 100% из активного ингредиента. Далее, применение пестицидов в соответствии с настоящим изобретением включает в дополнение к их прямому применению по отношению к вредителям любое другое применение, при котором амидные соединения формулы (1) или их соли действуют на вредителей. В качестве такого другого применения может быть упомянут случай, при котором другие эффективные соединения разлагаются в амидные соединения формулы (1) в окружающей среде, такой как почва, которые затем будут действовать на вредителей. Ниже настоящее изобретение будет описано со ссылками на примеры. Однако следует понимать, что настоящее изобретение никоим образом не ограничено этими специфическими примерами. Пример синтеза 1. Получение N-цианометил-4-трифторметил-3-пиридинкарбоксамида (соединение N1). Раствор 0.96 г 4-трифторметил-3-пиридинкарбоновой кислоты и 1,19 г тионилхлорида в 5 мл бензола нагревали с обратным холодильником в течение 30 мин в присутствии каталитического количества диметилформамида. Избыточный тионилхлорид и бензол отгоняли при пониженном давлении. Затем, остаток растворяли в 15 мл тетрагидрофурана. После этого сюда добавляли 1,82 г триэтиламина и 1,05 г аминоацетонитрилсульфата, и смесь перемешивали при комнатной температуре в течение 18 ч. Затем смесь выливали в воду и экстрагировали этилацетатом. Органический слой промывали водным раствором хлористого аммония, водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и затем концентрировали под пониженным давлением. Остаток очищали с помощью колоночной хроматографии на силикагеле, получая 0,50 г желаемого продукта (соединение N1), имеющего точку плавления от 155 до 161oC. Пример синтеза 2. Получение N-аллил-4-трифторметил-3-пиридинкарбоксамида (соединение N 22). Раствор 0,26 г 4-трифторметил-3-пиридинкарбоновой кислоты и 0,24 г тионилхлорида в 10 мл бензола нагревали с обратным холодильником в течение 30 мин в присутствии каталитического количества диметилформамида. Избыток тионилхлорида и бензола отгоняли под пониженным давлением. Затем остаток растворяли в 15 мл тетрагидрофурана. После этого сюда добавляли 0,21 триэтиламина и 0,12 г аллиламина, и смесь перемешивали при комнатной температуре в течение 20 ч. Затем смесь выливали в водный раствор хлористого аммония и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и затем концентрировали под понижением давлением. Остаток очищали с помощью колоночной хроматографии на силикагеле, получая 0,21 г желаемого продукта (соединение N 22), имеющего точку плавления от 75,5 до 77oC. Пример синтеза 3. Получение 4-трифторметил-3-пиридинкарбоксамида (соединение N 5). Раствор, включающий 3 г 4-трифторметил-3-пиридинкарбоновой кислоты, 6,7 мл тионилхлорида и 20 мл бензола, нагревали с обратным холодильником в течение 1,5 ч в присутствии каталитического количества диметилформамида. Избыток тионилхлорида и бензола отгоняли. Затем остаток растворяли в 5 мл этилацетата. Этот раствор постепенно по каплям прибавляли к 20 мл аммиака при охлаждении льдом. После окончания прикапывания раствора смесь перемешивали при комнатной температуре в течение 30 мин. Затем воду и этилацетат отгоняли под пониженным давлением. Остаток экстрагировали нагретым этилацетатом, получая 2,1 г 4-трифторметил-3-пиридинкарбоксамида (точка плавления: 162,7oC) в качестве желаемого продукта. Пример синтеза 4. Получение 4-трифторметил-3-пиридинкарбоксамида (соединение N 5). (1) 11,3 г 3-циано-2,6-дихлор-4-трифторметилпиридин постепенно прибавляли к 22,6 мл концентрированной серной кислоты, затем смесь нагревали и оставляли на 1 ч реагировать при 100oC. По окончании реакции смесь выливали в ледяную воду, после чего образовывался белый осадок. Осадок собирали на фильтре, а фильтрат экстрагировали метиленхлоридом. Органический слой сушили над безводным сульфатом натрия, и затем отгоняли растворитель под пониженным давлением, получая белое твердое вещество. Это твердое вещество и полученный ранее осадок объединяли, получая 9,2 г 2,6-дихлор-4-трифторметил-3-пиридикарбоксамида. (2) 9,2 г 2,6-дихлор-4-трифторметил-3-пиридинкарбоксамида полученного на стадии (1) (см. выше), 0,66 г 10%-ного палладированного угля и 6,4 г безводного ацетата натрия прибавляли к 200 мл метанола. Затем проводили восстановительную реакцию под атмосферой водорода при комнатной температуре в течение 12 ч. После окончания реакции катализатор восстановления удаляли целитом, а фильтрат концентрировали. Проводили экстракцию, добавляя этилацетат и воду к осадку. Органический слой сушили над безводным сульфатом натрия. Затем отгоняли растворитель, получая 5,2 г 4-трифторметил-3-пиридинкарбоксамида в качестве желаемого продукта. Пример синтеза 5. Получение этил 4-трифторметилникотиноиламиноацетимидата (соединение N 32). В охлаждаемую льдом колбу типа колбы Кьельдаля помещали 5 мл абсолютного этанола и прибавляли к нему 100 мг (0,4 ммоля) 4-трифторметил-N-(цианометил)-3-пиридикарбоксамида. После того как смеси давали поглотить хлористый водород, колбу запечатывали и оставляли стоять в холодильнике на 21 ч. Затем смесь возвращали к комнатной температуре и подвергали перегонке под пониженным давлением с последующей сушкой под вакуумом. Полученный таким образом гидрохлорид добавляли к водному раствору кислого карбоната натрия и таким образом нейтрализовали. Затем экстрагировали диэтилэфиром. Органический слой сушили над безводным сульфатом натрия и концентрировали под пониженным давлением. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (проявляющий растворитель: н-гексан/этилацетат 3/7), получая 0,165 г (выход: 45,8%) этил 4-трифторметилниоотинииламида, имеющего точку плавления от 64,5 до 66,0oC. Пример синтеза 6. Получение О-метил N-(4-трифторметилникотиноилтиокарбамата (соединение N 9). В 30 мл бензола прибавляют 1,12 г (11 ммолей) тиоцианата калия и затем прикапывали при комнатной температуре 2,19 г (10 ммолей) 4-трифторметилникотиновой кислоты. Затем смесь нагревали с обратным холодильником в течение 6 ч. После нагревания с обратным холодильником смесь перегоняли под пониженным давлением, получая 4-трифторметилникотиноилтиоизоцианат. Полученный таким образом тиоизоцианат прибавляли к 30 мл ацетонитрила и к нему прикапывали 0,44 мл (10,5 ммоля) метанола. Смесь перемешивали при комнатной температуре в течение 16 ч. Реакционный раствор выливали в воду и экстрагировали этилацетатом. Органический слой промывали водным раствором натрия и затем концентрировали под пониженным давлением. Полученный таким образом остаток очищали с помощью колоночной хроматографии на силикагеле ( проявляющий растворитель: н-гексан/этилацетат 6/4), получая 0.84 г (выход: 30,4% ) О-метил N-(4- трифторметилникотиноил) тиокарбамата, имеющего точку плавления от 138 до 141,5oC. Пример синтеза 7. Получение О-метил S-метил N-(4-трифторникотиноил) иминотиокарбоната (соединение N 14). В раствор, содержащий 0,200 г (0,78 ммоля) О-метил N-(4-трифторметилникотиноил тиокарбамата, полученного в вышеприведенном примере 6, и 2 мл диметилформамида, прибавляли при комнатной температуре 0,034 г (0,85 ммоля). Смесь затем перемешивали 15 мин и затем к ней прикапывали 0,118 г (0,83 ммоля) иодистого метила. Смесь перемешивали при комнатной температуре в течение одного часа, затем выливали в воду и экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и концентрировали под пониженным давлением. Полученный таким образом остаток очищали с помощью колоночной хроматографии на силикагеле (проявляющий растворитель: н-гексан/этилацетат 7/3), получая 0,133 г (выход: 63,1%) маслянистого О-метил S-метил N-(4-трифторметилникотиноил) иминокарбоната. Пример синтеза 8. Получение N-(N"-изопропиламинометил)-4-тирфторметилпиридин- 3-карбоксамида (соединение N 4). В 30 мл диметоксиэтана пропускали при 20oC 0,6 г газообразного хлористого водорода. Затем этот раствор охлаждали до -30oC. Затем к нему прикапывали раствор, содержащий 0,72 г (3,4 ммоля) 1, 3, 5-триизопропил-2, 4, 6-гексагидротриазина, растворенного в 5 мл диметоксиэтана и затем прибавляли еще 1,88 г (9,9 ммоля) трифторметилпиридин-3-карбоксамида. Этот раствор перемешивали при комнатной температуре в течение 12 ч. Затем растворитель отгоняли под пониженным давлением. Остаток растворяли в 30 мл метанола, и к нему потом добавляли 3 г (30 ммоля) триэтиламина. Метанол отгоняли под пониженным давлением, и затем добавляли сюда 30 мл этилацетата. После этого примеси отфильтровывали, фильтрат концентрировали и очищали с помощью колоночной хроматографии на силикагеле (элюент: этилацетат/этанол 85/15), получая 1,1 г (выход: 42,6%) N-(N1-изопропиламинометил)-4-трифторметилпиридин-3-карбоксамид, имеющего точку плавления 119,8oC, в качестве желаемого продукта. Пример синтеза 9. Получение N-(N1, N1-диметиламинометил)-4-трифторметилпиридин-3-карбоксамида (соединение N 11). К смешанному раствору, содержащему 1,3 г (6,8 ммоля) 4-трифторметилпиридин-3-карбоксамида, 1,5 мл воды и 0,63 г (7 ммоля) диметиламина, прибавляли 0,57 г (7 ммоля) 37%-ного водного раствора формальдегида. Затем смесь оставляли на два часа реагировать при 80oC. После окончания реакции к реакционному раствору прибавляли безводный карбонат натрия до его насыщения. Затем к нему прибавляли метиленхлорид и воду и проводили экстракцию. Органический слой сушили над безводным сульфатом натрия, и после этого растворитель отгоняли под пониженным давлением. Остаток, полученный таким образом, очищали с помощью колоночной хроматографии на силикагеле (элюент: этилацетат/метанол 19/1), получая 0,55 г (выход: 32,5%) N-(N1, N1-диметиламинометил)-4-трифторметилпиридин-3-карбоксамид (точка плавления: 50 58oC) в качестве желаемого продукта. Пример синтеза 10. Получение 4-трифторметил-3-пиридинкарбоксамид 1-оксида (соединение N 111). 0,8 г 4-трифторметил-3-пиридинкарбоксамида растворяли в 7 мл уксусной кислоты. Затем постепенно прикапывали к нему 0,72 г 30%-ного водного раствора перекиси водорода. После окончания прикапывания реакционный раствор нагревали до 70oC и перемешивали в течение 8 часов при этой температуре. После окончания реакция растворитель отгоняли под пониженным давлением. Полученный таким образом остаток промывали н-гексаном, получая 0,6 г 4-трифторметил-3-пиридинкарбоксамид 1-оксида (точка плавления 198,8oC) в качестве желаемого продукта. Соединения формулы (1), полученные в соответствии с настоящим изобретением, показаны в таблице. Соединения формулы (1) также включают следующие соединения: соединение N 124: 4-хлордифторметил-3-пиридинкарбоксамид, соединение N 125: 4-дихлорфторметил-3-пипридинкарбоксамид, соединение N 126: 4-трихлорметил-3-пириндикарбоксамид, соединение N 127: 4-дифторметил-3-пиридинкарбоксамид, соединение N 128: 4-фторметил-3-пиридинкарбоксамид, соединение N 129: 4-b,b,b-трифторэтил-3-пиридинкарбоксамид, соединение N 130: 4-пентафторэтил-3-пиридинкарбоксамид, соединение N 131: 4-дибромметил-3-пиридинкарбоксамид (т. пл. 115 - 117,5oC), соединение N 132: 4-бромметил-3-пиридинкарбоксамид. Пример испытаний 1. Инсектицидное испытание против тли персиковой (Murus persicae). Каждый состав, содержащий активный ингредиент, диспергировали в воде, получая дисперсию каждого активного ингредиента с концентрацией 800 ч./млн. Черешок каждого из баклажан только с одним оставшимся листом (высажен в горшок, имеющий диаметр 8 см и высоту 7 см) снабжали наклейкой, и на каждый лист баклажана высаживали и инкубировали примерно по 2 3 бескрылых живородящих самки персиковой тли (Murus persicae). Через два дня после заражения взрослых насекомых удаляли и считали число личинок. Затем лист баклажанного растения, зараженный личинками, погружали в вышеприготовленную дисперсию, имеющую заданную концентрацию, приблизительно на 10 с, затем сушили на воздухе и содержали в освещаемой камере с постоянной температурой 26oC. На 5-й день после обработки считали мертвых насекомых и определяли смертность по следующему уравнению: )-цис-4-/3-(4-трет. -бутилфенил)-2-метилпропил/-2,6-диметилморфолин (обычное название: фенпроиморф). Оловоорганические соединения: гидроксид трифенилолова (обычное название: фентин гидроксид) и ацетат трифенилолова (обычное название: фентин ацетат). Мочевинные соединения: 1-(4-хлорбензил)-1-циклопентил-3-фенилмочевина (обычное название: пенцисурон). Соединения циппамовой (коричной) кислоты: (E )4-/3(4-хлорфенил)-3-(3,4-диметоксифенил)акрилоил/-морфолин (обычное название: диметофорф). Фенилкарбоматные соединения: изопропил 3,4-диэтоксикарбанилат (обычное название: диэтофенкарб). Цианпиррольные соединения: 3-циан-4-(2,2-дифтор-1,3-бенодиоксол-4-ил)-пиррол) (обычное название: сафир) и 3-(2",3"-дихлорфенил)-4-цианопиррол (обычное название: фенпиклонил). Пиридинаминные соединения: 3-хлор-V-(3-хлор-2,6-динитро-4-a, a, a-трифтортолил)-5-трифторметил-2-пиридинамин (обычное название: флуазинам). Другие активные ингредиенты фунгицидов включают антрахиновые соединения, кротонокислотные соединения, антибиотики и другие соединения, такие как: диизопропиловый эфир 1,3-дитиолан-2-илиденмалоновой кислоты (обычное название: изопротиолан), 5-метил-1,2,4-триазоло/3,4-b/бензотиазол (обычное название: трициклозол), 1,2,5,6-тетрагидропирроло/3,2,1-ij/хинолин-4-он (обычное название: пирохилон), 6-(3,5-дихлор-4-метилфенил)-3(2H)-пиридазинон (обычное название: дикломезин), 3-аллил-окси-1,2-бензотиазол-1,1-диоксид (обычное название: пробепазол). Подходящее весовое соотношение соединения согласно настоящему изобретению к другим сельскохозяйственным химикатам при смешении, когда оно используется в смеси или комбинации, в общем может быть в пределах от 1:300 до 300:1, предпочтительно в пределах от 1:100 до 100:1. Пестициды в соответствии с настоящим изобретением применяются при концентрации активного ингредиента от 0,1 до 500000 ч./млн, предпочтительно от 1 до 100000 ч./млн. Концентрация активного ингредиента может быть произвольно изменена в зависимости от рецептуры, способа, цели, времени или места применения и состояния насекомых-вредителей. Например, водные вредные насекомые могут быть уничтожены нанесением рецептуры, имеющей вышеупомянутую концентрацию, на место вспышки и, таким образом, концентрация активного ингредиента в воде меньше, чем вышеупомянутые пределы. Количество наносимого активного ингредиента на единицу площади поверхности обычно составляет от приблизительно 0,5 до 5000 г, предпочтительно от 10 до 1000 г на гектар. Однако в определенных специальных случаях это количество может выходить за указанные пределы. Различные рецептуры, содержащие соединения в соответствии с настоящим изобретением или их разбавленные композиции, могут наноситься способами, обычно применяемыми для этой цели, такими как распыление (т.е. распрыскивание, разбрызгивание, туманообразование, распыление, рассеивание порошка или зерен или диспергирование в воде), внесение в почву (т.е. смешивание или пропитка), нанесение на поверхность (т.е. покрытие, нанесение порошка или обкладка) или пропитка с целью получения отравленного корма. Далее, возможно кормить домашних животных кормом, содержащим вышеуказанный активный ингредиент и контролировать вспышку или рост численности вредителей, особенно насекомых, с помощью экскрементов животных. Далее, активный ингредиент может наноситься методом так называемого ультрамалого объема. При этом методе композиция может быть составлена на 100% из активного ингредиента. Далее, применение пестицидов в соответствии с настоящим изобретением включает в дополнение к их прямому применению по отношению к вредителям любое другое применение, при котором амидные соединения формулы (1) или их соли действуют на вредителей. В качестве такого другого применения может быть упомянут случай, при котором другие эффективные соединения разлагаются в амидные соединения формулы (1) в окружающей среде, такой как почва, которые затем будут действовать на вредителей. Ниже настоящее изобретение будет описано со ссылками на примеры. Однако следует понимать, что настоящее изобретение никоим образом не ограничено этими специфическими примерами. Пример синтеза 1. Получение N-цианометил-4-трифторметил-3-пиридинкарбоксамида (соединение N1). Раствор 0.96 г 4-трифторметил-3-пиридинкарбоновой кислоты и 1,19 г тионилхлорида в 5 мл бензола нагревали с обратным холодильником в течение 30 мин в присутствии каталитического количества диметилформамида. Избыточный тионилхлорид и бензол отгоняли при пониженном давлении. Затем, остаток растворяли в 15 мл тетрагидрофурана. После этого сюда добавляли 1,82 г триэтиламина и 1,05 г аминоацетонитрилсульфата, и смесь перемешивали при комнатной температуре в течение 18 ч. Затем смесь выливали в воду и экстрагировали этилацетатом. Органический слой промывали водным раствором хлористого аммония, водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и затем концентрировали под пониженным давлением. Остаток очищали с помощью колоночной хроматографии на силикагеле, получая 0,50 г желаемого продукта (соединение N1), имеющего точку плавления от 155 до 161oC. Пример синтеза 2. Получение N-аллил-4-трифторметил-3-пиридинкарбоксамида (соединение N 22). Раствор 0,26 г 4-трифторметил-3-пиридинкарбоновой кислоты и 0,24 г тионилхлорида в 10 мл бензола нагревали с обратным холодильником в течение 30 мин в присутствии каталитического количества диметилформамида. Избыток тионилхлорида и бензола отгоняли под пониженным давлением. Затем остаток растворяли в 15 мл тетрагидрофурана. После этого сюда добавляли 0,21 триэтиламина и 0,12 г аллиламина, и смесь перемешивали при комнатной температуре в течение 20 ч. Затем смесь выливали в водный раствор хлористого аммония и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и затем концентрировали под понижением давлением. Остаток очищали с помощью колоночной хроматографии на силикагеле, получая 0,21 г желаемого продукта (соединение N 22), имеющего точку плавления от 75,5 до 77oC. Пример синтеза 3. Получение 4-трифторметил-3-пиридинкарбоксамида (соединение N 5). Раствор, включающий 3 г 4-трифторметил-3-пиридинкарбоновой кислоты, 6,7 мл тионилхлорида и 20 мл бензола, нагревали с обратным холодильником в течение 1,5 ч в присутствии каталитического количества диметилформамида. Избыток тионилхлорида и бензола отгоняли. Затем остаток растворяли в 5 мл этилацетата. Этот раствор постепенно по каплям прибавляли к 20 мл аммиака при охлаждении льдом. После окончания прикапывания раствора смесь перемешивали при комнатной температуре в течение 30 мин. Затем воду и этилацетат отгоняли под пониженным давлением. Остаток экстрагировали нагретым этилацетатом, получая 2,1 г 4-трифторметил-3-пиридинкарбоксамида (точка плавления: 162,7oC) в качестве желаемого продукта. Пример синтеза 4. Получение 4-трифторметил-3-пиридинкарбоксамида (соединение N 5). (1) 11,3 г 3-циано-2,6-дихлор-4-трифторметилпиридин постепенно прибавляли к 22,6 мл концентрированной серной кислоты, затем смесь нагревали и оставляли на 1 ч реагировать при 100oC. По окончании реакции смесь выливали в ледяную воду, после чего образовывался белый осадок. Осадок собирали на фильтре, а фильтрат экстрагировали метиленхлоридом. Органический слой сушили над безводным сульфатом натрия, и затем отгоняли растворитель под пониженным давлением, получая белое твердое вещество. Это твердое вещество и полученный ранее осадок объединяли, получая 9,2 г 2,6-дихлор-4-трифторметил-3-пиридикарбоксамида. (2) 9,2 г 2,6-дихлор-4-трифторметил-3-пиридинкарбоксамида полученного на стадии (1) (см. выше), 0,66 г 10%-ного палладированного угля и 6,4 г безводного ацетата натрия прибавляли к 200 мл метанола. Затем проводили восстановительную реакцию под атмосферой водорода при комнатной температуре в течение 12 ч. После окончания реакции катализатор восстановления удаляли целитом, а фильтрат концентрировали. Проводили экстракцию, добавляя этилацетат и воду к осадку. Органический слой сушили над безводным сульфатом натрия. Затем отгоняли растворитель, получая 5,2 г 4-трифторметил-3-пиридинкарбоксамида в качестве желаемого продукта. Пример синтеза 5. Получение этил 4-трифторметилникотиноиламиноацетимидата (соединение N 32). В охлаждаемую льдом колбу типа колбы Кьельдаля помещали 5 мл абсолютного этанола и прибавляли к нему 100 мг (0,4 ммоля) 4-трифторметил-N-(цианометил)-3-пиридикарбоксамида. После того как смеси давали поглотить хлористый водород, колбу запечатывали и оставляли стоять в холодильнике на 21 ч. Затем смесь возвращали к комнатной температуре и подвергали перегонке под пониженным давлением с последующей сушкой под вакуумом. Полученный таким образом гидрохлорид добавляли к водному раствору кислого карбоната натрия и таким образом нейтрализовали. Затем экстрагировали диэтилэфиром. Органический слой сушили над безводным сульфатом натрия и концентрировали под пониженным давлением. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (проявляющий растворитель: н-гексан/этилацетат 3/7), получая 0,165 г (выход: 45,8%) этил 4-трифторметилниоотинииламида, имеющего точку плавления от 64,5 до 66,0oC. Пример синтеза 6. Получение О-метил N-(4-трифторметилникотиноилтиокарбамата (соединение N 9). В 30 мл бензола прибавляют 1,12 г (11 ммолей) тиоцианата калия и затем прикапывали при комнатной температуре 2,19 г (10 ммолей) 4-трифторметилникотиновой кислоты. Затем смесь нагревали с обратным холодильником в течение 6 ч. После нагревания с обратным холодильником смесь перегоняли под пониженным давлением, получая 4-трифторметилникотиноилтиоизоцианат. Полученный таким образом тиоизоцианат прибавляли к 30 мл ацетонитрила и к нему прикапывали 0,44 мл (10,5 ммоля) метанола. Смесь перемешивали при комнатной температуре в течение 16 ч. Реакционный раствор выливали в воду и экстрагировали этилацетатом. Органический слой промывали водным раствором натрия и затем концентрировали под пониженным давлением. Полученный таким образом остаток очищали с помощью колоночной хроматографии на силикагеле ( проявляющий растворитель: н-гексан/этилацетат 6/4), получая 0.84 г (выход: 30,4% ) О-метил N-(4- трифторметилникотиноил) тиокарбамата, имеющего точку плавления от 138 до 141,5oC. Пример синтеза 7. Получение О-метил S-метил N-(4-трифторникотиноил) иминотиокарбоната (соединение N 14). В раствор, содержащий 0,200 г (0,78 ммоля) О-метил N-(4-трифторметилникотиноил тиокарбамата, полученного в вышеприведенном примере 6, и 2 мл диметилформамида, прибавляли при комнатной температуре 0,034 г (0,85 ммоля). Смесь затем перемешивали 15 мин и затем к ней прикапывали 0,118 г (0,83 ммоля) иодистого метила. Смесь перемешивали при комнатной температуре в течение одного часа, затем выливали в воду и экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и концентрировали под пониженным давлением. Полученный таким образом остаток очищали с помощью колоночной хроматографии на силикагеле (проявляющий растворитель: н-гексан/этилацетат 7/3), получая 0,133 г (выход: 63,1%) маслянистого О-метил S-метил N-(4-трифторметилникотиноил) иминокарбоната. Пример синтеза 8. Получение N-(N"-изопропиламинометил)-4-тирфторметилпиридин- 3-карбоксамида (соединение N 4). В 30 мл диметоксиэтана пропускали при 20oC 0,6 г газообразного хлористого водорода. Затем этот раствор охлаждали до -30oC. Затем к нему прикапывали раствор, содержащий 0,72 г (3,4 ммоля) 1, 3, 5-триизопропил-2, 4, 6-гексагидротриазина, растворенного в 5 мл диметоксиэтана и затем прибавляли еще 1,88 г (9,9 ммоля) трифторметилпиридин-3-карбоксамида. Этот раствор перемешивали при комнатной температуре в течение 12 ч. Затем растворитель отгоняли под пониженным давлением. Остаток растворяли в 30 мл метанола, и к нему потом добавляли 3 г (30 ммоля) триэтиламина. Метанол отгоняли под пониженным давлением, и затем добавляли сюда 30 мл этилацетата. После этого примеси отфильтровывали, фильтрат концентрировали и очищали с помощью колоночной хроматографии на силикагеле (элюент: этилацетат/этанол 85/15), получая 1,1 г (выход: 42,6%) N-(N1-изопропиламинометил)-4-трифторметилпиридин-3-карбоксамид, имеющего точку плавления 119,8oC, в качестве желаемого продукта. Пример синтеза 9. Получение N-(N1, N1-диметиламинометил)-4-трифторметилпиридин-3-карбоксамида (соединение N 11). К смешанному раствору, содержащему 1,3 г (6,8 ммоля) 4-трифторметилпиридин-3-карбоксамида, 1,5 мл воды и 0,63 г (7 ммоля) диметиламина, прибавляли 0,57 г (7 ммоля) 37%-ного водного раствора формальдегида. Затем смесь оставляли на два часа реагировать при 80oC. После окончания реакции к реакционному раствору прибавляли безводный карбонат натрия до его насыщения. Затем к нему прибавляли метиленхлорид и воду и проводили экстракцию. Органический слой сушили над безводным сульфатом натрия, и после этого растворитель отгоняли под пониженным давлением. Остаток, полученный таким образом, очищали с помощью колоночной хроматографии на силикагеле (элюент: этилацетат/метанол 19/1), получая 0,55 г (выход: 32,5%) N-(N1, N1-диметиламинометил)-4-трифторметилпиридин-3-карбоксамид (точка плавления: 50 58oC) в качестве желаемого продукта. Пример синтеза 10. Получение 4-трифторметил-3-пиридинкарбоксамид 1-оксида (соединение N 111). 0,8 г 4-трифторметил-3-пиридинкарбоксамида растворяли в 7 мл уксусной кислоты. Затем постепенно прикапывали к нему 0,72 г 30%-ного водного раствора перекиси водорода. После окончания прикапывания реакционный раствор нагревали до 70oC и перемешивали в течение 8 часов при этой температуре. После окончания реакция растворитель отгоняли под пониженным давлением. Полученный таким образом остаток промывали н-гексаном, получая 0,6 г 4-трифторметил-3-пиридинкарбоксамид 1-оксида (точка плавления 198,8oC) в качестве желаемого продукта. Соединения формулы (1), полученные в соответствии с настоящим изобретением, показаны в таблице. Соединения формулы (1) также включают следующие соединения: соединение N 124: 4-хлордифторметил-3-пиридинкарбоксамид, соединение N 125: 4-дихлорфторметил-3-пипридинкарбоксамид, соединение N 126: 4-трихлорметил-3-пириндикарбоксамид, соединение N 127: 4-дифторметил-3-пиридинкарбоксамид, соединение N 128: 4-фторметил-3-пиридинкарбоксамид, соединение N 129: 4-b,b,b-трифторэтил-3-пиридинкарбоксамид, соединение N 130: 4-пентафторэтил-3-пиридинкарбоксамид, соединение N 131: 4-дибромметил-3-пиридинкарбоксамид (т. пл. 115 - 117,5oC), соединение N 132: 4-бромметил-3-пиридинкарбоксамид. Пример испытаний 1. Инсектицидное испытание против тли персиковой (Murus persicae). Каждый состав, содержащий активный ингредиент, диспергировали в воде, получая дисперсию каждого активного ингредиента с концентрацией 800 ч./млн. Черешок каждого из баклажан только с одним оставшимся листом (высажен в горшок, имеющий диаметр 8 см и высоту 7 см) снабжали наклейкой, и на каждый лист баклажана высаживали и инкубировали примерно по 2 3 бескрылых живородящих самки персиковой тли (Murus persicae). Через два дня после заражения взрослых насекомых удаляли и считали число личинок. Затем лист баклажанного растения, зараженный личинками, погружали в вышеприготовленную дисперсию, имеющую заданную концентрацию, приблизительно на 10 с, затем сушили на воздухе и содержали в освещаемой камере с постоянной температурой 26oC. На 5-й день после обработки считали мертвых насекомых и определяли смертность по следующему уравнению:  Насекомые, отпавшие от листа, считались мертвыми. В результате смертность была 100% с каждым соединением NN 1-56, 58-66, 69, 70, 72-79, 82, 85-89, 91, 99 и 102-111, и от 90 до 99% с соединениями NN 57, 67, 68, 71 и 80. Пример испытаний 2. Системное испытание против тли персиковой (Murus persicae). Каждый состав, содержащий активный ингредиент, диспергировали в воде, получая дисперсию каждого активного ингредиента с концентрацией 800 ч./млн. Черешок каждого из баклажанных растений только с одним оставшимся листом (высажены в горшок диаметром 8 см и высотой 7 см) снабжали наклейкой и на каждый лист баклажанного растения высаживали и инкубировали приблизительно 2 3 бескрылых живородящих самки персиковой тли (Murus persicae). Через два дня после заражения взрослых насекомых удаляли и подсчитывали число личинок. Затем баклажанное растение, зараженное личинками, обрабатывали путем пропитки почвы в горшке 10 мл вышеприготовленной дисперсии, имеющей заданную концентрацию, и содержали в освещаемой камере с постоянной температурой 26oC. На каждый 5-й день после обработки считали мертвых насекомых, и определяли смертность тем же способом, что и в примере испытаний 1. Смертность в результате была 100% с каждым из соединений NN 1-17, 20-23, 26-28, 30, 31, 33-37, 39-41, 44, 46, 49, 50, 78, 85, 86, 88, 89, 99, 103, 104 и 111. Пример испытаний 3. Системное испытание против Thirps palmi. Каждый состав, содержащий активный ингредиент, диспергировали в воде, получая дисперсию каждого активного ингредиента с концентрацией 800 ч./млн. Черешок каждого баклажанного растения только с одним оставшимся листом (высажен в горшок диаметром 8 см и высотой 7 см) снабжали наклейкой, и на каждый лист баклажанного растения высаживали приблизительно 20 взрослых насекомых Thirps palmi. Через один день после заражения баклажанное растение, зараженное взрослыми насекомыми, обрабатывали путем пропитки почвы в горшке в мл вышеприготовленной дисперсии, имеющей заданную концентрацию, и содержали в освещаемой камере с постоянной температурой 26oC. На 8-й день после обработки считали число паразитических взрослых насекомых и личинок следующего поколения. На необработанном баклажанном растении было 4 взрослых насекомых и 172 личинки. Напротив, на баклажанном растении, обработанном соединениями NN 1, 5 и 85, не было обнаружено ни одного взрослого насекомого, что указывает на высокую инсектицидную эффективность. Ниже приводятся примеры рецептур согласно настоящему изобретению. Однако эти конкретные примеры не ограничивают соединения согласно настоящему изобретению, количества активных ингредиентов или типы рецептур. Пример рецептуры 1, мас.ч. (а) соединение N 1 20 (б) каолин 72 (в) лигнинсульфонат натрия 8 Вышеприведенные компоненты равномерно смешивали, получая смачивающийся порошок. Пример рецептуры 2, мас.ч. (а) соединение N 4 5 (б) тальк 95 Вышеприведенные компоненты равномерно смешивали, получая дуст. Пример рецептуры 3, мас.ч. (а) соединение N 2 20 (б) N, N"-диметилацетамид 20 (в) полиоксиэтиленалкилфенилэфир 10 (г) ксилол 50 Вышеприведенные компоненты равномерно смешивали и растворяли, получая эмульгируемый концентрат. Пример рецептуры 4, мас.ч. (а) каолин 68 (б) лигнинсульфонат натрия 2 (в) полиоксиэтиленалкиларилсульфат 5 (г) тонкий порошок кремнезема 25 Смесь вышеприведенных компонентов смешивают с соединением N 5 в весовом соотношении 4:1, получая смачивающийся порошок. Пример рецептуры 5, мас.ч. (а) соединение N 12 50 (б) оксилированный полиалкилфенил-фосфат-триэтаноламин 2 (в) силикон 0,2 (г) вода 47,8 Вышеуказанные компоненты равномерно смешивали и измельчали в порошок, получая жидкий носитель, и добавляли, мас.ч. (д) поликарбоксилат натрия 5 (е) безводный сульфат натрия 42,8 и смесь равномерно смешивали и сушили, получая вододиспергируемые гранулы. Пример рецептуры 6, мас.ч. (а) соединение N 85 5 (б) полиоксиэтиленоктилфенилэфир 1 (в) полиоксиэтиленовый эфир фосфорной кислоты 0,5 (г) гранулированный карбонат кальция 93,5 Вышеприведенные компоненты (а) (в) равномерно смешивали и пластифицировали вместе с небольшим количеством ацетона, и затем смесь распыляли на компонент (г) для удаления ацетона, получая таким образом гранулы. Пример рецептуры 7, мас.ч. (а) соединение N 16 2,5 (б) N-метил-2-пирролидон 2,5 (в) соевое масло 95,0 Вышеприведенные компоненты равномерно смешивали и растворяли, получая состав ультрамалого объема. Пример рецептуры 8, мас.ч. (а) соединение N 3 5 (б) N, N1-диметилацетамид 15 (в) полиоксиэтиленалкил-арилэфир 10 (г) ксилол 70 Вышеприведенные компоненты равномерно смешивали, получая эмульгируемый концентрат. Пример рецептуры 9, мас.ч. (а) соединение N 111 20 (б) лаурилсульфат натрия 3 (в) водорастворимый крахмал 77 Вышеприведенные компоненты равномерно смешивали, получая водорастворимый порошок. Насекомые, отпавшие от листа, считались мертвыми. В результате смертность была 100% с каждым соединением NN 1-56, 58-66, 69, 70, 72-79, 82, 85-89, 91, 99 и 102-111, и от 90 до 99% с соединениями NN 57, 67, 68, 71 и 80. Пример испытаний 2. Системное испытание против тли персиковой (Murus persicae). Каждый состав, содержащий активный ингредиент, диспергировали в воде, получая дисперсию каждого активного ингредиента с концентрацией 800 ч./млн. Черешок каждого из баклажанных растений только с одним оставшимся листом (высажены в горшок диаметром 8 см и высотой 7 см) снабжали наклейкой и на каждый лист баклажанного растения высаживали и инкубировали приблизительно 2 3 бескрылых живородящих самки персиковой тли (Murus persicae). Через два дня после заражения взрослых насекомых удаляли и подсчитывали число личинок. Затем баклажанное растение, зараженное личинками, обрабатывали путем пропитки почвы в горшке 10 мл вышеприготовленной дисперсии, имеющей заданную концентрацию, и содержали в освещаемой камере с постоянной температурой 26oC. На каждый 5-й день после обработки считали мертвых насекомых, и определяли смертность тем же способом, что и в примере испытаний 1. Смертность в результате была 100% с каждым из соединений NN 1-17, 20-23, 26-28, 30, 31, 33-37, 39-41, 44, 46, 49, 50, 78, 85, 86, 88, 89, 99, 103, 104 и 111. Пример испытаний 3. Системное испытание против Thirps palmi. Каждый состав, содержащий активный ингредиент, диспергировали в воде, получая дисперсию каждого активного ингредиента с концентрацией 800 ч./млн. Черешок каждого баклажанного растения только с одним оставшимся листом (высажен в горшок диаметром 8 см и высотой 7 см) снабжали наклейкой, и на каждый лист баклажанного растения высаживали приблизительно 20 взрослых насекомых Thirps palmi. Через один день после заражения баклажанное растение, зараженное взрослыми насекомыми, обрабатывали путем пропитки почвы в горшке в мл вышеприготовленной дисперсии, имеющей заданную концентрацию, и содержали в освещаемой камере с постоянной температурой 26oC. На 8-й день после обработки считали число паразитических взрослых насекомых и личинок следующего поколения. На необработанном баклажанном растении было 4 взрослых насекомых и 172 личинки. Напротив, на баклажанном растении, обработанном соединениями NN 1, 5 и 85, не было обнаружено ни одного взрослого насекомого, что указывает на высокую инсектицидную эффективность. Ниже приводятся примеры рецептур согласно настоящему изобретению. Однако эти конкретные примеры не ограничивают соединения согласно настоящему изобретению, количества активных ингредиентов или типы рецептур. Пример рецептуры 1, мас.ч. (а) соединение N 1 20 (б) каолин 72 (в) лигнинсульфонат натрия 8 Вышеприведенные компоненты равномерно смешивали, получая смачивающийся порошок. Пример рецептуры 2, мас.ч. (а) соединение N 4 5 (б) тальк 95 Вышеприведенные компоненты равномерно смешивали, получая дуст. Пример рецептуры 3, мас.ч. (а) соединение N 2 20 (б) N, N"-диметилацетамид 20 (в) полиоксиэтиленалкилфенилэфир 10 (г) ксилол 50 Вышеприведенные компоненты равномерно смешивали и растворяли, получая эмульгируемый концентрат. Пример рецептуры 4, мас.ч. (а) каолин 68 (б) лигнинсульфонат натрия 2 (в) полиоксиэтиленалкиларилсульфат 5 (г) тонкий порошок кремнезема 25 Смесь вышеприведенных компонентов смешивают с соединением N 5 в весовом соотношении 4:1, получая смачивающийся порошок. Пример рецептуры 5, мас.ч. (а) соединение N 12 50 (б) оксилированный полиалкилфенил-фосфат-триэтаноламин 2 (в) силикон 0,2 (г) вода 47,8 Вышеуказанные компоненты равномерно смешивали и измельчали в порошок, получая жидкий носитель, и добавляли, мас.ч. (д) поликарбоксилат натрия 5 (е) безводный сульфат натрия 42,8 и смесь равномерно смешивали и сушили, получая вододиспергируемые гранулы. Пример рецептуры 6, мас.ч. (а) соединение N 85 5 (б) полиоксиэтиленоктилфенилэфир 1 (в) полиоксиэтиленовый эфир фосфорной кислоты 0,5 (г) гранулированный карбонат кальция 93,5 Вышеприведенные компоненты (а) (в) равномерно смешивали и пластифицировали вместе с небольшим количеством ацетона, и затем смесь распыляли на компонент (г) для удаления ацетона, получая таким образом гранулы. Пример рецептуры 7, мас.ч. (а) соединение N 16 2,5 (б) N-метил-2-пирролидон 2,5 (в) соевое масло 95,0 Вышеприведенные компоненты равномерно смешивали и растворяли, получая состав ультрамалого объема. Пример рецептуры 8, мас.ч. (а) соединение N 3 5 (б) N, N1-диметилацетамид 15 (в) полиоксиэтиленалкил-арилэфир 10 (г) ксилол 70 Вышеприведенные компоненты равномерно смешивали, получая эмульгируемый концентрат. Пример рецептуры 9, мас.ч. (а) соединение N 111 20 (б) лаурилсульфат натрия 3 (в) водорастворимый крахмал 77 Вышеприведенные компоненты равномерно смешивали, получая водорастворимый порошок.
ФОРМУЛА ИЗОБРЕТЕНИЯ1. Производные пиридина общей формулы I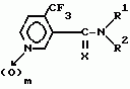 где X кислород или сера; R1 водород, низший алкил, который может быть замещен группой циано, трифторметил, циклопропил, гидрокси, низший алкокси, низший алкоксикарбонил, низший алкилкарбонилокси, фенокси, формил, ацетил, бензоил, (низший алкил)тио, амидо, тиоамидо, N-(низший алкил)амидо, моно(низший алкил)-амино, ди(низший алкил)амино, трифторметилпиридилкарбонилокси, трифторметилпиридилкарбониламино, фенил (который может быть замещен низшим алкилом, низшим алкокси, галогеном, нитро, трифторметилом или 4-метилтиофенокси), (низший алкил)сульфонил, амидино, этил имидат, пирролидино, пиперидино, морфолино (который может быть замещен в кольце низшими алкильными группами) или пиперазино, замещенный по второму атому азота кольца низшим алкилом или фенилом, низший алкенил, низший алкинил, С3-С6- циклоалкил или R1 радикал -C(W")R3, где W1 кислород или сера, R3 низший алкил, низший алкокси, (низший алкил)тио или (низший алкил)амино, SO2R4, где R4 низший алкил или ди(низший алкил)амино, NHR5, где R5 - 2-пиридил; R2 водород, низший алкил, который может быть замещен низшим алкокси или (низший алкил)карбонилокси, группа где X кислород или сера; R1 водород, низший алкил, который может быть замещен группой циано, трифторметил, циклопропил, гидрокси, низший алкокси, низший алкоксикарбонил, низший алкилкарбонилокси, фенокси, формил, ацетил, бензоил, (низший алкил)тио, амидо, тиоамидо, N-(низший алкил)амидо, моно(низший алкил)-амино, ди(низший алкил)амино, трифторметилпиридилкарбонилокси, трифторметилпиридилкарбониламино, фенил (который может быть замещен низшим алкилом, низшим алкокси, галогеном, нитро, трифторметилом или 4-метилтиофенокси), (низший алкил)сульфонил, амидино, этил имидат, пирролидино, пиперидино, морфолино (который может быть замещен в кольце низшими алкильными группами) или пиперазино, замещенный по второму атому азота кольца низшим алкилом или фенилом, низший алкенил, низший алкинил, С3-С6- циклоалкил или R1 радикал -C(W")R3, где W1 кислород или сера, R3 низший алкил, низший алкокси, (низший алкил)тио или (низший алкил)амино, SO2R4, где R4 низший алкил или ди(низший алкил)амино, NHR5, где R5 - 2-пиридил; R2 водород, низший алкил, который может быть замещен низшим алкокси или (низший алкил)карбонилокси, группа 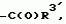 где R3 где R3 - низший алкил, низший алкокси, (низший алкил)тио или трифторметилпиридил, или группа -SO2R4 - низший алкил, низший алкокси, (низший алкил)тио или трифторметилпиридил, или группа -SO2R4 , где R4 , где R4 - низший алкил; либо R1 и R2, взятые вместе, образуют группуC(R6)R7, где R6 и R7 независимо друг от друга - низший алкокси, (низший алкил)тио или R1 и R2 вместе с атомом азота образуют морфолиновое кольцо, 4-(низший алкил)пиперазиновое кольцо или 2-цианимино-3-метил-1,3-диазолидиновое кольцо; m 0 или 1 при условии, что когда m 0 и X кислород, R1 и R2 не являются одновременно водородом. 2. Производные пиридина по п.1, отличающиеся тем, что X кислород. 3. Производные пиридина по п.1, отличающиеся тем, что R1 водород, низший алкил, который может быть замещен цианогруппой, трифторметилом, циклопропилом, гидрокси-, низшей алкоксигруппой, низшим алкоксикарбонилом, низшей алкилкарбонилокси-, феноксигруппой, формилом, ацетилом, бензоилом, (низший алкил)тио-, амидо-, тиоамидо-, N-(низший алкил)амидо-, моно(низший алкил)амино-, ди(низший алкил)амино-, трифторметил пиридилкарбонилокси-, трифторметилпиридилкарбониламиногруппой, фенилом, который может быть замещен, низшим алкилом, низшей алкоксигруппой, галогеном, нитрогруппой, трифторметилом или 4-метилтиофеноксигруппой, (низший алкил)сульфонилом, амидино-, этилимидат-, пирролидино-, пиперидино-, морфолиногруппой (которая может быть замещена в ядре низшими алкилами) или пиперазиногруппой, замещенной у второго атома азота ядра низшим алкилом или фенилом, или группа C(W")R3, где W" кислород или сера, и R3 низший алкил, низшая алкоксигруппа, R2 водород, низший алкил, который может быть замещен низшей алкокси- или (низший алкил)-карбонилоксигруппой, или группа - низший алкил; либо R1 и R2, взятые вместе, образуют группуC(R6)R7, где R6 и R7 независимо друг от друга - низший алкокси, (низший алкил)тио или R1 и R2 вместе с атомом азота образуют морфолиновое кольцо, 4-(низший алкил)пиперазиновое кольцо или 2-цианимино-3-метил-1,3-диазолидиновое кольцо; m 0 или 1 при условии, что когда m 0 и X кислород, R1 и R2 не являются одновременно водородом. 2. Производные пиридина по п.1, отличающиеся тем, что X кислород. 3. Производные пиридина по п.1, отличающиеся тем, что R1 водород, низший алкил, который может быть замещен цианогруппой, трифторметилом, циклопропилом, гидрокси-, низшей алкоксигруппой, низшим алкоксикарбонилом, низшей алкилкарбонилокси-, феноксигруппой, формилом, ацетилом, бензоилом, (низший алкил)тио-, амидо-, тиоамидо-, N-(низший алкил)амидо-, моно(низший алкил)амино-, ди(низший алкил)амино-, трифторметил пиридилкарбонилокси-, трифторметилпиридилкарбониламиногруппой, фенилом, который может быть замещен, низшим алкилом, низшей алкоксигруппой, галогеном, нитрогруппой, трифторметилом или 4-метилтиофеноксигруппой, (низший алкил)сульфонилом, амидино-, этилимидат-, пирролидино-, пиперидино-, морфолиногруппой (которая может быть замещена в ядре низшими алкилами) или пиперазиногруппой, замещенной у второго атома азота ядра низшим алкилом или фенилом, или группа C(W")R3, где W" кислород или сера, и R3 низший алкил, низшая алкоксигруппа, R2 водород, низший алкил, который может быть замещен низшей алкокси- или (низший алкил)-карбонилоксигруппой, или группа 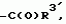 где R3 где R3 низший алкил, низшая алкоксигруппа, (низший алкил)тиогруппа или трифторметилпиридил, либо R1 и R2 вместе образуют группу C(R6)R7, где R6 и R7 независимо друг от друга представляют собой низшую алкокси или низшую алкилтиогруппу. 4. Производные пиридина по п.1, отличающиеся тем, что X кислород, R1 водород, низший алкил, низший алкоксиалкил, низший алкиламиноалкил, ди(низший алкил)аминоалкил, пиперидиноалкил, низший гидроксиалкил, низший цианоалкил, тиокарбамоилалкил, низший алкилкарбонилоксиалкил, низший алкилкарбонил, низший алкокситиокарбонил или низший алкоксикарбонил, R2 водород, низший алкил, низший алкоксиалкил, низший алкилкарбонилоксиалкил, низший алкилкарбонил, трифторметилпиридилкарбонил или низший алкоксикарбонил или R1 и R2 вместе образуют группу C(R6)R7, где R6 и R7 являются низшей алкоксигруппой или низшей алкилтиогруппой. 5. Производные пиридина по п.1, отличающиеся тем, что указанное соединение представляет собой 4-трифторметил-3-пиридинкарбоксамид-1-оксид, или N-цианометил-4-трифторметил-3-пиридинкарбоксамид, N-тиокарбамоилметил-4-трифторметил-3-пиридинкарбоксамид, N-этоксиметил-4-трифторметил-3-пиридинкарбоксамид, N-изопропиламино-метил-4-трифторметил-3-пиридинкарбоксамид, N-цианометил-N, N-бис-(4-трифторметилникотиноил)амин, N-ацетил-N - цианометил-4-трифторметил-3-пиридинкарбоксамид, N-цианометил-N -метил-4-трифторметилпиридин-3-карбоксамид, О-метил-N-( 4-трифторметилникотиноил) тиокарбамат, N-метил-4-трифторметилпиридин -3-карбоксамид, N-(N", N"-диметиламинометил)-4-трифторметилпиридин-3-карбоксамид, N-(1-пиперидинилметил)-4-трифторметилпиридин-3-карбоксамид, N-цианометил-N-(4-трифторметилникотиноил) аминометилпивалат, O, S-диметил-N-(4-трифторметилникотиноил)иминоформиат, N-гидроксиметил-4-трифторметил-3-пиридинкарбоксамид, N-ацетил-4-трифторметил-3-пиридинкарбоксамид или метил N-(4-трифторметилникотиноил)-карбамат или 1-оксид этих соединений. 6. Способ получения производных пиридина общей формулы I-I низший алкил, низшая алкоксигруппа, (низший алкил)тиогруппа или трифторметилпиридил, либо R1 и R2 вместе образуют группу C(R6)R7, где R6 и R7 независимо друг от друга представляют собой низшую алкокси или низшую алкилтиогруппу. 4. Производные пиридина по п.1, отличающиеся тем, что X кислород, R1 водород, низший алкил, низший алкоксиалкил, низший алкиламиноалкил, ди(низший алкил)аминоалкил, пиперидиноалкил, низший гидроксиалкил, низший цианоалкил, тиокарбамоилалкил, низший алкилкарбонилоксиалкил, низший алкилкарбонил, низший алкокситиокарбонил или низший алкоксикарбонил, R2 водород, низший алкил, низший алкоксиалкил, низший алкилкарбонилоксиалкил, низший алкилкарбонил, трифторметилпиридилкарбонил или низший алкоксикарбонил или R1 и R2 вместе образуют группу C(R6)R7, где R6 и R7 являются низшей алкоксигруппой или низшей алкилтиогруппой. 5. Производные пиридина по п.1, отличающиеся тем, что указанное соединение представляет собой 4-трифторметил-3-пиридинкарбоксамид-1-оксид, или N-цианометил-4-трифторметил-3-пиридинкарбоксамид, N-тиокарбамоилметил-4-трифторметил-3-пиридинкарбоксамид, N-этоксиметил-4-трифторметил-3-пиридинкарбоксамид, N-изопропиламино-метил-4-трифторметил-3-пиридинкарбоксамид, N-цианометил-N, N-бис-(4-трифторметилникотиноил)амин, N-ацетил-N - цианометил-4-трифторметил-3-пиридинкарбоксамид, N-цианометил-N -метил-4-трифторметилпиридин-3-карбоксамид, О-метил-N-( 4-трифторметилникотиноил) тиокарбамат, N-метил-4-трифторметилпиридин -3-карбоксамид, N-(N", N"-диметиламинометил)-4-трифторметилпиридин-3-карбоксамид, N-(1-пиперидинилметил)-4-трифторметилпиридин-3-карбоксамид, N-цианометил-N-(4-трифторметилникотиноил) аминометилпивалат, O, S-диметил-N-(4-трифторметилникотиноил)иминоформиат, N-гидроксиметил-4-трифторметил-3-пиридинкарбоксамид, N-ацетил-4-трифторметил-3-пиридинкарбоксамид или метил N-(4-трифторметилникотиноил)-карбамат или 1-оксид этих соединений. 6. Способ получения производных пиридина общей формулы I-I 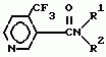 где R1 и R2 имеют значения по п.1 и могут являться одновременно водородом, отличающийся тем, что осуществляют реакцию 4-трифторметилпиридин-3-карбоновой кислоты или ее реакционноспособного производного с соединением общей формулы III HN(R1)R2, где R1 и R2 имеют указанные значения. 7. Инсектицидная композиция, содержащая в качестве активного компонента производное пиридинкарбоксамида и подходящие добавки, отличающаяся тем, что в качестве указанного производного пиридинкарбоксамида содержит соединение формулы I по п.1, или 4-трифторметил-3-пиридинкарбоксамид, в инсектицидно эффективном количестве. 8. Композиция по п.7, отличающаяся тем, что активным компонентом является 4-трифторметил-3-пиридинкарбоксамид, N-цианометил-4-трифторметил-3-пиридинкарбоксамид, N-тиокарбомоилметил-4-трифторметил-3-пиридинкарбоксамид, N-этоксиметил-4-трифторметил-3-пиридинкарбоксамид, N-изопропиламинометил-4-трифторметил-3-пиридинкарбоксамид, N-цианометил-N, N-бис(4-трифторметилникотиноил)амин, N-ацетил-N цианометил-4-трифторметил-3-пиридинкарбоксамид, N-цианометил-N метил-4- трифторметил пиридин-3-карбоксамид, О-метил-N-(4-трифторметилникотиноил)тиокарбамат, N-метил-4-трифторметилпиридин-3-карбоксамид, N(N", N"-диметиламинометил)-4-трифторметилпиридин-3-карбоксамид, N-(1-пиперидинил)-4-трифторметилпиридин-3-карбоксамид, N-цианометил-N-(4-трифторметилникотиноил)аминометилпивалат, O, S-диметил-N-(4- трифторметилникотиноил)-иминоформиат, N-гидроксиметил-4-трифторметил-3-пиридинкарбоксамид, N-ацетил-4-трифторметил-3-пиридинкарбоксамид или метил N-(4-трифторметил никотиноил)карбамат или его 1-оксид. 9. Композиция по п.7, отличающаяся тем, что активным компонентом является 4-трифторметил-3-пиридикарбоксамид или его 1-оксид. Приоритет по пунктам 17.03.93 по пп.1-8. 05.02.93 по п.9. где R1 и R2 имеют значения по п.1 и могут являться одновременно водородом, отличающийся тем, что осуществляют реакцию 4-трифторметилпиридин-3-карбоновой кислоты или ее реакционноспособного производного с соединением общей формулы III HN(R1)R2, где R1 и R2 имеют указанные значения. 7. Инсектицидная композиция, содержащая в качестве активного компонента производное пиридинкарбоксамида и подходящие добавки, отличающаяся тем, что в качестве указанного производного пиридинкарбоксамида содержит соединение формулы I по п.1, или 4-трифторметил-3-пиридинкарбоксамид, в инсектицидно эффективном количестве. 8. Композиция по п.7, отличающаяся тем, что активным компонентом является 4-трифторметил-3-пиридинкарбоксамид, N-цианометил-4-трифторметил-3-пиридинкарбоксамид, N-тиокарбомоилметил-4-трифторметил-3-пиридинкарбоксамид, N-этоксиметил-4-трифторметил-3-пиридинкарбоксамид, N-изопропиламинометил-4-трифторметил-3-пиридинкарбоксамид, N-цианометил-N, N-бис(4-трифторметилникотиноил)амин, N-ацетил-N цианометил-4-трифторметил-3-пиридинкарбоксамид, N-цианометил-N метил-4- трифторметил пиридин-3-карбоксамид, О-метил-N-(4-трифторметилникотиноил)тиокарбамат, N-метил-4-трифторметилпиридин-3-карбоксамид, N(N", N"-диметиламинометил)-4-трифторметилпиридин-3-карбоксамид, N-(1-пиперидинил)-4-трифторметилпиридин-3-карбоксамид, N-цианометил-N-(4-трифторметилникотиноил)аминометилпивалат, O, S-диметил-N-(4- трифторметилникотиноил)-иминоформиат, N-гидроксиметил-4-трифторметил-3-пиридинкарбоксамид, N-ацетил-4-трифторметил-3-пиридинкарбоксамид или метил N-(4-трифторметил никотиноил)карбамат или его 1-оксид. 9. Композиция по п.7, отличающаяся тем, что активным компонентом является 4-трифторметил-3-пиридикарбоксамид или его 1-оксид. Приоритет по пунктам 17.03.93 по пп.1-8. 05.02.93 по п.9.Популярные патенты: 2407282 Способ выращивания корнесобственных саженцев винограда и машина для его осуществления ... высотой 0,18 0,24 м. Между технологическими колеями на уплотненную поверхность плоского гребня равномерным слоем распределяют древесную золу нормой 150 250 г/м2. На гребень укладывают два гибких поливных трубопровода с водовыпусками системы капельного орошения с шагом между водовыпусками 0,2 м. Каждый гребень укрывают светопроницаемой пленкой, края пленки сдвигают в технологические колеи и присыпают почвой. При прогревании почвы под пленкой в слое 0,18 0,24 м до температуры +20°С высаживают укороченные черенки с двумя-тремя почками с шагом высадки 0,12 0,13 м в два ряда вдоль гибких поливных трубопроводов. А при температуре почвы выше +35°С в пленке с шагом 1 м делают ... 2033002 Орудие для междурядной обработки почвы ... рыхлительных стоек 18. Подвески 17 образованы секторными опорами 19, к которым крепятся радиальные верхние рычаги-пластины 20 и нижние рычаги 21, которые крепятся к трубчатым поперечинам 22, которые крепятся вертикальными подвесками к участкам 12 трубчатой рамы 3. К нижним рычагам 21 шарнирно крепятся рыхлительные стойки 18, которые выполнены в виде переднего круглого стержня 24 с жестко прикрепленной к нему по длине пластиной 25, а подрезающий элемент выполнен в виде пластины 26, площадь которой больше площади поперечного сечения нижнего торца стойки 18 и выступает по всему ее контуру. Пластина 25 имеет систему отверстий 27, за счет которых стойка 18 удерживается рычагом 21 и ... 2120753 Способ получения пестицидного водного суспензионного концентрата и пестицидный водный суспензионный концентрат ... для растворения. Затем в полученной смеси диспергировали 2.0 части соединения N 19, измельченного в сухом виде до среднего размера частиц 21 мкм, и полученную смесь перемешивали. Смесь, полученную таким образом путем диспергирования, загружали в мельницу ДИНО-МИЛЛ, модель KDL, оборудованную сосудом вместимостью 350 мл, вместе с 280 мл керамических шариков с размером частиц 0.3 мм и плотностью 5.6 г/см3 и осуществляли мокрое измельчение в течение 30 минут со скоростью вращения мешалки 2000 о/мин. Полученная суспензия соединения 19, имеет средний размер частиц 0.3 мкм. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения пестицидного водного суспензионного концентрата, включающий тонкое ... 2488263 Система механической подачи недомолота для вторичного обмолота на возвратную доску ... ипо существу равномерного распределения вторично обмолоченного недомолота в системе очистки с помощью распределительного шнека. Предпочтительно, чтобы этап распределения вторично обмолоченного недомолота в системе очистки дополнительно определяется тем, что на горизонтальном шнеке по его длине выполнено по меньшей мере одно отверстие, предназначенное для равномерного распределения вторично обмолоченного недомолота в системе очистки. Хотя изобретение проиллюстрировано при его использовании на роторном комбайне, его можно использовать и на других типах комбайнов, в том числе на обычных комбайнах с соломотрясом и гибридных комбайнах с поперечными цилиндрами обмолачивания и роторными ... 2241322 Навесное устройство трактора ... в правом и левом раскосах 5.При наезде одним из боковых рабочих органов почвообрабатывающего орудия на возвышение нагрузка на эту сторону возрастает, сжимая пружину сжатия 11. Это способствует копированию опорным колесом орудия неровностей почвы.При попадании опорного колеса орудия в понижение происходит сжатие пружины 12, а это обеспечивает копирование поверхности с другой стороны рамы орудия. Тяговое усилие трактора будет иметь оптимальную величину, а нагрузки, в этом случае возникающие от боковых усилий, передаются лишь на пружины 11 и 12 раскосов 5 навесного устройства на трактор. Описанная конструкция раскосов 5 обеспечивает устойчивое положение сельскохозяйственного орудия в ... |
Еще из этого раздела: 2229213 Способ регулирования роста зерновых культур 2010519 Способ биологической борьбы с вредителями растений 2091023 Способ защиты растений от заболеваний, вызванных нематодами 2267924 Способ стимулирования роста растений 2462866 Рыболовная катушка 2496298 Узел крепления пальцев подборщика 2450505 Порционное устройство для вытирания семян трав 2293463 Способ разработки лесосек 2484613 Способ создания почвенно-растительного покрова при рекультивации нарушенных земель 2437864 Способ микробиологической переработки птичьего помета |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||