Способ клонального микроразмножения растенийПатент на изобретение №: 2080780 Автор: Чережанова Л.В., Овчинникова В.Н., Мелик-Саркисов О.С. Патентообладатель: Всероссийский научно-исследовательский институт сельскохозяйственной биотехнологии РАСХН Дата публикации: 10 Июня, 1997 Адрес для переписки: подача заявки11.05.1994 публикация патента10.06.1997 Изображения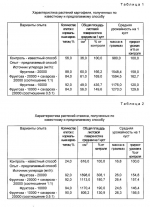 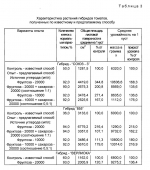 Использование: сельское хозяйство и биотехнология. Сущность изобретения: клональное микроразмножение заключается в том, что экспланты высаживают на питательную среду для получения регенератов, проводят их микрочеренкование и укоренение микрочеренков на питательной среде, содержащей в качестве источников углерода фруктозу или смесь фруктозы с сахарозой в количестве 10000-20000 мг/л среды, причем в смеси соотношение фруктозы к сахарозе 0,2-1:1 соответственно. 1 з.п. ф-лы, 3 табл. , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУИзобретение относится к биотехнологии и может быть использовано для массового размножения растений в условиях культуры ткани. Клональное микроразмножение растений это один из видов техники in vitro, используемый для быстрого неполового размножения растений. Преимуществами этого вида размножения в сравнении с традиционными методами являются значительно более высокие коэффициенты размножения, миниатюризация процесса, оздоровление посадочного материала от разного рода инфекций. В условиях in vitro можно размножать растения, которые трудно размножаются обычным способом, например древесные растения. Области применения клонального микроразмножения разнообразны и имеют тенденцию к расширению. Наиболее широко оно используется для размножения вновь созданных и уже существующих хозяйственных сортов с целью массового получения оздоровленного посадочного материала. Основными этапами при клональном микроразмножении растений являются получение регенерантов из эксплантов, которые выделяют из различных органов и тканей растений, и собственно размножение регенерантов, осуществляемое различными путями, например стимуляцией (развития пазушных почек экспланта, микрочеренкованием побега, индукцией) образования адвентивных почек тканями листа и стебля и другими путями. В настоящее время для ряда сельскохозяйственных культур разработаны технологии размножения in vitro: на ячменно-ржаных и ячменно-пшеничных гибридах (Першина Л.А. Шумный В.К. "Особенности каллусной ткани и растений -регенератов ячменно-ржаных и ячменнно-пшеничных гибридов". Культура клеток растений и биотехнология. М. Наука, 1986, с. 176-178), на перспективных сортах винограда (Дорощенко Н.Н. "Микроклональное размножение перспективных сортов винограда". Тезисы докладов Всесоюзной научно-технической конференции "Применение биотехнологии в животноводстве, растениеводстве и ветеринарной медицине" 11-13 октября 1988 г. Л. с. 163-164) и других сельскохозяйственных культурах. Наиболее близким способом является способ получения посадочного материала картофеля (Мелик-Саркисов О.С. Овчинникова В.Н. Ульянов Р.П. Получение безвирусного посадочного материала картофеля микроклубнями, индуцированными в культуре in vitro. Методические рекомендации. ВАСХНИЛ, ВНИИ прикладной молекулярной биологии и генетики. М. 1985), который заключается в следующем: глазки клубня картофеля, вырезанного вместе с частью паренхимы клубня, проращивают во влажном песке. Из верхушечной части выросших проростков изолируют апикальную меристему, которую помещают в пробирки на поверхность агаризованной питательной среды и культивируют в течение 60 дней до формирования в пробирках регенерантов. Пробирочные растения черенкуют. Черенки помещают на питательную среду и выращивают 3-4 недели до образования растений-регенерантов. Последние используют для получения миниклубней или в условиях in vitro, или в условиях защищенного грунта. Культивирование эксплантов до образования регенерантов и укоренение микрочеренков осуществляют на агаризованных питательных средах. На основу сред используют среду по прописи Мурасиге и Скуга (Murashige T. Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue ciltures. Phisiol. Plant. 1962. V. 15. N13. P. 473-497), которая содержит, мг/л: макросоли: NH4NO3 1650, KNO3 1900, MgSO4 7H2O 370, CaCl2 7H2O 370, CaCl2  2H2O 440, KH2PO4 170; микросоли: MnSO4 2H2O 440, KH2PO4 170; микросоли: MnSO4  4H2O 22,3, H3BO3 - 6,2, ZnSO4 4H2O 22,3, H3BO3 - 6,2, ZnSO4  4H2O 8,6, CoCl2 4H2O 8,6, CoCl2  6H2O - 0,025, CuSo4 6H2O - 0,025, CuSo4  5H2O 0,025, NaMoO4 5H2O 0,025, NaMoO4  2H2O 0,025, Kl 0,83; витамины: тиамин 0,1, миоинозитол 80, пиридоксин - 0,5, никотиновая кислота 0,5. Источником углеродного питания служит сахароза в количестве 20000 мг/л. Для уплотнения в среду добавляют агар (7000 мг/л). Для формирования регенерантов из эксплантов в среду добавляют гибберелловую кислоту (2,0 мг/л) и кинетин (1,0 мг/л). На этапе укоренения микрочеренков среда содержит 2H2O 0,025, Kl 0,83; витамины: тиамин 0,1, миоинозитол 80, пиридоксин - 0,5, никотиновая кислота 0,5. Источником углеродного питания служит сахароза в количестве 20000 мг/л. Для уплотнения в среду добавляют агар (7000 мг/л). Для формирования регенерантов из эксплантов в среду добавляют гибберелловую кислоту (2,0 мг/л) и кинетин (1,0 мг/л). На этапе укоренения микрочеренков среда содержит  -индолилуксусную кислоту или b индолилмасляную кислоту в количестве 0,05 или 0,1 мг/л соответственно. Необходимым условием клонального микроразмножения растений является стабильное воспроизводство исходного генотипа. Однако соблюдение этого условия вызывает ряд трудностей, т.к. биологически активные компоненты питательных сред способны вызывать генетические изменения в клетках, что приводит к генетической вариабельности получаемых регенерантов. В процессе культивирования in vitro генетические изменения накапливаются, увеличивается количество регенерантов, отличающихся от исходного типа (Леонова Н.С. "Использование метода культуры ткани в селекции картофеля". Сибирский вестник с/х науки, 1986, N3, с. 18-26). Такие изменения характерны и для известного способа. У растений-регенерантов отмечается большое количество нарушений хромосом, уменьшается количество клеток с нормальным кариотипом. Регенеранты характеризуются значительным морфофизиологическим разнообразием и утратой ценных хозяйственных признаков. Таким образом, разработка приемом культивирования растений, направленных на снижение отрицательного воздействия компонентов питательных сред на клетки и на стабильное воспроизведение исходного (нормального) генотипа, является актуальной задачей. Технический эффект от использования изобретения заключается в увеличении выхода регенерантов с исходным (нормальным) генотипом. Технический эффект достигается с помощью способа клонального микроразмножения растений, включающего посадку экспланта на питательную среду для получения регенерантов, их микрочеренкование и укоренение микрочеренков на питательной среде, содержащей сахара в качестве источника углерода, отличающуюся тем, что в качестве источника углерода среда для укоренения содержит фруктозу в количестве 10000-20000 мг/л или смесь фруктозы и сахарозы в соотношении 0,5-1:1. Фруктоза представляет собой моносахарид, относится к группе гексоз, сохраняет ряд особенностей, присущих карбонильной группе, и часто определяется как восстанавливающий сахар. Фруктоза легко проникает через клеточные мембраны и вступает в гликолитический путь дыхания (Калинин Ф.Л. Лобов В.П. Жидков В.А. Справочник по биохимии. Киев, Наукова Думка, 1971, с.500). Использование ее в питательных средах для культивирования растений in vitro как отдельно, так и в смеси с сахарозой неизвестно. Внесение в среду для укоренения фруктозы меньше 10000 мг/л не позволяет достичь необходимого результата, а выше 20000 мг/л существенным образом не изменяет достигаемый технический эффект. Предлагаемый способ апробировали на растениях картофеля (сорт Янтарный), гибридах томатов (Союз-3, Верлиока и 855) и стахисе байкальском (Stachys baicalensis Fisch). Эффективность предлагаемого и известного способов оценивали по количеству клеток у растений-регенерантов, имеющих нормальный (исходный) кариотип. Растения-регенеранты сравнивали по биометрическим и цитогенетическим показателям, а также по продуктивности при высадке растений в грунт. Цитогенетический анализ структурных и количественных изменений хромосом проводили на давленных ацетокарминовых препаратах по общепринятой методике. Пример 1 (контроль). Для введения в культуру in vitro и получения оздоровленных регенерантов картофеля используют метод апикальной меристемы в культуре in vitro (Мелик-Саркисов О.С. Овчинникова В.Н. Ульянов Р.П. "Получение безвирусного посадочного материала картофеля микроклубнями, индуцированными в культуре in vitro". Методические указания, М. 1985). Глазки клубня картофеля вырезают вместе с частью паренхимы клубня (1,5 x 1,5 см) и проращивают во влажном песке при 25-27oС в темноте. Выросшие этиолированные проростки срезают, стерилизуют в 0,1%-ном растворе диацида 5-7 мин и трижды промывают стерильной водой. Из верхушечной части побега изолируют апикальную меристему размером 150-250 мк. Изолированную меристему помещают в пробирку на поверхность агаризованной питательной среды следующего состава, мг/л: макро- и микроэлементы по Мурасиге и Скугу, сахароза 20000, агар 7000, тиамин 1,0, пиридоксин 0,5, никотиновая кислота 0,5, аскорбиновая кислота 1,0, гибберелловая кислота 2,0, кинетин 1,0. Культивирование апексов проводят в течение 60 дней при 16-часовой продолжительности светового дня, температуре 24-25oC днем и 19-20oC ночью и освещенности 5000-6000 лкс. Сформированные пробирочные растения используют для дальнейшего размножения с помощью микрочеренкования. В стерильных условиях растений извлекают из пробирок. С помощью скальпеля растения разрезают на черенки, количество которых соответствует числу узлов на исходном пробирочном растении. Укоренение черенков осуществляют на питательной среде (среда для укоренения) следующего состава, мг/л: макро- и микроэлементы по Мурасиге и Скугу, сахароза 20000, агар 7000, тиамин 1,0, пиридоксин 0,5, никотиновая кислота 0,5, аскорбиновая кислота 1,0. Для ускорения добавляют b индолилмасляную кислоту или b - индолилуксусную кислоту в количестве 0,1 или 0,05 мг/л соответственно. Культивирование черенков проводят в тех же условиях, что и апикальные меристемы. Время культивирования 3-4 недели. Полученные растения регенеранты на среде для укоренения используют для получения микроклубней или в условиях in vitro или в закрытом грунте. В первом случае пробирочные растения черенкуют и черенки высаживают в пробирки с питательной средой, которая содержит, мг/л: макро- и микроэлементы по Мурасиге и Скугу, сахарозу 40000-60000, агар 6000, тиамин 1,0, пиридоксин 0,5, никотиновую кислоту 0,5, аскорбиновую кислоту 1,0, кинетин 0,5. Черенки инкубируют при 16-часовой продолжительности светового дня, температуре 24-25oC днем и 19-20oC ночью при освещенности 5000-6000 лкс. После образования у пробирочных растений 5-6 листьев пробирки с растениями на 3 недели переносят в климатическую камеру с температурой 15oC и продолжительностью светового дня 8 ч. В зависимости от сорта картофеля образование клубней происходит через 1-1,5 месяца после переноса растений в условия, индуцирующие клубнеобразование. При получении миниклубней в защищенном грунте растения картофеля, полученные in vitro, высаживают в грунт и выращивают в заданных условиях до получения миниклубней кондиционных размеров (3-5 г). Пример 2 (опыт). Ведение в культуру in vitro и получение регенерантов картофеля, а также их микрочеренкование, проводят согласно примеру 1. Укоренение микрочеренков осуществляют на питательной среде для укоренения, в которой в качестве источника углерода используют фруктозу в количестве 10000-20000 мг/л или смесь фруктозы и сахарозы в соотношении 0,5 1:1. Время и условия культивирования пробирочных растений аналогичны примеру 1. Из пробирочных растений, выросших на среде для укоренения, в условиях in vitro или в защищенном грунте получают миниклубни. Миниклубни картофеля, полученные от растений-регенерантов, выращенных по примерам 1 и 2, высаживают в почву и наблюдают за развитием растений. Проводят цитогенетический анализ корневых и стеблевых меристем. Развитие растений оценивают по биометрическим показателям и продуктивности. В опыте по сравнению с контролем наблюдали более раннюю и дружную всхожесть растений (всходы появлялись на 5 дней раньше). Растения отличались однородностью, крепостью стебля и мощной, не измененной морфологически листовой поверхностью. Урожайность опытных растений значительно превышала урожайность контрольных растений. Цитогенетический анализ показал, что количество нарушений хромосом в контроле в 1,5 2 раза больше, чем у опытных растений, а количество клеток с нормальным кариотипом (2n=48) в 1,5 1,64 раза меньше. Результаты представлены в табл. 1. Пример 3 (контроль). Регенеранты стахиса, оздоровленные методом апикальной меристемы в условиях in vitro (см. пример 1), размножают микрочеренкованием. Для черенкования используют регенеранты с 8-10 листьями. Черенки высаживают в пробирки на питательную среду для черенкования (см. пример 1). Культивирование стахиса проводят при 16-часовой продолжительности светового дня, освещенности 5000 лкс, температуре 24 25oC днем и 19-20oC ночью. Через 4-5 недель культивирования выросшие пробирочные растения высаживают в грунт. Пример 4 (опыт). Укоренение черенков стахиса проводят на среде для черенкования, в которой в качестве источника углерода используют фруктозу в количестве 10000 20000 мг/л или смесь фруктозы и сахарозы в соотношении 0,5 1:1 (см. пример 2). Пробирочные растения стахиса, полученные по примерам 3 и 4, высаживают в открытый грунт и выращивают до окончания вегетационного периода (до полного увядания растений). У растений проводят цитогенетический анализ корневых и стеблевых меристем. Развитие растений оценивают по биометрическим показателям и продуктивности. Цитогенетические исследования показали, что у опытных растений в меристемах корня и стебля количество клеток с нормальным кариотипом более, чем в 3 раза больше по сравнению с контрольными растениями. Опытные растения характеризовались многостебельностью и большей облиственностью. Общая площадь листовой поверхности в растете на один куст в 1,5 3 раза превышает таковую у контрольных растений. Урожайность клубней увеличивается в 1,5 раза. Результаты представлены в табл.2. Пример 5 (контроль). Для клонального микроразмножения гибридов томата используют семена этих растений. Для введения в асептическую культуру семена в течение 5-7 мин стерилизуют в 0,1%-ном растворе диацида, трижды промывают стерильной водой. Подготовленные таким образом семена по одному помещают в пробирки с питательной средой следующего состава, мг/л: макро- и микроэлементы по Мурасиге и Скугу, сахароза 20000, агар 7000, тиамин 1,0, пиридоксин 0,5, никотиновая кислота - 0,5, аскорбиновая кислота 1,0, b индолилмасляная кислота 0,1. Культивирование осуществляют при 24-25oC днем и 19-20oC ночью, 16-часовой продолжительности светового дня и освещенности 5000-6000 лкс. Время культивирования 3-4 недели. В течение этого срока формируются пробирочные растения с 4-5 листьями. Полученные растения черенкуют и каждый черенок высаживают в пробирку на агаризованную питательную среду для черенкования. Среда, условия и время культивирования аналогичны примеру 1. Пример 6 (опыт). Пробирочные растения томатов, полученные по примеру 5, черенкуют. Укоренение микрочеренков проводят на среде для черенкования, в которой в качестве источника углерода используют фруктозу в количестве 10000-20000 мг/л или смесь фруктозы и сахарозы в соотношении 0,5 1:1. Время и условия культивирования по примеру 1. Регенеранты, полученные после черенкования по примерам 5 и 6, высаживают в грунт и выращивают до полного созревания плодов. До высадки в грунт у регенерантов проводят цитогенетический анализ корневых и стеблевых меристем. Развитие растений оценивают по биометрическим показателям и продуктивности растений. Анализ показал, что у опытных растений томатов клеток с нормальным кариотипом в 2 раза больше, чем у контрольных. В условиях защищенного грунта опытные растения, развивающиеся из регенерантов, опережают в своем развитии контрольные растения. Стадия бутонизации, начало цветения, завязывания плодов у опытных растений наступает на две недели раньше, чем у контрольных. Начало созревания плодов у опытных растений отмечается через 3 месяца после высадки в грунт, тогда как у контрольных через 3,5 месяца. В среднем, в зависимости от гибрида томатов, урожайность растений в 1,5 2,2 раза превышает урожайность контрольных растений (табл.3). Таким образом, использование в качестве источника углерода в среде для укоренения фруктозы в количестве 10000-20000 мг/л или смеси фруктозы и сахарозы в соотношении 0,5 1:1 уменьшает структурные и количественные изменения хромосом. Число клеток с нормальным кариотипом возрастает. Растения-регенеранты, полученные по предлагаемому способу, в условиях защищенного грунта опережают в своем развитии контрольные растения и характеризуются повышенной продуктивностью. -индолилуксусную кислоту или b индолилмасляную кислоту в количестве 0,05 или 0,1 мг/л соответственно. Необходимым условием клонального микроразмножения растений является стабильное воспроизводство исходного генотипа. Однако соблюдение этого условия вызывает ряд трудностей, т.к. биологически активные компоненты питательных сред способны вызывать генетические изменения в клетках, что приводит к генетической вариабельности получаемых регенерантов. В процессе культивирования in vitro генетические изменения накапливаются, увеличивается количество регенерантов, отличающихся от исходного типа (Леонова Н.С. "Использование метода культуры ткани в селекции картофеля". Сибирский вестник с/х науки, 1986, N3, с. 18-26). Такие изменения характерны и для известного способа. У растений-регенерантов отмечается большое количество нарушений хромосом, уменьшается количество клеток с нормальным кариотипом. Регенеранты характеризуются значительным морфофизиологическим разнообразием и утратой ценных хозяйственных признаков. Таким образом, разработка приемом культивирования растений, направленных на снижение отрицательного воздействия компонентов питательных сред на клетки и на стабильное воспроизведение исходного (нормального) генотипа, является актуальной задачей. Технический эффект от использования изобретения заключается в увеличении выхода регенерантов с исходным (нормальным) генотипом. Технический эффект достигается с помощью способа клонального микроразмножения растений, включающего посадку экспланта на питательную среду для получения регенерантов, их микрочеренкование и укоренение микрочеренков на питательной среде, содержащей сахара в качестве источника углерода, отличающуюся тем, что в качестве источника углерода среда для укоренения содержит фруктозу в количестве 10000-20000 мг/л или смесь фруктозы и сахарозы в соотношении 0,5-1:1. Фруктоза представляет собой моносахарид, относится к группе гексоз, сохраняет ряд особенностей, присущих карбонильной группе, и часто определяется как восстанавливающий сахар. Фруктоза легко проникает через клеточные мембраны и вступает в гликолитический путь дыхания (Калинин Ф.Л. Лобов В.П. Жидков В.А. Справочник по биохимии. Киев, Наукова Думка, 1971, с.500). Использование ее в питательных средах для культивирования растений in vitro как отдельно, так и в смеси с сахарозой неизвестно. Внесение в среду для укоренения фруктозы меньше 10000 мг/л не позволяет достичь необходимого результата, а выше 20000 мг/л существенным образом не изменяет достигаемый технический эффект. Предлагаемый способ апробировали на растениях картофеля (сорт Янтарный), гибридах томатов (Союз-3, Верлиока и 855) и стахисе байкальском (Stachys baicalensis Fisch). Эффективность предлагаемого и известного способов оценивали по количеству клеток у растений-регенерантов, имеющих нормальный (исходный) кариотип. Растения-регенеранты сравнивали по биометрическим и цитогенетическим показателям, а также по продуктивности при высадке растений в грунт. Цитогенетический анализ структурных и количественных изменений хромосом проводили на давленных ацетокарминовых препаратах по общепринятой методике. Пример 1 (контроль). Для введения в культуру in vitro и получения оздоровленных регенерантов картофеля используют метод апикальной меристемы в культуре in vitro (Мелик-Саркисов О.С. Овчинникова В.Н. Ульянов Р.П. "Получение безвирусного посадочного материала картофеля микроклубнями, индуцированными в культуре in vitro". Методические указания, М. 1985). Глазки клубня картофеля вырезают вместе с частью паренхимы клубня (1,5 x 1,5 см) и проращивают во влажном песке при 25-27oС в темноте. Выросшие этиолированные проростки срезают, стерилизуют в 0,1%-ном растворе диацида 5-7 мин и трижды промывают стерильной водой. Из верхушечной части побега изолируют апикальную меристему размером 150-250 мк. Изолированную меристему помещают в пробирку на поверхность агаризованной питательной среды следующего состава, мг/л: макро- и микроэлементы по Мурасиге и Скугу, сахароза 20000, агар 7000, тиамин 1,0, пиридоксин 0,5, никотиновая кислота 0,5, аскорбиновая кислота 1,0, гибберелловая кислота 2,0, кинетин 1,0. Культивирование апексов проводят в течение 60 дней при 16-часовой продолжительности светового дня, температуре 24-25oC днем и 19-20oC ночью и освещенности 5000-6000 лкс. Сформированные пробирочные растения используют для дальнейшего размножения с помощью микрочеренкования. В стерильных условиях растений извлекают из пробирок. С помощью скальпеля растения разрезают на черенки, количество которых соответствует числу узлов на исходном пробирочном растении. Укоренение черенков осуществляют на питательной среде (среда для укоренения) следующего состава, мг/л: макро- и микроэлементы по Мурасиге и Скугу, сахароза 20000, агар 7000, тиамин 1,0, пиридоксин 0,5, никотиновая кислота 0,5, аскорбиновая кислота 1,0. Для ускорения добавляют b индолилмасляную кислоту или b - индолилуксусную кислоту в количестве 0,1 или 0,05 мг/л соответственно. Культивирование черенков проводят в тех же условиях, что и апикальные меристемы. Время культивирования 3-4 недели. Полученные растения регенеранты на среде для укоренения используют для получения микроклубней или в условиях in vitro или в закрытом грунте. В первом случае пробирочные растения черенкуют и черенки высаживают в пробирки с питательной средой, которая содержит, мг/л: макро- и микроэлементы по Мурасиге и Скугу, сахарозу 40000-60000, агар 6000, тиамин 1,0, пиридоксин 0,5, никотиновую кислоту 0,5, аскорбиновую кислоту 1,0, кинетин 0,5. Черенки инкубируют при 16-часовой продолжительности светового дня, температуре 24-25oC днем и 19-20oC ночью при освещенности 5000-6000 лкс. После образования у пробирочных растений 5-6 листьев пробирки с растениями на 3 недели переносят в климатическую камеру с температурой 15oC и продолжительностью светового дня 8 ч. В зависимости от сорта картофеля образование клубней происходит через 1-1,5 месяца после переноса растений в условия, индуцирующие клубнеобразование. При получении миниклубней в защищенном грунте растения картофеля, полученные in vitro, высаживают в грунт и выращивают в заданных условиях до получения миниклубней кондиционных размеров (3-5 г). Пример 2 (опыт). Ведение в культуру in vitro и получение регенерантов картофеля, а также их микрочеренкование, проводят согласно примеру 1. Укоренение микрочеренков осуществляют на питательной среде для укоренения, в которой в качестве источника углерода используют фруктозу в количестве 10000-20000 мг/л или смесь фруктозы и сахарозы в соотношении 0,5 1:1. Время и условия культивирования пробирочных растений аналогичны примеру 1. Из пробирочных растений, выросших на среде для укоренения, в условиях in vitro или в защищенном грунте получают миниклубни. Миниклубни картофеля, полученные от растений-регенерантов, выращенных по примерам 1 и 2, высаживают в почву и наблюдают за развитием растений. Проводят цитогенетический анализ корневых и стеблевых меристем. Развитие растений оценивают по биометрическим показателям и продуктивности. В опыте по сравнению с контролем наблюдали более раннюю и дружную всхожесть растений (всходы появлялись на 5 дней раньше). Растения отличались однородностью, крепостью стебля и мощной, не измененной морфологически листовой поверхностью. Урожайность опытных растений значительно превышала урожайность контрольных растений. Цитогенетический анализ показал, что количество нарушений хромосом в контроле в 1,5 2 раза больше, чем у опытных растений, а количество клеток с нормальным кариотипом (2n=48) в 1,5 1,64 раза меньше. Результаты представлены в табл. 1. Пример 3 (контроль). Регенеранты стахиса, оздоровленные методом апикальной меристемы в условиях in vitro (см. пример 1), размножают микрочеренкованием. Для черенкования используют регенеранты с 8-10 листьями. Черенки высаживают в пробирки на питательную среду для черенкования (см. пример 1). Культивирование стахиса проводят при 16-часовой продолжительности светового дня, освещенности 5000 лкс, температуре 24 25oC днем и 19-20oC ночью. Через 4-5 недель культивирования выросшие пробирочные растения высаживают в грунт. Пример 4 (опыт). Укоренение черенков стахиса проводят на среде для черенкования, в которой в качестве источника углерода используют фруктозу в количестве 10000 20000 мг/л или смесь фруктозы и сахарозы в соотношении 0,5 1:1 (см. пример 2). Пробирочные растения стахиса, полученные по примерам 3 и 4, высаживают в открытый грунт и выращивают до окончания вегетационного периода (до полного увядания растений). У растений проводят цитогенетический анализ корневых и стеблевых меристем. Развитие растений оценивают по биометрическим показателям и продуктивности. Цитогенетические исследования показали, что у опытных растений в меристемах корня и стебля количество клеток с нормальным кариотипом более, чем в 3 раза больше по сравнению с контрольными растениями. Опытные растения характеризовались многостебельностью и большей облиственностью. Общая площадь листовой поверхности в растете на один куст в 1,5 3 раза превышает таковую у контрольных растений. Урожайность клубней увеличивается в 1,5 раза. Результаты представлены в табл.2. Пример 5 (контроль). Для клонального микроразмножения гибридов томата используют семена этих растений. Для введения в асептическую культуру семена в течение 5-7 мин стерилизуют в 0,1%-ном растворе диацида, трижды промывают стерильной водой. Подготовленные таким образом семена по одному помещают в пробирки с питательной средой следующего состава, мг/л: макро- и микроэлементы по Мурасиге и Скугу, сахароза 20000, агар 7000, тиамин 1,0, пиридоксин 0,5, никотиновая кислота - 0,5, аскорбиновая кислота 1,0, b индолилмасляная кислота 0,1. Культивирование осуществляют при 24-25oC днем и 19-20oC ночью, 16-часовой продолжительности светового дня и освещенности 5000-6000 лкс. Время культивирования 3-4 недели. В течение этого срока формируются пробирочные растения с 4-5 листьями. Полученные растения черенкуют и каждый черенок высаживают в пробирку на агаризованную питательную среду для черенкования. Среда, условия и время культивирования аналогичны примеру 1. Пример 6 (опыт). Пробирочные растения томатов, полученные по примеру 5, черенкуют. Укоренение микрочеренков проводят на среде для черенкования, в которой в качестве источника углерода используют фруктозу в количестве 10000-20000 мг/л или смесь фруктозы и сахарозы в соотношении 0,5 1:1. Время и условия культивирования по примеру 1. Регенеранты, полученные после черенкования по примерам 5 и 6, высаживают в грунт и выращивают до полного созревания плодов. До высадки в грунт у регенерантов проводят цитогенетический анализ корневых и стеблевых меристем. Развитие растений оценивают по биометрическим показателям и продуктивности растений. Анализ показал, что у опытных растений томатов клеток с нормальным кариотипом в 2 раза больше, чем у контрольных. В условиях защищенного грунта опытные растения, развивающиеся из регенерантов, опережают в своем развитии контрольные растения. Стадия бутонизации, начало цветения, завязывания плодов у опытных растений наступает на две недели раньше, чем у контрольных. Начало созревания плодов у опытных растений отмечается через 3 месяца после высадки в грунт, тогда как у контрольных через 3,5 месяца. В среднем, в зависимости от гибрида томатов, урожайность растений в 1,5 2,2 раза превышает урожайность контрольных растений (табл.3). Таким образом, использование в качестве источника углерода в среде для укоренения фруктозы в количестве 10000-20000 мг/л или смеси фруктозы и сахарозы в соотношении 0,5 1:1 уменьшает структурные и количественные изменения хромосом. Число клеток с нормальным кариотипом возрастает. Растения-регенеранты, полученные по предлагаемому способу, в условиях защищенного грунта опережают в своем развитии контрольные растения и характеризуются повышенной продуктивностью.
ФОРМУЛА ИЗОБРЕТЕНИЯ1. Способ клонального микроразмножения растений, включающий посадку экспланта на питательную среду для получения регенерантов, их микрочеренкование и укоренение микрочеренков на питательной среде, содержащей сахара в качестве источника углерода, отличающийся тем, что в качестве источника углерода в питательной среде для укоренения используют фруктозу или смесь фруктозы с сахарозой в количестве 10000 20000 мг/л среды. 2. Способ по п.1, отличающийся тем, что используют смесь фруктозы с сахарозой в соотношении 0,5 1 1 соответственно.Популярные патенты: 2453091 Способ обработки почвы ... плотности формируемых участков у авторов аналога не было.На фиг.1 изображено вертикальное строение пахотного слоя, получающееся при использовании различных известных способов обработки почвы, от технологии на базе вспашки и далее по цепочке (по мере роста степени минимизации обработки) до прямого посева. Принципиальным при этом является рост плотности в подсеменном слое по мере повышения степени минимизации обработки. То есть в предлагаемом способе минимизация обработки осуществляется не в горизонтальной плоскости, как сейчас, а в вертикальной. Участки с разной плотностью в предлагаемой технологии обрабатываются на одинаковую глубину, но с разной интенсивностью. На фиг.2 ... 2112341 Лапа плоскорежущая ... котором с целью повышения качества обработки путем исключения присыпания растений почвой и снижения потерь влаги верхний рабочий орган выполнен в виде плоской пластины, которая расположена вертикально над лезвием плоскорежущей лапы; нижняя кромка пластины расположена параллельно кромке плоскорежущей лапы; пластина установлена в выполненном в щеке пазу, а фиксатор ее положения выполнен в виде стяжного болта ( авт. св. СССР N 1628873). К причинам, препятствующим достижению требуемого технического результата при использовании известного устройства, принятого за прототип, относятся из-за чрезмерного перемещения почвы в бок большие канавы за стойкой и крепежными болтами пластины и ... 2090040 Машина для возделывания корнеклубневых культур ... на левую сторону, а левый диск на правую сторону. При этом для более интенсивного образования гребня необходимо промежутки между пальцами захватов закрыть диафрагмами. На фиг. 6 представлена схема расположения захватов однорядкового модуля при входе их в почву в междурядье, а на фиг. 7 изображен вид половины гребня при окучивании с одного междурядья. При проходе модуля по соседнему междурядью гребни будут принимать симметричную форму. При использовании блока модулей одновременно будет происходить окучивание нескольких рядков. Применение машины для возделывания корнеклубневых культур, составленной из универсальных модулей, позволяет: сократить номенклатуру и количество ... 2062564 Способ оценки устойчивости растений к засухе северного и южного типа на ранних этапах онтогенеза ... и гибридов растений для целей селекции. Известен способ оценки засухоустойчивости при действии дефицита влаги и высокой температуры (1). Способ основан на определении скорости гидролиза статолитного крахмала в клетках корневого чехлика (метод П.А.Генкеля). Метод включает проращивание семян в оптимальных условиях и последующее экспонирование двухсуточных проростков над раствором хлористого калия и прогрева при температуре 37-38oС. Устойчивость оценивают по степени гидролиза статолитного крахмала, которая определяется визуально под микроскопом и оценивается в условных баллах. Основным недостатком этого метода является его приблизительность, недостаточная точность, невозможность ... 2209542 Контейнер ... размещенным в приемных гнездах, выполненных на основании и крышке, а также приемным желобом, установленным на крышке со стороны основания с возможностью контакта с ним. Гофрированный чехол выполняется из герметичного материала и закрепляется в приемном желобе и по периметру основания. Боковые стенки выполняются в виде шарнирно связанных с крышкой защитных кожухов, соединенных с основанием посредством винтовых стяжек, нижние штанги которых соединены с основанием, а верхние размещены с возможностью взаимодействия с подпружиненными пальцами, установленными на крышке, а также с подпружиненными пальцами, закрепленными на защитных кожухах. Устройство поясняется на фиг.1-6. На фиг.1 ... |
Еще из этого раздела: 2462016 Устройство для протравливания семян 2157068 Способ управления роением в пчеловодческом хозяйстве 2112361 Контроллер программируемого управления поливом 2307495 Пневматический высевающий аппарат 2028763 Измельчитель древесной поросли 2261583 Выгрузное устройство бункера зерноуборочного комбайна 2165701 Фунгицидная композиция и способ обработки культур для борьбы или профилактики грибковых заболеваний 2114528 Устройство для клеточного содержания мелких животных 2057432 Биологический состав кузнецова для подсочки деревьев, в том числе каучуконосов (варианты), и способ его приготовления 2464765 Сепарирующее устройство корнеклубнеуборочной машины |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||