Способ получения гетеробициклоалкановПатент на изобретение №: 2034847 Автор: Джон Бернард Вестон[GB], Джон Патрик Ларкин[GB], Ян Гарольд Смит[GB] Патентообладатель: Дзе Велкам Фаундейшн Лимитед (GB) Дата публикации: 10 Мая, 1995 Адрес для переписки: подача заявки22.03.1991 публикация патента10.05.1995 Изображения    Использование: в сельском хозяйстве в качестве пестицидов, особенно против членистоногих вредителей. Сущность изобретения: продукт - бициклоалканы ф-лы 1, приведенной в тексте описания, где R - C1-C6 - алкил, незамещенный или замещенный C1-C6 - алкоксигруппой; C2-C6 - алкенил; C3-C6 - циклоалкил, незамещенный или замещенный атомом галогена; R1 - атом водорода; R2 - атом водорода; C1-C3 - алкил, незамещенный или замещенный атомом галогена или цианогруппой; А - X - содержит от 3 до 20 атомов углерода, где, X - H, A - C2-C12 - алкил с прямой или разветвленной цепью, незамещенный или замещенный C1-C6 - алкинилом, C1-C6 алкинилоксигруппой, C1-C6 - алкинилтиогруппой, C1-C6 - алкинилоксииминогруппой или C1-C6 - алкинилоксикарбонильной группой; C2-C6 - алкенил, незамещенный атомом галогена; C2-C12 - алкенил, незамещенный или замещенный гидроксигруппой, C1-C6 - алкоксигруппой или Si(CH3)3 - группой; C2-C12 - алкинил, незамещенный или замещенный C1-C6 - алкоксигруппой или Si(CH3)3; C1-C6 - алкинилоксикарбонил; N - (C1-C6 - алкинил) - карбомоил или N - C1-C2 - алкинилацетамидогруппа; Y и Y1 - O или S; Z-CH2O или CH2S. Реагент 1: соединение ф-лы 2, приведенной в тексте описания. Реагент 2: соединение ф-лы 3: (Alko)3CT алкил, где Т - AX или атом водорода. В случае когда Т - атом водорода, Y и Y1-S, полученное соединение ф-лы 4, приведенной в тексте описания, где R, R1, R2 и Z указано выше, подвергают взаимодействию с соединением ф-лы 5 LAX, где L - атом галогена, AX - указано выше. 5 табл. , , , , , , , , , , , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУИзобретение относится к способу получения новых химических соединений, имеющих пестицидную активность. Более конкретно, изобретение относится к получению соединений класса бициклоалканов. В [1, 2, 3, 4] описан ряд 2,6,7-триоксабицикло [2,2,2]-октанов. Настоящее изобретение предлагает получение соединений формулы R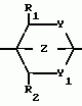 A-X (I) где R С1-С6-алкил, незамещенный или замещенный С1-С6-алкоксигруппой; С2-С6-алкенил; С3-С6-циклоалкил, незамещенный или замещенный галоидом; R1 атом водорода; R2 атом водорода, С1-С3-алкил, незамещенный или замещенный галоидом или циано; А-Х содержит от 3 до 20 атомов, причем Х атом водорода; А С2-С12-алкил с прямой или разветвленной цепью, незамещенный или замещенный С1-С6-алкинилом, С1-С6-алкинил- оксигруппой, С1-С6-алкинилтиогруппой, С1-С6-алкинилоксииминогруппой или С1-C6-алкинилоксикарбонильной группой; С2-С6-алкенил, незамещенный или замещенный галоидом; С2-С12-алкенил, незамещенный или замещенный гидроксигруппой, С1-С6-алкоксигруппой или группой Si(CH3)3; С2-С12-алкинил, незамещеный или замещенный С1-С6-алкокси- или Si(CH3)3-группой; С1-С6-алкинилоксикарбонил; N-(C1-С6-алкинил)карбамоил или N-(С1-С2-алкинил)ацетамидогруппу; Y и YI 0 или S; Z CH2O или CH2S. Соединения формулы (1) могут существовать во множестве изомерных форм. Настоящее изобретение охватывает получение как отдельных изомеров соединений формулы (1), так и их смесей. Настоящее изобретение также охватывает получение соединений формулы (1), содержащих радиоактивные изотопы, в частности, соединений, в которых один атом углерода представляет собой С14 или 1-3 атома водорода замещены тритием. Предпочтительные соединения, получаемые согласно настоящему изобретению, включают 1(гекс-5-инил)-4-пропил-2,6,7-триоксабицикло[2.2.2] октан; 1-/пент-4-инил/-4-пропил-3-трифторметил-2,6,7-три- оксабицикло[2.2.2] октан; 1-(гекс-5-инил)-4-пропил-3-трифторметил-2,6,7-триоксаби- цикло[2.2.2]октан; 1-(пент-4-инил)-4-пропил-2,6,7-триоксабицикло[2.2.2] -октан-3-карбо- нитрил; 1-(гекс-5-инил)-4-пропил-2,6,7-триоксабицикло[2.2.2] -октан-3-карбонитрил; 4-(циклогексил)-1-(пент-4-инил)-2,6,7-триокса- бицикло-[2.2.2] октан; 4-(циклогексил)-1-(гекс-5-инил)-2,6,7-триоксабицикло-[2.2.2] -октан; 4-т-бутил-1-(гекс-5-инил)-2,6,7-триоксабицикло[2.2.2]октан; 4-т-бутил-1-(6-триметилсилилгекс-5-инил)-2,6,7-триоксабицик-ло[2.2.2] октан; 1-(4-этинилциклогексил)-4-пропил-2,6,7-триоксабицикло[2.2.2] -октан; 4-т-бутил-1-(4-этинилциклогексил)-2,6,7- триоксабицикло[2.2.2]-октан (цис- и транс-изомеры); 4-т-бутил-1-(3,3-диметилбут-1-инил)-2,6,7-триоксабицикло[2.2.2] октан; 1-/3,3-диметилбут-1-инил-4-пропил-2,6,7- триоксабицикло[2.2.2] -октан-3-карбонитрил; 4-т-бутил-1-(гекс-5-инил)-2,6,7-диокса-7-тиабицикло-[2.2.2]октан; 1-(гекс-5-инил)- 4-пропил-2-окса-6,7-дитиабицикло[2.2.2] октан; 1-(гекс-5-инил)-4-пропил-2,6,7-тритиабицикло[2.2.2] октан; 4-т-бутил-1-[2-(пропан-2-инилтио)этил] -2,6,7-триоксабицикло- [2.2.2] -октан; 4-пропил-1-[2-(проп-2-инилтио)этил] -2,6,7-триоксабицикло[2.2.2]-ок- тан; 4-т-бутил-1-[2-(проп-2-инилокси)этил] -2,6,7-триоксабицикло[2.2.2] октан; 4-пропил-1-[2-проп-2-инилокси)этил] -2,6,7-триок- сабицикло[2.2.2]-октан -3-карбонитрил; 1-бут-3-инилоксиметил/-4-пропил-2,6,7-три-оксабицикло[2.2.2] октан; 4-т-бутил-1-(бут-3-инилоксиметил)-2,6,7-триоксабицикло- [2.2.2] октан; 1-(бут-3-инилоксиметил)-4-пропил-2,6,7-триоксабицикло[2.2.2] октан -3-карбонитрил; 4-т-бутил-1-/гепт-6-инил/- 2,6,7-триоксабицикло[2.2.2]октан; 1-(гепт-6-инил)-4-пропил-2,6,7-триоксабицикло- [2.2.2] октан; 4-бутил-1-(гекс-5-инил)-2,6,7-триоксабицикло[2.2.2] октан-3-карбонитрил; 1-(гекс-5-инил)-4-(2-метилпроп-2-енил)-2,6,7-триоксабицикло[2.2.2] октан -3-карбонитрил; 1-/гекс-5-инил/-4 -проп-2-енил/-2,6,7-триоксабицикло[2.2.2] октан-3- карбо- нитрил; 1-(гекс-5-инил)4-проп-2-енил)-2,6,7-триоксабицикло[2.2.2] октан-3- карбонитрил; 1-/бут-3-инилоксиметил/-4-/проп- 2-енил/-2,6,7-триоксабицикло[2.2.2]октан -3-карбонитрил; 4-/бут-3-енил/-1-/гекс-5-инил/-2,6,7-триоксабицикло[2.2.2] октан-3- карбонитрил; 4-т-бутил-1-/4-метилгекс-5-инил/-2,6,7-триоксабицикло[2.2.2] октан; 1-[2-(бут-3-инилокси)этил]-4-пропил-2,6,7-три- оксабицикло[2.2.2] -октан; 1-[1-(бут-3-инилокси)этил]-4-пропил-2,6,7-триоксабицик-ло [2.2.2] -октан; 1-(бут-3-инилтиометан)-4-пропил-2,6,7-триоксабицикло[2.2.2] октан; 4-т-бутил-1-(бут-3-инилтиометил)-2,6,7-три- оксабицикло[2.2.2]октан; 4-бутил-1-(гекс-5-инил)-2-окса-6,7-дитиабицикло[2.2.2] октан; 4-т-бутил-1-(гекс-5-инил)-2-окса-6,7-дитиа-бицикло[2.2.2] октан; 4-т-бутил-1-/гекс-5-инил/-2,6,7-триоксабицикло-[2.2.2] октан- 3-карбонитрил; 1-(гекс-5-инил)-4-изобутил- 2,6,7-триоксабицикло[2.2.2]октан-3-карбо-нитрил; 4-этоксиметил-1-(гекс-5-инил)-2,6,7-триоксабицикло[2.2.2] октан-3- карбонитрил; 1-(1-метилгекс-5-инил)-4-пропил- 2,6,7-триоксабицикло[2.2.2]октан; 4-т-бутил-1-(1-метилгекс-5-инил)-2,6,7-триоксаби- цикло[2.2.2] октан; 1-(1-метилгекс-5-инил)-4-пропил-2,6,7-триоксабицикло[2.2.2] октан-3- карбонитрил; метил-7-(4-пропил-2,6,7-триоксабицикло[2.2.2] окт-1-ил)гепт-2-иноат; 1-(гекс-5-инил)-4-фенил-2,6,7-триоксабицик-ло[2.2.2] октан; 1-/гекс-5-инил/-4-изобутил-2-окса-6,7-дитиабицикло[2.2.2] октан; 1-(гекс-5-инил)-3-метил-4-пропил-2-окса-6,7-дитиабицикло[2.2.2] -октан; 1-/3-метилгекс-5-инил/-4-пропил-2,6,7-триоксабицик- ло[2.2.2] октан-3- карбонитрил; 1-/2-метилгекс-5-инил/-4-пропил-2,6,7-триоксабицик- ло[2.2.2]октан-3- карбонитрил; 1-(3,3-диметилбут-1-инил)-4-изобутил-2,6,7-триоксаби- цикло[2.2.2] октан-3- карбонитрил; 1-(бут-3-инилоксиметил)-4-пропил-2,6,7-тритиаби-цикло[2.2.2] октан; 1-(транс-4-е)-этинилциклогксил)-4-пропил-2,6,7-триоксабицикло- [2.2.2] октан-3-карбонитрил; 4-пропил-1-[E)Z)-6-(триметилсилил)гекс-3-ен-5-инил] -2,6,7- триоксабицикло[2.2.2] октан-3-карбонитрил; 1-[(E)Z)-гекс-3-ен-5-инил] -4-пропил-2,6,7-триоксабицикло[2.2.2] октан-3-карбо- нитрил (E:Z 1:2); 1-[(E)Z)-7-метоксигепт-3-ен-5-инил] -4-пропил-2,6,7-триоксабицик- ло[2.2.2] октан-3-карбонитрил (E: Z 1:2); 1-[(E)Z)-7-гидроксигепт-3-ен-5-инил]-4-про- пил-2,6,7-триоксибицикло[2.2.2] октан-3-карбонитрил; 4-т-бутил-1-[(E)-гекс-1-ен-5- [инил] -2,6,7-триоксабицикло[2.2.2] -октан-3- карбонитрил; 4-пропил-2,6,7-триоксабицикло[2.2.2] октан-1-карбоксальдегид оксим-0-(проп-2-инил)эфир; 1-(гекс-5-инил)-4-изо- бутил-2,6,7-тритиабицикло[2.2.2]октан; 1-(гекс-5-инил)-4-фенил-2-окса-6,7-дитиаби-цикло[2.2.2] октан; 4-пропил-1-/4-метилгекс-5-инил/-2,6,7-триоксабицикло[2.2.2] октан-3- карбонитрил; 4-этил-1-(гекс-5-инил)-2,6,7-тритиабицикло[2.2.2]октан; 1-(гекс-5-инил)-4-фенил-2,6,7-триоксабицик-ло[2.2.2] октан-3-карбонитрил; 4-циклопропилметил-1-/гекс-5-инил/-2,6,7-триокса- бицикло[2.2.2]октан-3- карбонитрил; 4-изобутил-1-/3/метилгекс-5-инил/-2,6,7-триок-сабицикло[2.2.2] октан-3- карбонитрил; 1-[( A-X (I) где R С1-С6-алкил, незамещенный или замещенный С1-С6-алкоксигруппой; С2-С6-алкенил; С3-С6-циклоалкил, незамещенный или замещенный галоидом; R1 атом водорода; R2 атом водорода, С1-С3-алкил, незамещенный или замещенный галоидом или циано; А-Х содержит от 3 до 20 атомов, причем Х атом водорода; А С2-С12-алкил с прямой или разветвленной цепью, незамещенный или замещенный С1-С6-алкинилом, С1-С6-алкинил- оксигруппой, С1-С6-алкинилтиогруппой, С1-С6-алкинилоксииминогруппой или С1-C6-алкинилоксикарбонильной группой; С2-С6-алкенил, незамещенный или замещенный галоидом; С2-С12-алкенил, незамещенный или замещенный гидроксигруппой, С1-С6-алкоксигруппой или группой Si(CH3)3; С2-С12-алкинил, незамещеный или замещенный С1-С6-алкокси- или Si(CH3)3-группой; С1-С6-алкинилоксикарбонил; N-(C1-С6-алкинил)карбамоил или N-(С1-С2-алкинил)ацетамидогруппу; Y и YI 0 или S; Z CH2O или CH2S. Соединения формулы (1) могут существовать во множестве изомерных форм. Настоящее изобретение охватывает получение как отдельных изомеров соединений формулы (1), так и их смесей. Настоящее изобретение также охватывает получение соединений формулы (1), содержащих радиоактивные изотопы, в частности, соединений, в которых один атом углерода представляет собой С14 или 1-3 атома водорода замещены тритием. Предпочтительные соединения, получаемые согласно настоящему изобретению, включают 1(гекс-5-инил)-4-пропил-2,6,7-триоксабицикло[2.2.2] октан; 1-/пент-4-инил/-4-пропил-3-трифторметил-2,6,7-три- оксабицикло[2.2.2] октан; 1-(гекс-5-инил)-4-пропил-3-трифторметил-2,6,7-триоксаби- цикло[2.2.2]октан; 1-(пент-4-инил)-4-пропил-2,6,7-триоксабицикло[2.2.2] -октан-3-карбо- нитрил; 1-(гекс-5-инил)-4-пропил-2,6,7-триоксабицикло[2.2.2] -октан-3-карбонитрил; 4-(циклогексил)-1-(пент-4-инил)-2,6,7-триокса- бицикло-[2.2.2] октан; 4-(циклогексил)-1-(гекс-5-инил)-2,6,7-триоксабицикло-[2.2.2] -октан; 4-т-бутил-1-(гекс-5-инил)-2,6,7-триоксабицикло[2.2.2]октан; 4-т-бутил-1-(6-триметилсилилгекс-5-инил)-2,6,7-триоксабицик-ло[2.2.2] октан; 1-(4-этинилциклогексил)-4-пропил-2,6,7-триоксабицикло[2.2.2] -октан; 4-т-бутил-1-(4-этинилциклогексил)-2,6,7- триоксабицикло[2.2.2]-октан (цис- и транс-изомеры); 4-т-бутил-1-(3,3-диметилбут-1-инил)-2,6,7-триоксабицикло[2.2.2] октан; 1-/3,3-диметилбут-1-инил-4-пропил-2,6,7- триоксабицикло[2.2.2] -октан-3-карбонитрил; 4-т-бутил-1-(гекс-5-инил)-2,6,7-диокса-7-тиабицикло-[2.2.2]октан; 1-(гекс-5-инил)- 4-пропил-2-окса-6,7-дитиабицикло[2.2.2] октан; 1-(гекс-5-инил)-4-пропил-2,6,7-тритиабицикло[2.2.2] октан; 4-т-бутил-1-[2-(пропан-2-инилтио)этил] -2,6,7-триоксабицикло- [2.2.2] -октан; 4-пропил-1-[2-(проп-2-инилтио)этил] -2,6,7-триоксабицикло[2.2.2]-ок- тан; 4-т-бутил-1-[2-(проп-2-инилокси)этил] -2,6,7-триоксабицикло[2.2.2] октан; 4-пропил-1-[2-проп-2-инилокси)этил] -2,6,7-триок- сабицикло[2.2.2]-октан -3-карбонитрил; 1-бут-3-инилоксиметил/-4-пропил-2,6,7-три-оксабицикло[2.2.2] октан; 4-т-бутил-1-(бут-3-инилоксиметил)-2,6,7-триоксабицикло- [2.2.2] октан; 1-(бут-3-инилоксиметил)-4-пропил-2,6,7-триоксабицикло[2.2.2] октан -3-карбонитрил; 4-т-бутил-1-/гепт-6-инил/- 2,6,7-триоксабицикло[2.2.2]октан; 1-(гепт-6-инил)-4-пропил-2,6,7-триоксабицикло- [2.2.2] октан; 4-бутил-1-(гекс-5-инил)-2,6,7-триоксабицикло[2.2.2] октан-3-карбонитрил; 1-(гекс-5-инил)-4-(2-метилпроп-2-енил)-2,6,7-триоксабицикло[2.2.2] октан -3-карбонитрил; 1-/гекс-5-инил/-4 -проп-2-енил/-2,6,7-триоксабицикло[2.2.2] октан-3- карбо- нитрил; 1-(гекс-5-инил)4-проп-2-енил)-2,6,7-триоксабицикло[2.2.2] октан-3- карбонитрил; 1-/бут-3-инилоксиметил/-4-/проп- 2-енил/-2,6,7-триоксабицикло[2.2.2]октан -3-карбонитрил; 4-/бут-3-енил/-1-/гекс-5-инил/-2,6,7-триоксабицикло[2.2.2] октан-3- карбонитрил; 4-т-бутил-1-/4-метилгекс-5-инил/-2,6,7-триоксабицикло[2.2.2] октан; 1-[2-(бут-3-инилокси)этил]-4-пропил-2,6,7-три- оксабицикло[2.2.2] -октан; 1-[1-(бут-3-инилокси)этил]-4-пропил-2,6,7-триоксабицик-ло [2.2.2] -октан; 1-(бут-3-инилтиометан)-4-пропил-2,6,7-триоксабицикло[2.2.2] октан; 4-т-бутил-1-(бут-3-инилтиометил)-2,6,7-три- оксабицикло[2.2.2]октан; 4-бутил-1-(гекс-5-инил)-2-окса-6,7-дитиабицикло[2.2.2] октан; 4-т-бутил-1-(гекс-5-инил)-2-окса-6,7-дитиа-бицикло[2.2.2] октан; 4-т-бутил-1-/гекс-5-инил/-2,6,7-триоксабицикло-[2.2.2] октан- 3-карбонитрил; 1-(гекс-5-инил)-4-изобутил- 2,6,7-триоксабицикло[2.2.2]октан-3-карбо-нитрил; 4-этоксиметил-1-(гекс-5-инил)-2,6,7-триоксабицикло[2.2.2] октан-3- карбонитрил; 1-(1-метилгекс-5-инил)-4-пропил- 2,6,7-триоксабицикло[2.2.2]октан; 4-т-бутил-1-(1-метилгекс-5-инил)-2,6,7-триоксаби- цикло[2.2.2] октан; 1-(1-метилгекс-5-инил)-4-пропил-2,6,7-триоксабицикло[2.2.2] октан-3- карбонитрил; метил-7-(4-пропил-2,6,7-триоксабицикло[2.2.2] окт-1-ил)гепт-2-иноат; 1-(гекс-5-инил)-4-фенил-2,6,7-триоксабицик-ло[2.2.2] октан; 1-/гекс-5-инил/-4-изобутил-2-окса-6,7-дитиабицикло[2.2.2] октан; 1-(гекс-5-инил)-3-метил-4-пропил-2-окса-6,7-дитиабицикло[2.2.2] -октан; 1-/3-метилгекс-5-инил/-4-пропил-2,6,7-триоксабицик- ло[2.2.2] октан-3- карбонитрил; 1-/2-метилгекс-5-инил/-4-пропил-2,6,7-триоксабицик- ло[2.2.2]октан-3- карбонитрил; 1-(3,3-диметилбут-1-инил)-4-изобутил-2,6,7-триоксаби- цикло[2.2.2] октан-3- карбонитрил; 1-(бут-3-инилоксиметил)-4-пропил-2,6,7-тритиаби-цикло[2.2.2] октан; 1-(транс-4-е)-этинилциклогксил)-4-пропил-2,6,7-триоксабицикло- [2.2.2] октан-3-карбонитрил; 4-пропил-1-[E)Z)-6-(триметилсилил)гекс-3-ен-5-инил] -2,6,7- триоксабицикло[2.2.2] октан-3-карбонитрил; 1-[(E)Z)-гекс-3-ен-5-инил] -4-пропил-2,6,7-триоксабицикло[2.2.2] октан-3-карбо- нитрил (E:Z 1:2); 1-[(E)Z)-7-метоксигепт-3-ен-5-инил] -4-пропил-2,6,7-триоксабицик- ло[2.2.2] октан-3-карбонитрил (E: Z 1:2); 1-[(E)Z)-7-гидроксигепт-3-ен-5-инил]-4-про- пил-2,6,7-триоксибицикло[2.2.2] октан-3-карбонитрил; 4-т-бутил-1-[(E)-гекс-1-ен-5- [инил] -2,6,7-триоксабицикло[2.2.2] -октан-3- карбонитрил; 4-пропил-2,6,7-триоксабицикло[2.2.2] октан-1-карбоксальдегид оксим-0-(проп-2-инил)эфир; 1-(гекс-5-инил)-4-изо- бутил-2,6,7-тритиабицикло[2.2.2]октан; 1-(гекс-5-инил)-4-фенил-2-окса-6,7-дитиаби-цикло[2.2.2] октан; 4-пропил-1-/4-метилгекс-5-инил/-2,6,7-триоксабицикло[2.2.2] октан-3- карбонитрил; 4-этил-1-(гекс-5-инил)-2,6,7-тритиабицикло[2.2.2]октан; 1-(гекс-5-инил)-4-фенил-2,6,7-триоксабицик-ло[2.2.2] октан-3-карбонитрил; 4-циклопропилметил-1-/гекс-5-инил/-2,6,7-триокса- бицикло[2.2.2]октан-3- карбонитрил; 4-изобутил-1-/3/метилгекс-5-инил/-2,6,7-триок-сабицикло[2.2.2] октан-3- карбонитрил; 1-[( )-3-метилгекс-5-инил] -4-пропил-2,6,7- триоксабицикло[2.2.2]октан-3-карбонитрил; 1-/2-метилгекс-5-инил/-4-проп-2-енил/- 2,6,7-триоксабицикло[2.2.2]октан-3- карбонитрил; 4-т-бутил-1-/3,3-диметилбутил/-2,6,7-триоксабицикло[2.2.2] октан; 1-/3,3-ди- метилбутил/-4-пропил-2,6,7-триоксабицик- ло[2.2.2] октан-3- карбонитрил; 1-[(E)-3,3-диметилбутил-1-енил]-4-пропил-2,6,7-триок- сабицикло[2.2.2]октан-3- карбонитрил; 1-/т-бутилтиометил/-4-пропил-2,6,7-три- оксабицикло[2.2.2] октан-3-карбонитрил; 1-[(Z)-1-фтор-3,3-диметилбут-1-енил] -4-про- пил-2,6,7-триоксабицикло[2.2.2] октан-3-карбонитрил; 1-/гепт-5-инил/-4-пропил-2,6,7-триоксабицикло[2.2.2]октан. Согласно настоящему изобретению способ получения соединений формулы (I) осуществляется с помощью взаимодействия соединения (AlkO)3 CТ формулы III с соединением формулы R )-3-метилгекс-5-инил] -4-пропил-2,6,7- триоксабицикло[2.2.2]октан-3-карбонитрил; 1-/2-метилгекс-5-инил/-4-проп-2-енил/- 2,6,7-триоксабицикло[2.2.2]октан-3- карбонитрил; 4-т-бутил-1-/3,3-диметилбутил/-2,6,7-триоксабицикло[2.2.2] октан; 1-/3,3-ди- метилбутил/-4-пропил-2,6,7-триоксабицик- ло[2.2.2] октан-3- карбонитрил; 1-[(E)-3,3-диметилбутил-1-енил]-4-пропил-2,6,7-триок- сабицикло[2.2.2]октан-3- карбонитрил; 1-/т-бутилтиометил/-4-пропил-2,6,7-три- оксабицикло[2.2.2] октан-3-карбонитрил; 1-[(Z)-1-фтор-3,3-диметилбут-1-енил] -4-про- пил-2,6,7-триоксабицикло[2.2.2] октан-3-карбонитрил; 1-/гепт-5-инил/-4-пропил-2,6,7-триоксабицикло[2.2.2]октан. Согласно настоящему изобретению способ получения соединений формулы (I) осуществляется с помощью взаимодействия соединения (AlkO)3 CТ формулы III с соединением формулы R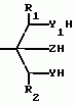 (II) где Т обозначает группу АХ или атом водорода, когда Y и Y1 обозначают серу, R, R1, R2, Y, Y1 и Z имеют вышеприведенные значения, и Alk обозначает С1-С4-алкил, а затем, если Т обозначает водород, осуществляют взаимодействие полученного соединения формулы (IV) R (II) где Т обозначает группу АХ или атом водорода, когда Y и Y1 обозначают серу, R, R1, R2, Y, Y1 и Z имеют вышеприведенные значения, и Alk обозначает С1-С4-алкил, а затем, если Т обозначает водород, осуществляют взаимодействие полученного соединения формулы (IV) R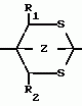 H с соединением LAX формулы V, где L обозначает атом галогена, и R1-R2, Z, A и Х имеют вышеприведенные значения. Конденсация происходит в присутствии кислотного катализатора, например, минеральной кислоты, такой, как концентрированная соляная кислота или эфират трехфтористого бора и/или п-толуолсульфокислота. Реакцию удобно осуществлять при неэкстремальной температуре, например, от -70 до 150оС, и обычно, от -10 до 150оС. Реакцию соединения формулы (IV) c LAX можно осуществлять в присутствии сильного основания, такого, как бутиллитий, в инертном растворителе, таком, как простой эфир, и удобно, тетрагидрофуран, при неэкстремальной температуре, например, от -70 до 30оС. Соединения формулы (1) могут быть использованы для борьбы с вредителями, такими, как членистоногие, например, насекомые и акарицидные вредители, и паразитические черви, то есть, нематоды. Соединения формулы (1) представляют особенную ценность в защите полевых, фуражных, многолетних (на плантации), оранжерейных, садовых и виноградниковых культур, декоративных растений, а также плантациевых и лесных деревьев, например, хлебных злаков (таких, как кукуруза, пшеница, рис, сорго), хлопчатника, табака, овощей и салатов (таких, как бобовые, капуста, латук, лук, томаты и перец), полевых культур (таких, как картофель, сахарная свекла, земляной орех, соя культурная, репа), сахарного тростника, фуража (такого, как кукуруза, сорго, люцерна), плантациевых (таких, как чай, кофе, какао, банан, масличная пальма, кокосовый орех, каучук, специй), садовых и лесных (таких, как косточковые и односеменные плоды, цитрусовые, авокадо, манго, маслины и орехи), виноградниковых, декоративных растений, цветов и кустарников под стеклом и в садах и парках, деревьев (как опадающих, так и вечнозеленых) в лесах, плантациях и питомниках. Они также ценны при защите строевого леса (на корню, срубленного, переработанного или строительного) от нападения пильщиков (например, Urocerus) или жуков (например, околитидов, платиподидов, ликтидов, бострихидов, керамбицидов, анобиидов). Соединения формулы (1) также находят применение при защите хранящихся продуктов, таких, как зерно, фрукты, орехи, специи, табак, либо в целом виде, измельченном, либо в сформованном в продукты, от моли,жуков, клещей. Также защищают хранящиеся животные продукты, такие, как кожа, волос, шерсть и перья в натуральной или переработанной форме (например, в виде ковровых или текстильных изделий) от нападения моли и жуков, а кроме того защищают мясо и рыбу от нападения жуков, клещей и мух. Соединения общей формулы I представляют особую ценность в борьбе с членистоногими или гельминтами, которые губительны или действуют как переносчики заболеваний для людей и домашних животных, и особенно при борьбе с клещами, вшами, блохами, мелкими двукрылыми насекомыми и кусающими и назойливыми мухами. Стабилизаторы для предотвращения любой химической деградации, которая может случаться с соединениями настоящего изобретения,включают, например, антиокислители (такие, как токоферолы, бутилгидроксианизол и бутилгидрокситолуол) и поглотители (такие, как эпихлоргидрин) и органические или неорганические основания, например, триалкиламины, такие, как триэтиламин, который может воздействовать как стабилизатор основания и как поглотитель. Не ограничивая объема изобретения, прилагаемые ниже примеры иллюстрируют предпочтительные варианты осуществления изобретения. Все температурные значения приведены в оС. П р и м е р 1. 4-Трет-бутил-1-(гекс-5-инил)-2,6,7-триоксабицикло[2.2.2] октан. Смесь, состоящую из 2-трет-бутил-2-оксиметилпропан-1,3-диола (0,75) и триметилового эфира ортогепт-6-иновой кислоты (0,75 г), нагревают до 50оС до получения гомогенного состояния. Прибавляют одну каплю концентрированной соляной кислоты, и смесь нагревают до примерно 135оС в потоке азота в течение 10 мин. Затем смесь охлаждают и хроматографируют на глиноземе, используя в качестве элюента смесь дихлорметан: насыщенный аммиаком гексан, 1:6. Получают 4-трет-бутил-1-(гекс-5-инил)-2,6,7-триоксабицикло[2,2,2]октан в виде бесцветных кристаллов 0,38 г, перекристаллизованных из гексана). Аналогичным способом получают 1-(гекс-5-инил)-4-фенил-2,6,7-триоксабицик-ло[2,2,2]октан из 2-оксиметил-2-фенилпропан-1,3-диола. П р и м е р 2. 1-гекс-5-инил-4-н-пропил-2,6,7-тритиабицикло[2.2.2]октан. Раствор, содержащий риметиловый эфир ортогепт-6-иновой кислоты (6,0 г) в сухом метаноле (24 мл), перемешивают при 0оС в атмосфере азота. Прибавляют 2-меркаптометил-2-н-пропилпропан-1,3-дитиол (3,0 г) в сухом метаноле (10 мл), а затем добавляют метанол, насыщенный хлористым водородом (1,0 мл). После перемешивания 20 минут при 0оС прибавляют сухой триэтиламин (3,0 мл). Затем добавляют воду (100 мл), и смесь экстрагируют диэтиловым эфиром. Эфирные экстракты сушат над безводным сульфатом магния и упаривают в вакууме. Остаток хроматографируют на глиноземе с элюированием смесью дихлорметан:насыщенный аммиаком гексан, 1: 10. Летучие компоненты удаляют в вакууме (Kugelrohn при 130оС, давление 0,5 мм Hg). Остаток выкристаллизовывают из гексана. Получают 1-(гекс-5-инил)-4-н-пропил-2,6,7-тритиабицикло(2.2.2)-октан в виде бесцветных кристаллов (0,90 г). Используя аналогичную методику, по-лучают 4-этил-1-(гекс-5-инил)-2,6,7-тритиабицикло[2,2,2] октан и 4-изобутил-1- (гекс-5-инил)-2,6,7-тритиабицикло[2,2,2]-ок- тан из триметилортогепт-6-ината и 2-этил-2-меркаптометилпропан-1,3-дитиола и 2-изобутил-2-меркаптометилпропан-1,3-дитиола соответственно. П р и м е р 3. 4-Трет-бутил-(7-метоксигепт-5-нил)-2,6,7-триоксабицикло[2.2.2]ок-тан. (I) Хлоргидрат метилового эфира 5-бромпентаиминокислоты (т.пл. 89oС) полу- чают из 5-бромвалеронитрила. (II) Триметил 5-бромортопентанат (бесцветная жидкость, т.кип. 108-110оС, давление 16 мм Hg) получают из хлоргидрата метил-5-бромпентанимидата. (III) 1-(4-бромбутил)-4-трет-бутил-2,6,7-триоксабицикло[2,2,2]октан (т. пл. 111-115оС) получают из 5-бромортопентаната и 2-трет-бутил-2-оксиметилпропана-1,3-ди- ола. Масс-спектр (химическая ионизация):М+1 30 7, 309 (IV) К перемешанному раствору, содежащему безводный жидкий аммиак (70 мл) и сухой диэтиловый эфир (20 мл) прибавляют натрий (0,1 г) при -70оС в атмосфере азота. Через 10 минут к полученному темноголубому раствору прибавляют нитрат железа (15 мг). Реакционную смесь, которая становится зеленой, доводят до температуры 30оС и прибавляют небольшими порциями дополнительное количество натрия (0,75 г). Смесь перемешивают в течение 30 мин при -30оС и прибавляют метилпропаргилэфир (2,2 г). Смесь перемешивают еще час при -30оС и прибавляют 1-(4-бромбутил)-4-трет-бутил-2,6,7-триоксабицикло[2.2.2]ок- тан (1,0 г) в сухом диэтиловом эфире (50 мл). Смесь перемешивают при -30оС в течение 1 часа. Прибавляют твердый хлорид аммония (1,7 г), а затем метанол (5 мл), и реакционную смесь доводят до комнатной температуры. Добавляют воду (20 мл), и водную смесь экстрагируют диэтиловым эфиром. Эфирные экстракты сушат над безводным сульфатом магния и упаривают в вакууме. Остаток хроматографируют на глиноземе, используя в качестве элюента смесь дихлорметан: насыщенный аммиаком гексан, 1:9. 4-Трет-бутил-(7-метоксигепт-5-инил)-2,6,7-триоксабицикло[2.2.2] октан получают в виде бесцветного твердого вещества (т.пл. 47-49оС, рекристаллизованного из гексана). П р и м е р 4. 1-(бут-3-инилоксиметил)-4-н-пропил-2,6,7-триоксабицикло[2.2.2]ок-тан. I) Метансульфонилхлорид (74,0 г) прибавляют по каплям в течение 30 минут к раствору 2-оксиметил-2-н-пропилпропан-1,3-диола (28,0 г) в сухом пиридине (200 мл) в атмосфере азота при 0оС. Смесь нагревают до комнатной температуры. После перемешивания в течение 18 ч, смесь выливают в воду (200 мл) и экстрагируют хлороформом (2х200 мл). Экстракты хлороформа промывают водой (2х100 мл), сушат над безводным сульфатом магния и упаривают в вакууме с выходом твердого вещества коричневого цвета. Этот продукт перемешивают в простом диэтиловом эфире (200 мл) с получением 2-оксиметил-2-н-пропил-пропан- 1,3-диола триметансульфоната в виде белого твердого вещества (70,0 г, т.пл. 103,6оС). II) Тритиокарбонат натрия (18,0 г) (см. I.Org. Chem. Вып. 33, с. 1275, 1968) в воде ((25 мл) прибавляют к раствору, содержащему триметансульфонат 2-оксиметил-2-н-пропилпропан-1,3-диола (12,0 г) в диметилформамиде (100 мл). Смесь нагревают с обратным холодильником (130оС) в течение 4 ч с последующим охлаждением до комнатной температуры. После перемешивания в течение 18 часов, медленно прибавляют в течение 30 мин раствор разбавленной серной кислоты (50 мл). Смесь экстрагируют хлороформом. Полученные экстракты сушат над безводным сульфатом магния и упаривают в вакууме с выходом коричневой жидкости. Прибавляют гексан (200 мл), а затем смесь промывают водой (3х50 мл). Сушат над безводным сульфатом магния и после упаривания получают масло янтарного цвета (6,8 г). Неочищенное масло (6,4 г) в диэтиловом эфире (10 мл) прибавляют по каплям к суспензии алюмогидрата лития (3,0 г) в диэтиловом эфире (100 мл) при скорости, достаточной для поддержания орошения. После завершения введения алюмогидрата лития, смесь перемешивают еще 1 час, а затем осторожно прибавляют воду (3 мл). Вводят разбавленную серную кислоту (3 мл) и прибавляют воду (3 мл). Смесь фильтруют, твердый осадок промывают диэтиловым эфиром (50 мл), а затем объединенные экстракты сушат над безводным сульфатом магния. После упаривания в вакууме получают 2-меркаптометил-2-непропилпропан-1,3-диол в виде бледножелтого масла (5,3 г). III) Хлористый водород (газ) барботируют через суспензию параформальдегида (4,3 г) в бут-3-ин-1-оле (10,0 г) (фирмы "Aldrich") и сухого дихлорметана (30 мл) при -20оС в течение 30 минут. Смесь нагревают до комнатной температуры, а затем перемешивают еще 18 ч. Прибавляют холодную воду (30 мл), полученный органический слой отделяют, сушат над безводным хлоридом кальция, и после упаривания получают простой хлорметиловый эфир бут-3-инила в виде жидкости янтарного цвета (14,2 г). (IV) Смесь 2-меркаптометил-2-н-пропилпропан-1,3-дитиола (2,3 г) и триэтилового эфира ортомуравьиной кислоты (1,74 г) нагревают в сухом толуоле, содержащем паратолуолсульфокислоту, (5 мг) и этанол, полученного отгонкой. После охлаждения прибавляют толуол (15 мл), и полученную смесь промывают водой (2х10 мл). После сушки над безводным сульфатом магния и упаривания в вакууме получают светложелтое масло. Полученное масло экстрагируют диэтиловым эфиром (50 мл), и экстракты упаривают в вакууме с выходом белого твердого вещества. После очистки хроматографией на глиноземе, элюируя смесью дихлорметан: насыщенный аммиаком гексан, 1:10, получают 4-н-пропил-2,6,7-тритиабицикло[2.2.2]октан в виде белого твердого вещества (0,33 г, т.пл. 139оС). Масс-спектр (химическая ионизация: М+1 207). V) н-Бутиллитий (0,3 мл), 1,6 М раствор в гексане) прибавляют к раствору 4-н-пропил-2,6,7-тритиабицикло[2.2.2]октана (0,1 г) в сухом тетрагидрофуране (5 мл) при -70оС в атмосфере азота. Раствор перемешивают в течение 30 мин, и прибавляют простой хлорметиловый эфир бут-3-инила (0,58 г) в сухом тетрагидрофуране (2,0 мл), реакционную смесь нагревают до 20оС. Прибавляют воду (10 мл), а затем полученную смесь экстрагируют диэтиловым эфиром. Эфирные экстракты сушат над безводным сульфатом магния, и растворитель упаривают в вакууме. Остаток очищают хроматографией на глиноземе с элюированием смесью 1:10 ди- хлорметан: насыщенный аммиаком гексан. Получают 1-(бут-3-инилоксиметил)-4-н-пропил-2,6,7-тритиабицикло[2.2.2] октан в виде воскообразного твердого вещества 0,032 г). П р и м е р 5. 4-Трет-бутил-1-(гекс-5-инил)-2,6-диокса-7-тиабицикло[2.2.2]октан. 4-Трет-бутил-1-(гекс-5-инил)-2,6-диокса- 7-тиабицикло[2.2.2] октан получают из триметилового эфира ортогепт-6-иновой кислоты и 2,2-ди(оксиметил)-3,3-диме- тилбутан-1-тиола (см. описание к Европатенту N 216625) по методике, описанной в указанном патенте. П р и м е р 6. 4-(2,2-дихлорциклопропилметил)-1-(гекс-5-инил)-2,6,7-триоксабицик-ло [2.2.2]октан. I) Триацетат 2-оксиметил-2-(проп-2-енил)пропан-1,3-диола (2,2 г) нагревают до 130оС при перемешивании. Прибавляют трихлорацетат натрия (5,0 г) в течение 2 ч, а затем реакционную смесь нагревают до 155оС в течение 24 ч. Эфирные экстракты сушт над безводным сульфатом магния и упаривают в вакууме. Остаток очищают хроматографией на двуокиси кремния с элюированием смесью диэтиловый эфир:гексан, 1:4. Получают 2-(2,2-дихлорциклопропилметил)-2-дксиметилпропан-1,3-диола триацетат в виде бесцветного масла (1,4 г). Масс-спектр (химическая ионизация):аммиак в качестве ионизирующего газа, М+18 372. Составы 1. Эмульгируемый концентрат Соединение формулы (I) 10,00 Этилен КЕО 20,00 Ксилол 67,50 Бутиллированный гваякол 2,50 100,00 2. Смачиваемый порошок Соединение формулы (I) 25,00 Аттапульгит 69,50 Изопропилбензол- сульфонат натрия 0,50 Натриевая соль конден- сированной нафталин- сульфокислоты 2,50 Бутилированный окси- толуол 2,50 100,00 3. Дуст (порошок) Соединение формулы (I) 0,50 Бутилированный гваякол 0,10 Тальк 99,40 100,00 4. Приманка Соединение формулы (I) 40,25 Ледяной сахар 59,65 Бутилированный ок- ситолуол 0,10 100,00 5. Лак Соединение формулы (I) 0,1 Бутилат пиперонила 0,5 Бутилированный гваякол 10,1 Высокоароматический уайт-спирт 92,0 100,00 6. Аэрозоль Соединение формулы (I) 0,30 Бутилированный гваякол 0,10 1,1,1-трихлорэтан 4,00 Непахнущий керосин 15,60 Арктон 11/12, 50:50 смесь 80,00 100,00 7. Спрэй (раствор для опрыскивания) Соединение формулы (I) 0,1 Бутилированный гваякол 0,1 Ксилол 10,0 Непахнущий керосин 89,8 100,00 8. Спрэй с усиливающим действием Соединение формулы (I) 0,1 Бутилат пиперонила 0,5 Бутилированный гваякол 0,1 Ксилол 10,1 Непахнущий керосин 89,2 100,00 Биологическая активность Не ограничивая объема, следующие примеры иллюстрируют пестицидную активность соединений формулы (1). Испытания на действие растворов для опрыскивания Активность соединений предлагаемого изобретения испытывали при растворении заявленных соединений в ацетоне (5%), а затем разведении полученного раствора в смеси вода:Synperonic (94,5%0,5%) для получения водной эмульсии. Затем указанный раствор используют для обработки следующих вредителей-насекомых Musca donustica. 20 женских особей Musca помещают в картонный цилиндр с сеткой по обеим сторонам. Через сетку на насекомых распыляют раствор, содержащий испытуемое соединение. Через 48 часов при 25оС оценивают летальность. Следующие соединения проявляют активность при <1000 ч/млн:4, 5, 14, 20, 21, 22, 24, 24, 25, 26, 28, 32, 43, 44, 45, 50, 53, 54, 56, 69, 71, 72, 76, 77, 82, 83, 89. Следующие соединения проявляют пестицидную активность при <200 ч/млн. 6, 9, 10, 11, 12, 13, 15, 16, 17, 29, 30, 31, 33, 34, 46, 47, 48, 52, 57, 58, 59, 60, 61, 62, 63, 64, 65, 68, 74, 75, 78, 79, 80, 81, 83, 84, 85, 90. Sitophilus granaris и Tribolium costaneum. 20 имаго Sitophilus и Tribolium прибавляют к 10 г пшеницы, зерна которой предварительно обработаны 2 мл раствора, содержащего предлагаемые соединения. Смертность оценивали через 6 дней при 25оС. Следующие соединения проявляют пестицидную активность против Sitophilus granaris и при <1000 ч/млн. 7, 10, 19, 22, 23, 25, 26, 27, 32, 43, 44, 50, 56, 69, 82, 85, 89, 90. Следующие соединения проявляют активность против Sitophilus granaris при расходе <200 ч/млн: 3, 4, 5, 6, 9, 12, 14, 15, 16, 17, 29, 30, 31, 33, 34, 45, 47, 48, 53, 54, 57, 58, 60, 61, 62, 68, 72, 74, 75, 76, 77, 78, 79, 80, 81. Следующие соединения проявляют активность против Tribolium lastaneum в дозе <1000 ч/млн: 4, 6, 10, 14, 17, 33, 53, 57, 58, 65, 71, 76, 79, 82, 84. Следующие соединения проявляют активность в качестве пестицидов против Tribolium castaneum при <200 ч/млн: 9, 12, 15, 16, 34, 46, 63, 74, 75. Myzus persicae 10 имаго Myzus помещают на пластинку листка китайской капусты. Через 24 часа листовую пластинку опрыскивают раствором, содержащим испытуемое соединение. Смертность оценивают через 2 дня при 25оС. Следующие соединения проявляют пестицидную активность при дозе <1000 ч/млн: 4, 9, 17, 37, 46, 53, 56, 60, 71, 77, 78, 79, 80, 81, 84. Следующие соединения проявляют пестицидную активность в дозе <200 ч/млн: 6, 45, 47, 48, 57, 58, 59,62, 63, 74, 75, 76. Plutella xycostella 7 личинок Plutella опрыскивают раствором, содержащим испытуемое соединение и помещают на листок китайской капусты, который опрыскан аналогичным образом испытуемым соединением, и которому дают высохнуть. В альтернативном варианте 8-10 личинок Plutella помещают на пластинки листьев и опрыскивают раствором, содержащим испытуемое соединение. смертности подсчитывают через 2 дня при 25оС. Следующие соединения проявляют пестицидную активность при <1000 ч/млн: 15, 16, 25, 29, 31, 33, 34, 35, 48, 55, 56, 58, 59, 65, 68, 71, 75, 77, 78, 79, 80, 81, 83, 85, 87. Следующие соединения проявляют активность при дозе <200 ч/млн 9, 12, 13, 46, 57, 74. Tetranychus urticаe Пластины листьев, содержащие смешанную популяцию Tetranychus urticae опрыскивают раствором испытуемого соединения. смертности оценивают через 2 дня при 25оС. Следующие соединения проявляют активность в дозе <1000 ч/млн: 78, 81, 83, 90. Следующие соединения проявляют пестицидную активность в дозе <200 ч/млн. 60, 80. Дополнительные испытания на действие раствора для опрыскивания. Пестицидная активность предлагаемых соединений была исследована дополнительно. Соединения растворяют в ацетоне (75%), и затем прибавляют воду. Далее указанный раствор используют для опрыскивания следующих насекомых-вредителей: Aphis fabaе. Смешанную популяцию Aphis fabal испытывали на листьях настурции. Следующие соединения проявляют пестицидную активность в дозе <1000 ч/млн: 4, 6, 13, 16, 17, 25, 26, 29, 30, 31, 33, 46, 47, 50, 54, 63, 65. Macrosteles fascifrous Имаго Macrosteles fascifrous испытывали на ростках пшеницы. Следующие соединения проявляют активность в дозе <1000 ч/млн: 6, 9, 13, 16, 17, 23, 25, 26, 29, 31, 33, 34, 46, 47, 63, 65, 68. Tetranychus urticae Смешанную популяцию Tetranychus urticae испытывали на листьях бобовых. Следующие соединения проявляют активность в дозе <1000 ч/млн: 5, 9, 16, 30, 33, 31, 46, 47, 50, 65, 68. Diabrotica undecimpumtata в третьей стадии развития подвергают испытанию на фильтровальной бумаге. Следующие соединения проявляют пестицидную активность в дозе <1000 ч/млн: 3, 4, 5, 6, 13, 16, 17, 23, 26, 29, 30, 31, 33, 34, 46, 47, 53, 63, 65, 68. Испытания на местное применение Активность предлагаемых соединений против неанестезированной женской особи обыкновенной мухи Musca Lomestica (WRL-линии) показана при местном применении на испытуемом насекомом раствора, содержащего испытуемое соединение и бутилат пиперонила в бутаноле. Смертность оценивали через 48 часов. Следующие соединения проявляют пестицидную активность в дозе 1 мкг: 9, 10, 11, 12, 13, 15, 17, 29, 30, 31, 33, 34, 47, 52, 63, 64, 68, 83, 84, 85. Активность предлагаемых соединений против анестезированной мужской особи Periplaneta americana продемонстрирована при местном применении на испытуемом насекомом раствора, содержащего испытуемое соединение в бутаноне. Смертность оценивают через 6 дней. Следующие соединения проявляют активность в дозе <50 мкг: 2, 6, 16, 17, 25, 31, 39, 83. Пестицидную активность предлагаемых соединений против анестезированной мужской особи Blatelba germanica продемонстрирована путем местного применения на испытуемом насекомом раствора, содержащего испытуемое соединение в бутаноне. Смертность определяют через 6 дней. Следующие соединения проявляют пестицидную активность в дозе <5 мкг: 6, 9, 12, 14, 15, 16, 17, 20, 29, 30, 31, 33, 34, 45, 46, 48, 56, 57, 58, 59, 60, 61, 62, 63, 65, 66, 71, 72, 74, 75, 83, 84, 90. Нематоцидная активность Meloidogyne imognita Отобранные соединения предлагаемого изобретения анализировали на только что вылупившейся нематоде Meloidogyne imognita 2. Испытуемый раствор содержит смесь 1% ацетона со 100 ч/млн. Тритона Х-100. Нематоцидную активность определяют через 24 часа. Следующие соединения проявляют активность в дозе <100 ч/млн: 6, 16, 17, 26. Токсичность относительно млекопитающих Токсичность предлагаемых соединений устанавливают при оральной интубации мыши Charles niber CDL голодавшей 3 часа. Испытуемые соединения вводят в виде растворов в ДМСО в дозе 200 мг/10 мл/мг, 20 мг/10 мл/кг и 2 мг/10 мл/мг. Токсичность определяют через 14 дней после приема. Следующие соединения проявляют токсичность с LD50 200 мкг-1. 17, 60. Следующие соединения проявляют токсичность с LD50 в интервале 20-200 мгкг-1. 16, 75. П р и м е р 7. 3-Циано-4-циклобутил-1-(гекс-5-инил)-2,6,7-триоксабицикло[2.2.2] октан. (I) К перемешиваемой суспензии хлорхромата пиридиния в сухом дихлорметане добавляли 3-циклобутил-3-гидроксиметилоксетан. Смесь перемешивали в течение 2 часов, разбавляли диэтиловым эфиром и затем очищали на колонке из флорсила, элюируя эфиром. Выпаривание, давало 3-циклобутил-3-формилоксетан в виде жидкости. (II) К перемешиваемому раствору 3-циклобутил-3-формилоксетана и гепт-6-иноилхлорида в эфире при 0о добавляли раствор цианида натрия в воде. Раствор оставляли перемешиваться на ночь при комнатной температуре, затем промывали водой, и органический слой сушили над безводным сульфатом магния и упаривали. Остаток хроматографировали на двуокиси кремния, предварительно обработанной гексаном, содержащим 1% триэтиламина, элюируя смесью гексан-дихлорметан в соотношении по объему от 9:1 с увеличением до 3:7. Получили 1-циано-1-(3-циклобутилоксетан-3-ил)метил-гент-6-иноат. (III) Эфират трехфтористого бора добавляли при -70о в атмосфере азота к перемешиваемому раствору 1-циано-1-(3-циклобу- тилоксетан-3-ил)метил-гепт-6-иноата в сухом дихлорметане. Раствору давали нагреться до комнатной температуры и перемешивали в течение ночи. Добавляли триэтиламин, раствор упаривали досуха, оставляя смолу, которая распределялась между водой и дихлорметаном. Органический слой отделяли, сушили над безводным карбонатом кальция и упаривали. Остаток хроматографировали на основной окиси алюминия (элюент гексан: дихлорметан, 4:1 по объему). Получали 3-циано-4-циклобутил-1-(гекс-5-инил)-2,6,7-триоксабицикло[2.2.2] октан в виде твердого белого вещества. Данные приведены в табл.1. Данные по соединениям 1-91 приведены в табл.2, 3. Характеристические данные для триоксабициклооктанов и других бициклооктанов приведены в табл.4, 5. Прилагаемая табл.6 показывает значения ррm (частей на млн), при которых соединения являются активными. (А) За исключением соединений 9, 83 и 14, все соединения в заявке на Европатент N 300297 являются активными в отношении цикадки, однако ни одно из соединений в предшествующих патентах (патентах Европейского ведомства NN 211598, 216624 и 216625) не проявляет данную активность; (В) Все соединения в Европатенте N 300297 являются активными в отношении тли бобовой, однако только два соединения в предшествующих патентах проявляют данную активность; (С) Все соединения в Европатенте N 300297 являются активными в отношении блошки длинноусой, однако только некоторые соединения в предыдущих патентах проявляют эту активность. Во вторичных испытаниях соединения Европатента N 300297 в основном являются более активными. Di Diabrotica undecimpunetata (блошка длинноусая) Ма Macrostiles fascifraus (цикадка) Ар Aphis fabae (тля бобовая) Tu Tetranychus urticae (клещик паутинный двупятнистый) Sg Sitophilus granarius (взрослые (каландрины) Тс Tribolium castaneum взрослые (мучной хрущак) Рх Plutelia xylostella личинки (моль капустная) Мр Muzus persicae взрослые (тля персиковая) Bg Blattella germanica взрослые (таракан рыжый) Md Musca domestica взрослые (муха комнатная) (и) несинергизировано под действием пиперонилбутоксида. Обычно испытания на Blattella несинергизированы и испытания на Musca несинергизированы. H с соединением LAX формулы V, где L обозначает атом галогена, и R1-R2, Z, A и Х имеют вышеприведенные значения. Конденсация происходит в присутствии кислотного катализатора, например, минеральной кислоты, такой, как концентрированная соляная кислота или эфират трехфтористого бора и/или п-толуолсульфокислота. Реакцию удобно осуществлять при неэкстремальной температуре, например, от -70 до 150оС, и обычно, от -10 до 150оС. Реакцию соединения формулы (IV) c LAX можно осуществлять в присутствии сильного основания, такого, как бутиллитий, в инертном растворителе, таком, как простой эфир, и удобно, тетрагидрофуран, при неэкстремальной температуре, например, от -70 до 30оС. Соединения формулы (1) могут быть использованы для борьбы с вредителями, такими, как членистоногие, например, насекомые и акарицидные вредители, и паразитические черви, то есть, нематоды. Соединения формулы (1) представляют особенную ценность в защите полевых, фуражных, многолетних (на плантации), оранжерейных, садовых и виноградниковых культур, декоративных растений, а также плантациевых и лесных деревьев, например, хлебных злаков (таких, как кукуруза, пшеница, рис, сорго), хлопчатника, табака, овощей и салатов (таких, как бобовые, капуста, латук, лук, томаты и перец), полевых культур (таких, как картофель, сахарная свекла, земляной орех, соя культурная, репа), сахарного тростника, фуража (такого, как кукуруза, сорго, люцерна), плантациевых (таких, как чай, кофе, какао, банан, масличная пальма, кокосовый орех, каучук, специй), садовых и лесных (таких, как косточковые и односеменные плоды, цитрусовые, авокадо, манго, маслины и орехи), виноградниковых, декоративных растений, цветов и кустарников под стеклом и в садах и парках, деревьев (как опадающих, так и вечнозеленых) в лесах, плантациях и питомниках. Они также ценны при защите строевого леса (на корню, срубленного, переработанного или строительного) от нападения пильщиков (например, Urocerus) или жуков (например, околитидов, платиподидов, ликтидов, бострихидов, керамбицидов, анобиидов). Соединения формулы (1) также находят применение при защите хранящихся продуктов, таких, как зерно, фрукты, орехи, специи, табак, либо в целом виде, измельченном, либо в сформованном в продукты, от моли,жуков, клещей. Также защищают хранящиеся животные продукты, такие, как кожа, волос, шерсть и перья в натуральной или переработанной форме (например, в виде ковровых или текстильных изделий) от нападения моли и жуков, а кроме того защищают мясо и рыбу от нападения жуков, клещей и мух. Соединения общей формулы I представляют особую ценность в борьбе с членистоногими или гельминтами, которые губительны или действуют как переносчики заболеваний для людей и домашних животных, и особенно при борьбе с клещами, вшами, блохами, мелкими двукрылыми насекомыми и кусающими и назойливыми мухами. Стабилизаторы для предотвращения любой химической деградации, которая может случаться с соединениями настоящего изобретения,включают, например, антиокислители (такие, как токоферолы, бутилгидроксианизол и бутилгидрокситолуол) и поглотители (такие, как эпихлоргидрин) и органические или неорганические основания, например, триалкиламины, такие, как триэтиламин, который может воздействовать как стабилизатор основания и как поглотитель. Не ограничивая объема изобретения, прилагаемые ниже примеры иллюстрируют предпочтительные варианты осуществления изобретения. Все температурные значения приведены в оС. П р и м е р 1. 4-Трет-бутил-1-(гекс-5-инил)-2,6,7-триоксабицикло[2.2.2] октан. Смесь, состоящую из 2-трет-бутил-2-оксиметилпропан-1,3-диола (0,75) и триметилового эфира ортогепт-6-иновой кислоты (0,75 г), нагревают до 50оС до получения гомогенного состояния. Прибавляют одну каплю концентрированной соляной кислоты, и смесь нагревают до примерно 135оС в потоке азота в течение 10 мин. Затем смесь охлаждают и хроматографируют на глиноземе, используя в качестве элюента смесь дихлорметан: насыщенный аммиаком гексан, 1:6. Получают 4-трет-бутил-1-(гекс-5-инил)-2,6,7-триоксабицикло[2,2,2]октан в виде бесцветных кристаллов 0,38 г, перекристаллизованных из гексана). Аналогичным способом получают 1-(гекс-5-инил)-4-фенил-2,6,7-триоксабицик-ло[2,2,2]октан из 2-оксиметил-2-фенилпропан-1,3-диола. П р и м е р 2. 1-гекс-5-инил-4-н-пропил-2,6,7-тритиабицикло[2.2.2]октан. Раствор, содержащий риметиловый эфир ортогепт-6-иновой кислоты (6,0 г) в сухом метаноле (24 мл), перемешивают при 0оС в атмосфере азота. Прибавляют 2-меркаптометил-2-н-пропилпропан-1,3-дитиол (3,0 г) в сухом метаноле (10 мл), а затем добавляют метанол, насыщенный хлористым водородом (1,0 мл). После перемешивания 20 минут при 0оС прибавляют сухой триэтиламин (3,0 мл). Затем добавляют воду (100 мл), и смесь экстрагируют диэтиловым эфиром. Эфирные экстракты сушат над безводным сульфатом магния и упаривают в вакууме. Остаток хроматографируют на глиноземе с элюированием смесью дихлорметан:насыщенный аммиаком гексан, 1: 10. Летучие компоненты удаляют в вакууме (Kugelrohn при 130оС, давление 0,5 мм Hg). Остаток выкристаллизовывают из гексана. Получают 1-(гекс-5-инил)-4-н-пропил-2,6,7-тритиабицикло(2.2.2)-октан в виде бесцветных кристаллов (0,90 г). Используя аналогичную методику, по-лучают 4-этил-1-(гекс-5-инил)-2,6,7-тритиабицикло[2,2,2] октан и 4-изобутил-1- (гекс-5-инил)-2,6,7-тритиабицикло[2,2,2]-ок- тан из триметилортогепт-6-ината и 2-этил-2-меркаптометилпропан-1,3-дитиола и 2-изобутил-2-меркаптометилпропан-1,3-дитиола соответственно. П р и м е р 3. 4-Трет-бутил-(7-метоксигепт-5-нил)-2,6,7-триоксабицикло[2.2.2]ок-тан. (I) Хлоргидрат метилового эфира 5-бромпентаиминокислоты (т.пл. 89oС) полу- чают из 5-бромвалеронитрила. (II) Триметил 5-бромортопентанат (бесцветная жидкость, т.кип. 108-110оС, давление 16 мм Hg) получают из хлоргидрата метил-5-бромпентанимидата. (III) 1-(4-бромбутил)-4-трет-бутил-2,6,7-триоксабицикло[2,2,2]октан (т. пл. 111-115оС) получают из 5-бромортопентаната и 2-трет-бутил-2-оксиметилпропана-1,3-ди- ола. Масс-спектр (химическая ионизация):М+1 30 7, 309 (IV) К перемешанному раствору, содежащему безводный жидкий аммиак (70 мл) и сухой диэтиловый эфир (20 мл) прибавляют натрий (0,1 г) при -70оС в атмосфере азота. Через 10 минут к полученному темноголубому раствору прибавляют нитрат железа (15 мг). Реакционную смесь, которая становится зеленой, доводят до температуры 30оС и прибавляют небольшими порциями дополнительное количество натрия (0,75 г). Смесь перемешивают в течение 30 мин при -30оС и прибавляют метилпропаргилэфир (2,2 г). Смесь перемешивают еще час при -30оС и прибавляют 1-(4-бромбутил)-4-трет-бутил-2,6,7-триоксабицикло[2.2.2]ок- тан (1,0 г) в сухом диэтиловом эфире (50 мл). Смесь перемешивают при -30оС в течение 1 часа. Прибавляют твердый хлорид аммония (1,7 г), а затем метанол (5 мл), и реакционную смесь доводят до комнатной температуры. Добавляют воду (20 мл), и водную смесь экстрагируют диэтиловым эфиром. Эфирные экстракты сушат над безводным сульфатом магния и упаривают в вакууме. Остаток хроматографируют на глиноземе, используя в качестве элюента смесь дихлорметан: насыщенный аммиаком гексан, 1:9. 4-Трет-бутил-(7-метоксигепт-5-инил)-2,6,7-триоксабицикло[2.2.2] октан получают в виде бесцветного твердого вещества (т.пл. 47-49оС, рекристаллизованного из гексана). П р и м е р 4. 1-(бут-3-инилоксиметил)-4-н-пропил-2,6,7-триоксабицикло[2.2.2]ок-тан. I) Метансульфонилхлорид (74,0 г) прибавляют по каплям в течение 30 минут к раствору 2-оксиметил-2-н-пропилпропан-1,3-диола (28,0 г) в сухом пиридине (200 мл) в атмосфере азота при 0оС. Смесь нагревают до комнатной температуры. После перемешивания в течение 18 ч, смесь выливают в воду (200 мл) и экстрагируют хлороформом (2х200 мл). Экстракты хлороформа промывают водой (2х100 мл), сушат над безводным сульфатом магния и упаривают в вакууме с выходом твердого вещества коричневого цвета. Этот продукт перемешивают в простом диэтиловом эфире (200 мл) с получением 2-оксиметил-2-н-пропил-пропан- 1,3-диола триметансульфоната в виде белого твердого вещества (70,0 г, т.пл. 103,6оС). II) Тритиокарбонат натрия (18,0 г) (см. I.Org. Chem. Вып. 33, с. 1275, 1968) в воде ((25 мл) прибавляют к раствору, содержащему триметансульфонат 2-оксиметил-2-н-пропилпропан-1,3-диола (12,0 г) в диметилформамиде (100 мл). Смесь нагревают с обратным холодильником (130оС) в течение 4 ч с последующим охлаждением до комнатной температуры. После перемешивания в течение 18 часов, медленно прибавляют в течение 30 мин раствор разбавленной серной кислоты (50 мл). Смесь экстрагируют хлороформом. Полученные экстракты сушат над безводным сульфатом магния и упаривают в вакууме с выходом коричневой жидкости. Прибавляют гексан (200 мл), а затем смесь промывают водой (3х50 мл). Сушат над безводным сульфатом магния и после упаривания получают масло янтарного цвета (6,8 г). Неочищенное масло (6,4 г) в диэтиловом эфире (10 мл) прибавляют по каплям к суспензии алюмогидрата лития (3,0 г) в диэтиловом эфире (100 мл) при скорости, достаточной для поддержания орошения. После завершения введения алюмогидрата лития, смесь перемешивают еще 1 час, а затем осторожно прибавляют воду (3 мл). Вводят разбавленную серную кислоту (3 мл) и прибавляют воду (3 мл). Смесь фильтруют, твердый осадок промывают диэтиловым эфиром (50 мл), а затем объединенные экстракты сушат над безводным сульфатом магния. После упаривания в вакууме получают 2-меркаптометил-2-непропилпропан-1,3-диол в виде бледножелтого масла (5,3 г). III) Хлористый водород (газ) барботируют через суспензию параформальдегида (4,3 г) в бут-3-ин-1-оле (10,0 г) (фирмы "Aldrich") и сухого дихлорметана (30 мл) при -20оС в течение 30 минут. Смесь нагревают до комнатной температуры, а затем перемешивают еще 18 ч. Прибавляют холодную воду (30 мл), полученный органический слой отделяют, сушат над безводным хлоридом кальция, и после упаривания получают простой хлорметиловый эфир бут-3-инила в виде жидкости янтарного цвета (14,2 г). (IV) Смесь 2-меркаптометил-2-н-пропилпропан-1,3-дитиола (2,3 г) и триэтилового эфира ортомуравьиной кислоты (1,74 г) нагревают в сухом толуоле, содержащем паратолуолсульфокислоту, (5 мг) и этанол, полученного отгонкой. После охлаждения прибавляют толуол (15 мл), и полученную смесь промывают водой (2х10 мл). После сушки над безводным сульфатом магния и упаривания в вакууме получают светложелтое масло. Полученное масло экстрагируют диэтиловым эфиром (50 мл), и экстракты упаривают в вакууме с выходом белого твердого вещества. После очистки хроматографией на глиноземе, элюируя смесью дихлорметан: насыщенный аммиаком гексан, 1:10, получают 4-н-пропил-2,6,7-тритиабицикло[2.2.2]октан в виде белого твердого вещества (0,33 г, т.пл. 139оС). Масс-спектр (химическая ионизация: М+1 207). V) н-Бутиллитий (0,3 мл), 1,6 М раствор в гексане) прибавляют к раствору 4-н-пропил-2,6,7-тритиабицикло[2.2.2]октана (0,1 г) в сухом тетрагидрофуране (5 мл) при -70оС в атмосфере азота. Раствор перемешивают в течение 30 мин, и прибавляют простой хлорметиловый эфир бут-3-инила (0,58 г) в сухом тетрагидрофуране (2,0 мл), реакционную смесь нагревают до 20оС. Прибавляют воду (10 мл), а затем полученную смесь экстрагируют диэтиловым эфиром. Эфирные экстракты сушат над безводным сульфатом магния, и растворитель упаривают в вакууме. Остаток очищают хроматографией на глиноземе с элюированием смесью 1:10 ди- хлорметан: насыщенный аммиаком гексан. Получают 1-(бут-3-инилоксиметил)-4-н-пропил-2,6,7-тритиабицикло[2.2.2] октан в виде воскообразного твердого вещества 0,032 г). П р и м е р 5. 4-Трет-бутил-1-(гекс-5-инил)-2,6-диокса-7-тиабицикло[2.2.2]октан. 4-Трет-бутил-1-(гекс-5-инил)-2,6-диокса- 7-тиабицикло[2.2.2] октан получают из триметилового эфира ортогепт-6-иновой кислоты и 2,2-ди(оксиметил)-3,3-диме- тилбутан-1-тиола (см. описание к Европатенту N 216625) по методике, описанной в указанном патенте. П р и м е р 6. 4-(2,2-дихлорциклопропилметил)-1-(гекс-5-инил)-2,6,7-триоксабицик-ло [2.2.2]октан. I) Триацетат 2-оксиметил-2-(проп-2-енил)пропан-1,3-диола (2,2 г) нагревают до 130оС при перемешивании. Прибавляют трихлорацетат натрия (5,0 г) в течение 2 ч, а затем реакционную смесь нагревают до 155оС в течение 24 ч. Эфирные экстракты сушт над безводным сульфатом магния и упаривают в вакууме. Остаток очищают хроматографией на двуокиси кремния с элюированием смесью диэтиловый эфир:гексан, 1:4. Получают 2-(2,2-дихлорциклопропилметил)-2-дксиметилпропан-1,3-диола триацетат в виде бесцветного масла (1,4 г). Масс-спектр (химическая ионизация):аммиак в качестве ионизирующего газа, М+18 372. Составы 1. Эмульгируемый концентрат Соединение формулы (I) 10,00 Этилен КЕО 20,00 Ксилол 67,50 Бутиллированный гваякол 2,50 100,00 2. Смачиваемый порошок Соединение формулы (I) 25,00 Аттапульгит 69,50 Изопропилбензол- сульфонат натрия 0,50 Натриевая соль конден- сированной нафталин- сульфокислоты 2,50 Бутилированный окси- толуол 2,50 100,00 3. Дуст (порошок) Соединение формулы (I) 0,50 Бутилированный гваякол 0,10 Тальк 99,40 100,00 4. Приманка Соединение формулы (I) 40,25 Ледяной сахар 59,65 Бутилированный ок- ситолуол 0,10 100,00 5. Лак Соединение формулы (I) 0,1 Бутилат пиперонила 0,5 Бутилированный гваякол 10,1 Высокоароматический уайт-спирт 92,0 100,00 6. Аэрозоль Соединение формулы (I) 0,30 Бутилированный гваякол 0,10 1,1,1-трихлорэтан 4,00 Непахнущий керосин 15,60 Арктон 11/12, 50:50 смесь 80,00 100,00 7. Спрэй (раствор для опрыскивания) Соединение формулы (I) 0,1 Бутилированный гваякол 0,1 Ксилол 10,0 Непахнущий керосин 89,8 100,00 8. Спрэй с усиливающим действием Соединение формулы (I) 0,1 Бутилат пиперонила 0,5 Бутилированный гваякол 0,1 Ксилол 10,1 Непахнущий керосин 89,2 100,00 Биологическая активность Не ограничивая объема, следующие примеры иллюстрируют пестицидную активность соединений формулы (1). Испытания на действие растворов для опрыскивания Активность соединений предлагаемого изобретения испытывали при растворении заявленных соединений в ацетоне (5%), а затем разведении полученного раствора в смеси вода:Synperonic (94,5%0,5%) для получения водной эмульсии. Затем указанный раствор используют для обработки следующих вредителей-насекомых Musca donustica. 20 женских особей Musca помещают в картонный цилиндр с сеткой по обеим сторонам. Через сетку на насекомых распыляют раствор, содержащий испытуемое соединение. Через 48 часов при 25оС оценивают летальность. Следующие соединения проявляют активность при <1000 ч/млн:4, 5, 14, 20, 21, 22, 24, 24, 25, 26, 28, 32, 43, 44, 45, 50, 53, 54, 56, 69, 71, 72, 76, 77, 82, 83, 89. Следующие соединения проявляют пестицидную активность при <200 ч/млн. 6, 9, 10, 11, 12, 13, 15, 16, 17, 29, 30, 31, 33, 34, 46, 47, 48, 52, 57, 58, 59, 60, 61, 62, 63, 64, 65, 68, 74, 75, 78, 79, 80, 81, 83, 84, 85, 90. Sitophilus granaris и Tribolium costaneum. 20 имаго Sitophilus и Tribolium прибавляют к 10 г пшеницы, зерна которой предварительно обработаны 2 мл раствора, содержащего предлагаемые соединения. Смертность оценивали через 6 дней при 25оС. Следующие соединения проявляют пестицидную активность против Sitophilus granaris и при <1000 ч/млн. 7, 10, 19, 22, 23, 25, 26, 27, 32, 43, 44, 50, 56, 69, 82, 85, 89, 90. Следующие соединения проявляют активность против Sitophilus granaris при расходе <200 ч/млн: 3, 4, 5, 6, 9, 12, 14, 15, 16, 17, 29, 30, 31, 33, 34, 45, 47, 48, 53, 54, 57, 58, 60, 61, 62, 68, 72, 74, 75, 76, 77, 78, 79, 80, 81. Следующие соединения проявляют активность против Tribolium lastaneum в дозе <1000 ч/млн: 4, 6, 10, 14, 17, 33, 53, 57, 58, 65, 71, 76, 79, 82, 84. Следующие соединения проявляют активность в качестве пестицидов против Tribolium castaneum при <200 ч/млн: 9, 12, 15, 16, 34, 46, 63, 74, 75. Myzus persicae 10 имаго Myzus помещают на пластинку листка китайской капусты. Через 24 часа листовую пластинку опрыскивают раствором, содержащим испытуемое соединение. Смертность оценивают через 2 дня при 25оС. Следующие соединения проявляют пестицидную активность при дозе <1000 ч/млн: 4, 9, 17, 37, 46, 53, 56, 60, 71, 77, 78, 79, 80, 81, 84. Следующие соединения проявляют пестицидную активность в дозе <200 ч/млн: 6, 45, 47, 48, 57, 58, 59,62, 63, 74, 75, 76. Plutella xycostella 7 личинок Plutella опрыскивают раствором, содержащим испытуемое соединение и помещают на листок китайской капусты, который опрыскан аналогичным образом испытуемым соединением, и которому дают высохнуть. В альтернативном варианте 8-10 личинок Plutella помещают на пластинки листьев и опрыскивают раствором, содержащим испытуемое соединение. смертности подсчитывают через 2 дня при 25оС. Следующие соединения проявляют пестицидную активность при <1000 ч/млн: 15, 16, 25, 29, 31, 33, 34, 35, 48, 55, 56, 58, 59, 65, 68, 71, 75, 77, 78, 79, 80, 81, 83, 85, 87. Следующие соединения проявляют активность при дозе <200 ч/млн 9, 12, 13, 46, 57, 74. Tetranychus urticаe Пластины листьев, содержащие смешанную популяцию Tetranychus urticae опрыскивают раствором испытуемого соединения. смертности оценивают через 2 дня при 25оС. Следующие соединения проявляют активность в дозе <1000 ч/млн: 78, 81, 83, 90. Следующие соединения проявляют пестицидную активность в дозе <200 ч/млн. 60, 80. Дополнительные испытания на действие раствора для опрыскивания. Пестицидная активность предлагаемых соединений была исследована дополнительно. Соединения растворяют в ацетоне (75%), и затем прибавляют воду. Далее указанный раствор используют для опрыскивания следующих насекомых-вредителей: Aphis fabaе. Смешанную популяцию Aphis fabal испытывали на листьях настурции. Следующие соединения проявляют пестицидную активность в дозе <1000 ч/млн: 4, 6, 13, 16, 17, 25, 26, 29, 30, 31, 33, 46, 47, 50, 54, 63, 65. Macrosteles fascifrous Имаго Macrosteles fascifrous испытывали на ростках пшеницы. Следующие соединения проявляют активность в дозе <1000 ч/млн: 6, 9, 13, 16, 17, 23, 25, 26, 29, 31, 33, 34, 46, 47, 63, 65, 68. Tetranychus urticae Смешанную популяцию Tetranychus urticae испытывали на листьях бобовых. Следующие соединения проявляют активность в дозе <1000 ч/млн: 5, 9, 16, 30, 33, 31, 46, 47, 50, 65, 68. Diabrotica undecimpumtata в третьей стадии развития подвергают испытанию на фильтровальной бумаге. Следующие соединения проявляют пестицидную активность в дозе <1000 ч/млн: 3, 4, 5, 6, 13, 16, 17, 23, 26, 29, 30, 31, 33, 34, 46, 47, 53, 63, 65, 68. Испытания на местное применение Активность предлагаемых соединений против неанестезированной женской особи обыкновенной мухи Musca Lomestica (WRL-линии) показана при местном применении на испытуемом насекомом раствора, содержащего испытуемое соединение и бутилат пиперонила в бутаноле. Смертность оценивали через 48 часов. Следующие соединения проявляют пестицидную активность в дозе 1 мкг: 9, 10, 11, 12, 13, 15, 17, 29, 30, 31, 33, 34, 47, 52, 63, 64, 68, 83, 84, 85. Активность предлагаемых соединений против анестезированной мужской особи Periplaneta americana продемонстрирована при местном применении на испытуемом насекомом раствора, содержащего испытуемое соединение в бутаноне. Смертность оценивают через 6 дней. Следующие соединения проявляют активность в дозе <50 мкг: 2, 6, 16, 17, 25, 31, 39, 83. Пестицидную активность предлагаемых соединений против анестезированной мужской особи Blatelba germanica продемонстрирована путем местного применения на испытуемом насекомом раствора, содержащего испытуемое соединение в бутаноне. Смертность определяют через 6 дней. Следующие соединения проявляют пестицидную активность в дозе <5 мкг: 6, 9, 12, 14, 15, 16, 17, 20, 29, 30, 31, 33, 34, 45, 46, 48, 56, 57, 58, 59, 60, 61, 62, 63, 65, 66, 71, 72, 74, 75, 83, 84, 90. Нематоцидная активность Meloidogyne imognita Отобранные соединения предлагаемого изобретения анализировали на только что вылупившейся нематоде Meloidogyne imognita 2. Испытуемый раствор содержит смесь 1% ацетона со 100 ч/млн. Тритона Х-100. Нематоцидную активность определяют через 24 часа. Следующие соединения проявляют активность в дозе <100 ч/млн: 6, 16, 17, 26. Токсичность относительно млекопитающих Токсичность предлагаемых соединений устанавливают при оральной интубации мыши Charles niber CDL голодавшей 3 часа. Испытуемые соединения вводят в виде растворов в ДМСО в дозе 200 мг/10 мл/мг, 20 мг/10 мл/кг и 2 мг/10 мл/мг. Токсичность определяют через 14 дней после приема. Следующие соединения проявляют токсичность с LD50 200 мкг-1. 17, 60. Следующие соединения проявляют токсичность с LD50 в интервале 20-200 мгкг-1. 16, 75. П р и м е р 7. 3-Циано-4-циклобутил-1-(гекс-5-инил)-2,6,7-триоксабицикло[2.2.2] октан. (I) К перемешиваемой суспензии хлорхромата пиридиния в сухом дихлорметане добавляли 3-циклобутил-3-гидроксиметилоксетан. Смесь перемешивали в течение 2 часов, разбавляли диэтиловым эфиром и затем очищали на колонке из флорсила, элюируя эфиром. Выпаривание, давало 3-циклобутил-3-формилоксетан в виде жидкости. (II) К перемешиваемому раствору 3-циклобутил-3-формилоксетана и гепт-6-иноилхлорида в эфире при 0о добавляли раствор цианида натрия в воде. Раствор оставляли перемешиваться на ночь при комнатной температуре, затем промывали водой, и органический слой сушили над безводным сульфатом магния и упаривали. Остаток хроматографировали на двуокиси кремния, предварительно обработанной гексаном, содержащим 1% триэтиламина, элюируя смесью гексан-дихлорметан в соотношении по объему от 9:1 с увеличением до 3:7. Получили 1-циано-1-(3-циклобутилоксетан-3-ил)метил-гент-6-иноат. (III) Эфират трехфтористого бора добавляли при -70о в атмосфере азота к перемешиваемому раствору 1-циано-1-(3-циклобу- тилоксетан-3-ил)метил-гепт-6-иноата в сухом дихлорметане. Раствору давали нагреться до комнатной температуры и перемешивали в течение ночи. Добавляли триэтиламин, раствор упаривали досуха, оставляя смолу, которая распределялась между водой и дихлорметаном. Органический слой отделяли, сушили над безводным карбонатом кальция и упаривали. Остаток хроматографировали на основной окиси алюминия (элюент гексан: дихлорметан, 4:1 по объему). Получали 3-циано-4-циклобутил-1-(гекс-5-инил)-2,6,7-триоксабицикло[2.2.2] октан в виде твердого белого вещества. Данные приведены в табл.1. Данные по соединениям 1-91 приведены в табл.2, 3. Характеристические данные для триоксабициклооктанов и других бициклооктанов приведены в табл.4, 5. Прилагаемая табл.6 показывает значения ррm (частей на млн), при которых соединения являются активными. (А) За исключением соединений 9, 83 и 14, все соединения в заявке на Европатент N 300297 являются активными в отношении цикадки, однако ни одно из соединений в предшествующих патентах (патентах Европейского ведомства NN 211598, 216624 и 216625) не проявляет данную активность; (В) Все соединения в Европатенте N 300297 являются активными в отношении тли бобовой, однако только два соединения в предшествующих патентах проявляют данную активность; (С) Все соединения в Европатенте N 300297 являются активными в отношении блошки длинноусой, однако только некоторые соединения в предыдущих патентах проявляют эту активность. Во вторичных испытаниях соединения Европатента N 300297 в основном являются более активными. Di Diabrotica undecimpunetata (блошка длинноусая) Ма Macrostiles fascifraus (цикадка) Ар Aphis fabae (тля бобовая) Tu Tetranychus urticae (клещик паутинный двупятнистый) Sg Sitophilus granarius (взрослые (каландрины) Тс Tribolium castaneum взрослые (мучной хрущак) Рх Plutelia xylostella личинки (моль капустная) Мр Muzus persicae взрослые (тля персиковая) Bg Blattella germanica взрослые (таракан рыжый) Md Musca domestica взрослые (муха комнатная) (и) несинергизировано под действием пиперонилбутоксида. Обычно испытания на Blattella несинергизированы и испытания на Musca несинергизированы.
ФОРМУЛА ИЗОБРЕТЕНИЯСПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОБИЦИКЛОАЛКАНОВ общей формулы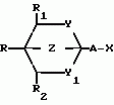 где Y и Y1 0 или S; Z1 CH2O или CH2S; R1 водород, R2 водород, C1 C3 алкил, незамещенный или замещенный галогеном или цианогруппой; A X содержит 3 20 атомов углерода, где X водород, A - C2-C12-алкил с прямой или разветвленной цепью, незамещенный или замещенный C1 C6 алкинилом, C1-C6 -алкинолоксигруппой, C1 C6-алкинилтиогруппой, C1-C6-алкинилоксииминогруппой или C1-C6-алкинилоксикарбонильной группой, C2-C6-алкенил, незамещенный или замещенный галогеном; C2-C12-алкенил, незамещенный или замещенный гидроксигруппой, C1-C6-алкоксигруппой или Si (CH3)3-группой, C2-C12-алкинил, незамещенный или замещенный C1-C6-алкоксигруппой или Si (CH3)3-группой, C1-C6-алкинилоксикарбонил, N-(C1-C6-алкинил)карбамоил или N-(C1-C2-алкинил)ацетамидогруппа; R-C1-C6-алкил, незамещенный или замещенный C1-C6-алкоксигруппой, C2-C6-алкенил;С3-С6-циклоалкил, незамещенный или замещенный галогеном, отличающийся тем, что соединение общей формулы где Y и Y1 0 или S; Z1 CH2O или CH2S; R1 водород, R2 водород, C1 C3 алкил, незамещенный или замещенный галогеном или цианогруппой; A X содержит 3 20 атомов углерода, где X водород, A - C2-C12-алкил с прямой или разветвленной цепью, незамещенный или замещенный C1 C6 алкинилом, C1-C6 -алкинолоксигруппой, C1 C6-алкинилтиогруппой, C1-C6-алкинилоксииминогруппой или C1-C6-алкинилоксикарбонильной группой, C2-C6-алкенил, незамещенный или замещенный галогеном; C2-C12-алкенил, незамещенный или замещенный гидроксигруппой, C1-C6-алкоксигруппой или Si (CH3)3-группой, C2-C12-алкинил, незамещенный или замещенный C1-C6-алкоксигруппой или Si (CH3)3-группой, C1-C6-алкинилоксикарбонил, N-(C1-C6-алкинил)карбамоил или N-(C1-C2-алкинил)ацетамидогруппа; R-C1-C6-алкил, незамещенный или замещенный C1-C6-алкоксигруппой, C2-C6-алкенил;С3-С6-циклоалкил, незамещенный или замещенный галогеном, отличающийся тем, что соединение общей формулы 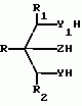 где R, R1, R2, Y, Y1 и Z имеют указанные значения, подвергают взаимодействию с соединением общей формулы III (AlkO)3CT где Alk C1-C4-алкил; T AX или водород, а затем, в случае, когда T водород, а Y и Y1 сера, полученное соединение общей формулы где R, R1, R2, Y, Y1 и Z имеют указанные значения, подвергают взаимодействию с соединением общей формулы III (AlkO)3CT где Alk C1-C4-алкил; T AX или водород, а затем, в случае, когда T водород, а Y и Y1 сера, полученное соединение общей формулы 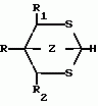 где R, R1, R2 и Z имеют указанные значения, подвергают взаимодействию с соединением формулы LAX, где L галоген; AX имеет указанные значения. Приоритет по признакам: 22.07.87 при Y и Y1 0 или S; Z CH2O или CH2S; R1 водород; R2 водород, C1 C3-алкил, незамещенный или замещенный галогеном или цианогруппой; R C1 - C6-алкил, незамещенный или замещенный C1 - C6-алкоксигруппой, C2 C6-алкенил, C3 C6-циклоалкил, незамещенный или замещенный галогеном; X водород, A - C2 C8-алкил с прямой или разветвленной цепью, незамещенный или замещенный C1 C6-алкинилом, C1 - C6-алкинилкарбонильной группой, C2 C6-алкенил, незамещенный или замещенный алкоксигруппой или Si (CH3)3-группой. 07.10.87 при Y, Y1, Z, R и R1, имеющими указанные значения; R2 C2 C6-алкенил, незамещенный или замещенный галогеном. 26.04.88 при Y, Y1, Z, R и R1, имеют указанные значения, R2 C2 C6-алкенил, незамещенный или замещенный гидроксигруппой или Si (CH3)3-группой, C2 - C6-алкинилоксикарбонил, N=(C1 C6-алкинил)карбомоил или N=(C1 C6-алкинил)ацетамидогруппа. где R, R1, R2 и Z имеют указанные значения, подвергают взаимодействию с соединением формулы LAX, где L галоген; AX имеет указанные значения. Приоритет по признакам: 22.07.87 при Y и Y1 0 или S; Z CH2O или CH2S; R1 водород; R2 водород, C1 C3-алкил, незамещенный или замещенный галогеном или цианогруппой; R C1 - C6-алкил, незамещенный или замещенный C1 - C6-алкоксигруппой, C2 C6-алкенил, C3 C6-циклоалкил, незамещенный или замещенный галогеном; X водород, A - C2 C8-алкил с прямой или разветвленной цепью, незамещенный или замещенный C1 C6-алкинилом, C1 - C6-алкинилкарбонильной группой, C2 C6-алкенил, незамещенный или замещенный алкоксигруппой или Si (CH3)3-группой. 07.10.87 при Y, Y1, Z, R и R1, имеющими указанные значения; R2 C2 C6-алкенил, незамещенный или замещенный галогеном. 26.04.88 при Y, Y1, Z, R и R1, имеют указанные значения, R2 C2 C6-алкенил, незамещенный или замещенный гидроксигруппой или Si (CH3)3-группой, C2 - C6-алкинилоксикарбонил, N=(C1 C6-алкинил)карбомоил или N=(C1 C6-алкинил)ацетамидогруппа.Популярные патенты: 2260932 Способ уборки льна и тресты при неблагоприятных погодных условиях ... с использованием рулонного пресс-подборщика, при перемещении которого по полю подбирающий барабан поднимает одновременно две ленты стеблей льна, разостланные комбайном. Совмещенные ленты поступают в прессовальную камеру. По мере ее заполнения производят обвязку сдвоенного рулона и выбрасывание его на землю [4, 5]. В качестве недостатка способа рулонирования стеблей лубяных культур, например льна, необходимо отметить то, что он не ориентирован и на применение при неблагоприятных погодных условиях уборки льнотресты. В то же время в Российской Федерации большинство льна возделывается в зоне рискованного земледелия, где в период уборки тресты часто стоит дождливая погода. В нашей ... 2177223 Блесна ... изгибания в различных направлениях. 12. Блесна по п.1, отличающаяся тем, что блестящий элемент соединен с цевьем и поддевом крючка неподвижно. 13. Блесна по п.1, отличающаяся тем, что блестящий элемент соединен с цевьем и поддевом крючка путем огибания блестящего элемента вокруг цевья и поддева крючка частично и/или полностью. 14. Блесна по п.1, отличающаяся тем, что блестящий элемент соединен с цевьем и поддевом крючка посредством пайки, сварки, склейки, склепки. 15. Блесна по п.1, отличающаяся тем, что блестящий элемент выполнен по меньшей мере из одного или более слоев из различных материалов с различной удельной массой. MM4A Досрочное прекращение действия патента ... 2016512 Средство для борьбы против стресса у рыб и способ борьбы со стрессом у рыб ... сильного дождя и т.п. Результаты и обсуждение теста заражения. Результаты опытов показаны на фиг.1-6 следующим образом. Каждая фигура показывает число зараженных рыб в группе контроля и в группе, обработанной ТБА, и число мертвых рыб (только среди контрольных рыб, так как никакая смертность не была отмечена в группе, обработанной ТБА). День 0 - день для опыта стресса. Фиг.1 - опыт стресса : 30 с на 5 рыбах. Фиг.2. - опыт стресса : 30 с на 10 рыбах. Фиг.3 - опыт стресса : 60 с на 5 рыбах. Фиг.4 - опыт стресса : 60 с на 10 рыбах. Фиг.5 - опыт стресса : 120 с на 5 рыбах. Фиг.6 - опыт стресса : 120 с на 10 рыбах. а) Тенденция, отмеченная в контрольной группе. Для того же числа рыб, ... 2250583 Агрегат дернинный комбинированный ... аппаратами и их приводом, семянаправители, прикатывающие катки, состоит из двух дисков, формирующих вертикальные стенки полосы и расположенных по ширине друг от друга на расстоянии равном, ширине обрабатываемой полосы фрезерных рабочих органов дернинной сеялки, и смещенных относительно друг друга в направлении движения агрегата на расстояние не менее радиуса диска, а перед подпружиненными секциями рабочих органов по середине полосы установлены щелерезы-камнеудалители.Качественное и локальное внесение удобрений при изменении глубины обработки щелерезами-камнеудалителями достигается за счет того, что на щелерезах-камнеудалителях закреплены туконаправители с возможностью осевых ... 2195808 Способ хранения корнеплодов, картофеля и капусты ... 2, но картофель сорта Домодедовский ранний закладывали при температуре 26-29oС. Результат приведен в таблице. Пример 4. Все операции осуществляют по примеру 2, но вместо сульфатного отвердителя берут хлоридный (соляную кислоту HCl, хлористый аммоний). Результаты приведены в таблице. Они показали, что температура в бурте снизилась до +10oС, убыль массы резко сократилась. Это объясняется как выделением углекислого газа, так и образованием хлористого кальция, сопровождающихся поглощением тепла. Последнее происходит и в результате повышения его концентрации при испарении влаги. Пример 5. Все операции проводят так же, как и в примере 4, но в качестве отвердителя берут насыщенный ... |
Еще из этого раздела: 2201663 Устройство для ориентированной посадки лука 2484613 Способ создания почвенно-растительного покрова при рекультивации нарушенных земель 2438304 Улей 2464784 Защитный слой для растений и деревьев, его изготовление и его применение 2100354 Макроциклический лактон, фармацевтическая композиция, обладающая антибиотической активностью, и инсектоакарицидная композиция 2287923 Роторный энергосберегающий мостовой агрегат для сельскохозяйственных работ 2464765 Сепарирующее устройство корнеклубнеуборочной машины 2201069 Травяное покрытие на основе гибкого полотна 2048055 Устройство для отрезания и погрузки сенажа и силоса 2076594 Установка для промышленного разведения дождевых червей |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||