1-алкокси-2,7-диметилокта-2,7-диены, обладающие акарицидной активностью, и способ их полученияПатент на изобретение №: 2496763 Автор: Петрушкина Елена Алексеевна (RU), Хомишин Дмитрий Владимирович (UA), Мысова Надежда Евгеньевна (RU), Перегудов Александр Сергеевич (RU), Енгашева Екатерина Сергеевна (RU) Патентообладатель: Федеральное государственное бюджетное учреждение науки Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук (ИНЭОС РАН) (RU) Дата публикации: 27 Октября, 2013 Начало действия патента: 21 Сентября, 2012 Адрес для переписки: 119991, Москва, В-334, ГСП-1, ул. Вавилова, 28, ИНЭОС РАН, патентный отдел Изобретение относится к новым соединениям общей формулы
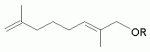
Изобретение относится к химии терпеновых соединений, а именно к новым соединениям 1-алкокси-2,7-диметилокта-2,7-диенам, конкретно к 1-(3-метил-бутилокси)-2,7-диметилокта-2,7-диену, 1-(бут-2-енилокси)-2,7-диметилокта-2,7-диену и 1-(3,7-диметил-окта-2,6-диенилокси)-2,7-диметилокта-2,7-диену, общей формулы
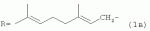
где R=(CH3)2CHCH 2CH2- (1а); R=CH3CH=CHCH2 - (1б);
Заявляемые соединения наиболее эффективно могут быть использованы в ветеринарии и сельском хозяйстве в качестве акарицидов. Заявляемые соединения, их свойства и способ получения в литературе не описаны. Известны акарицидные препараты, действующим началом которых являются пиретроиды (флувалинат, флуметрин, акринатрин), формамины (амитраз), бензилаты (бромпропилат), фосфорорганические соединения (кумафос), фенолы (тимол), органические кислоты, эфирные масла. В России наиболее широкое применение имеют препараты на основе флувалината (пиретроид) и амитраза (формамин). Известно, что перечисленные химические соединения токсичны для животных и это ограничивает возможности использования их в ветеринарии. Известны нетоксичные соединения терпенового ряда, обладающие биологической активностью (инсектицидной, фунгицидной и антибактериальной), которые не вызывают появление резистентных к ним организмов. Однако до сих пор неизвестны индивидуальные соединения монотерпенового ряда, проявляющие акарицидную активность в отношении клещей, паразитирующих на животных. Против клещей, паразитирующих на растениях, обычно используют экстракты растений, содержащих терпеноиды (Вот FS, Bianco ЕМ, da Camara СА. Acaricidal and repellent activity of terpenoids from seaweeds Collected in Pemambuco, Brazil. Nat Prod Commun. 2012 Apr; 7(4): 463-6.). Известно, что против иксодовых клещей, паразитирующих на человеке, проявляет умеренную активность сложный пентациклический тритерпен - урсоловая кислота, вьщеляемая из растительного сырья (Annan K, Jackson N, Dickson RA, Sam GH, Komlaga G. Acaricidal effect of an isolate from Hoslundia opposita vahl against Amblyomma variegatum (Acari: Ixodidae). Phcog Res 2011; 3: 185-8). Однако нет данных по акарицидной активности простых эфиров, содержащих монотерпеновые заместители. Поиск новых акарицидов среди нетоксичных соединений монотерпенового ряда представляется перспективным. Наиболее близкими по структуре к заявляемым соединениям являются терпеновые эфиры, полученные при теломеризации изопрена с аллиловым и бензиловым спиртами, в присутствии каталитической системы ( В случае высших спиртов образуется неразделимая смесь изомерных теломеров, точный состав которой определить не удалось (Захаркин Л.И., Гусева В.В., Петровский П.В. Простой синтез формиата (±)-2,6-диметилоктан-1-ола, биологически активного аналога агрегационного феромона малого мучного хрущака, из 1-аллилокси- и 1-бензилокси-2,б-диметил-2,7-диенов - теломеров изопрена с аллиловым и бензиловым спиртами // Изв. АН Сер. хим. 1995. Описано несколько способов получения простых эфиров, содержащих один монотерпеновый заместитель. Так, например, линалилаллиловый эфир был получен аллилированием линалоола бромистьш аллилом в присутствии NaH в безводном ДМФА (Н.В. Ammar, J.Le Notre, M. Salem, M.Т. Kaddachi, L. Toupet, J.-L. Renaud, C. Bmneau, P.Н. Dixneuf Eur. J. Inorg. Chem. 2003, 4055-4064). Недостатком указанного способа является использование взрывоопасного гидрида натрия, для работы с которым требуется специальное оборудование, и бромистого аллила, который является лакриматором. Известны способы получения терпенил-акил(С1-С 4), -алкенил(С3-С4), -галоалкил(С 3), -алкинил(С3) эфиров, описанные в патенте US 4173543 (1979): (1) эфиры получают с низкими выходами реакцией терпеновых спиртов с низшими алкил-, алкенил-, галоалкил-, алкиниловыми спиртами в присутствии пара-толуолсульфокислоты и (2) путем взаимодействия терпеновых спиртов с сульфатами низших спиртов в присутствии гидрида натрия в безводном ДМФА. Недостатками этих способов являются невысокие выходы и использование взрывоопасного гидрида натрия. Основными недостатками известных способов получения терпеновых простых эфиров являются необходимость использования палладиевых катализаторов и образование изомерных трудноразделимых смесей, использование опасных (гидрид натрия), токсичных (аллил бромистый) или дорогостоящих (комплексы палладия) реагентов. Описано алкилирование фенольного гидроксила морфина четвертичными солями аммониевьми солями триалкиланилинов (алкил - метил, этил, бензил) (Rodionow W.M. Les ethers alcoyliques des acides sulfoaromatiques comme agents d'alcoylation // Bull. Soc. Chim. Fr. 1929. V.45. 4. P.109-121 и Родионов В.М. Значение алкильных фрагментов ароматических сульфокислот для алкилирования органических соединений // Избранные труды Изд. АН СССР. 1958. С.32-48), но при этом не происходит алкилирования аллильной спиртовой группы. До сих пор не было известно об использовании четвертичных аммониевых солей для алкилирования гидроксильной группы алифатических спиртов. Триалкилфениламмониевые соли, содержащие терпеновый заместитель, не могут быть использованы для алкилирования, так как такие соли не могут быть получены (разлагаются при получении) (Захаркин Л.И., Петрушкина Е.А. // Изв. АН СССР. Сер. Хим. 1986 Задачей настоящего изобретения является получение ранее неизвестных простых эфиров, содержащих терпеновый заместитель, а именно 1-(3-метил-бутилокси)-2,7-диметилокта-2,7-диена, 1-(бут-2-енилокси)-2,7-диметилокта-2,7-диена и 1-(3,7-диметил-окта-2,6-диенилокси)-2,7-диметилокта-2,7-диена, которые проявляют акарицидную активность и разработка способа их получения из коммерчески доступного сырья. Поставленная задача решается получением новых соединений формулы 1
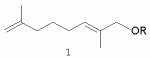
где -R=(CH3)2CHCH 2CH2- (1a); -R=CH3 CH=CHCH2- (1б);
обладающих акарицидной активностью, и способом получения заявляемых соединений путем взаимодействия соответствующих спиртов с четвертичными терпениламмониевыми солями такими как N-(2,7- диметил-2,7-октадиен-1-ил)аллилдиэтиламмоний бромид, N-(2,7-диметил-2,7-октадиен-1-ил)аллилпиперидиний бромид и N-(2,7-диметил-2,7-октадиен-1-ил)метилдиэтиламмоний иодид в присутствии NaOH. Заявляемый способ является оригинальным и базируется на ранее неизвестной некаталитической реакции аллилирования спиртов терпениламмониевыми солями. Показано, что аллилирование изоамилового спирта (2а) действием солей, таких, как N-(2,7-диметил-2,7-октадиен-1-ил)аллилпиперидиний бромид (3д), N-(2,7-диметил-2,7-октадиен-1-ил)метилдиэтиламмоний иодид (3е); кротилового спирта (2б) действием N-(2,7-диметил-2,7-октадиен-1-ил)аллилпиперидиний бромида (3д), а также аллилирование гераниола (2в) действием N-(2,7-диметил-2,7-октадиен-1-ил)аллилдиэтиламмоний бромида (3г) и N-(2,7-диметил-2,7-октадиен-1-ил)аллилпиперидиний бромида (3д) в присутствии 10 эквивалентов NaOH в соответствующем кипящем спирте или при 150°C в случае гераниола, простые эфиры 1-(3-метил-бутилокси)-2,7-диметилокта-2,7-диен (1а), 1-(бут-2-енилокси)-2,7-диметилокта-2,7-диен (1б) и 1-(3,7-диметил-окта-2,6-диенилокси)-2,7-диметилокта-2,7-диен (1в) (MS-GC и ЯМР) (Схема 1). Имеет место реакция аллилирования спиртов (2а-в) солями (3г-3е) в присутствие NaOH и в отсутствие катализатора. Схема 1 Было исследовано влияние алкильных заместителей уходящей аммониевой группы на выход реакции в случае изоамилового спирта и гераниола. Наиболее эффективными реагентами являются соли (3г, 3д), при их применении реакция происходит наиболее селективно без образования побочных продуктов. В Табл.1 представлены результаты применения способа для получения заявляемых соединений (1а-в) при варьировании солей и условий реакции. Оказалось, что пиперидиновая соль (3д) позволила получить с высоким выходом (97%) эфир (1в). Увеличение времени нагревания не приводит к существенному увеличению выходов эфиров (1б) и (1в). Соли (3г-е) получают известным двухстадийным способом, включающим теломеризацию изопрена с пиперидином или диэтиламином в присутствии Pd(асас) 2-Ph3P в растворе MeCN с образованием N-(2,7-диметилокта-2,7-диен-1-ил)пиперидина или диэтиламина с выходом 80-95% и последующую их кватернизацию действием соответствующего галоидного алкила при комнатной температуре в течение 2-3 дней. Целевые соли (3г-е) получают с выходом 75-90% (Петрушкина Е.А., Захаркин Л.И. "Синтез новых синтетических регуляторов роста растений - изомерных 1-(диметилоктил), 1-алкилпиперидиний и морфолиний галогенидов на основе теломеризации изопрена со вторичными аминами" ЖОХ. 2003. Т.73. Вып.10. С.1747-1752.). Таблица 1 Влияние условий проведения реакции и структуры солей (3г-е) на выход реакцииАммониевая соль (3г-е)R3OH (соотношение (3г-е)/(2а-в) Т °С,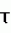 чВыход (1а-в), % 3дИзоамиловый спирт (1/25) Т. кип., 1(1a) 40 3еИзоамиловый спирт (1/25)Т. кип., 1 (1a) 83е Изоамиловый спирт (1/25)Т. кип., 6,5 (1a) 203д Кротиловый спирт (1/42) Т. кип., 1(1б) 10 3гГераниол (1/2) 150,1(1в) 57 3дГераниол (1/2) 150,1(1в) 97 чВыход (1а-в), % 3дИзоамиловый спирт (1/25) Т. кип., 1(1a) 40 3еИзоамиловый спирт (1/25)Т. кип., 1 (1a) 83е Изоамиловый спирт (1/25)Т. кип., 6,5 (1a) 203д Кротиловый спирт (1/42) Т. кип., 1(1б) 10 3гГераниол (1/2) 150,1(1в) 57 3дГераниол (1/2) 150,1(1в) 97Предлагаемый способ позволяет получать заявляемые соединения (1а-в) путем прямого алкилировании спиртов такими солями как N-(2,7-диметил-2,7-октадиен-1-ил)аллилдиэтиламмоний бромид, N-(2,7-диметил-2,7-октадиен-1-ил)аллилпиперидиний бромид и N-(2,7-диметил-2,7-октадиен-1-ил)метилдиэтиламмоний иодид в отсутствие катализаторов и растворителей. Заявляемый способ получения простых терпеновых эфиров не требует использования пожаро- и взрывоопасных реагентов, токсичных веществ и дорогих катализаторов. Заявляемый способ базируется на новой, ранее не описанной реакции аллилирования спиртов терпениламмониевыми солями, обнаруженной авторами изобретения. Заявляемые соединения - 1-(3-метил-бутилокси)-2,7-диметилокта-2,7-диен, 1-(бут-2-енилокси)-2,7-диметилокта-2,7-диен и 1-(3,7-диметил-окта-2,6-диенилокси)-2,7-диметилокта-2,7-диен, общей формулы 1, проявляют высокую акарицидную активность в отношении куриных клещей Dermanyssus gallinae и иксодовых клещей крупного рогатого скота Hyalomma scupense. Изобретение иллюстрируется приведенными ниже примерами. Пример 1. Получение 1-(3-метил-бутилокси)-2,7-диметилокта-2,7-диена (1a). В двухгорлую колбу с обратным холодильником, в токе аргона вносят 0.94 г соли N-(2,7-диметил-2,7-октадиен-1-ил)аллилпиперидиний бромида (3д), 1.1 г NaOH и 8 мл изоамилового спирта. Реакцию проводят при перемешивании при температуре кипения в течение 1 часа. После нагревания реакционную смесь разбавляют водой, продукт экстрагируют эфиром. Продукты разделяют колоночной хроматографией на силикагеле. В качестве элюента используют смесь гексан-эфир возрастающей полярности. Эфир (1а) получен с выходом 40%. Спектр ПМР (600,22 МГц, CDCl3, Спектр ЯМР 13С (150,93 МГц, CDCl3 , Для отнесения сигналов в спектрах ЯМР 1 Н и 13С применяют двумерные гомо- (Н,Н) и гетеро- (Н,С) корреляционные методики, использующие импульсные полевые градиенты - gs-COSY, gs-HMQC и gs-HMBC. Масс-спектр (m/z, I, %): M+ 224(20), 168(30), 136(100), 121(75), 107(30), 95(70), 81(85), 71(100), 55(60). Пример 2. Получение 1-(бут-2-енилокси)-2,7-диметилокта-2,7-диена (1б). Эфир (1б) получают по методике, аналогичной описанной в примере 1, из 0.94 г N-(2,7-диметил-2,7-октадиен-1-ил)аллилпиперидиний бромида (3д), 1.1 г NaOH и 7 мл кротилового спирта при температуре кипения в течение 1 часа с выходом 10%. Спектр ПМР (CDCl3, Масс-спектр (m/z, I, %): M+ 208(1), 153(1), 136(20), 121(10), 107(5), 95(100), 81(25), 69(23), 55(75). Пример 3. Получение 1-(3,7-диметил-окта-2,6-диен-1-илокси)-2,7-диметилокта-2,7-диена (1в). Эфир (1в) получают по методике, описанной в примере 1 из 0.94 г N-(2,7-диметил-2,7-октадиен-1-ил)аллилпиперидиний бромида (3д), 1.1 г NaOH и 1 мл гераниола при 150°С в течение 1 часа с выходом 97%. Спектр ПМР (CDCl3 , Масс-спектр (m/z, I, %): M+ 153(10), 136(10), 123(30), 109(5), 95(40), 81(50), 69(100), 55(20). Пример 4. Испытания на акарицидную активность соединений (1а-в) проводили в экспериментах in vitro на куриных клещах Dermanyssus gallinae. Клещей распределяли по стадиям развития в разные бюксы и хранили при температуре 20°С. При проведении опытов, на дно чашек Петри предварительно наносили водные растворы терпеноидов (1а-в), затем на обработанное дно чашек Петри помещали личинки, нимфы и имаго клещей D. Gallinae. Опыты проводили в течение 2 суток при 20°С. Определение жизнеспособности и фиксацию изменений морфологии клещей проводили каждые 8 часов путем просмотра чашек Петри под лупой МБС-1. Результаты представлены в Таблице 2. После гибели объектов разрушение хитина продолжалось. Таблица 2 Исследование водно-спиртовых растворов соединений 1а-в на на куриных клещах Dermanyssus gallinae in vitro МатериалРезультаты  пробысоединение стадия развития клещагибель окрасИзменение структуры хитина Морфологические изменения внутренних органов 11a10 личинок Через 8 чкоричневый Плавление (укорочение) конечностей, плавление (деформация) хитинового покрова, в двух случаях полный лизис объекта+ 21a10 нимф Через 8 чкоричневый Плавление (укорочение) конечностей, плавление (деформация) хитинового покрова+ 31a 10 имагоЧерез 8 ч Насыщенно-коричневыйПлавление (укорочение) конечностей, плавление (деформация) хитинового покрова +41б 10 личинокЧерез 8 чжелто-коричневый Плавление (укорочение) конечностей, плавление (деформация)хитинового покрова+ 51б10 нимф Через 8 чжелто-коричневый Плавление (укорочение) конечностей, плавление (деформация) хитинового покрова+ 61б 10 имагоЧерез 16 ч коричневыйПлавление (укорочение) конечностей, плавление (деформация) хитинового покрова +71в 10 личинокЧерез 8 чнормальныйПлавление (укорочение) конечностей, плавление (деформация) хитинового покрова +8 1в10 нимфЧерез 16 чнормальный Плавление (укорочение) конечностей, плавление (деформация) хитинового покрова+ 91в10 имаго Через 16 чнормальный Плавление (укорочение) конечностей, плавление (деформация) хитинового покрова+ пробысоединение стадия развития клещагибель окрасИзменение структуры хитина Морфологические изменения внутренних органов 11a10 личинок Через 8 чкоричневый Плавление (укорочение) конечностей, плавление (деформация) хитинового покрова, в двух случаях полный лизис объекта+ 21a10 нимф Через 8 чкоричневый Плавление (укорочение) конечностей, плавление (деформация) хитинового покрова+ 31a 10 имагоЧерез 8 ч Насыщенно-коричневыйПлавление (укорочение) конечностей, плавление (деформация) хитинового покрова +41б 10 личинокЧерез 8 чжелто-коричневый Плавление (укорочение) конечностей, плавление (деформация)хитинового покрова+ 51б10 нимф Через 8 чжелто-коричневый Плавление (укорочение) конечностей, плавление (деформация) хитинового покрова+ 61б 10 имагоЧерез 16 ч коричневыйПлавление (укорочение) конечностей, плавление (деформация) хитинового покрова +71в 10 личинокЧерез 8 чнормальныйПлавление (укорочение) конечностей, плавление (деформация) хитинового покрова +8 1в10 нимфЧерез 16 чнормальный Плавление (укорочение) конечностей, плавление (деформация) хитинового покрова+ 91в10 имаго Через 16 чнормальный Плавление (укорочение) конечностей, плавление (деформация) хитинового покрова+ Пример 5. Испытания на акарицидную активность соединений (1а-в) проводили в экспериментах на сытых самках иксодовых клещей Hyalomma scupense. Для испытаний готовили 0.1%-ные растворы эфиров (16, в) 1%-ном водном растворе этанола. Для сравнения использовали 1%-ную суспензию дифлубензурона в воде - как активного ювеноида. 10 экземпляров сытых самок помещают на тканевые салфетки, завязывают ниткой и на 1 мин. помещают в испытуемую жидкость. Затем самок помещают в пробирку, закрытую ватной пробкой и содержат в термостате в присутствии воды. Контролем служат такие же сытые самки, искупанные в чистой воде. Учет ведут в первые трое суток, а также в последующие дни с учетом влияния акарицида на яйцекладку и выведение личинок (2-4 недели). Через 27-29 дней (норма 7-14 суток для контроля) сытые самки, обработанные опытными препаратами, начали яйцекладку. Через 42 дня 100%-ю яйцекладку дали самки, обработанные препаратом (1б). Из пяти самок, обработанных препаратом (1в), четыре почернели и погибли, не дав яйцекладки, тогда как из пяти самок, обработанных суспензией дифлубензурона, только три самки почернели и погибли. Результаты биологических испытаний in vitro показали, что водно-спиртовые растворы заявляемых соединений (1а-в) обладают выраженным акарицидным действием на различные стадии развития куриных клещей Dermanyssus gallinae: личинка, нимфа, имаго, вызывая изменение тканей разных стадий клещей, при этом перехода одной стадии развития в другую не отмечается. Заявляемые соединения испытывали также на иксодовых клещах крупного рогатого скота Hyalomma scupense, показано, что соединения (1б) и (1в) вызывают задержку яйцекладки.. Наиболее активным является соединение (1в), при обработке сытых самок клещей соединением (1в) яйцекладка не происходит в 80% случаев, самки погибают. Показано, что соединение (1в) превосходит по своей активности коммерческий ювеноид дифлубензурон. Техническим результатом изобретения являются новые соединения: 1-(3-метил-бутилокси)-2,7-диметилокта-2,7-диен, 1-(бут-2-енилокси)-2,7-диметилокта-2,7-диен и 1-(3,7-диметил-окта-2,6-диенилокси)-2,7-диметилокта-2,7-диен, общей формулы 1, проявляющие высокую акарицидную активность, и удобный способ их получения из доступного сырья, который заключается в аллилировании соответствующих спиртов четвертичными терпениламмониевыми солями. Заявляемый способ не требует применения опасных реагентов, дорогих катализаторов и позволяет легко выделять целевые продукты стардартными приемами. Заявляемые соединения в виде водно-спиртовых растворов обладают выраженным акарицидным действием в отношении куриных клещей Dermanyssus gallinae и иксодовых клещей крупного рогатого скота Hyalomma scupense. Акарицидная активность заявляемого соединения (1в) превышает активность известного коммерчески доступного ювеноидного препарата дифлубензурона. Таким образом, заявляемые соединения могут быть использованы в качестве акарицидных препаратов в ветеринарии при саркоптозах и псороптозах домашних и сельскохозяйственных животных. Формула изобретения1. Соединения общей формулы 2. Способ получения соединений по п.1, заключающийся во взаимодействии соответствующих спиртов с четвертичными терпениламмониевыми солями, такими, как N-(2,7-диметил-2,7-октадиен-1-ил)аллилдиэтиламмоний бромид, N-(2,7-диметил-2,7-октадиен-1-ил)аллилпиперидиний бромид и N-(2,7-диметил-2,7-октадиен-1-ил)метилдиэтиламмоний йодид, в присутствии NaOH. Популярные патенты: 2175177 Агромост с оснасткой для прокладки и уплотнения постоянных грунтовых колей ... на отведенном для этой цели и предварительно подготовленном с помощью планировщика агроугодье постоянные колеи для своих гусениц; уплотнять колеи, чтобы движение по ним существенно сократило затраты энергоносителя; создать на грунте вспомогательные уплотненные борозды, которые позволили бы оператору выполнять точное движение агромоста по приложенным и уплотненным колеям без использования какого-либо одного или нескольких направляющих рельс; минимизировать трудовые и материальные затраты на прокладку и уплотнение колей под пролетами дождевальных машин, которые, подобно отечественной машине "Кубань", обеспечивают рациональным поливом крупномасштабные угодья площадью 150-250 га; ... 2265314 Устройство системы зашторивания теплиц с регулируемым ходом ... поступательного движения и несущие на себе балки зашторивания 3 с закрепленным на них одним краем шторного экрана 4. Второй край экрана неподвижно закреплен на фермах теплицы (фиг.2). Параллельно основным штангам 2 в уменьшенном пролете теплицы в направляющих 5 устанавливаются дополнительные штанги 6, не связанные с приводом. На дополнительных штангах крепится балка зашторивания 7 уменьшенного пролета теплицы и установлены два упора 8, между которыми помещается поводок 9 (возможно с роликами 10), закрепленный на балке зашторивания 3 предыдущего пролета, поддерживающий дополнительную штангу и входящий при движении поочередно в контакт с упорами 8 (фиг.3). Расстояние между ... 2069949 Устройство для направленной передачи наследственной информации ... ... 2297128 Способ мелиорации солонцовых почв в условиях орошения ... которых используют, например, аммиачную селитру в количестве 10 кг на тонну соломы и расчетную дозу мелиоранта, в качестве которого используют аммонизированный фосфогипс в форме полугидрата в количестве 6 т/га.Затем солому, азотные удобрения и мелиорант заделывают в поверхностный слой почвы дискованием с использованием тяжелых дисковых орудий. После этого осуществляют вспашку на глубину 28-30 см, посев суданской травы и ее возделывание по общепринятой технологии, причем оросительную норму полива суданской травы увеличивают на 15-20% по сравнению с рекомендуемой для увлажнения соломы в почве и удаления продуктов химической реакции в процессе мелиорации вглубь по профилю почвы. ... 2048767 Способ отбора самок норок для воспроизводства ... самцов), В дальнейшем для воспроизводства отбираются только те животные, которые имеют в генотипе признак оптимальной группы, а именно, неравновесие в сторону избытка гетерозигот по эстеразе-1, гомозигот по эстеразе-2, гетерозигот по малатдегидрогеназе среди обследуемых песцов и неравновесие по конкретным аллелям по эстеразе-2, малатдегидрогеназе и трансферрину среди норок. Отбор самцов с таким балансом генов приводит к повышению уровня выхода щенков (а.с. СССР N 1394502,кл. А 01 К 67/02 дата подачи заявки 31.03.86). Несмотря на то, что описанный способ эффективен с точки зрения повышения продуктивности зверей, применение его в практике звероводческих хозяйств весьма ... |
Еще из этого раздела: 2278509 Брудер для обогрева сельскохозяйственных животных 2048752 Дождевальная машина 2060624 Валкообразующий транспортер жатки-накопителя 2475025 Средство для обработки семян зерновых и зернобобовых культур, пораженных фузариозом 2102853 Питательное устройство для растений 2274986 Способ посева семян трав и кустарников для создания пастбищ на опустыненных землях и почвообрабатывающее орудие для его осуществления 2060618 Пневматический высевающий аппарат 2197796 Рабочий орган ручного почвообрабатывающего орудия 2201663 Устройство для ориентированной посадки лука 2420945 Гидравлическая система сельхозмашины |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
 , где R=CH3(CH3)CHCH2CH 2-, CH3CH=CHCH2-,
, где R=CH3(CH3)CHCH2CH 2-, CH3CH=CHCH2-,  , которые обладают акарицидной активностью. Изобретение относится также к способу их получения, который заключается во взаимодействии соответствующих спиртов с четвертичными терпениламмониевыми солями, такими как N-(2,7-диметил-2,7-октадиен-1-ил)аллилдиэтиламмоний бромид, N-(2,7-диметил-2,7-октадиен-1-ил)аллилпиперидиний бромид и N-(2,7-диметил-2,7-октадиен-1-ил)метилдиэтиламмоний йодид, в присутствии NaOH. Предлагаемые соединения могут найти применение в качестве акарицидных препаратов в ветеринарии при саркоптозах и псороптозах домашних и сельскохозяйственных животных. 2 н.п. ф-лы, 2 табл., 5 пр.
, которые обладают акарицидной активностью. Изобретение относится также к способу их получения, который заключается во взаимодействии соответствующих спиртов с четвертичными терпениламмониевыми солями, такими как N-(2,7-диметил-2,7-октадиен-1-ил)аллилдиэтиламмоний бромид, N-(2,7-диметил-2,7-октадиен-1-ил)аллилпиперидиний бромид и N-(2,7-диметил-2,7-октадиен-1-ил)метилдиэтиламмоний йодид, в присутствии NaOH. Предлагаемые соединения могут найти применение в качестве акарицидных препаратов в ветеринарии при саркоптозах и псороптозах домашних и сельскохозяйственных животных. 2 н.п. ф-лы, 2 табл., 5 пр.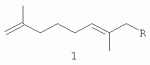
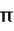 -AllPdCl)2+Ph3P+RONa, а также с хлорэтанолом и высшими спиртами -н-амиловым и н-нониловьм, которая протекает с невысокими выходами (не выше 38%).
-AllPdCl)2+Ph3P+RONa, а также с хлорэтанолом и высшими спиртами -н-амиловым и н-нониловьм, которая протекает с невысокими выходами (не выше 38%).
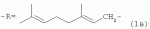

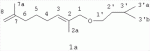
 , м.д., J, Гц): 0.91 д (6Н, 3'aCH3 , 3'bCH3, J3'-3'а =6.64); 1.40-1.52 м (4Н, 3'CH, 5CH 2, J3'-3'a=6.64, J3'-2' =6.87, J5-4=7.78); 1.56-1.70 м (8H, 2aCH 3, 2'CH2, 7aCH 3, J2'-3'=6.87, J2'-1' =6.87); 1.91-2.01 м (4H, 4CH2, 6 CH2, J4-3=7.56); 3.40 т (2H, 1' CH2, J1'-2'=6.87); 3.85 с (2Н, 1СН2); 4.45, 4.47 с, с (2Н, 8 CH2); 5.42 т (1Н, 3CH, J3-4=7.56).
, м.д., J, Гц): 0.91 д (6Н, 3'aCH3 , 3'bCH3, J3'-3'а =6.64); 1.40-1.52 м (4Н, 3'CH, 5CH 2, J3'-3'a=6.64, J3'-2' =6.87, J5-4=7.78); 1.56-1.70 м (8H, 2aCH 3, 2'CH2, 7aCH 3, J2'-3'=6.87, J2'-1' =6.87); 1.91-2.01 м (4H, 4CH2, 6 CH2, J4-3=7.56); 3.40 т (2H, 1' CH2, J1'-2'=6.87); 3.85 с (2Н, 1СН2); 4.45, 4.47 с, с (2Н, 8 CH2); 5.42 т (1Н, 3CH, J3-4=7.56).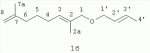

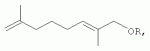 где R=CH3(CH3)CHCH2 CH2-,R=CH3CH=CHCH2-,
где R=CH3(CH3)CHCH2 CH2-,R=CH3CH=CHCH2-,  обладающие акарицидной активностью.
обладающие акарицидной активностью.