Способ криосохранения морских микроводорослейПатент на изобретение №: 2496318 Автор: Борода Андрей Викторович (RU), Айздайчер Нина Александровна (RU), Одинцова Нэлия Адольфовна (RU) Патентообладатель: Федеральное государственное бюджетное учреждение науки Институт биологии моря им. А.В. Жирмунского Дальневосточного отделения Российской академии наук (RU), Федеральное государственное автономное образовательное учреждение высшего профессионального образования "Дальневосточный федеральный университет" (ДВФУ) (RU) Дата публикации: 27 Октября, 2013 Начало действия патента: 15 Июня, 2012 Адрес для переписки: 690068, кр. Приморский, г. Владивосток, ул. Кирова, 31, кв.68, Ю.Ю.Кравцовой Изображения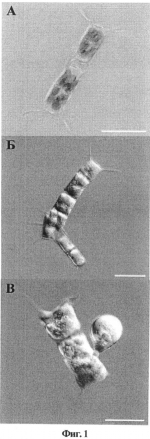 Изобретение относится к области криобиологии, клеточной биологии, морской биотехнологии и гидробиологии. Проводят обработку клеток морских микроводорослей криопротекторной смесью, содержащей проникающий и непроникающий криопротекторы и питательную среду. Осуществляют замораживание с последующим сохранением в жидком азоте. В качестве питательной среды берут стерильную морскую воду при следующем соотношении компонентов, в масс.%: проникающий криопротектор 5-7,5%; непроникающий криопротектор 1,5-3%; стерильная морская вода - остальное. Перед замораживанием проводят инкубацию клеток морских микроводорослей на ледяной бане в течение не менее 10 минут. Замораживание ведут в три этапа: сначала охлаждают до -25°C со скоростью 0,9-1,1°C/мин; затем охлаждают до -75°C со скоростью 2-2,5°C/мин; после чего охлаждают до -196°C, помещая клетки морских микроводорослей в жидкий азот. В качестве проникающего криопротектора можно использовать диметилсульфоксид (ДМСО) или этиленгликоль. В качестве непроникающего криопротектора - трегалозу или поливинилпирролидон (ПВП). Изобретение позволяет повысить выход жизнеспособных, функционально активных клеток микроводорослей после замораживания-оттаивания и восстановить их культуру в течение недели после криоконсервации, обеспечивая при этом возможность количественной оценки функционального состояния микроводорослей. 2 з.п. ф-лы, 1 ил., 3 табл., 5 пр. Изобретение относится к биотехнологии и, в частности к способам криосохранения биологического материала, а именно клеток морских микроводорослей, и может быть использовано в криобиологии, клеточной биологии, морской биотехнологии и гидробиологии для сохранения микроводорослей. Главный эффект сверхнизких температур связан с ингибированием химических и физических процессов, что является основой длительного сохранения биологического материала. Начиная с 60-х годов прошлого века, резко возрос интерес к криоконсервации разных групп водорослей (Ben-Amotz, Gilboa, 1980; Morris, 1986; Day, 1998; Taylor, Fletcher, 1999; Day, Brand, 2005; Benson, 2008; Day et al., 2008). Это связано с необходимостью длительного сохранения коллекций культур водорослей, которые подвергаются значительным изменениям в процессе субкультивирования, кроме того, существует постоянный риск контаминации, дрейфа генов и снижения питательной ценности микроводорослей при пересевах. Развитие методов криоконсервации водорослей связано также с нуждами марикультуры: получение из них биоактивных веществ, обладающих фармацевтическим потенциалом, и использование микроводорослей для кормления личинок и молоди морских беспозвоночных. Для токсикологических исследований и приготовления стандартов биотоксинов необходимо постоянно поддерживать коллекции токсических микроводорослей. Известны способы криосохранения микроводорослей путем введения в криопротекторную смесь только проникающих криопротекторов (McLellan M.R. (1989) Cryopreservation of diatoms. Diatom Res. 4: 301-318) или различных непроникающих внутрь клеток веществ, среди которых, в основном, используют различные сахара (Morris G.J., Canning C.E. (1978) The cryopreservation of Euglena gracilis. J. gen. Microbiol. 108: 27-31). Однако в вышеуказанных способах удалось сохранить лишь отдельные группы или виды водорослей, причем после оттаивания клеток, замороженных указанными способами, количество жизнеспособных клеток можно определить только через 1-2 недели культивирования. При этом оценить функциональную активность клеток (подвижность, состав пигментов, интенсивность фотосинтеза и т.д.) невозможно. В первом случае, при замораживании водорослей использовали только проникающие криопротекторы, что не позволяет сохранить крупные (более 20 мкм), содержащие много воды (более 75% по массе) клетки, например, диатомовой водоросли Actinocyclus subtilis. Использование во втором аналоге непроникающих криопротекторов также не позволяет обеспечить достаточный выход жизнеспособных клеток после оттаивания. Известен способ для криосохранения морских микроводорослей с использованием смеси, состоящей из проникающего криопротектора, 5% диметилсульфоксида (ДМСО), и питательной среды (Ben-Amotz, А., Gilboa, A. Cryopreservation of marine unicellular algae. I. A survey of algae with regard to size, culture age, photosynthetic activity and chlorophyll-to cell ratio. Mar. Ecol. Prog. 1980, Ser 2: 157-161). Недостатком данного способа является отсутствие четких рекомендаций по скорости замораживания и только визуальная качественная оценка жизнеспособности микроводорослей, во многом отражающая лишь субъективный подход исследования. В результате, оценить степень сохранности микроводорослей после оттаивания можно только через несколько недель культивирования. Наиболее близким по количеству существенных признаков и достигаемому техническому результату к изобретению является способ криосохранения морских микроводорослей 7 классов, принадлежащих к 4 отделам: планктонных и бентосных диатомовых, зеленых, красных и золотистых (Rhodes et al., 2006. Cryopreservation of economically valuable marine micro-algae in the classes Bacillariophyceae, Chlorophyceae, Cyanophyceae, Dinophyceae, Haptophyceae, Prasinophyceae, and Rhodophyceae. Cryobiology. V.52: 152-156). Способ включает обработку микроводорослей криопротекторной смесью, содержащей проникающий криопротектор (10-15% ДМСО на питательной среде, подходящей отдельному виду водоросли), и режим замораживания: охлаждение с 20 до -40°C со скоростью 3°C/мин., выдержку при -40°C в течение 10 мин. перед помещением в жидкий азот (-196°C). Тестируемые микроводоросли в течение первой недели после оттаивания отставали в развитии от контрольных, незамороженных экземпляров, а через 3-4 недели контрольные и размороженные микроводоросли имели одинаковые размерные характеристики. К недостаткам данного способа криосохранения морских микроводорослей, принятого за прототип, следует отнести: - высокую концентрацию проникающего криопротектора (более 10%); - использование только одного вида криопротектора, ДМСО; - использование специально приготовленной питательной среды, причем различающейся по составу компонентов для различных видов водорослей; - значительную скорость замораживания (более 3°С/мин.), не позволяющую успешно замораживать крупные клетки. Использование в известном способе вышеуказанных признаков усиливает осмотические эффекты, имеющие место при замораживании, что, в конечном результате, приводит к повреждению оболочек клеток, а также к замедлению восстановления культур водорослей после оттаивания. Во всех вышеупомянутых способах в качестве основы для приготовления криопротекторов использовали различные питательные среды (среду Гольдберга, среду f, B150 и др.), предназначенные для культивирования отдельных видов, родов или классов водорослей, что на практике оказывается не очень удобным, осложняет и удорожает процесс криоконсервации. Кроме того, в состав этих питательных сред входит множество веществ (солей, витаминов и др.), которые способствуют усилению негативных факторов замораживания, например, окислительных и осмотических процессов. Хотя метод, принятый заявителем за прототип, апробирован на представителях различных отделов микроводорослей, его недостатком является также полное отсутствие количественной оценки жизнеспособности и функционального состояния выживших после замораживания-оттаивания микроводорослей, что не позволяет проанализировать степень их сохранности. По биологическому материалу, полученному после оттаивания, практически невозможно произвести количественную оценку эффективности данного способа замораживания. Кроме того, данный способ не пригоден для криосохранения крупных клеток микроводорослей, в состав клеток которых входит значительное количество воды (более 75% по массе), в частности диатомовых водорослей родов Attheya, Actinocyclus и др. Этот вывод можно сделать из результатов эксперимента, представленных в данной статье. Клетки микроводорослей больших размеров (A. subtilis) полностью разрушались после замораживания-оттаивания. Задача изобретения - разработать способ криосохранения клеток морских микроводорослей, принадлежащих к различным таксонам и имеющим отличные друг от друга физиологические и морфологические особенности, позволяющий избежать снижения функциональной активности клеток и добиться их быстрого восстановления (в течение недели) после криоконсервации, за счет снижения количества образующегося при замораживании льда, как внутри, так и снаружи клеток. Поставленная задача решается тем, что в известном способе криосохранения клеток морских микроводорослей, включающим их обработку криопротекторной смесью, содержащей проникающий криопротектор и питательную среду, и замораживание с последующим сохранением в жидком азоте, согласно изобретению, в состав криопротекторной смеси дополнительно вводят непроникающий криопротектор, а в качестве питательной среды берут стерильную морскую воду, при следующем соотношении компонентов, в мас.%: Проникающий криопротектор 5-7,5%Непроникающий криопротектор 1,5-3%Стерильная морская водаостальное;перед замораживанием проводят инкубацию клеток морских микроводорослей на ледяной бане в течение не менее 10 минут, а замораживание ведут в три этапа: сначала охлаждают до -25°C со скоростью 0,9-1,1°C/мин.; затем охлаждают до -75°C со скоростью 2-2,5°C/мин.; после чего охлаждают до -196°С, помещая клетки морских микроводорослей в жидкий азот. Дополнительное введение в криопротекторную смесь непроникающего криопротектора значительно повышает степень сохранности клеток микроводорослей при криоконсервации и увеличивает скорость восстановления культуры после оттаивания, поскольку обеспечивает защиту мембран клеток от действия осмотических сил и разрушения липидного бислоя, что особенно важно при криоконсервации крупных (более 20 мкм), содержащих много внутриклеточной воды микроводорослей. Использование комбинации проникающего и непроникающего криопротекторов в заявленных концентрациях позволило также расширить круг замораживаемых микроводорослей, в частности, впервые осуществлена криоконсервация крупных, чувствительных к замораживанию диатомовых водорослей рода Attheya. Введение в криопротекторную смесь менее 5% проникающих и менее 1,5% непроникающих криопротекторов снижает степень сохранности клеток микроводорослей, поскольку не обеспечивает связывания внутриклеточной воды в достаточной степени, что повышает риск ее превращения в лед, а, в конечном результате, приводит к разрушению клеток микроводорослей, снижая при этом не только их функциональную активность, но и степень их сохранности. Добавление более 7,5% проникающих криопротекторов оказывает токсическое действие, уменьшая количество выживших функционально активных клеток и скорость их деления после оттаивания. Введение в криопротекторную смесь более 3% непроникающих криопротекторов экономически нецелесообразно, так как не вызывает дополнительного увеличения жизнеспособности клеток морских микроводорослей после замораживания. Для достижения заявленного технического результата в качестве проникающего криопротектора целесообразно использовать диметилсульфоксид (ДМСО) или этиленгликоль, а в качестве непроникающего криопротектора трегалозу или поливинилпирролидон (ПВП). Таким образом, благодаря комплексному введению проникающих и непроникающих криопротекторов при замораживании снижается количество образующегося льда, как внутри, так и снаружи клеток, а также обеспечивается дополнительная стабилизация клеточных оболочек непроникающим криопротектором (трегалозой или ПВП), и, как следствие, повышается степень выживаемости клеток и их функциональная активность после оттаивания. Однако при этом наблюдается не суммарный эффект действия криопротекторов, а их кумулятивный эффект. Использование морской стерильной воды в качестве питательной среды при криосохранении морских микроводорослей не только значительно упрощает и удешевляет процесс криосохранения, но и предотвращает возможность возникновения негативных эффектов, обусловленных, присутствием в специальных питательных средах различных химических соединений, устраняя при замораживании окислительные и осмотические процессы. В конечном результате, использование стерильной морской воды в качестве питательной среды способствует повышению жизнеспособности и функциональной активности клеток, а также восстановлению их культуры в течение недели после криоконсервации. Предварительная выдержка суспензии замораживаемых клеток на ледяной бане в течение не менее 10 минут дает возможность криопротекторам связаться с молекулами воды, снижая льдообразование, и с молекулами клеточных оболочек, защищая их в дальнейшем от разрушения. Проведение поэтапного замораживания клеток перед помещением их в жидкий азот, имеющий температуру -196°C, позволяет избежать образования внутриклеточного льда и, как следствие, снижения функциональной активности клеток, повышая скорость восстановления клеток морских водорослей до 7 суток после криоконсервации. Последний факт имеет огромное значение, когда необходимо в короткие сроки получить большое количество клеток различных культур микроводорослей, например, при проведении экологических тестов морских акваторий, наработки биологической массы водорослей для кормления личинок морских животных, получения биологически активных веществ (полисахаридов, липидов и др.) из водорослей. Принципиальным фактором при проведении поэтапного охлаждения является скорость охлаждения, от нее зависят ключевые температуры (-25°C и -75°C) между этапами. Снижение скорости охлаждения ниже 0,9°C/мин. на первом этапе и ниже 2°С/мин. - на втором этапе приводит к увеличению общего времени замораживания и значений ключевых температур, что повышает степень обезвоживания клеток, количество образующегося внеклеточного льда и токсическое действие криопротекторов, вследствие чего, снижается степень сохранности клеток и их функциональная активность. Увеличение скорости охлаждения выше 1,1°C/мин, на первом этапе и выше 2,5°C/мин. - на втором этапе, наоборот, снижает общую продолжительность замораживания и значения ключевых температур, в результате, больше воды остается внутри клеток, формируя внутриклеточный лед, что при оттаивании клеток приводит к их гибели. Таким образом, применение скоростей замораживания выше или ниже упомянутых интервалов заметно снижает выход жизнеспособных и функционально активных клеток, от которых зависит скорость восстановления культур водорослей. В качестве морских микроводорослей, используют морские микроводоросли с отличными друг от друга физиологическими и морфологическими особенностями. Заявленный метод пригоден для замораживания как культур морских микроводорослей, клетки которых содержат незначительное количество воды (менее 75% по массе) (Phaeodactylum tricornutum, Isochrysis galbana, Nannochloris maculata, Porphyridium purpureum), так и культур микроводорослей в состав клеток которых входит значительное количество воды (более 75% по массе), в частности диатомовых водорослей рода Attheya. Использование в заявленном способе микроводорослей, принадлежащих к различным таксонам и отличающимся по строению, размеру и физиологии, анализ динамики деления их клеток и содержания в них пигментов позволяет дать объективную количественную оценку влияния криоконсервации на жизнеспособность и функциональную активность микроводорослей. Впервые, получены положительные результаты при криосохранении крупных, чувствительных к замораживанию диатомовых водорослей рода Attheya, вследствие использования плавного режима замораживания (со скоростью 0,9-2,5°C/мин.) и невысокой суммарной концентрации криопротекторов (6,5-11,5%). При заявленных условиях криоконсервации большинство свободной внутриклеточной воды цитоплазмы успевает выйти из клеток, а оставшуюся часть связывают проникающие криопротекторы, предотвращая образование внутриклеточного льда. В то же время непроникающие криопротекторы препятствуют росту кристаллов льда в окружающем клетки растворе и защищают оболочки клеток от осмотических эффектов. Все это позволяет повысить степень сохранности клеток микроводорослей при криоконсервации и увеличить скорость восстановления культуры после оттаивания: активное деление клеток начинается через 3-5 суток, а переход в стационарную фазу роста (когда наблюдается максимальная концентрация клеток) происходит через 7-10 суток после оттаивания. Способ осуществляется следующим образом. Микроводоросли были получены из коллекции Института биологии моря им. А.В. Жирмунского ДВО РАН и культивированы до фазы стационарного роста, как описано в методическом пособии Орловой с коллегами (Орлова Т.Ю., Айздайчер Н.А., Стоник И.В., 2011. Лабораторное культивирование морских микроводорослей, включая продуцентов фитотоксинов: научно-методическое пособие. Владивосток, Дальнаука, стр.88). Берут суспензию микроводорослей, переносят в полипропиленовые криовиалы, находящиеся на ледяной бане, и добавляют охлажденную криопротекторную смесь. Криовиалы выдерживают на ледяной бане не менее 10 минут, затем переносят в криостат (Proline RP 845 (LAUDA, Германия) и охлаждают до -25°C со скоростью 0,9-1,1°C/мин., что занимает 25-30 мин., после чего полипропиленовые криовиалы помещают на пенопластовый плотик (15×10×5 см) плавающий в камере с жидким азотом, и замораживают до -75°С со скоростью 2-2,5°C/мин. (данная температура достигается за 20-25 мин.) Замороженные пробы переносят в дьюар с жидким азотом (-196°C) на хранение. Температуру контролируют с помощью регистратора температуры ТС-08 (Omega Engineering, США). Оттаивание проводят на водяной бане (20-25°C) при интенсивном перемешивании. Сразу после оттаивания, содержимое криовиал переносят в охлажденные стерильные пробирки. Криосмесь удаляют из проб с помощью постепенного разбавления морской водой в десять раз на ледяной бане и дальнейшего центрифугирования (A. arenicola, A. ussurensis and P. cruentum - 5 мин. при 70 g; I. galbana - 10 мин. при 450 g; N. maculata - 10 мин. при 1750 g). Промывку повторяют еще раз, осадок клеток после второго центрифугирования ресуспендируют в 2 мл свежей питательной среды и культивируют в течение 21 суток при 17°C и искусственном освещении (фото период - 12 ч при интенсивности 70 µмоль/(м 2×сек)). В качестве контроля используют незамороженные микроводоросли на соответствующей стадии развития. Эффективность способа оценивают с помощью известной методики определения концентрации клеток путем прямого подсчета числа клеток в камере Горяева (Odintsova N.A., Boroda A.V., Velansky P.V., Kostetsky E.Ya. Fatty acid profile changes of embryonic cells of marine invertebrates during cryopreservation. Cryobyology. 2009. V.59: 335-343), a физиологическую активность клеток оценивают по содержанию пигментов в клетках (Jeffrey S.W., Humphrey G.F. New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton. Biochem. Physiol. Pflanzen (BPP). 1975. Bd. 167, S.191-194). Необходимо отметить, что содержание пигментов в клетках до замораживания определяли, начиная с 3 суток культивирования, так как до этого момента концентрация клеток была слишком мала для экстракции пигментов. Количество клеток непосредственно после оттаивания было достаточным для проведения анализа содержания пигментов, так как для замораживания использовали клетки на стадии стационарного роста, когда концентрация была максимальной. Пример 1. Берут крупные (30-40 мкм) неподвижные морские диатомовые водоросли A. arenicola. Микроводоросли выращивают до стадии стационарного роста, помещая их на 7-9 суток в сосуды со стерильной питательной средой f/2 (Guillard R.R.L. Culture of phytoplankton for feeding marine invertebrates. In: Culture of Marine Invertebrate Animals // - Smith W.L., Chanley M.H., eds. (1975). New York: Plenum Press, p.26-60) при 17°C и искусственном освещении (фото период - 12 ч при интенсивности 70 µмоль/(м2×сек)). Состав криопротекторов и режим замораживания приведены в табл.1. В полипропиленовые криовиалы объемом 2 мл помещают по 0,6 мл суспензии микроводорослей (107 клеток/мл) и добавляют 1,2 мл криопротекторной смеси (стерильная морская вода, в которую добавляют этиленгликоль до конечной его концентрации в криопротекторной смеси 5% и ПВП до конечной концентрации 3%). Криовиалы выдерживают на ледяной в бане течение 10 минут, затем переносят в криостат (Proline RP 845 (LAUDA, Германия)), охлажденный до -25°C для замораживания со скоростью 0,9°C/мин. в течение 28 мин., после чего их помещают на пенопластовый плотик (20×15×5 см), плавающий в камере с жидким азотом, для замораживания до -75°C со скоростью 2,5°C/мин в течение 20 минут. Замороженные пробы переносят в дьюар с жидким азотом. Оттаивание проводят на водяной бане (25°C) при интенсивном перемешивании. В качестве контроля используют незамороженные микроводоросли. Пример 2. Берут крупные (25-30 мкм) неподвижные морские диатомовые водоросли A. ussurensis. Все последующие процедуры аналогично примеру 1, за исключением того, что используют криопротекторную смесь, включающую 7,5% ДМСО, 1,5% трегалозы и 91% стерильной морской воды. Условия замораживания приведены в табл.1, пример 2. Пример 3. Берут мелкие (1-4 мкм) неподвижные зеленые водоросли N. maculata. Все последующие процедуры, такие же, как в примере 1, за исключением того, что для культивирования используют среду Гольдберга (Kabanova Yu.G. 1961. Concerning in vitro Culturing of Marine Planktonic Diatoms and Peridinea Algae. Tr. 10 AN SSSR 47: 203-216), криопротекторная смесь состоит из: 5% ДМСО, 1,5% ПВП и 93,5% стерильной морской воды. Замораживание проводят согласно режиму, указанному в табл.1, пример 3. Пример 4. Берут активно двигающиеся золотистые микроводоросли I. galbana среднего размера (5-10 мкм). Все последующие процедуры, такие же, как в примере 1, за исключением того, что криопротекторная смесь состоит из 7,5% этиленгликоля, 3% трегалозы и 89,5% стерильной морской воды. Режим замораживания указан в табл.1, пример 4. Пример 5. Берут неподвижные красные микроводоросли Р. purpureum дисковидной формы и небольшого размера (диаметром 4-8 мкм, толщиной 2-4 мкм). Все последующие процедуры аналогичны примеру 3. В качестве криопротекторной смеси используют 5% ДМСО и 3% трегалозу, остальное процентное содержание (92%) составляет стерильная морская вода. Замораживание проводят согласно режиму, указанному в табл.1, пример 5. Достижение технического результата подтверждается данными экспериментов по криоконсервации различных видов морских микроводорослей, условия, замораживания которых указаны в табл.1. В табл.2, приведена концентрация клеток морских микроводорослей при культивировании до и после криоконсервации (в млн. клеток/мл), а в табл.3 приведено содержание пигментов в клетках морских микроводорослей до и после криоконсервации (в мкг/млн. клеток), полученных согласно примерам 1, 2 и 5. Как видно из результатов, представленных в табл.2 начало активного деления клеток всех видов водорослей приходится на 3-5 сутки после оттаивания (табл.2, концентрация клеток выражена в млн. клеток/мл), что в 2-3 раза раньше по сравнению с существующими аналогами. Переход в стационарную фазу роста происходит уже на 7-10 сутки, когда концентрация клеток в суспензии близка к максимальной для данного вида водоросли и не изменяется значительно при дальнейшем культивировании. Необходимо отметить, что максимальная концентрация клеток после эксперимента практически совпадала с таковой контрольных клеток, а в случае с A. ussurensis (Пример 2), I. galbana (Пример 4) и Р. purpureum (Пример 5) заметно превосходила концентрацию контрольных клеток. После 17 суток начинается деградация, как контрольных, так и экспериментальных культур. Рост числа клеток у 2-х видов водорослей, I. galbana (Пример 4 и Р. purpureum (Пример 5), продолжался даже спустя 21 сутки культивирования. Таким образом, экспериментально подтверждено, что степень сохранности клеток и скорость восстановления их культуры после оттаивания значительно превосходят эти характеристики у прототипа. В качестве количественной характеристики функциональной активности клеток используют содержание в них пигментов, в частности общее содержание хлорофиллов С1 и С2, хлорофилла А и каротиноидов. Тенденции изменения количества отдельных пигментов в экспериментальных и контрольных клетках схожи между собой, а их значения в большинстве случаев находятся в пределах стандартных отклонений в каждом примере (табл.3). Содержание пигментов выражено в мкг/млн. клеток; Сх Непосредственно после оттаивания происходит незначительное снижение содержания отдельных пигментов клеток по сравнению с клетками до замораживания. В течение 7 суток культивирования экспериментальных клеток, когда начинается экспоненциальный рост числа клеток, наблюдают увеличение содержания пигментов. При переходе в стационарную фазу роста (на 10-е сутки) количество пигментов в клетках снижается, возвращаясь на уровень близкий к клеткам непосредственно после оттаивания. Подобные изменения в содержании пигментов происходят также при культивировании контрольных незамороженных клеток Эти данные позволяют количественно охарактеризовать высокий уровень сохранности физиологической активности клетками после замораживания-оттаивания заявленным способом, что не было сделано в прототипе. Для подтверждения нормального состояния клеток после криоконсервации проводят визуальные наблюдения и делают фотографии с помощью микроскопа Axiovert 200M (Carl Zeiss, Германия). В частности, для водорослей рода Attheya (Пример Показателем нормального состояния водорослей рода Attheya является наличие ярко-окрашенного расправленного хлоропласта в клетках, который хорошо виден на примере A. ussurensis до замораживания (фиг.1А). После замораживания A. ussurensis в присутствии 7,5% ДМСО и 1,5% трегалозы (фиг.1Б) клетки с такими хлоропластами появляются уже через 5-7 суток после оттаивания, а на 18-21 сутки заметно формирование многочисленных спор (фиг.1В), появление которых свидетельствует о функциональной активности клеток. Масштабная линейка на всех микрофотографиях составляет 25 мкм. Дополнительной качественной характеристикой функциональной активности клеток I. galbana является их подвижность. При визуальном наблюдении с помощью микроскопа через 3 суток культивирования отчетливо видно, что 30-40% экспериментальных клеток восстанавливают свою подвижность, а через 7 суток - активно двигаются уже более 95% клеток. Все полученные результаты свидетельствуют о высокой степени сохранности клеток микроводорослей, их функциональной активности и скорости деления, сопоставимых с контрольными клетками до замораживания, при соблюдении условий заявленного способа криосохранения. Формула изобретения1. Способ криосохранения клеток морских микроводорослей, включающий их обработку криопротекторной смесью, содержащей проникающий криопротектор и питательную среду, замораживание с последующим сохранением в жидком азоте, отличающийся тем, что в состав криопротекторной смеси дополнительно вводят непроникающий криопротектор, а в качестве питательной среды берут стерильную морскую воду при следующем соотношении компонентов, мас.%: проникающий криопротектор 5-7,5непроникающий криопротектор 1,5-3стерильная морская водаостальное, перед замораживанием клеток проводят инкубацию клеток морских микроводорослей на ледяной бане в течение не менее 10 мин, а замораживание ведут в три этапа: сначала охлаждают до -25°C со скоростью 0,9-1,1°C/мин; затем охлаждают до -75°C со скоростью 2-2,5°C/мин., после чего охлаждают до -196°C, помещая клетки морских микроводорослей в жидкий азот.2. Способ по п.1, отличающийся тем, что в качестве проникающего криопротектора используют диметилсульфоксид или этиленгликоль. 3. Способ по п.1, отличающийся тем, что в качестве непроникающего криопротектора используют трегалозу или поливинилпирролидон. Популярные патенты: 2177226 Способ защиты растений от болезней, регулирования их роста и защитно-стимулирующий комплекс для его осуществления ... водой. Рабочей жидкости расходуют 200-300 л/га. Таким образом, соотношение оксигумата и защитно-стимулирующего комплекса, включающего "Полиазофос-К", составляет для случая обработка посевов ячменя 1:32-33. Пример 1 приготовления рабочей жидкости при протравливании семенного картофеля выглядит следующим образом. Бак оборудования для протравливания семенного картофеля ОПС-1АК заливается на 2/3 объема водой. Затем в него вводят пастообразный "Полиазофос-К" из расчета 0,25 кг/т, оксигумат - 0,2 л/т и другие вещества, например янтарную кислоту 0,00002 кг/т, фунгицид ТЕКТО из расчета 0,09-0,12 кг/т и т.д. В этом случае соотношение оксигумата и защитно-стимулирующего комплекса будет ... 2274986 Способ посева семян трав и кустарников для создания пастбищ на опустыненных землях и почвообрабатывающее орудие для его осуществления ... для создания пастбищ на опустыненных землях включает образование канавки для семян в поверхностной зоне, высев семян в канавку, их заделку путем вдавливания семян в почву и образование влагонакопительных углублений. Каждой канавке для семян придают в сечении форму астроиды, описываемой системе прямоугольных координат уравнением:X2/3+Y 2/3=R2/3,где Х - текущая координата точки на поверхности канавки по оси ОХ;Y - текущая координата на поверхности канавки по оси OY;R - радиус описанной окружности кромок рабочих элементов для поделки канавок. Влагонакопительные углубления в виде прерывистых борозд выполняют по разнонаклонным линиям к направлению движения при поделке канавок для ... 2064741 Устройство для обработки почвы ... стабилизации глубины обработки почвы содержит автоматическую систему с обратной связью, включающую механизм стабилизации глубины обработки почвы. Механизм стабилизации глубины обработки почвы в первом варианте содержит механизм 30 изменения расположения центра масс устройства для обработки почвы, перемещая элементы его конструкции, например, энергетическое устройство 3, представляющее собой дизель-электрогенераторную станцию, относительно элементов внедрения рабочих органов. Механизм 26 стабилизации глубины обработки почвы во втором варианте содержит механизм изменения угла атаки самозаглубляющихся рабочих органов, агрегатируемых с устройством для обработки почвы сельхозмашин, ... 2154296 Зерноуборочная машина, преимущественно зерноуборочный комбайн, с мультипроцессорным управляющим устройством ... При массивном контакте режущего аппарата с почвой, когда одна из ощупывающих скоб отжата не менее чем на 85%, происходит автоматическое экстренное поднятие, т.е. выход за хранящееся в памяти заданное значение, и посылается предупредительный сигнал. Как и в регуляторе ширины среза, регулятор контура работает в качестве регулятора поперечного наклона с соответствующими заданными значениями и датчиками контакта с почвой, благодаря чему вблизи почвы обеспечивается параллельное расположение режущего аппарата. Поперечное регулирование действует практически всегда. Его точность регулирования ("мертвая зона") при малых отжимах ощупывающей скобы режущего аппарата, когда фактическое значение ... 2161391 Комбинированная почвообрабатывающая посевная машина ... и спиральный каток, причем прицепная часть машины оборудована ящиком для семян с высевающими аппаратами и дисковыми сошниками, за которыми установлен уплотняющий барабан. Размещение лап-сошников за дисковыми батареями повышает качество крошения почвы, распределение удобрений под почвой и обеспечивает укладку туков удобрений на влажное ложе. Установка за плоскорезными лапами-сошниками лопастного барабана-выравнивателя повышает качество разделки подрезанного пласта, улучшает контакт туков с влажным ложем почвы. Расположение на раме навесной части машины спирального катка позволяет одновременно производить уплотнение почвы на глубине заделки семян, мульчирование верхнего слоя почвы ... |
Еще из этого раздела: 2411718 Устройство для внутрипочвенного импульсного дискретного полива растений 2265314 Устройство системы зашторивания теплиц с регулируемым ходом 2400069 Способ защиты материалов от микробного разрушения 2178965 Картофелекопатель ручной мотыжный 2010519 Способ биологической борьбы с вредителями растений 2195808 Способ хранения корнеплодов, картофеля и капусты 2400963 Передвижной перегрузчик для зерна сельскохозяйственных культур 2404898 Устройство на воздушной подушке для разбрасывателей органоминеральных удобрений 2140738 Производные n-арилгидразина, способ их получения, способ подавления насекомых и композиция для подавления насекомых 2161400 Способ определения активности агентов |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
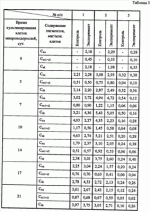
|
|
||
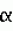 - хлорофилл А; Сх
- хлорофилл А; Сх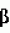 - хлорофилл В; Cxc1+c2 - сумма хлорофиллов С1 и С2; Ck - каротиноиды. Стандартное отклонение во всех экспериментах не превышало 0,1 мкг/млн. клеток.
- хлорофилл В; Cxc1+c2 - сумма хлорофиллов С1 и С2; Ck - каротиноиды. Стандартное отклонение во всех экспериментах не превышало 0,1 мкг/млн. клеток. 1) и водоросли I. galbana (Пример
1) и водоросли I. galbana (Пример