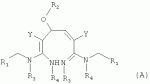
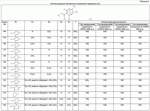
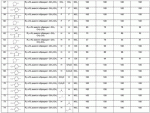
Гетероциклические азотсодержащие или кислородсодержащие соединения с инсектицидной активностью, образованные из диальдегидов, и их получение и примененияПатент на изобретение №: 2495023 Автор: ЛИ Чжун (CN), ЦЯНЬ Сюйхун (CN), ШАО Сюйшен (CN), СЮЙ Сяоюн (CN), ТАО Лимин (CN), СУН Гунхуа (CN) Патентообладатель: ИСТ ЧАЙНА ЮНИВЕРСИТИ ОФ САЙЕНС ЭНД ТЕКНОЛОДЖИ (CN), ШАНХАЙ ШЭННУН ПЕСТИСАЙД КО., ЛТД. (CN) Дата публикации: 27 Января, 2013 Начало действия патента: 18 Декабря, 2009 Адрес для переписки: 191002, Санкт-Петербург, а/я 5, ООО "Ляпунов и партнеры", пат.пов. Е.Г.Ильмеру, рег. 1144 Изобретение относится к новым гетероциклическим азот- и кислородсодержащим соединениям, обладающим инсектицидной активностью. В формулах (А), (В), (С), (D):
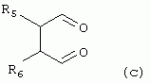
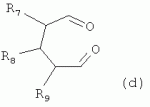
R1 представляет собой 5- или 6-членный гетероцикл, содержащий атом азота, кислорода и/или серы, галогенозамещенный 5- или 6-членный гетероцикл, содержащий атом азота, кислорода и/или серы, замещенный или незамещенный фенил, где заместители представляют собой одну или более чем одну группу, выбранную из группы, состоящей из атомов галогена, С1-4галогеноалкила или С1-4хлоралкоксила; R5, R6, R7, R8 и R9 представляют собой Н, насыщенный или ненасыщенный С1-4алкил, атом галогена, насыщенный или ненасыщенный С1-8алкоксил, насыщенный С1-4галогеноалкоксил, С1-4алкилкарбонил, С1-8алкиловый сложный эфир, С1-4алкилсульфонил, фенил, бензил или трифторметансульфонильную эфирную группу; Y представляет собой нитро, циано, трифторметил, трифторацетил или трифторметилсульфонил. Значения радикалов R, R2-R4 приведены в формуле изобретения. Изобретение также относится к агрохимической композиции, содержащей указанные соединения, к применению агрохимической композиции для борьбы с сельскохозяйственными вредителями и к способу получения указанных соединений. 5 н. и 7 з.п. ф-лы, 7 табл., 36 пр. Область техники Данное изобретение относится к новым производным неоникотиноида, к способу их получения и к их применениям. Предшествующий уровень техники Представленный имидаклопридом, неоникотиноидный инсектицид стал пусковым фактором открытия пестицидов, со свойством высокой инсектицидной активности, широким инсектицидным спектром, низкой токсичностью для млекопитающих и водных животных, хорошими системными свойствами, подходящей полевой стабильностью и благоприятностью для окружающей среды. После имидаклоприда была разработана серия неоникотиноидных инсектицидов, таких как тиоклоприд, клотианидин, тиаметоксам, ацетамиприд, нитенпирам и динотефуран (ЕР 247477, 296453, 685477, 235725, 235725, 315826, 192060, 244777, 0386565, 580553, 1031566, JP 62292765, 8259568, 8291171 и 7242633). Однако применение и разработка этих соединений ограничены вследствие устойчивости, вызванной слишком частым применением имидаклоприда, и перекрестной устойчивости среди неоникотиноидных инсектицидов, вызванной структурным сходством. Тем не менее, неоникотиноидные инсектициды, в основном, проявляют высокую активность в отношении вредителей Homoptera и Coleoptera, и узкий инсектицидный спектр ограничивает их широкое применение в борьбе с вредителями. Таким образом, в данной области техники крайне необходимо разработать соединения с эффективными активностями из высокоактивных нитрометиленовых соединений, чтобы решить проблему устойчивости, расширить инсектицидный спектр и применять их в инсектицидных композициях. Краткое описание изобретения В данном изобретении предложены новые эффективные инсектициды, которые позволяют решить проблему устойчивости к неоникотиноидным инсектицидам, расширить инсектицидный спектр и решить проблемы, существующие в данной области техники. Одной целью изобретения является разработка производных для эффективной борьбы с вредителями и их получение. Другой целью изобретения является разработка защиты растущих и собранных растений и предупреждение их инвазии насекомыми. В соответствии с первым аспектом изобретения предложено соединение формулы (А), (В), (С) или (D), его оптический изомер, цис-транс-изомер или его агрохимически приемлемые соли
где R1 представляет собой 5- или 6-членный гетероцикл, содержащий атом азота, кислорода и/или серы, замещенный галогеном 5- или 6-членный гетероцикл, содержащий атом азота, кислорода и/или серы, замещенный или незамещенный фенил, где заместители представляют собой одну или более чем одну группу, выбранную из группы, состоящей из атомов галогена, C1-4 галогеноалкила или C1-4 хлороалкоксила; R2 представляет собой Н, C1-8 насыщенный или ненасыщенный алкил, замещенный галогеном C 1-8 насыщенный или ненасыщенный алкил, -CH2CH 2OCH2CH3, -CH2CH2 OCH3, C1-8 насыщенный или ненасыщенный алкоксил, фенил, бензил, C1-4 алкилкарбонил или С 1-4 алкилсульфонил; R3 и R 4 независимо выбраны из Н, C1-6 алкила, аллила, бензила, C1-4алкоксил-С1-4алкила, С 1-4алкоксилкарбонила, феноксикарбонила, С2-6 алкинилкарбонила, C2-3алкенилкарбонила, С3-6 циклоалкилкарбонила, незамещенной бензоильной группы или бензоильной группы, замещенной одной или более чем одной группой, выбранной из группы, состоящей из атомов галогена, С1-4алкила, С1-4галогеноалкила, С1-4алкоксила или C 1-4алкилкарбонила, фуранкарбонила или N,N-диметилкарбонила; либо R3 и R4 вместе образуют -СН2 -СН2-, -СН2-СН2-СН2 - или -CH2-XR-CH2-, где Х представляет собой N, О, S или другой гетероатом; R представляет собой заместитель на Х и выбран из Н, С1-6алкила, аллила, бензила, фенила, C1-4алкоксил-С1-4алкила, С1-4 алкоксилкарбонила, феноксикарбонила, C2-6алкинилкарбонила, С2-3алкенилкарбонила, С3-6циклоалкилкарбонила, незамещенной бензоильной группы или бензоильной группы, замещенной одной или более чем одной группой, выбранной из группы, состоящей из атомов галогена, С1-4галогеноалкила, C1-8 насыщенного или ненасыщенного алкила или алкоксила, либо С 1-4алкилкарбонила, фуранкарбонила или N,N-диметилкарбонила. R5, R6, R7, R 8 и R9 представляют собой Н, насыщенный или ненасыщенный С1-4алкил, атом галогена, насыщенный или ненасыщенный C1-8алкоксил, насыщенный или ненасыщенный С1-4галогеноалкоксил, C1-4алкилкарбонил, C1-8алкилэфир, С1-4алкилсульфонил, фенил или бензил; Y представляет собой нитро, циано, трифторметил, трифторацетил или трифторметилсульфонил. В одном воплощении предпочтительно R1 выбран из пиридила, тиазолила, пиримидинила, тетрагидрофурила, оксазолила или их галогенированных групп. В одном воплощении предпочтительный R1 представляет собой галогенопиридил, галогенотиазолил, галогенопиримидинил, галогенотетрагидрофурил или галогенооксазолил. Предпочтительными галогенированными группами являются хлориды. В другом воплощении R1 представляет собой В другом воплощении R2 представляет собой Н, насыщенный или ненасыщенный С1-4алкил, насыщенный или ненасыщенный С1-4галогеноалкил, С1-4 алкилкарбонил, незамещенный бензил или бензил, замещенный одной или более чем одной группой, выбранной из группы, состоящей из атома галогена, С1-4галогеноалкила или С1-4 хлороалкоксила. В одном воплощении R2 представляет собой Н или С1-3алкил. Более предпочтительно R2 представляет собой Н или метил. В другом воплощении R3 и R4 представляют собой Н, С1-6алкил, либо R3 и R4 вместе образуют -CH2-CH2- или -СН 2-СН2-СН2-. В одном воплощении R3 и R4 представляют собой атом водорода или C1-3алкил, и предпочтительно Н, метил или этил. Альтернативно R3 и R4 вместе образуют -СН2-СН2- или -СН2-СН 2-СН2-. В другом воплощении R 5, R6, R7, R8 и R 9 представляют собой Н, насыщенный или ненасыщенный С 1-2алкил, атом галогена, насыщенный или ненасыщенный С 1-4алкоксил, насыщенный или ненасыщенный C1-2 галогеноалкоксил, С1-4алкилэфирную группу (RCOO-), С1-2алкилсульфонил или трифторметансульфонилэфирную группу. В одном воплощении R5, R 6, R7, R8 и R9 представляют собой Н, метил, атом хлора, атом брома, метоксил или этоксил и предпочтительно представляют собой Н, метил и метоксил. В другом воплощении Y представляет собой нитрогруппу или цианогруппу. В одном воплощении Y представляет собой нитрогруппу. В соответствии со вторым аспектом изобретения предложена агрохимическая композиция, содержащая: (a) 0,001-99,99 масс.% вышеупомянутого соединения, его оптического изомера, цис-транс-изомера, его агрохимически приемлемых солей или их комбинации; и (b) агрохимически приемлемый носитель или эксципиент. В одном воплощении концентрация компонента (а) составляет 0,01-99,9 масс.%, и предпочтительно 0,05-90 масс.%. В одном воплощении агрохимическую композицию применяют для уничтожения или борьбы с насекомыми, выбранными из группы, состоящей из Coleoptera, Lepidoptera, Hemiptera, Orthoptera, Isoptera и двукрылых насекомых. В одном воплощении вредители имеют ротовой аппарат колюще-сосущего типа или грызущего типа. В другом воплощении вредители включают настоящую тлю, коричневую рисовую цикаду, белокрылку, цикадку, трипсов, совку хлопковую, гусеницу, поражающую капусту, капустную моль, совку литура или гусеницу злаковых растений. В другом воплощении агрохимическая композиция дополнительно содержит другие активные соединения, которые выбраны из группы, состоящей из инсектицида, кобальта, бактерицидного агента, акарицида, нематицида, фунгицида и регуляторов роста. В соответствии с третьим аспектом изобретения предложено применение агрохимической композиции при уничтожении или борьбе с сельскохозяйственными вредителями, санитарными вредителями и вредителями, вредными для здоровья животных; либо агрохимическую композицию применяют как инсектицидную композицию для уничтожения или борьбы с сельскохозяйственными вредителями, санитарными вредителями и вредителями, вредными для здоровья животных. В соответствии с четвертым аспектом изобретения предложен способ уничтожения или борьбы с сельскохозяйственными вредителями, санитарными вредителями и вредителями, вредными для здоровья животных, включающий нанесение вышеописанной агрохимической или инсектицидной композиции на растения, окружающую их почву или окружающую среду, которая атакована или будет атакована насекомыми. В соответствии с пятым аспектом изобретения предложено применение соединения, его оптического изомера или цис-транс-изомера, его агрохимически приемлемых солей или их комбинации при получении инсектицидной композиции. В соответствии с шестым аспектом изобретения предложен способ получения соединения, его оптического изомера или цис-транс-изомера, его агрохимически приемлемых солей, включающий приведенные ниже стадии: В присутствии каталитической кислоты и при 0-60°С взаимодействие соединения формулы (а) с соединением (b), (с) или (d), в результате чего образуется соединение (А), (В), (С) или (D), где R2 представляет собой Н,
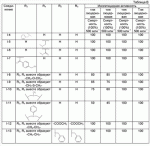
где R1, R3, R 4, R5, R6, R7, R8 , R9 и Y являются такими, как определено выше, и n равно 0 или 1. В одном воплощении температура реакции составляет 15-45°С, и предпочтительно 20-30°С. В другом воплощении растворитель выбран из ацетонитрила или этанола, и предпочтительно ацетонитрила. В другом воплощении каталитическая кислота выбрана из концентрированной соляной кислоты, концентрированной серной кислоты или бензойной кислоты, и предпочтительно концентрированной соляной кислоты. В одном воплощении способ включает: в присутствии каталитической кислоты приведенную ниже реакцию проводят при 20-30°С в ацетонитриле в течение 2-24 часов, в результате чего образуется соединение (А), где R2 представляет собой Н: в присутствии каталитической кислоты приведенную ниже реакцию проводят при 20-30°С в ацетонитриле в течение 2-24 часов, в результате чего образуется соединение (В): в присутствии каталитической кислоты приведенную ниже реакцию проводят при 10-50°С в ацетонитриле в течение 2-24 часов, в результате чего образуется соединение (С): в присутствии каталитической кислоты приведенную ниже реакцию проводят при 10-50°С в ацетонитриле в течение 2-24 часов, в результате чего образуется соединение (D): Подробное описание изобретения После долговременного и глубокого исследования авторы изобретения синтезировали новый класс неоникотиноидных производных, которые получают путем взаимодействия нитрометиленовых соединений с диальдегидом, основанный на нитрометиленовой группе современных нитрометиленовых неоникотиноидных инсектицидов. Эти новые производные проявляют значимо высокие активности и расширенный инсектицидный спектр. Авторы изобретения выполнили настоящее изобретение на основе вышеописанного. Определение заместителей Термин «C1-6алкил» относится к прямоцепочечному или разветвленному алкилу с 1-6 атомами углерода, такому как метил, этил, пропил, изопропил, бутил, изобутил, emop-бутил, mpem-бутил или некоторые подобные группы. Термин «С1-6алкоксил» относится к прямоцепочечному или разветвленному алкоксилу с 1-6 атомами углерода, такому как метоксил, этоксил, пропоксил, изопропоксил, бутоксил, изобутоксил, втор-бутоксил, трет-бутоксил или некоторые подобные группы. Термин «галоген» относится к атому фтора, хлора, брома или йода. Термин «галогенированный» относится к одному или более чем одному замещению одним и тем же или другим атомом «галогена», как упомянуто выше, такому кактрифторметил, пентафторэтил или подобные группы. Термин «5- или 6-членный гетероциклический алкил» относится к 5- или 6-членному кольцевому циклическому алкилу, содержащему один или более чем один гетероатом, выбранный из атома азота, кислорода или серы, такому как пиридил, тиазил, пиримидинил, тетрагидрофурил, оксазолил и т.д. Получение соединения по изобретению Соединения по изобретению можно синтезировать, как описано выше. Соединение (а) может быть получено в соответствии с техническими ссылками в данной области техники, такими как WO 2006056108 A1, WO 2007101369 A1 и PCT/CN 2008/071115. В одном воплощении соединение формулы (А) можно синтезировать, следуя приведенной ниже методике, где R2 представляет собой Н; В одном воплощении соединение формулы (В) можно синтезировать, следуя приведенной ниже методике: В одном воплощении соединение формулы (С) можно синтезировать, следуя приведенной ниже методике: В одном воплощении соединение формулы (D) можно синтезировать, следуя приведенной ниже методике: В одном воплощении соединение формулы (А) можно синтезировать, следуя приведенной ниже методике: (1) Раствор 2-хлор-5-(хлорметил)пиридина в ацетонитриле добавляют по каплям к раствору 5-10 моль диамина. Реакцию проводят при 0-50°С в течение 5-10 часов. После завершения смесь перегоняют при пониженном давлении для удаления диамина, растворяют в этилацетате и выпаривают с получением N-((6-хлорпиридин-3-ил)метил)диамина. (2) Смесь N-((6-хлорпиридин-3-ил)метил)диамина и 1,1-диметилтио-2-нитроэтена растворяют в этаноле и кипятят с обратным холодильником в течение 4-8 часов с получением нитрометиленового соединения. (3) В присутствии кислотного катализатора, такого как соляная кислота, серная кислота, гетерополикислоты и т.д., нитрометиленовое соединение взаимодействует с оксальдегидом (глиоксалем) с получением соединения формулы (А). В другом воплощении соединение формулы (В) можно синтезировать, следуя приведенной ниже методике: (1) К водному раствору этиламина добавляют соответствующее количество ацетонитрила. Затем 2-хлор-5-(хлорметил)пиридин в ацетонитриле добавляют по каплям в ледяной бане. Мониторинг реакции осуществляют с помощью ТСХ (тонкослойной хроматографии). После завершения в смесь добавляют большое количество воды, экстрагируют ДХМ (дихрорметаном), высушивают, фильтруют и выпаривают с получением N-((6-хлорпиридин-3-ил)метил)этенамина в виде масла. (2) Смесь N-((6-хлорпиридин-3-ил)метил)этенамина и 1,1-диметилтио-2-нитроэтена растворяют в этаноле и кипятят с обратным холодильником в течение 4-8 часов. После завершения смесь концентрируют и очищают колоночной хроматографией с получением N-((6-хлорпиридин-3-ил)метил)-N-этил-1-(метилтио)-2-нитроэтенамина. (3) Смесь спиртового раствора метиламина и N-((6-хлорпиридин-3-ил)метил)-N-этил-1-(метилтио)-2-нитроэтенамина растворяют в этаноле и подвергают взаимодействию в течение 4-8 часов в ледяной бане. После завершения смесь концентрируют и очищают колоночной хроматографией с получением N-((6-хлорпиридин-3-ил)метил)-N-этил-N'-метил-2-нитроэтен-1,1-диамина. (4) В присутствии кислотного катализатора, такого как соляная кислота, серная кислота, гетерополикислоты и т.д., N-((6-хлорпиридин-3-ил)метил)-N-этил-N'-метил-2-нитроэтен-1,1-диамин взаимодействует с малоновым альдегидом с получением соединения формулы (В). В другом воплощении соединение формулы (С) можно синтезировать, следуя приведенной ниже методике: (1) Раствор 2-хлор-5-(хлорметил)пиридина в ацетонитриле добавляют по каплям к раствору 5-10 моль диамина. Реакцию проводят при 0-50°С в течение 5-10 часов. После завершения смесь перегоняют при пониженном давлении для удаления диамина, растворяют в этилацетате и выпаривают с получением N-((6-хлорпиридин-3-ил)метил)диамина. (2) Смесь N-((6-хлорпиридин-3-ил)метил)диамина и 1,1-диметилтио-2-нитроэтена растворяют в этаноле и кипятят с обратным холодильником в течение 4-8 часов с получением нитрометиленового соединения. (3) В присутствии кислотного катализатора, такого как соляная кислота, серная кислота, гетерополикислоты и т.д., нитрометиленовое соединение взаимодействует с янтарным альдегидом с получением соединения формулы (С). В другом воплощении соединение формулы (D) можно синтезировать, следуя приведенной ниже методике: (1) Раствор 2-хлор-5-(хлорметил)пиридина в ацетонитриле добавляют по каплям к раствору 5-10 моль диамина. Реакцию проводят при 0-50°С в течение 5-10 часов. После завершения смесь перегоняют при пониженном давлении для удаления диамина, растворяют в этилацетате и выпаривают с получением N-((6-хлорпиридин-3-ил)метил)диамина. (2) Смесь N-((6-хлорпиридин-3-ил)метил)диамина и 1,1-диметилтио-2-нитроэтена растворяют в этаноле и кипятят с обратным холодильником в течение 4-8 часов с получением нитрометиленового соединения. (3) В присутствии кислотного катализатора, такого как соляная кислота, серная кислота, гетерополикислоты и т.д., нитрометиленовое соединение взаимодействует с глутаральдегидом с получением соединения формулы (D). Инсектиидная активность активных соединений по изобретению Термины «активный ингредиент по изобретению» или «активное соединение по изобретению» представляют собой соединение по изобретению, его оптически изомер или цис-транс-изомер, или его агрохимически приемлемые соли. «Активное соединение по изобретению» проявляет значительно повышенные активности и расширенный инсектицидный спектр. Термин «агрохимически приемлемые соли» означает, что анион соли является известным или приемлемым при образовании инсектицидно приемлемой соли. Предпочтительно соль растворима в воде. Соли, образованные соединениями формулы (А), (В), (С) и (D), включают соли, образованные с неорганической кислотой (например, гидрохлорат, фосфат, сульфат и нитрат) и соли, образованные с органической кислотой (например, ацетат и бензоат). Активное соединение по данному изобретению можно применять для борьбы и уничтожения обычных насекомых-вредителей сельскохозяйственных культур и растений, насекомых-вредителей зернохранилищ, насекомых, вредных для здоровья населения, и насекомых, вредных для здоровья животных. В данном изобретении термин «инсектицид» представляет собой любое соединение, которое предотвращает появление или борется с любым из вышеупомянутых насекомых. Примерные насекомые включают, но не ограничены ими; Coleoptera: Sitophilus zeamai, Tribolium castaneum, Henosepilachna vigintioctomaculata, Henosepilachna spars, Agriotes fuscicollis, Anomala cupripes, Popillia quadriguttata, Monolepta hieroglyphica, Monochamus alternatus, Echinocnemus squameus, Basiprionota bisignata, Anoplophora chinensis, Apripona gennari, Scolytus schevy, Agriotes fuscicollis. Lepidoptera: Lymantria dispar, Malacosoma neustria testacea, Diaphania perspectalis, Clania variegate, Cnidocampa flauescens, Dendrolimus punctatus, Orgyia gonostigma, Paranthrene tabaniformis, Spodoptera litura, Chilo suppressalis, Ostrinia nubilalis, Ephestia cautella, Adoxophyes orana, Laspyresia splendana, Agrotis fucosa, Galleria mellonella, Plutella xylostella, Phyllocnistis citrella, or Mythimna separate. Homoptera: Nephotettix cincticeps, Nilaparvata lugens, Pseudococcus comstocki, Unaspis yanonensis, Myzus persicae, Aphis gossydii, Lipaphis erysimi pseudobrassicae, Stephanitis nashi, or Bemisia tabaci. Orthoptera: Blattella germanica, Periplaneta americana, Gryllotalpa africana, or Locusta migratoria. Isoptera: Solenopsis invicta, Coptotermes formosanus. Diptera: Musca domestica, Aedes aegypti, Delia platura, Culex sp., Anopheles sinensis. Насекомые, вредные для здоровья человека: Boophilus microplus, Haemaphysalis longicornis, Hyalomma anatolicum, Hypoderma spp., Fasciola hepatica, Moniezia Blanchard, Ostertagia spp., Trypanosoma enansi, Babesia bigemina, etc. Соединения по изобретению обладают специфичными эффектами на насмекомых-вредителей сельскохозяйственных культур и растений, имеющих колюще-сосущий или грызущий ротовой аппарат, таких как тля, цикадка, коричневая рисовая цикада, трипсы, белокрылка и т.д. Инсектицидная композиция, содержащая соединение по изобретению Активные соединения по изобретению можно обычно включать в инсектицидную композицию. Активные соединения по изобретению можно включать в общепринятые препараты, такие как растворы, эмульсии, суспензии, порошки, пенки, пасты, гранулы, аэрозоли, натуральные и синтетические материалы, пропитанные активными соединениями, и микрокапсулы в полимерах, покрывающий комплекс для семян, препараты, используемые с камерой сгорания (такой как дымовой цилиндр, дымовая коробка и дымовая пластина) и препараты холодного аэрозоля и теплого аэрозоля ULV. Эти препараты могут быть получены известным способом, например, путем смешивания активных соединений с наполнителями, которые являются жидкими или в виде сжиженного газа, твердыми разбавителями или носителями, необязательно с использованием поверхностно-активных агентов, которые являются эмульгирующими агентами и/или диспергирующими агентами, и/или пенообразующими агентами. В случае использования воды в качестве наполнителя органические растворители можно также использовать как вспомогательные растворители. Обычно правильно использовать жидкие растворители в качестве разбавителя или носителя, например, ароматические углеводороды, такие как ксилол, толуол и алкилнафталины; хлорированные ароматические или хлорированные алифатические углеводороды, такие как хлорбензолы, хлорэтилены и метиленхлорид; алифатические углеводороды, такие как циклогексан или парафины, например, нефтяные фракции; спирты, такие как этанол или гликоль, а также их простые эфиры и сложные эфиры; кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон или циклогексанон; либо нераспространенные полярные растворители, такие как диметилформаммид и диметилсульфоксид, а также вода. Под сжиженными газообразными разбавителями или носителями подразумевают жидкости, которые являются газообразными при нормальной температуре и при нормальном давлении, например, аэрозольные пропелленты, такие как галогенированные углеводороды, а также бутан, пропан, азот и диоксид углерода. Твердый носитель включает измельченные природные минералы, такие как каолины, глины, тальки, кварцы, аттапульгиты, монтмориллониты или кизельгуры; измельченные синтетические минералы, такие как высокодисперсная кремниевая кислота, оксид алюминия и силикат. Твердый носитель, используемый для частиц, представляет собой дробленые и фракционированные природные камни, такие как кальцит, мрамор, пемза, сепиолит и доломит, а также синтетические гранулы неорганического или органического крупного порошка и гранулы органического материала, такого как древесные опилки, скорлупа кокосовых орехов, кукурузные початки и стебли табака и тому подобное. В качестве эмульгирующих и/или пенообразующих агентов можно использовать неионные и анионные эмульгаторы, такие как сложные эфиры полиоксиэтилена и жирных кислот, простые эфиры полиоксиэтилена и жирных спиртов, например, алкиларилполигликолевые эфиры, алкилсульфонаты, алкилсульфаты, арилсульфонаты, а также продукты гидролиза альбумина. Диспергирующие агенты включают, например, лигнин, отработанные сульфитные щелоки и метилцеллюлозу. Клеящие вещества, такие как карбоксиметилцеллюлоза и природные и синтетические полимеры (такие как аравийская камедь, поливиниловый спирт и поливинилацетат) в форме порошков, гранул или эмульсий можно использовать в препаратах. Возможно использовать красители, такие как неорганические красящие вещества, например, оксид железа, оксид кобальта и берлинская лазурь, и органические красящие вещества, такие как красящие вещества, представляющие собой диазосоединения, или красящие вещества, представляющие собой фталоцианины металлов, и питательные микроэлементы, такие как соли железа, марганца, бора, меди, кобальта, алюминия и цинка. Активное соединение по изобретению может быть представлено в виде смеси с другими активными соединениями в коммерческом препарате или в форме применения, полученной из коммерческого препарата. Другие соединения могут представлять собой инсектицид, бактерицидный агент, акарицид, нематоцид, фунгицид, регулятор роста и тому подобное. Инсектицид включает, например, фосфаты, карбаматы, пиретроиды, хлорированные углеводороды, бензоилмочевину, нереистоксин и вещество, продуцируемое микроорганизмами, такое как авермектин. Кроме того, активное соединение по изобретению может быть представлено в виде смеси с синергистом в коммерческом препарате или в форме применения, полученной из коммерческого препарата. Синергист используют для усиления действия активного соединения, если само соединение активно, необязательно использовать синергист. Как правило, препараты содержат 0,001-99,99 мас.%, предпочтительно 0,01-99,9 мас.% и более предпочтительно 0,05-90 мас.% активного соединения по изобретению. Концентрация активного соединения в форме применения, полученной из коммерческого препарата, может варьировать в широком диапазоне. Концентрация активного соединения в препарате для применения составляет, например, 0,0000001-100% (мас./об.) и предпочтительно 0,0001-1%. Примеры Далее изобретение проиллюстрировано приведенными ниже примерами. Должно быть понятно, что эти примеры предназначены только для иллюстрации изобретения, и не ограничивают объема изобретения. Что касается экспериментальных методов в приведенных ниже примерах, их осуществляют в обычных условиях или в соответствии с инструкциями изготовителей, если не указано иное. Процентное содержание и доли вычислены по массе. Термин «к.т.» представляет собой комнатную температуру. Пример 1 Синтез 4-(1-((6-хлорпиридин-3-ил)метил)-4,5-дигидро-1Н-имидазол-2-ил)-1-(1-((6-хлорпиридин-3-ил)метил)имидазолидин-2-илиден)-1,4-динитробут-3-ен-2-ола (соединение 13) В соответствии со способом, описанным в WO 2006056108 А1 и WO 2007101369 А1, 2-хлор-5-((2-(нитрометилен)имидазолидин-1-ил)метил)пиридин был получен из 2-хлор-5-(хлорметил)пиридина (0,03 моль) при выходе 56%. Rf=0,46 (петролейный эфир: EtOAc=1:1); т.пл.=156,9°С-161,8°С; ЖХ-МС (m/s): 220 (25), 126 (100), 90 (9). Синтез 4-(1-((6-хлорпиридин-3-ил)метил)-4,5-дигидро-1Н-имидазол-2-ил)-1-(1-((6-хлорпиридин-3-ил)метил)имидазолидин-2-илиден)-1,4-динитробут-3-ен-2-ола В 50 мл круглодонную колбу добавляли 1,27 г (0,005 моль) 2-хлор-5-((2-(нитрометилен)имидазолидин-1-ил)метил)пиридина, 30 мл ацетонитрила и 3 мл 30% водного раствора оксальдегида. После перемешивания в течение 0,5 часа добавляли катализатор - концентрированную HCl. Затем реакционную смесь перемешивали и проводили мониторинг по ТСХ до завершения. После этого смесь фильтровали с получением белого порошка, который кристаллизовали с получением 1,05 г чистого конечного продукта в виде белого порошкообразного твердого вещества. Выход: примерно 76%. Т.пл.=164,6-165,3°С; 1H ЯМР (400 МГц, ДМСО-d 6): Пример 2 Синтез 2-хлор-5-((4-(1-((6-хлорпиридин-3-ил)метил)имидазолидин-2-илиден)-2-метокси-1,4-динитробут-3-енил)-4,5-дигидроимидазол-1-ил)метил) пиридина (соединение 14) В 50 мл круглодонную колбу добавляли 0,549 г (0,001 моль) соединения 13, 10 мл метанола, 50 мл дихлорметана и каталитическое количество концентрированной HCl. Реакционную смесь кипятили с обратным холодильником и проводили мониторинг по ТСХ. После завершения смесь выпаривали для удаления растворителя и очищали колоночной хроматографией с получением конечного продукта в виде желтого порошка (выход 62%). Т.пл.=151,6-153,1°С; 1H ЯМР (400 МГц, ДМСО-d6): Пример 3 Синтез N1,N 7-бис((6-хлорпиридин-3-ил)метил)-N1,N7 -диэтил-N1,N7-диметил-2,6-динитрогепта-2,5-диендиамина (Соединение 37) (1): Синтез N-((6-хлорпиридин-3-ил)метил)этанамина 65-70% раствор этиламина (70 г, 1 моль), ацетонитрил 50 мл, добавляли в трехгорлую круглодонную колбу, оборудованную капельной воронкой с выравниванием давления и термометром. Раствор перемешивали в ледяной бане в течение 15 мин с контролем температуры около 0°С. Затем добавляли 2-хлор-5-(хлорметил)пиридин (16,10 г, 0,10 моль) в 25 мл ацетонитрила с помощью капельной воронки с выравниванием давления в течение 3,5 ч со скоростью 3 капли/мин. После завершения добавляли воду, и реакционную смесь экстрагировали ДХМ. Органическую фазу собирали с получением, таким образом, 14 г N-((6-хлорпиридин-3-ил)метил)этанамина в виде масла при выходе 70%. ЖХ-МС: m/z (%)=170 ([М]+, 20), 155 (80), 126 (100), 114 (10), 90 (12). (2): Синтез N-((6-хлорпиридин-3-ил)метил)-N-этил-1-(метилтио)-2-нитроэтенамина В 100 мл трехгорлую круглодонную колбу добавляли N-((6-хлорпиридин-3-ил)метил)этанамин (17,0 г, 0,1 моль), (2-нитроэтен-1,1-диил)бис(метилсульфан) (15,0 г, 0,09 моль), сухой этанол (50 мл). Смесь кипятили с обратным холодильником. После завершения реакционную смесь охлаждали до к.т. и концентрировали при пониженном давлении с получением сырого продукта в виде масла, которое очищали колоночной хроматографией с получением 5,3 г N-((6-хлорпиридин-3-ил)метил)-М-этил-1-(метилтио)-2-нитроэтенамина при выходе 18,5%. ЖХ-МС: m/z (%)=242 ([М]+-46, 53), 227 (15), 213 (100), 169 (45), 155 (28), 141 (29), 126 (91), 90 (12). (3): Синтез N-((6-хлорпиридин-3-ил)метил)-N-этил-N'-метил-2-нитроэтен-1,1-диамина В 100 мл круглодонную колбу добавляли N-((6-хлорпиридин-3-ил)метил)-N-этил-1-(метилтио)-2-нитроэтенамин (5 г, 0,017 моль), спиртовой раствор метиламина (1,8 г, 0,017 моль), сухой этанол (30 мл). Смесь перемешивали в бане со льдом до снижения температуры до 0°С и постоянно перемешивали до завершения реакции. Реакционную смесь выпаривали при пониженном давлении для удаления растворителя и концентрировали с получением сиропа, который растворяли в некотором количестве ДХМ и очищали колоночной хроматографией, используя ДХМ/МеОН=25:1 в качестве элюента и силикагель в качестве наполнителя. Получали 0,9 г N-((6-хлорпиридин-3-ил)метил)-N-этил-N-метил-2-нитроэтен-1,1-диамина при выходе 19,1%. Rf=0,23 (ДХМ/ацетон=5:1,); т.пл.=78-80°С, (лит. [67] 79-81°С); ЖХ-МС: m/z (%)=236 ([М]+-34, 32), 207 (49), 169 (52), 126 (49), 110 (20), 90 (16), 67 (100). 16,65. (4): Синтез N1,N7-бис((6-хлорпиридин-3-ил)метил)-N 1,N7-диэтил-N1',N7' -диметил-2,6-динитрогепта-2,5-диенамидина (соединение 37) В 50 мл круглодонную колбу добавляли 1,35 г (0,005 моль) N-((6-хлорпиридин-3-ил)метил)-N-этил-N-метил-2-нитроэтен-1,1-диамина, 30 мл сухого ацетонитрила, 0,72 г (0,01 моль) малонового альдегида и каталитическое количество концентрированной HCl. Реакционную смесь перемешивали при к.т. и проводили мониторинг по ТСХ. После завершения смесь выпаривали для удаления растворителя и очищали колоночной хроматографией с получением конечного продукта в виде бледно-желтого порошка при выходе 56%. Т.пл.=117,3-118,7°С; 1H ЯМР (400 МГц, ДМСО-d6): Пример 4 Синтез 2-хлор-5-((5-(1-((6-хлорпиридин-3-ил)метил)-4,5-дигидро-1Н-имидазол-2-ил)-1,5-динитропента-1,4-диенил)-4,5-дигидроимидазол-1-ил)метил)пиридина (соединение 39) В 50 мл круглодонную колбу добавляли 1,27 г (0,005 моль) 2-хлор-5-((2-(нитрометилен)имидазолидин-1-ил)метил)пиридина, 30 мл сухого ацетонитрила, 0,720 г (0,01 моль) малонового альдегида и каталитическое количество HCl. Реакционную смесь перемешивали при к.т. и проводили мониторинг по ТСХ. После завершения смесь выпаривали для удаления растворителя и очищали колоночной хроматографией с получением конечного продукта в виде бледно-желтого порошка при выходе 52%. Т.пл.=136,5-137,8°С; 1H ЯМР (400 МГц, ДМСО-d6): Пример 5 Синтез 1-((2-хлортиазол-5-ил)метил)-5-(1-((2-хлортиазол-5-ил)метил)-4,5-дигидро-1Н-имидазол-2-ил)-1,5-динитропента-1,4-диенил)-4,5-дигидро-1Н-имидазола (соединение 41) Следуя способу, описанному в Примере 1, 0,03 моль 2-хлор-5-(хлорметил)тиазола использовали вместо 2-хлор-5-(хлорметил)пиридина в качестве исходного вещества и получили 1-((2-хлортиазол-5-ил)метил)-2-(нитрометилен)имидазолидин при выходе 56%. ЖХ-МС (m/s) 226 (24), 132 (100), 77 (9). Синтез 1-((2-хлортиазол-5-ил)метил)-5-(1-((2-хлортиазол-5-ил)метил)-4,5-дигидро-1Н-имидазол-2-ил)-1,5-динитропента-1,4-диенил)-4,5-дигидро-1Н-имидазола В 50 мл круглодонную колбу добавляли 1,30 г (0,005 моль) 1-((2-хлортиазол-5-ил)метил)-2-(нитрометилен)имидазолидина, 30 мл сухого ацетонитрила, 0,720 г (0,01 моль) малонового альдегида и каталитическое количество концентрированной HCl. Реакционную смесь перемешивали при к.т. и проводили мониторинг no TCX. После завершения смесь выпаривали для удаления растворителя и очищали колоночной хроматографией с получением конечного продукта в виде бледно-желтого порошка при выходе 44%. Т.пл.=138,6-139,9°С; 1H ЯМР (400 МГц, ДМСО-d6): Пример 6 Синтез 1-((6-хлорпиридин-3-ил)метил)-5-(1-((6-хлорпиридин-3-ил)метил)-1,4,5,6-тетрагидропиримидин-2-ил)-1,5-динитропента-1,4-диенил)-1,4,5,6-тетрагидропиримидина (соединение 43) В соответствии со способом, описанным в WO 2006056108 А1 и WO 2007101369 A1, 1-((6-хлорпиридин-3-ил)метил)-2-(нитрометилен)-гексагидропиримидин получали из 2,42 г (0,015 ммоль) 2-хлор-5-(хлорметил)пиридина при выходе 56%; Rf=0,19 (EtOH: ДХМ=1:1); т.пл.=175,7°С-182,6°С; ЖХ-МС (m/s): 225 (100), 196 (9), 154 (10), 139 (11), 126 (31), 113 (10), 90 (31). Синтез 1-((6-хлорпиридин-3-ил)метил)-5-(1-((6-хлорпиридин-3-ил)метил)-1,4,5,6-тетрагидропиримидин-2-ил)-1,5-динитропента-1,4-диенил)-1,4,5,6-тетрагидропиримидина В 50 мл круглодонную колбу добавляли 1,34 г (0,005 моль) 1-((6-хлорпиридин-3-ил)метил)-2-(нитрометилен)-гексагидропиримидина, 30 мл сухого ацетонитрила и 0,720 г (0,01 моль) малонового альдегида и каталитическое количество концентрированной HCl. Реакционную смесь перемешивали при к.т. и проводили мониторинг по ТСХ. После завершения смесь выпаривали для удаления растворителя и очищали колоночной хроматографией с получением конечного продукта в виде бледно-желтого порошка при выходе 55%. Т.пл.=133,7-134,9°С; 1H ЯМР (400 МГц, ДМСО-d6): Пример 7 Синтез N-((6-хлорпиридин-3-ил)метил)-N-этил-2-метил-4-нитро-8-окса-2-аза-бицикло[3.2.1]окт-3-ен-3-амина (соединение 46) В 50 мл круглодонную колбу добавляли 1,35 г (0,005 моль) N-((6-хлорпиридин-3-ил)метил)-N-этил-N'-метил-2-нитроэтен-1,1-диамина, 30 мл сухого ацетонитрила, 0,860 г (0,01 моль) янтарного альдегида и каталитическое количество концентрированной HCl. Реакционную смесь перемешивали при к.т. и проводили мониторинг по ТСХ. После завершения смесь выпаривали для удаления растворителя и очищали колоночной хроматографией с получением конечного продукта в виде бледно-желтого порошка при выходе 40%. Т.пл.=125,3-125,7°С; 1H ЯМР (400 МГц, ДМСО-d6): Пример 8 Синтез 1-((6-хлорпиридин-3-ил)метил)-9-нитро-2,3,5,6,7,8-гексагидро-1Н-5,8-эпоксиимидазо[1,2-а]азепина (соединение 52) В 50 мл круглодонную колбу добавляли 1,27 г (0,005 моль) 2-хлор-5-((2-(нитрометилен)имидазолидин-1-ил)метил)пиридина, 30 мл сухого ацетонитрила, 0,860 г (0,01 моль) янтарного альдегида и каталитическое количество концентрированной HCl. Реакционную смесь перемешивали при к.т. и проводили мониторинг по ТСХ. После завершения смесь выпаривали для удаления растворителя и очищали колоночной хроматографией с получением конечного продукта в виде бледно-желтого порошка при выходе 71%. Т.пл.=149,0-150,0°С; 1H ЯМР (400 МГц, ДМСО-d6): Пример 9 Синтез 1-((2-хлортиазол-5-ил)метил)-9-нитро-2,3,5,6,7,8-гексагидро-1Н-5,8-эпоксиимидазо[1,2-а]азепина (соединение 53) В 50 мл круглодонную колбу добавляли 1,30 г (0,005 моль) 1-((2-хлортиазол-5-ил)метил)-2-(нитрометилен)имидазолидина, 30 мл сухого ацетонитрила, 0,860 г (0,01 моль) янтарного альдегида и каталитическое количество концентрированной HCl. Реакционную смесь перемешивали при кт и проводили мониторинг по ТСХ. После завершения смесь выпаривали для удаления растворителя и очищали колоночной хроматографией с получением конечного продукта в виде бледно-желтого порошка при выходе 63%. Т.пл.=151,7-152,1°С; 1H ЯМР (400 МГц, ДМСО-d6): Пример 10 Синтез 1-((6-хлорпиридин-3-ил)метил)-10-нитро-1,2,3,4,6,7,8,9-октагидро-6,9-эпоксипиримидо[1,2-а]азепина (соединение 61) В 50 мл круглодонную колбу добавляли 1,34 г (0,005 моль) (Е)-1-((6-хлорпиридин-3-ил)метил)-2-(нитрометилен)-гексагидропиримидина, 30 мл сухого ацетонитрила и 0,860 г (0,01 моль) янтарного альдегида и каталитическое количество концентрированной HCl. Реакционную смесь перемешивали при к.т. и проводили мониторинг по ТСХ. После завершения смесь выпаривали для удаления растворителя и очищали колоночной хроматографией с получением конечного продукта в виде бледно-желтого порошка при выходе 38%. Т.пл.=143,2-144,9°С; 1H ЯМР (400 МГц, ДМСО-d6): Пример 11 Синтез 1-((6-хлорпиридин-3-ил)метил)-2,3,5,6,7,8-гексагидро-1Н-5,8-эпоксиимидазо[1,2-а]азепин-9-карбонитрила (соединение 64) В 50 мл круглодонную колбу добавляли 1,17 г (0,005 моль) 2-(1-((6-хлорпиридин-3-ил)метил)имидазолидин-2-илиден)ацетонитрила, 30 мл сухого ацетонитрила и 0,860 г (0,01 моль) янтарного альдегида и каталитическое количество концентрированной HCl. Реакционную смесь перемешивали при к.т. и проводили мониторинг по ТСХ. После завершения смесь выпаривали для удаления растворителя и очищали колоночной хроматографией с получением конечного продукта в виде бледно-желтого порошка при выходе 66%. Т.пл.=125,1-126,8°С; 1H ЯМР (400 МГц, ДМСО-d6): Пример 12 Синтез 1-((6-хлорпиридин-3-ил)метил)-10-нитро-1,2,3,5,6,7,8,9-октагидро-5,9-эпоксиимидазо[1,2-а]азоцина (соединение 77) В 50 мл круглодонную колбу добавляли 1,27 г (0,005 моль) 2-хлор-5-((2-(нитрометилен)имидазолидин-1-ил)метил)пиридина, 30 мл ацетонитрила, 3 мл 25% водного раствора глутаральдегида (0,0075 моль глутаральдегида) и каталитическое количество концентрированной HCl. Реакционную смесь перемешивали при кт и проводили мониторинг по ТСХ. После завершения смесь выпаривали для удаления растворителя и очищали колоночной хроматографией с получением конечного продукта в виде бледно-желтого порошка при выходе 86%. Т.пл.=174,7-175,4°С; 1H ЯМР (400 МГц, ДМСО-d 6): Пример 13 Синтез 10-нитро-1-((тетрагидрофуран-3-ил)метил)-1,2,3,5,6,7,8,9-октагидро-5,9-эпоксиимидазо[1,2-а]азоцина (соединение 80) Следуя способу, описанному в Примере 1, 0,2 моль 3-(хлорметил)тетрагидрофурана использовали вместо 2-хлор-5-(хлорметил)пиридина в качестве исходного вещества. Получали 2-(нитрометилен)-1-((тетрагидрофуран-3-ил)метил)имидазолидин при выходе 51%. ЖХ-МС (m/s) 177 (29), 99 (100), 56 (9). Синтез 10-нитро-1-((тетрагидрофуран-3-ил)метил)-1,2,3,5,6,7,8,9-октагидро-5,9-эпоксиимидазо[1,2-а]азоцина В 50 мл круглодонную колбу добавляли 1,065 г (0,005 моль) 2-(нитрометилен)-1-((тетрагидрофуран-3-ил)метил)имидазолидина, 30 мл ацетонитрила, 3 мл 25% водного раствора глутаральдегида (0,0075 моль глутаральдегида) и каталитическое количество концентрированной HCl. Реакционную смесь перемешивали при к.т. и проводили мониторинг по ТСХ. После завершения смесь выпаривали для удаления растворителя и очищали колоночной хроматографией с получением конечного продукта в виде бледно-желтого порошка при выходе 36%. Т.пл.=115,3-116,9°С; 1H ЯМР (400 МГц, ДМСО-d 6): Пример 14 Тест на инсектицидную активность соединений по изобретению (1) Тест на активность в отношении тли люцерновой (Aphis craccivoral) Тли, которые принадлежат к Homoptera и имеют колюще-сосущий ротовой аппарат, являются распространенными насекомыми для сельскохозяйственных растений. Aphis craccivoral тестировали путем погружения. Метод тестирования: точно взвешенные различные образцы независимо добавляли к N,N-диметилформамиду с получением 10 г/л маточного раствора. Смесь разводили 0,2 мл/л водным раствором Тритона Х-100 до концентрации 500 м.д. После стабильного сосания на проростках фасоли взрослых тлей без крыльев вместе с проростками фасоли погружали в разведение 500 м.д., вынимали через 5 секунд, и избыточное разведение отсасывали промокательной бумагой, и взрослых тлей без крыльев инкубировали в чистом сосуде при постоянной температуре 23°С. Каждую концентрацию повторяли 3 раза, и контрольная группа содержала 0,2 мл/л водного раствора Тритон Х-100. Число погибших тлей подсчитывали через 24 часа для вычисления смертности по следующей формуле: смертность (%) = (число контрольных живых тлей - число обработанных живых тлей)/число контрольных живых тлей × 100%. Результаты приведены ниже в таблицах 1-4. (2) Тест на активность в отношении коричневых рисовых цикад {Nilaparvata lugens) Коричневые рисовые цикады, которые принадлежат к Homoptera и имеют колюще-сосущий ротовой аппарат, являются распространенными насекомыми для сельскохозяйственных растений. Nilaparvata lugens тестировали путем распыления. Метод тестирования; тестируемое соединение точно готовили в растворе ацетона до конечной концентрации 500, 250, 100, 50, 25, 12,5, 6,25, 3,13, 1,57 и 0,79 м.д. Водный раствор ацетона использовали в качестве контроля. Каждый процесс повторяли в 3 сосудах (3 раза). 2 мл раствора равномерно распыляли на каждую чашку с помощью ручного мини-опрыскивателя. 10 Nilaparvata lugens вводили в каждую ванночку за 6 часов до распыления. Проводили три серии экспериментов. Число погибших Nilaparvata lugens подсчитывали через 24 часа для вычисления смертности с использованием вышеупомянутой формулы. Результаты представлены ниже в таблицах 1-4. (3) Тест на активность в отношении гусеницы, поражающей злаковые растения (Pseudaletia separate Walker) Гусениц, поражающих злаковые растения, тестировали путем скармливания погруженных листьев. Тестируемое соединение точно готовили в растворе ацетона до конечной концентрации 500, 250, 100, 50, 25, 12,5, 6,25, 3,13, 1,57 и 0,79 м.д. Водный раствор ацетона использовали в качестве контроля. Свежие листья кукурузы погружали в раствор на 3 секунды и высушивали при комнатной температуре и использовали для скармливания тестируемым насекомым. Каждый процесс повторяли 3 раза, причем в каждом эксперименте тестировали 10 гусениц. Число погибших гусениц подсчитывали через 24 часа для вычисления смертности с использованием вышеупомянутой формулы. Результаты представлены ниже в таблицах 1-4. (4) Тест на активность в отношении капустной моли (Plutella xylostella) Капустную моль тестировали путем скармливания погруженных листьев. Свежие листья капусты погружали в вышеупомянутый раствор на 3 секунды и и высушивали при комнатной температуре и использовали для скармливания тестируемым насекомым. Каждый процесс повторяли 3 раза, причем в каждом эксперименте тестировали 10 капустных молей. Число погибших капустных молей подсчитывали через 24 часа для вычисления смертности с использованием вышеупомянутой формулы. Результаты представлены ниже в таблицах 1-4. Таблица 1 Инсектицидные активности соединения формулы (А) 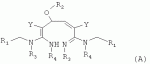 Соед. Соед.  R1 R2 R3 R4Y Инсектицидная активностьТля люцерноваяКоричневая рисовая цикада Гусеница злаковая Моль капустнаяСмертность (100%) 500 м.д.Смертность (100%) 500 м.д. Смертность (100%) 500 м.д. Смертность (100%) 500 м.д.1 R1 R2 R3 R4Y Инсектицидная активностьТля люцерноваяКоричневая рисовая цикада Гусеница злаковая Моль капустнаяСмертность (100%) 500 м.д.Смертность (100%) 500 м.д. Смертность (100%) 500 м.д. Смертность (100%) 500 м.д.1  H C2H5СН3 NO2 8091100 1002 H C2H5СН3 NO2 8091100 1002  СН3 C2H5 СН3NO2 100100100 1003 СН3 C2H5 СН3NO2 100100100 1003  C2H 5C2H5 СН3NO 2100100 100100 4 C2H 5C2H5 СН3NO 2100100 100100 4 С3Н7 C2H5 СН3NO 2100100 100100 5 С3Н7 C2H5 СН3NO 2100100 100100 5 i-С3Н7 С2Н5 СН3NO 2100100 100100 6 i-С3Н7 С2Н5 СН3NO 2100100 100100 6 бензил C2H5СН3 NO2 100100100 1007 бензил C2H5СН3 NO2 100100100 1007  H НСН3 NO224 353521 8 H НСН3 NO224 353521 8 СН3 НСН3 NO245 446756 9 СН3 НСН3 NO245 446756 9 C2H5 НСН 3NO2 8987100 10010 C2H5 НСН 3NO2 8987100 10010  С3Н7 НСН 3NO2 453687 9011 С3Н7 НСН 3NO2 453687 9011  i-С3Н7 НСН 3NO2 769095 10012 i-С3Н7 НСН 3NO2 769095 10012  бензил НСН3 NO267 9297100 13 бензил НСН3 NO267 9297100 13 Н R3 и R4 вместе образуют -CH2 -CH2NO2 NO285 100100 14 Н R3 и R4 вместе образуют -CH2 -CH2NO2 NO285 100100 14 СН3 R3 и R4 вместе образуют -CH2 -CH2NO2 100100100 10015 СН3 R3 и R4 вместе образуют -CH2 -CH2NO2 100100100 10015  C2H5 R3 и R4 вместе образуют -CH2-CH2 NO2100 100100100 16 C2H5 R3 и R4 вместе образуют -CH2-CH2 NO2100 100100100 16 С3Н7 R3 и R4 вместе образуют -CH2-CH2 NO2100 100100100 17 С3Н7 R3 и R4 вместе образуют -CH2-CH2 NO2100 100100100 17 i-С3Н7 R3 и R4 вместе образуют -CH2-CH2 NO2100 100100100 18 i-С3Н7 R3 и R4 вместе образуют -CH2-CH2 NO2100 100100100 18 бензил R3 и R4 вместе образуют -CH2 -CH2NO2 100100100 10019 бензил R3 и R4 вместе образуют -CH2 -CH2NO2 100100100 10019  Н R3 и R4 вместе образуют -CH2 -CH2CN 90100100 10020 Н R3 и R4 вместе образуют -CH2 -CH2CN 90100100 10020  Н R3 и R4 вместе образуют -CH2 -CH2CN 98100100 10021 Н R3 и R4 вместе образуют -CH2 -CH2CN 98100100 10021  Н R3 и R4 вместе образуют -CH2 -CN100 100100 100 Н R3 и R4 вместе образуют -CH2 -CN100 100100 100   CH2- CH2-      22 22  H R3 и R4 вместе образуют -CH2 -CH2CN 7310092 10023 H R3 и R4 вместе образуют -CH2 -CH2CN 7310092 10023  H R3 и R4 вместе образуют -CH2 -CH2CN 568787 10024 H R3 и R4 вместе образуют -CH2 -CH2CN 568787 10024  H R3 и R4 вместе образуют -CH2 -CH2CN 658390 10025 H R3 и R4 вместе образуют -CH2 -CH2CN 658390 10025 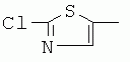 H R3 и R4 вместе образуют -CH2 -CH2NO2 8987100 10026 H R3 и R4 вместе образуют -CH2 -CH2NO2 8987100 10026  H R3 и R4 вместе образуют -CH2 -CH2NO2 100100100 10027 H R3 и R4 вместе образуют -CH2 -CH2NO2 100100100 10027  H R3 и R4 вместе образуют -CH2 -CH2NO2 100100100 10028 H R3 и R4 вместе образуют -CH2 -CH2NO2 100100100 10028  H R3 и R4 вместе образуют -CH2 -CH2NO2 100100100 10029 H R3 и R4 вместе образуют -CH2 -CH2NO2 100100100 10029  H R3 и R4 вместе образуют -CH2 -CH2NO2 100100100 10030 H R3 и R4 вместе образуют -CH2 -CH2NO2 100100100 10030  H R3 и R4 вместе образуют -CH2 -CH2-CH2-NO 2100100 100100 31 H R3 и R4 вместе образуют -CH2 -CH2-CH2-NO 2100100 100100 31 H R3 и R4 вместе образуют -CH2 -CH2-CH2-NO 24677 7783 32 H R3 и R4 вместе образуют -CH2 -CH2-CH2-NO 24677 7783 32 H R3 и R4 вместе образуют -CH2 -CH2-CH2-NO 26561 8792 33 H R3 и R4 вместе образуют -CH2 -CH2-CH2-NO 26561 8792 33 H R3 и R4 вместе образуют -CH2 -CH2-CH2-NO 23250 5852 34 H R3 и R4 вместе образуют -CH2 -CH2-CH2-NO 23250 5852 34 H R3 и R4 вместе образуют -CH2 -CH2-CH2-NO 27688 9086 35 H R3 и R4 вместе образуют -CH2 -CH2-CH2-NO 27688 9086 35 H R3 и R4 вместе образуют -CH2 -CH2-CH2-NO 27690 6877 36 H R3 и R4 вместе образуют -CH2 -CH2-CH2-NO 27690 6877 36 H R3 и R4 вместе образуют -CH2 -CH2-CH2-NO 28797 100100 Таблица 2 Инсектицидные активности соединения формулы (В) H R3 и R4 вместе образуют -CH2 -CH2-CH2-NO 28797 100100 Таблица 2 Инсектицидные активности соединения формулы (В) 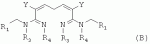 Соед. Соед.  R1 R3 R4Y Инсектицидная активностьТля люцерноваяТля люцерновая Тля люцерноваяТля люцерновая Смертность (100%) 500 м.д. Смертность (100%) 500 м.д.Смертность (100%) 500 м.д.Смертность (100%) 500 м.д.37 R1 R3 R4Y Инсектицидная активностьТля люцерноваяТля люцерновая Тля люцерноваяТля люцерновая Смертность (100%) 500 м.д. Смертность (100%) 500 м.д.Смертность (100%) 500 м.д.Смертность (100%) 500 м.д.37  C2H5 СН3NO 2100100 100100 38 C2H5 СН3NO 2100100 100100 38 HСН 3NO2 100100100 10039 HСН 3NO2 100100100 10039  R3 и R 4 вместе образуют -CH2-CH2 NO2NO2 100100100 40 R3 и R 4 вместе образуют -CH2-CH2 NO2NO2 100100100 40 R3 и R 4 вместе образуют -CH2-CH2 CN5687 87100 41 R3 и R 4 вместе образуют -CH2-CH2 CN5687 87100 41 R3 и R 4 вместе образуют -CH2-CH2 NO2100 100100100 42 R3 и R 4 вместе образуют -CH2-CH2 NO2100 100100100 42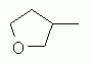 R3 и R 4 вместе образуют -CH2-CH2 NO2100 100100100 43 R3 и R 4 вместе образуют -CH2-CH2 NO2100 100100100 43 R3 и R 4 вместе образуют -CH2-CH2-CH 2-NO2 7887100 96 R3 и R 4 вместе образуют -CH2-CH2-CH 2-NO2 7887100 96 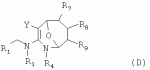 Соед. Соед.  R1 R3 R4R7 , R8, R9 YИнсектицидная активность Тля люцерновая Тля люцерноваяТля люцерновая Тля люцерноваяСмертность (100%) 500 м.д.Смертность (100%) 500 м.д. Смертность (100%) 500 м.д. Смертность (100%) 500 м.д.75 R1 R3 R4R7 , R8, R9 YИнсектицидная активность Тля люцерновая Тля люцерноваяТля люцерновая Тля люцерноваяСмертность (100%) 500 м.д.Смертность (100%) 500 м.д. Смертность (100%) 500 м.д. Смертность (100%) 500 м.д.75  C2H5 СН3H NO2100 100100 10076 C2H5 СН3H NO2100 100100 10076  HСН 3HNO 2100100 100100 77 HСН 3HNO 2100100 100100 77 R3 и R 4 вместе образуют -CH2-CH2 HNO2 100100100 10078 R3 и R 4 вместе образуют -CH2-CH2 HNO2 100100100 10078  R3 и R 4 вместе образуют -CH2-CH2 HCN56 8787100 79 R3 и R 4 вместе образуют -CH2-CH2 HCN56 8787100 79 R3 и R 4 вместе образуют -CH2-CH2 HNO2 100100100 10080 R3 и R 4 вместе образуют -CH2-CH2 HNO2 100100100 10080  R3 и R 4 вместе образуют -CH2-CH2 HNO2 100100100 10081 R3 и R 4 вместе образуют -CH2-CH2 HNO2 100100100 10081  R3 и R 4 вместе образуют -CH2-CH2-CH 2-HNO 27887 10096 R3 и R 4 вместе образуют -CH2-CH2-CH 2-HNO 27887 10096 Пример 15 Получение инсектицидной композиции, содержащей активное соединение по изобретению а) Масляная суспензия Готовили следующие ингредиенты: 25 масс.% любого соединения, выбранного из соединений 1-73; 5 масс.% полиоксиэтиленсорбитана гексаолеата и 70 масс.% высшего алифатического углеводородного масла. Все компоненты измельчали в песочной мельнице до тех пор, пока твердые гранулы не уменьшались до размера менее чем примерно 5 микрометров. Полученную в результате вязкую суспензию можно было использовать непосредственно, либо использовать после эмульгирования в воде. б) Водная суспензия Готовили следующие компоненты: 25 масс.% любого соединения, выбранного из соединений 1-73; 3 масс.% гидрата аттапульгита; 10 масс.% кальция лигносульфоната; 0,5 масс.% натрия дигидрофосфата и 61,5 масс.% воды. Все компоненты измельчали в шаровой мельнице до тех пор, пока твердые гранулы не уменьшались до размера менее чем примерно 10 микрометров. Водную суспензию можно было использовать непосредственно. в) Препарат приманки Готовили следующие ингредиенты: 0,1-10 масс.% любого соединения, выбранного из соединений 1-73; 80 масс.% пшеничной муки и 19,9-10 масс.% мелассы. Все ингредиенты в достаточной степени смешивали и по необходимости формовали. Пищевая приманка может быть проглочена, или ее можно распределять в домашних или промышленных помещениях, таких как кухня, больница, хранилище, а также на открытом воздухе в области, пораженной насекомыми, вредными для здоровья населения. Все документы, цитируемые в данной заявке, включены в изобретение в виде ссылки, как если бы каждый из них был включен индивидуально. Кроме того, должно быть понятно, что в свете вышеописанных положений изобретения специалист в данной области техники может произвести различные изменения или модификации изобретения, и эти эквиваленты будут, тем не менее, находиться в пределах объема изобретения, определенного прилагаемой ниже формулой изобретения. Дополнительный пример 1: Стадия 1. Синтез N-бензил-1,2-этандиамина Бензилхлорид (1,26 г, 10 ммоль) растворяли в безводном этаноле (40 мл), смесь перемешивали в ледяной бане и добавляли безводный этандиамин (50 ммоль). Раствор становился желтым. После добавления смесь перемешивали при комнатной температуре в течение 24 часов и проводили мониторинг по ТСХ. После завершения смесь фильтровали, и фильтрат упаривали для удаления этанола. К остатку добавляли воду и экстрагировали смесь с помощью CH 2Cl2 (30 мл × 10). Органические фазы объединяли, сушили над Na2SO4 и концентрировали с получением конечного продукта в виде желтого масла (0,627 г. Выход: 41,8%). Стадия 2. Синтез ((2-(нитрометилен)имидазолин-1-ил)метил)бензола N-бензил-1,2-этандиамин (10 ммоль) растворяли в безводном этаноле (10 мл) и добавляли (2-нитроэтилен-1,1-диил)бис(метилсульфана) (1,61 г, 10 ммоль). Смесь кипятили с обратным холодильником и проводили мониторинг по ТСХ. После завершения смесь охлаждали до комнатной температуры и фильтровали. Отфильтрованный осадок промывали этилацетатом трижды и осушали с получением целевого продукта (1,012 г. Выход: 46%). Стадия 3. Синтез 1-бензил-9-нитро-2,3,5,6,7,8-гексагидро-1Н-5,8-эпоксиимидазо[1,2-а]азепина Целевое соединение получали способом согласно Примеру 8 за исключением того, что 2-хлор-5-((2-(нитрометилен)имидазолидин-1-ил)метил)пиридин заменяли ((2-(нитрометилен)имилазолидин-1-ил)метил)бензолом. Выход составил 30%. Т.Пл. 124,7-125,6°С, 1H ЯМР (400 МГц, ДМСО-d6) Дополнительный пример 2: 1. Синтез N-((пиридин-3-ил)метил)-1,2-этандиамина Указанное в заголовке соединение получали согласно Стадии 1 Дополнительного примера 1, за исключением того, что бензилхлорид заменяли 3-хлорметил-пиридин гидрохлоридом. Выход составил 41,8%. 2. 3-((2-(трифторметил)сульфурил-винил)имидазолидин-1-ил)метил)пиридин Соединение, указанное в заголовке, получали согласно Стадии 2 Дополнительного примера 1, за исключением того, что использовали другие исходные вещества, как указано на реакционной схеме. Выход составил 48%. 3. Синтез 1-(пиридин-3-ил)метил)-9-(трифторметил)сульфурил-2,3,5,6,7,8-гексагидро-1Н-5,8-эпоксимидазо[1,2-а]азепина Соединение, указанное в заголовке, получали согласно Стадии 3 Дополнительного примера 1, за исключением того, что использовали другие исходные вещества, как указано на реакционной схеме. Выход составил 36%. 1H ЯМР (400 МГц, ДМСО-d6) Дополнительный пример 3: 1. Синтез N-((2-хлор-пиридин-5-ил)метил)-1,2-этандиамина Соединение, указанное в заголовке, получали согласно Стадии 1 Дополнительного примера 1, за исключением того, что использовали другие исходные вещества, как указано на реакционной схеме. Выход составил 47,2%. 2. Синтез 2-хлор-5-((2-(трифторметил-винил)имидазолидин-1-ил)метил)пиридина Соединение, указанное в заголовке, получали согласно Стадии 2 Дополнительного примера 1, за исключением того, что использовали другие исходные вещества, как указано на реакционной схеме. Выход составил 57%. 3. Синтез 1-(2-хлор-пиридин-5-ил)метил)-9-трифторметил-2,3,5,6,7,8-гексагидро-1Н-5,8-эпоксимидазо[1,2-а]азепина Соединение, указанное в заголовке, получали согласно Стадии 3 Дополнительного примера 1, за исключением того, что использовали другие исходные вещества, как указано на реакционной схеме. Выход составил 61%. 1H ЯМР (400 МГц, ДМСО-d6) 13С ЯМР (100 МГц, ДМСО) Дополнительный пример 4: 1. Синтез N-((5-хлортиазол-2-ил)метил)-1,2-этандиамина Соединение, указанное в заголовке, получали согласно Стадии 1 Дополнительного примера 1, за исключением того, что использовали другие исходные вещества, как указано на реакционной схеме. Выход составил 39.1%. 2. Синтез 5-хлор-2-((2-(трифторметокси-винил)имидазолидин-1-ил)метил)тиазола Соединение, указанное в заголовке, получали согласно Стадии 2 Дополнительного примера 1, за исключением того, что использовали другие исходные вещества, как указано на реакционной схеме. Выход составил 44%. 3. Синтез 1-(5-хлортиазол-2-ил)метил)-9-три фторметокси-2,3,5,6,7,8-гескагидро-1Н-5,8-эпоскимидазо[1,2-а]азепина Соединение, указанное в заголовке, получали согласно Стадии 3 Дополнительного примера 1, за исключением того, что использовали другие исходные вещества, как указано на реакционной схеме. Выход составил 48%. 1Н ЯМР (400 МГц, ДМСО-d6) 13С ЯМР (100 МГц, ДМСО) Дополнительный пример 5: Инсектицидную активность соединений, полученных согласно Дополнительным примерам 1-4 тестировали тем же способом, что и в Примере 14. Результаты испытаний показали, что смертность тли люцерновой, коричневой рисовой цикады, гусениц, поражающих злаковые растения, и капустной моли составила 90~100% при 500 млн-1.    Инсектицидная активность Соединение R1Y тля люцерноваяКоричневая рисовая цикада Гусеница злаковая капустная мольСмертность (100%) 500 млн-1Смертность (100%) 500 млн-1Смертность (100%) 500 млн-1Смертность (100%) 500 млн-1Дополнительный пример 1 Инсектицидная активность Соединение R1Y тля люцерноваяКоричневая рисовая цикада Гусеница злаковая капустная мольСмертность (100%) 500 млн-1Смертность (100%) 500 млн-1Смертность (100%) 500 млн-1Смертность (100%) 500 млн-1Дополнительный пример 1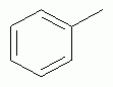 -NO2 9510090 90Дополнительный пример 2 -NO2 9510090 90Дополнительный пример 2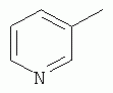  100100 100100 Дополнительный пример 3 100100 100100 Дополнительный пример 3 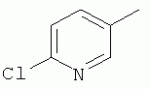 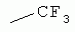 100100 100100 Дополнительный пример 3 100100 100100 Дополнительный пример 3 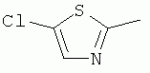 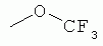 100100 100100 100100 100100 Дополнительный пример 6: Синтез соединения I-1 Соединение 13 (0,01 моль) подвергали реакции с бензил бромидом (0,01 моль) в присутствии триэтаноламина (TEA) (0,01 моль) в MeCN (30 мл) при комнатной температуре. Проводили мониторинг реакции по ТСХ. После завершения смесь упаривали для удаления растворителя, и полученную смесь очищали колоночной хроматографией с получением конечного соединения. Выход: 85%. т.пл.=168,1-168,9°С; 1 H ЯМР (400 МГц; ДМСО-d6): Масс-спектрометрия высокого разрешения (ES+) вычислено для C 29H29 Дополнительный пример 7: Синтез соединения I-2 Соединение I-2 получили согласно Дополнительному примеру 5, за исключением того, что использовали другие исходные вещества, как показано на реакционной схеме. Выход: 83%. т.пл.=169,5-171,2°С; 1H ЯМР (400 МГц, ДМСО-d6): Масс-спектрометрия высокого разрешения (ES+), вычислено для C30H30N8O 5 Дополнительный пример 8: Синтез соединения I-3 Соединение I-3 получали согласно Дополнительному примеру 5 за исключением того, что использовали другие исходные вещества, как показано на реакционной схеме. Выход: 73%. т.пл.=202,2-203,1°С; 1H ЯМР (400 МГц; ДМСО-d6): Масс-спектрометрия высокого разрешения (ES+), вычислено для C 28H27N8O7 Дополнительный пример 9: Синтез соединения I-4 Соединение I-4 получали согласно Примеру 8, за исключением того, что использовали другие исходные вещества, как показано на реакционной схеме. Выход: 62%. т.пл.=128,2-129,8°С; 1H ЯМР (400 МГц; ДМСО-d6): Масс-спектрометрия высокого разрешения (ES+), вычислено для C19H 20N4O3 Дополнительный пример 10: Синтез соединения I-5 Соединение I-5 получали согласно Примеру 8, за исключением того, что использовали другие исходные вещества, как показано на реакционной схеме. Выход: 68%. т.пл.=130,2-130,8°С; 1H ЯМР (400 МГц; ДМСО-d6): Масс-спектрометрия высокого разрешения (ES+), вычислено для C14H18N 4O4 Дополнительный пример 11: Синтез соединения I-6 Соединение I-6 получали согласно Примеру 8, за исключением того, что использовали другие исходные вещества, как показано на реакционной схеме. Выход: 71%. т.пл.=144,2-145,8°С; 1H ЯМР (400 МГц; ДМСО-d6): Масс-спектрометрия высокого разрешения (ES+), вычислено для C14H16N4 O5 Дополнительный пример 12: Синтез соединения I-7 Соединение I-7 получали согласно Примеру 8, за исключением того, что использовали другие исходные вещества, как показано на реакционной схеме. Выход: 72%. т.пл.=158,2-159,8°С; 1H ЯМР (400 МГц; ДМСО-d6): Масс-спектрометрия высокого разрешения (ES+), вычислено для C20H19N4O4Br 35Cl (M+H)+ 493,0200; обнаружено 493,0191. Вычислено для C20H19N4O4Br 37Cl (M+H)+ 495,0200; обнаружено 495,0191. Дополнительный пример 13: Синтез соединения I-8 Соединение I-8 получали согласно Примеру 8, за исключением того, что использовали другие исходные вещества, как показано на реакционной схеме. Выход: 66%. т.пл.=138,2-139,7°С; 1 H ЯМР (400 МГц; ДМСО-d6): Масс-спектрометрия высокого разрешения (ES+), вычислено для C14H16N 4O4 Дополнительный пример 14: Синтез соединения I-9 Соединение I-9 получали согласно Примеру 8, за исключением того, что использовали другие исходные вещества, как показано на реакционной схеме. Выход: 63%, т.пл.=168,2-169,4°С; 1H ЯМР (400 МГц; ДМСО-d6): Масс-спектрометрия высокого разрешения (ES+), вычислено для C14H 16N4O3S35Cl (М+Н) + 355,0553; обнаружено 355,0559. Вычислено для C14 H16N4O3S37Cl (M+H) + 357,0553; обнаружено 357,0559. Дополнительный пример 15: Синтез соединения I-10 Соединение I-10 получали согласно Примеру 8, за исключением того, что использовали другие исходные вещества, как показано на реакционной схеме. Выход: 68%. т.пл.=155,2-156,7°С; 1H ЯМР (400 МГц; ДМСО-d6): Масс-спектрометрия высокого разрешения (ES+), вычислено для C15H 19N6O3 Дополнительный пример 16: Синтез соединения I-11 Соединение I-11 получали согласно Примеру 8, за исключением того, что использовали другие исходные вещества, как показано на реакционной схеме. Выход: 71%. т.пл.=142,2-143,8°С; 1H ЯМР (400 МГц; ДМСО-d6): Масс-спектрометрия высокого разрешения (ES+), вычислено для C20H21N5O3 Дополнительный пример 17: Синтез соединения I-12 Соединение I-12 получали согласно Примеру 8, за исключением того, что использовали другие исходные вещества, как показано на реакционной схеме. Выход: 58%. т.пл.=151,2-152,9°С; 1H ЯМР (400 МГц; ДМСО-d6): Масс-спектрометрия высокого разрешения (ES+), вычислено для C 18H19N4O35Cl (M+H)+ 439.0942; обнаружено 439,0933. Вычислено для C18H19 N4O35Cl (M+H)+, 441,0942; обнаружено 441,0933. Дополнительный пример 18: Синтез соединения I-13 Соединение I-13 получали согласно Примеру 8, за исключением того, что использовали другие исходные вещества, как показано на реакционной схеме. Выход: 69%. т.пл.=145,2-146,8°С; 1H ЯМР (400 МГц; ДМСО-d6): Масс-спектрометрия высокого разрешения (ES+), вычислено для C 28H28N4O3 Дополнительный пример 19: Синтез соединения I-14 Соединение I-14 получали согласно Примеру 8, за исключением того, что использовали другие исходные вещества, как показано на реакционной схеме. Выход: 64%. т.пл.=188,2-189,8°С; 1Н ЯМР (400 МГц; ДМСО-d 6): Масс-спектрометрия высокого разрешения (ES+), вычислено для C16H 20N4O5S35Cl (М+Н)+ 415,0765; обнаружено 415,0760. Вычислено для C16H20 N4O5S37Cl (М+Н)+, 417,0765; обнаружено 417,0760. Дополнительный пример 20: Синтез соединения I-15 Соединение I-15 получали согласно Примеру 8, за исключением того, что использовали другие исходные вещества, как показано на реакционной схеме. Выход: 63%. т.пл.=148,2-149,8°С; 1H ЯМР (400 МГц; ДМСО-d6): Масс-спектрометрия высокого разрешения (ES+), вычислено для C 21H22N4O3 Дополнительный пример 21: Инсектицидную активность соединений, полученных согласно Дополнительным Примерам 5-20 определяли тем же способом, что и в Примере 14 настоящей заявки. Тест показал, что все соединения с I-1 по I-15 обладают очень хорошей инсектицидной активностью. Формула изобретения1. Соединение формулы (А), (В), (С) или (D), или его агрохимически приемлемые соли, 2. Соединение или его агрохимически приемлемые соли по п.1, где R1 выбран из пиридила, тиазолила, тетрагидрофурила, оксазолила или их галогенированных групп. 3. Соединение или его агрохимически приемлемые соли по п.1, где R2 представляет собой H, насыщенный или ненасыщенный С1-4алкил, насыщенный или ненасыщенный С1-4галогеноалкил, С1-4 алкилкарбонил, незамещенный бензил или бензил, замещенный одной или более чем одной группой, выбранной из группы, состоящей из атома галогена, С1-4галогеноалкила или С1-4 хлоралкоксила. 4. Соединение или его агрохимически приемлемые соли по п.1, отличающиеся тем, что R3 и R4 представляют собой Н, C1-6алкильную группу, либо R3 и R4 вместе образуют -СН2 -СН2- или -CH2-CH2-CH2 -. 5. Соединение или его агрохимически приемлемые соли по п.1, где R5, R6, R7, R 8 и R9 представляют собой Н, насыщенный С 1-2алкил, атом галогена, насыщенный или ненасыщенный С 1-4алкоксил, насыщенный С1-2галогеноалкоксил, С1-2алкилсульфонил или трифторметансульфонильную эфирную группу. 6. Соединение или его агрохимически приемлемые соли по п.1, где Y представляет собой нитрогруппу или цианогруппу. 7. Агрохимическая композиция, имеющая инсектицидную активность, содержащая:(а) 0,001-99,99 мас.% соединения или его агрохимически приемлемых солей по любому из пп.1-6 или их комбинации; и(б) агрохимически приемлемый носитель или эксципиент. 8. Применение агрохимической композиции по п.7 для уничтожения или борьбы с сельскохозяйственными вредителями, санитарными вредителями и вредителями, вредными для здоровья животных. 9. Способ получения соединения или его агрохимически приемлемых солей по любому из пп.1-6, включающий приведенные ниже стадии: в присутствии каталитической кислоты и при 0-60°С взаимодействие соединения формулы (а) с соединением (b) посредством чего получают соединение (А) или (В), где R2 представляет собой Н, 10. Способ по п.9, включающий:в присутствии каталитической кислоты проводят приведенную ниже реакцию при 20-30°С в ацетонитриле в течение 2-24 ч, посредством чего получают соединение (А), где R2 представляет собой Н: 11. Способ получения соединения или его агрохимически приемлемых солей по любому из пп.1-6, включающий приведенные ниже стадии:в присутствии каталитической кислоты и при 0-60°С взаимодействие соединения формулы (а) с соединением (с) или (d), посредством чего получают соединение (С) или (D) 12. Способ по п.11, включающий: в присутствии каталитической кислоты проводят приведенную ниже реакцию при 10-50°С в ацетонитриле в течение 2-24 ч, посредством чего получают соединение (С): Популярные патенты: 2091380 Производные пиколиновой кислоты или их кислотно-аддитивные соли, способ их получения, нербицидная композиция и способ борьбы с сорняками ... т. пл. 240 245oC. Пример 6. Получение 3-/4,6-диметоксипиримидин-2-ил/окси-6-диметиламинопиримидин -2-карбоксилата кальция (Соединение N 50). 1,0 г/3,1 ммоль к 3-/4,6-диметоксипиримидин-2-ил/окси/-6- диметиламинопиридин-2-карбоксилата калия растворялся в 10 мл тетрагидрофурана и к нему добавлялось 0,15 г/1,5 ммоль/ осажденного карбоната кальция. Кроме того, к получающейся в результате смеси добавлялось 10 мл воды и смесь перемешивалась при комнатной температуре. Реакционная жидкость концентрировалась при пониженном давлении и к ней добавлялся ацетон для осаждения кристалла. Полученный таким образом кристалл отделялся с помощью фильтрования и промывался гексаном с получением ... 2193304 Захват лесозаготовительной машины ... подачи обычно достигается гидравлическими двигателями. Для обрезки сучков и нарезки ствола в размер подающее устройство перемещает ствол от комля к кроне. Устройство захвата останавливают, когда отмерена определенная длина ствола, и ствол обрезают с помощью средств обрезки, размещенных на захвате. Так продолжается пока ствол не будет разрезан на приемлемые куски. В то же время, когда ствол движется через кольцо из сучкорезных лезвий, закрепленных в захвате, лезвия срезают сучки со ствола. Скорость перемещения ствола дерева очень высока, поэтому и подающие, и сучкорезные средства должны пропускать ствол дерева в соответствии с изменениями его диаметра и ровности. В ... 2464780 Способ, устройство и компьютерный программный продукт для управления группой молочного скота ... нулевой. Для группы молочного скота индивидуальное оптимальное решение для рационов может быть найдено, например, за счет индивидуальной оптимизации, если не применены предварительные условия (например, квота на молоко, время, доступное для доения и тому подобное). Например, если предварительные условия включают установленную квоту на молоко, то есть общий надой молока на группу молочного скота, или максимальное доступное эффективное время для доения, которое фактически также может быть рассчитано заранее для максимального общего надоя молока, то индивидуальные параметры могут быть затем найдены при использовании теории регрессии или также на практике, например, варьированием ... 2234219 Композиция для отпугивания паразитов ... действием в отношении нимф Amblyomma, которое продолжается значительно дольше, чем действие ДЭТА. Наиболее выраженным продолжительным действием обладают, например, соединения №№1.26-1.36, 1,40, 1.45, 1.47, 1.95, 1.96, 1.97, 1.137 и 1.139 даже при концентрации 3,2 мкг/см2.Тест с использованием арены для оценки in vitro активности в отношении Boophilus microplus Biarra (личинки)Тестирование проводят согласно описанному выше методу, внося в каждую лунку приблизительно 60-100 личинок. 10 мг растворенного тестируемого соединения наносят на площадь 2,4 см2. Оценка видеоизображений показывает, что соединения формулы (I) обладают выраженным репеллентным действием в отношении личинок ... 2166252 Способ удаления костного мозга из губчатых костных трансплантатов ... "Ультразвуковой насос" способен обеспечить очистку труднодоступных узких полостей губчатой костной ткани, разрушая клетки и клеточные структуры, в том числе и жировые. Были проведены испытания по удалению костного мозга из губчатых костных трансплантатов по известной методике (Приказ министра здравоохранения СССР, N 482, г. Москва от 14.06.72) и по предлагаемому способу с использованием ультразвуковых колебаний. Нативный материал был изучен микроскопически. Полутонкие срезы, полученные с замороженной декальцинированной губчатой костной ткани, окрашивали Суданом IV. Также окрашивали полутонкие срезы спонгиозы метиленовым синим в растворе буры. На препаратах нативной губчатой ... |
Еще из этого раздела: 2241344 Способ производства зеленого корма 2236787 Способ испытаний опрыскивателей и устройство для его осуществления 2440708 Комбинированное устройство для ротационного внутрипочвенного рыхления 2038763 Регулятор вакуума 2160981 Способ создания плантаций солодки голой на обесструктуренных почвах в орошаемом земледелии 2477044 Искусственная рыболовная приманка (варианты) 2200216 Волокнистый материал для защиты от бытовых насекомых 2449809 Дезинфицирующее средство 2161400 Способ определения активности агентов 2067798 Агромостовой комплекс |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
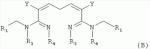
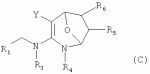
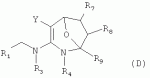
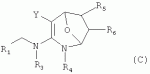
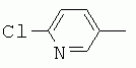 ,
, 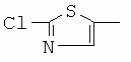 или
или 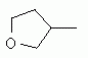 .
.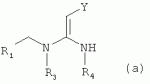
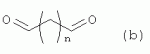




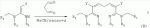



 9,01 (s, 1H), 8,41 (d, J=2,0 Гц, 1H), 8,38 (d, J=2,0 Гц, 1H), 7,80-7,86 (m, 2H), 7,51-7,54 (m, 2H), 6,50 (d, J=7,2 Гц, 1H), 5,34 (d, J=15,2 Гц, 1H), 5,18 (d, J=15,2 Гц, 1H), 4,84 (dd, J1=2,4 Гц, J2=7,2 Гц, 1H), 4,77 (d, J=16,8 Гц, 1H), 4,67 (d, J=16,8 Гц, 1H), 3,98 (d, J=2,4 Гц, 1H), 3,86-3,95 (m, 2H), 3,61-3,80 (m, 5H), 3,40-3,47 (m, 1H) млн-1 ; 13С ЯМР (100 МГц, ДМСО-d6):
9,01 (s, 1H), 8,41 (d, J=2,0 Гц, 1H), 8,38 (d, J=2,0 Гц, 1H), 7,80-7,86 (m, 2H), 7,51-7,54 (m, 2H), 6,50 (d, J=7,2 Гц, 1H), 5,34 (d, J=15,2 Гц, 1H), 5,18 (d, J=15,2 Гц, 1H), 4,84 (dd, J1=2,4 Гц, J2=7,2 Гц, 1H), 4,77 (d, J=16,8 Гц, 1H), 4,67 (d, J=16,8 Гц, 1H), 3,98 (d, J=2,4 Гц, 1H), 3,86-3,95 (m, 2H), 3,61-3,80 (m, 5H), 3,40-3,47 (m, 1H) млн-1 ; 13С ЯМР (100 МГц, ДМСО-d6): 

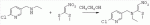
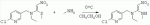
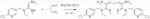
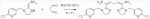

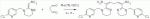
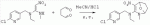
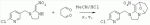
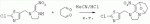
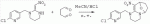

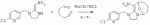
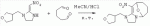


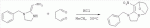
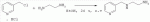

























 ;в присутствии каталитической кислоты, проводят приведенную ниже реакцию при 20-30°С в ацетонитриле в течение 2-24 ч, посредством чего получают соединение (В):
;в присутствии каталитической кислоты, проводят приведенную ниже реакцию при 20-30°С в ацетонитриле в течение 2-24 ч, посредством чего получают соединение (В): 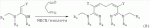 .
. ;в присутствии каталитической кислоты проводят приведенную ниже реакцию при 10-50°С в ацетонитриле в течение 2-24 ч, посредством чего получают соединение (D):
;в присутствии каталитической кислоты проводят приведенную ниже реакцию при 10-50°С в ацетонитриле в течение 2-24 ч, посредством чего получают соединение (D):  .
.