Способ создания линий мягкой пшеницы, устойчивых к бурой ржавчинеПатент на изобретение №: 2484621 Автор: Салина Елена Артемовна (RU), Леонова Ирина Николаевна (RU), Петраш Надежда Владимировна (RU), Адонина Ирина Григорьевна (RU), Щербань Андрей Борисович (RU) Патентообладатель: Федеральное государственное бюджетное учреждение науки Институт цитологии и генетики Сибирского отделения Российской академии наук (ИЦиг СО РАН) (RU) Дата публикации: 20 Июня, 2013 Начало действия патента: 4 Мая, 2012 Адрес для переписки: 630090, г.Новосибирск, пр-кт Ак. Лаврентьева, 10, ИЦиГ СО РАН, отдел защиты интеллектуальной собственности (ОЗИС), Л.Я. Кучумовой Изображения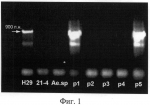 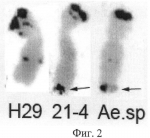 Изобретение относится к области биохимии. Представлен способ создания линий мягкой пшеницы, устойчивых к бурой ржавчине, включающий скрещивание коммерческого сорта мягкой пшеницы с гибридной линией 21-4, содержащей новый ген LrN21, самоопыление гибридов первого поколения F1 для получения гибридов второго поколения F2, среди которых с помощью молекулярного ПЦР-маркера 34vrn5b и цитологических ДНК-маркеров р8 с119.2 и Spelt1 отбирают растения, содержащие ген устойчивости LrN21, повторное самоопыление отобранных растений для получения растений поколения F3 и тестирование последних в полевых условиях на устойчивость к бурой ржавчине. Изобретение позволяет вести отбор растений, содержащих ген устойчивости LrN21 без проведения полевых тестов и сокращает время создания устойчивых линий мягкой пшеницы. 2 ил., 3 табл., 1 пр. ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУИзобретение относится к сельскому хозяйству и биотехнологии и может быть использовано в генетике и селекции зерновых культур. В настоящее время стало очевидным, что интенсивная селекция мягкой пшеницы, направленная на повышение урожайности, приводит к значительному сужению генетического разнообразия современных сортов по уровню устойчивости к грибным болезням. Создание сортов с генетической или «хозяйской» устойчивостью является одним из элементов защиты пшеницы от болезней. Расширение генетического разнообразия зерновых культур и пополнение генофонда по генам устойчивости к грибным болезням может быть достигнуто за счет включения в селекционный процесс диких сородичей, которые являются неисчерпаемым источником генов устойчивости [1]. В настоящее время известно пять генов устойчивости к бурой ржавчине, перенесенных в геном мягкой пшеницы от диплоидного вида Aegilops speltoides. Эти гены локализованы в хромосомах 4AL, 2В, 6BS, 1BL и 7AS мягкой пшеницы [www.grs.mg.ac.ip/wheat/komugi/genes]. К сожалению, часть из них к настоящему времени потеряла свою эффективность, остальные гены не могут быть использованы в селекционных целях из-за сложностей, возникающих в процессе переноса генов и их дальнейшей идентификации в элитных сортах мягкой пшеницы [2]. Известен способ создания линий мягкой пшеницы, устойчивых к бурой ржавчине (патент RU 2407283, опубл. 27.12.2010), заключающийся в следующем. Коммерческий сорт мягкой пшеницы скрещивают с линией-донором, содержащей ген Lr. В качестве донора устойчивости используют гибридную линию 832-2, содержащую в составе генома не более шести фрагментов хромосом Т. timopheevii, для которой предварительно проведен молекулярно-генетический анализ, установлена хромосомная локализация генов устойчивости и определены ДНК-маркеры для генов устойчивости. Далее гибриды первого поколения (F1) беккроссируют двукратно на исходный сорт, потомство BC2F1 тестируют ДНК-маркерами cfe229 и cfe204 к гену устойчивости Lr и отбирают линии, несущие ДНК-маркеры. Отобранные линии беккроссируют третий раз, проводят самоопыление потомства и в потомстве BC 3F2 отбирают линии, несущие ДНК-маркеры к гену устойчивости Lr в гомозиготном состоянии. На заключительном этапе потомство BC3F3 тестируют в полевых условиях. Однако данный способ является более трудоемким и длительным по времени, поскольку предполагает проведение трех этапов беккроссирования гибридов первого поколения, сопровождающихся самоопылением гибридных растений. Наиболее ближайшим к заявляемому способу-прототипу является способ создания гибридных форм мягкой пшеницы, устойчивых к бурой ржавчине, с использованием линии-донора гена Lr28 от Aegilops speltoides [3]. В данном способе линию-донор, содержащую ген Lr28, скрещивают с линией, полученной на основе коммерческого сорта мягкой пшеницы HD2687, гибридные растения F1 самоопыляют для получения поколения F2, среди которых с помощью молекулярного маркера SCS421570 отбирают растения с геном Lr28. Для выявления хромосомной локализации гена Lr28 растения поколения F2 анализируют с помощью 602 молекулярных маркеров, отобранные растения самоопыляют до поколения F2, в котором выявляют растения с геном Lr28 в гомозиготном состоянии. Полученные F3 растения проверяют на устойчивость к полевой популяции бурой ржавчины. Недостатками данного способа являются: 1. Отсутствие специфичности маркера SCS421570. Амплификация фрагмента, специфичного для маркера SCS421570, не всегда связана с наличием гена Lr28, что не позволяет однозначно различать устойчивые и чувствительные растения. В связи с отсутствием специфичности маркер SCS421570 не включен в список маркеров, рекомендуемых для использования в селекционных программах [http://maswheat.ucdavis.edu1]. 2. Маркер SCS421570 выявляет наличие гена Lr28, но не определяет его хромосомную локализацию. Информация о хромосомной локализации гена устойчивости необходима для прогнозирования влияния чужеродного фрагмента хромосомы, содержащей ген устойчивости, на другие хозяйственно-ценные признаки сорта-реципиента. 3. Использование 602 молекулярных маркеров для выявления хромосомной локализации гена, что увеличивает время проведения анализа и его стоимость. 4. Значительное снижение и даже полная потеря устойчивости к бурой ржавчине уже созданных сортов мягкой пшеницы, содержащих ген Lr28 [4]. Задачей данного изобретения является создание линии-донора мягкой пшеницы, содержащей новый эффективный ген устойчивости к бурой ржавчине от Aegilops speltoides. Технический результат заключается в упрощении известного способа и расширении его функциональных возможностей. Поставленная задача достигается предлагаемым способом, заключающимся в следующем. Гибридную линию мягкой пшеницы 21-4 (Т. aestivum - Ae.speltoides), содержащую новый ген устойчивости LrN21, локализованный в дистальном районе хромосомы 5В, скрещивают с элитным сортом мягкой пшеницы и растения поколения F1 самоопыляют до поколения F 2. Из поколения F2 с помощью молекулярного ПЦР маркера 34vrn5b отбирают растения, содержащие ген LrN21. Отобранные с помощью ПЦР-маркера 34vrn5b растения F2 с геном LrN21 проверяют цитологическими ДНК-маркерами Spelt1 и pSc119.2, с помощью которых выявляют растения с локализацией гена LrN21 в хромосоме 5В и в гомозиготном состоянии. Основными определяющими отличиями предлагаемого способа от прототипа являются: - в качестве линии-донора используют гибридную линию мягкой пшеницы 21-4, содержащую новый более эффективный ген устойчивости к бурой ржавчине LrN21 от Aegilops speltoides; - из поколения F2 с помощью молекулярного ПЦР маркера 34vrn5b отбирают растения, содержащие новый ген LrN21, что позволяет на ранних стадиях создания линий быстро и экономично отбирать растения, содержащие ген LrN21 без проведения полевых испытаний; - в качестве цитологических ДНК-маркеров используют специально подобранные известные маркеры Speltl/pSc119.2, выявляющие хромосомную локализацию гена LrN21 и его гомозиготное состояние на стадии F2, что позволяет сократить время и стоимость создания устойчивых линий. Изобретение иллюстрируется следующим примером. Пример Гибридные линии Т. aestivum - Ае. speltoides, полученные ранее от скрещивания мягкой пшеницы с видом Ае. speltoides, были проверены на устойчивость к бурой ржавчине на стадиях проростков и взрослых растений. Среди проверенных образцов была отобрана линия 21-4, проявляющая высокий уровень устойчивости к бурой ржавчине (по шкале иммунности Майнса и Джексона [5]). В таблице 1 представлены данные (в баллах) по устойчивости гибридных линий с генетическим материалом Aegilops speltoides и изогенной линии с геном Lr28. Из таблицы 1 видно, что линия ThLr28, содержащая ген Lr28 (прототип), показала средний уровень устойчивости (балл 1 и 2 по шкале иммунности) к этой же популяции бурой ржавчины. Цитологический и молекулярной анализ показал, что линия 21-4 имеет единичный фрагмент генома Aegilops speltoides, который находится в дистальном районе хромосомы 5В и имеет происхождение из хромосомы 5S Aegilops speltoides. Согласно литературным данным до настоящего времени не зафиксировано гена устойчивости к бурой ржавчине, происходящего из хромосомы 5S Aegilops speltoides [1, www.grs.nig.ac.jp/wheat/komugi/genes]. Новый ген был обозначен символом LrN21. Гибридную линию 21-4 - донор нового гена скрещивали с сортом мягкой пшеницы Новосибирская 29 и полученные гибридные растения поколения F 1 самоопыляли до поколения F2. В поколении F 2 с помощью ПЦР-маркера 34vrn5b отбирали растения, содержащие ген LrN21. Нуклеотидная последовательность ПЦР-маркера 34vrn5b, условия реакции для ПЦР и размер фрагмента амплификации приведены в таблице 2. Отобранные с помощью ПЦР-маркера 34vrn5b растения поколения F2, содержащие новый ген LrN21, проверяли с помощью цитологических ДНК-маркеров Spelt1 и pSc119.2 для выявления хромосомной локализации гена и его гомозиготного состояния. Информация о цитологических ДНК-маркерах Spelt1 и pSc119.2 и методе флюоресцентной in situ гибридизации для их визуализации опубликована в [6]. Маркер pSc119.2 использовали для идентификации хромосомы 5В мягкой пшеницы. Маркер Spelt1 использовали для выявления участка хромосомы 5S Aegilops speltoides, содержащей новый ген устойчивости LrN21. Растения поколения F2, отобранные с помощью ПЦР-маркера 34vrn5b и цитологических ДНК-маркеров pSc119.2 и Speltl, самоопыляли до поколения F3 и дополнительно проверяли на устойчивость к бурой ржавчине в полевых условиях. Результаты представлены в таблице 3. Результаты фитопатологического теста показали эффективность применения ПЦР-маркера 34vrn5b и цитологических ДНК-маркеров pSc119.2 и Spelt1 для маркирования нового гена устойчивости к бурой ржавчине LrN21 и его выявления в потомстве от скрещивания линии-донора 21-4 и сорта Новосибирская 29. Результаты анализа для ПЦР-маркера 34vrn5b с геномной ДНК линии-донора 21-4, сорта мягкой пшеницы Новосибирская 29 (Н29), вида Aegilops speltoides (Ae.sp) и растений поколения F2, полученных от скрещивания линии-донора 21-4 и сорта Новосибирская 29, не содержащих (растения 1 и 5) и содержащих (растения 2, 3 и 4) новый ген LrN21, приведены на фиг.1. Фрагмент ДНК длиной 900 п.н., свидетельствующий об отсутствии или наличии гена LrN21, указан стрелкой. На фиг.2 представлены хромосома 5В сорта мягкой пшеницы Новосибирская 29 (Н29), хромосома 5S вида Aegilops speltoides (Ae.sp) и хромосома 5В линии-донора 21-4, содержащая участок хромосомы 5S Aegilops speltoides. Локализация цитологических ДНК-маркеров соответствует черным точкам на хромосомах, из них стрелками показана локализация маркера Spelt1, который маркирует участок хромосомы 5S Aegilops speltoides с геном устойчивости LrN21. Таким образом, созданные предложенным способом линии могут пополнить генофонд мягкой пшеницы по генам устойчивости и могут быть использованы в селекционных программах как доноры генов для получения устойчивых сортов мягкой пшеницы. Молекулярный ПЦР-маркер и цитологические ДНК-маркеры, подобранные к новому гену устойчивости LrN21, позволят отбирать линии, содержащие данный ген устойчивости, без проведения полевых тестов и, соответственно, сократить срок создания новых форм мягкой пшеницы. Таблица 1 № гибридной линии T.aestivum - Ae.speltoides Устойчивость к бурой ржавчине (в баллах) Стадия проростков Стадия взрослых растений 6-14 47-4 3 48-7 4 410-6 4 411-6 3 413-3 2 317-7 2 217-12 2 321-4 0 021-12 1 1,2ThLr28 1 1,2 Таблица 2 Маркер34vrn5b Нуклеотидные последовательности праймеров 5'-CATATCAGATCCAGGAAGGT-3'5'-CATCCTCTGCCCTCTCTCCTGA-3' Условия реакции ПЦР(1 мин при 94°С, 1 мин при 55°С, 1 мин при 72°С): 30 циклов Размер продукта амплификации 900 пар нуклеотидов Условия проведения электрофореза1% агароза Таблица 3 ОбразецУстойчивость к бурой ржавчине (в бал.) Наличие ПЦР-маркера 34vrn5b Наличие цитологического ДНК-маркера pSc119.2 Наличие цитологического ДНК-маркера Spelt1 Новосибирская 294 присутствует присутствуетотсутствует Линия 21-4 0 отсутствуетприсутствует присутствует Aegilops speltoides 0 отсутствуетприсутствует присутствует Растение 1 0отсутствует присутствует присутствует Растение 24 присутствуетприсутствует отсутствует Растение 3 4присутствует присутствует отсутствует Растение 44 присутствуетприсутствует отсутствует Растение 5 0отсутствует присутствует присутствуетИсточники информации 1. Mclntosh R.A., Yamazaki Y., Dubcovsky J., et al. Catalogue of Gene Symbols for Wheat. 2010. www.grs.nig.ac.jp/wheat/komugi/genes. 2. Афанасенко О.С. Проблемы создания сортов с длительной устойчивостью к болезням. Защита и карантин растений. 2010, № 3: 4-9. 3. Vinod K.B.B., Sharma J.B., Singh A.K., Sivasamy M., Singh M., Prabhu K.V., Tomar S.M.S., Sharma T.R., Singh B. Molecular markers assisted pyramiding of leaf rust resistance genes Lr19 and Lr28 in bred wheat (T.aestivum L.) variety HD2687. Indian J. Genet. 2011, 71: 304-311. 4. Волкова Г.В. Изучение и использование генетического потенциала устойчивости пшеницы к грибным болезням. Защита и карантин растений. 2010, № 9: 13-17. 5. Mains E.B., Jackson H.S. Physiological specialization in the leaf rust of wheat, Puccinia triticina Erikss. Phytopathology. 1926, 16: 89-120. 6. Салина Е.А., Егорова Е.М., Адонина И.Г. и др. ДНК маркеры для генотипирования и создания интрогрессивных линий пшеницы (Triticum aestivum L. x Aegilops speltoides Tausch; Т. aestivum x T. timopheevii Zhuk.) Вестник ВОГиС. 2008, 12: 620-628. ФОРМУЛА ИЗОБРЕТЕНИЯСпособ создания линий мягкой пшеницы, устойчивых к бурой ржавчине, включающий скрещивание коммерческого сорта мягкой пшеницы с линией мягкой пшеницы, являющейся донором гена устойчивости, самоопыление гибридов первого поколения F1 для получения гибридов второго поколения F2, среди которых с помощью молекулярного ПЦР-маркера и цитологических ДНК-маркеров отбирают растения с геном устойчивости, повторное самоопыление отобранных растений для получения растений поколения F3 и тестирование последних в полевых условиях на устойчивость к бурой ржавчине, отличающийся тем, что в качестве линии-донора гена устойчивости используют гибридную линию 21-4, содержащую новый ген LrN21, а среди гибридов второго поколения проводят отбор растений, содержащих ген LrN21, локализованный в хромосоме 5В, с помощью последовательного применения ПЦР-маркера 34vrn5b и цитологических ДНК-маркеров pSc119.2 и Spelt1. Популярные патенты: 2427999 Способ повышения плодородия мерзлотных засоленных почв в условиях криолитзоны ... микроорганизмов, учитываемых на КАА (утилизирующие минеральные источники азота), была во многом сходной с таковой учитываемых на МПА.Таким образом, процессы минерализации зеленой массы в исследуемой почве в условиях криолитозоны крайне заторможены. Ответная реакция микрофлоры наблюдается только через год после запашки, а последействие сохраняется в течение 2-3 лет. Сидеральные удобрения оказывают влияние не только на численность микроорганизмов, но и на групповой состав, что приводит к усиленному размножению бактерий и актиномицетов. При этом содержание бактерий составляет 85-90% от общей численности микроорганизмов. Положительный баланс гумуса сидерата в мерзлотных ... 2125366 Доильный аппарат ... в сочленении "патрубок-молочный шланг", увеличивается эффективность процесса эвакуации патологического секрета, промывки /дезинфекции/ деталей линии "катетер-доильное ведро" и удаления оставшегося количества консистентных лекарственных средств. Внутренний и наружный диаметр наконечника 40 больше соответствующих диаметров части катетера 37, находящейся в сочленении с соском коровы. Это позволяет унифицировать молочные шланги, применяемые в доильных аппаратах. Увеличение внутреннего диаметра наконечника 40 способствует более свободному выведению молока и растворов с патологическим секретом из вымени коровы в доильное ведро. Применение доильного аппарата позволит повысить ... 2169462 Улей (варианты), способ его сборки и способ круглогодичного содержания в нем пчел ... чего осуществляют нагрев до температуры 90...100oC в течение 15. . .30 мин с последующим охлаждением до комнатной температуры, соединение же листовой заготовки по образующей обеспечивают встык с использованием местного теплового воздействия. Сборку наружной защитной оболочки, например, можно осуществить из двух листов, соединяя их при помощи двух продольных швов (на фигурах не показано) или при помощи накладки из того же материала, приклеивая ее с внутренней стороны оболочки эпоксидным клеем. Сборку гнездового корпуса можно проводить также следующим образом: на внешнюю поверхность внутренней оболочки приклеивают бруски из пенопласта с одновременной склейкой их между собой, после ... 2189742 Способ обработки инкубационных яиц ... посылок гармонических колебаний или биполярных импульсов напряженности поля с постоянной на протяжении цикла облучения амплитудой импульсов или амплитудой огибающей посылок с амплитудой импульсов или огибающей посылок напряженности поля в диапазоне 0,5-120 кВ/м; частота повторения импульсов, посылок в диапазоне 100-1000 Гц или 5-50 кГц; длительностью импульсов, посылок 0,5-9,5 м/с или 0,01-0,15 м/с; частотой заполнения посылок 5-25 кГц или 250-500 кГц. При этом задают конкретные частоту следования импульсов, посылок, время разового непрерывного облучения объекта воздействия, число таких непрерывных облучений, амплитуду напряженности поля при каждом разовом облучении. Более ... 2091380 Производные пиколиновой кислоты или их кислотно-аддитивные соли, способ их получения, нербицидная композиция и способ борьбы с сорняками ... кислоты и насыщенной соленой водой и сушилась, концентрировалась и затем очищалась с помощью хроматографии на силикагельной колонке с получением целевого соединения. Выход; 0,4 г (84%), т. пл. 91 96oC. Исходное соединение для соединения изобретения может быть получено следующим образом. где R6, L1 и X имеет значения, определнные выше. Так, соединение формулы (II-3) может быть получено с помощью преобразования соединения формулы (II-1) в соединение формулы (II-2) и затем каталитического гидрирования водородом. Преобразование соединения формулы (II-1) соответственно в соединение формулы (II-4) и соединение формулы (II-5) может осуществляться известными способами (см. например, ... |
Еще из этого раздела: 2112341 Лапа плоскорежущая 2254705 Способ уплотнения и герметизации консервируемых кормов в рулонах 2387128 Система сбора отходов для отделения жидких отходов от твердых отходов 2248687 Способ весеннего боронования озимых культур и зубовая борона для его осуществления 2007081 Способ биологической борьбы с вредителями капусты 2304875 Способ активации воды для полива при выращивании растений и устройство для его осуществления 2464784 Защитный слой для растений и деревьев, его изготовление и его применение 2495561 Машина лесозаготовительная 2422377 Биоцидный концентрат 2423807 Культиватор (варианты) и фреза для него |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||