Водный раствор для консервации тканей и органовПатент на изобретение №: 2479999 Автор: ПЕРАЛЬТА УРОС Кармен (ES), РОСЕЛЬО-САТАФАУ Джоан (ES), БЕН МОСБАХ Исмаил (ES), БАРТРОНС БАЧ Рамон (ES) Патентообладатель: УНИВЕРСИДАД ДЕ БАРСЕЛОНА (ES), ИНСТИТУТ Д'ИНВЕСТИГАСИОНС БИОМЕДИКЕС АУГУСТ ПИ И СИНЕР (ES), КОНСЕХО СУПЕРИОР ДЕ ИНВЕСТИГАСИОНЕС СЬЕНТИФИКАС (ES) Дата публикации: 27 Июня, 2012 Начало действия патента: 18 Мая, 2009 Адрес для переписки: 129090, Москва, ул. Б. Спасская, 25, стр.3, ООО "Юридическая фирма Городисский и Партнеры", пат.пов. А.В.Мицу, рег. 364 Изображения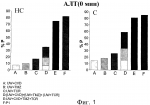 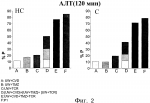 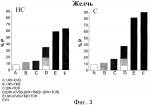 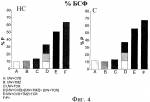 Изобретение относится к медицине. Водный раствор для консервации тканей и органов включает эффективное количество карведилола, эффективное количество такролимуса и эффективное количество триметазидина. Ткани и органы хранят в растворе при температуре 2-10°С. Изобретение позволяет повысить степень защиты органов и тканей. 3 н. и 10 з.п. ф-лы, 10 ил., 6 табл. Настоящее изобретение относится к водному раствору для консервации тканей и органов, его использованию, в частности для консервации маргинальных органов, и способу консервации тканей и органов. Уровень техники Пересадка органов является предпочтительным способом лечения для пациентов с конечной стадией хронических заболеваний. Несмотря на успехи в улучшении методов пересадки, повреждение трансплантата, происходящее в течение ишемического периода и последующей реперфузии, все еще остается нерешенной проблемой в клинической практике. После забора у донора и до пересадки реципиенту орган(ы) и ткани подвергаются неизбежному периоду ишемии. Поэтому жидкие растворы, используемые для консервации органов и тканей, должны отвечать некоторым требованиям: удалять кровь донора, быстро охлаждать орган и обеспечивать эффективную консервацию и защиту от вызванных ишемией повреждений. Статическая низкотемпературная консервация является эффективным способом консервации органа в течение коротких периодов ишемии. Однако длительные периоды ишемии связаны с первичным отсутствием функции у трансплантата при пересадке печени и нарушением функции трансплантата при пересадке почки. Кроме потребности в продлении периода ишемии, ограниченное число доноров и связанное с этим увеличение числа пациентов, ожидающих пересадки органов, привело к одобрению использования маргинальных органов, которые плохо переносят повреждения, вызываемые длительной ишемией. В случае пересадки печени использование маргинальных органов, таких как стеатозные трансплантаты, связано с увеличенным по сравнению с нестеатозными трансплантатами риском первичного отсутствия функции или нарушения функции у трансплантата после пересадки. Кроме того, печень с некоторыми типами стеатоза считается непригодной для пересадки, что увеличивает дефицит органов для пересадки. Хорошо известно, что большинство повреждений, обнаруживаемых в маргинальных органах во время пересадки, связано с периодом низкотемпературной консервации. Эти наблюдения указывают на то, что консервация органов должна быть оптимизирована. Поэтому основной целью консервации органов является попытка увеличить время, в течение которого они переносят ишемию. Существуют данные, указывающие на то, что состав консервирующих растворов является критическим фактором для качества органов, хранящихся в течение длительных ишемических периодов. Консервирующий раствор, созданный в Университете Висконсина (UW), считается стандартным раствором для консервации печени, так как он доказал свою эффективность в уменьшении повреждений, вызываемых гипотермической ишемией, и увеличил предельное время хранения. Этот консервирующий раствор содержит различные компоненты, служащие для улучшения сохранения органов, включая коллоидный гидроксиэтилкрахмал для предотвращения отека клеток, аденозин в качестве источника АТФ для реперфузии, аллопуринол и глутатион, обладающие антиоксидантным действием, и неспособные к проникновению через клеточную мембрану агенты, такие как лактобионовая кислота и раффиноза. Однако консервирующий раствор UW имеет ограничения, касающиеся его эффективности, связанные с тем, что при продлении периодов гипотермической ишемии (16 ч - 24 ч) в пересаженных органах наблюдались необратимые повреждения. Такролимус (TCR) является химическим соединением из группы макролидов, обладающим иммунодепрессивной, антимикробной и другими видами фармакологической активности, он применяется для предотвращения реакций отторжения при пересадке органов и тканей, а также при лечении аутоиммунных и инфекционных заболеваний. Известно, что введение этого вещества в консервирующие растворы способно защитить от реперфузионного повреждения. Консервирующий раствор UW, содержащий такролимус, был описан в литературе (K.G. Rajesh et al., Карведилол (CVD) является липофильным неселективным В недавней работе указывается на то, что добавление триметазидина (TMZ) в консервирующий раствор UW улучшало способность стандартного консервирующего раствора защищать как нестеатозную, так и в особенности стеатозную печень, подвергнутую длительному ишемическому периоду (см. I. Ben Mosbah et al., Тем не менее некоторые из свойств раствора UW, такие как высокая концентрация калия (необходимая для промывки органа перед реперфузией трансплантата в теле реципиента) и наличие гидроксиэтилкрахмала (ГЭК) для поддержания онкотического давления (который возможно ответственен за агрегацию эритроцитов) не способствуют сохранению органов. Недавние исследования показали, что трансплантаты печени (как стеатозные, так и нестеатозные трансплантаты) лучше сохраняются в модифицированном консервирующем растворе UW (названном IGL-1), который от оригинального раствора UW отличается взаимным изменением значений концентраций K+ и Na+ и заменой ГЭК полиэтиленгликолем (ПЭГ) (см. I. Ben Mosbah et al., Таким образом, все еще существует потребность в создании консервирующих растворов, позволяющих увеличить время, в течение которого орган переносит ишемию, и минимизировать неизбежный риск, связанный с пересадкой маргинальных органов. Сущность изобретения Несмотря на то, что консервирующие растворы, содержащие такролимус, карведилол или триметазидин, или известны, или предполагаются из уровня техники, водный раствор для консервации тканей и органов, содержащий комбинацию этих трех активных фармацевтических ингредиентов никогда не был предложен. Авторами изобретения было неожиданно обнаружено, что консервирующий раствор, содержащий комбинацию такролимуса, карведилола и триметазидина, синергически улучшает сохраняемость тканей и органов в течение длительного ишемического периода. В частности, синергический эффект особенно заметен в случае маргинальных органов, таких как стеатозная печень, что делает этот раствор особенно полезным, так как он, по-видимому, способен улучшать исходное состояние маргинальных органов, пригодных для пересадки, но обладающих неполноценной послеоперационной функциональностью, и также может увеличить использование органов, которые сегодня считаются непригодными для пересадки, и тем самым увеличить количество органов, пригодных для пересадки. Таким образом, в одном аспекте настоящее изобретение относится к водному консервирующему раствору для консервации тканей и органов, содержащему эффективное количество карведилола, эффективное количество такролимуса и эффективное количество триметазидина. Водный консервирующий раствор настоящего изобретения делает возможным сохранение тканей и органов в течение периода времени более длительного, чем тот, который достигается другими известными консервирующими растворами. Другим преимуществом консервирующего раствора настоящего изобретения является то, что он делает возможным продление периода времени, в течение которого ткань или орган функционируют должным образом, и в течение которого они могут быть использованы для пересадки, по сравнению с тем периодом, который может быть достигнут при использовании других консервирующих растворов. В другом аспекте данное изобретение относится к применению водного раствора настоящего изобретения для консервации тканей или органов. Этот раствор может быть применен для консервации тканей или органов млекопитающих, включая человека. Примерами указанных тканей являются вены и артерии. Также частью данного изобретения является способ консервации тканей и органов, включающий сохранение указанных тканей или органов в водном растворе настоящего изобретения при температуре от 2°С до 10°С. Реперфузионное повреждение, связанное с приживлением ткани или органа и отторжением трансплантата, предотвращается путем погружения ткани или органа в водный консервирующий раствор настоящего изобретения. Используемый в настоящем изобретении термин «эффективная концентрация» активного ингредиента обозначает количество активного ингредиента, которое обеспечивает консервацию тканей или органов. Любой приведенный здесь диапазон значений может быть расширен или изменен без потери желаемого эффекта, как это будет очевидно для специалиста в данной области техники. Таким образом, данные диапазоны значений, например концентраций и тому подобного, следует рассматривать как приблизительные, если специально не указано иное. На протяжении текста описания и формулы изобретения термин «включать» и его производные не предполагают исключение других технических характеристик, добавок, компонентов или стадий. Краткое описание чертежей На фиг. 1-10 показано влияние добавления такролимуса (TCR), карведилола (CVD) и триметазидина (TMZ) к некоторым известным консервирующим растворам и действие консервирующего раствора Примера 1 (P1) на стеатозную (С) и нестеатозную (НС) печень, подвергнутую длительному ишемическому периоду. Числа %P означают процент защиты. На Фиг.1 показан процент защиты по сравнению с консервирующим раствором UW, когда количество АЛТ оценивалось в конце ишемического периода (0 мин). На Фиг.2 показан процент защиты по сравнению с консервирующим раствором UW, когда количество АЛТ оценивалось в конце реперфузии (120 мин). На Фиг.3 показан процент защиты по сравнению с консервирующим раствором UW, когда уровень выработки желчи оценивался в конце реперфузии (120 мин). На Фиг.4 показан процент защиты по сравнению с консервирующим раствором UW, когда печеночный клиренс, выраженный в виде % БСФ в желчи, оценивался во время реперфузии. На Фиг.5 показан процент защиты по сравнению с консервирующим раствором UW, когда уровень АТФ оценивался в конце реперфузии (120 мин). На Фиг.6 показан процент защиты по сравнению с консервирующим раствором IGL-1, когда количество АЛТ оценивалось в конце ишемического периода (0 мин). На Фиг.7 показан процент защиты по сравнению с консервирующим раствором IGL-1, когда количество АЛТ оценивалось в конце реперфузии (120 мин). На Фиг.8 показан процент защиты по сравнению с консервирующим раствором IGL-1, когда уровень выработки желчи оценивался в конце реперфузии (120 мин). На Фиг.9 показан процент защиты по сравнению с консервирующим раствором IGL-1, когда печеночный клиренс, выраженный в виде % БСФ в желчи, оценивался во время реперфузии. На Фиг.10 показан процент защиты по сравнению с консервирующим раствором IGL-1, когда уровень АТФ оценивался в конце реперфузии (120 мин). Подробное описание изобретения Водный раствор настоящего изобретения может быть применен к тканям или органам во время их забора у донора и во время их хранения, транспортировки и последующей пересадки реципиенту. Он может быть использован для короткого и преимущественно для длительного ишемического периода. В предпочтительном варианте осуществления водный раствор настоящего изобретения содержит карведилол в концентрации от 5 до 10 мкМ, такролимус в концентрации от 5 до 10 мкМ и триметазидин в концентрации от 0,01 мкМ до 10 мкМ. Для того чтобы избежать образования клеточного или тканевого отека, водный раствор настоящего изобретения включает в себя полиэтиленгликоль (ПЭГ), имеющий молекулярную массу более 15000, который позволяет обеспечить онкотическое давление. Предпочтительно, используемый ПЭГ имеет молекулярную массу 35000. Более предпочтительно, ПЭГ представляет собой нелинейный очищенный ПЭГ, а именно ПЭГ, синтезированный из молекул ПЭГ с низкой молекулярной массой. В соответствии с другим предпочтительным вариантом осуществления водный раствор настоящего изобретения имеет рН от 6,5 до 8 и осмоляльность от 290 до 320 мМ/кг, а также включает в себя ПЭГ, имеющий молекулярную массу более 15000, в концентрации от 0,01 до 5 мМ, раффинозу в концентрации от 20 до 40 мМ, MgSO4 в концентрации от 1 до 10 мМ, H2PO4 В еще одном предпочтительном варианте осуществления водный раствор настоящего изобретения имеет рН 7,4, осмоляльность 320 мкМ/кг и концентрацию ПЭГ, имеющего молекулярную массу более 15000 - 0,03 мМ, концентрацию раффинозы - 30 мМ, концентрацию MgSO4 - 5 мМ, концентрацию H2 PO4 Хорошо известно, что основной причиной, по которой органы признаются непригодными для пересадки, является стеатоз. Вышеуказанные предпочтительные варианты осуществления консервирующего раствора настоящего изобретения позволяют повысить устойчивость стеатозной печени к ишемическому-реперфузионному повреждению, связанному с пересадкой печени. Этот факт позволяет улучшить посттрансплантационное функционирование стеатозного трансплантата и увеличить количество органов пригодных для пересадки. Особенно предпочтительный водный раствор настоящего изобретения состоит из следующих компонентов: - полиэтиленгликоль, имеющий молекулярную массу примерно 35000, в концентрации 0,03 мМ, - раффиноза в концентрации 30 мМ, - MgSO4 в концентрации 5 мМ, - H2PO4 - ионы калия в концентрации 40 мМ, - ионы натрия в концентрации 120 мМ, - лактобионовая кислота в концентрации 100 мМ, - такролимус в концентрации 5 мкМ, - карведилол в концентрации 10 мкМ, - триметазидин в концентрации 1 мкМ, и имеет рН 7,4 и осмоляльность 320 мМ/кг. Более предпочтительно, этот консервирующий раствор также включает в себя дексаметазон в концентрации 16 г/л и пенициллин в концентрации 200000 ед./л. В этих двух предпочтительных вариантах осуществления консервирующий раствор настоящего изобретения не содержит определенных медикаментов, таких как глутатион (GSH), ГЭК, инсулин, аллопуринол и аденозин, которые входят в состав уже известных консервирующих растворов (таких как консервирующие растворы UW и/или IGL-1) и которые, как было показано, являются неэффективными или даже оказывают отрицательное воздействие на консервируемый орган. Особенно значительное взаимное усиление действия было отмечено для этих трех предпочтительных консервирующих растворов, так как они обеспечивают защиту как стеатозной, так и нестеатозной печени, по сравнению с результатами, полученными для других консервирующих растворов. Как уже отмечалось выше, в дополнительном аспекте настоящее изобретение относится к применению описанного и заявленного здесь водного раствора настоящего изобретения для консервации тканей или органов. В предпочтительном варианте осуществления изобретения орган является органом брюшной полости, таким как печень, почка и поджелудочная железа. Предпочтительно орган брюшной полости является маргинальным органом и более предпочтительно - стеатозной печенью. Консервирующий раствор настоящего изобретения применяется для статической низкотемпературной консервации и используется при температуре от 2°С до 10°С, предпочтительно от 3°С до 5°С, и более предпочтительно при 4°С. Кроме того, настоящее изобретение охватывает все возможные комбинации частных и предпочтительных групп, описанных выше. Дополнительные цели, преимущества и отличительные признаки настоящего изобретения станут очевидны специалисту в данной области техники частично из описания и частично из осуществления изобретения. Следующие примеры и рисунки приводятся в качестве иллюстрации и не предназначены для ограничения настоящего изобретения. Примеры Пример 1: Приготовление водного консервирующего раствора Водный раствор, чей состав приведен в Таблице 1, был приготовлен в соответствии с описанным ниже процессом. Таблица 1 Концентрация (мМ)Лактобионовая кислота100 H2 PO4 Концентрация (мМ)Лактобионовая кислота100 H2 PO4 - 25MgSO 45 Раффиноза 30ПЭГ 350000,03 Ионы калия 40Ионы натрия120 Такролимус 5.10-3 Карведилол10 .10-3 Триметазидин1 .10-3 - 25MgSO 45 Раффиноза 30ПЭГ 350000,03 Ионы калия 40Ионы натрия120 Такролимус 5.10-3 Карведилол10 .10-3 Триметазидин1 .10-3 Стадия 1: К раствору, содержащему 1 г диализированного полиэтиленгликоля (ПЭГ 35000), добавляли 4,11 мг такролимуса (TCR) и перемешивали до образования первого раствора. Стадия 2: В емкость объемом один литр, содержащую 800 мл дистиллированной и деионизированной воды комнатной температуры, добавляли 35,83 г лактобионовой кислоты и перемешивали до растворения. Затем добавляли 0,60 г MgSO4, 22,5 мл 5Н NaOH, 6 мл 5Н KOH, 3,4 г KH2PO4 и 17,83 г раффинозы для получения второго раствора. Далее в этот второй раствор добавляли 1 мл исходного раствора TMZ (исходный раствор: 2,66 мг TMZ, растворенного в 10 мл воды) и 10 мл исходного раствора CVD (исходный раствор: 6,5 мг карведилола в 8 мл винной кислоты и 8 мл воды). Раствор, приготовленный на стадии 1, смешивали с раствором, приготовленным на стадии 2, после чего при необходимости добавляли 5Н NaOH для того, чтобы довести значение pH до 7,4±0,1. В довершение всего в емкость добавляли воду, чтобы довести объем до литра, после чего раствор фильтровали и стерилизовали. Раствор, имеющий осмолярность 320±10 мосм/л, был получен, перед использованием в него добавляли дексаметазон (16 г/л) и пенициллин (200000 ед./л). Пример 2 В этом примере сравнивается влияние на печень водного раствора настоящего изобретения по отношению к результатам, полученным при использовании консервирующих растворов UW и IGL-1. Повреждение и функционирование печени оценивали путем измерения уровня трансаминаз, выработки желчи, печеночного клиренса (% БСФ) и содержания АТФ. Для выполнения исследования были использованы гомозиготные (тучные, Ob) и гетерозиготные (худые, Ln) крысы Цукера в возрасте 16-18 недель, приобретенные у фирмы «Иффа-Кредо» (Iffa-Credo, L'Abresle, France). Изолированная перфузируемая печень была использована для того, чтобы при оценке повреждения и функционирования печени избежать влияния других органов, компонентов плазмы и нейронально/гормональных эффектов. Архитектура печени, микроциркуляция и выработка желчи сохраняются в этой экспериментальной модели. Данная экспериментальная модель часто рассматривается в литературе, в качестве предназначенной для испытания эффективности различных консервирующих растворов для пересадки. Все процедуры выполнялись под изофлурановым ингаляционным наркозом. Данное исследование было проведено в соответствии с законодательством Евросоюза об экспериментах над животными (Директива 86/609/CEE). Подготовка печени и экспериментальные группы Хирургическая операция была выполнена так, как описано в предыдущих исследованиях (I. Ben Mosbah et al., Консервирующие растворы и экспериментальные группы Составы консервирующих растворов UW, IGL-1 и P1 приведены в Таблице 2, где P1 обозначает раствор, приготовленный в соответствии с настоящим изобретением. Таблица 2 КомпонентыСвойства UW IGL-1P1 Na+ (ммоль) Катион 30100 120K + (ммоль)Катион 100 3040 Mg2+ (ммоль) Катион 55 5Сульфат (ммоль)Буфер 5 55 Фосфат (ммоль) Буфер25 2525 Лактобионовая кислота (ммоль)Буфер 100 100100 Раффиноза (ммоль) Сахар 3030 30ГЭК (г/л) Коллоид 50- -ПЭГ (г/л) Коллоид -1 1Аденозин (ммоль)Источник энергии 5 5- Аллопуринол (ммоль) Антиоксидант 11 -GSH (ммоль) Антиоксидант 33 -Триметазидин (мкмоль)Митохондриальный протектор- - 1Карведилол (мкмоль)Антиоксидант - -10 Такролимус (мкмоль) Противовоспалительное вещество- -5 Инсулин (ед./л) Митохондриальный протектор 4040 -Дексаметазон (г/л)Мембранный протектор 16 1616 Пенициллин (ед./л) Антибиотик 200000200000 200000 ГЭК = гидроксиэтилкрахмал; GSH = Глутатион.A) Исследование I: сравнение растворов P1 и UW 1) UW: Печени 16 крыс Цукера (8 Ln и 8 Ob) хранили в течение 24 ч при температуре 4°С в растворе UW. 2) UW+CVD: Печени 16 крыс Цукера (8 Ln и 8 Ob) хранили в течение 24 ч при температуре 4°С в растворе UW, содержащем 10 мкМ карведилола. 3) UW+TMZ: Печени 16 крыс Цукера (8 Ln и 8 Ob) хранили в течение 24 ч при температуре 4°С в растворе UW, содержащем 1 мкМ триметазидина. 4) UW+TCR: Печени 16 крыс Цукера (8 Ln и 8 Ob) хранили в течение 24 ч при температуре 4°С в растворе UW, содержащем 5 мкМ такролимуса. 5) UW+CVD+TMZ+TCR: Печени 16 крыс Цукера (8 Ln и 8 Ob) хранили в течение 24 ч при температуре 4°С в растворе UW, содержащем 10 мкМ карведилола, 1 мкМ триметазидина и 5 мкМ такролимуса. Результаты, полученные в группах 1-5 сравнивали с результатами, полученными при хранении печеней 16 крыс Цукера (8 Ln и 8 Ob) в течение 24 ч при температуре 4°С в консервирующем растворе P1. B) Исследование II: сравнение растворов P1 и IGL-1 1) IGL: Печени 16 крыс Цукера (8 Ln и 8 Ob) хранили в течение 24 ч при температуре 4°С в растворе IGL-1. 2) IGL+CVD: Печени 16 крыс Цукера (8 Ln и 8 Ob) хранили в течение 24 ч при температуре 4°С в растворе IGL-1, содержащем 10 мкМ карведилола. 3) IGL+TMZ: Печени 16 крыс Цукера (8 Ln и 8 Ob) хранили в течение 24 ч при температуре 4°С в растворе IGL-1, содержащем 1 мкМ триметазидина. 4) IGL+TCR: Печени 16 крыс Цукера (8 Ln и 8 Ob) хранили в течение 24 ч при температуре 4°С в растворе IGL-1, содержащем 5 мкМ такролимуса. 5) IGL+CVD+TMZ+TCR: Печени 16 крыс Цукера (8 Ln и 8 Ob) хранили в течение 24 ч при температуре 4°С в растворе IGL-1, содержащем 10 мкМ карведилола, 1 мкМ триметазидина и 5 мкМ такролимуса. Результаты, полученные в группах 1-5 сравнивали с результатами, полученными при хранении печеней 16 крыс Цукера (8 Ln и 8 Ob) в течение 24 ч при температуре 4°С в консервирующем растворе P1. Методика проведения эксперимента После 24 ч холодной консервации трансплантата измеряли уровень аланинаминотрансферазы (АЛТ), накопленной после длительной ишемии. Кроме этого после 24 ч холодной консервации трансплантата, для того чтобы сымитировать период тепловой ишемии, которой подвергается трансплантат во время операции по его пересадке реципиенту, печень в течение 30 мин подвергали воздействию температуры 22°С. Затем, через воротную вену печень подключали к системе рециркуляционной перфузии и перфузировали в течение 120 мин при температуре 37°С. В течение первых 15 мин перфузирования ток жидкости постепенно увеличивали, для того чтобы стабилизировать давление в воротной вене на уровне 12 мм рт. ст. (Pression Monitor BP-1; Instruments, Inc, Sarasota, FL, USA). Ток жидкости регулировали при помощи перистальтического насоса (Minipuls 3, Gilson, France). Перфузионная жидкость состояла из питательной среды Уильяма E для культур клеток (Bio Whitaker, Spain) с альбуминовым раствором Кребса-Хензелайта. Перфузионную жидкость насыщали кислородом, используя газовую смесь, состоящую из 95% O2 и 5% CO2. Температуру перфузионной жидкости поддерживали на уровне 37°С. По окончании нормотермической реперфузии (120 мин) отбирали аликвоты перфузионной жидкости, для того чтобы определить количество АЛТ. Также определяли уровень выработки желчи, печеночный клиренс (% БСФ) в образцах желчи и содержание АТФ в образцах печени. Определение биохимических показателей - Определение трансаминаз . Уровень трансаминаз, в качестве показателя повреждения печени, определяли в соответствии с инструкциями к коммерческим наборам фирмы Боерингер Маннхейм (Boehringer Mannheim, Munich, Germany). - Выработка желчи. Уровень выработки желчи оценивали как показатель функционирования печени. Желчь собирали через желчный проток, уровень выработки желчи оценивали путем измерения объема желчи, полученной после 120 мин перфузирования, и представляли в виде мкл/г печени. - Печеночный клиренс БСФ. Как и уровень выработки желчи, печеночный клиренс БСФ рассматривается как еще один надежный показатель функционирования печени. БСФ (бромсульфофталеин) в количестве 10 мг добавляли в перфузионную жидкость через 30 минут после начала перфузирования. Концентрацию БСФ в образцах желчи определяли путем измерения поглощения при длине волны 580 нм. Печеночный клиренс БСФ выражали как % БСФ. - Определение АТФ. Образцы печени гомогенизировали в растворе, содержащем хлорную кислоту, и уровень АТФ определяли при помощи высокоэффективной жидкостной хроматографии. Статистическое исследование Данные выражали в виде среднего значения ± стандартная ошибка. Полученные данные были подвергнуты статистическому исследованию путем анализа дисперсионного критерия, и уровень статистической значимости определяли при помощи критерия Стьюдента-Ньюмана-Кейлса. Во всех случаях результат считался достоверно различным, если p<0,05. Уровень АЛТ оценивали для того, чтобы определить повреждение печени после периода хранения трансплантата. Определение этого показателя является ценным инструментом для прогнозирования повреждения органа после холодной консервации. Повышенный уровень трансаминаз в конце периода гипотермической ишемии наблюдался в стеатозной печени по сравнению с нестеатозной, при хранении как в растворе UW, так и в растворе IGL. Это подтверждает низкую устойчивость стеатозной печени к повреждающему действию, возникающему во время гипотермической ишемии. Значения АЛТ (ед./л) в конце периода гипотермической ишемии для трансплантатов, хранившихся в растворе UW, составили 32,87±2,91 и 152,23±2,21 для нестеатозной и стеатозной печени, соответственно. Значения АЛТ (ед./л) в конце периода гипотермической ишемии для трансплантатов, хранившихся в растворе IGL, составили 21,44±0,62 и 87,47±3,20 для нестеатозной и стеатозной печени, соответственно. Повышенный уровень трансаминаз в конце реперфузии наблюдался в стеатозной печени по сравнению с уровнем, обнаруженным в нестеатозной печени. Значения АЛТ (ед./л) в конце реперфузии для трансплантатов, хранившихся в консервирующем растворе UW, составили 45,05±3,53 и 159,11±3,01 для нестеатозной и стеатозной печени, соответственно. Значения АЛТ (ед./л) в конце реперфузии для трансплантатов, хранившихся в консервирующем растворе IGL, составили 35,62±2,32 и 121,41±1,23 для нестеатозной и стеатозной печени, соответственно. Функционирование печени оценивали путем измерения выработки желчи и печеночного клиренса (% БСФ). Выработка желчи и % БСФ в стеатозной печени были ниже, чем в нестеатозной печени, при хранении как в растворе UW, так и в растворе IGL. Значения выработки желчи (мкл/г/120 мин) в конце реперфузии для печени, хранившейся в растворе UW, составили 9,55±0,25 и 1,46±0,18 для нестеатозной и стеатозной печени, соответственно. Значения выработки желчи (мкл/г/120 мин) в конце реперфузии для печени, хранившейся в растворе IGL, составили 14,25±0,63 и 3,44±0,38 для нестеатозной и стеатозной печени, соответственно. Значения % БСФ в желчи в конце реперфузии для печени, хранившейся в растворе UW, составили 6,13±1,13 и 4,70±0,65 для нестеатозной и стеатозной печени, соответственно. Значения % БСФ в желчи в конце реперфузии для печени, хранившейся в растворе IGL, составили 8,04±0,61 и 7,34±0,58 для нестеатозной и стеатозной печени, соответственно. Пониженный уровень АТФ в конце реперфузии наблюдался в стеатозной печени по сравнению с уровнем АТФ, зафиксированным в нестеатозной печени, при хранении как в растворе UW, так и в растворе IGL-1. Значения уровня АТФ (мкМ/г) в конце реперфузии для печени, хранившейся в растворе UW, составили 0,90±0,02 и 0,61±0,03 для нестеатозной и стеатозной печени, соответственно. Значения уровня АТФ (мкМ/г) в конце реперфузии для печени, хранившейся в растворе IGL, составили 1,19±0,09 и 0,77±0,06 для нестеатозной и стеатозной печени, соответственно. Ниже, в Таблицах 3-6, показано влияние добавления такролимуса (TCR), карведилола (CVD) и триметазидина (TMZ) к известным консервирующим растворам и действие консервирующего раствора Примера 1 (P1) на стеатозную и нестеатозную печень, подвергнутую длительному ишемическому периоду. Значения выражены в процентах защиты, определяемой по показателям повреждения и функциональности печени: АЛТ в конце 24 ч ишемического периода (0 мин), АЛТ в конце реперфузии (120 мин), выработка желчи, % БСФ и содержание АТФ в конце реперфузии (120 мин), по сравнению с консервирующим раствором UW или IGL-1. Таблица 3 Нестеатозная печень (от крыс Цукера Ln) в консервирующем растворе UW UW+CVD UW+TMZ UW+TCR[UW+CVD]+ [UW+TMZ]+[UW+TCR] UW+TCR+ CVD+TMZ P1АЛТ (0 мин)7,51 10,1017,16 34,77 74,90 82,10 АЛТ (120 мин)11,66 17,44 20,5949,69 76,68 85,05 Желчь 8,2412,0 14,034,24 58,87 63,37 % БСФ 9,3810,69 13,7633,83 50,80 63,76 АТФ 8,655,28 16,6630,59 54,8 66,37 Таблица 4 Стеатозная печень (от крыс Цукера Ob) в консервирующем растворе UW UW+CVD UW+TMZ UW+TCR[UW+CVD]+ [UW+TMZ]+[UW+TCR] UW+TCR+ CVD+TMZ P1АЛТ (0 мин)7,51 10,1017,16 34,77 74,90 82,10 АЛТ (120 мин)11,66 17,44 20,5949,69 76,68 85,05 Желчь 8,2412,0 14,034,24 58,87 63,37 % БСФ 9,3810,69 13,7633,83 50,80 63,76 АТФ 8,655,28 16,6630,59 54,8 66,37 Таблица 4 Стеатозная печень (от крыс Цукера Ob) в консервирующем растворе UW UW+CVD UW+TMZ UW+TCR[UW+CVD]+ [UW+TMZ]+[UW+TCR] UW+TCR+ CVD+TMZ P1АЛТ (0 мин)14,44 18,5425,77 58,75 81,06 85,20 АЛТ (120 мин)11,0 10,12 19,5540,67 71,33 78,53 Желчь 8,5011,40 17,6037,50 81,40 91,50 % БСФ 11,4510,70 13,30 35,45 56,067,50 АТФ 7,26 6,5316,22 30,01 55,2075,0 Таблица 5 Нестеатозная печень (от крыс Цукера Ln) в консервирующем растворе IGL-1 UW+CVD UW+TMZ UW+TCR[UW+CVD]+ [UW+TMZ]+[UW+TCR] UW+TCR+ CVD+TMZ P1АЛТ (0 мин)14,44 18,5425,77 58,75 81,06 85,20 АЛТ (120 мин)11,0 10,12 19,5540,67 71,33 78,53 Желчь 8,5011,40 17,6037,50 81,40 91,50 % БСФ 11,4510,70 13,30 35,45 56,067,50 АТФ 7,26 6,5316,22 30,01 55,2075,0 Таблица 5 Нестеатозная печень (от крыс Цукера Ln) в консервирующем растворе IGL-1 IGL +CVD IGL +TMZ IGL +TCR[IGL+CVD]+ [IGL+TMZ]+[IGL+TCR] IGL+TCR+ CVD+TMZ P1АЛТ (0 мин)9,42 7,9819,17 36,57 63,7172,57 АЛТ (120 мин)15,97 17,4118,59 51,97 70,52 81,11 Желчь9,26 4,5014,52 28,28 43,7049,0 % БСФ 8,74 8,3710,15 27,26 41,4049,0 АТФ 8,17 8,4116,56 33,14 48,6359,60 Таблица 6 Стеатозная печень (от крыс Цукера Ob) в консервирующем растворе IGL-1 IGL +CVD IGL +TMZ IGL +TCR[IGL+CVD]+ [IGL+TMZ]+[IGL+TCR] IGL+TCR+ CVD+TMZ P1АЛТ (0 мин)9,42 7,9819,17 36,57 63,7172,57 АЛТ (120 мин)15,97 17,4118,59 51,97 70,52 81,11 Желчь9,26 4,5014,52 28,28 43,7049,0 % БСФ 8,74 8,3710,15 27,26 41,4049,0 АТФ 8,17 8,4116,56 33,14 48,6359,60 Таблица 6 Стеатозная печень (от крыс Цукера Ob) в консервирующем растворе IGL-1 IGL +CVD IGL +TMZ IGL +TCR[IGL+CVD]+ [IGL+TMZ]+[IGL+TCR] IGL+TCR+ CVD+TMZ P1АЛТ (0 мин)9,89 13,9419,24 43,07 61,75 74,27 АЛТ (120 мин)14,62 10,75 19,4744,84 63,76 72,69 Желчь 9,306,0 15,030,30 59,0 72,10 % БСФ 9,738,22 9,9827,93 49,28 62,58 АТФ 7,992,63 18,1528,77 57,0 65,37 IGL +CVD IGL +TMZ IGL +TCR[IGL+CVD]+ [IGL+TMZ]+[IGL+TCR] IGL+TCR+ CVD+TMZ P1АЛТ (0 мин)9,89 13,9419,24 43,07 61,75 74,27 АЛТ (120 мин)14,62 10,75 19,4744,84 63,76 72,69 Желчь 9,306,0 15,030,30 59,0 72,10 % БСФ 9,738,22 9,9827,93 49,28 62,58 АТФ 7,992,63 18,1528,77 57,0 65,37 Согласно показателям повреждения и функциональности печени, наши результаты указывают на то, что совместное добавление такролимуса, карведилола и триметазидина к консервирующим растворам UW или IGL-1 (UW+TCR+CVD+TMZ или IGL-1+TCR+CVD+TMZ) обеспечивало более высокую степень защиты стеатозной и нестеатозной печени по сравнению с результатами, полученными в тех вариантах, когда такролимус, карведилол и триметазидин добавляли по отдельности к консервирующим растворам UW (т.е. [UW+TCR]+[UW+CVD]+[UW+TMZ]) или IGL-1 (т.е. [IGL+TCR]+[IGL+CVD] +[IGL+TMZ]). Кроме того, консервирующий раствор P1 обеспечивал более высокую степень защиты как стеатозной, так и нестеатозной печени по сравнению с результатами, полученными для UW+TCR+CVD+TMZ и IGL-1+TCR+CVD+TMZ. Резюмируя, на основании результатов, приведенных в Таблицах 3-6, можно утверждать, что для растворов настоящего изобретения характерен синергический эффект, который особенно выражен в случае консервирующего раствора P1. Этот синергический эффект особенно ярко проявляется в случае консервации стеатозной печени. Формула изобретения1. Водный раствор для консервации тканей и органов, включающий эффективное количество карведилола, эффективное количество такролимуса и эффективное количество триметазидина. 2. Раствор по п.1, в котором концентрация карведилола составляет от 5 до 10 мкМ, концентрация такролимуса составляет от 5 до 10 мкМ и концентрация триметазидина составляет от 0,01 до 10 мкМ. 3. Раствор по п.1, дополнительно включающий полиэтиленгликоль, имеющий молекулярную массу более 15000. 4. Раствор по п.1, в котором значение рН составляет от 6,5 до 8 и осмоляльность составляет от 290 до 320 мМ/кг и который дополнительно включает:- полиэтиленгликоль, имеющий молекулярную массу более 15000, в концентрации от 0,01 до 5 мМ,- раффинозу в концентрации от 20 до 40 мМ, - MgSO4 в концентрации от 1 до 10 мМ, - 5. Раствор по п.4, в котором значение рН составляет 7,4, осмоляльность составляет 320 мМ/кг, концентрация полиэтиленгликоля составляет 0,03 мМ, концентрация раффинозы составляет 30 мМ, концентрация MgSO4 составляет 5 мМ, концентрация 6. Раствор по п.5, состоящий из- полиэтиленгликоля, имеющего молекулярную массу примерно 35000, в концентрации 0,03 мМ,- раффинозы в концентрации 30 мМ,- MgSO4 в концентрации 5 мМ,- 7. Раствор по п.6, дополнительно включающий дексаметазон в концентрации 16 г/л и пенициллин в концентрации 200000 ед./л. 8. Раствор по любому из пп.1-7, отличающийся тем, что он не содержит глутатион (GSH), гидроксиэтилкрахмал (ГЭК), инсулин, аллопуринол и аденозин. 9. Применение раствора по любому из п.п.1-8 для консервации ткани или органа. 10. Применение по п.9, в котором орган является органом брюшной полости. 11. Применение по п.10, в котором орган брюшной полости является маргинальным органом. 12. Применение по п.11, в котором маргинальный орган является стеатозной печенью. 13. Способ консервации тканей и органов, включающий сохранение указанных тканей или органов в водном консервирующем растворе по любому из пп.1-8 при температуре от 2 до 10°С. Популярные патенты: 2387128 Система сбора отходов для отделения жидких отходов от твердых отходов ... 12 для привода в движение конвейера 12 в направлении, в целом обозначенном стрелкой 110. Твердые отходы таким образом переносятся вдоль конвейера 12 к самому верхнему концу 29 конвейера 12, где они разгружаются из конвейера 12 в сборник 22 твердых отходов. Перемещение твердых отходов вдоль и из конвейера 12 обозначено в целом стрелками 95 и 97.На фиг.2, где элементы, соответствующие таким же элементам на фиг.1 и фиг.4, обозначены аналогичными номерами позиций с добавлением знака «.1», показана система сбора отходов согласно другому варианту воплощения изобретения. Система сбора отходов обозначена в целом позицией 10.1 и включает в себя конвейер 12.1, имеющий самый ... 2482660 Способ выращивания рапса ярового на семена ... ярового рапса осуществляют прямым комбайнированием. Способ позволяет повысить интенсивность выращивания рапса ярового на семена. 5 табл. Изобретение относится к сельскому хозяйству, точнее к растениеводству и кормопроизводству, и может быть использовано в зерновых и зерно-паро-пропашных севооборотах в крупных и мелких сельскохозяйственных предприятиях.Известен способ выращивания рапса ярового на корм, который заключается в том, что посев рапса проводят в период массового развития крестоцветных сорняков и отмирания первой волны перезимовавших крестоцветных блошек. Рапс яровой выращивается в поукосной культуре. В качестве предшествующей культуры используют озимую рожь. Для зоны ... 2272399 Зерноуборочный комбайн ... которых закреплены подбичники с бичами и устройства для принудительного осевого перемещения обмолачиваемой массы, отличающийся тем, что деки выполнены в виде вращающихся труб, внутри которых установлены молотильные барабаны, передние части молотильных барабанов открыты сверху, размещены под измельчителем и на них установлены захватывающие устройства.2. Зерноуборочный комбайн по п.1, отличающийся тем, что молотильные барабаны выполнены в виде открытых с переднего и закрытых с заднего торца труб, в передних частях внутренних полостей которых установлены турбокомпрессоры с воздухозаборниками, а в боковых стенках - сопловые устройства.3. Зерноуборочный комбайн по п.1, ... 2453090 Способ минимальной обработки почвы ... «подгона» и наличия сорных растений зерно обмолачивается качественно и чисто, а сушильные комплексы меньше загружаются. Кроме того, при заявленной обработке созревание урожая происходит на 8-10 дней раньше, качество обмолота улучшается по сравнению с технологией, где посев осуществляется дисковой сеялкой. Также снижается расход энергии при сушке и очистке зерна. Пример 2.Обработка почвы под зернобобовые культуры (горох), предшественником которых являются зерновые культуры. Осенью после уборки предшествующей культуры (зерновые культуры) поля обрабатывали в течение 2-4 дней дискаторами БДМ-6×4 под углом 30-40° от направления уборки на глубину 6-7 см при скорости ... 2196418 Устройство для укладки, сушки и хранения прессованного сена и соломы в рулонах ... передачей или карданными шарнирами и снабжены приводом, при этом крыша навеса снабжена вертикальными направляющими, выполненными с возможностью вертикального перемещения по опорным стойкам, и горизонтальными направляющими, закрепленными на боковых сторонах крыши для обеспечения возможности горизонтального перемещения балок при помощи колес и привода, балки выполнены съемными и снабжены направляющими для горизонтального перемещения тельфера, снабженного захватом с шипами, выполненными в форме оси с возможностью поворота рулонов и установки их в надлежащем положении, при этом нечетные ряды отверстий между рулонами соединены с вентилятором при помощи патрубков и труб, а четные ряды ... |
Еще из этого раздела: 2496298 Узел крепления пальцев подборщика 2464765 Сепарирующее устройство корнеклубнеуборочной машины 2075933 Композиция для иммунизации растений от различных фитопатогенов 2060650 Дозатор концентрированных кормов 2400960 Ориентирующее устройство для корнеплодов конической формы 2091006 Способ создания и формирования хвойнодубоволиственных лесов на северной половине ареала дуба 2137365 Способ отпугивания биологических существ 2160520 Способ создания лакричных плантаций, предпочтительно солодки голой, на бросовых землях 2423042 Электронно-оптический способ регулирования технологии производства агропродукции 2490869 Способ направленного изменения циркуляции воздушных масс и связанных с ней погодных условий |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
 Mitochondrial Permeability transition-pore inhibition enhances functional recovery after long-time hypothermic heart preservation
Mitochondrial Permeability transition-pore inhibition enhances functional recovery after long-time hypothermic heart preservation , Transplantation, 2003, vol. 76(9), pp. 1314-20). Его действие было испытано при консервации сердец. Тем не менее было сделано заключение о том, что такролимус не оказывает никакого влияния на процесс консервации.
, Transplantation, 2003, vol. 76(9), pp. 1314-20). Его действие было испытано при консервации сердец. Тем не менее было сделано заключение о том, что такролимус не оказывает никакого влияния на процесс консервации.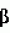 -адреноблокатором, обладающим сосудорасширяющим действием, осуществляемым главным образом за счет избирательной блокады
-адреноблокатором, обладающим сосудорасширяющим действием, осуществляемым главным образом за счет избирательной блокады 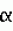 1 рецепторов, и сильным антиоксидантным действием. Карведилол обладает значительно большей способностью ингибировать перекисное окисление липидов, чем другие протестированные
1 рецепторов, и сильным антиоксидантным действием. Карведилол обладает значительно большей способностью ингибировать перекисное окисление липидов, чем другие протестированные 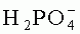 в концентрации от 10 до 40 мМ,- ионы калия в концентрации от 30 до 50 мМ,- ионы натрия в концентрации от 110 до 160 мМ и- лактобионовую кислоту в концентрации от 70 до 140 мМ.
в концентрации от 10 до 40 мМ,- ионы калия в концентрации от 30 до 50 мМ,- ионы натрия в концентрации от 110 до 160 мМ и- лактобионовую кислоту в концентрации от 70 до 140 мМ.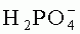 составляет 25 мМ, концентрация ионов калия составляет 40 мМ, концентрация ионов натрия составляет 120 мМ, концентрация лактобионовой кислоты составляет 100 мМ, концентрация такролимуса составляет 5 мкМ, концентрация карведилола составляет 10 мкМ и концентрация триметазидина составляет 1 мкМ.
составляет 25 мМ, концентрация ионов калия составляет 40 мМ, концентрация ионов натрия составляет 120 мМ, концентрация лактобионовой кислоты составляет 100 мМ, концентрация такролимуса составляет 5 мкМ, концентрация карведилола составляет 10 мкМ и концентрация триметазидина составляет 1 мкМ.