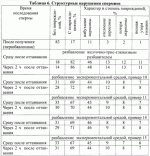
Среда для криоконсервации спермы козловПатент на изобретение №: 2436299 Автор: Аксенова Полина Владимировна (RU), Айбазов Али-Магомет Муссаевич (RU) Патентообладатель: Государственное научное учреждение Ставропольский научно-исследовательский институт животноводства и кормопроизводства Российской академии сельскохозяйственных наук (RU) Дата публикации: 20 Декабря, 2011 Начало действия патента: 6 Мая, 2010 Адрес для переписки: 355017, г.Ставрополь, пер. Зоотехнический, 15, ГНУ СНИИЖК Россельхозакадемии, лаб. воспроизводства овец и коз Изобретение относится к животноводству. Среда для криоконсервации спермы козлов включает глюкозу кристаллическую, трис-(гидроксиметил)-аминометан, лимонную кислоту 1-водную, желток куриный, глицерин, воду дистиллированную, янтарную кислоту и альгинат натрия при следующем соотношении компонентов, мас.%: Глюкоза кристаллическая - 0,600-0,667 Трис-(гидроксиметил)-аминометан - 3,635-4,03 9 Лимонная кислота 1-водная - 1,887-2,084 Янтарная кислота - 0,197-0,232 Альгинат натрия - 0,020-0,040 Глицерин- 5,000-5,500 Желток куриный - 2,500-3,000 Вода дистиллированная - остальное. Изобретение позволяет улучшить устойчивость спермиев к криоконсервации и стабилизировать их биологическую полноценность в процессах замораживания-оттаивания. 7 табл. Область техники, к которой относится изобретение Изобретение относится к сельскому хозяйству, в частности к искусственному осеменению коз, и может быть использовано в биотехнике репродукции других близкородственных видов сельскохозяйственных и диких животных. Уровень техники Известна среда для разбавления и замораживания спермы быков, включающая на 100 мл: 0,8-1,2 г фруктозы, 1,4-1,6 г цитрата натрия, 2,3-2,6 г TRIS'a, 7,5-9,5 г липопротеинов низкой плотности, 5-8 мл глицерина, 0,085-0,12 млн ИЕ пенициллина и дистиллированную воду (см. Qingwang Li; Jianhong Нu; Hongwei Zhao; Zhongliang Jiang, Известны: синтетическая среда для разбавления и замораживания спермы баранов, содержащая лактозу, декстрин, трис-(оксиметил)-аминометан, двунатриевую двухводную соль этилендиаминтетрауксусной кислоты, глицерин, желток куриного яйца и дистиллированную воду, при этом она дополнительно содержит ксилит и бромид-N,N-диметил-N-децил-4-окси-3,5-ди-трет-бутил-бензиламина при следующем соотношении ингредиентов, мас.%: лактоза - 5,0-8,0, декстрин - 3,5-7,0, трис-(оксиметил)-аминометан - 0,065-0,13, двунатриевая двухводная соль этилендиаминтетрауксусной кислоты - 0,08-0,16, глицерин - 3,5-6,0, желток куриного яйца - 12,0-15,0, ксилит - 0,1-0,3, бромид-N,N-диметил-N-децил-4-окси-3,5-ди-трет-бутил-бензиламина - 0,002-0,008, вода дистиллированная - остальное (см. пат. RU Недостатком данных сред является их специфичность для спермы баранов. Среды для замораживания спермы баранов можно применять для криоконсервации спермы козлов, однако только в половой сезон, при этом после оттаивания отмечается довольно низкая активность спермиев (3,7-4,2 балла). При круглогодичном же использовании козлов, в неполовой сезон, когда качество нативной спермы хуже, после криоконсервации и оттаивания отмечается подвижность спермиев ниже 4 баллов, либо некроспермия. При имеющемся разнообразии разбавителей для спермы быков и баранов имеется мало сред для разбавления спермы козлов. Из готовых применяется синтетическая безжелточная среда OVIX-CELL (Франция) и молочный разбавитель (Франция), включающий на 100 мл: 0,194 г глюкозы, 10,0 г молока, 7,0 г глицерина, 0,03 г пенициллина, 0,05 стрептомицина. Однако эти разбавители технологически сложны для применения, так как их использование связано многократным многоступенчатым разбавлением, предварительным отмыванием и центрифугированием спермиев. Применение данной технологии увеличивает себестоимость дозы спермы в 20-25 раз, кроме того, ее можно использовать только стационарно. Для консервации спермы козлов без отмывания спермиев имеется синтетическая среда, содержащая на 100 мл: 10,0 г сахарозы, 2,0 г комплексоната Na2Ca ЭДТА, 0,03-0,06 г полигена, 7,0 г глицерина, 20 мл желтка куриного яйца и дистиллированную воду (Россия, Инструкция по технологии работы организаций по искусственному осеменению и трансплантации эмбрионов сельскохозяйственных животных, 2000). Однако при замораживании спермы козла в данной среде ее активность после оттаивания варьирует и составляет 1,5-4,0 балла при низкой оплодотворяемости, поэтому на практике данная среда не используется. Наиболее близким по технической сущности и достигаемому положительному эффекту и принятый авторами за прототип является желточно-трис-глюкозный разбавитель для козлов (Австралия), состоящий из глюкозы (0,625-1,000 мас.%), трис-(гидроксиметил)-аминометана (3,786-6,057 мас.%), лимонной кислоты (2,172-3,475 мас.%), желтка куриного (2,5-4,0 мас.%), глицерина - 5-8 мас.% и дистиллированной воды до 100 мл (G. Evans, W.M.C. Maxwell Salamon's Artificial Insemination of Sheep and Goats. - Sydney: Butterworths, 1987). Недостатком данного разбавителя является невысокое качество спермы после замораживания-оттаивания: активность спермиев - 4-4,5 балла при оплодотворяющей способности - 44-48%. Раскрытие изобретения Задачей предлагаемого изобретения является разработка среды для криоконсервации спермы козлов, обладающей способностью повышать устойчивость спермиев к криоконсервации и последующему оттаиванию. Технический результат, который может быть получен с помощью предлагаемого изобретения, сводится к улучшению устойчивости спермиев к криоконсервации и стабилизации их биологической полноценности в процессах замораживания-оттаивания. Технический результат достигается с помощью среды для криоконсервации спермы козлов, включающей трис-(гидроксиметил)-аминометан, лимонную кислоту 1-водную, глюкозу кристаллическую, глицерин, желток куриный, воду дистиллированную, при этом она дополнительно содержит янтарную кислоту и альгинат натрия при следующем соотношении компонентов в мас.%: Глюкоза кристаллическая 0,600-0,667 Трис-(гидроксиметил)-аминометан 3,635-4,039 Лимонная кислота 1,887-2,084 Янтарная кислота 0,197-0,232 Альгинат натрия0,020-0,040 Глицерин 5,000-5,500 Желток куриный 2,500-3,000 Вода дистиллированная остальноеСущность получения среды для разбавления спермы козлов заключается в следующем. Берут желточно-трис-глюкозный разбавитель для козлов (G.Evans, W.M.C.Maxwell Salamon's Artificial Insemination of Sheep and Goats. - Sydney: Butterworths, 1987), состоящий из глюкозы, трис-(гидроксиметил)-аминометана, лимонной кислоты, желтка куриного и глицерина, и дополнительно вводят янтарную кислоту и натрия альгинат при следующем соотношении компонентов в мас.%: Глюкоза кристаллическая 0,600-0,667 Трис-(гидроксиметил)-аминометан 3,635-4,039 Лимонная кислота 1-водная 1,887-2,084 Янтарная кислота 0,197-0,232 Альгинат натрия0,020-0,040 Глицерин 5,000-5,500 Желток куриный 2,500-3,000 Вода дистиллированная остальноеЯнтарная кислота (бутандиовая кислота, этан-1,2-дикарбоновая кислота) содержится во всех органах и тканях организма, в том числе в семенной жидкости. Является продуктом пятой реакции и субстратом шестой реакции цикла трикарбоновых кислот. (Т.Т.Березов, Б.Ф.Коровкин. - Биологическая химия М.: Медицина, 1990. - 528 с.) Ее цитопротекторное воздействие обусловлено следующими свойствами: - способностью повышать емкость буферных систем; - антигипоксическим действием, обусловленным ее влиянием на транспорт медиаторных аминокислот, - антиоксидантным действием. Нарушение энергетического метаболизма в спермиях в результате замораживаниия-оттаивания приводит к изменению трансмембранных ионных потоков и накоплению внутриклеточного кальция. Одновременно развивается атака активными формами кислорода, связанная с утечкой электронов, накапливающихся на промежуточных звеньях дыхательной цепи, белков, нуклеиновых кислот и липидов, протекающая по механизму свободно-радикального окисления. Свободные радикалы (высокоактивные формы кислорода, пероксид водорода, альдегиды), образующиеся при неполном восстановлении кислорода, изменяющие функциональные свойства ряда ферментов, углеводов, белков, в том числе дезоксирибонуклеиновой кислоты (ДНК) и рибонуклеиновой кислоты (РНК), в результате клетка утрачивает свои функции, и стимулируются, помимо прямого повреждающего действия кристаллизации и рекристаллизации, вторичные деструктивные процессы. Янтарная кислота оказывает модулирующее влияние на мембраносвязанные ферменты, ионные каналы, рецепторные комплексы, в том числе бензодиазепиновые, ГАМК и ацетилхолиновые. Восстановление дыхательной функции спермиев в присутствии янтарной кислоты идет двумя путями: восстановлением НАД-зависимого участка цикла Кребса (Ленинджер А. Основы биохимии. - М.: Мир - 1991-384 с.) или стимуляцией альтернативного пути, которым является сукцинатоксидазное окисление или окисление янтарной кислоты, замещающее прерванные вследствие процессов кристаллизации и рекристаллизации участки цикла окислительного фосфорилирования (Виноградов А.Д. Измерение активности сукцинатдегидрогеназы/ Реакции живых систем и состояние энергетического обмена. - Пущино, 1979. - с.98-125; Кондрашова М.Н. Взаимодействие процессов переаминирования и окисления карбоновых кислот при разных функциональных состояниях тканей // Биохимия. - 1991. - т.56. - вып.3. - С.388-405). Натрия альгинат является натриевой солью природной альгиновой кислоты, выделяемой из коричневых морских водорослей. Образует высоковязкие растворы, стабилизирует эмульсии. Хорошо растворяется в воде в присутствии глицерина и сахаров, рН 1% раствора = 6,5-7,0 (Афанасьев Н.И., Парфенова Л.Н. Вязкость водных растворов полиэлектролитов. // Изв. вузов. Лесной журнал. - 1991. Благодаря своим уникальным физико-химическим свойствам, хорошим связующим способностям альгинат натрия широко используется в профилактической и клинической медицине и биотехнологии (Л.К.Добродеева, В.П.Белозеров, Н.И.Кондаков, Н.В.Цимбаленко, Л.П.Шилина, К.Г.Добродеев. Пищевые добавки водорослевого происхождения для профилактики и лечения иммунодефицитных состояний. Архангельск, 1996. 12 с; Ю.С.Оводов. Избранные главы биоорганической химии. // Сыктывкар, Сыктывкарский ун-т. 1998, 222 с; Ю.С.Хотимченко, В.В.Ковалев, О.В.Савченко, О.А.Зиганшина. Физико-химические свойства, физиологическая активность и применение альгинатов - полисахаридов бурых водорослей // Биология моря. 2001, Т.22. Альгинат натрия в составе среды выполняет две функции. Первая связана с его способностью увеличивать вязкость раствора. Это необходимо потому, что, как правило, сперма, разведенная средой, имеет вязкость меньше, чем нативная и при искусственном осеменении часть ее вытекает наружу, что снижает эффективность оплодотворения. Вторая функция - реконструктивная. Альгинат натрия в слабоконцентрированных растворах существует в виде агрегатов разных размеров. Установлено тримодальное распределение по размерам частиц в диапазоне концентраций 10-6-10 -5 г/дл, что указывает на присутствие трех групп частиц с размерами гидродинамических радиусов (ГДР), укладывающихся в интервалы: R1=2-4 нм (отдельные молекулы альгината натрия); R2=20-60 нм и R3=130-370 нм (ассоциаты макромолекул). Выше концентрации 10-5 г/дл наблюдается двумодальное распределение, и в растворе присутствуют частицы групп R2 и R3. Количество частиц второй группы резко увеличивается до концентрации раствора альгината натрия равной 5·10-4 г/дл. Количество частиц третьей группы увеличивается постепенно и при концентрации раствора альгината натрия равной 2·10-3 г/дл наступает равновесие в системе, где присутствуют частицы только второй и третьей группы, процентное содержание в растворе которых составляет 70-90% и 30-10% соответственно (И.А.Оберюхтина, К.Г.Боголицын, Н.Р.Попова, Л.Н.Парфенова. Применение метода лазерной корреляционной спектроскопии в исследовании гидродинамических свойств разбавленных растворов альгината натрия. Всероссийская конференция «Химия и технология растительных веществ», устный доклад, Казань, 24-27 июня 2002 г). Одной из основных причин снижения оплодотворяющей способности в процессе криоконсервации и дефростации является повреждение наружной протоплазматической оболочки головки спермиев, разрушение акросомы, а также значительные потери аминокислот липопротеидов и повреждение ферментных систем (Н.А.Желтобрюх, 1973, Д.Т.Данов и соавт., 1984; P.Watson, 1975; H.Wiggin, J.Almguist, 1975; M.Mollova, 1980). Идея заключается в том, что макромолекулы альгината натрия, обладая полиэлектролитным эффектом будут «заклеивать» повреждения в мембране спермия, предупреждая «вытекание» ферментов, в частности, гиалуронидазы и составляющих веществ, и, кроме того, предотвращать образование конгломератов, что наблюдается у спермиев с поврежденной оболочкой в результате нарушения действия сил электростатического отталкивания. Осуществление изобретения Примеры конкретного выполнения получения среды для криоконсервации спермы козлов. Примеры 1-16 сведены в таблицы 1-6. Подбор оптимальных концентраций осуществляли с учетом изменения рН и осмотического давления разбавителя. Среды готовили при следующем соотношении компонентов (табл.1, 2): Таблица 1 Рецепты экспериментальных сред КомпонентыЖелточно-трис-глюкозный разбавительПример 1Пример 2 Пример 3 Пример 4Пример 5Пример 6 Пример 7 Пример 8 Фруктоза кристаллическая - -- -- -- -Глюкоза кристаллическая 0,6670,667 0,667 0,6670,667 0,600 0,6000,734 0,734 Трис-(гидроксиметил)-аминометан 4,0394,039 4,039 4,0394,039 3,635 3,6354,442 4,442 Лимонная кислота 1-водная 2,3162,200 2,084 1,8531,158 1,922 1,8872,280 2,235 Янтарная кислота -0,116 0,2320,463 1,158 0,1620,197 0,267 0,302 Глицерин5,300 5,500 5,5005,500 5,500 5,0005,000 6,000 6,000 Желток куриный2,600 2,500 2,5002,500 2,500 3,0003,000 2,500 2,500 Вода дистиллированная остальное Таблица 2 Рецепты экспериментальных сред (продолжение) КомпонентыПример 9Пример 10 Пример 11 Пример 12 Пример 13Пример 14Пример 15Пример 16 Глюкоза кристаллическая 0,600 0,600 0,6000,600 0,667 0,667 0,6670,667 Трис-(гидроксиметил)-аминометан 3,635 3,635 3,6353,635 4,039 4,039 4,0394,039 Лимонная кислота 1-водная1,887 1,887 1,8871,887 2,084 2,084 2,0842,084 Янтарная кислота 0,197 0,197 0,1970,197 0,232 0,232 0,2320,232 Альгинат натрия 0,010 0,020 0,0400,080 0,010 0,020 0,0400,080 Глицерин 5,000 5,000 5,0005,000 5,500 5,500 5,5005,500 Желток куриный 3,000 3,000 3,0002,000 2,500 2,500 2,5002,500 Вода дистиллированная остальное - -- -- -- -Глюкоза кристаллическая 0,6670,667 0,667 0,6670,667 0,600 0,6000,734 0,734 Трис-(гидроксиметил)-аминометан 4,0394,039 4,039 4,0394,039 3,635 3,6354,442 4,442 Лимонная кислота 1-водная 2,3162,200 2,084 1,8531,158 1,922 1,8872,280 2,235 Янтарная кислота -0,116 0,2320,463 1,158 0,1620,197 0,267 0,302 Глицерин5,300 5,500 5,5005,500 5,500 5,0005,000 6,000 6,000 Желток куриный2,600 2,500 2,5002,500 2,500 3,0003,000 2,500 2,500 Вода дистиллированная остальное Таблица 2 Рецепты экспериментальных сред (продолжение) КомпонентыПример 9Пример 10 Пример 11 Пример 12 Пример 13Пример 14Пример 15Пример 16 Глюкоза кристаллическая 0,600 0,600 0,6000,600 0,667 0,667 0,6670,667 Трис-(гидроксиметил)-аминометан 3,635 3,635 3,6353,635 4,039 4,039 4,0394,039 Лимонная кислота 1-водная1,887 1,887 1,8871,887 2,084 2,084 2,0842,084 Янтарная кислота 0,197 0,197 0,1970,197 0,232 0,232 0,2320,232 Альгинат натрия 0,010 0,020 0,0400,080 0,010 0,020 0,0400,080 Глицерин 5,000 5,000 5,0005,000 5,500 5,500 5,5005,500 Желток куриный 3,000 3,000 3,0002,000 2,500 2,500 2,5002,500 Вода дистиллированная остальноеДля определения эффективности и оптимального соотношения ингредиентов экспериментальной среды была проведена серия опытов. Сперму (все сравнительные опыты проведены на смешанных эякулятах) разбавляют испытуемыми синтетическими средами в соотношении 1:3. В качестве контрольной среды берут прототип - желточно-трис-фруктозный разбавитель. Разбавленную сперму разливают в стеклянные флаконы и помещают в холодильную камеру при температуре 0 По результатам первой серии экспериментов (табл.3), наилучшей оказалась среда с янтарной кислотой (пример 2) (табл.1). Таблица 3 Подвижность спермиев при разбавлении экспериментальной средой с янтарной кислотой (эксперимент 1) Подвижность спермы, баллы Желточно-трис-глюкозный разбавитель Экспериментальная среда (n=5) пример 1пример 2пример 3 пример 4 До разбавления8,84±0,22 8,84±0,22 8,84±0,228,84±0,22 8,84±0,22 Сразу после разбавления 8,54±0,21 8,61±0,239,12±0,18 9,04±0,22 7,43±0,23 Через 3 ч эквилибрации 7,64±0,187,95±0,27 8,51± 0,256,75±0,27 3,51± 0,24 Сразу после замораживания-оттаивания 4,16±0,224,27±0,27 5,05± 0,253,16±0,26 ед Через 2 ч после оттаивания 3,85±0,253,90±0,29 4,13±0,18 еднПримечание: выделены показатели с Р<0,05 относительно желточно-трис-глюкозного разбавителя В таблице 4 представлены результаты эксперимента 2 по определению оптимального содержания янтарной кислоты и соотношения компонентов. Таблица 4 Подвижность спермиев при разбавлении экспериментальной средой с янтарной кислотой (эксперимент 2) Подвижность спермы, баллы Экспериментальная среда (n=5) Пример 5Пример 6Пример 2Пример 7 Пример 8 До разбавления 8,75±0,25 8,75±0,25 8,75±0,25 8,75±0,258,75±0,25 Сразу после разбавления8,38±0,25 8,96± 0,269,09 ±0,21 9,13±0,238,86±0,12 Через 3 ч эквилибрации7,78±0,17 8,30± 0,228,45 ±0,23 8,02±0,187,03±0,27 Сразу после замораживания-оттаивания 4,32±0,19 4,98±0,25 5,10±0,19 4,68±0,183,74±0,36 Через 2 ч после оттаивания 4,00±0,25 4,10±0,22 4,16±0,21 3,77±0,161,85±0,31При разбавлении спермы этими средами (примеры 2 и 6), подвижность спермиев незначительно увеличивается, затем, через 3 ч эквилибрации, снижается на 3,4-5,1%, тогда как в желточно-трис-глюкозном разбавителе - на 13,6%. Сразу после замораживания-оттаивания активными остаются 56,9-58,3% спермиев, тогда как в желточно-трис-глюкозном разбавителе - 47,1%. Через 2 часа после оттаивания при сохранении спермы при 38°C активными остаются 46,7-47,5% спермиев, в желточно-трис-глюкозном разбавителе же - 43,6%. Примеры 5, 7 и 8 оказались менее эффективны. После добавления в среду альгината натрия наилучшими (по подвижности спермиев) оказались примеры 10, 11, 14 и 15 (табл.5). При этом подвижность спермиев сразу после замораживания-оттаивания выше на 34,4-39,1%, чем в желточно-трис-глюкозном разбавителе, и на 12,5-17,2-%, чем в примерах 2 и 6. Подвижность спермиев через 2 ч после оттаивания была выше на 42,3-47,1%, чем в желточно-трис-глюкозном разбавителе, и на 30,6-36,3%), чем в примерах 2 и 6. По результатам экспериментов сперма, сохраняемая в испытуемых (примеры 10, 11, 14, 15) и в желточно-трис-глюкозном разбавителе, была подвергнута акроскопической оценке по методике И.И.Соколовской с соавт. (1981). Для иммобилизации спермиев перед исследованием используют 1% водный раствор фтористого натрия. Каплю подготовленной к использованию спермы наносят на предметное стекло, накрывают покровным стеклом. Избыток влаги удаляют фильтрованной бумагой. При этом спермии в остающемся слое жидкости располагались свободно, в один слой. Края покровного стекла обрабатывают вазелином, чтобы в процессе просматривания не происходило высыхания препарата. Просмотр проводят в оптическом микроскопе при увеличении ×400-500, используя конденсор темного поля ОИ-10 или ОИ-13. В каждом препарате подсчитывают 200 спермиев, отдельно регистрируя неподвижные спермии и спермии с поврежденными акросомами (включая полное отсутствие акросом). Характер и степень структурных повреждений оценивают следующим образом. У неповрежденных спермиев четко просматривается ярко светящийся контур головки и жгутиков. Среди остальных спермиев различают 4 категории их неполноценности: - I категория - общее разбухание акросомы, что выражено тусклыми ее контурами; - II категория - начало отслоения акросомы - отсутствие свечения в области экваториального сегмента; - III категория - потеря акросомы, когда видны только задний ядерный колпачок и жгутики; - IV категория - полная утеря головки, виден только жгутик. Как видно из таблицы 6, при криоконсервации спермы в желточно-трис-глюкозном разбавителе было 82% спермиев с повреждениями акросомы, при этом 36% с отслоением и полной потерей акросомы. После 2 часов сохранения оттаянной спермы при 38°C количество поврежденных спермиев увеличилось до 86%, при 38% с отслоением и полной потерей акросомы. При криоконсервации спермы в экспериментальной среде (примеры 10, 11, 14, 15) спермиев с повреждениями акросомы было на 13-15% меньше сразу после оттаивания и на 14-17% меньше через 2 ч после оттаивания. Испытание среды Биологическая полноценность спермы после криоконсервации в различных средах проверялась в научно-производственном опыте на клинически здоровых козах зааненской породы, подобранных по принципу аналогов. Цель эксперимента состоит в том, чтобы установить качество новой среды для криоконсервации спермы козлов в сравнении с существующими. Сперму получают в искусственную вагину, исследуют по «Инструкции по технологии работы организаций по искусственному осеменению и трансплантации эмбрионов сельскохозяйственных животных» (2000). Для разбавления спермы были взяты: глюкозо-цитратно-желточный разбавитель для овец, рекомендованный «Инструкцией по технологии работы организаций по искусственному осеменению и трансплантации эмбрионов сельскохозяйственных животных» (2000), молочный разбавитель для козлов (Франция), желточно-трис-глюкозный разбавитель для козлов (Австралия) и экспериментальная среда. Сперму разбавляют в соотношении 1:3. Проводят искусственное осеменение в шейку матки дважды в течение половой охоты с интервалом 12 ч в дозе 0,2 мл/гол. По результатам козления проводят учет оплодотворяемости и плодовитости. Из эксперимента выяснено, что оплодотворяемость коз при осеменении криоконсервированной спермой, разбавленной экспериментальной средой, выше на 28-12%, чем при осеменении спермой, разбавленной существующими средами. Плодовитость при этом выше 6,7-15,0% соответственно. Таблица 7 Результаты осеменения коз криоконсервированной спермой Разбавитель Осеменено коз, гол. Из них окозлилось, гол. Оплодотворяемость, % Получено козлят, гол. Плодовитость Глюкозо-цитратно-желточный 25 1144,0 14127,3 Молочный 258 32,010 125,0 Желточно-трис-глюкозный 2512 48,016 133,3 Экспериментальная среда 2515 60,0 21 140,0Таким образом, из эксперимента следует, что заявляемое изобретение по сравнению с прототипом и другими известными техническими решениями обладает рядом преимуществ. 1. Применение среды повышает защитные свойства спермы при замораживании (Т=-196°C) и способствует сохранению оплодотворяющей способности спермы после оттаивания. 2. Учитываются видовые особенности животных, для которых среда предназначена. 3. Среда проста по составу и технологична в приготовлении. 4. Среда не требует использования дорогостоящих препаратов. Формула изобретенияСреда для криоконсервации спермы козлов, включающая глюкозу кристаллическую, трис-(гидроксиметил)-аминометан, лимонную кислоту 1-водную, желток куриный, глицерин, воду дистиллированную, отличающаяся тем, что она дополнительно содержит янтарную кислоту и альгинат натрия при следующем соотношении компонентов, мас.%: Глюкоза кристаллическая 0,600-0,667 Трис-(гидроксиметил)-аминометан 3,635-4,039 Лимонная кислота 1-водная 1,887-2,084 Янтарная кислота 0,197-0,232 Альгинат натрия0,020-0,040 Глицерин 5,000-5,500 Желток куриный 2,500-3,000 Вода дистиллированная ОстальноеMM4A Досрочное прекращение действия патента из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 07.05.2012 Дата публикации: 27.02.2013 Популярные патенты: 2144756 Селекционная сеялка для посева семян в кассеты ... а верхнему придана форма дуговой пружины, конец которой укреплен в боковой стенке семенной банки. 3. Селекционная сеялка по п.1, отличающаяся тем, что высевающий барабан выполнен комбинированным и состоит из основного цилиндрического корпуса и сменного экрана, изготовленного из антистатичного материала, например из медной фольги, где ячейки для забора семян из разгрузочных камер семенных банок сгруппированы по 2 - 3 штуки в один ряд, но в теле основного корпуса они имеют форму полусферических лунок, а на экране углубления соответствуют размерам и форме самого крупного семени данного вида или группы видов культивируемых растений, к тому же каждая соседняя ячейка ориентирована ... 2100354 Макроциклический лактон, фармацевтическая композиция, обладающая антибиотической активностью, и инсектоакарицидная композиция ... прежде чем обработать по каплям раствором триэтиламина (12,6 мл) в сухом дихлорметане (40 мл). Реакционную смесь перемешивают в течение 1,25 ч без охлаждения и выливают в смесь (1:1) холодной воды и простого эфира. Водный слой экстрагируют простым эфиром. Соединившиеся органические слои промывают водой, соляным раствором, высушивают и выпаривают. Остаточную пену хроматографируют на двуокиси кремния, используя смесь дихлорметана с ацетоном (50:1) с получением названного соединения (3,4 г); (CDCl3) содержит 3,33 (М; 1Н), 3,49 (м; 1Н), 3,70 (д 10; 1Н) и 5,52 (д.5; 1Н), м/з содержит 652, 634, 609, 591, 574, 482, 263, 235 и 151. Пример 2. 23-кето Фактор A. Соединение примера 1 (276 ... 2165134 Корнеподрезающий рабочий орган машины для добычи лакричного сырья ... площади 35 для поддержания пласта над лезвием 4. Корнеподрезающий рабочий орган машины для добычи корней лакрицы работает следующим образом. Монтажной частью 12 каждую боковину 10 и 11 болтами М 30х120, устанавливаемыми в отверстия 13, фиксируют U-образный нож на раме машины для добычи лакричного сырья. Рама машины, снабженная опорными кошами с винтовыми механизмами, посредством кронштейнов навески, агрегатируется с тракторами класса тяги 3 - 5. Рассмотрим процесс подрезания и извлечения корней и корневищ солодки в качестве лакричного сырья при работе на легких почвах. При установившемся движении на предварительно подготовленном массиве естественных зарослей солодки режущие кромки ... 2201069 Травяное покрытие на основе гибкого полотна ... за травяным покрытием; - значительное время образования травяного покрытия вследствие относительно продолжительного времени всхода растений и недостаточной интенсивности их роста и развития из-за использования только минеральных удобрений, не позволяющих удерживать влагу в зоне расположения семян, что негативно влияет на скорость растворения питательных веществ, а следовательно, и на поступление их в растения; - значительная стоимость покрытия из-за использования синтетических материалов и сложного и трудоемкого технологического процесса его промышленного изготовления. Целью предлагаемого изобретения является промышленное экономически выгодное изготовление травяного покрытия на ... 2454055 Устройство для ротационного внутрипочвенного рыхления с механическим приводом ... щелерезом из нижнего обрабатываемого слоя почвы на поверхность при работе устройства для ротационного внутрипочвенного рыхления.Техническим результатом, получаемым при практическом использовании изобретения, является создание возможности производить механический привод рыхлителя, при этом обеспечивать высокое качество обработки почвы устройством для ротационного внутрипочвенного рыхления и снижать затраты энергии на обработку почвы.Для решения поставленной технической задачи предлагаемый механический привод устройства для ротационного внутрипочвенного рыхления, содержащий ротационный щелерез с диском щелереза, кольцевым щелерезом с промежуточной шестерней внутреннего ... |
Еще из этого раздела: 2056755 Способ регулирования роста овощных культур 2157068 Способ управления роением в пчеловодческом хозяйстве 2479988 Способ формирования линейно ориентированного виноградника с капельным орошением (версия 3) 2193304 Захват лесозаготовительной машины 2126616 Устройство управления навесной системой трактора 2231250 Устройство для промышленного выращивания земляники и других растений 2404898 Устройство на воздушной подушке для разбрасывателей органоминеральных удобрений 2059362 Установка для выращивания мидий 2091006 Способ создания и формирования хвойнодубоволиственных лесов на северной половине ареала дуба 2450135 Двигатель самоходной машины |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
 патента CN101220345 (А) от 2008.07.16). Недостатком данной среды является неточность рецепта, в частности неясно: «TRIS» обозначает трис-(оксиметил)-аминометан либо трис-(гидроксиметил)-аминометан, также понятие «липопротеины низкой плотности» объединяет целый класс, к тому же неясен механизм их выделения из организма, готового же препарата для реализации не существует. Таким образом, затруднительно воспользоваться данным рецептом. Кроме того, среда предназначена для быков, значит, ее нельзя экстраполировать на козлов.
патента CN101220345 (А) от 2008.07.16). Недостатком данной среды является неточность рецепта, в частности неясно: «TRIS» обозначает трис-(оксиметил)-аминометан либо трис-(гидроксиметил)-аминометан, также понятие «липопротеины низкой плотности» объединяет целый класс, к тому же неясен механизм их выделения из организма, готового же препарата для реализации не существует. Таким образом, затруднительно воспользоваться данным рецептом. Кроме того, среда предназначена для быков, значит, ее нельзя экстраполировать на козлов. +3°C на 3 часа для эквилибрации, затем замораживают в жидком азоте (при -196°C) по общепринятой методике (Инструкция по технологии работы организаций по искусственному осеменению и трансплантации эмбрионов сельскохозяйственных животных, 2000). Оттаивают сперму в специальном оттаивателе, в соответствии с той же инструкцией. Для определения выживаемости спермиев производят оценку по подвижности в баллах. Сперму оценивают на подвижность по десятибалльной шкале после дополнительного разбавления в отношении 1:2 изотоническим раствором лимоннокислого натрия (3,1%), для чего каплю исследуемой спермы рассматривают под микроскопом при температуре +38°C.
+3°C на 3 часа для эквилибрации, затем замораживают в жидком азоте (при -196°C) по общепринятой методике (Инструкция по технологии работы организаций по искусственному осеменению и трансплантации эмбрионов сельскохозяйственных животных, 2000). Оттаивают сперму в специальном оттаивателе, в соответствии с той же инструкцией. Для определения выживаемости спермиев производят оценку по подвижности в баллах. Сперму оценивают на подвижность по десятибалльной шкале после дополнительного разбавления в отношении 1:2 изотоническим раствором лимоннокислого натрия (3,1%), для чего каплю исследуемой спермы рассматривают под микроскопом при температуре +38°C.