Способ укоренения растений, полученных в культуре in vitroПатент на изобретение №: 2423045 Автор: Гузенко Елена Витальевна (BY), Лемеш Валентина Александровна (BY), Хотылева Любовь Владимировна (BY), Картель Николай Александрович (BY), Баер Олег Александрович (UA), Емец Алла Ивановна (UA), Блюм Ярослав Борисович (UA) Патентообладатель: Государственное научное учреждение "Институт генетики и цитологии Национальной академии наук Беларуси" (BY) Дата публикации: 10 Июля, 2011 Начало действия патента: 24 Февраля, 2010 Адрес для переписки: 220072, Республика Беларусь, г.Минск, ул. Академическая, 27, ГНУ "Институт генетики и цитологии Национальной академии наук Беларуси", ОНИР, А.П. Быченко Изображения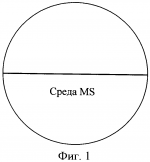 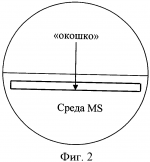 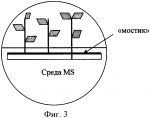 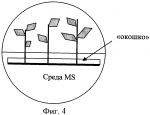 Чашки Петри заполняют безгормональной средой Мурасига и Скуга, содержащей половинный набор макросолей и витаминов, и добавляют агар и сахарозу. Далее в каждой чашке с помощью скальпеля удаляют половину среды. Отступив от верхней границы оставшейся половины среды, прорезают «окошко» практически на всю ширину чашки. Отделенные от каллуса побеги льна помещают в подготовленные таким образом чашки Петри, и, горизонтально протыкая «мостик» из среды, продвигают каждый побег до тех пор, пока срез стебля слегка не коснется поверхности той части среды, которая расположена ниже «окошка». Чашки с помещенными в них побегами размещают на световых установках вертикально. Такая подготовка чашек обеспечивает быструю индукцию ризогенеза у побегов льна. Интенсивное развитие корневой системы способствует быстрому установлению оптимального эндогенного баланса гормонов, что позволяет растениям легко адаптироваться к условиям выращивания ex vitro. 6 ил. Изобретение относится к области биотехнологии растений, в частности, к тем методам культивирования в условиях in vitro, где требуется укоренение полученных растений-регенерантов и адаптация их к естественным условиям выращивания (ex vitro). Изобретение может успешно использоваться в технологиях на основе культивируемых тканей и клеток растений, а именно: получение биологически активных веществ растительного происхождения, ускоренное микроклональное размножение, получение безвирусных растений, получение растений после отдаленной гибридизации, антерные культуры (гаплоиды, дигаплоиды), клеточный мутагенез и селекция, соматическая гибридизация, генетическая трансформация. Известно, что корнеобразование (ризогенез) и последующая адаптация к почвенным условиям являются наиболее трудно выполнимыми этапами в культуре in vitro для любого растительного материала и в высокой степени для льна, регенеранты которого характеризуются особенно низкой адаптационной способностью [1, 2]. В используемых методах для получения корней у регенерантов льна меняют основной состав среды, уменьшая в два, а иногда и в четыре раза концентрацию минеральных солей по рецепту Мурасига и Скуга [1, 3, 4] или заменяют ее средой Уайта [5], уменьшают количество сахаров до 0,5-1% и полностью исключают цитокинины, оставляя один лишь ауксин [6]. В качестве стимулятора корнеобразования применяют Аналогами заявляемого способа индукции корнеобразования могут считаться способы получения корней на жидких питательных средах. В данных способах для поддержания побегов используются подложки из парафиновых дисков, П-образных полосок фильтровальной бумаги, пенопластовых тонких пластинок либо пластинок из любого другого инертного пористого материала [5, 9]. Полоски загибаются, концами вниз помещаются в пробирку так, чтобы образовавшаяся горизонтальная плоскость материала оказалась чуть выше уровня жидкой среды. Культивирование эксплантов происходит на подложке. Данные способы неудобны в исполнении, так как требуются многочисленные сложные манипуляции в стерильных условиях, к тому же микропобеги льна проблематично закрепить на подложке. Кроме того, использование парафиновых дисков может иметь отрицательное воздействие на корнеобразование и качество корневой системы из-за ухудшения аэрации микропобегов [9]. Наиболее близким к заявляемому является метод, в котором используется безгормональная среда Мурасига и Скуга, содержащая половинный набор макросолей и витаминов, агар (7 г/л) и сахарозу (10 г/л) [1]. Несмотря на варьирование состава сред способ получения корней у регенерированных побегов льна во всех методиках одинаков: побеги длиной 2-2,5 см отделяют от каллуса и заглубляют в выбранной среде так, чтобы побег сохранял вертикальное положение. В течение довольно длительного промежутка времени (1-2 месяца) формируются корни. Данный способ имеет существенные недостатки. При долгом культивировании растительных тканей на питательных средах происходит постепенное накопление веществ токсического действия (фенольные соединения), что приводит к формированию растений с измененной морфологией [10]. Возможно накопление этилена, вызывающего эпинастию и хлороз [10, 11]. Вместе с тем, наблюдаются такие нежелательные эффекты, как подавление пролиферации пазушных меристем, образование верифицированных (оводненных) побегов и, как следствие, уменьшение способности растений к укоренению. При заглублении побегов в среду культивирования уменьшается аэрация нижней части стебля растения-регенеранта. В таких условиях образование корней затруднено, а образовавшиеся корни обладают сниженной биосинтетической активностью, замедляется поглощение воды и солей, что вызывает ослабление роста побегов [12]. В связи с этим задача заявляемого способа состоит в создании определенных условий культивирования, стимулирующих ризогенез, у растений-регенерантов. Для решения поставленной задачи разработана методика стимулирования корнеобразования. Сущность заявленного способа состоит в том, что при переносе на среду для ризогенеза побеги льна не заглубляются в питательную среду, а культивируются на границе - питательная среда/воздух. Известно, что у молодых тканей с высоким содержанием физиологически активного материала (в данном случае срез стебля регенерированного побега) интенсивность клеточного дыхания выше, чем у зрелой ткани. Также известно, что образование вторичных корней происходит из клеток камбия. Заявляемый способ основан на улучшении аэрации камбиальной зоны стебля, что приводит к увеличению активности клеток этой зоны, и, следовательно, способствует образованию корней. Для заявляемого способа используется безгормональная среда Мурасига и Скуга, содержащая половинный набор макросолей и витаминов, агар (7 г/л), сахарозу (10 г/л). Далее следует специальная подготовка чашек Петри, заполненных средой указанного состава. Подготовка включает следующие этапы: 1) заливают 25-30 мл среды в чашку Петри диаметром 90 мм; 2) отделяют с помощью скальпеля и удаляют половину среды (фиг.1); 3) отступив от верхней границы оставшейся половины среды 50 мм, прорезают «окошко» практически на всю ширину чашки (примерный размер 50×80 мм) (фиг.2); 4) отделенные от каллуса побеги помещают в подготовленную, как изложено выше, чашку Петри, горизонтально протыкая «мостик» из среды (фиг.3); 5) продвигают побег до тех пор, пока срез стебля слегка не коснется поверхности той части среды, которая расположена ниже «окошка» (фиг.4); 6) чашки Петри с помещенными в них побегами размещают на световых установках вертикально. При реализации проектов с применением биотехнологических методов на культуре льна в основном используются сорта льна масличного [13, 14, 15]. Они обладают более высокой регенерационной способностью по сравнению с сортами льна-долгунца [16]. При разработке заявляемого способа мы использовали генотипы сортов и льна масличного, и льна-долгунца. Индукция ризогенеза по заявляемому методу позволяет одинаково успешно получать функциональные корни у побегов льна обоих типов. Наблюдаемое интенсивное развитие корневой системы (фиг.5A, Б) способствует быстрому установлению оптимального эндогенного баланса гормонов, что позволяет растениям легко адаптироваться к условиям выращивания ex vitro (фиг.6А, Б). В результате проведенных нами наблюдений установлено, что индукция ризогенеза заявляемым способом - сокращает сроки образования корней до 10-20 дней по сравнению с 30-60 днями, если пользоваться общепринятой методикой; - повышает эффективность ризогенеза до 80% по сравнению с 10-20%, если пользоваться общепринятой методикой; - позволяет получить хорошо развитую корневую систему, что облегчает адаптацию побегов к условиям ex vitro; - позволяет получать корни у генотипов льна с различной регенерационной способностью. Источники информации 1. Поляков А.В. Биотехнология в селекции льна. Тверь. 2000. 150 с. 2. Pretova A., Obert В. and Bartosova Z. Flax // Biotechnology in Agriculture and Forestry. Vol.6. Transgenic Crops VI Red. by E.C. Springer-verlag Berlin Heidelberg. 2007. P.129-140. 3. Поляков А.В., Кельнер Е.В. Органогенез и регенерация у льна-долгунца в культуре in vitro // Технические культуры: М.: Агропромиздат, 1991. С.192-199. 4. Burbulis N., Blinstrubiene A., Kupriene R., Sliesaravicius A., Venskutoniene E. Optimization of Linseed flax (Linum usitatissimum L.) in vitro cultures // Zemdirbyste. Agriculture. V.94. N4. 2007. P.120-128. 5. Основы биотехнологии растений. Культура клеток и тканей: Учебное пособие / Составители: Сорокина И.К., Старичкова Н.И., Решетникова Т.Б., Гринь Н.А. СГУ им. Н.Г.Чернышевского. 2002. 45 с. 6. Teguh Wijayanto and Alan McHughen. Genetic transformation of Linum by particle bombardment // In Vitro Cell. Dev. Biol. - Plant 35:456-465, November-December, 1999. 7. Rutkowska-Krause I., Mankowska G., Poliakov A.V. Regeneration ofandrogenic flax (Linum usitatissimum L.) plants and their application in breeding programme // Natural Fibres. 2002, P.92-101. 8. Wang Yu Fu, Kang Qing Hua, Liu Yan, Li Xi Chen, Liu Shao Jun, Xu Ying. Study on Flax Genetic Transformation mediated by Agrobacterium tumefaciens // J. Natural Fibres, Vol.1(1) 2004, P.1-10. 9. Пронина И.Н. Оптимизация процесса ризогенеза подвоев и сортов яблони и груши in vitro. Автореферат канд. дисс. Мичуринск, 2008. 23 с. 10. Кузьмина Н.А. Основы биотехнологии // http://www.biotechnolog.ru/, 2005. 11. Бабикова А.В., Горпенченко Т.Ю., Журавлев Ю.Н. Растение как объект биотехнологии. КОМАРОВСКИЕ ЧТЕНИЯ. Вып.LV. 2007. С.184-211. 12. Крамер П.Д., Козловский Т.Т. Физиология древесных растений. 1983. 464 с. 13. Баер О.А., Баер Г.Я., Емец А.И., Блюм Я.Б. Введение в культуру in vitro и регенерационная способность сортов льна-долгунца с различной устойчивостью к полеганию // Физ. и биох. культ, растений. 2004. Т.36. 14. Поляков А.В., Чикризова О.Ф., Каляева М.А., Захарченко Н.С., Балохина Н.В., Бурьянов Я.И. Трансформация растений льна-долгунца // Физиол. растений. 1998. Т.45. 15. Wang Yu Fu, Kang Qing Hua, Liu Yan, Li Xi Chen, Liu Shao Jun, Xu Ying. Study on Flax Genetic Transformation mediated by Agrobacterium tumefaciens // J. Natural Fibres, Vol.1(1) 2004. P.1-10. 16. Yelena Guzenko, Valentina Lemesh, Lyubov Khotyleva. Comparative analysis of regenerative ability in linseed and fiber flax cultivars // INTERNATIONAL SCIENTIFIC CONFERENCE Actualities in Plant Physiology 12-13 June, 2008, Babtai, Lithuanian Institute of Horticulture. P.58-59. Формула изобретенияСпособ укоренения растений, полученных в культуре in vitro, с использованием безгормональной среды Мурасига и Скуга, содержащей половинный набор макросолей и витаминов, агар (7 г/л), сахарозу (10 г/л), отличающийся тем, что при переносе на среду указанного состава побеги льна не заглубляют в питательную среду, а культивируют на границе «питательная среда/воздух», при этом чашки Петри, заполненные средой указанного состава, проходят следующие этапы подготовки: заливают 25-30 мл среды в чашку Петри диаметром 90 мм; отделяют с помощью скальпеля и удаляют половину среды, как показано на фигуре 1; отступив от верхней границы оставшейся половины среды 50 мм, прорезают «окошко» практически на всю ширину чашки (примерный размер 50×80 мм), как показано на фигуре 2; отделенные от каллуса побеги помещают в подготовленную, как изложено выше, чашку Петри, горизонтально протыкая «мостик» из среды, как показано на фигуре 3; продвигают побег до тех пор, пока срез стебля слегка не коснется поверхности той части среды, которая расположена ниже «окошка», как показано на фигуре 4; чашки Петри с помещенными в них побегами размещают на световых установках вертикально. Популярные патенты: 2493697 Технологическая линия для подготовки к скармливанию пророщенного зерна ... обеспечивает сушку пророщенного зерна с наименьшими энергетическими затратами, а также равномерное распределение пророщенного зерна в комбикорме, за счет измельчения пророщенного высушенного зерна и его равномерного дозирования в спиральный транспортер. Формула изобретения Технологическая линия для подготовки к скармливанию пророщенного зерна, состоящая из загрузочного шнека, конвейера для проращивания зерна, при этом под нижним транспортером установлен бункер конвейерной сушилки, конвейерная сушилка выполнена с возможностью работы на отработанных газах котельной установки, под нижним транспортером установлен наклонный трубопровод, наклонный трубопровод выполнен с ... 2294617 Устройство для отрезания и погрузки силоса и сенажа ... вил внедряются в кормовой массив, затем включаются гидроцилиндры привода ножа. Нож, очерчивая траекторию по дуге, углубляется в кормовой массив и отрезает порцию корма от массива с трех сторон. Затем порция корма зубьями вил отрывается по основанию, поднимается вверх и погружается в транспортное средство. При подборе разрыхленного корма шаг зубьев уменьшается вращением стяжного винта. Стойки, в отверстиях которых расположены резьбовые части винта, сдвигаются и перемещаются в направляющих навстречу друг другу одновременно в горизонтальном и в вертикальном направлениях. Стойки движутся навстречу друг другу за счет шарнирного соединения со звеньями рычажно-шарнирного механизма и ... 2440708 Комбинированное устройство для ротационного внутрипочвенного рыхления ... (скалывания) почвы рыхлящими пальцами рампы перед фрезерованием, исключения лобового движения открытого вала фрезерователя в почве, который в предлагаемом техническом решении почва обтекает сверху по наклонной поверхности рыхлящих пальцев;- усиливается крошение почвы при фрезеровании за счет пересечения траекторий почвенной массы, увлекаемой по окружности почвенной фрезой, с нижней и верхней плоскостями рыхлящих пальцев, а также с поступательно перемещающейся вдоль этих плоскостей почвенной массой; - повышается надежность вала фрезерователя за счет увеличения жесткости на изгиб в условиях импульсных динамических нагрузок при обработке почвы, поскольку вал фрезерователя в ... 2272840 Способ молекулярного маркирования пола хмеля обыкновенного (humulus lupulus l) ... Праймеры были получены после выделения и секвенирования (определения нуклеотидной последовательности) специфичных для мужских растений продуктов ПНР, полученных с двумя микросателлитными праймерами. На фиг.1 стрелкой указан специфичный для мужских растений фрагмент ДНК размером около 700 пн (1,2 - фореграммы мужских растений, 4,5 - женских растений хмеля), полученный с микросателлитным праймером [AC]8 YG. На фиг.2 стрелкой указан специфичный для мужских растений фрагмент ДНК размером около 500 пн (обозначения те же, что на фиг.1), полученный с микросателлитным праймером [CA]8 GT.Предлагаемые нами молекулярные маркеры (две комбинации олигонуклеотидных праймеров) пригодны для ... 2452165 Высевающий аппарат зерновой сеялки с централизованным дозированием семян ... за поддержание патента в силе Дата прекращения действия патента: 06.10.2012 Дата публикации: ... |
Еще из этого раздела: 2400963 Передвижной перегрузчик для зерна сельскохозяйственных культур 2027341 Бункер для сыпучих материалов 2195801 Картофелекопатель швыряльного типа 2389173 Способ выращивания земляники садовой 2197082 Установка для охлаждения молока с использованием естественного холода 2261588 Способ электростимуляции жизнедеятельности растений 2272399 Зерноуборочный комбайн 2437262 Культиватор-плоскорез 2094986 Гербицидный состав 2492623 Портативный электроинструмент с управлением спусковым механизмом |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
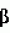 -индолил-3-масляную кислоту,
-индолил-3-масляную кислоту,  1. С.48-54.
1. С.48-54.