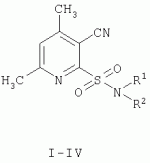
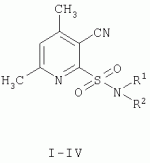
Способ получения n-замещенных 4,6-диметил-3-цианопиридил-2-сульфониламидовПатент на изобретение №: 2300527 Автор: Дмитриева Ирина Геннадиевна (RU), Дядюченко Людмила Всеволодовна (RU), Стрелков Владимир Денисович (RU), Конюшкин Леонид Дмитриевич (RU), Кайгородова Елена Алексеевна (RU) Патентообладатель: Федеральное государственное образовательное учреждение высшего профессионального образования Кубанский государственный аграрный университет (RU) Дата публикации: 10 Июня, 2007 Начало действия патента: 19 Января, 2006 Адрес для переписки: 350044, г.Краснодар, ул. Калинина, 13, КГАУ, ПИО, проректору по НИР В.И.Нечаеву Описывается способ получения N-замещенных 4,6-диметил-3-цианопиридил-2-сульфониламидов, которые могут найти применение в качестве биологически активных веществ. Способ заключается в том, что 4,6-диметил-3-цианопиридил-2-сульфонилхлорид, образующийся путем окислительного хлорирования 4,6-диметил-3-циано(1Н)пиридил-2-тиона, минуя стадию сушки, подвергают взаимодействию с амином. При этом взаимодействие с аминами осуществляют, прибавляя к водной суспензии 4,6-диметил-3-цианопиридил-2-сульфонилхлорида раствор амина в ацетоне при температуре 8-10°С. Технический результат: получение целевых продуктов с высокими выходами - 69-74%. N-замещенные 4,6-диметил-3-цианопиридил-2-сульфониламиды проявляют антидотную активность по отношению к гербициду 2,4-Д на проростках подсолнечника. 2 з.п. ф-лы. Изобретение относится к органической химии, конкретно к способу получения новых химических соединений пиридинового ряда общей формулы:
I R1=аллил, R 2=аллил; II R1=H, R 2=циклогексил; III R1=H, R 2=2-этилфенил; IV R1=H, R 2=изопропил; которые могут найти применение и сельском хозяйстве в качестве биологически активных веществ. Известен способ получения ароматических и гетероциклических N-замещенных сульфониламидов путем взаимодействия соответствующих сульфонилхлоридов с первичными и вторичными аминами [1. Вейганд-Хильгетаг. Методы эксперимента в органической химии. - М.: Химия. 1969. С.621-622]. В свою очередь, ароматические и гетероциклические сульфонилхлориды удобно получать окислительным хлорированием соответствующих меркаптопроизводных [там же, с.613]. Для синтеза сульфониламидов в реакцию с аминами вводится высушенный и очищенный сульфонилхлорид, реакция проводится в среде безводного растворителя, так как сульфонилхлориды являются легкогидролизуемыми веществами. Однако этот метод не позволяет получить N-замещенные 4,6-диметил-3-цианопиридил-2-сульфониламиды. Наиболее близким к предлагаемому способу по технической сущности является способ получения N-замещенных 1,2,4-триазолил-3-сульфониламидов, который выбран в качестве прототипа, заключающийся в том, что полученный окислительным хлорированием и высушенный 1,2,4-триазолил-3-сульфонилхлорид прибавляют к водному раствору аминов при 20°С и после перемешивания при этой же температуре выделяют целевые продукты [2. Патент ЧССР №177897 от 15.03.79 В«Гербицид - средство и способ получения основного компонентаВ»]. Недостатком этого способа является то, что он тоже не позволяет получить N-замещенные 4,6-диметил-3-цианопиридил-2-сульфониламиды. Задачей настоящего изобретения является разработка удобного и надежного способа получения N-замещенных 4,6-диметил-3-цианопиридил-2-сульфониламидов I-IV, которые могут найти применение в сельском хозяйстве в качестве биологически активных веществ. Поставленная задача достигается проведением двухстадийного синтеза: стадия первая - синтез 4,6-диметил-3-цианопиридил-2-сульфонилхлорида V, стадия вторая - взаимодействие последнего с аминами по схеме: Синтез 4,6-диметил-3-цианопиридил-2-сульфонилхлорида V осуществляли окислительным хлорированием 4,6-диметил-3-циано(1Н)пиридил-2-тиона VI в среде 2N HCl при температуре -2-0°С, аналогично описанному в аналогах [1, 2]. Особенностью полученного сульфонилхлорида V является то, что при его сушке в разных условиях (температура комнатная, давление атмосферное или 5-10 мм рт.ст., либо осушивание вытяжки с последующей отгонкой растворителя) во всех случаях происходит элиминирование группы SO2 из молекулы последнего, и вместо целевого 4,6-диметил-3-цианопиридил-2-сульфонилхлорида V выделяется нежелательный 4,6-диметил-2-хлорникотинонитрил. Чтобы избежать разложение 4,6-диметил-3-цианопиридил-2-сульфонилхлорида, сырой продукт V, минуя стадию сушки, немедленно использовали в реакциях с аминами. Для этого к водной суспензии V при температуре 8-10°С прибавляли по каплям раствор соответствующего амина в ацетоне и после 3-4 ч перемешивания выделяли сульфониламиды I-IV с достаточно высокими выходами - 69-74%. В том случае, когда к раствору аминов в воде прибавляли сульфохлорид V при 20°С, как описано в [2], реакционная масса разогревалась до 35-40°С и выход сульфониламидов I-IV резко снижался до 42-46%, вероятно в результате разложения сульфонилхлорида V. Таким образом, предлагаемый способ позволяет с высокими выходами получать целевые N-замещенные 4,6-диметил-3-цианопиридил-2-сульфониламиды I-IV. Этот результат достигается тем, что 4,6-диметил-3-цианопиридил-2-сульфонилхлорид V, исключая стадию сушки, вводят в реакцию с аминами, причем к водной суспензии сульфонилхлорида V прибавляют раствор амина (а не наоборот) при температуре 8-10°С. Исходный 4,6-диметил-3-циано-(1Н)пиридин-2-тион получен известным способом [3. Е.А.Кайгородова, Л.Д.Конюшкин и др. // Изв. Академии наук. Сер. химич. - 1994. - №12. - С.2215-2219.]. Синтезированные N-замещенные 4,6-диметил-3-цианопиридил-2-сульфониламиды I-IV испытывали на антидотную активность на проростках подсолнечника по отношению к гербициду 2,4-дихлорфеноксиуксусной кислоте в условиях лабораторного опыта. Соединения I-IV снижали отрицательное действие 2,4-Д на гипокотиле проростков подсолнечника на 20-31%, на корнях на 25-33%. Очевидно, что ряд N-замещенных 4,6-диметил-3-цианопиридил-2-сульфониламидов I-IV является перспективным в плане поиска новых средств защиты растений от нежелательного действия гербицидов и, в случае расширения этого ряда соединений, могут быть найдены более эффективные антидоты. Изобретение иллюстрируется следующими примерами: Пример 1. N,N-диаллил-4,6-диметил-3-цианопиридил-2-сульфониламид (соединение I). Стадия 1. В суспензию 2,0 г (10 ммоль) 4,6-диметил-3-циано(1Н)пиридил-2-тиона в 20 мл 2 N HCl при перемешивании в течение 1 ч барботируют Cl 2, поддерживая температуру реакционной смеси в интервале 0...-2°С. После отключения тока хлора перемешивание продолжают при этой же температуре еще 20 мин. Осадок образовавшегося 4,6-диметил-3-цианопиридил-2-сульфонилхлорида V отфильтровывают, промывают на фильтре ледяной водой и немедленно используют в стадии 2. Стадия 2. Навеску 1,5 г (6,5 ммоль) влажного 4,6-диметил-3-цианопиридил-2-сульфонилхлорида V суспендируют в 6 мл воды, имеющей температуру 8-10°С, и при перемешивании прикапывают раствор 1,26 г (13 ммоль) диаллиламина в 2 мл ацетона, поддерживая температуру реакционной смеси постоянной. После окончания прибавления перемешивание продолжают при той же температуре 1,5-2 ч, затем температуру постепенно поднимают до комнатной и перемешивают еще 1,5-2 ч. Реакционную массу подкисляют конц. HCl до рН=3-4, осадок отфильтровывают, промывают водой, сушат. После перекристаллизации из гексана получают 1,33 г (70%) целевого продукта I с т.пл.=52-53°С. Найдено, %: С=57,58; Н=5,69; N=14,57; S=11,11; C 14H17N3O 2S; Вычислено, %: С=57,71; Н=5,88; N=14,42, S=11,00. Спектр ЯМР 1Н(ДМСО-D 6):7,69 (1Н, с, Н-5), 5,77 (2Н, м, СН2 СН=СН2), 5,20 (4Н, м, СН 2СН=СН2), 3,93 (4Н, д, CH2CH=СН 2), 2,62 (3Н, с, 6-СН3 Ру), 2,57 (3Н, с, 4-СН3 Ру). Масс-спектр (m/z, относительная интенсивность, %): 186 [М-SO2 , - CH2CH=CH2] + (8), 171 [186-СН3] + (5), 131 [М-SO2N(CH 2CH=CH2)2] + (23), 96 [N(CH2CH=CH 2)2]+ (100). Пример 2. N-циклогексил-4,6-диметил-3-цианопиридил-2-сульфониламид (соединение II). Стадия 1. Так же, как в примере 1. Стадия 2. 1,5 г (6,5 ммоль) влажного 4,6-диметил-3-цианопиридил-2-сульфонилхлорида V суспендируют в 6 мл воды, имеющей температуру 8-10°С, и при перемешивании прикапывают раствор 1,29 г (13 ммоль) циклогексиламина в 2 мл ацетона. После окончания прибавления перемешивание продолжают при той же температуре 1,5-2 ч, затем температуру постепенно поднимают до комнатной и перемешивают еще 1,5-2 ч. Реакционную массу подкисляют конц. HCl до рН=3-4, осадок отфильтровывают, промывают водой, сушат. После перекристаллизации из смеси гексан: этилацетат =1:3 получают 1,41 г (74%) целевого продукта II с т.пл.=151-152°С. Найдено, %: С=57,12; Н=6,41; N=14,17; S=11,08; C14H19N 3O2S; Вычислено, %: С=57,31; Н=6,53; N=14,32, S=10,93. Спектр ЯМР 1 H(ДМСО-D6): 8,30 (1Н, уш. с, NH), 7,65 (1Н, с, Н-5), кольцо циклогексана: 3,18 (м), 1,81 (м), 1,75 (м), 1,48 (м), 1,21 (м), 1,10 (м), 2,62 (3Н, с, 6-СН 3 Ру), 2,55 (3Н, с, 4-СН3 Ру). Масс-спектр (m/z, относительная интенсивность, %): 293 [M] + (2), 250 [М-C3H 7]+ (57), 186 [250-SO 2]+ (28), 159 [186-HCN] + (38), 131 [М-SO2NHC 6H11]+ (49), 98 [NH C6H11] + (100). Пример 3. N-этилфенил-4,6-диметил-3-цианопиридил-2-сульфониламид (соединение III). Стадия 1. Так же, как в примере 1. Стадия 2. 1,1 г (4,8 ммоль) влажного 4,6-диметил-3-цианопиридил-2-сульфонилхлорида V суспендируют в 5 мл воды, имеющей температуру 8-10°С, и при перемешивании прикапывают раствор 0,58 г (4,8 ммоль) 2-этиланилина и 1,48 г триэтиламина (4,8 ммоль) в 2 мл ацетона. После окончания прибавления перемешивание продолжают при той же температуре 1,5-2 ч, затем температуру постепенно поднимают до комнатной и перемешивают еще 3,5-4 ч. Реакционную массу подкисляют конц. HCl до рН=3-4, осадок отфильтровывают, промывают водой, сушат. После перекристаллизации из смеси гексан:этилацетат=1:1 получают 1,04 г (69%) целевого продукта III ст.пл.=147-148°С. Найдено, %: С=61,17; Н=5,62; N=13,18; S=10,34; С16Н 17N3O2S; Вычислено, %: С=60,93; Н=5,43; N=13,32, S=10,17. Спектр ЯМР 1Н (ДМСО-D6): 10,24 (1Н, уш. с, NH), 7,70 (1Н, с, Н-5), 7,24...7,05 (4Н, м, Ar), 2,66 (2Н, к, J=5, СН2 СН3), 2,60 (3Н, с, 6-СН 3 Ру), 2,55 (3Н, с, 4-СН3 Ру), 1,08 (3Н, т, J=5, СН2СН 3). Масс-спектр (m/z, относительная интенсивность, %): 314 [M]+ (23), 251 [М-SO 2]+ (16), 236 [251-СН 3]+ (23), 222 [251-С 2Н5]+ (27), 131 [М-SO2NH С6Н 4 С2Н5-2] + (11), 120 [NH С6Н 4 С2Н5-2] + (100). Пример 4. N-изопропил-4,6-диметил-3-цианопиридил-2-сульфониламид (соединение IV). Стадия 1. Так же, как в примере 1. Стадия 2. 1,1 г (4,8 ммоль) влажного 4,6-диметил-3-цианопиридил-2-сульфонилхлорида V суспендируют в 5 мл воды, имеющей температуру 8-10°С, и при перемешивании прикапывают раствор 0,57 г (9,6 ммоль) изопропиламина в 2 мл ацетона. После окончания прибавления перемешивание продолжают при той же температуре 1,5-2 ч, затем температуру постепенно поднимают до комнатной и перемешивают еще 1,5-2 ч. Реакционную массу подкисляют конц. HCl до рН=3-4, осадок отфильтровывают, промывают водой, сушат. После перекристаллизации из гексана получают 0,87 г (72%) целевого продукта IV с т.пл.=98-99°С. Найдено, %: С=51,17; Н=5,64; N=16,72; S=12,43; C 11H15N3O 2S; Вычислено, %: С=52,16; Н=5,97; N=16,59, S=12,66. Спектр ЯМР 1H(ДМСО-D 6): 8,18 (1Н, д, J=, NH), 7,66 (1Н, с, Н-5), 3,52 [1Н, м, J=, СН(СН3) 2], 2,60 (3Н, с, 6-СН3 Ру), 2,55 (3Н, с, 4-СН3 Ру), 1,12 [6Н, д, J=, CH (CH3) 2]. Масс-спектр (m/z, относительная интенсивность, %): 238 [М-СН3] + (61), 174 [238-SO2] + (42), 131 [М-SO2NHC 3H7-i]+ (84), 104 [131-HCN]+ (37), 58 [NHC 3H7-i]+ (100). Пример 5. N-циклогексил-4,6-диметил-3-цианопиридил-2-сульфониламид (соединение II). Стадия 1. Так же, как в примере 1. Стадия 2. К раствору 1,29 г (13 ммоль) циклогексиламина в 5 мл воды при температуре 8-10°С прибавляют 1,5 г (6,6 ммоль)) влажного 4,6-диметил-3-цианопиридил-2-сульфонилхлорида (температура реакционной массы при этом поднимается до 38°С), перемешивают 30-40 мин, подкисляют конц. HCl до рН=3-4, осадок отфильтровывают, сушат. После переосаждения из 5% раствора КОН получают 0,79 г (42%) целевого продукта II с т.пл.=151-152°С. Элементный анализ и спектральные характеристики идентичны приведенным в примере 2. Пример 6. N-циклогексил-4,6-диметил-3-цианопиридил-2-сульфониламид (соединение II). Стадия 1. Так же, как в примере 1. Стадия 2. 1,5 г (6,5 ммоль) влажного 4,6-диметил-3-цианопиридил-2-сульфонилхлорида V суспендируют в 6 мл воды, имеющей комнатную температуру, и при перемешивании прикапывают раствор 1,29 г (13 ммоль) циклогексиламина в 2 мл ацетона. После окончания прибавления перемешивание продолжают при той же температуре 1,5-2 ч, затем температуру постепенно поднимают до комнатной и перемешивают еще 1,5-2 ч. Реакционную массу подкисляют конц. HCl до рН=3-4, осадок отфильтровывают, промывают водой, сушат. После перекристаллизации из смеси гексан: этилацетат =1:3 получают 0,9 г (47%) целевого продукта II с т.пл.=151-152°С. Элементный анализ и спектральные характеристики идентичны приведенным в примере 2. Пример 7. 4,6-диметил-3-цианопиридил-2-сульфонилхлорид (соединение V). В суспензию 2,0 г (10 ммоль) 4,6-диметил-3-циано(Н)пиридил-2-тиона в 20 мл 2N HCl при перемешивании в течение 1 ч барботируют Cl 2, поддерживая температуру реакционной смеси в интервале 0...-2°С. После отключения тока хлора перемешивание продолжают при этой же температуре еще 20 мин. Осадок отфильтровывают, промывают на фильтре ледяной водой и немедленно подвергают взаимодействию с амином. Структура продукта V подтверждена косвенно, соединениями I-IV, синтезированными на его основе. Пример 6. 4,6-диметил-2-хлорникотинонитрил Способ А. Продукт V (пример 5) после промывания ледяной водой сушат в вакуумном эксикаторе при 5-10 мм рт.ст., получают побочный 2-хлорникотинонитрил с выходом 81%. Способ Б. Продукт V (пример 5) после промывания ледяной водой экстрагируют бензолом, вытяжку сушат безводным Na2SO 4, растворитель отгоняют с помощью ротационного испарителя, получают побочный 2-хлорникотинонитрил с выходом 73%. Найдено, %: C=57,82; Н=4,38; N=17,02; C8H 7ClN2; Вычислено, %: С=57,67; Н=4,23; N=16,81. Спектр ЯМР 1H(ДМСО-D 6): 7,45 (1Н, с, 5Н), 2,62 (3Н, с, СН3 -6), 2,55 (3Н, с, СН3-4). Масс-спектр (m/z, относительная интенсивность, %): 166 [М] + (100), 130 [М-CN]+ (30), 104 [130-CN] + (24), 103 [130-HCN]+ (26). Формула изобретения1. Способ получения N-замещенных 4,6-диметил-3-цианопиридил-2-сульфониламидов формулы
I R1=аллил, R 2=аллил; II R1=H, R 2=циклогексил; III R1=H, R 2=2-этилфенил; IV R1=H, R 2=изопропил, отличающийся тем, что 4,6-диметил-3-цианопиридил-2-сульфонилхлорид, образующийся путем окислительного хлорирования 4,6-диметил-3-циано(1Н)пиридил-2-тиона, минуя стадию сушки, подвергают взаимодействию с амином. 2. Способ по п.1, отличающийся тем, что взаимодействие с аминами осуществляют, прибавляя к водной суспензии 4,6-диметил-3-цианопиридил-2-сульфонилхлорида раствор амина в ацетоне. 3. Способ по п.1, отличающийся тем, что взаимодействие с аминами осуществляют при температуре 8-10°С. MM4A - Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 20.01.2008 Извещение опубликовано: 20.09.2009 БИ: 26/2009 Популярные патенты: 2053661 Устройство для сколачивания ульевых рамок ... пружинными токоведущими контактами 31, взаимодействующими с крайними проволоками в местах закрепления концов и обеспечивающими надежный электрический контакт. Вертикальные стойки, собранные перекладиной, в дальнейшем используются для выполнения следующих видов работ при установке сменных узлов: на стойки 1 устанавливается поддон-столешница, который используется как стол (очистка рамок, сбор прополиса и т.д.); на стойки 1 устанавливается полубак с краном закрепляется и используется как стол для чистки рамок от наростов воска, сбора ломаной суши и т.д.); на стойки 1 устанавливается полубак и на него сверху фильтр, которые закрепляются и используются для распечатывания сотов перед ... 2435369 Гербицидные композиции ... как акролеин, аллиловый спирт, азафенидин, беназолин, бентазон, бензобициклон, бутидазол, цианамид кальция, камбендихлор, хлорфенак, хлорфенопроп, хлорфлуразол, хлорфлуренол, цинметилин, кломазон, CPMF, крезол, орто-дихлорбензол, димепиперат, эндотал, флуоромидин, флуридон, флурохлоридон, флуртамон, флутиацет, инданофан, метазол, метилизотиоцианат, нипираклофен, ОСН, оксадиаргил, оксадиазон, оксазикломефон, пентахлорфенол, пентоксазон, фенилмеркурацетат, пиноксаден, просульфалин, пирибензоксим, пирифталид, квинокламин, родентанил, сулгликапин, тидиазимин, тридифан, триметурон, трипропиндан и тритак.Дополнительно, в качестве следующих примеров, гербициды включают гербициды, описанные ... 2271092 Сортировка барабанного типа ... или горизонтально, или наклонно в сторону выхода самой крупной фракции.4. Сортировка по п.1, отличающаяся тем, что спиральный каркас выполнен коническим, причем большее основание конуса расположено в зоне выхода из него самой крупной фракции продукта.5. Сортировка по п.1, отличающаяся тем, что привод выполнен электромеханическим или ручным. MM4A - Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 19.09.2005 Извещение опубликовано: 10.06.2007 БИ: ... 2120753 Способ получения пестицидного водного суспензионного концентрата и пестицидный водный суспензионный концентрат ... 2.5 части полиоксиэтиленстирилфенилфосфата, 1.2 часть очищенного бентонита, 5.0 частей этиленгликоля и 0.5 части силиконовой эмульсии смешивали с 90.6 частями воды для растворения. Затем в полученной смеси диспергировали 2.0 части соединения N 19, измельченного в сухом виде до среднего размера частиц 21 мкм, и полученную смесь перемешивали. Смесь, полученную таким образом путем диспергирования, загружали в мельницу ДИНО-МИЛЛ, модель KDL, оборудованную сосудом вместимостью 350 мл, вместе с 280 мл керамических шариков с размером частиц 0.3 мм и плотностью 5.6 г/см3 и осуществляли мокрое измельчение в течение 30 минут со скоростью вращения мешалки 2000 о/мин. Полученная ... 2247490 Способ освоения закустаренных земель и устройство для его осуществления ... нагрузку на узлы и предотвращает преждевременный износ ходовой части трактора. На фиг.1 представлено устройство для осуществления предлагаемого способа освоения закустаренных земель.На фиг.2 - схема и последовательность выполнения предлагаемого способа. Устройство для осуществления предлагаемого способа освоения закустаренных земель включает базовый трактор 1 с навешенным сзади подъемным рабочим органом с двумя секциями дисковых батарей. Передняя секция 2 смонтирована на раме 3, задняя секция 4 смонтирована на раме 5 и шарнирно соединена с рамой 3 с возможностью подъема относительно нее с помощью гидроцилиндров 6.Впереди трактора 1 на раме 7 установлено пригибающее устройство 8, ... |
Еще из этого раздела: 2243658 Способ повышения урожайности картофеля и томатов 2407280 Устройство и способ для осушения воздуха в теплице и теплица 2067798 Агромостовой комплекс 2406295 Способ экологического мониторинга лесов 2215407 Способ создания исходного материала для селекции растений 2384065 Инсектоакарицидное средство 2389173 Способ выращивания земляники садовой 2159526 Устройство для навешивания сельскохозяйственных орудий на трактор 2492623 Портативный электроинструмент с управлением спусковым механизмом 2185045 Способ посева, устройство для его осуществления и семявысевающий аппарат конструкции ибрагимова |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||