Штамм бактерий bacillus spp. kr-083 в качестве средства для защиты растений от фитопатогенных микроорганизмов и стимуляции их ростаПатент на изобретение №: 2295562 Автор: Чеботарь Владимир Кузьмич (RU), Уй Гум Канг (KR) Патентообладатель: Государственное научное учреждение Всероссийский научно-исследовательский институт сельскохозяйственной микробиологии Российской академии сельскохозяйственных наук (ГНУ ВНИИСХМ Россельхозакадемии) (RU) Дата публикации: 20 Марта, 2007 Начало действия патента: 23 Августа, 2005 Адрес для переписки: 191186, Санкт-Петербург, а/я 142, пат.пов. Т.В.Петровой Изобретение относится к биотехнологии и касается нового штамма ризосферных бактерий Bacillus spp. KR-083, депонированного под №148 ВНИИСХИ-Д, в качестве средства для защиты сельскохозяйственных растений от фитопатогенных микроорганизмов и стимуляции их роста. Штамм Bacillus spp. KR-083 был выделен из корней риса, произрастающего в провинции Иенгнам Республики Южная Корея. Изобретение позволяет одновременно достичь защиты растений от фитопатогенных микроорганизмов и стимулировать рост растений. 6 табл. Изобретение относится к биотехнологии и касается нового штамма ризосферных бактерий Bacillus spp. KR-083 в качестве средства для защиты сельскохозяйственных растений от фитопатогенных микроорганизмов и стимуляции их роста. Известно и описано изобретение В«Биопрепарат Фитоспорин для защиты растений от болезнейВ» по патенту РФ №2099947 с приоритетом от 15.11.1996 г. на имя Института Микробиологии и вирусологии НАН Украины (UA) и Научно-производственного объединения "Башкирское" (RU), публикация 27.12.1997 г. Основу биопрепарата В«ФитоспоринВ» составляет штамм бактерий Bacillus Subtilis ВНИИСХМ 128 с концентрацией клеток 10 9-1010 на 1 мл физраствора в количестве 92-98 об. % и наполнитель в количестве 2-8 об. %. При этом штамм Bacillus Subtilis ВНИИСХМ 128 характеризуется высокой антагонистической активностью в отношении фитопатогенных бактерий и грибов, что позволяет использовать его для защиты различных видов сельскохозяйственных, декоративных, древесных растений (прототип). Задачей заявленного изобретения является выявление штамма, пригодного для использования в сельском хозяйстве не только с целью защиты растений от фитопатогенных микроорганизмов, но и одновременно с целью стимуляции их роста. Указанная задача решается за счет того, что для защиты сельскохозяйственных растений от фитопатогенных микроорганизмов и одновременно стимуляции их роста используется штамм ризосферных бактерий Bacillus spp. KR-083. Сокращение В«sppВ» в названии штамма означает, что бактерии принадлежат роду Bacillus, но не идентифицируются по виду, т.к. имеют значительные различия с имеющимися известными видами. Штамм ризосферных бактерий Bacillus spp. KR-083 был выделен из корней риса, произрастающего в провинции Иенгнам Республики Южная Корея и депонирован под регистрационным номером В«148 ВНИИСХМ-ДВ» от 14.07.2005 г. Среда культивирования: картофельный агар (200 г картофеля, глюкоза 10 г, агар 20 г на 1 л среды). Температура 28°С, рН среды 6,8-7,0, микроаэрофил. Время культивирования при 28°С составляет 48 часов. Штамм характеризуется следующими морфолого-культуральными и физиолого-биохимическими признаками. Клетки имеют форму правильных палочек с закругленными концами и монополярным перитрихиальным расположением жгутиков. Размер клеток составляет (1,5-2,0)×(0,8-1,0) мкм. Через 24 часа роста на жидкой питательной среде наблюдается накопление поли- На картофельно-декстрозном агаре образует круглые, непрозрачные, бесцветные, слизистые колонии с ровными краями. Диаметр колоний 3-5 мм. Оптимальная температура для роста (28-37)°С. При температуре более 45°С и менее 11°С рост замедленный. Оптимальное значение рН среды 6,8, рост происходит также при рН от 5,5 до 7,5. Штамм KR-083 способен фиксировать молекулярный азот, не гидролизует казеин и крахмал, медленно коагулирует лакмусовое молоко с обесцвечиванием лакмуса. У штамма наблюдается рост при 4°С, наличии 7% NaCl и 0,001% лизоцима. Штамм обладает денитрифицирующей активностью до газообразного азота. В качестве единственного источника углерода штамм KR-083 использует глюкозу, арабинозу, ксилозу, лактозу, галактозу, фруктозу, сахарозу, мальтозу, маннит с образованием кислоты, а также рамнозу декстрин и крахмал с образованием щелочи. Выявлено и экспериментально установлено, что штамм KR-083 проявляет антагонистические свойства по отношению к возбудителям болезней сельскохозяйственных культур - фитопатогенных бактерий и грибов: - для пшеницы озимой и яровой - штамм эффективен против мучнистой росы (Erysiphe graminis), бурой ржавчины (Puccinia recondita), фузариозной корневой гнили (Fusarium culmorum); - для ячменя ярового - эффективен против плесневения семян (Penicillium, Alternaria), корневых гнилей (Bipolaris sorokiniana); - для капусты белокочанной и цветной - эффективен против сосудистого бактериоза (Xanthomonas campestris), черной ножки (Rhizoctonia solani), питиозной корневой гнили (Pythium irregulare); - для картофеля - эффективен против фитофтороза (Phytophtora infestans), ризоктониоза (Rhizoctonia solani), фузариозного увядания (Fusarium oxysporum); - для винограда - эффективен против милдью (Plasmopara viticola), оидиума (Uncinula necator), серой гнили (Botrytis cinerea). В таблице 1, 2 представлены сравнительные результаты по антагонистической активности двух штаммов бактерий: Bacillus subtilis ВНИИСХМ 128 (продуцента биопрепарата Фитоспорин) и заявляемого штамма Bacillus spp. KR083, по отношению к фитопатогенным микроорганизмам. Таблица 1.Антагонистическая активность штаммов ризосферных бактерий по отношению к фитопатогенным бактериямШтамм Зона ингибирования роста, мм Erwinia carotovora А-1 Pseudomonas syringiae 8300Pseudomonas syringiae 2314Erwinia carotovora 3391 Clavibacter michiganense 17-1Bacillus subtilis 128 (Фитоспорин)14,2±1,3 18,9±1,611,8±0,9 28,8±2,116,0±1,2 Bacillus spp. KR-083 (заявленный) 27,0±1,826,0±2,1 18,0±1,332,0±2,8 28,0±2,2Из данных, приведенных в таблице 1, видно, что заявленный штамм бактерий Bacillus spp. KR-083 обладает большей антагонистической активностью по отношению к фитопатогенным бактериям по сравнению с прототипом - штаммом Bacillus subtilis 128 ВНИИСХМ - продуцентом биопрепарата Фитоспорин. Таблица 2.Антагонистическая активность штаммов ризосферных бактерий по отношению к фитопатогенным грибам.Штамм Зона ингибирования роста, мм Phytophtora capsiciRhizoctonia solaniFusarium culmorum Fusarium solaniPythium spp. Bacillus subtilis 128 (Фитоспорин) 26,5±2,216,7±1,8 16,2±1,316,4±1,3 22,1±2,5Bacillus spp. KR-083 (заявленный)36,1±2,8 30,7±1,734,0±4,4 23,7±1,728,1±2,9Из данных, приведенных в таблице 2, видно, что заявленный штамм бактерий Bacillus spp. KR-083 обладает большей антагонистической активностью по отношению к фитопатогенным грибам по сравнению с прототипом - штаммом Bacillus subtilis 128 ВНИИСХМ - продуцентом биопрепарата Фитоспорин. Для развития растений им требуется азот. Азотфиксация - это включение азота воздуха в соединение, доступное для использования растениями и другими организмами. Биологическая азотфиксация осуществляется азотфиксирующими микроорганизмами. В связи с этим азотфиксирующая активность штамма является важной характеристикой, оказывающей влияние на стимуляцию роста растений. Заявленный штамм бактерий Bacillus spp. KR-083 обладает азотфиксирующими свойствами, т.е. ростстимулирующими свойствами, в отличие от прототипа - штамма бактерии Bacillus subtilis 128 ВНИИСХМ, который азот не фиксирует. Поэтому для сравнения (за эталон) азотфиксирующей активности штамма бактерий Bacillus spp. KR-083 была взята чистая культура ризобактерии Herbas-pirillum seropedicae ATCC 35892, выделенная также из корней риса (типовой штамм, хранящийся в Американской Коллекции типовых культур). В таблице 3 представлены данные по азотфиксирующей активности штамма бактерий Bacillus spp. KR-083 по сравнению с эталоном - азотфиксирующей бактерией Herbaspirillum seropedicae ATCC 35892 (типовой штамм, хранящийся в Американской Коллекции типовых культур). Таблица 3.Азотфиксирующая (ацетиленредуктазная) активность чисты культур ризобактерий, выделенных из корней рисаШтамм Азотфиксирующая (ацетиленредуктазная) активность (наномолей С2Н 4/4 мл среды) через 12 чЧерез 24 ч через 48 ччерез 72 ч через 96 чHerbaspirillum seropedicae ATCC 35892 (эталон)0,93 7,89170,931025,44 1726,75Bacillus spp. KR-083 (заявленный)0,45 21,48249,68635,09 943,61Из данных, приведенных в таблице 3, видно, что заявленный штамм бактерий Bacillus spp. KR-083 на начальном этапе (24-48) часов обладает большей азотфиксирующей активностью по сравнению с эталоном - типовым штаммом азотфиксирующей бактерии Herbaspirillum seropedicae ATCC 35892, выделенным так же, как и заявленный штамм, из корней риса. Ростстимулирующая активность штамма Bacillus spp. KR-083 и штамма Bacillus subtilis ВНИИСХМ 128 определялась двумя методами: а) методом стимуляции корней проростков кукурузы; б) методом биотеста с хлореллой. а) Определение ростстимулирующей активности штаммов методом стимуляции корней проростков кукурузы. Семена кукурузы промывались в проточной воде в течение 2 часов, помещались в пластиковые подносы с влажной фильтровальной бумагой проростками вверх, укрывались влажной фильтровальной бумагой и помещались для проращивания в инкубатор при 28°С. Через 48 ч отбирались проростки длиной 1-1,5 см. Кончики корней кукурузы на 2-3 мм погружались в бактериальную суспензию соответствующих штаммов бактерий (например, в рабочую культуру, полученную описанным ниже способом) различной концентрации на 1,5 часа. В качестве контроля использовали стерильную питательную среду - среду культивирования штамма Bacillus spp. KR-083. Затем проростки кукурузы помещались в пластиковые подносы с увлажненной фильтровальной бумагой так, чтобы кончики корней находились на одной стартовой линии. Проростки укрывали влажной фильтровальной бумагой и помещали в инкубатор при 28°С. Через 24 ч корни проростков, пересекшие стартовую линию, отрезались и измерялась их длина. Ростстимулирующую активность сравниваемых штаммов Bacillus spp. KR-083 и Bacillus subtilis ВНИИСХМ 128 рассчитывали по отношению к контрольным проросткам. б) Определение ростстимулирующей активности штаммов методом биотеста с хлореллой. Во ВНИИСХМ был разработан метод оценки ростстимулирующей активности ризобактерий с помощью водоросли Chlorella vulgaris. Штамм Chlorella vulgaris 157 (получен от проф. Б.В.Громова, С.-Петербургский Госуниверситет) был выращен на модифицированной среде Хата (KNO3 - 0,1 г/л, КН2PO4 - 0,07 г/л, MgSO4×7H 2O - 0,033, пептон - 1 г/л, глюкоза - 1 г/л, дрожжевой экстракт - 0,1 г/л, агар - 10 г/л, рН 6,5) при 20°С и освещенности 2500 люкс. Пятидневная культура с одного косяка смешивалась со 150 мл агаровой среды Хата (t=50°C) и разливалась в чашки Петри. После застывания агара пробочным сверлом делали колодцы диаметром 4 мм, в которые помещались 100 мкл бактериальной суспензии (рабочей культуры), полученной на основе штамма бактерий Bacillus spp. KR-083, a также на основе штамма, взятого за прототип Bacillus subtilis ВНИИСХМ 128 - продуцента биопрепарата Фитоспорин. В качестве контроля использовали питательную среду - среду культивирования штамма Bacillus spp. KR-083. Инокулированные чашки помещались на свет, и диаметр колоний подсчитывался на 5 день инкубации. Данные по ростстимулирующей активности штамма Bacillus spp. KR-083 и штамма, взятого за прототип Bacillus subtilis ВНИИСХМ 128 - продуцента биопрепарата Фитоспорин, которая была определена двумя вышеописанными методами, представлены в таблице 4. Таблица 4.Ростстимулирующая активность ризобактерий, выделенных из корней риса, определенная методом биотестов с хлореллой и методом стимуляции корней проростков кукурузыШтамм Рост хлореллы через 5 дней ( , мм)Рост корней проростков кукурузы (% к контролю)* при разведении 1:1 при разведении 1:50при разведении 1:100Bacillus subtilis ВНИИСХМ 128 (Фитоспорин)0 +7,9+2,3+1,2 Bacillus spp. KR-083 (заявленный) 3,0±0,2-20,4 +26,3+11,1 * - среднее из десяти повторностей (замеров) , мм)Рост корней проростков кукурузы (% к контролю)* при разведении 1:1 при разведении 1:50при разведении 1:100Bacillus subtilis ВНИИСХМ 128 (Фитоспорин)0 +7,9+2,3+1,2 Bacillus spp. KR-083 (заявленный) 3,0±0,2-20,4 +26,3+11,1 * - среднее из десяти повторностей (замеров) Из данных, приведенных в таблице 4, видно, что заявленный штамм бактерий Bacillus spp. KR-083 обладает более сильной ростстимулирующей активностью по сравнению с прототипом - штаммом Bacillus subtilis ВНИИСХМ 128, в частности в методе стимуляции корней проростков кукурузы - при наиболее часто применяемом на практике разведении (концентрации) бактериальной суспензии (маточной культуры штамма) 1:50 и 1:100. Влияние штамма бактерии Bacillus spp. KR-083 на повышение урожайности различных сельскохозяйственных культур (картофеля, яровой и озимой пшеницы, ячменя, риса, сахарной свеклы, подсолнечника, капусты, моркови, свеклы, салата, редиса) была экспериментально подтверждена. Эффективность штаммов Bacillus spp.KR-083 и Bacillus subtilis ВНИИСХМ 128 в вегетационных опытах с редисом с.Жара (при обработке семян и по вегетации после всходов) представлена в таблице 5. При этом вегетационные опыты проводили по принятой методике (Доспехов, 1986 г.), причем под "% NPK" понимались агрономически рекомендуемые дозы внесения азота, фосфора и калия по действующему веществу при выращивании редиса. Таблица 5.Эффективность штаммов ризобактерий в вегетационных опытах с редисом с.Жара Вариант опыта Редис с.Жара Урожай (г/сосуд)% прибавки к контролю Контроль 50% NPK 5,87-Контроль 100% NPK8,0536,7 Фон 50% NPK Bacillus subtilis ВНИИСХМ 128 + (Фитоспорин) 6,8316,4 Bacillus spp. KR-083 + (заявленный) 7,7822,5Bacillus subtilis ВНИИСХМ 128 +++ (Фитоспорин)7,32 24,7Bacillus spp. KR-083 +++ (заявленный)9,31 58,6Условные обозначения: + - обработка семян;+++ - обработка семян и две обработки по вегетации через 7 и 15 дней после всходовИз данных, приведенных в таблице 5, видно, что в вегетационных полевых опытах с редисом с.Жара инокуляция заявленным штаммом бактерий Bacillus spp. KR-083 способствует увеличению урожая редиса, причем в большей степени, чем аналогичная обработка штаммом Bacillus subtilis ВНИИСХМ 128 (прототипом) -продуцентом биопрепарата Фитоспорин. Сравнительные данные, характеризующие влияние штаммов Bacillus spp. KR-083 и Bacillus subtilis ВНИИСХМ 128 на повышение урожайности картофеля с.Невский в производственных опытах в Ленинградской области (ГП ОПХ В«КаложицыВ»), приведены в таблице 6. Таблица 6.Урожайность картофеля с.Невский в производственных опытах в Ленинградской области (ГП ОПХ В«КаложицыВ»)Вариант опытаУрожайность (ц/га) Прибавка к контролю (ц/га)(%) Контроль366,6 -- Bacillus subtilis ВНИИСХМ 128 (Фитоспорин) 387,420,85,7 Bacillus spp. KR-083 (заявленный) 483,3116,7 31,8Из данных, приведенных в таблице 6, видно, что инокуляция заявленным штаммом бактерий Bacillus spp. KR-083 в производственных опытах с картофелем с.Невский способствовала увеличению урожайности картофеля в большей степени, чем штаммом - прототипом Bacillus subtilis ВНИИСХМ 128 - продуцентом биопрепарата Фитоспорин. То есть примеры, приведенные в таблицах 5 и 6, подтверждают, что инокуляция посевного материала и обработка всходов заявленным штаммом бактерий Bacillus spp. KR-083 способствует увеличению урожайности овощей на (15-32) %. Таким образом, из данных, приведенных выше в таблицах следует, что заявленный штамм бактерий Bacillus spp. KR-083 обладает большей антагонистической активностью по отношению к фитопатогенным микроорганизмам (бактериям и грибам), а также более высокой ростстимулирующей активностью растений благодаря способности биологической азотфиксации по сравнению со штаммом-прототипом Bacillus subtilis ВНИИСХМ 128, а его применение в сельском хозяйстве способствует увеличению урожайности культур. Важным является также и то, что при использовании указанного штамма в составе биопрепаратов бактерии Bacillus spp. KR-083 образуют споры, что позволяет сохранять эти препараты без потери жизнеспособности бактерий в течение длительного срока, не менее 12 месяцев с момента их получения. Концентрация (количество жизнеспособных клеток и спор) штамма бактерии Bacillus spp. KR-083 для его эффективного использования в составе различных биопрепаратов должна составлять 10 6-108 клеток в 1 мл культуральной жидкости. Экспериментально установлено, что использование штамма в концентрации менее 106 кл/мл ведет к снижению антагонистического эффекта, а увеличение концентрации свыше 109 кл/мл не приводит к увеличению эффективности защитного и ростостимулирующего действия. Ниже приведен пример получения жидкой формы микробиологического препарата на основе заявляемого штамма ризосферных бактерий Bacillus spp. KR-083. 1. Чистая культура в колбах. Для получения этой культуры для бактерий Bacillus spp. KR-083 готовят жидкую питательную среду следующего состава, г/л: пептон - 20,0 глицерин - 10,0 K2HPO 4 - 1,5 MgSO4 - 1,5 Значение рН смеси подводят перед стерилизацией до значения 7,0. Полученную жидкую питательную среду разливают в 750 мл качалочные колбы по 100 мл и стерилизуют при 1 атм 30 минут. Инокуляцию колб проводят стерильно микробиологической петлей из пробирки со скошенным питательным агаром (200 г картофеля, 10 г глюкозы, 20 г агара на 1 л среды), содержащим чистую культуру бактерий Bacillus spp. KR-083, помещают на качалку (220 об/мин) и культивируют 48 часов при температуре 28°С. 2. Маточная культура в колбах. Маточную культуру выращивают на среде и при условиях, указанных в п.1 для чистой культуры. Засев колб производят 5 мл чистой культуры и выращивают 48 часов. При этом достигается титр около 5×109 кое/мл (колониеобразующих единиц в 1 мл). Посевной материал (чистую и маточную культуры) хранят в холодильнике до 1 месяца при температуре (4-6)°С. 3. Рабочая культура Рабочую культуру получают в бутылях или ферментерах на аналогичных средах, допускается разбавление питательной среды в 2 раза. Норма инокуляции маточной культурой составляет 2-5% объема среды. Продолжительность культивирования - 48 часов при температуре 28-30°С. При выращивании рабочих культур допускается повышение температуры до 33°С. Таким образом, получают концентрат суспензии препарата. 4. Жидкая форма биопрепарата на основе штамма бактерии Bacillus spp. KR-083 KR-083. Благодаря относительно высокой биологической активности используемого штамма и высокой скорости роста жидкий препарат в готовом виде, а также в производстве, практически не заражается посторонней микрофлорой. Тем не менее, необходим постоянный контроль всех этапов производства. Для приготовления жидкой формы препарата необходимо использовать помещение площадью 20-40 м2, отделанное кафелем и полами с твердым покрытием, пригодным для ежедневной мойки и стерилизации. Помещение должно содержаться в отличном санитарном состоянии, быть достаточно сухим и хорошо вентилируемым. В помещении ежедневно производится влажная уборка и обработка его антисептиками (0,5% раствором хлорной извести, хлорамином, фенолом или формалином). Воздух помещения периодически очищается от микрофлоры путем осаждения ее стерильной водой, распыляемой с помощью гидропульта. Перед началом работы в помещении (за 2-3 часа) включается система бактерицидных ламп (БУВ, ПРК-2 или ПРК-4). УФ-лампы расположены в центре рабочего помещения над рабочими столами и под столами, имея в виду, что основная В«грязьВ» поступает в основном с пола. Чистота воздуха контролируется микробиологическими пробами, взятыми после пятиминутной экспозиции на три чашки Петри с МПА + 0,5% глюкозы. Чашки с высевами просматриваются после выдержки в термостате при температуре 37°С в течение 3-5 суток. В случае выявления большого количества (10-15 колоний) микрофлоры в воздухе бокса производится дезинфекция. Работа производится в чистых, накрахмаленных, хорошо проглаженных халатах и колпаках, отдельной обуви, которые находятся в тамбуре рабочего помещения, где работающие надевают их и снимают по окончании работы в помещении. Полученный концентрат суспензии препарата на основе штамма KR-083 (рабочую культуру) разводят стерильной водой в соотношении 1:10 или 1:20, чтобы получить конечную концентрацию не менее 100 миллионов колониеобразующих единиц в 1 мл препарата (не менее 10 8 кое/мл). Жидкий препарат стерильно разливают в полиэтиленовые бутылки или канистры емкостью 0,25; 0,5; 1,0 и 10,0 литров. Полиэтиленовые бутылки или канистры ополаскивают спиртом. На бутылки или канистры размещают тарные этикетки и инструкции по применению. Полученную жидкую форму препарата выдерживают в течение 3-5 дней при 20-25°С, после чего ее можно применять для обработки сельскохозяйственных культур. Строгий контроль и правильное ведение процесса приготовления жидкой формы предопределяют высокое качество биопрепарата на основе штамма KR-083 и его соответствующую активность при возделывании сельскохозяйственных культур. Формула изобретенияШтамм ризосферных бактерий Bacillus spp. KR-083, депонированный под №148 ВНИИСХМ-Д, в качестве средства для защиты сельскохозяйственных растений от фитопатогенных микроорганизмов и стимуляции их роста. Популярные патенты: 2464765 Сепарирующее устройство корнеклубнеуборочной машины ... тел в точке контакта;R1 - радиус скругления упругого элемента элеватора, м;R2 - радиус клубня, м;Е1 - модуль упругости материала поверхности упругого элемента, Н/м2;Е2 - модуль упругости корнеклубнеплода, Н/м2;µ 1 - коэффициент Пуассона материала поверхности упругого элемента;µ2 - коэффициент Пуассона клубня; Р - сжимающая сила, Н.2. Сепарирующее устройство корнеклубнеуборочной машины по п.1, отличающееся тем, что покрытие жестких пластин с внешней стороны выполнено эластичным. 3. Сепарирующее устройство корнеклубнеуборочной машины по п.2, отличающееся тем, что консольно закрепленные упругие элементы прутков элеватора выполнены ... 2307495 Пневматический высевающий аппарат ... элементов, кроме того, внутренний диаметр сопла избыточного давления равен двойному максимальному диаметру дозирующих элементов, заборное устройство содержит две трубки, а выступы в крышке и прокладке выполнены таким образом, что их длина больше расстояния от внешней кромки высевающего диска до окружности расположения дозирующих элементов внутреннего ряда на величину, равную максимальному диаметру дозирующих элементов. MM4A - Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 21.03.2008 Извещение опубликовано: ... 2228024 Способ профилактики мастита у коров и устройство для его осуществления ... от состояния вымени подбирают параметры НЧ ультразвуковых колебаний. Например, если вымя животного находится в хорошем физиологическом состоянии и небольших размеров, то для профилактической дезинфицирующей обработки достаточно использовать НЧ ультразвук с частотой до 800 кГц, интенсивностью 1,5 Вт/см2 и в течение 2 мин. Поскольку раствор попадает в зону активных ультразвуковых колебаний, он дробится на мельчайшие частицы, образуя туман, и гасит колебания, и поэтому поверхность вымени достигают колебания с меньшей частотой и интенсивностью. Такую универсальную обработку вымени НЧ ультразвуком с дезинфицирующим или лечебным веществом можно осуществлять в сухостойный и ... 2267261 Молочно-доильный комплекс ... трудозатрат на проведение дойки при максимальном использовании полезной площади. Задача решается тем, что в молочно-доильном комплексе, включающем помещение для содержания животных, доильную установку с приводом, направляющей и ограничителями, перекрываемые входы и выходы, молочный блок, при двухрядном и более расположении стойл доильные установки расположены по обе стороны помещения в доильных залах, при этом ограничители доильных установок установлены с возможностью возвратно-поступательного перемещения по направляющим с поочередной фиксацией в крайних положениях в зависимости от направления движения коров, причем длина перемещения составляет 1,2...1,4 м. Ограничители выполнены в ... 2267897 Высевающий аппарат ... над семяпроводом. Поверхности ведущего, обводного и натяжного барабанов армированы фрикционным материалом. Аппарат обеспечит равномерный однозерновой вынос семян из семенного ящика и их подачу в семяпровод. 4 з.п. ф-лы, 1 ил. Изобретение относится к сельскохозяйственному машиностроению, в частности к высевающим аппаратам для однозернового высева. Известен высевающий аппарат, включающий горизонтально расположенный ячеистый диск с отражателем семян, в котором с целью уменьшения повреждения семян при высеве отражатель семян выполнен в виде цилиндрической щетки с осью вращения, перпендикулярной оси вращения диска, закрытой в нерабочей зоне кожухом, с целью привода щетки во ... |
Еще из этого раздела: 2218755 Способ длительного клонирования пайзы (echinochloa frumentacea link) 2007081 Способ биологической борьбы с вредителями капусты 2460269 Малогабаритный картофелеуборочный комбайн 2088063 Широкозахватный сельскохозяйственный агрегат 2216923 Способ выращивания льна-долгунца 2227965 Способ возделывания бахчевых культур и устройство для его осуществления 2464769 Машина для прессования тюков с вязальным устройством 2094986 Гербицидный состав 2075933 Композиция для иммунизации растений от различных фитопатогенов 2080765 Комбайн для уборки овощей |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
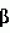 -оксибутирата. Штамм образует споры, положительно окрашивается по Граму. Рост в жидкой и полужидкой питательной среде микроаэрофильный, метаболизм дыхательный.
-оксибутирата. Штамм образует споры, положительно окрашивается по Граму. Рост в жидкой и полужидкой питательной среде микроаэрофильный, метаболизм дыхательный.