Оптически активный гербицидный n-метил-n-2-фторфениламид (r)-феноксипропионовой кислоты, способ борьбы с куриным просом и гербицидная композицияПатент на изобретение №: 2264392 Автор: КИМ Дае Вханг (KR), ЧАНГ Хае Сунг (KR), КО Янг Кван (KR), РИУ Дзае Воок (KR), ВОО Дзае Чун (KR), КОО Донг Ван (KR), КИМ Дзин Сеог (KR), ЧУНГ Бонг-Дзин (KR), КВОН Ох-Йеон (KR) Патентообладатель: ДОНГБУ ХАННОНГ КЕМИКАЛ КО., ЛТД. (KR) Дата публикации: 10 Апреля, 2005 Начало действия патента: 1 Ноября, 2001 Адрес для переписки: 129010, Москва, ул. Б.Спасская, 25, стр.3, ООО "Юридическая фирма Городисский и Партнеры", пат.пов. Е.Е.Назиной Описывается N-метил-N-2-фторфениламид (R)-феноксипропионовой кислоты формулы Описывается также способ борьбы с куриным просом, произрастающим при культивировании риса, который включает применение эффективного количества соединения формулы (1) и гербицидная композиция на основе соединения формулы (1). Технический результат - соединение формулы (1) обладает стабильностью в отношении риса и предотвращает произрастание куриного проса. 3 н.п. ф-лы, 5 табл. Настоящее изобретение относится к оптически активным гербицидным N-метил-N-2-фторфениламидным производным (R)-феноксипропионовой кислоты, представленным следующей формулой (I), способу их получения, их использованию для предупреждения прорастания куриного проса в рисе и использованию композиции в качестве подходящих гербицидов где Х представляет собой водород, галоген, гидрокси, NH2, CO2H, С1-С6-алкиламино, замещенный 1 или 2 С1-С3-алкилами, С 1-С6-алкил, С1-С6-алкокси, С1-С3-галогеналкил, С1-С 3-галогеналкокси, С2-С4-алкоксиалкокси, С1-С4-алкилтионил, С1-С 4-алкилсульфонил, С2-С6-алкенил, С2-С6-алкинил, С2-С6 -алкенилокси, С2-С6-алкинилокси, С 1-С3-алкоксикарбонил или С1-С 3-алкилкарбонил; Y представляет собой водород или фтор; и n равно целому числу от 0 до 2, где Х может быть комбинацией разных заместителей, когда n равно 2. [Предпосылки создания изобретения] В патенте США № 4130413 описаны соединения, представленные следующей формулой (2): где (R1)m представляет собой водород, галоген, CF3, NO2, CN или алкил; А представляет собой О, S или NH; R2 представляет собой водород или алкил; Z представляет собой В патенте США № 4531969 описаны соединения, представленные следующей формулой (3) где R5 представляет собой R7 представляет собой водород или алкил; и Z представляет собой В патенте США № 5254527 описаны соединения, представленные следующей формулой (4), где R5 представляет собой Z представляет собой Хотя некоторые соединения формулы (1) настоящего изобретения описаны в вышеуказанных патентах, ни в одном патенте не описывается синтез соединения формулы (1) и не были испытаны те же соединения на их гербицидную активность. В публикации патента Японии 2-11580 описано соединение, представленное формулой (5) где L представляет собой низший алкил, галоген, метокси, метоксифенокси, бензилокси, метилтио или метилвинил и n равно целому числу 0-2. В публикации патентов Японии sho 53-40767 и sho 54-112828 также описано, что амидные производные феноксипропионовой кислоты обладают гербицидной активностью. Кроме того, авторы настоящего изобретения описывают гербицидные N-алкил-N-2-фторфениламидные производные феноксипропионовой кислоты в Международной публикации патента № WO 2000/05956. Хотя многие из гербицидов для риса были недавно разработаны и использованы, куриное просо среди сорняков является самой большой проблемой в культуре риса. Разработка гербицидов для борьбы с куриным просом является настоятельной проблемой, которая существует в области сельского хозяйства и требующей срочного решения. После высадки молодого риса гербициды, разработанные до сих пор, не могут эффективно подавлять произрастание куриного проса, так что оно наносит большой вред урожаю. Сообщалось, что урожай риса снижается на 2%, когда куриное просо произрастает 1 неделю на площади 1 м2, приблизительно на 10%, когда просо произрастает 5 недель на 1 м2, приблизительно на 19%, когда просо произрастает 10 недель на 1 м2 и приблизительно на 35%, когда просо произрастает 20 недель на 1 м2. Для цели борьбы с куриным просом, которое наносит вред урожаю риса в количественном отношении, использовали много различных типов гербицидов. Однако до сих пор остается потребность в гербициде с более широким спектром гербицидной активности, со свойствами, не агрессивными (благотворными) в отношении окружающей среды, и эффективном по стоимости. Авторы данного изобретения провели интенсивное исследование для получения гербицидов для эффективной борьбы с куриным просом и, особенно, для обнаружения селективной гербицидной активности N-алкил-N-2-фторфениламидных производных феноксипропионовой кислоты формулы (6). В результате авторы изобретения завершили создание данного изобретения, обнаружив, что некоторые N-алкил-N-2-фторфениламиды феноксипропионовой кислоты формулы (6) существуют в виде (R)- или (S)-стереоизомера, и (R)-стереоизомеры обеспечивают более высокую стабильность (не являются активными) в отношении риса и лучшую гербицидную активность по сравнению с (S)-стереоизомерами или их смесями. Превосходная активность (R)-стереоизомеров отличает данное изобретение от других. Следовательно, целью настоящего изобретения является создание оптически активных гербицидных соединений, которые проявляют превосходную селективность в отношении риса и предотвращают рост вредного куриного проса. [Описание изобретения] Настоящим изобретением является создание оптически активных гербицидных N-метил-N-2-фторфениламидов феноксипропионовой кислоты формулы (1) с превосходной гербицидной активностью, а также значительной стабильностью (неактивностью) в отношении риса, где Х представляет собой водород, галоген, гидрокси, NH 2, CO2H, С1-С6-алкиламино, замещенный 1 или 2 С1-С3-алкилами, С 1-С6-алкил, С1-С6-алкокси, С1-С3-галогеналкил, С1-С 3-галогеналкокси, С2-С4-алкоксиалкокси, С1-С4-алкилтионил, С1-С 4-алкилсульфонил, С2-С6-алкенил, С2-С6-алкинил, С2-С6 -алкенилокси, С2-С6-алкинилокси, С 1-С3-алкоксикарбонил или С1-С 3-алкилкарбонил; Y представляет собой водород или фтор и n равно целому числу 0-2, где Х может быть комбинацией разных заместителей, когда n равно 2. Оптически активные соединения формулы (1) по настоящему изобретению могут быть определены, как показано в следующей таблице 1. Таблица 1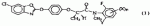 RY XCH3 HH CH2CH3 HHCH 3H4-F CH3 H3-FCH 3H5-F CH3 H4-ClCH 3H4-F, 5-F CH3 H4-BrCH 3H4-CH 3CH3 H4-SCH 3CH3 H4-CH 2CH3 CH3H 4-пропилCH3 H4-изопропил CH3 H4-бутил CH3H 4-изобутилCH3 H4-CO 2CH3 CH3H 4-OCH3R YX CH3H 4-OC2Н5 CH3 H4-О-изопропил CH3H 4-О-аллилCH3 H4-О-пропил CH3 FHCH 3F3-F CH3 F4-FCH 2CH3F 4-FCH3 F4-Cl CH3F 4-BrCH3 F4-CH3 CH3 F4-CH 2CH3 CH3F 4-пропилCH3 F4-изопропил CH3 F4-циклопропил CH3F 4-бутилCH3 F4-изобутил CH3 F4-OCH3 CH3 F4-OC2Н 5CH3 F4-О-изопропил CH3 F4-О-пропил CH3F 3-F, 5-FCH3 H5-F CH3 H5-ClCH 3H5-Br CH3 H5-CH3 CH3 H5-SCH3 CH3 H5-CH2CH 3CH3 H5-пропил CH3 H5-изопропил CH3H 5-циклопропилCH 3H5-бутил CH3 H5-изобутил RYX CH3 H5-OCH3 CH3 H4-OC2Н 5CH3 H5-О-изопропил CH3 H5-О-пропил CH3H 5-О-аллилCH3 F5-H CH3 F5-FCH 3F5-Cl CH3 F5-BrCH 3F5-CH 3CH3 F5-CH 2CH3 CH3F 5-пропилCH3 F5-изопропил CH3 F5-циклопропил CH3F 5-н-бутилCH3 F5-изобутил CH3 F5-OCH3 CH3 F5-OC2Н 5CH3 F5-О-изопропил CH3 F5-О-пропил RY XCH3 HH CH2CH3 HHCH 3H4-F CH3 H3-FCH 3H5-F CH3 H4-ClCH 3H4-F, 5-F CH3 H4-BrCH 3H4-CH 3CH3 H4-SCH 3CH3 H4-CH 2CH3 CH3H 4-пропилCH3 H4-изопропил CH3 H4-бутил CH3H 4-изобутилCH3 H4-CO 2CH3 CH3H 4-OCH3R YX CH3H 4-OC2Н5 CH3 H4-О-изопропил CH3H 4-О-аллилCH3 H4-О-пропил CH3 FHCH 3F3-F CH3 F4-FCH 2CH3F 4-FCH3 F4-Cl CH3F 4-BrCH3 F4-CH3 CH3 F4-CH 2CH3 CH3F 4-пропилCH3 F4-изопропил CH3 F4-циклопропил CH3F 4-бутилCH3 F4-изобутил CH3 F4-OCH3 CH3 F4-OC2Н 5CH3 F4-О-изопропил CH3 F4-О-пропил CH3F 3-F, 5-FCH3 H5-F CH3 H5-ClCH 3H5-Br CH3 H5-CH3 CH3 H5-SCH3 CH3 H5-CH2CH 3CH3 H5-пропил CH3 H5-изопропил CH3H 5-циклопропилCH 3H5-бутил CH3 H5-изобутил RYX CH3 H5-OCH3 CH3 H4-OC2Н 5CH3 H5-О-изопропил CH3 H5-О-пропил CH3H 5-О-аллилCH3 F5-H CH3 F5-FCH 3F5-Cl CH3 F5-BrCH 3F5-CH 3CH3 F5-CH 2CH3 CH3F 5-пропилCH3 F5-изопропил CH3 F5-циклопропил CH3F 5-н-бутилCH3 F5-изобутил CH3 F5-OCH3 CH3 F5-OC2Н 5CH3 F5-О-изопропил CH3 F5-О-пропил Оптически активные соединения формулы (1) по данному изобретению могут быть синтезированы с использованием обычного способа, представленного в следующей ниже схеме 1, путем взаимодействия соединения формулы (7) с соединением формулы (8), Схема 1 где Х' представляет собой ОН, Cl, Br или фенокси; Х представляет собой водород, галоген, гидрокси, NH2 , CO2H, С1-С6-алкиламино, замещенный 1 или 2 С1-С3-алкилами, С1-С 6-алкил, С1-С6-алкокси, С 1-С3-галогеналкил, С1-С3 -галогеналкокси, С2-С4-алкоксиалкокси, С1-С4-алкилтионил, С1-С 4-алкилсульфонил, С2-С6-алкенил, С2-С6-алкинил, С2-С6 -алкенилокси, С2-С6-алкинилокси, С 1-С3-алкоксикарбонил или С1-С 3-алкилкарбонил; Y представляет собой водород или фтор и n равно целому числу 0-2, где Х может быть комбинацией разных заместителей, когда n равно 2. Способ по схеме 1 проводят, предпочтительно, с использованием связующего агента, такого как трифенилфосфин, и органического основания, такого как триэтиламин или пиридин, при температуре от 0 до 100°С в инертном растворителе, таком как простые эфиры, подобные тетрагидрофурану, диэтилацетат, ацетонитрил, толуол, ксилол, гексан, метиленхлорид, тетрахлорид углерода, дихлорэтан или тому подобное. После выпаривания растворителя сырой продукт очищают колоночной хроматографией. Другим способом получения соединений (1), представленным в следующей ниже схеме 2, является алкилирование соединения формулы (9) соединением формулы (10), Схема 2 где Х" представляет собой Cl, Br, I, бензолсульфонилокси, толуолсульфонилокси, метансульфонилокси или низший алкилсульфат и Х представляет собой водород, галоген, гидрокси, NH2 , CO2H, С1-С6-алкиламино, замещенный 1 или 2 С1-С3-алкилами, С1-С 6-алкил, С1-С6-алкокси, С 1-С3-галогеналкил, С1-С3 -галогеналкокси, С2-С4-алкоксиалкокси, С1-С4-алкилтионил, С1-С 4-алкилсульфонил, С2-С6-алкенил, С2-С6-алкинил, С2-С6 -алкенилокси, С2-С6-алкинилокси, С 1-С3-алкоксикарбонил или С1-С 3-алкилкарбонил; Y представляет собой водород или фтор и n равно целому числу от 0 до 2, где Х может быть комбинацией разных заместителей, когда n равно 2. Способ по схеме 2 проводят, предпочтительно, с использованием сильного основания, которое достаточно для отщепления водорода от амида, NH. Примеры сильного основания включают NaOH, KOH, LiOH, NaH, н-BuLi, LDA и тому подобное. Реакцию проводят при температуре от -78 до 50°С в инертном растворителе, таком как простые эфиры, подобные этиловому эфиру, диоксану или тетрагидрофурану, или углеводороды, подобные гексану. Другим способом получения соединений (1), представленным в следующей схеме 3, является взаимодействие соединения формулы (11) с соединением формулы (12) в присутствии основания, Схема 3 где Y' представляет собой галоген, алкилсульфонилокси, галогеналкилсульфонилокси, бензолсульфонилокси или толуолсульфонилокси; Х представляет собой водород, галоген, гидрокси, NH2 , CO2H, С1-С6-алкиламино, замещенный 1 или 2 С1-С3-алкилами, С1-С 6-алкил, С1-С6-алкокси, С 1-С3-галогеналкил, С1-С3 -галогеналкокси, С2-С4-алкоксиалкокси, С1-С4-алкилтионил, С1-С 4-алкилсульфонил, С2-С6-алкенил, С2-С6-алкинил, С2-С6 -алкенилокси, С2-С6-алкинилокси, С 1-С3-алкоксикарбонил или С1-С 3-алкилкарбонил; Y представляет собой водород или фтор и n равно целому числу от 0 до 2, где Х может быть комбинацией разных заместителей, когда n равно 2. На схеме 3 примеры основания включают неорганические основания типа гидроксидов щелочных металлов, таких как гидроксид натрия и гидроксид калия, карбонатов щелочных металлов, таких как карбонат натрия и карбонат калия, гидрокарбонатов щелочных металлов, таких как гидрокарбонат натрия и гидрокарбонат калия, и органические основания, такие как триэтиламин, N,N-диметиланилин, пиридин и 1,8-диазабицикло[5,4,0]ундец-7-ен. Для быстрого завершения реакции, если необходимо, может быть добавлен катализатор фазового переноса, такой как бромид тетра-н-бутиламмония или 18-краун-6-[1,4,7,10,13,16-гексаоктациклооктадекан]. Кроме того, если считают необходимым, могут быть использованы один или более чем два растворителя. Примеры инертного органического растворителя включают кетоны, такие как ацетон; ароматические углеводороды, такие как толуол, ксилол и хлорбензол; алифатические углеводороды, такие как петролейный эфир и лигроин; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; нитрилы, такие как ацетонитрил и пропионитрил, и амиды, такие как N,N-диметилформамид, N,N-диметилацетамид, и N-метилпирролидон. Взаимодействие проводят при температуре от 0°С до температуры кипения с обратным растворителем, предпочтительно, при температуре 5-50°С, в течение 1-24 часов для получения требуемого продукта с высоким выходом. Другим способом получения оптически активного соединения (1), представленным в следующей схеме 4, является взаимодействие соединения формулы (13) с соединением формулы (14) в присутствии основания, где Y' представляет собой галоген, алкилсульфонилокси, галогеналкилсульфонилокси, бензолсульфонилокси или толуолсульфонилокси; Х представляет собой водород, галоген, гидрокси, NH2 , CO2H, С1-С6-алкиламино, замещенный 1 или 2 С1-С3-алкилами, С1-С 6-алкил, С1-С6-алкокси, С 1-С3-галогеналкил, С1-С3 -галогеналкокси, С2-С4-алкоксиалкокси, С1-С4-алкилтионил, С1-С 4-алкилсульфонил, С2-С6-алкенил, С2-С6-алкинил, С2-С6 -алкенилокси, С2-С6-алкинилокси, С 1-С3-алкоксикарбонил или С1-С 3-алкилкарбонил; Y представляет собой водород или фтор и n равно целому числу от 0 до 2, где Х может быть комбинацией разных заместителей, когда n равно 2. В схеме 4 примеры основания включают неорганические основания типа гидроксидов щелочных металлов, таких как гидроксид натрия и гидроксид калия, карбонатов щелочных металлов, таких как карбонат натрия и карбонат калия, гидрокарбонатов щелочных металлов, таких как гидрокарбонат натрия и гидрокарбонат калия; и органические основания, такие как триэтиламин, N,N-диметиланилин, пиридин, пиколин, хинолин и 1,8-диазабицикло[5,4,0]ундец-7-ен. Если необходимо, может быть использован катализатор фазового переноса, такой как бромид тетра-н-бутиламмония или 18-краун-6-[1,4,7,10,13,16-гексаоктациклооктадекан]. Кроме того, если считают необходимым, может быть использован более чем один растворитель. Примеры инертного органического растворителя включают кетоны, такие как ацетон и бутанон; ароматические углеводороды, такие как бензол, толуол, ксилол и хлорбензол; алифатические углеводороды, такие как петролейный эфир и лигроин; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; нитрилы, такие как ацетонитрил или пропионитрил, и амиды, такие как N,N-диметилформамид, N,N-диметилацетамид, и N-метилпирролидон. Взаимодействие проводят при температуре от 0°С до температуры кипения с обратным растворителем, предпочтительно, при 20-100°С, в течение 1-24 часов для получения требуемого продукта с высоким выходом. Настоящее изобретение будет далее иллюстрировано следующими ниже примерами. Однако они не должны быть истолкованы как ограничение данного изобретения, определяемого прилагаемой формулой изобретения. [Примеры] Пример 1: Получение N-(2-фторфенил)-N-метиламида (S)-2-бромпропионовой кислоты (S)-2-Бромпропионовую кислоту (3,4 г, 0,022 моль) и 2-фторанилин (3 г, 0,024 моль) растворяют в 50 мл хлороформа и охлаждают до 0°С. Дициклогексилкарбодиимид (5 г, 0,024 моль), растворенный в 10 мл хлороформа, медленно вводят через шприц. Температуру реакционной смеси повышают до комнатной температуры и реакционную смесь перемешивают в течение 1 часа. Твердое вещество, оставшееся в результате реакции, фильтруют и промывают дважды 20 мл хлороформа. Фильтрат концентрируют при пониженном давлении и сырой продукт очищают колоночной хроматографией (элюент: этилацетат/н-гексан, 1/3), получая при этом 5 г требуемого продукта. 1 Н ЯМР (CDCl3): Пример 2: Получение N-(2-фторфенил)-N-метиламида (R)-2-(4-гидроксифенокси)пропионовой кислоты N-(2-Фторфенил)-N-метиламид (S)-2-бромпропионовой кислоты (18,2 г, 0,07 моль), гидрохинон (7 г, 0,064 моль), карбонат калия (10,54 г, 0,076 моль) и бромид тетра-н-бутиламмония (1 г) растворяют в 350 мл ацетонитрила и нагревают при кипячении с обратным холодильником в течение 6 часов. Реакционную смесь охлаждают до комнатной температуры и твердое вещество, оставшееся в результате реакции, фильтруют. Фильтрат концентрируют при пониженном давлении и сырой продукт очищают колоночной хроматографией (элюент: этилацетат/н-гексан, 1/2), получая при этом 16 г требуемого продукта. 1 Н ЯМР (CDCl3): Пример 3: Получение N-(2-фторфенил)-N-метиламида (R)-2-[4-(6-хлор-2-бенэоксаэолилокси)фенокси]пропионовой кислоты N-(2-Фторфенил)-N-метиламид (R)-2-(4-гицроксифенокси)пропионовой кислоты (11/5 г, 0,04 моль), 2,6-дихлорбензоксазол (6,85 г, 0,036 моль), карбонат калия (6 г, 0,043 моль) и бромид тетра-н-бутиламмония (1 г) растворяют в 300 мл ацетонитрила и нагревают при кипячении с обратным холодильником в течение 7 часов. Реакционную смесь охлаждают до комнатной температуры и твердое вещество, оставшееся в результате реакции, фильтруют. Фильтрат концентрируют при пониженном давлении и сырой продукт очищают колоночной хроматографией (элюент: этилацетат/н-гексан, 1/3), получая при этом 12,5 г требуемого продукта. 1H ЯМР (CDCl3): [a]D 22=-22° (с, 1,0 хлороформ) Пример 4: Получение N-(2-фторфенил)-N-метиламида (R)-2-[4-(6-хлор-2-бенэоксаэолилокси)фенокси]пропионовой кислоты (R)-2-[4-(6-Хлор-2-бензоксазолилокси)фенокси]пропионовую кислоту (346,7 мг, 1 ммоль) растворяют в 10 мл тетрагидрофурана. Последовательно добавляют 2-фторанилин (111,12 мг, 1 ммоль), трифенилфосфин (393,4 мг, 1,5 ммоль), триэтиламин (0,15 мл, 1 ммоль) и четыреххлористый углерод (1 мл) и смесь нагревают при кипячении с обратным холодильником в течение 8 часов. Реакционную смесь охлаждают до комнатной температуры и подкисляют 5% хлористоводородной кислотой с последующим добавлением воды. Подкисленную реакционную смесь экстрагируют трижды этилацетатом. Объединенный органический слой сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении. Сырой продукт очищают колоночной хроматографией (элюент: этилацетат/н-гексан, 1/4), получая при этом 200 мг требуемого продукта. Т. пл.: 132-136°С 1Н ЯМР (CDCl3): Пример 5: Получение N-(2-фторфенил)-N-метиламида (R)-2-[4-(6-хлор-2-бензоксазолилокси)фенокси]пропионовой кислоты N-(2-Фторфенил)амид (R)-2-[4-(6-хлор-2-бензоксазолилокси)фенокси]пропионовой кислоты (100 мг, 0,24 ммоль) растворяют в 10 мл безводного тетрагидрофурана и последовательно при 00С добавляют 60% NaH (10 мг, 0,24 ммоль) и CH3I (34 мг, 0,24 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5 часов. Реакционную смесь выливают в ледяную воду и ее экстрагируют трижды этилацетатом. Объединенный слой органического растворителя сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Сырой продукт очищают колоночной хроматографией (элюент: этилацетат/н-гексан, 1/2), получая при этом 75 мг требуемого продукта. 1Н ЯМР (CDCl3): Пример 6: Получение N-(2-фторфенил)-N-метиламида (R)-2-[4-(6-хлор-2-бензоксазолилокси)фенокси]пропионовой кислоты (R)-2-[4-(6-Хлор-2-бензоксазолилокси)фенокси]пропионовую кислоту (346,7 мг, 1 ммоль) растворяют в 10 мл тетрагидрофурана и последовательно добавляют N-метил-2-фторанилин (125 мг, 1 ммоль), трифенилфосфин (393,4 мг, 15 ммоль), триэтиламин (0,15 мл, 1 ммоль) и четыреххлористый углерод (1 мл), и реакционную смесь нагревают при кипячения с обратным холодильником в течение 12 часов. Реакционную смесь охлаждают до комнатной температуры и подкисляют 5% хлористоводородной кислотой с последующим добавлением воды. Подкисленную реакционную смесь экстрагируют трижды этилацетатом. Объединенный слой органического растворителя сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении. Сырой продукт очищают колоночной хроматографией (элюент: этилацетат/н-гексан, 1/2), получая при этом 100 мг требуемого продукта. Пример 7: Получение N-метил-N-(2,4,5-трифторфенил)амида (R)-2-[4-(6-хлор-2-бензоксазолилокси)фенокси]пропионовой кислоты (R)-2-[4-(6-Хлор-2-бензоксазолилокси)фенокси]пропионовую кислоту (0,693 г, 2 ммоль) растворяют в 15 мл тетрагидрофурана и последовательно добавляют N-метил-2,4,5-трифторанилин (0,322 г, 2 ммоль), трифенилфосфин (0,78 г, 2 ммоль), триэтиламин (0,4 мл) и четыреххлористый углерод (2 мл) и затем реакционную смесь нагревают при кипячении с обратным холодильником в течение 18 часов. Реакционную смесь охлаждают до комнатной температуры и подкисляют 5% хлористоводородной кислотой. Подкисленную реакционную смесь экстрагируют трижды этилацетатом. Объединенный слой органического растворителя сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении. Сырой продукт очищают колоночной хроматографией (элюент: этилацетат/н-гексан, 1/2), получая при этом 250 мг требуемого продукта. 1Н ЯМР (CDCl3): Пример 8: Получение N-метил-N-(2,6-дифторфенил)амида (R)-2-[4-(6-хлор-2-бензоксазолилокси)фенокси]пропионовой кислоты (R)-2-[4-(6-Хлор-2-бензоксазолилокси)фенокси]пропионовую кислоту (0,693 г, 2 ммоль) и N-метил-2,6-дифторанилин (0,284 г, 2 ммоль) растворяют в 20 мл тетрагидрофурана и последовательно добавляют трифенилфосфин (0,78 г, 2 ммоль), триэтиламин (0,42 мл) и четыреххлористый углерод (2 мл). Реакционную смесь нагревают при кипячении с обратным холодильником в течение 16 часов. Реакционную смесь охлаждают до комнатной температуры и подкисляют 5% хлористоводородной кислотой. Подкисленную реакционную смесь экстрагируют трижды этилацетатом. Объединенный слой органического растворителя сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении. Сырой продукт очищают колоночной хроматографией (элюент: этилацетат/н-гексан, 1/2), получая при этом 205 мг требуемого продукта. 1Н ЯМР (CDCl3): Пример 9: Получение N-(2,4-дифторфенил)-N-метиламида (R)-2-[4-(6-хлор-2-бензоксазолилокси)фенокси]пропионовой кислоты (R)-2-[4-(6-Хлор-2-бензоксазолилокси)фенокси]пропионовую кислоту (0,693 г, 2 ммоль) растворяют в 15 мл тетрагидрофурана и последовательно добавляют N-метил-2,4-дифторанилин (0,284 г, 2 ммоль), трифенилфосфин (0,78 г, 2 ммоль), триэтиламин (0,42 мл) и четыреххлористый углерод (2 мл). Реакционную смесь нагревают при кипячении с обратным холодильником в течение 12 часов. Реакционную смесь охлаждают до комнатной температуры и подкисляют 5% хлористоводородной кислотой с последующим добавлением воды. Подкисленную реакционную смесь экстрагируют трижды этилацетатом. Объединенный слой органического растворителя сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении. Сырой продукт очищают колоночной хроматографией (элюент: этилацетат/н-гексан, 1/2), получая при этом 230 мг требуемого продукта. 1Н ЯМР (CDCl3): Пример 10: Получение N-метил-N-(2,3,6-трифторфенил)амида (R)-2-[4-(6-хлор-2-бензоксазолилокси)фенокси]пропионовой кислоты (R)-2-[4-(6-Хлор-2-бензоксазолилокси)фенокси]пропионовую кислоту (0,693 г, 2 ммоль) добавляют к 6 мл тионилхлорида и реакционную смесь нагревают при кипячении с обратным холодильником в течение 2 часов. Избыток тионилхлорида удаляют при пониженном давлении и к остатку добавляют 3 мл безводного тетрагидрофурана. К реакционной смеси при 0°С медленно добавляют раствор N-метил-2,3,6-трифторанилина (0,32 г, 2 ммоль) и триэтиламин (0,42 мл) в безводном тетрагидрофуране (10 мл). Смесь перемешивают при 0°С в течение 30 минут и перемешивают при комнатной температуре в течение дополнительного 1 часа. После вливания воды реакционную смесь экстрагируют трижды этилацетатом. Объединенный слой органического растворителя сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении. Сырой продукт очищают колоночной хроматографией (элюент: этилацетат/н-гексан, 1/2), получая при этом 240 мг требуемого продукта. 1Н ЯМР (CDCl3): Примеры 11-16 Соединения, представленные в следующей таблице 2, получали по такой же методике, что и в примере 10, за исключением использования производных анилина вместо N-метил-2,3,6-трифторанилина. Таблица 2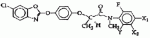 Определение X1X 21H-ЯМР(CDCl 3)Пример 11HCH 31,42(3H,т), 2,3(3H,с),3,25(3H,с),4,62(1H,м),6,8-7,4(10H,м) Пример 12 ClH1,42(3H,т),3,3(3H,с),4,62(1H,м),6,7-7,5(10H,м) Пример 13 HF1,42(3H,т),3,3(3H,с),4,62(1H,м),6,5-7,4(10H,м) Пример 14 CH3H 1,42(3H,т),2,38(3H,с),3,25(3H,с),4,62(1H,м),6,8- 7,4(10H,м) Пример 15OCH 3H1,42(3H,т),3,25(3H,с),3,8(3H,с),4,65(1H,м),6,65- 7,45(10H,м)Пример 16 OCH2CH3 H1,25(3H,т),1,42(3H,т),3,25(3H,с),4,0(2H,кв), 4,62(1H,м),6,65-7,42(10H,м) Определение X1X 21H-ЯМР(CDCl 3)Пример 11HCH 31,42(3H,т), 2,3(3H,с),3,25(3H,с),4,62(1H,м),6,8-7,4(10H,м) Пример 12 ClH1,42(3H,т),3,3(3H,с),4,62(1H,м),6,7-7,5(10H,м) Пример 13 HF1,42(3H,т),3,3(3H,с),4,62(1H,м),6,5-7,4(10H,м) Пример 14 CH3H 1,42(3H,т),2,38(3H,с),3,25(3H,с),4,62(1H,м),6,8- 7,4(10H,м) Пример 15OCH 3H1,42(3H,т),3,25(3H,с),3,8(3H,с),4,65(1H,м),6,65- 7,45(10H,м)Пример 16 OCH2CH3 H1,25(3H,т),1,42(3H,т),3,25(3H,с),4,0(2H,кв), 4,62(1H,м),6,65-7,42(10H,м) Композиция Чтобы использовать соединения по настоящему изобретению в качестве гербицидов, они должны быть изготовлены в виде такого подходящего типа состава, как смачиваемый порошок, эмульсии, гранулы, дусты, суспензии и растворы, смешиванием с носителем, поверхностно-активным веществом, диспергирующим агентом или дополнительным агентом. Многие из них можно наносить непосредственно или после разбавления подходящей средой. Композиции могут быть получены при объеме разбрызгивания от сотен литров до тысяч литров на гектар. Композиции содержат приблизительно 0,1 масс.%-99 масс.% активного ингредиента(ов) и рекомендуется добавление 0,1%-20% поверхностно-активного вещества(веществ) или 0%-99,9% твердого или жидкого разбавителя(ей). Композиции содержат эти ингредиенты в следующих приблизительных пропорциях, показанных в таблице 3. Таблица 3 КомпозицииМасс.% Активный ингредиентРазбавитель Поверхностно-активное вещество Смачиваемый порошок 10-900-741-10 Суспензия3-50 40-950-15 Эмульсияраствор 3-5040-950-15 Гранулы0,1-95 5-99,91-15Пропорция активных ингредиентов зависит от предназначения использования. Иногда желательно более высокое соотношение поверхностно-активного вещества к активным ингредиентам, и это достигается включением его в композицию или танк для смешивания. Твердые разбавители с высокой абсорбцией являются предпочтительными для смачиваемого порошка. Предпочтительными являются жидкие разбавители и растворители, которые стабильны против разделения фаз при 00С. Все композиции могут содержать небольшое количество добавок для предотвращения формования, слеживания, коррозии и роста микроорганизмов. В соответствии с общепринятыми способами получения композиции, растворы могут быть получены только смешиванием ингредиентов, а мелкоизмельченные твердые вещества смешиванием и измельчением молотковой мельницей. Суспензии могут быть изготовлены влажным размолом и гранулы могут быть изготовлены распылением (разбрызгиванием) активных ингредиентов на предварительно приготовленный гранулированный носитель. Примеры получения типичных композиций являются следующими. Композиция 1: Смачиваемый порошок Ингредиенты тщательно смешивают, снова смешивают после разбрызгивания жидкого поверхностно-активного вещества на твердые ингредиенты и размалывают на молотковой мельнице до тех пор, пока твердые компоненты не достигнут размера ниже 100 мкм. Активный ингредиент (соединение примера 3) 20 масс.%Эфир додецилфенола и полиэтиленгликоля2 масс.% Лигнинсульфонат натрия 4 масс.%Алюминат натрия и кремния 6 масс.% Монтмориллонит68 масс.%Композиция 2: смачиваемый порошок Ингредиенты смешивают, размалывают молотковой мельницей до тех пор, пока все твердые компоненты не достигнут размера менее 25 мкм, и упаковывают. Активный ингредиент (соединение примера 3) 80 масс.%Алкилнафталинсульфонат натрия2 масс.% Лигнинсульфонат натрия2 масс.% Синтетический аморфный диоксид кремния 3 масс.%Каолинит 13 масс.%Композиция 3: Эмульсия Ингредиенты смешивают и гомогенно растворяют с получением эмульсий. Активный ингредиент (соединение примера 3) 30 масс.%Циклогексанон 20 масс.% Полиоксиэтиленаралкиловый эфир11 масс.% Алкилбензолсульфонат кальция 4 масс.%Метилнафталин 35 масс.%Композиция 4: Гранулы Ингредиенты тщательно перемешивают. 20 масс. частей воды добавляют к 100 масс. частям смеси ингредиентов. Смесь ингредиентов гранулируют до размера 14-32 меш с использованием экструзионного гранулятора и сушат. Активный ингредиент (соединение примера 3) 5 масс.%Натриевая соль сульфонатного производноголаурилового спирта 2 масс.%Лигнинсульфонат натрия5 масс.% Карбоксиметилцеллюлоза2 масс.% Сульфат калия16 масс.% Пластер70 масс.%Композиции по данному изобретению наносят в разбавителе распылением до определенной концентрации. Полезность Соединения по настоящему изобретению обладают высокой активностью в качестве гербицидов для обработки листьев для защиты риса и являются особенно эффективными для риса вследствие превосходного подавления куриного проса. Активный ингредиент может быть использован в количестве от 10 г до 4 кг на гектар, предпочтительно от 50 г до 400 г. Количество соединений настоящего изобретения зависит от количества и размера сорняков и композиций. Гербициды настоящего изобретения могут быть использованы по отдельности или в комбинации с другими гербицидами, инсектицидами или бактерицидами. Особенно существенным является добавление агента, выбранного из группы, состоящей из бентазона, хинклорака, пропанила, симетрина, 2,4-D, феноксапроп-этила, линурона, МСРА, азафенидина, карфентразона, молината, тиобенкарба, пендиметалина, бенсульфон-метила, пиразосульфурон-этила, метсульфурон-метила, тибензсульфурон-метила, трибенурон-метила, трифлуралина, амидосульфурона, бромоксинила, бутахлора, мекопропа, метрибузина, бифенокса, бенфурезата, изопротурона, цигалофоп-бутила, мефенасета, фентразамида, пириминобак-метила, биспирибак натрия, азимсульфруона, циклосульфамурона, пианхора и их смесей. Гербицидное действие соединений настоящего изобретения испытывали в примерах, представленных ниже. Экспериментальный пример 1: Испытание на обработку листьев Семена риса, пшеницы, ячменя, кукурузы, хлопчатника, куриного проса, сорго обыкновенного, росички кровяной и проса раздвоенно-цветкового засевали в горшке с площадью поверхности 600 см2. Когда куриное просо, выращиваемое в теплице, в которой поддерживали 20-30°С, достигало размера в три листа, непосредственно на листья наносили смачиваемый порошок, полученный смешиванием 1 массовой части активного соединения, 5 массовых частей ацетона и 1 массовой части эмульгатора, и разбавленный водой, в количестве 2000 л на гектар. Концентрацию разбрызгиваемой жидкости выбирали такую, чтобы были достигнуты определенные количества активного соединения. Через 14 дней после обработки степень повреждения растений оценивали в % повреждения по сравнению с развитием необработанного контроля. 0%нет действия (такое же как у необработанного контроля 20%слабое действие 70%гербицидное действие 100%полное уничтожениеВ испытании активное соединение(я) формулы (I) по изобретению проявляет превосходную селективность по отношению к растениям и гербицидную активность против сорняков. Таблица 4 АббревиатураНаучное название Русское названиеORYSA Oryza sativa L. cv. DongjinРис ECHCGEchinochloa crus-galli Beauv. var. caudata KitagawaКуриное просоСреди соединений формулы (1) гербицидную активность N-(2-фторфенил)-N-метиламида (R)-2-[4-(6-хлор-2-бензоксазолилокси)фенокси]пропионовой кислоты (пример 3) сравнивали со (S)-стереоизомером и их рацемической смесью и результаты суммировали в таблице 5. Таблица 5 Количество для обработки листьев (г/га) (R)-соединениеR,S-рацемическое соединение(S)-соединение) Рис (4 листа)Куриное просо (4 листа)Рис (4 листа) Куриное просо (4 листа)Рис (4 листа) Куриное просо (4 листа) 400022,5100 3,81000,0 100200011,3 1000,0 1000,0100 10002,5 1000,0100 0,0100500 0,0100 0,01000,0 1002500,0 1000,0 1000,0100 1250,0 1000,0100 0,010063 0,0100 0,01000,0 100320,0 1000,0 1000,092,5 160,0 1000,0100 0,065,08 0,098,8 0,045,00,0 7,540,0 62,50,0 2,50,00,0 20,0 6,30,00,0 0,00,01 -- --- -(R)-соединение R,S-рацемическое соединение (S)-соединение [Промышленная пригодность] На основании описанного выше следует отметить, что оптически активные (R)-стереоизомеры настоящего изобретения проявляют превосходную селективность по отношению к рису и превосходящую гербицидную активность против куриного проса по сравнению с их рацемическими смесями и (S)-стереоизомерами. Следовательно, оптически активные соединения настоящего изобретения могут быть очень эффективными при возделывании риса. Кроме того, доказано, что оптически активные соединения являются очень стабильными (не активными) в отношении пшеницы, ячменя, бобовых культур и кукурузы и полезными для борьбы с сорняками. Формула изобретения1. Гербицидное соединение, N-метил-R-2-фторфениламид (R)-феноксипропионовой кислоты, обладающее стабильностью в отношении риса и предотвращающее произрастание куриного проса, имеющее формулу 2. Способ борьбы с куриным просом, произрастающим при культивировании риса, без нанесения какого-либо значительного вреда упомянутому рису, который включает применение эффективного количества N-метил-N-2-фторфениламид (R)-феноксипропионовой кислоты следующей формулы: 3. Гербицидная композиция, включающая, 0,1-99 мас.% N-метил-N-2-фторфениламида (R)-феноксипропионовой кислоты формулы 0,1-20 мас.% поверхностно-активного вещества и 0-99,9 мас.% разбавителя. Популярные патенты: 2086081 Рабочий орган культиватора ... с двусторонними лезвиями. При виде в плане (2,4,7-9) обе горизонтальные стороны по наружному контуру имеют форму трапеции CDEF и C"D"E"F" (фиг. 2,5), непараллельные стороны CD и FE которой склонены в сторону, противоположную вертикальной стороне 4 профиля (CF>DE), и снабжены лезвием 6 и 7. Вследствие этого с двух сторон каждой плоскорежущей лапы 3 и 5 образуется угол раствора (фиг. 2). Внутри каждой трапеции предусмотрен преимущественно треугольный вырез GHK или G"H"K", примыкающий одной стороной GK(G"K") к стойке 1. При наличии в составе рабочего органа двух [-образных профилей 2 последние оппозитно расположены относительно друг друга ( фиг.6) и вертикальными сторонами 4 ... 2102853 Питательное устройство для растений ... их сложность, обусловленная наличием полупроницаемой мембраны в нижней части корпуса, которая, к тому же может засоряться частицами почвы. Другой недостаток питательных устройств мембранного типа заключается в неудобстве их перезарядки активным веществом. Питатели подобного типа устанавливаются под поверхностью почвы, при этом их местоположение остается скрытым от глаз. Это затрудняет последующее извлечение питательного устройства из почвы для его новой подзарядки. Кроме того, в качестве активного вещества можно применять только химические соединения, имеющие осмотическое давление в интервале 80 - 350 атм. Основной задачей настоящего изобретения является упрощение и удешевление ... 2056755 Способ регулирования роста овощных культур ... листьев. П р и м е р 1. Растения салата сорта "Каменная головка" выращивали в теплице в вегетационных сосудах. В сосуды помещали до 12 кг почвы и вносили по 18 г комплексного минерального удобрения ("Нитрофоска") на один сосуд. В фазе интенсивного нарастания биомассы салата растения обрабатывали 0,05; 0,1; 0,5 и 1,0% -ными водными растворами препарата Сапфир (сконцентрированный и очищенный экстракт из отходов производства пива) до полного смачивания поверхности листьев. Контрольные растения обрабатывали тем же количеством воды. Через 7 сут после обработки снимали урожай салата (листья товарной спелости), отбирали среднюю пробу и определяли содержание нитратов в продукции. ... 2228588 Копатель корнеклубнеплодов ... которого расположен паз 4 под углом наклона к оси его вращения. Угол наклона определяется выражением где К - коэффициент пропорциональности плеч шатуна, о.е.;3 - перемещение лемеха в одну сторону, м;r - радиус барабана, м;е - эксцентриситет, м.Эксцентриковый цилиндрический кривошип 2 представляет собой цилиндр, внутри которого размещается эксцентриковый барабан 3. В месте прилива 12 эксцентрикового цилиндрического кривошипа 2 выполнено гнездовое отверстие 14 для размещения роликового толкателя 5. Прилив 12 оборудован разъемным соединением 8, например, выполненным в виде резьбового соединения, или соединения иного типа, прилива 12 с заглушкой, оборудованной ушком для ... 2477599 Жатка зерноуборочного комбайна ... торсиона 20 и закрепленных в отверстии 17 шплинтом 18, при этом свободный конец 22 пружинного пальца 19 опирается на полку соседней гребенки 12 транспортера 6, перекрывая пространство между гребенками 12, захватывают хлебную массу и направляют ее к центру жатки. При переходе с прямого участка транспортера 6 (фиг.3) гребенки 12 вместе с пружинными пальцами 19 и его концами 21 будут менять направление и вбрасывать хлебную массу к подающему битеру 7.При дальнейшем повороте гребенки 12 (фиг.3) уже конец 22 пружинного пальца 19 (фиг.2) будет поворачиваться, отходя от полки соседней гребенки 12 (фиг.3) и воздействовать на хлебную массу, вбрасывая ее к подающему битеру 7 с пальчиковым ... |
Еще из этого раздела: 2124820 Устройство для изменения объемного заряда в атмосфере 2053661 Устройство для сколачивания ульевых рамок 2235450 Малогабаритная машина для обескрыливания, очистки и сортирования лесных семян 2420058 Способ выращивания зеленных культур в интенсивной светокультуре 2490869 Способ направленного изменения циркуляции воздушных масс и связанных с ней погодных условий 2279799 Балансир рыболовный 2420940 Энергосберегающий способ обеззараживания семян люпина от антракноза 2415552 Питатель молотилки зерноуборочного комбайна 2028749 Капустоуборочная машина 2236124 Способ создания местообитания и адаптации молоди объектов аквакультуры в водных экосистемах |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
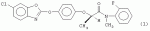 ,
,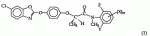 ,
,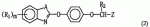 ,
,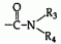 , где R3 и R4 могут быть одинаковыми или разными и представляют собой водород, С1-С6 -алкил, С1-С6-гидроксиалкил, С3 -С6-циклоалкил, С1-С4-алкокси или фенил, замещенный 1-3 заместителями, выбранными из С 1-С4-алкила, С1-С6-алкокси, галогена и CF3.
, где R3 и R4 могут быть одинаковыми или разными и представляют собой водород, С1-С6 -алкил, С1-С6-гидроксиалкил, С3 -С6-циклоалкил, С1-С4-алкокси или фенил, замещенный 1-3 заместителями, выбранными из С 1-С4-алкила, С1-С6-алкокси, галогена и CF3.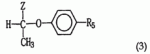 ,
,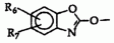 , где R6 представляет собой водород или галоген;
, где R6 представляет собой водород или галоген;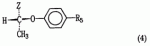
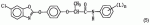
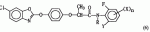
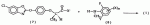 ,
,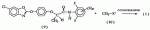 ,
,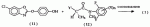 ,
,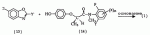 ,
, 1,7 (3Н, д), 3,24 (3Н, с), 4,16 (0,7 Н, кв), 4,34 (0,3 Н, кв), 7,13-7,48 (4Н, м).
1,7 (3Н, д), 3,24 (3Н, с), 4,16 (0,7 Н, кв), 4,34 (0,3 Н, кв), 7,13-7,48 (4Н, м).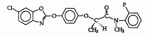
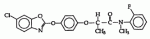
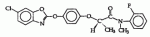
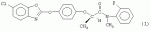 ,
,