Способ получения генетически модифицированных растений картофеля сорта елизавета с помощью agrobacterium tumefaciensПатент на изобретение №: 2231251 Автор: Стародубцева А.М. (RU), Скрябин К.Г. (RU) Патентообладатель: Центр "Биоинженерия" РАН (RU), Стародубцева Анастасия Михайловна (RU), Скрябин Константин Георгиевич (RU) Дата публикации: 27 Июня, 2004 Начало действия патента: 17 Июня, 2002 Адрес для переписки: 121165, Москва, Г-165, а/я 15, ООО "ППФ-ЮСТИС" Изображения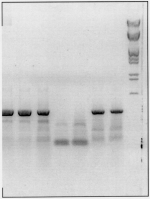    Изобретение относится к селекции и биотехнологии растений. Экспланты растений картофеля сорта “ЕЛИЗАВЕТА” сокультивируют с трансформированным штаммом A. tumefaciens, а затем помещают на питательную среду для инициации каллусообразования с последующей регенерацией из них фертильных трансгенных растений. Сокультивацию осуществляют контактированием эксплантов с фильтром, смоченным бактериальной суспензией, в течение 48  4 часа. Для инициации каллусообразования используют питательную среду, содержащую зеатин в количестве от 0,6 до 1,0 4 часа. Для инициации каллусообразования используют питательную среду, содержащую зеатин в количестве от 0,6 до 1,0 0,5 мг/л, БАП - от 0,6 до 1,0 0,5 мг/л, БАП - от 0,6 до 1,0 0,5 мг/л и НУК или ИУК - от 0,01 до 0,05 мг/л. На восьмой день экспланты помещают на среду для регенерации, содержащую зеатин в количестве от 0,5 до 3,5 мг/л и ГК3 в количестве от 0,01 до 0,05 мг/л. 4 з.п. ф-лы, 1 ил., 5 табл.
Изобретение относится к селекции и биотехнологии растений, в частности генной инженерии. Изобретение может быть использовано для получения генетически модифицированных растений картофеля сорта Елизавета, экспрессирующего различные гетерологичные гены.Способ получения трансгенных растений картофеля сорта Елизавета заключается в генетической трансформации сегментов стебля (эксплантов) in vitro культивируемых растений картофеля методом сокультивирования с Agrobacterium tumefaciens, несущей рекомбинантные плазмиды с селективными, маркерными и полезными генами, и в последующей регенерации до фертильных трансгенных растений, имеющих внесенные гены и сохраняющих все признаки исходного сорта.Картофель (Solanum tuberosum var. tuberosum) выращивается в России повсеместно, практически во всех климатических зонах. Относительно высокая продуктивность при известной простоте возделывания позволяет картофелю стабильно занимать второе место после злаковых культур в отечественном сельскохозяйственном производстве. Сегодня более 90% товарного картофеля производится в ЛПХ (личных подсобных хозяйствах), а для наименее обеспеченных слоев населения картофель находится на первом месте в рационе питания.Таким образом, проблема получения стабильного урожая картофеля является одной из важнейших. В России решение этой проблемы осложняется рядом неблагоприятных факторов, среди которых основное место занимают потери урожая от болезней, вредителей и сорной растительности.Первые работы по трансформации картофеля были начаты в восьмидесятых годах XX века [Ooms G., Hooykaas P.J.J., van Veen R.J.M., van Bellen P., Regensburg-Tuink T.J.G., Schilperoort R.A. Plasmid 1985 7: 15-29] и в 1986 году впервые была показана возможность получения картофеля с использованием Agrobacterium tumefaciens [An G., Watson B.D., Chiang C.C. Plant Physiology, 1986, v.81, p.301-305] сотрудниками Центра "Биоинженерия" РАН в 1990-1992гг. [Глагоцкая Т.Ц., Шульга О.А., Сидоров В.А., Захарьев В.М., Скрябин К.Г., Глеба Ю.Ю. ДАН СССР 314, №5, с.1240-1242, 1990, Feher A., Skryabin K.G., Balazs E., Preiszner J., Shulga O.A., Zakharyev V.M., Dudits D. Plant Cell Reports, 1992, v.11, p.48-52].За первыми попытками последовало более 200 работ, многие из которых посвящены модификации и оптимизации процедуры трансформации [Tavazza R., Tavazza M., Ordas R.J., Ancora G., Benvenuto E. Plant Science, 1988. v.59, p.175-181; Snyder G.W. & Belknap W.R. Plant Cell Reports, 1993, v.12, p.324-327]. Миновав первый этап разработки и освоения методов трансформации, к настоящему моменту во многих странах перешли к этапу внедрения полученных результатов в производство, что, в свою очередь, обусловило переход от работы с модельными, легко трансформируемыми генотипами к коммерческим генотипам (сортам). Однако подавляющее большинство коммерческих сортов картофеля, включая и основные российские сорта, не относится к легко трансформируемым.Несмотря на усилия по созданию единой эффективной методики трансформации, такая система трансформации для различных генотипов (сортов) до сих пор не создана. При необходимости получения модифицированных растений трудно трансформируемых коммерческих сортов приходится проводить оптимизацию протокола для каждого генотипа [Wordragen M.F. & Dons H.J.M. Plant Molecular biology reporter, 1992, v.10(1), p.12-36].Наиболее близким к предложенному является способ получения генетически модифицированных растений картофеля [Гулина И.В. Создание трансгенных растений картофеля, экспрессирующих модифицированный ген 0,5 мг/л и НУК или ИУК - от 0,01 до 0,05 мг/л. На восьмой день экспланты помещают на среду для регенерации, содержащую зеатин в количестве от 0,5 до 3,5 мг/л и ГК3 в количестве от 0,01 до 0,05 мг/л. 4 з.п. ф-лы, 1 ил., 5 табл.
Изобретение относится к селекции и биотехнологии растений, в частности генной инженерии. Изобретение может быть использовано для получения генетически модифицированных растений картофеля сорта Елизавета, экспрессирующего различные гетерологичные гены.Способ получения трансгенных растений картофеля сорта Елизавета заключается в генетической трансформации сегментов стебля (эксплантов) in vitro культивируемых растений картофеля методом сокультивирования с Agrobacterium tumefaciens, несущей рекомбинантные плазмиды с селективными, маркерными и полезными генами, и в последующей регенерации до фертильных трансгенных растений, имеющих внесенные гены и сохраняющих все признаки исходного сорта.Картофель (Solanum tuberosum var. tuberosum) выращивается в России повсеместно, практически во всех климатических зонах. Относительно высокая продуктивность при известной простоте возделывания позволяет картофелю стабильно занимать второе место после злаковых культур в отечественном сельскохозяйственном производстве. Сегодня более 90% товарного картофеля производится в ЛПХ (личных подсобных хозяйствах), а для наименее обеспеченных слоев населения картофель находится на первом месте в рационе питания.Таким образом, проблема получения стабильного урожая картофеля является одной из важнейших. В России решение этой проблемы осложняется рядом неблагоприятных факторов, среди которых основное место занимают потери урожая от болезней, вредителей и сорной растительности.Первые работы по трансформации картофеля были начаты в восьмидесятых годах XX века [Ooms G., Hooykaas P.J.J., van Veen R.J.M., van Bellen P., Regensburg-Tuink T.J.G., Schilperoort R.A. Plasmid 1985 7: 15-29] и в 1986 году впервые была показана возможность получения картофеля с использованием Agrobacterium tumefaciens [An G., Watson B.D., Chiang C.C. Plant Physiology, 1986, v.81, p.301-305] сотрудниками Центра "Биоинженерия" РАН в 1990-1992гг. [Глагоцкая Т.Ц., Шульга О.А., Сидоров В.А., Захарьев В.М., Скрябин К.Г., Глеба Ю.Ю. ДАН СССР 314, №5, с.1240-1242, 1990, Feher A., Skryabin K.G., Balazs E., Preiszner J., Shulga O.A., Zakharyev V.M., Dudits D. Plant Cell Reports, 1992, v.11, p.48-52].За первыми попытками последовало более 200 работ, многие из которых посвящены модификации и оптимизации процедуры трансформации [Tavazza R., Tavazza M., Ordas R.J., Ancora G., Benvenuto E. Plant Science, 1988. v.59, p.175-181; Snyder G.W. & Belknap W.R. Plant Cell Reports, 1993, v.12, p.324-327]. Миновав первый этап разработки и освоения методов трансформации, к настоящему моменту во многих странах перешли к этапу внедрения полученных результатов в производство, что, в свою очередь, обусловило переход от работы с модельными, легко трансформируемыми генотипами к коммерческим генотипам (сортам). Однако подавляющее большинство коммерческих сортов картофеля, включая и основные российские сорта, не относится к легко трансформируемым.Несмотря на усилия по созданию единой эффективной методики трансформации, такая система трансформации для различных генотипов (сортов) до сих пор не создана. При необходимости получения модифицированных растений трудно трансформируемых коммерческих сортов приходится проводить оптимизацию протокола для каждого генотипа [Wordragen M.F. & Dons H.J.M. Plant Molecular biology reporter, 1992, v.10(1), p.12-36].Наиболее близким к предложенному является способ получения генетически модифицированных растений картофеля [Гулина И.В. Создание трансгенных растений картофеля, экспрессирующих модифицированный ген 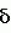 -эндотоксина из В. thuringiensis var tenebrionis. Диссертация, М., 1994, с.9, б-ка Института молекулярной биологии им. В.А.Энгельгардта].Этот способ получения генетически модифицированных растений картофеля осуществляется следующим образом (модификация известного метода Horsch R.B., Rogers S.G., Fraley R.T. Transgenic plants. Cold Spring Harb Symp Quant Biol. 1985; 50:433-7).Стеблевые сегменты картофеля получали из растений, выращенных асептически в течение четырех недель на среде S1, и переносили их в жидкую среду MS. Ночную культуру штамма A. tumefaciens добавляли к стеблевым сегментам, находящимся в чашке Петри в 10 мл жидкой среды MS таким образом, чтобы соотношение культуры штамма A. tumefaciens и среды инкубирования составляло 1:20. Сокультивирование A. tumefaciens и стеблевых сегментов растений картофеля проводили в течение 16-18 часов при 28 -эндотоксина из В. thuringiensis var tenebrionis. Диссертация, М., 1994, с.9, б-ка Института молекулярной биологии им. В.А.Энгельгардта].Этот способ получения генетически модифицированных растений картофеля осуществляется следующим образом (модификация известного метода Horsch R.B., Rogers S.G., Fraley R.T. Transgenic plants. Cold Spring Harb Symp Quant Biol. 1985; 50:433-7).Стеблевые сегменты картофеля получали из растений, выращенных асептически в течение четырех недель на среде S1, и переносили их в жидкую среду MS. Ночную культуру штамма A. tumefaciens добавляли к стеблевым сегментам, находящимся в чашке Петри в 10 мл жидкой среды MS таким образом, чтобы соотношение культуры штамма A. tumefaciens и среды инкубирования составляло 1:20. Сокультивирование A. tumefaciens и стеблевых сегментов растений картофеля проводили в течение 16-18 часов при 28 С в темноте. По окончании инкубации сегменты переносили на среду MS, содержащую агар в концентрации 0,7%. Через трое суток сегменты переносили на среду MSV с фитогормонами состава: 0,2 мг/л НУК, 1 мг/л зеатина, 0,02 мг/л ГК3, 1 мг/л БАП, соли MS, 0,7% агар, 100 мкг/мл цефотаксима, 200 мкг/мл карбенициллина, 50 мкг/мл канамицина. Регенеранты переносили на среду S1, содержащую селективный агент и цефотаксим, чтобы предупредить агробактериальное заражение растений.Данная методика не является эффективной для картофеля сорта Елизавета.Задачей изобретения является создание эффективной методики для трансформации растений картофеля сорта Елизавета.Технический результат изобретения заключается в повышении эффективности трансформации данного генотипа.Технический результат достигается тем, что в способе получения генетически модифицированных растений картофеля, заключающемся в сокультивировании эксплантов со штаммом A. tumefaciens, несущим рекомбинантные плазмиды с селективными, маркерными и полезными генами, помещении эксплантов на питательную среду для инициации каллусообразования и последующей регенерации до фертильных трансгенных растений, имеющих внесенные гены и признаки исходного сорта, сокультивацию эксплантов картофеля сорта Елизавета предпочтительно осуществлять путем нанесения суспензии штамма А. tumefaciens на поверхность агаризованной питательной среды, накрывания его бумажным фильтром, раскладывания на фильтре эксплантов и выдержки в течение 48 С в темноте. По окончании инкубации сегменты переносили на среду MS, содержащую агар в концентрации 0,7%. Через трое суток сегменты переносили на среду MSV с фитогормонами состава: 0,2 мг/л НУК, 1 мг/л зеатина, 0,02 мг/л ГК3, 1 мг/л БАП, соли MS, 0,7% агар, 100 мкг/мл цефотаксима, 200 мкг/мл карбенициллина, 50 мкг/мл канамицина. Регенеранты переносили на среду S1, содержащую селективный агент и цефотаксим, чтобы предупредить агробактериальное заражение растений.Данная методика не является эффективной для картофеля сорта Елизавета.Задачей изобретения является создание эффективной методики для трансформации растений картофеля сорта Елизавета.Технический результат изобретения заключается в повышении эффективности трансформации данного генотипа.Технический результат достигается тем, что в способе получения генетически модифицированных растений картофеля, заключающемся в сокультивировании эксплантов со штаммом A. tumefaciens, несущим рекомбинантные плазмиды с селективными, маркерными и полезными генами, помещении эксплантов на питательную среду для инициации каллусообразования и последующей регенерации до фертильных трансгенных растений, имеющих внесенные гены и признаки исходного сорта, сокультивацию эксплантов картофеля сорта Елизавета предпочтительно осуществлять путем нанесения суспензии штамма А. tumefaciens на поверхность агаризованной питательной среды, накрывания его бумажным фильтром, раскладывания на фильтре эксплантов и выдержки в течение 48 4 часов при 16-20 4 часов при 16-20 C C 1 1 C, для инициации каллусообразования используют питательную среду, содержащую зеатин в количестве 0,1-1,5 мг/л, БАП в количестве 0,1-1,5 мг/л, и НУК или ИУК в количестве 0,01-0,05 мг/л, а на среду для регенерации, содержащую зеатин в количестве 0,5-3,5 мг/л и ГК3 в количестве 0,01-0,05 мг/л, экспланты переносят на восьмой день.Для подготовки штамма A. tumefaciens его предварительно целесообразно засевать штрихом на питательную среду на 3-0,5 суток в темноте при 24-29 C, для инициации каллусообразования используют питательную среду, содержащую зеатин в количестве 0,1-1,5 мг/л, БАП в количестве 0,1-1,5 мг/л, и НУК или ИУК в количестве 0,01-0,05 мг/л, а на среду для регенерации, содержащую зеатин в количестве 0,5-3,5 мг/л и ГК3 в количестве 0,01-0,05 мг/л, экспланты переносят на восьмой день.Для подготовки штамма A. tumefaciens его предварительно целесообразно засевать штрихом на питательную среду на 3-0,5 суток в темноте при 24-29 С, за двое суток до сокультивации засевают полученной смесью колоний первую ночную культуру штамма А. tumefaciens в питательной среде, за одни сутки до сокультивации засевают вторую ночную культуру путем внесения в питательную среду первой ночной культуры, в день сокультивации разводят в 5-7 раз ночную культуру жидкой средой.Кроме того, после сокультивации отмывку эксплантов можно осуществлять путем помещения эксплантов в раствор, содержащий жидкую среду и антибиотик, подавляющий развитие штамма A. tumefaciens, на 5-40 минут при комнатной температуре.Предпочтительнее после помещения эксплантов в раствор отмывку проводить с использованием ротационной качалки.Способ получения генетически модифицированных растений картофеля сорта Елизавета осуществляется следующим образом.Данный протокол рассчитан на постановку одного трансформационного эксперимента, исходя из среднего количества исходных материнских растений - 100 С, за двое суток до сокультивации засевают полученной смесью колоний первую ночную культуру штамма А. tumefaciens в питательной среде, за одни сутки до сокультивации засевают вторую ночную культуру путем внесения в питательную среду первой ночной культуры, в день сокультивации разводят в 5-7 раз ночную культуру жидкой средой.Кроме того, после сокультивации отмывку эксплантов можно осуществлять путем помещения эксплантов в раствор, содержащий жидкую среду и антибиотик, подавляющий развитие штамма A. tumefaciens, на 5-40 минут при комнатной температуре.Предпочтительнее после помещения эксплантов в раствор отмывку проводить с использованием ротационной качалки.Способ получения генетически модифицированных растений картофеля сорта Елизавета осуществляется следующим образом.Данный протокол рассчитан на постановку одного трансформационного эксперимента, исходя из среднего количества исходных материнских растений - 100 10 шт. Среднее количество эксплантов - 500 10 шт. Среднее количество эксплантов - 500 50 шт.Культура исходных растений: исходные растения, свободные от вирусной и вироидной инфекции, культивировали в асептических условиях в культуре in vitro. Для этого стебли исходных растений нарезали на черенки с одной пазушной почкой и культивировали в вегетационных сосудах на питательной среде, содержащей минеральные соли и витамины (например, среда Msbase, табл.1) при температуре +18-22 50 шт.Культура исходных растений: исходные растения, свободные от вирусной и вироидной инфекции, культивировали в асептических условиях в культуре in vitro. Для этого стебли исходных растений нарезали на черенки с одной пазушной почкой и культивировали в вегетационных сосудах на питательной среде, содержащей минеральные соли и витамины (например, среда Msbase, табл.1) при температуре +18-22 С С 1 1 С в дневное и +15-18 С в дневное и +15-18 С С 1 1 С в ночное время; фотопериодичности 16 часов день/8 часов ночь (освещенность 120 С в ночное время; фотопериодичности 16 часов день/8 часов ночь (освещенность 120 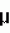 Е) 3-5 недель.Подготовку штамма A. tumefaciens проводили следующим образом.Засевали штамм A. tumefaciens штрихом на питательную среду (например, среда LB, табл.4) на 3 Е) 3-5 недель.Подготовку штамма A. tumefaciens проводили следующим образом.Засевали штамм A. tumefaciens штрихом на питательную среду (например, среда LB, табл.4) на 3 0,5 суток в темноте при +25-28 0,5 суток в темноте при +25-28 С С 1 1 С.За два дня до планируемой трансформации засевали смесью колоний первую (I) ночную культуру штамма A. tumefaciens объемом 1-6 мл С.За два дня до планируемой трансформации засевали смесью колоний первую (I) ночную культуру штамма A. tumefaciens объемом 1-6 мл 0,2 в питательной среде (например, среда LB, табл.4) при +25-28 0,2 в питательной среде (например, среда LB, табл.4) при +25-28 С С 1 1 С, 100-140 С, 100-140 10 об./мин.За день до сокультивации засевали вторую (II) ночную культуру объемом 5-10 10 об./мин.За день до сокультивации засевали вторую (II) ночную культуру объемом 5-10 3 мл. Для этого вносили в питательную среду (например, среда LB, табл.4) ночную культуру I в количестве 1/100 от конечного объема. Культивировали при +25-28 3 мл. Для этого вносили в питательную среду (например, среда LB, табл.4) ночную культуру I в количестве 1/100 от конечного объема. Культивировали при +25-28 С С 1 1 С, 100-140 С, 100-140 10 об./мин.Прекультивацию проводили за день до сокультивации следующим образом.Нарезали стебель на сегменты без пазушных почек длиной 5-10 10 об./мин.Прекультивацию проводили за день до сокультивации следующим образом.Нарезали стебель на сегменты без пазушных почек длиной 5-10 2 мм. Заливали чашки Петри небольшим количеством (4-5 2 мм. Заливали чашки Петри небольшим количеством (4-5 1 мл) питательной среды (например, среда CM, табл.1), сверху накрывали двумя бумажными стерильными фильтрами, экспланты раскладывали поверх фильтров для прекультивации на 24 1 мл) питательной среды (например, среда CM, табл.1), сверху накрывали двумя бумажными стерильными фильтрами, экспланты раскладывали поверх фильтров для прекультивации на 24 4 часа при 18-21 4 часа при 18-21 С С 1 1 С.Первый день трансформации1. Ночную культуру II разводили в 5-7 раз жидкой средой (например, среда СМ, табл.1).2. Сокультивация: Наносили разведенную суспензию штамма A. tumefaciens (0,2-0,5 С.Первый день трансформации1. Ночную культуру II разводили в 5-7 раз жидкой средой (например, среда СМ, табл.1).2. Сокультивация: Наносили разведенную суспензию штамма A. tumefaciens (0,2-0,5 0,05 мл) равномерно по поверхности агаризованной питательной среды, для чего фильтры с эксплантами аккуратно снимали, а затем возвращали для сокультивации на 48 0,05 мл) равномерно по поверхности агаризованной питательной среды, для чего фильтры с эксплантами аккуратно снимали, а затем возвращали для сокультивации на 48 4 часов при 16-20 4 часов при 16-20 С С 1 1 С. В контрольных вариантах использовали вместо агробактериальной суспензии такое же количество жидкой питательной среды (например, среда Msbase, табл.1).3. Отмывка эксплантов:Вариант I. Помещали экспланты в раствор (15-50 С. В контрольных вариантах использовали вместо агробактериальной суспензии такое же количество жидкой питательной среды (например, среда Msbase, табл.1).3. Отмывка эксплантов:Вариант I. Помещали экспланты в раствор (15-50 10 мл), содержащий жидкую среду (например, среда Msbase, табл.1) и раствор антибиотика, подавляющего развитие штамма A. tumefaciens и выбранного в зависимости от используемой генетической конструкции, на 10-30 10 мл), содержащий жидкую среду (например, среда Msbase, табл.1) и раствор антибиотика, подавляющего развитие штамма A. tumefaciens и выбранного в зависимости от используемой генетической конструкции, на 10-30 5 минут при комнатной температуре (18-20 5 минут при комнатной температуре (18-20 С С 1 1 С).Вариант II. Экспланты в растворе жидкой среды и антибиотика, приготовленном как в варианте I, отмыли с использованием ротационной качалки (шейкера) при 50-70 С).Вариант II. Экспланты в растворе жидкой среды и антибиотика, приготовленном как в варианте I, отмыли с использованием ротационной качалки (шейкера) при 50-70 10 об./мин в течение 15-30 10 об./мин в течение 15-30 10 минут при комнатной температуре (18-20 10 минут при комнатной температуре (18-20 С С 1 1 С).Третий день трансформацииПосле сокультивации (включая этап отмывки, когда она необходима) помещали экспланты на питательную среду (например, среда CIM, табл.1) для инициации каллусообразования.Использовали в питательной среде для инициации каллусообразования: зеатин в концентрации от 0,6 до 1,0 С).Третий день трансформацииПосле сокультивации (включая этап отмывки, когда она необходима) помещали экспланты на питательную среду (например, среда CIM, табл.1) для инициации каллусообразования.Использовали в питательной среде для инициации каллусообразования: зеатин в концентрации от 0,6 до 1,0 0,5 мг/л, БАП в концентрации от 0,6 до 1,0 0,5 мг/л, БАП в концентрации от 0,6 до 1,0 0,5 мг/л и НУК или ИУК в концентрации от 0,02 до 0,04 0,5 мг/л и НУК или ИУК в концентрации от 0,02 до 0,04 0,01 мг/л.Восьмой деньПереносили экспланты на чашки со средой для регенерации (например, среда RM, табл.1) с добавлением селективного агента, выбранного в зависимости от используемой генетической конструкции.Для тестирования эффективности процесса регенерации в контрольных вариантах использовали среду для регенерации без добавления селективного агента (например, среда RM, табл.1).Использовали в питательной среде для регенерации: зеатин в концентрации от 0,6 до 1,0 0,01 мг/л.Восьмой деньПереносили экспланты на чашки со средой для регенерации (например, среда RM, табл.1) с добавлением селективного агента, выбранного в зависимости от используемой генетической конструкции.Для тестирования эффективности процесса регенерации в контрольных вариантах использовали среду для регенерации без добавления селективного агента (например, среда RM, табл.1).Использовали в питательной среде для регенерации: зеатин в концентрации от 0,6 до 1,0 0,5 мг/л, БАП в концентрации от 0,6 до 1,0 0,5 мг/л, БАП в концентрации от 0,6 до 1,0 0,5 мг/л и ГК3 в концентрации от 0,02 до 0,04 0,5 мг/л и ГК3 в концентрации от 0,02 до 0,04 0,01 мг/л.Через каждые 14 днейПереносили экспланты на свежие чашки Петри со средой для регенерации того же состава.При появлении регенерантовСрезали регенеранты и переносили их в пробирки, содержащие среду для укоренения (например, среда RIM, табл.1).Первичные регенеранты, укоренившиеся на селективной среде, считали прошедшими первичный отбор.Перечень графических материаловНа чертеже приведен пример электрофоретического анализа продуктов ПЦР на препаратах ДНК модифицированных линий сорта Елизавета (Негатив). Дорожки:8 - маркер молекулярной массы 0,01 мг/л.Через каждые 14 днейПереносили экспланты на свежие чашки Петри со средой для регенерации того же состава.При появлении регенерантовСрезали регенеранты и переносили их в пробирки, содержащие среду для укоренения (например, среда RIM, табл.1).Первичные регенеранты, укоренившиеся на селективной среде, считали прошедшими первичный отбор.Перечень графических материаловНа чертеже приведен пример электрофоретического анализа продуктов ПЦР на препаратах ДНК модифицированных линий сорта Елизавета (Негатив). Дорожки:8 - маркер молекулярной массы 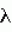 /Hind;4, 5 - ПЦР на препаратах ДНК растений, в которых не обнаружена трансгенная вставка;1, 2, 3, 6 - ПЦР на препаратах ДНК растений, в которых обнаружен перенесенный ген npt II;7 - продукт ПЦР на плазмидной ДНК (0,1 нг/реакцию), использованной для трансформации растений.Далее прошедшие отбор первичные регенеранты проверяли на наличие перенесенной генетической конструкции при помощи ПЦР-анализа с праймерами, специфичными для кодирующей области трансгенной конструкции. Уровень экспрессии целевого гена проверяли при помощи иммуноферментного анализа [Towbin H., Staehelin Т., Gordon J. Proc. Natl. Acad. Sci. USA 1979, v.76(9):4350-4].Эффективность регенерации по предложенному способу для сорта Елизавета составляет 78,4% по сравнению с 56,7% для способа по ближайшему аналогу.Эффективность трансформации по предложенному способу для сорта Елизавета составляет 9,7% по сравнению с 3,2% для способа по ближайшему аналогу.Экспериментальный пример использования патентуемого способа получения трансгенных растений картофеля сорта Елизавета.Эксперимент по получению трансгенных растений картофеля сорта Елизавета, экспрессирующих ген NPT II, обеспечивающего устойчивость трансгенных растений к антибиотику канамицин.Культура исходных растений: исходные растения, свободные от вирусной и вироидной инфекции в количестве 100 шт. культивировали в асептических условиях в культуре in vitro. Для этого стебли исходных растений нарезали на черенки с одной пазушной почкой и культивировали в вегетационных сосудах на питательной среде, содержащей минеральные соли и витамины (среда Msbase, табл.1) при температуре +18-21 /Hind;4, 5 - ПЦР на препаратах ДНК растений, в которых не обнаружена трансгенная вставка;1, 2, 3, 6 - ПЦР на препаратах ДНК растений, в которых обнаружен перенесенный ген npt II;7 - продукт ПЦР на плазмидной ДНК (0,1 нг/реакцию), использованной для трансформации растений.Далее прошедшие отбор первичные регенеранты проверяли на наличие перенесенной генетической конструкции при помощи ПЦР-анализа с праймерами, специфичными для кодирующей области трансгенной конструкции. Уровень экспрессии целевого гена проверяли при помощи иммуноферментного анализа [Towbin H., Staehelin Т., Gordon J. Proc. Natl. Acad. Sci. USA 1979, v.76(9):4350-4].Эффективность регенерации по предложенному способу для сорта Елизавета составляет 78,4% по сравнению с 56,7% для способа по ближайшему аналогу.Эффективность трансформации по предложенному способу для сорта Елизавета составляет 9,7% по сравнению с 3,2% для способа по ближайшему аналогу.Экспериментальный пример использования патентуемого способа получения трансгенных растений картофеля сорта Елизавета.Эксперимент по получению трансгенных растений картофеля сорта Елизавета, экспрессирующих ген NPT II, обеспечивающего устойчивость трансгенных растений к антибиотику канамицин.Культура исходных растений: исходные растения, свободные от вирусной и вироидной инфекции в количестве 100 шт. культивировали в асептических условиях в культуре in vitro. Для этого стебли исходных растений нарезали на черенки с одной пазушной почкой и культивировали в вегетационных сосудах на питательной среде, содержащей минеральные соли и витамины (среда Msbase, табл.1) при температуре +18-21 С С 1 1 С в дневное и +15-18 С в дневное и +15-18 С С 1 1 С в ночное время; фотопериодичности 16 часов день/8 часов ночь (освещенность 120 С в ночное время; фотопериодичности 16 часов день/8 часов ночь (освещенность 120  E) 4 недели.Для трансформации использовали штамм Agrobacterium tumefaciens СВЕ 121, содержащий плазмиду pBIKm, в состав кассеты экспрессии которой входят генетические конструкции:промотор pNOS - ген NPT II - NOS-T терминатор.Подготовку штамма A. tumefaciens СВЕ 121 проводили следующим образом. Засевали штамм A. tumefaciens СВЕ 121 штрихом на питательную среду LB (табл.4) на 3 E) 4 недели.Для трансформации использовали штамм Agrobacterium tumefaciens СВЕ 121, содержащий плазмиду pBIKm, в состав кассеты экспрессии которой входят генетические конструкции:промотор pNOS - ген NPT II - NOS-T терминатор.Подготовку штамма A. tumefaciens СВЕ 121 проводили следующим образом. Засевали штамм A. tumefaciens СВЕ 121 штрихом на питательную среду LB (табл.4) на 3 0,5 суток в темноте при +26 0,5 суток в темноте при +26 С С 1 1 С.За два дня до планируемой трансформации засевали смесью колоний первую (I) ночную культуру штамма A. tumefaciens СВЕ 121 объемом 6 мл С.За два дня до планируемой трансформации засевали смесью колоний первую (I) ночную культуру штамма A. tumefaciens СВЕ 121 объемом 6 мл 0,2 в питательной среде - среда LB (табл.4) при +26 0,2 в питательной среде - среда LB (табл.4) при +26 С С 1 1 С, 100-140 С, 100-140 10 об/мин.За день до сокультивации засевали вторую (II) ночную культуру объемом 6 10 об/мин.За день до сокультивации засевали вторую (II) ночную культуру объемом 6 1 мл. Для этого вносили в питательную среду LB (табл.4) ночную культуру I в количестве 1/100 от конечного объема. Культивировали при +26 1 мл. Для этого вносили в питательную среду LB (табл.4) ночную культуру I в количестве 1/100 от конечного объема. Культивировали при +26 С С 1 1 С, 100-140 С, 100-140 10 об/мин. Проводили прекультивацию, для чего нарезали стебель на сегменты без пазушных почек длиной 5-10 10 об/мин. Проводили прекультивацию, для чего нарезали стебель на сегменты без пазушных почек длиной 5-10 2 мм. Заливали чашки Петри небольшим количеством (4-5 2 мм. Заливали чашки Петри небольшим количеством (4-5 1 мл) питательной среды (среда CIM, табл. 1), сверху накрывали двумя бумажными стерильными фильтрами, экспланты раскладывали поверх фильтров для прекультивации на 24 1 мл) питательной среды (среда CIM, табл. 1), сверху накрывали двумя бумажными стерильными фильтрами, экспланты раскладывали поверх фильтров для прекультивации на 24 4 часа при 18-21 4 часа при 18-21 1 1 С.Первый день трансформации1. Ночную культуру штамма A. tumefaciens разводили в 5-7 раз жидкой средой CIM.2. Для проведения этапа сокультивации наносили разведенную суспензию штамма (0,2-0,5 С.Первый день трансформации1. Ночную культуру штамма A. tumefaciens разводили в 5-7 раз жидкой средой CIM.2. Для проведения этапа сокультивации наносили разведенную суспензию штамма (0,2-0,5 0,05 мл) равномерно по поверхности агаризованной питательной среды, для чего фильтры с эксплантами аккуратно снимали, а затем возвращали поверх нанесенной суспензии, экспланты раскладывали на влажном фильтре для сокультивации на 48 0,05 мл) равномерно по поверхности агаризованной питательной среды, для чего фильтры с эксплантами аккуратно снимали, а затем возвращали поверх нанесенной суспензии, экспланты раскладывали на влажном фильтре для сокультивации на 48 4 часов при 16-20 4 часов при 16-20 С С 1 1 С.В контрольном варианте вместо суспензии штамма A. tumefaciens СВЕ 121 использовали такое же количество жидкой питательной среды (среда СМ, табл.1).После проведения этапа сокультивации отмывали экспланты по следующей схеме:Помещали экспланты в раствор (25 С.В контрольном варианте вместо суспензии штамма A. tumefaciens СВЕ 121 использовали такое же количество жидкой питательной среды (среда СМ, табл.1).После проведения этапа сокультивации отмывали экспланты по следующей схеме:Помещали экспланты в раствор (25 10 мл), содержащий жидкую среду (среда СМ, табл.1) и раствор антибиотика карбенициллина (500 мг/л), подавляющего развитие штамма A. tumefaciens СВЕ 121, отмывали с использованием ротационной качалки (шейкера) при 50-70В±10 об/мин в течение 30 10 мл), содержащий жидкую среду (среда СМ, табл.1) и раствор антибиотика карбенициллина (500 мг/л), подавляющего развитие штамма A. tumefaciens СВЕ 121, отмывали с использованием ротационной качалки (шейкера) при 50-70В±10 об/мин в течение 30 10 минут при комнатной температуре (18-20 10 минут при комнатной температуре (18-20 С).Третий день трансформацииПосле сокультивации (включая этап отмывки) помещали экспланты на питательную среду (среда CIM, табл.1) для инициации каллусообразования.Использовали в питательной среде для инициации каллусообразования: зеатин в концентрации 1,0 С).Третий день трансформацииПосле сокультивации (включая этап отмывки) помещали экспланты на питательную среду (среда CIM, табл.1) для инициации каллусообразования.Использовали в питательной среде для инициации каллусообразования: зеатин в концентрации 1,0 0,01 мг/л, БАП в концентрации 1,0 0,01 мг/л, БАП в концентрации 1,0 0,01 мг/л и НУК в концентрации от 0,02 0,01 мг/л и НУК в концентрации от 0,02 0,005 мг/л.Восьмой деньПереносили экспланты на чашки со средой RM для регенерации (среда RM, табл.1) с добавлением селективного агента антибиотика канамицина в концентрации 100 мг/л. В качестве селективного агента использовали антибиотик канамицин, так как генетическая конструкция содержит ген NPT II, кодирующий фермент неомицинфосфотрансферазу, экспрессия которого обеспечивает устойчивость к антибиотику канамицину.Для тестирования эффективности процесса регенерации в контрольных вариантах использовали среду для регенерации без добавления селективного агента (среда RM, табл.1).Использовали в питательной среде для регенерации зеатин в концентрации от 1,0 0,005 мг/л.Восьмой деньПереносили экспланты на чашки со средой RM для регенерации (среда RM, табл.1) с добавлением селективного агента антибиотика канамицина в концентрации 100 мг/л. В качестве селективного агента использовали антибиотик канамицин, так как генетическая конструкция содержит ген NPT II, кодирующий фермент неомицинфосфотрансферазу, экспрессия которого обеспечивает устойчивость к антибиотику канамицину.Для тестирования эффективности процесса регенерации в контрольных вариантах использовали среду для регенерации без добавления селективного агента (среда RM, табл.1).Использовали в питательной среде для регенерации зеатин в концентрации от 1,0 0,01 мг/л, БАП в концентрации 1,0 0,01 мг/л, БАП в концентрации 1,0 0,01 мг/л и ГК3 в концентрации 0,02 0,01 мг/л и ГК3 в концентрации 0,02 0,01 мг/л.Через каждые 14 днейПереносили экспланты на свежие чашки Петри со средой для регенерации того же состава.При появлении регенерантовСрезали регенеранты и переносили их в пробирки, содержащие среду для укоренения (среда RIM, табл.1). Первичные регенеранты, укоренившиеся на селективной среде, содержащей антибиотик канамицин в концентрации 100 мг/л, считали прошедшими первичный отбор.Далее прошедшие отбор первичные регенеранты проверяли на наличие перенесенной генетической конструкции при помощи ПЦР-анализа с праймерами, специфичными для кодирующей области трансгенной конструкции. Для ПЦР-анализа генома растений на наличие гена NPTII были использованы праймеры nptF и nptR.Оба праймера находятся на расстоянии 355 нуклеотидов друг от друга.nptF primer: 5' TGC TCC TGC CGA GAA AGT ATC С 3'nptR primer: 5'AGG ACA TAG CGT TGG CTA CCC G 3'Методика выделения ДНК.Для выделения ДНК 25-50 мг растительной ткани (листовая пластинка) растирали в гомогенизаторе в 120 мкл буфера I (50 mM Tris HCl, рН 8.0; 10 mМ EDTA; 50 мкг/мл панкреатической РНКазы) до получения гомогенной суспезии. Затем к полученной суспезии добавляли 125 мкл лизирующего буфера II (0.2 М NaOH; 1% додецил сульфата Na). Полученную смесь обрабатывали в шейкере 2 минуты при комнатной температуре. Далее переносили пробирки в термостат и инкубировали при 65 0,01 мг/л.Через каждые 14 днейПереносили экспланты на свежие чашки Петри со средой для регенерации того же состава.При появлении регенерантовСрезали регенеранты и переносили их в пробирки, содержащие среду для укоренения (среда RIM, табл.1). Первичные регенеранты, укоренившиеся на селективной среде, содержащей антибиотик канамицин в концентрации 100 мг/л, считали прошедшими первичный отбор.Далее прошедшие отбор первичные регенеранты проверяли на наличие перенесенной генетической конструкции при помощи ПЦР-анализа с праймерами, специфичными для кодирующей области трансгенной конструкции. Для ПЦР-анализа генома растений на наличие гена NPTII были использованы праймеры nptF и nptR.Оба праймера находятся на расстоянии 355 нуклеотидов друг от друга.nptF primer: 5' TGC TCC TGC CGA GAA AGT ATC С 3'nptR primer: 5'AGG ACA TAG CGT TGG CTA CCC G 3'Методика выделения ДНК.Для выделения ДНК 25-50 мг растительной ткани (листовая пластинка) растирали в гомогенизаторе в 120 мкл буфера I (50 mM Tris HCl, рН 8.0; 10 mМ EDTA; 50 мкг/мл панкреатической РНКазы) до получения гомогенной суспезии. Затем к полученной суспезии добавляли 125 мкл лизирующего буфера II (0.2 М NaOH; 1% додецил сульфата Na). Полученную смесь обрабатывали в шейкере 2 минуты при комнатной температуре. Далее переносили пробирки в термостат и инкубировали при 65 С в течение 45 минут. По окончании инкубации пробирки охлаждали до температуры 20-25 С в течение 45 минут. По окончании инкубации пробирки охлаждали до температуры 20-25 С и добавляли в каждую по 125 мкл нейтрализующего раствора III (2.5 mM ацетата К, рН 4.5). Содержимое пробирок тщательно перемешивали на шейкере и центрифугировали при 14000 об/мин в течение 10 минут. Надосадочную жидкость переносили в новые микроцентрифужные пробирки, содержащие 500 мкл смолы Wizard MaxiPreps и далее выделяли ДНК согласно рекомендациям фирмы Promega для набора Wizard Preps. Концентрация ДНК в получаемых препаратах составляла 15-100 мкг/мл. Полученные препараты ДНК были хорошего качества ( С и добавляли в каждую по 125 мкл нейтрализующего раствора III (2.5 mM ацетата К, рН 4.5). Содержимое пробирок тщательно перемешивали на шейкере и центрифугировали при 14000 об/мин в течение 10 минут. Надосадочную жидкость переносили в новые микроцентрифужные пробирки, содержащие 500 мкл смолы Wizard MaxiPreps и далее выделяли ДНК согласно рекомендациям фирмы Promega для набора Wizard Preps. Концентрация ДНК в получаемых препаратах составляла 15-100 мкг/мл. Полученные препараты ДНК были хорошего качества (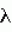 260: 260: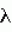 280>1. 8), пригодны для амплификации и содержали РНК в следовых количествах - менее 1%, согласно данным электрофоретического анализа.Методика проведения ПЦР-анализаПроведение ПЦР осуществляли на ДНК-амплификаторе Techne Genius. Центрифугирование осуществляли на настольной микроцентрифуге Eppendorf 5415C с максимальной скоростью вращения ротора 14000 об/мин. Термостатирование образцов осуществляли в сухом термостате “Термо 28-23”. Анализ продуктов ПЦР производили путем электрофореза в агарозном геле соответствующей концентрации при напряженности электрического поля 6 В/см с последующим окрашиванием гелей бромистым этидием (концентрация красящего раствора 1 мкг/мл в воде, время окрашивания - 20 минут при комнатной температуре) и фотографированием полученной картины в ультрафиолете (длина волны - 260-280 нм) на фотопленку “Микрат-Изопан” при помощи TTL-фотоаппарата типа “Зенит” (светофильтр КС-8). Ввод полученных данных электрофореза в компьютер осуществляли посредством прямого сканирования негативов на сканере Mustek 9600. Обработку оцифрованной информации проводили при помощи пакета Adobe Photoshop 5.0.Состав реакционной смеси для ПЦР:- Праймеры - по 25 пМ каждого;- 10X буфер - 2,5 мкл;- 2 мМ dNTP - 2,5 мкл;- BioTaq полимераза 5Е мкл - 0,5 мкл;- ДНК-матрица - 100 нг;- Н2О - до 25 мкл.Условия проведения ПЦР были выбраны следующие: 35 цикла: 94 280>1. 8), пригодны для амплификации и содержали РНК в следовых количествах - менее 1%, согласно данным электрофоретического анализа.Методика проведения ПЦР-анализаПроведение ПЦР осуществляли на ДНК-амплификаторе Techne Genius. Центрифугирование осуществляли на настольной микроцентрифуге Eppendorf 5415C с максимальной скоростью вращения ротора 14000 об/мин. Термостатирование образцов осуществляли в сухом термостате “Термо 28-23”. Анализ продуктов ПЦР производили путем электрофореза в агарозном геле соответствующей концентрации при напряженности электрического поля 6 В/см с последующим окрашиванием гелей бромистым этидием (концентрация красящего раствора 1 мкг/мл в воде, время окрашивания - 20 минут при комнатной температуре) и фотографированием полученной картины в ультрафиолете (длина волны - 260-280 нм) на фотопленку “Микрат-Изопан” при помощи TTL-фотоаппарата типа “Зенит” (светофильтр КС-8). Ввод полученных данных электрофореза в компьютер осуществляли посредством прямого сканирования негативов на сканере Mustek 9600. Обработку оцифрованной информации проводили при помощи пакета Adobe Photoshop 5.0.Состав реакционной смеси для ПЦР:- Праймеры - по 25 пМ каждого;- 10X буфер - 2,5 мкл;- 2 мМ dNTP - 2,5 мкл;- BioTaq полимераза 5Е мкл - 0,5 мкл;- ДНК-матрица - 100 нг;- Н2О - до 25 мкл.Условия проведения ПЦР были выбраны следующие: 35 цикла: 94 С - 30 сек, 55 С - 30 сек, 55 С - 30 сек, 72 С - 30 сек, 72 С - 90 сек, окончательная полимеризация -7 минут.Появление продукта ПЦР с указанными праймерами и длиной 350 нуклеотидов при условии отсутствия его в реакциях, поставленных на контрольной ДНК, свидетельствует о присутствии искомого гена в геномной ДНК анализируемой линии.Результаты эксперимента по получению трансгенных растений картофеля сорта Елизавета, экспрессирующих ген NPT II.В результате проведения одного трансформационного эксперимента (по описанному выше протоколу) было получено 473 регенеранта из 603 эксплантов от 100 исходных растений. Таким образом, эффективность регенерации (процентное отношение количества регенерантов к количеству эксплантов) составила 78,4%.Последующий после получения регенерантов и первичного отбора на селективной среде первичный молекулярный анализ методом ПЦР подтвердил наличие перенесенного гена NPT II в геноме 46 растений (чертеж), следовательно, эффективность трансформации (процентное отношение трансформантов к количеству регенерантов) составила 9,7%. С - 90 сек, окончательная полимеризация -7 минут.Появление продукта ПЦР с указанными праймерами и длиной 350 нуклеотидов при условии отсутствия его в реакциях, поставленных на контрольной ДНК, свидетельствует о присутствии искомого гена в геномной ДНК анализируемой линии.Результаты эксперимента по получению трансгенных растений картофеля сорта Елизавета, экспрессирующих ген NPT II.В результате проведения одного трансформационного эксперимента (по описанному выше протоколу) было получено 473 регенеранта из 603 эксплантов от 100 исходных растений. Таким образом, эффективность регенерации (процентное отношение количества регенерантов к количеству эксплантов) составила 78,4%.Последующий после получения регенерантов и первичного отбора на селективной среде первичный молекулярный анализ методом ПЦР подтвердил наличие перенесенного гена NPT II в геноме 46 растений (чертеж), следовательно, эффективность трансформации (процентное отношение трансформантов к количеству регенерантов) составила 9,7%. 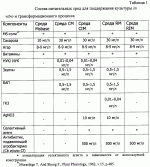 Для приготовления сред, представленных в табл.1, готовили раствор MS- солей в деионизованной воде, доводя рН до значения 5,6-5,8 Для приготовления сред, представленных в табл.1, готовили раствор MS- солей в деионизованной воде, доводя рН до значения 5,6-5,8 0,1 с помощью растворов IN КОН и IN HCl. Стерилизацию сред осуществляли в автоклаве при 1 атм, 121 0,1 с помощью растворов IN КОН и IN HCl. Стерилизацию сред осуществляли в автоклаве при 1 атм, 121 С в течение 20 минут. После охлаждения среды до +45-50 С в течение 20 минут. После охлаждения среды до +45-50 С добавляли витамины (табл.2), гормоны, антибиотики и селективные агенты (методика приготовления и концентрации стоков см. табл.3) соответственно составу сред и заливали чашки Петри ( С добавляли витамины (табл.2), гормоны, антибиотики и селективные агенты (методика приготовления и концентрации стоков см. табл.3) соответственно составу сред и заливали чашки Петри (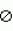 9 см) по 20 9 см) по 20 5 мл среды в каждую. В табл.4 представлен состав питательной среды Luria-Bertani, в табл.5 представлены наименования и происхождение препаратов. 5 мл среды в каждую. В табл.4 представлен состав питательной среды Luria-Bertani, в табл.5 представлены наименования и происхождение препаратов.
Формула изобретения1. Способ получения генетически модифицированных растений - картофеля, заключающийся в сокультивировании эксплантов с штаммом Agrobacterium tumefaciens, несущим рекомбинантные плазмиды с селективными, маркерными и полезными генами, помещении эксплантов на питательную среду для инициации каллусообразования и последующей регенерации до фертильных трансгенных растений, имеющих внесенные гены и признаки исходного сорта, отличающийся тем, что для инициации каллусообразования эксплантов картофеля сорта Елизавета используют питательную среду, содержащую зеатин в концентрации от 0,6 до 1,0 0,5 мг/л, 6-бензиламинопурин (БАП) в концентрации от 0,6 до 1,0 0,5 мг/л, 6-бензиламинопурин (БАП) в концентрации от 0,6 до 1,0 0,5 мг/л и нафтилуксусная кислота (НУК) или индолил-3-уксусная кислота (ИУК) в количестве 0,01 0,5 мг/л и нафтилуксусная кислота (НУК) или индолил-3-уксусная кислота (ИУК) в количестве 0,01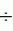 0,05 мг/л, а на восьмой день помещают экспланты на среду для регенерации, содержащую зеатин в количестве 0,5 0,05 мг/л, а на восьмой день помещают экспланты на среду для регенерации, содержащую зеатин в количестве 0,5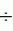 3,5 мг/л и гибберелловую кислоту (ГК3) в количестве 0,01 3,5 мг/л и гибберелловую кислоту (ГК3) в количестве 0,01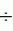 0,05 мг/л.2. Способ по п.1, отличающийся тем, что сокультивацию осуществляют путем нанесения суспензии штамма Agrobacterium tumefaciens на поверхность агаризованной питательной среды, накрывания его двумя бумажными фильтрами, раскладывания эксплантов поверх фильтров с последующей выдержкой в течение 48 0,05 мг/л.2. Способ по п.1, отличающийся тем, что сокультивацию осуществляют путем нанесения суспензии штамма Agrobacterium tumefaciens на поверхность агаризованной питательной среды, накрывания его двумя бумажными фильтрами, раскладывания эксплантов поверх фильтров с последующей выдержкой в течение 48 4 ч при 15-21 4 ч при 15-21 С.3. Способ по п.1 или 2, отличающийся тем, что для подготовки штамма Agrobacterium tumefaciens его предварительно засевают штрихом на питательную среду на 3 С.3. Способ по п.1 или 2, отличающийся тем, что для подготовки штамма Agrobacterium tumefaciens его предварительно засевают штрихом на питательную среду на 3 0,5 суток в темноте при 24-29 0,5 суток в темноте при 24-29 С, за двое суток до сокультивации засевают полученной смесью колоний первую ночную культуру штамма Agrobacterium tumefaciens в питательной среде, за одни сутки до сокультивации засевают вторую ночную культуру путем внесения в питательную среду первой ночной культуры, в день сокультивации разводят ночную культуру в 5-7 раз в жидкой среде.4. Способ по любому из пп.1-3, отличающийся тем, что после сокультивации помещают экспланты в раствор, содержащий жидкую среду и антибиотик, подавляющий развитие штамма Agrobacterium tumefaciens, на 5-40 мин при комнатной температуре.5. Способ по любому из пп.1-3, отличающийся тем, что помещают экспланты в раствор, содержащий жидкую среду и антибиотик, подавляющий развитие штамма Agrobacterium tumefaciens, и отмывают экспланты при комнатной температуре с использованием ротационной качалки в течение 5-40 мин. С, за двое суток до сокультивации засевают полученной смесью колоний первую ночную культуру штамма Agrobacterium tumefaciens в питательной среде, за одни сутки до сокультивации засевают вторую ночную культуру путем внесения в питательную среду первой ночной культуры, в день сокультивации разводят ночную культуру в 5-7 раз в жидкой среде.4. Способ по любому из пп.1-3, отличающийся тем, что после сокультивации помещают экспланты в раствор, содержащий жидкую среду и антибиотик, подавляющий развитие штамма Agrobacterium tumefaciens, на 5-40 мин при комнатной температуре.5. Способ по любому из пп.1-3, отличающийся тем, что помещают экспланты в раствор, содержащий жидкую среду и антибиотик, подавляющий развитие штамма Agrobacterium tumefaciens, и отмывают экспланты при комнатной температуре с использованием ротационной качалки в течение 5-40 мин.Популярные патенты: 2285375 Способ обработки почвы и устройство для его осуществления ... рабочего органа на шток гидроцилиндра, что требует большого усилия движению штока.Задачей заявленной группы изобретений является устранение указанных недостатков. Технический результат - снижение энергоемкости обработки почвы и эффективное использование плодородного слоя.Это достигается тем, что в способе обработки почвы, включающем предварительную установку глубины обработки на стационаре, заглубление рабочих органов и рыхление, поле разбивают на поперечные участки относительно направления движения агрегата для возделывания на поле разных видов культур, причем при движении агрегата по полю на каждом последующем поперечном участке глубину рыхления изменяют относительно предыдущего ... 2450135 Двигатель самоходной машины ... 36 для формирования траектории по команде автоводителя и водителя. Окучник 37 бороздорез-плуг, окучник и др. рабочие органы имеют 38, 39, 40 диски защиты курса обкатыванием камней и корней. Шагающее колесо 41 или диск на кривошипе 42 с упором 43 самоповорота или самоподъема могут дать сигнал о сцеплении, преобразовать колебания и создать реакцию /тормозить отход назад/ и утилизировать энергию колебания рамы или передать колебания рабочим органам. Диск 43 поворотом может стать якорем при шагающем движении.Рабочие органы с диском /фиг.6/ крылом 44 или 45, или 46 реверсивного типа могут самоповорачиваться сопротивлением почвы, обладают свойством антимаятника. Диск с отвалами /фиг.6, ... 2438305 Способ выращивания цыплят-бройлеров ... прототипа является выращивание крупных мясных цыплят на подстилке до 10-недельного возраста, что является слишком длительным сроком выращивания и способствует увеличению выхода кожи с подкожным жиром, внутреннего жира и отрицательно сказывается на качестве мяса.Общим в изобретении является выращивание цыплят на подстилке в помещении с высоким убойным выходом.Задача изобретения - вырастить цыплят на подстилке в помещении с использованием выгулов, с высоким выходом и качеством мяса.Технический результат состоит в увеличении убойного выхода, сортности мяса с высокими мясными качествами, снижении выхода кожи с подкожным жиром, внутреннего жира при снижении затрат корма на выращивание ... 2464769 Машина для прессования тюков с вязальным устройством ... тюков по п.1, отличающаяся тем, что при нахождении зажимных колодок (41, 42) в положении освобождения вязального шпагата (24) ширина зазора (40) увеличивается к открытой стороне. 6. Машина для прессования тюков по п.1 или 2, отличающаяся тем, что вязальное устройство (6) содержит наружное удерживающее устройство (25) и крючок-узловязатель (26) для связывания концевого участка (43), ограниченного между внутренним и наружным удерживающими устройствами (34, 25) для вязального шпагата.7. Машина для прессования тюков по п.6, отличающаяся тем, что внутреннее удерживающее устройство (34) для вязального шпагата выполнено с возможностью приложения к вязальному шпагату удерживающего ... 2175477 Способ борьбы с тлями ... компонента (прототип 2) обеспечивает высокую эффективность против всех видов тлей, кроме смородинной галловой. Однако использование афидицидной композиции с таким высоким содержанием компонентов нежелательно, так как вызывает ожоги молодых, формирующихся листочков. Уменьшение количества компонентов вдвое (прототип 1) устраняет фитотоксичность, но при этом снижается эффективность обработки против крыжовниковой и малиновой тлей до 68,3 - 67,3%. При таком соотношении активных компонентов (0,5 и 0,5%) обработка показала низкую эффективность в отношении смородинной галловой тли (3,2%) и лишь гибель зеленой яблонной тли была высокой - 98,8%. Резкое снижение эффективности обработки ... |
Еще из этого раздела: 2150199 Способ закрепления элемента рыболовной снасти, выполненного с внутренней полостью, к леске 2078495 Устройство для транспортирования кормов в хранилищах башенного типа 2038763 Регулятор вакуума 2073513 Способ профилактики технологических стрессов молодняка крупного рогатого скота 2229213 Способ регулирования роста зерновых культур 2437262 Культиватор-плоскорез 2489835 Гнездовой высевающий аппарат для посева проросших семян овощных культур 2405306 Способ определения содержания крахмала по содержанию глюкозы с учетом индивидуального коэффициента пересчета в растительном материале 2151493 Установка для гидропонного выращивания растений 2415570 Искусственное роение и борьба с естественным роением пчелиных семей |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||